Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.


61
до складу ЛПЦ бактерій. Припускають, що основою антигенрозпізнавальних структур вищих
безхребетних та нижчих хребетних є лектин-, глікан- та ЛПЦ- зв'язувальні білки.
Антигенрозпізнавальна структура адаптивного імунітету характеризується наявністю білків
суперродини імуноґлобулінів, до складу яких входять одно- та багатодоменні білки. Спочатку
однодоменні білки функціонували як міжклітинні ліганди для забезпечення орієнтації клітин щодо
сусідів, обмеження мітотичної активності та ін. У міру ускладнення структури організмів
ускладнювалася і функція білків суперродини імуноґлобулінів — унаслідок дублікації початкового
гена утворилися багатодоменні білки V- і С-типів, що зумовлює появу гомо- і гетеродимерів, в яких
V-домени кооперативно розпізнають ліганди. Як і для більшості білків, що містять V1 -домен,
предком антигенрозпізнавальної структури був рецептор-димер клітинної поверхні. Перші
антигенрозпізнавальні структури типу Т-клітинних рецепторів виявляються у первинних
багатоклітинних безхребетних за відсутності лімфоцитоподібних клітин. Імуноґлобуліни і частково
ТкР безпосередньо перейшли до розпізнавання чужорідних білків, а ТкР поєднали розпізнавання
аутологічних та чужорідних пептидів з розпізнаванням детермінант аутологічних антигенів МНС І
та МНС II. Лігандами предків ТкР та ВкР, напевно, були примітивні антигени гістосумісності. Про
це свідчать одночасна їх поява у хрящових риб, спорідненість С-доменів ТкР, ВкР, антигенів МНС І
та МНС II, особливості диференціювання Т- лімфоцитів.
Система гістосумісності — одна з найдавніших протективних систем багатоклітинних організмів.
Ксенотрансплантати відторгаються в усіх безхребетних. Основними факторами відторгнення є
подібні до НК клітини, лектини та біохімічна несумісність. Алогенна гістонесумісність виявлена не
у всіх безхребетних. Вона відсутня у деяких членистоногих та молюсків, нематод, немертин.
Чужорідні тканини або інфільтруються блукаючими амебоцитами, целомоцитами, гемоцитами і
лізуються, або ізолюються бар'єром щільної міжклітинної речовини. Генетичну природу алогенної
гістонесумісності доведено для кишковопорожнинних, голкошкірих, покривників. У покривників
відторгнення алотрансплантатів контролюється генетичним локусом Fu/HC, його алелі
експресуються кодомінантно. Відторгнення виникає у разі незбігу навіть за одним алелем Fu/CH.
Деякі дослідники вважають локус Fu/CH покривників попередником антигенів МНС І та II класів.
У хрящових риб виявлено структури, які гомологічні деяким ланцюгам антигенів МНС І та II класів,
що свідчить про поділ антигенів гістосумісності. В амфібій і рептилій містяться антигени
гістосумісності І і II класів, з'ясовано певну гомологію їх амінокислотних послідовностей з
антигенами МНС І і II типів людини. Антигени МНС І класу з самого початку появи і на всіх етапах
еволюції, зокрема ссавців, клітинної і тканинної специфічності не мають.
14.5. ОНТОГЕНЕЗ ІМУННОЇ СИСТЕМИ.
Локалізація органів гемолімфомієлопоезу у хребетних, як правило, змінюється в онтогенезі кілька
разів. Гемопоетична стовбурова самопідтримувальна клітина дає початок усім форменим елементам
крові та новим стовбуровим клітинам і диференціюється в певних органах у мікрооточенні
резидентних клітин. Перші стовбурові кровотворні клітини з'являються в жовтковому мішку на
третьому тижні ембріонального розвитку, потім ембріональна печінка стає основним депо
стовбурових клітин, де кровотворення триває до кінця ембріогенезу. У ссавців жовтковий мішок
функціонує недовго. На п'ятому тижні починається формування селезінки, а в печінці з'являються
Т-лімфоцити Зачаток тимуса виявляють в ембріоні людини на шостому тижні; на сьомому
відбувається формування епітеліального тимуса без наявності в ньому лімфоцитів. Останні
з'являються в крові, печінці й активні у реакції змішаної культури, тобто здатні розпізнавати
алоантигени. Перші В-клітини з'являються в паренхімі печінки через 5-7 тижнів ембріонального
розвитку. Ці клітини містять у цитоплазмі IgM, але не мають поверхневих та секреторних
імуноглобулінів. На 8-му тижні тимус заселяється великими лімфоцитами і з'являються тільця
Гассаля, відмічається синтез компонентів комплементу С3, С4, С5, інтерферону. Через 7 — 8 тижнів
ембріогенезу починається закладання кісткового мозку, але як кровотворний орган він починає
функціонувати на 4-му місяці вагітності. В печінці через 9 тижнів виявляються В-лімфоцити, що
експресують поверхневі IgM та IgG і починається синтез лізоциму. Клітини тимуса через 10 тижнів
відповідають на ФГА і активні в реакції змішаної культури, в тимусі ембріона розрізняють кіркову і
мозкову зони, а В-лімфоцити здійснюють повноцінний синтез IgM. На 12-му тижні в тимусі й
селезінці виявляються В-клітини, спостерігається початок синтезу IgG, утворюються лімфатичні
вузли, клітини селезінки відповідають на ФГА, а Т-клітини розпізнають антигени, індукують РТПХ.
Зрілі Т-лімфоцити з маркерами CD4 та CD8 з'являються на 14-му тижні ембріогенезу і це
супроводжується чіткою експресією молекул МНС І та II класів.
У цей самий період виявляється цитотоксична активність лімфоцитів крові й селезінки та синтез
компонента комплементу C1q. Через 16 — 20 тижнів ембріонального розвитку виявляється
цитотоксична активність тимоцитів, у слизовій апендикса з'являються скупчення лімфоцитів та
первинних фолікулів. Початок синтезу IgA та максимальна гемопоетична активність клітин
кісткового мозку спостерігається через 30 тижнів. Отже, у перші 8—12 тижнів розвитку в ембріонах
формуються Т- і В-системи імунітету, що свідчить про ранню появу механізмів контролю за
генетичною сталістю соматичних клітин організму.
В-клітини в ембріональному періоді спочатку утворюються в печінці, а потім — у кістковому
мозку, де диференціюються на зрілі клітини з різними поверхневими імуноглобулінами. Під час
диференціювання здійснюється перебудова імуноглобулінових генів. В ембріоні за нормального
розвитку плазматичні клітини не утворюються, однак у разі інфекцій вони утворюються.
У постнатальному періоді гемопоез відбувається лише в кістковому мозку. У новонароджених
селезінка та лімфовузли розвинені ще мало, рівень імуноглобулінів низький, у крові виявляються
лише сліди IgA, IgE, IgD, спостерігається незначний синтез IgM. Винятком є IgG, рівень якого
значний і який потрапляє до плода від матері крізь плаценту, а після народження — з материнським
молоком. У новонароджених кількість плазматичних клітин значно знижена. Так, у пуповинній
крові новонароджених пул IgM-синтезувальних клітин становить 16 % дорослих, кількість IgA-
продукувальних клітин незначна, а синтез IgG не виявлено. Наприкінці першого місяця життя
кількість IgM-синтезувальних клітин досягає рівня дорослих, а кількість IgG- і IgA-продукувальних
клітин знижена. Однак вміст Т- та В-клітин у крові, а також проліферативна відповідь на мітогени
аналогічна дорослим, здатність лімфоцитів синтезувати імуноґлобуліни та відторгати трансплантати
досить значна. Водночас реакція Т-клітин на бактеріальні антигени знижена і досягає рівня
дорослих на 6 -12-му місяці життя. У Т-клітин знижене продукування ІФН та ІЛ-2 і пригнічена
кілерна активність. У новонароджених спостерігається високий рівень супресорних CD8-клітин.
Материнські антитіла (IgG) зберігаються до 30 діб; за цей час значно збільшується синтез власних
імуноґлобулінів. У 9 міс. рівень IgM досягає рівня дорослих.
У процесі старіння ефективність імунітету знижується. Основними причинами вікових порушень
гуморальної та клітинної імунної відповіді є пригнічення активності Т-хелперів і Т-супресорів, що
зумовлює виникнення так званих хвороб старечого віку — аутоімунні ушкодження та злоякісні
пухлини.
ВИСНОВКИ.
Захисні реакції у безхребетних виникли одночасно з появою багатоклітинності і опосередковуються
клітинними та гуморальними факторами неспецифічного імунітету. У примітивних безхребетних
з'являються перші фагоцитарні клітини — блукаючі амебоцити, які стають родоначальними
клітинами для макрофагів, ПМЯЛ, лімфоцитів та інших клітин крові, розпізнавання «не свого»
виникає на найбільш ранніх етапах еволюційного розвитку — у примітивних безхребетних і
зумовлене лектинами, аглютинінами, комплементоподібними та іншими речовинами. Ефекторними
клітинами відторгнення є амебоцити, при цьому нерідко формується слабка недовготривала пам'ять
до трансплантата. Припускають, що амебоцити є носіями предкового V-гена.
Значним поштовхом формування імунної системи є виникнення у кільчастих червів примітивних
органів кровотворення, які на наступних етапах еволюції ускладнювалися й розміщувалися в різних
органах і тканинах, та поява спеціалізованих лімфоцитоподібних клітин з маркером Т-лімфоцитів.
Вирішальним моментом у становленні адаптивної імунної системи, як самостійної є виникнення
зачатків тимуса та зачатків кісткового мозку у круглоротих — міног, що привело до утворення двох
самостійних популяцій лімфоцитів — Т- і В-клітин.
Контрольні запитання.
1. Які основні захисні фактори у безхребетних?
2. Які механізми розпізнавання «не свого» у безхребетних?
3. Які клітини є родоначальниками імунокомпетентних клітин?
4. Коли виникають і як виявляються ознаки Т-залежних реакцій у безхребетних?
5. В яких організмах виникають В-залежні імунні реакції?
6. Як виникло різноманіття антигенрозпізнавальних структур лімфоцитів?
7. В яких організмах формується специфічна імунна відповідь?
8. Які особливості онтогенезу імунної системи людини?
РОЗДІЛ 15. ПРОТИІНФЕКЦІЙНИЙ ІМУНІТЕТ.
62
Патогени і природний імунітет. Вчення про імунітет історично виникло у процесі пізнання
механізмів захисту від інфекційних захворювань і пов'язане з відкриттям вакцин проти віспи й сказу
та запровадженням пасивної імунізації проти дифтерії і туберкулінової реакції для діагностики
туберкульозу. Ці відкриття сприяли розробленню ефективних методів діагностики, профілактики і
лікування інфекційних захворювань, що зумовило різке скорочення їх чисельності та збільшення
тривалості життя людей у розвинених країнах. Проте і нині питання, пов'язані з вивченням
протиінфекційного імунітету, надзвичайно актуальні у зв'язку з виникненням стійких до
антибіотиків та інших антимікробних засобів штамів патогенів, появою нових збудників
інфекційних захворювань (хвороби легіонерів, СНІДу, неспецифічної пневмонії тощо) і швидким їх
поширенням унаслідок широких контактів людей різних континентів. Для деяких нових збудників
характерна значна мінливість антигенної структури, здатність гальмувати захисні функції
організму, що зумовлює тяжкий перебіг хвороби та значно стримує створення ефективних
лікувальних препаратів і вакцин.
Запобігання проникненню і розмноженню патогенів різної природи є однією з основних функцій
імунної системи. Збудниками патологічних процесів в організмі є різноманітні аґенти (пріони,
віруси, бактерії, гриби, найпростіші, гельмінти), в яких неоднакові розміри, антигенна структура,
здатність продукувати фактори патогенності, місця існування. Вони проникають в організм
переважно переважно через травми різного походження або шляхом прикріплення до епітеліальних
клітин шкіри, слизових оболонок травного каналу, дихальної, сечовидільної й статевої систем.
Патогени закріплюються на клітинах лише за умови наявності на них рецепторів до певних лігандів,
які можуть маскуватися відповідними факторами — муциновими сполуками, неспецифічними і
специфічними імуноґлобулінами, представниками нормальної мікрофлори.
Багато патогенів здатні виділяти токсини, які руйнують шар епітелію і таким чином створюють
умови для проникнення у внутрішнє середовище. Здебільшого патогени з міжклітинної рідини
потрапляють у лімфу і затримуються в лімфатичних вузлах, де індукують специфічну (адаптивну)
відповідь. У разі ушкодження кровоносних капілярів або порушення цілісності бар'єрних структур
лімфатичних вузлів патогени проникають у кров і розносяться по всьому організму, що призводить
до утворення вторинних місць існування і розмноження їх та залучення в імунну відповідь
селезінки й інших лімфоїдних утворів. Крім того, деяким патогенам властивий тканинний тропізм.
У захисті від проникнення, розмноження та існування в організмі патогенів на ранньому етапі
беруть участь переважно неімунні механізми (механічні, фізичні, хімічні, біологічні) і фактори
природного імунітету, а на пізньому — специфічні імунні фактори.
Функціонування цих захисних факторів організму залежить від генетичного статусу, віку,
харчування, впливу на організм несприятливих чинників — фізичних, хімічних, біологічних, а
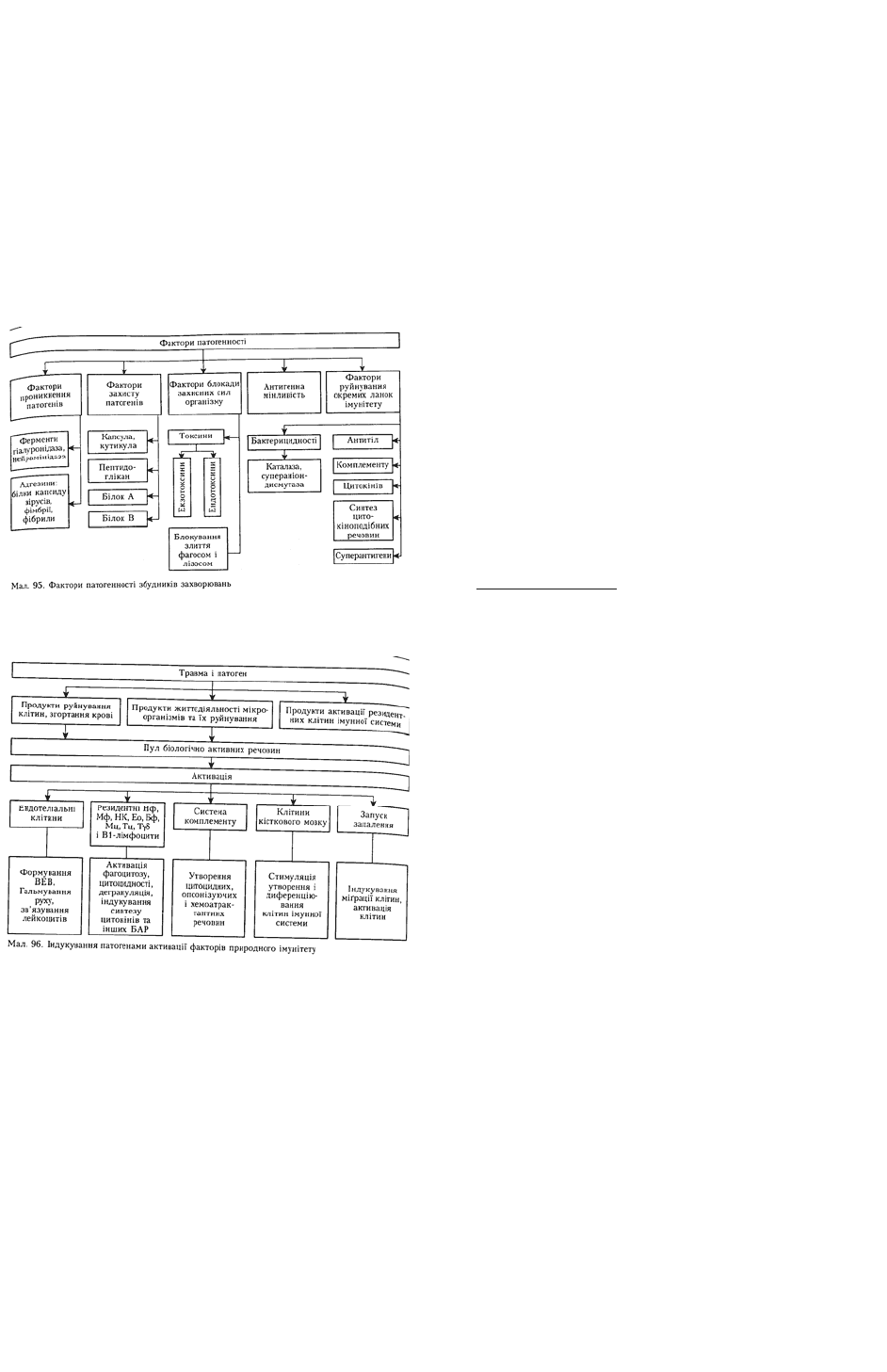
також від властивостей самого патогену — наявності факторів патогенності (мал. 95). При
внутрішньоклітинному існуванні одні патогени можуть швидко лізуватися (пневмококи, віруси
герпесу тощо), а інші — протистояти захисним факторам клітини й інтесивно розмножуватися
(мікобактерії, лістерії).
Для більшості патогенів однією з перших перешкод на шляху проникнення в організм є цілісність
шкіри і слизових оболонок та наявність на їхній поверхні певних захисних факторів (слизу, кислот,
лізоциму, нормальної мікрофлори). Після проникнення в тканини патогени зазнають атаки різних
місцевих гуморальних і клітинних неспецифічних факторів. Здебільшого проникнення патогенів у
тканини пов'язане з механічним пошкодженням клітин і супроводжується виділенням біологічно
активних речовин із пошкоджених клітин організму і патогенів та продуктів життєдіяльності
останніх, що зумовлює активацію клітин імунної системи, секрецію цитокінів і виникнення
опосередкованих цитокінами ефектів (мал. 96).
На кожній стадії взаємодії патогенів з організмом діють відповідні неспецифічні фактори. Більшість
факторів природної резистентності діють негайно. Це фагоцити, НК, В1- і Тγδ-лімфоцити, лізоцим,
різні інгібітори, система комплементу.
Одночасно з активацією фагоцитів відбувається активація комплементу лектиновим,
альтернативним і класичним шляхами на патогенах завдяки наявності на їхній поверхні певних
молекул, які здатні активувати комплемент. Результатом активації комплементу є утворення
багатофункціональних біологічно активних компонентів комплементу.
Сукупність бар'єрних факторів та факторів природної резистентності здебільшого знешкоджують
патогени. Однак у разі значної вірулентності патогенів або великої його кількості, недостатньої
активності факторів природної резистентності індукується запальний процес, мета якого — ізоляція
і знешкодження патогену (див. розд. 2).
Ранні захисні реакції факторів природної резистентності в неімунному організмі здійснюються
впродовж 3 — 4 діб і здебільшого знешкоджують патогени, що проникли, однак за певних дефіцитів
системи природної резистентності або значної патогенності збудників вони не знешкоджуються, що
зумовлює подальший розвиток та ускладнення запального процесу і формування специфічної
імунної відповіді.
Адаптивна імунна відповідь. Важливим фактором, що регулює індукування специфічної імунної
відповіді певного виду, є місце існування та розмноження патогенів. Так, при інфекціях, збудники
яких розмножуються на поверхні епітеліального покриву, активуються Тх2 і формується переважно
місцевий імунітет за участю секреторного IgA і IgE, макрофагів, мастоцитів та еозинофілів. За
міжклітинної локалізації патогенів роль АПК в основному відіграють макрофаги і В2-лімфоцити;
при цьому активуються Тх2 і запускається гуморальна імунна відповідь із синтезом IgM та IgG. За
внутрішньоклітинного існування патогенів основними ефективними факторами їх знешкодження є
клітинні фактори; при цьому основними АПК є дендритні клітини, що зумовлює диференціювання
Тх0 в Тх1 із синтезом ІЛ-2, ІЛ-12, γ-ІФН і призводить до активації цитотоксичних CD8T-
лімфоцитів, НК та макрофагів. Внутрішньоклітинні патогени знешкоджуються або внаслідок
активації бактерицидних систем інфікованих макрофагів цитокінами, або руйнуванням клітин разом
з патогеном цитотоксичними лімфоцитами. Слід зазначити, що всі внутрішньоклітинні патогени
певний час перебувають поза клітинами, де можуть бути об'єктами для захисних систем організму.
В індукуванні певних захисних реакцій організму основну роль відіграють поверхневі
макромолекули патогенів. Для більшості патогенів — це білки і глікопротеїни оболонки, які є
тимусзалежними антигенами. Крім того, деякі патогени мають на своїх поверхневих структурах
молекули, що належать до тимуснезалежних антигенів (ТНЗА) І і II типів. ТНЗА, з одного боку,
сприяють швидкому розвитку гуморальної імунної відповіді без участі Т-клітин, а з іншого, —
неучасть Т-клітин зумовлює синтез переважно IgM з низьким афінітетом, нездатність
«переключати» синтез ізотипів імуноґлобулінів, відсутність формування імунної пам'яті,
індукування у деяких випадках анергії.
У формуванні протиінфекційної адаптивної імунної відповіді можна виділити кілька фаз:
початкову, або проміжну; продуктивну та імунну пам'ять. Початкова антигенспецифічна відповідь,
яка займає проміжне положення між природним захистом і адаптивним імунітетом, переважно
формується у перші 3—4 доби на місці прикріплення або проникнення патогену. Вона
зумовлюється трьома факторами: наявністю Тγδ-лімфоцитів, CD5B1-лімфоцитів і синтезом антитіл
В1-клітинами в процесі тимуснезалежної імунної відповіді.
Тγδ-лімфоцити містяться переважно в слизових оболонках і першими розпізнають специфічний
антиген подібно до В1-клітин прямим його зв'язуванням без участі АПК. Вони здатні зв'язувати
невелику кількість антигенів — здебільшого стресові білки мікобактерій та інфіковані клітини — і
лізувати їх. СD5В1-клітини можуть розпізнавати обмежену кількість антигенних структур без участі
Т-клітин поза зародковими центрами без підсиленого мутагенезу V-генів. Вони синтезують IgM
антитіла, які здатні нейтралізувати патогени і здійснювати комплементзалежний цитоліз. Після
потрапляння в організм ТНЗА можуть відразу індукувати синтез специфічних імуноґлобулінів
місцевими скупченнями організованої лімфоїдної тканини (реґіонарними лімфовузлами і
пейєровими бляшками). ТНЗА І типу (ЛПЦ) індукують синтез IgM, а ТНЗА ІІ типу — IgM і IgG2. Ці
імуноґлобуліни з обмеженою захисною функцією мають слабку нейтралізуючу і
комплементзв'язувальну активність і можуть взаємодіяти із рецепторами з низькою ефективністю.
Мітогенна властивість ТНЗА І типу зумовлює поліклональну активацію В-лімфоцитів і синтез
антитіл багатьох специфічностей за рахунок основної специфічності, індукування аутоімунних
процесів і анергію. Деякі токсини патогенів є суперантигенами, оскільки неспецифічно активують
до 20 — 30 % Т-лімфоцитів різних клонів без індукування захисних peaкцій. Це призводить до
надмірного синтезу цитокінів, що спричинює масову загибель Т-клітин унаслідок апоптозу й
зумовлює розвиток Т-імунодефіциту.
Продуктивна фаза адаптивної імунної відповіді починає функціонувати через 4 – 5 діб після
проникнення патогену. Такий великий інтервал зумовлюється складним шляхом імунної відповіді –
поглинання антигену АПК, у деяких випадках (особливо щодо корпускулярних антигенів) часткове
перетравлювання, процесинг антигену і представлення його пептидів на поверхню АПК разом з
антигенами МНС класу II, міграція АПК у регіонарні лімфовузли або лімфатичні утвори.
Формування імунної відповіді має переважно локальний характер — вона формується на місці
прикріплення і проникнення патогенну (слизові оболонки, шкіра).
Певні особливості має формуванні адаптивної імунної відповіді на слизових оболонках. Тут
основними АПК є В-лімфоцити і мастоцити та спостерігається локальний синтез ІЛ-4, що зумовлює
Тх2-залежну гуморальну, переважно IgA-антитілову відповідь. IgA-утворювальні (плазматичні)
клітини формуються в зародкових центрax реґіонарних лімфовузлів та лімфатичних фолікулів.
Плазматичні клітини заносяться кров'ю під слизовий шар lamina propria завдяки здатності їх
розпізнавати маркери активованого ендотелію і синтезують IgA. Останні здатні проникати крізь
епітеліальні клітини на поверхню слизових, де можуть взаємодіяти з патогенами і нейтралізувати їх,
тобто сприяти швидкій елімінації.
Локальний характер інфекції, як правило, триває недовго. Вона або ліквідується захисними силами
організму, або поширюється в тканини й органи. При цьому індукується синтез IgM і особливо
інтенсивно збільшується продукування IgG, які утворюються в реґіонарних лімфовузлах або
селезінці.
Захисна дія антитіл різноманітна: вони здатні нейтралізувати патогени внаслідок зв'язування
рецепторів, за допомогою яких вони прикріплюються до чутливих клітин, нейтралізувати
синтезовані ними токсини, опсонізувати патогени, сприяючи їх фагоцитозу та антитілозалежній
цитотоксичності, активувати комплемент, зумовлюючи їх лізис. Антитіла можуть бути
ефективними лише щодо доступних для них патогенів — у крові та в міжклітинному просторі, на
поверхні клітин.
Деякі збудники, переважно внутрішньоклітинні, індукують клітинну імунну відповідь, у процесі
якої генеруються цитотоксичні Т-клітини й активуються макрофаги, що сприяє лізису клітин,
інфікованих внутрішньоклітинними бактеріями, найпростішими, грибами, вірусами, або знищенню
патогенів самими інфікованими клітинами.
Наслідком розвитку гуморальної і клітинної імунної відповіді є виникнення протективного
імунітету, який триває 2 — 3 міс. і захищає організм від повторного захворювання впродовж однієї
епідемії та формування імунної пам'яті. У протективному імунітеті в процес знешкодження
патогенів можуть залучатися фактори, які відсутні або відіграють незначну роль у процесі
первинної інфекції. Так, під час первинних інфекцій, вхідними воротами яких є слизові оболонки,
наявні на них секреторні IgA не становлять значної перешкоди прикріпленню і проникненню
патогенів, але за наявності протективного імунітету специфічні секреторні IgA ефективно
знешкоджують патогени. Це характерно і для специфічних IgE, які в комплексі з відповідними
антигенами можуть активувати мастоцити та еозинофіли й швидко зумовлювати запальну реакцію
через виділення гістаміну та лейкотрієну для знешкодження патогену.
Тривалість адаптивного імунітету значною мірою залежить від збудника. В одних випадках його
тривалість невелика (грип, ящур), в інших — зберігається впродовж усього життя (кір, коклюш,
віспа). Імунітет може бути системним і місцевим (у певних органах і тканинах).
Відомо, що носіями імунної пам'яті є окремі субпопуляції В- і Т-лімфоцитів. Ефективність і напрям
вторинної імунної відповіді залежить від відносного вмісту серед Т-клітин пам'яті клітин з
детермінованими потенціями для диференціювання в напрямі Тх1 або Тх2. Імунна пам'ять
зумовлює швидку мобілізацію специфічних гуморальних і клітинних факторів захисту, що сприяє
швидкому розпізнаванню патогену і розвитку специфічної імунної відповіді. Формування імунної
пам'яті є основою вакцинації — імунітет індукується антигенами збудника для профілактики
захворювань.
Однак у деяких випадках імунна пам'ять після інфекцій не формується. Це зумовлюється такими
факторами, як індукування інфекційного процесу тимуснезалежними антигенами (інфекції,
спричинені пневмококами, патогенними ентеробактеріями та ін.), значна мінливість протективних
антигенів, що зумовлює при повторному інфікуванні зустріч організму фактично з новим патогеном
(віруси грипу, ящуру), або висока агресивність
патогену, який гальмує формування імунної
відповіді (особливо небезпечні інфекції — чума, холера та ін.).
15.1. ІМУНІТЕТ ДО БАКТЕРІЙ.
Природні фактори стійкості при бактеріальних інфекціях. Основні механізми захисних реакцій
організму після вторгнення бактерій описано в загальній характеристиці дії природних факторів
стійкості та формування адаптивної імунної відповіді. Однак для деяких патогенів є певні
особливості формування захисних реакцій.
Ефективність захисних механізмів організму під час бактеріальних інфекцій залежить як від стану
організму, так і від складу та будови клітинної стінки бактерій, способу їх існування та здатності
продукувати фактори агресії. За способом існування бактерії поділяють на позаклітинні та
внутрішньоклітинні, а за будовою клітинної стінки — на грампозитивні, грамнегативні та
мікобактерії. Грампозитивні бактерії мають у складі клітинної стінки товстий прошарок
пептидоглікану, тейхоєві кислоти, вуглеводи та білки. Пептидоглікан захищає бактерії від дії
комплементу, тому основними факторами захисту організму проти грампозитивних бактерій є
фагоцити. У грамнегативних бактерій зовнішня мембрана клітинної стінки містить ЛПЦ
(ендотоксини), які визначають антигенну специфічність і є високотоксичними речовинами для
організму. ЛПЦ та ряд субстанцій клітинної стінки грампозитивних бактерій здатні активувати
комплемент альтернативним шляхом, а ліпід А у складі ЛПЦ — ще й класичним без участі антитіл,
унаслідок чого утворюються опсоніни (С3b, С4b), хемотаксичні фактори (С3а, С5а, С5b67) та інші
медіатори запального процесу на ранніх етапах інфекції. Отже, проти грамнегативних бактерій
основними факторами захисту є фагоцити, опсоніни та система комплементу.
Мікобактерії, на відміну від інших бактерій, у клітинній стінці мають значну кількість ліпідів і є
кислотостійкими. Компоненти мікобактеріальної стінки індукують сильну імунну відповідь —
клітинну, в тому числі реакцію гіперчутливості сповільненого типу (ГСТ), і гуморальну, але остання
значної захисної ролі не відіграє. До антибактеріальних захисних механізмів належать клітинні —
специфічні Т-ефекторні клітини та активовані макрофаги.
Основним механізмом антибактеріального захисту є фагоцитоз. Більшість поглинених фагоцитами
бактерій швидко руйнується бактерицидними факторами. Ефективність фагоцитозу на ранніх
етапах підвищується опсонінами — наявними в організмі природними антитілами та компонентами
С3b, С4b, а пізніше фагоцити активуються під впливом цитокінів.
У разі неповного знешкодження бактерій формується запальний процес, в якому беруть участь
продукти руйнування клітин та життєдіяльності бактерій, фагоцити, НК, лімфоцити, компоненти
комплементу, різні цитокіни, продукти обміну арахідонової кислоти тощо. Під час розвитку
запального процесу формується специфічна імунна відповідь, яка зумовлює утворення
протективного імунітету та імунної пам'яті.
Особливості формування адаптивної імунної відповіді. Тип імунної відповіді та протективний
ефект її механізмів залежить від локалізації бактерій і факторів їх патогенності. Протективний
імунітет може формуватися як антибактеріальний, так і антитоксичний. Останній індукується під
час інфекцій, зумовлених бактеріями, основними факторами патогенності яких є токсини (дифтерія
— збудник Соrynbacterium diphtheriae, правець — збудник Clostridium tetani), і забезпечується
антитілами, що нейтралізують токсини. Тому для специфічної терапії цих інфекційних захворювань
використовують антитоксичні сироватки (протидифтерійну, протиправцеву), що містять специфічні
антитіла — антитоксини, а для імунопрофілактики — анатоксини, що є знешкодженими (позбавлені
отруйних властивостей) токсинами, які індукують синтез антитоксинів.
При інфекціях, спричинених нетоксигенними, але високоінвазійними бактеріями, що здатні
проникати в тканини, а іноді й у клітини та розмножуватися в них, зумовлюючи їх ушкодження,
формується антибактеріальний імунітет (переважно клітинний), який не завжди забезпечує повну
елімінацію збудника. Класичним прикладом є туберкульозна інфекція, для профілактики якої
використовують отриману Кальметом і Гереном вакцину BCG (bacilla Calmet-Guerin) з
атенуйованого (з ослабленою вірулентністю) штаму мікобактерій туберкульозу бичачого типу
(Муcobacterium bovis). Механізми імунітету при туберкульозній інфекції описано в розд. 11.
Важливу роль в імунітеті проти мікобактерій відіграють активовані Тх1-клітинами макрофаги та
цитотоксичні Т-клітини.
У разі інфекцій, спричинених бактеріями, які характеризуються локальною інвазійністю
та
локальною токсигенністю і здатністю продукувати ферменти, що руйнують міжклітинну речовину
сполучної тканини, створюється антибактеріальний і антитоксичний імунітет. У знищенні патогенів
беруть участь і гуморальні (антитіла), і клітинні фактори імунітету. До цієї найчисленнішої групи
бактерій належить збудник різних локальних гнійно-запальних процесів Staphylococcus aureus, який
крім токсинів продукує широкий спектр ферментів агресії (
гіалуронідазу, лецитиназу, фібринолізин,
ДНКазу), що забезпечують йому поширення та існування в міжклітинному просторі. У створенні
протистафілококового імунітету беруть участь антитіла, що інактивують токсини і ферменти, та
антитіла, що опсонізують бактеріальні клітини, а також фагоцити, які поглинають опсонізовані
бактерії і руйнують їх. Імунітет після перенесеної стафілококової інфекції є ненапруженим і
нетривалим, що
зумовлюється виділенням стафілококом великої кількості різних токсичних
факторів, здатних гальмувати функції клітин імунної системи та руйнувати їх, а також інгібувати
функціонування більшості факторів природної резистентності й адаптивної імунної відповіді.
Ефективної вакцини для створення штучного імунітету немає. Стафілококовий анатоксин
здебільшого не захищає від появи інфекції.
Для інфекцій, що асоціюються зі слизовими
оболонками, незалежно від того, чи супроводжуються
вони колонізацією бактеріями епітелію (Vibrio cholerae), чи проникненням і розмноженням в
епітелії (Shigella dysentheriae), чи обмежуються лише проникненням їх крізь епітелій (Salmonella
typhi), велике протективне значення мають секреторні IgA (sІgA), які, зв'язуючись з адгезинами на
поверхні бактерій, блокують прикріплення останніх до епітеліальних клітин. Протективний ефект
sІgA реалізується у
разі повторного інфікування. З урахуванням цього створення протективного
штучного імунітету до ентеральних інфекцій можна досягти введенням очищених адгезинів
бактерій, що підтверджено в експериментах на тваринах.
У разі поширення бактерій за межі епітеліального бар'єра і втягнення в імунну відповідь
реґіонарних лімфовузлів і селезінки зростає роль антитіл класу G, які сприяють видаленню
патогенів
унаслідок їх опсонізації та нейтралізації токсинів, що ними виділяються. Крім того, IgG
(ізотипів IgG1 і IgG3) та IgM, запускаючи активацію комплементу класичним шляхом, сприяють
лізису бактерій компонентами комплементу Однак чутливість до мембранолізувального комплексу
виявляють лише деякі грамнегативні бактерії, які за будовою зовнішньої мембрани подібні до
клітин організму.
Якщо антитіла є основними факторами захисту від бактерій, що існують у позаклітинному просторі,
то захист від внутрішньоклітинних патогенів (М. tuberculosis, L. cytogenes) забезпечують клітинні
імунні реакції: реакція ГСТ та цитотоксична реакція лімфоцитів.
Фактори, що гальмують формування антибактеріального імунітету. Формування
протективного імунітету під час бактеріальних інфекцій має свої особливості. Виявлено фактори
бактерій, що гальмують формування ефективного захисту. Найвідоміші з них наведено нижче.
Наявність капсули і капсулоподібних речовин захищає бактерії від дії факторів природної
резистентності та антитіл — перешкоджає опсонізації і фагоцитозу.
У деяких бактерій протективні антигени характеризуються високою гетерогенністю і
поліморфізмом, що ускладнює формування ефективної імунної відповіді на велику кількість

63
антигенів. Антигенний склад бактерій може змінюватися навіть упродовж однієї епідемії. Так,
стрептокок — збудник пневмонії (S. рпеитопіае), має понад 80 серотипів; М-білок, що є фактором
вірулентності стрептококів, є антигенозмінним.
Утворення гранульом (при туберкульозі, лепрі) сприяє виживанню бактерій упродовж тривалого
часу (див. розд. 11).
Індукування неадекватного виду імунної відповіді може бути зумовлене як макроорганізмом (певні
імунодефіцити), так і бактеріями.
Певну роль у формуванні малоефективної імунної відповіді та індукування ушкоджень організму
імунною системою відіграють антигени, спільні для бактерій і певних клітин організму. Прикладом
цього явища є аутоімунний процес при ревматизмі, зумовлений антитілами до епітопу β-D-N-
ацетилглюкозаміну — спільного для стрептокока і клітин синовіальної оболонки суглобів, м'язів і
клапанів серця. Відомі й інші випадки спільних антигенних детермінант для бактерій і клітин
макроорганізму.
Тимуснезалежні антигени (поліцукриди, ЛПЦ) можуть індукувати поліклональну активацію В-
лімфоцитів, що призводить до синтезу великої кількості імуноглобулінів різної специфічності за
рахунок специфічних.
Деякі компоненти бактерій (білок А стафілокока, М-білок стрептокока, ЛПЦ, кордфактор
туберкульозної палички, деякі антигени збудників кишкових інфекцій) здатні інактивувати лізоцим,
імуноґлобуліни, компоненти комплементу, ІФН, пригнічувати фагоцитоз та інші ланки захисних сил
організму. Так, протеїназа гонококів руйнує IgA, а білок А стафілокока та білок G стрептококів
зв'язують антитіла. Крім того, грамнегативні бактерії використовують найрізноманітніші способи
для уникнення літичної дії комплементу: зв'язування С3b на відстані від зовнішньої мембрани,
злущування лізуючого комплексу C5b— C9, розщеплення фіксованого комплементу ферментами
або стимуляція зв'язування С3b з факторами Н і J хазяїна, що призводить до його інактивації, тощо.
Реакція організму проти бактерій може призводити до ушкодження тканин, зумовленого імунними
механізмами. Як уже зазначалося (див. розд. 11), під час туберкульозної інфекції спостерігаються
ушкодження тканин, які виникають унаслідок імунного запалення (реакція ГСТ), основою якого є
активація макрофагів цитокінами, що продукуються Тх1-клітинами. Активовані макрофаги можуть
виділяти велику кількість цитокінів, які, очевидно, частково відповідають за ушкодження. Під час
інфекцій, що спричинюються грамнегативними бактеріями, надмірна секреція цитокінів може
призвести до розвитку шоку. Ініціатором викиду цитокінів найчастіше є бактеріальний токсин
(ЛПЦ), з чим пов'язана назва цього стану — ендотоксичний шок. Наслідком розвитку шоку є
геморагічні некрози, що найчастіше виражені у слизовій травного каналу. Ключову роль у розвитку
шоку відіграють прозапальні цитокіни ФНП-α, ІЛ-1, ІЛ-12, ІФН-γ, які зумовлюють пошкодження
ендотелію, відкладання фібрину, накопичення і дегрануляцію нейтрофілів і тромбоцитів. Деякі
бактеріальні екзотоксини, зокрема стафілококовий ентеротоксин, є суперантигенами, здатними
поліклонально активувати Т-лімфоцити, що зумовлює масовий синтез цитокінів, які спричинюють
апоптоз значної кількості Т-лімфоцитів і є причиною виникнення Т-залежного імунодефіциту.
15.2. ПРОТИВІРУСНИЙ ІМУНІТЕТ.
Особливості вірусного інфекційного процесу. Формування захисних реакцій макроорганізму у
відповідь на агресію вірусів залежить від стану імунної системи й особливо від структури і
біологічних властивостей вірусів. Віруси проникають в організм крізь слизові оболонки, шкіру або
через кров під час укусів комах і тварин, розмножуються в епітеліальних клітинах покривів, а після
потрапляння в кров — у інших клітинах, у тому числі в імунокомпетентних і в нервових.
Віруси характеризуються різними структурами, складом і розміром молекул нуклеїнових кислот
(від кількох генів у геномі РНК-вірусів до 200 генів у деяких ДНК-вірусів), наявністю або
відсутністю певних компонентів, що формують капсид і оболонку віріонів. Серед царства
вірусів
виділяють такі основні чотири групи: РНК-віруси; ДНК-віруси; віроїди (у рослин) — вірусна
нуклеїнова кислота без білкових молекул та пріони — «інфекційні білки», що є збудниками
повільних інфекцій. Незважаючи на різноманітність форм існування, віруси мають низку спільних
ознак. Вони є суворо облігатними внутрішньоклітинними патогенами і виявляють свою
життєдіяльність лише всередині інфікованих
клітин унаслідок «переключення» в клітинах процесу
метаболізму, морфофункціональних структур, ферментних систем для забезпечення
репродукування нового покоління віріонів з гальмуванням внутрішньоклітинних процесів і
можливим руйнуванням інфікованих клітин.
Від характерних ознак вірусних інфекцій певною мірою залежить формування захисних реакцій
організму — короткий інкубаційний період для більшості збудників, швидка репродукція вірусного
потомства і поширення віріонів кровотоком по всьому організму, гальмування активності та
руйнування клітин імунної системи, ушкодження тканин і органів, індукування запальних процесів.
Останні характеризуються, на відміну від таких при бактеріальних інфекціях, активною участю не
ПМЯЛ, а моноядерних клітин — лімфоцитів, моноцитів-макрофагів.
Інфікування вірусами клітин зумовлює зміни в структурі клітинної мембрани внаслідок заміни
глікопротеїнів клітинної оболонки вірусіндукованими білками, порушення структури клітинної
оболонки, що зумовлює появу нехарактерних антигенних структур, індукування експресії на
поверхні клітин чужорідних антигенів, зокрема пухлинних.
На формування противірусного захисту переважно впливають такі фактори: внутрішньоклітинний
тип репродукції вірусів з використанням клітинних механізмів синтезу макромолекул; еволюційна
стійкість віріонів до дії ферментних систем макроорганізму та деяких агресивних факторів
зовнішнього середовища; здатність вірусів модифікувати клітинну мембрану інфікованих клітин.
Отже, захисні реакції організму проти вірусів
мають бути спрямовані на розпізнавання,
нейтралізацію і знешкодження як самих віріонів, так і інфікованих ними клітин.
Природні фактори противірусного захисту. Якщо під час бактеріальних інфекцій первинними й
основними факторами запобігання проникненню і поширенню бактерій в організмі є система
комплементу, лізоцим, фагоцитарні клітини, нормальна мікрофлора, то під час вірусних інфекцій
вони
не мають великого значення. Основними противірусними факторами макроорганізму на
перших етапах інфекції є інгібітори вірусів, НК та фагоцитарні клітини, температурна реакція,
ІФНи. Антивірусну активність мають α- і β-інгібітори. α-інгібітори (термостабільні речовини, які
належать до α-ґлобулінів) перешкоджають адсорбції вірусів на клітинах, а β-інгібітори (належать до
β-ґлобулінів, термолабільні
) пригнічують розмноження орто- і міксовірусів. Нейрамінідаза орто- і
параміксовірусів руйнує β-інгібітори.
Певну роль у запобіганні проникненню деяких вірусів у клітини відіграє система комплементу.
Деякі онкогенні РНК-віруси здатні фіксувати С1-компонент комплементу і запускати активацію
комплементу класичним шляхом без участі комплексу антиген —антитіло. Інші віруси можуть
активувати комплемент через
С-реактивний білок та альтернативним шляхом. Слід зазначити, що
комплементзалежний цитоліз інфікованих вірусом клітин можливий лише за високої щільності
експресії вірусних антигенів на клітинній мембрані — не менш як 5·10
6
на клітину. Компоненти
комплементу під час приєднання до віріона здатні гальмувати його адсорбцію до відповідних
рецепторів і його проникнення в клітину. Крім того, компоненти комплементу можуть зумовлювати
агрегацію віріонів за допомогою конглютинінів і таким чином нейтралізувати їхні патогенні
властивості.
Після проникнення вірусів у клітини індукується утворення антивірусних факторів — інтерферонів
І
типу — α- і β-ІФНів і виділення їх за межі клітин. У нормі ІФНи в організмі не продукуються. В
сироватці крові практично здорових людей вони відсутні або виявляються у невеликій кількості (до
8 од/мл). Під час активації НК і макрофаги та сенсибілізовані Т-лімфоцити продукують інтерферон
II типу — ІФН-γ, який
має не лише антивірусну активність, а й широкий спектр регулювальної дії
щодо мобілізації і підвищення ефективності різних ланок природної та специфічної імунної
відповіді. ІФНи α і β діють на ранніх етапах вірусної інфекції, а ІФН-γ продукується переважно
ефекторними клітинами. У перші години вірусної інфекції здебільшого спостерігається значне
підвищення рівня
циркулюючого ІФНу. Одночасно індукуються та активуються ІФН-залежні
внутрішньоклітинні механізми противірусного захисту. Загалом перебіг і кінець хвороби залежать
від швидкості включення системи ІФНу в процес формування противірусного захисту. Внаслідок
взаємодії ІФНів з клітинами в них індукується синтез антивірусних субстанцій — протеїнкінази з
молекулярною масою 67 кД і 2',5'-олігоаденілатсинтетази.
Протеїнкіназа фосфорилює α-субодиницю, що ініціює трансляцію фактора eІF, що призводить до
інактивації його і блокади синтезу вірусних білків, 2',5'-олігоаденілатсинтетаза активує латентну
ендонуклеазу, яка руйнує вірусну РНК. Існують й інші механізми противірусної дії ІФНів. Так, під
час грипозної інфекції ІФНи α і β активують ген М, внаслідок чого продукується білок Мх, який
інгібує первинну транскрипцію генів вірусу ґрипу, але не впливає на транскрипцію інших вірусів.
У результаті адсорбції вірусу на клітинній мембрані, зміни структури клітинної мембрани, появи
вірусіндукованих білків на поверхні клітин модифікується структура клітинної стінки, що зумовлює
розпізнавання її факторами природної резистентності та специфічними цитолітичними Т-
лімфоцитами з наступним поглинанням інфікованих клітин або кілерним ефектом щодо них і
руйнуванням їх разом з вірусами.
Одну з основних функцій у природному противірусному захисті, зумовлених клітинами, відіграють
НК, які масово з'являються через дві доби після інфікування. Вони швидко розпізнають та вбивають
вірусінфіковані клітини, які в результаті інфекції втрачають антигени МНС І і стають чутливими до
дії кілерних клітин. Знешкодження інфікованих клітин здійснюється двома способами — літичним
ударом та індукуванням апоптозу.
Моноцити і макрофаги також є важливою ланкою у противірусному захисті — вони розпізнають
інфіковані вірусом клітини, поглинають їх і переважно інактивують. Однак у деяких випадках
фагоцити не здатні інактивувати вірус і поглинені віруси певний час можуть зберігати свою
життєздатність, навіть розмножуватися. Моноядерні фагоцити мають специфічні рецептори до
певних вірусів, що полегшує проникнення в них патогенів. Під час міграції такі інфіковані фагоцити
можуть бути джерелом поширення вірусів. Одна з важливих функцій моноядерних фагоцитів у
антивірусному захисті — це здатність утилізувати імунні комплекси вірус—антитіло та
інактивувати вірус. При цьому можливі й негативні наслідки — у фагосомах за низьких значень рН
комплекс АГ – АТ дисоціюється, а живий вірус може проникати в цитоплазму і там
репродукуватися.
Певну роль на ранніх етапах вірусної інфекції відіграють Тγδ-клітини, як кілери і продуценти ряду
цитокінів, та СD5В1-лімфоцити, як продуценти природних антитіл.
Формування адаптивної імунної відповіді. У разі неспроможності неспецифічних факторів
резистентності нейтралізувати віруси інфекційний процес прогресує, при цьому формується
специфічна імунна відповідь, основними компонентами якої є специфічні цитотоксичні Т-
лімфоцити та специфічні антитіла.
Найважливішими вірусними антигенами, які індукують ефективну імунну відповідь, є капсидні
білки безоболонкових вірусів і глікопротеїни вірусних оболонок. Усі вірусні антигени — Т-залежні.
В одних випадках АПК (макрофаги, дендритні клітини) презентують вірусні антигени, зв'язані з
антигенами МНС класу І, CD8 Т-лімфоцитам, із яких утворюються специфічні Т-кілери
, в інших —
вірусні антигени, зв'язані з антигенами МНС класу II — CD4 Т-хелперам (Тх2), які індукують
синтез антитіл до вірусних антигенів — спочатку IgM, а потім IgG.
В адаптивному противірусному імунітеті важливу роль відіграють клітинні фактори, насамперед Т-
лімфоцити. У разі наявності дефектів Т-системи макроорганізм стає дуже чутливим до вірусних
інфекцій і перебіг їх відбувається дуже тяжко. Ранніми специфічними факторами захисту проти
вірусів є Тγδ-лімфоцити з кілерною активністю та СD5В-лімфоцити, які можуть секретувати ранні
специфічні антитіла.
У процесі формування специфічної противірусної імунної відповіді першими (вже через дві доби
після інфікування) з'являються клітинні фактори — цитотоксичні Т-лімфоцити з фенотипом CD8,
які розпізнають модифіковані вірусами антигени клітинної мембрани через антигени МНС класу І
та лізують інфіковані вірусами клітини. Слід відзначити роль Т-хелперів, які індукують
диференціювання і проліферацію цитотоксичних CD8 Т-лімфоцитів, а під час деяких інфекцій,
зокрема кору, індукують утворення цитотоксичних клітин з фенотипом CD4, продукування антитіл
В-лімфоцитами, мобілізують та залучають у процес моноцити і макрофаги. Певну роль у
противірусному захисті відіграє антитілозалежна цитотоксичність НК через рецептор CD16.
Літичний ефект переважно здійснюється внаслідок продукування перфорину.
Специфічні імуноґлобуліни виявляють захисну функцію по-різному. Найефективнішими є антитіла
до вірусних глікопротеїнів. Одна з найважливіших функцій антитіл — нейтралізація вірусних
частинок. Цю функцію в секретах одночасно з вірусними інгібіторами виконують ізотипи IgA, IgG2,
які після приєднання до вірусів змінюють просторову організацію антигенів вірусу і позбавляють їх
можливості долати мембранний бар'єр та послаблюють зв'язок вірусів зі слизовими оболонками, що
сприяє швидкій евакуації патогенів. Нейтралізацію віріонів у міжклітинному просторі переважно
здійснюють IgG, а в крові — IgM. Приєднання до вірусних частинок антитіл класу IgG1, IgG3,
здатних зв'язуватися з FcR ефекторних клітин, зумовлює одночасно з нейтралізацією вірусів
прискорення фагоцитозу та розщеплення патогенів. Приєднання антитіл до вірусних частинок
змінює просторову структуру капсиду або поверхневих глікопротеїнів у процесі формування
комплексу АГ — АТ, що перешкоджає вірусам взаємодіяти з клітинними рецепторами або блокує
звільнення вірусного геному після проникнення нуклеокапсиду в цитоплазму. Така взаємодія
антитіл з вірусами відбувається в разі відсутності в структурі вірусів компонентів, здатних
фіксувати комплемент, та за відсутності або дефектів комплементу.
Важлива роль імуноґлобулінів класів G і М у противірусному захисті зумовлюється здатністю цих
антитіл опсонізувати віріони або інфіковані клітини, формувати імунні комплекси і таким чином
сприяти їх поглинанню фагоцитарними клітинами, фіксувати комплемент у процесі утворення
комплексу антиген — антитіло та індукувати активацію комплементу, що сприяє активному їх
поглинанню фагоцитарними клітинами і знешкодженню бактерицидними факторами й
активованими компонентами комплементу. В умовах наявності імунної пам'яті ефективним
специфічним захисним фактором слизових є секреторні IgA-антитіла.
Тривалість активного противірусного імунітету становить від кількох місяців до кількох років, а то
й довічно (вірус кору, поліомієліту). Пасивний імунітет зберігається впродовж кількох тижнів.
Імунодефіцити, зумовлені вірусами. У разі інфікування вірусами імунокомпетентних клітин
індукується порушення їх функціональної активності, внаслідок чого можуть виникати
імунодефіцитні стани. Найхарактерніші з них наведені нижче.
Руйнування Т-хелперів вірусом ВІЛ та вірусом лімфоцитарного хоріоменінгіту (родини
аденовірусів) призводить до значного зниження кількості CD4 Т-хелперів, внаслідок чого
спостерігається різке зниження активності цитотоксичних CD8T-лімфоцитів.
Деякі віруси (віруси Денге, грипу, герпесу простого, кору, поліомієліту) здатні інфікувати
імунокомпетентні клітини та змінювати їхню активність, унаслідок чого порушується кооперація Т-
і В-лімфоцитів, що призводить до гальмування певних ланок формування імунної відповіді.
У деяких випадках антитіла на віріонах (вірус Денге) можуть сприяти їх проникненню в клітини
внаслідок зв'язування Fc-фраґментом з Fc-рецептором клітини. Окремі віруси індукують виділення
інфікованими клітинами розчинних факторів, здатних інактивувати антитіла. Так, ВІЛ індукує
виділення інфікованими лімфоцитами білка gp120, що блокує вірусспецифічні антитіла.
Інфіковані вірусом клітини можуть продукувати фактори, які пригнічують активність CD4 Т-
лімфоцитів. Наприклад, вірус Епштейн-Барр виділяє ІЛ-10-подібну речовину, а цитомегаловірус
прискорює синтез ІЛ-10, що зумовлює пригнічення активності Tx1-клітин. Багато вірусів (вірус
Денге, вірус кліщового енцефаліту) неспецифічно активують супресорні клітини, отже, гальмують
формування специфічної імунної відповіді. Віруси грипу, кору, аденовіруси та інші здатні
індукувати апоптоз деяких популяцій Т-хелперів, що спричинює дисбаланс Тх1 і Тх2.
Механізми стійкості вірусів до захисних факторів організму. В процесі еволюційного розвитку
віруси виробили механізми, що захищають їх від дії факторів природної і специфічної
резистентності організму. Один із них — інтеграція вірусного геному в геном клітини. При цьому
відбуваються невеликі зміни геному клітин та експресується незначна кількість вірусних антигенів,
чим і зумовлюється уникнення імунного нагляду. В інших випадках віруси можуть зберігатися
тривалий час у певних анатомічних місцях без видимих ознак їх наявності, але після дії
несприятливих факторів вони можуть швидко розмножуватися і спричинювати певні ушкодження
(наявність вірусу герпесу простого в трійчастому нерві). Фактором захисту вірусів від захисних
механізмів організму є здатність деяких вірусів (параміксовірусів, герпес вірусів, ВІЛ) переходити з
клітини в клітину без видимої вірусемії; при цьому нерідко спостерігається злиття клітин та
утворення гігантських багатоядерних клітин. Деякі віруси, особливо ретровіруси, ВІЛ, віруси
ящуру, грипу та інші, часто змінюють свій антигенний спектр і раніше утворені антитіла не здатні
розпізнавати віріони зі зміненими антигенами. Виділяють поступову (антигенний дрейф) і різку
(антигенний шифт) зміну антигенів.
Деякі клітини організму (нейрони, клітини кришталика та ін.) не експресують антигени МНС класу
І і фактично не розпізнаються клітинами імунної системи. У нормі ці клітини ізольовані і в разі
порушення їх ізоляції у них можуть активно розмножуватися віруси.
Багато вірусів під час інфікування клітин виділяють ряд інгібіторів окремих ланок імунної відповіді.
Так, поксвіруси виділяють фактори, що блокують активність ІФНів і ФНП-α, а вірус віспи індукує
синтез інгібітора С4 компонента комплементу, який здатний блокувати класичний шлях активації
комплементу. У процесі репродукції вірусу гепатиту В синтезуються поверхневі антигени (HbsАr),
які завдяки зв'язуванню специфічних антитіл сприяють утворенню щита, що захищає віріони від дії
противірусних факторів.
Окремі віруси містять гени, що кодують білки, подібні до цитокінових рецепторів або до самих
цитокінів і порушують зумовлену цитокінами захисну дію. Деякі віруси продукують короткі
відрізки РНК, що конкурують за протеїнкіназу і таким чином пригнічують активність цього
ферменту – фактора прояву активності ІФНу.
Нещодавно виділені збудники повільних вірусних інфекцій нервової системи (губчастого
енцефаліту, Куру, Крейцфельдта —Якоба, скрепі) — пріони, тобто інфекційні білкові молекули.
Будь-яких захисних факторів і реакцій при цих захворюваннях не виявлено.
15.3. ІМУНІТЕТ ДО ГРИБІВ.
Природні фактори захисту. Мікози здебільшого є опортуністичними захворюваннями, оскільки
виникають переважно через певні вади імунної системи (тяжкі імунодефіцити, СНІД, аплазія тимуса
тощо). Першою та надзвичайно важливою і нерідко основною ланкою захисту макроорганізму від
мікозів є природні фактори захисту. Особливе значення серед гуморальних факторів у природному
захисті проти грибів має система комплементу. Про важливу роль системи комплементу в
антимікозному імунітеті свідчать дані значного зниження захисних реакцій, що призводить до
тяжкого перебігу захворювання, навіть до летальних наслідків, після інфікування кандидами
експериментальних тварин з дефектами комплементу. Ряд компонентів клітинної стінки грибів
здатні активувати комплемент альтернативним шляхом, манани клітинної стінки активують
комплемент класичним шляхом без участі специфічних антитіл, що має велике значення на перших
етапах взаємодії грибів з макроорганізмом за відсутності специфічних антитіл. Показано, що
опсонізація С. albicans (найбільш патогенного штаму) може здійснюватися лише за наявності іС3b
та С3d, рецептори до яких є у макрофагів, ПМЯЛ і НК.
Значну роль у природному захисті проти грибів відіграють клітинні фактори — фагоцити, НК, Тγδ-
лімфоцити, В1-лімфоцити, еозинофіли, епітеліальні та ендотеліальні клітини. Захоплення
фагоцитами грибів ускладнюється великими розмірами патогенів, при цьому в поглинанні грибів
беруть участь кілька фагоцитів. Клітини Candida можуть безпосередньо адгезуватися до макрофагів
лише через манозозв 'язувальний рецептор за участю іонів Са
2+
, а до нейтрофілів — лише через
опсоніни — через рецептор до Fc-фраґмента імуноґлобулінів або через CR1- і СR3-рецептори.
Експресія цих рецепторів підвищується за дії ІЛ-15 та ІЛ-4 і знижується після викиду активних
речовин фагоцитами. Важливою фунгіцидною дією фагоцитарних клітин є кисневозалежна
активність, яка зумовлена пероксидазою. Дефіцит мієлопероксидази є одним з основних факторів,
що спричинює виникнення кандидозу. Важливу роль у фунгіцидному ефекті фагоцитів відіграє
індуцибельна синтетаза іNOS та оксид нітрогену (II) NO
2
. Некисневі фактори цитоцидності
(дефензини, лізоцим, лактоферин, гранзими, перфорини) беруть активну участь у знешкодженні
грибів. Певну регуляторну роль відіграють цитокіни – ГМ-КСФ, ІЛ-15, ІФН-γ, які підвищують
кисневозалежну, а ФНІІ-α та ІФН-γ – азотзалежну цитоцидність.
НК здатні розпізнавати інфіковані грибами клітини і лізувати їх. При цьому в процесі взаємодії з
грибами вони активуються і продукують регулювальні цитокіни - ІЛ-2, ІФН-γ, ФНП-α.
У захисних реакціях при мікозах велике значення мають епітеліальні та ендотеліальні клітини. Так,
епітеліальні клітини слизових поряд з такими захисними функціями, як механічна перешкода,
постійне виділення слизу і забезпечення його руху, ще продукують дефензини, які ефективно
руйнують гриби. Ендотеліальні клітини за допомогою ендотеліальної NO-синтетази виробляють з
L-аргініну оксид нітрогену (II) NO, який бере активну участь у деградації патогену. Нерідко у місці
локалізації грибів унаслідок виділюваних ними протеаз можуть відбуватися тромбоз кровоносних
судин та формування епітеліоїдних грануломатозних реакцій з метою ізоляції патогену.
Усі ці фактори активуються і взаємодіють у процесі формування та функціонування доімунного
запалення. Якщо природні фактори стійкості не здатні знешкодити патоген, інфекційний процес
продовжує розвиватися і формується специфічна імунна відповідь (хоч і не завжди ефективна), що
має свої особливості.
Адаптивний імунітет. Поверхневі антигенні структури деяких грибів мають низьку імуногенність,
внаслідок чого антитіла утворюються в низьких титрах, що зумовлює низьку напруженість
гуморальної імунної відповіді. Нерідко в таких випадках основну роль у специфічній імунній
відповіді відіграють клітинні фактори. Під час мікозів можуть утворюватися антитіла всіх чотирьох
класів — М, G, А, Е. Першими з'являються IgM і зростаючі або високі титри IgM свідчать про
активний характер інфекції. Після приєднання до клітин грибів вони можуть гальмувати їхню
адгезію на клітинах макроорганізму. Антитіла класу G переважно виявляються під час інфекції і
мають значення як опсоніни (особливо IgG2a) і як активатори комплементу класичним шляхом.
Антитіла класу IgA виявляють за всіх форм кандидозу і вони відіграють, особливо секреторні IgA,
важливу роль у захисних реакціях — перешкоджають адгезії грибів до епітеліальних клітин
слизових оболонок та зв'язують гриби і таким чином сприяють швидкій їх евакуації.
Найефективнішими специфічними захисними факторами при мікозах є клітинні. Велике значення у
захисті макроорганізму при мікозах, зокрема при кандидозах, мають Тх1, що продукують ІФН-γ,
який стимулює поглинальну і фунгіцидну активність фагоцитів, сприяє ефективній презентації
антигенів грибів після їх переробки макрофагами імунокомпетентним клітинам. Водночас при
активації Тх2 гальмується активність Тх1, що призводить до пригнічення поглинальної та
фунгіцидної дії фагоцитів. Нерідко при цьому спостерігається значна стимуляція синтезу антитіл і
це часто пов'язано з погіршенням стану дослідних тварин.
Певну роль в антимікозному захисті відіграють CD8T-лімфоцити. Вони здатні розпізнавати і
руйнувати фагоцити з поглиненими грибами, а також безпосередньо самі гриби. Крім того, вони
продукують ІФН-γ та ІЛ-2, які стимулюють Тх1, НК, фагоцити і пригнічують Тх2. Окрема
популяція Т-лімфоцитів, яка несе γδ-рецептори і здебільшого наявна на першій лінії захисту
макроорганізму — в тканині шкіри і слизових оболонках, у тому числі в стінках кишок, тісно
пов'язана з елімінацією грибів та одужанням від інфекції. Вона активно перешкоджає проникненню
і розмноженню грибів унаслідок продукування ІНФ-γ, стимуляції фагоцитів, індукування реакції
ГСТ та кілерного ефекту. У разі стимуляції супресорних механізмів може виникати анергія —
відсутність або слабка ефективність імунної відповіді. При більшості вісцеральних і шкірно-
слизових мікозів спостерігається пригнічення клітинного імунітету. Це підтверджується фактами
високої частоти мікозів за природжених вад Т-клітин, стимуляції або супресії мікозів під час
модуляції Т-клітинної ланки імунної відповіді. Свої особливості у формуванні імунної відповіді
мають представники так званої групи опортуністичних мікозів, які індукуються умовно-
патогенними грибами при імунодефіцитах, дефектах тканин, органів, або в разі тривалого
застосування антибіотиків. Більшість опортуністичних мікозів супроводжується продукуванням IgG
та IgE і алергізацією організму.
Значна кількість мікозів характеризується алергізацією макроорганізму. Глибокі мікози і
дерматомікози супроводжуються реакцією ГСТ на антигени грибів. Крім того, ураження грибами
слизових оболонок дихальних і сечостатевих шляхів зумовлюють виникнення реакцій
гіперчутливості негайного типу. Винятком є збудник криптококозу, за якого алергічні реакції
виникають дуже рідко. Виникнення гіперчутливості переважно супроводжується формуванням
захисних реакцій — повторні захворювання в алергізованому організмі здебільшого мають легкий
перебіг. У деяких випадках при легеневому аспергільозі спостерігається різке зростання
продукування IgE.
Слід зазначити, що багато представників класу грибів використовують у різних біотехнологічних
виробництвах, і в працівників цієї сфери нерідко виникають алергічні захворювання, особливо
дихальних систем.
Інфекції, зумовлені грибами, часто супроводжуються зміною імунореактивності організму, що може
бути причиною діагностичних помилок унаслідок відсутності шкірних реакцій сповільненого типу
або клітинних реакцій in vitro під час проведення діагностичних проб (туберкулінової та інших) та
сприяти загрозливому розвитку вторинних інфекцій.

64
Захисні фактори грибів. У процесі еволюції у збудників інфекцій, зумовлених грибами,
сформувалася система захисті від дії захисних сил макроорганізму. Ця система включає широку
мінливість антигенної структури, зміну фаз росту, існування за різних температур і кислотності.
Гриби здатні синтезувати ряд протеїназ, які можуть розщеплювати імуноглобуліни, фактори
комплементу та інші захисні фактори. Наприклад, С.albicans має фермент каталазу, яка нейтралізує
дію пероксиду гідрогену. Кокциди, гістоплазмоїди та деякі інші гриби мають спільні антигенні
структури, що зумовлює перехресні реакції з комплементзв'язувальними антитілами класів G та М,
а також під час постановки шкірно-алергічних проб.
Для діагностики мікозних захворювань використовують реакції зв'язування комплементу, непрямої
аглютинації, імунодифузії та шкірно-алергічні реакції. Специфічна профілактика більшості мікозів
відсутня, за винятком кандидозів, для профілактики яких інколи застосовують убиті вакцини,
зокрема аутовакцини.
15.4. ІМУНІТЕТ ДО НАЙПРОСТІШИХ.
До збудників протозойних захворювань людини і тварин належать найдрібніші живі істоти царства
еукаріотів, які значно різняться між собою за розмірами, антигенною структурою, способами
проникнення в макроорганізм, місцями і формами паразитування.
Найпростіші набагато складніші від бактерій за своєю будовою (більшість має щільну еластичну
мембрану — петикули, а інколи і мінеральний скелет) та антигенним складом. Значна частина
найпростіших в організмі проходить кілька стадій розвитку, які різняться своєю антигенною
будовою, можуть розвиватися в організмі у різних місцях — на слизових оболонках і шкірі (амеби,
балантидії, лямблії, трихомонади, лейшманії), внутрішньоклітинно (лейшманії, трипаносоми,
плазмодії, токсоплазми, кокциди), в міжклітинному просторі (балантидії, токсоплазми, амеби), у
крові (плазмодії, трипаносоми, амеби) та в кишках, жовчному міхурі, печінці, спинному і головному
мозку, м'язах, міокарді. Для певних збудників характерна постійна мінливість поверхневих
антигенів. Крім того, продукти життєдіяльності найпростіших мають імуносупресивні властивості.
При деяких інфекціях в організмі з'являється велика кількість нових антигенів найпростіших і
змінених структур власних клітин унаслідок агресії збудників. Так, під час малярії в організмі
з'являється понад тисячу різних нових антигенів. Все це зумовлює формування малоефективної
імунної відповіді.
Найпростіші проникають в організм найчастіше через укуси комах, клопів та аліментарним шляхом.
Для внутрішньоклітинного проникнення вони використовують різноманітні рецептори. Так,
лейшманії проникають у макрофаги за допомогою рецептора до C1q-компонента комплементу, а
також за допомогою манозно-фукозного рецептора, збудник малярії проникає в еритроцити завдяки
спеціальній органелі — ронтрії та через специфічний на еритроцитах рецептор — антиген Дафі.
Чутливість окремих особин до протозойних захворювань контролюється певними генами імунної
відповіді.
Існують спостереження про наявність до деяких найпростіших природженої стійкості організму.
Так, більшість дорослих людей стійкі до балантидіозу. Виявлено індивідуальну несприйнятливість
окремих осіб до патогенних амеб, яка в деяких випадках спричинюється будовою і
функціонуванням стінки кишок. Природна резистентність місцевих жителів Африки до збудників
малярії зумовлена двома факторами — відсутністю в еритроцитах ізоантигену Дафі або наявністю
серпоподібної форми еритроцитів.
Неспецифічні фактори захисту першими стикаються з найпростішими і переважно знешкоджують
патогени. Однак за наявності певних вад системи захисту організму, значної патогенності збудника
або здатності його обминати відповідні ланки захисної системи найпростіші здатні закріплюватися
на слизових оболонках або проникати у внутрішнє середовище організму й колонізувати деякі
тканини, органи, клітини.
Характер і особливості індукування та формування адаптивної імунної відповіді для більшості
протозойних захворювань ще мало вивчені. Існує багато спостережень про відсутність формування
адаптивної імунної відповіді або дуже низький її рівень при деяких протозойних захворюваннях
(лямбліоз, амебіоз, трихомоноз), про що свідчить часте виникнення повторних захворювань.
Відомо, що деякі найпростіші зумовлюють становлення гуморального та клітинного імунітету, але
його роль у захисних реакціях організму неоднакова і здебільшого малоефективна. Це
спричинюється низкою факторів — особливістю антигенного складу, фізіологічними
особливостями паразитів, стадіями розвитку та існування, місцями паразитування тощо.
Вид специфічної імунної відповіді залежить від антигенної будови найпростішого, стадій існування
та місцезнаходження його. Гуморальна імунна відповідь формується майже за всіх форм
паразитування протозойних збудників, але найефективніше вона виявляється в разі перебування
паразитів у крові (малярія, трипаносомоз), У міжклітинному просторі певних тканин та органів
(лейшманіоз). Внутрішньоклітинна форма існування паразитів сприяє формуванню клітинної
імунної відповіді (токсоплазмоз, лейшманіоз). При існуванні на поверхні слизових оболонок
(лямбліоз, трихомоноз, амебіоз, балантидіоз) специфічна імунна відповідь формується дуже слабко
або й зовсім не виявляється.
Специфічна гуморальна імунна відповідь для кожного збудника формується зі своїми
особливостями залежно від антигенної будови збудника, форми існування на певній стадії,
здатності до антигенної мімікрії тощо. Так, при токсоплазмозі інтенсивно виробляються антитіла
класів G та М, які мають певні захисні функції. При лейшманіозі також продукуються специфічні
IgM та IgG, але вони не перешкоджають розмноженню лейшманій і не впливають на розвиток
хвороби. Це зумовлено переважно внутрішньоклітинним (внутрішньофагоцитарним і
внутрішньоендотеліальним) розвитком лейшманій. Слід зазначити, що лейшманії мають спільні
антигени з мікобактеріями і трипаносомами, що ускладнює серологічне їх диференціювання.
Важливим є процес формування специфічної стійкості до плазмодіїв. При малярії утворюються
специфічні антитіла, але у зв'язку зі зміною стадій розвитку паразита в кожному випадку утворені
раніше антитіла до попередніх стадій розвитку плазмодіїв малоефективні до наступних стадій і
лише після утворення антитіл до всіх стадій розвитку плазмодіїв формується протективний захист.
Тому ефективний протективний імунітет під час малярії формується лише у людей, які тривалий час
проживають у цій місцевості, після кількох реінфекцій. При малярії IgG позбавляють здатності
активних форм плазмодіїв проникати в еритроцити та сприяють розпізнаванню і фагоцитозу
спорозоїтів, вільних мерозоїтів, інвазованих еритроцитів. Масове руйнування еритроцитів і поява
великої кількості змінених власних еритроцитарних антигенних структур при малярії сприяє
утворенню великої кількості аутоантитіл.
Для більшості протозойних захворювань вирішальну роль у захисних реакціях організму відіграють
клітинні фактори імунної відповіді. Специфічна імунна відповідь при протозойних захворюваннях
характеризується сенсибілізацією організму, що зумовлює формування алергічних реакцій, та
появою активованих клітин імунної системи, продукуванням ними БАР з різною активністю.
Основними ефекторними клітинами імунної відповіді є цитотоксичні Т-лімфоцити – CD8 і CD4 —
та клітини з АЗКЦ як результат специфічної імунної гуморальної відповіді. У здійсненні
ефекторних реакцій важливу роль відіграють цитокіни, які виділяються Т-хелперами,
цитотоксичними Т-лімфоцитами, макрофагами та іншими клітинами під час їхньої активації і здатні
самі здійснювати кілерні ефекти (ФНП-α і β) або брати активну участь у регуляції (ІФНи,
інтерлейкіни 1, 2, 12, КСФ та ін.).
Про важливу роль клітинної ланки у захисті проти більшості протозойних захворювань свідчать
дані про здатність Т-клітин від імунних тварин захищати здорові тварини від збудників ряду
протозойних захворювань (трипаносоми, плазмодії), а також дані про нездатність мишей з
дефектами Т-клітинної ланки протистояти деяким непатогенним видам трипаносом і плазмодіїв, які
у нормальних мишей не спричинюють інфекцій з летальними наслідками.
Роль окремих субпопуляцій Т-лімфоцитів у захисних реакціях різна і залежить від багатьох
факторів — виду паразита, місцезнаходження, стадії його розвитку. Так, малярійний плазмодій
паразитує в еритроцитах і в клітинах печінки. Еритроцити і гепатоцити різняться за експресією
антигенів МНС — еритроцити експресують антигени МНС класу II, а гепатоцити — класу І. У свою
чергу, CD4 розпізнають лише антигени МНС класу II, а CD8 — класу І. Отже, при взаємодії з
інфікованими еритроцитами тільки CD4, а при взаємодії з інфікованими гепатоцитами тільки CD8
будуть активуватися і продукувати ІФН-γ. Останній інгібує розмноження паразитів і руйнує
інфіковані гепатоцити.
Хронічні протозойні захворювання часто супроводжуються імуносупресією зі значним зниженням
продукування ІФН-γ.
Участь у захисних реакціях Тх1 або Тх2 зумовлюється антигенною структурою збудників та їх
місцезнаходженням. Так, після ураження гепатоцитів плазмодіями активується Тх1, внаслідок чого
зменшується кількість паразитів завдяки виділенню ІФН-γ. Введення антитіл до ІФН-γ стійким
проти малярії мишам спричинює виникнення захворювання після їх інфікування плазмодіями.
Водночас Тх2 індукують утворення антитіл, беруть активну участь у руйнуванні інфікованих
плазмодіями еритроцитів у селезінці за механізмом АЗКЦ.
Роль окремих цитокінів у протипротозойному захисті може бути позитивною і негативною. Так,
ІФН-γ і ФНП-α активують внутрішньоклітинну мікробоцидність фагоцитів, тому відбувається
швидке їх знищення (лейшманії, трипаносоми, токсоплазми, деякі стадії плазмодіїв). ІЛ-12
стимулює проліферацію Тх1 – основного продуцента ІФН-γ і, як наслідок, патоген знешкоджується.
ІФН-γ та ІЛ-1, які секретуються макрофагами, підвищують стійкість гепатоцитів до малярійного
паразита. Слід зазначити, що ІЛ-4, ІЛ-10, ТФР-β гальмують активацію макрофагів, нейтралізують
активувальну дію ІФН-γ, знижують проліферацію Тх1, сприяють виживанню патогену і
ускладненню перебігу інфекційного процесу. Після введення ІЛ-3 інфікованим лейшманіями мишам
спостерігається загострення і розширення процесу.
У перехворілих на деякі протозойні захворювання (трипаносомоз, кокцидіоз) переважно формується
нестерильний малонапружений імунітет. Стійкий імунітет (здебільшого не стерильний) виникає
лише після лейшманіозу та малярії у місцевих жителів. При лейшманіозі протективний імунітет
зумовлюється в основному клітинними факторами, оскільки введення специфічних антитіл від
інфікованих лейшманіями тваринам не захищає їх, а перенесення Т-лімфоцитів від імунних тварин,
навпаки, їх захищає. Під час малярії протективний імунітет спричинюється гуморальними й
клітинними факторами і є суворо типовидовим та штамоспецифічним.
Механізм уникнення дії захисних сил організму. В процесі еволюційного розвитку у паразитів
сформувалася система уникнення дії захисних сил макроорганізму. Одним із основних факторів
захисту від специфічних антитіл є здатність найпростіших існувати всередині макрофагів завдяки
наявності систем захисту від дії цитодидних систем фагоцитів. Так, лейшманії в макрофагах оточені
електронно-щільним матеріалом, який захищає від дії цитоцидних факторів. Вони також здатні
проникати в клітини через рецептор до CR1, тобто уникати дихального вибуху, зменшувати
експресію антигенів МНС класу ІІ на поверхні макрофагів, отже, гальмувати здатність макрофагів
активувати Тх2. Лейшманій, локалізованих усередині фагоцитів, від дії метаболітів кисню
захищають фосфогліканова оболонка, яка є пасткою для метаболітів кисню, та супероксиддисмутаза
і глікопротеїн фосфогліканової оболонки Gp64, які розміщені на поверхні патогенів і нейтралізують
кисневі метаболіти. Токсоплазми здатні зумовлювати модифікацію фагосом і таким чином
пригнічувати злиття їх з лізосомами, а патогенні трипаносоми звільняються з фагосом у цитоплазму
ще до злиття їх з лізосомами. При малярії в макрофагах накопичується пігмент гемозоїн — продукт
розщеплення гемоглобіну, який може пригнічувати функціональну активність фагоцитів. Слід
зазначити, що ІФН-γ, ФНП-α та інші цитокіни здатні активувати синтез макрофагами цитоцидних
факторів, які знешкоджують внутрішньоклітинні патогени.
Деякі найпростіші (плазмодії, лейшманії, трипаносоми) вивільнюють у навколишнє середовище
антигени, які можуть блокувати специфічні антитіла і не допускати їх до патогенів. При
лейшманіозах спостерігається пригнічення активності Т-лімфоцитів, унаслідок чого вони не здатні
під час активації специфічними антигенами продукувати ІЛ-2 та ІФН-γ. У них знижені
продукування ІЛ-2 та експресія антигенів МНС II, тоді як секреція простагландинів (супресорні
фактори) підвищена. При малярії і трипаносомозах спостерігається гальмування секреції ІЛ-2 Тх1.
Важливим фактором маскування найпростіших є часта зміна поверхневих антигенних структур, що
зумовлюється існуванням різних стадій дозрівання. Це характерно для трипаносом і збудників
малярії. Тому наявність при цих захворюваннях повторних нападів спостерігається аж до повного
вироблення специфічної імунної відповіді до всіх стадій розвитку паразита.
Окремі представники найпростіших здатні захищатися від комплементзалежного лізису різними
факторами. Так, деякі види лейшманій на своїй поверхні мають ліпофосфогліканові структури, які
активують комплемент, але в процесі активації його ці структури вивільняються з клітин і патогени
уникають лізису. Ряд трипаносом мають на своїй поверхні глікопротеїн, здатний прискорювати
дисоціацію С3-конвертази і протидіяти активації комплементу.
Модифікація найпростішими імунної відповіді. Багато інфекцій, спричинених найпростішими,
супроводжуються модифікацією імунної відповіді з супресією різних її ланок. Так, при
трипаносомозах рівень ефективності гуморальної і клітинної імунної відповіді становить 5 — 10 %
норми; при цьому спостерігається висока активність супресорів. Збудники лейшманіозів
пригнічують тимуснезалежну гуморальну імунну відповідь на будь-які антигени, а збудники
малярії, вісцерального лейшманіозу, трипаносомозу здатні поліклонально активувати В-клітини.
При цьому можуть масово продукуватися неспецифічні імуноґлобуліни, особливо IgE, які можуть
зв'язувати відповідні рецептори, блокувати їх і перешкоджати приєднанню специфічних антитіл, що
призводить до гальмування ряду специфічних реакцій та формування алергічних реакцій.
Індукування вторинних імунодефіцитів під час деяких протозойних інфекцій може різко
підвищувати тяжкість і летальність бактеріальних, вірусних чи інших інфекцій. Однією з причин
такого стану є виділення багатьма паразитами імуносупресорних речовин, які можуть гальмувати
активність регуляторних та ефекторних клітин і одночасно активувати супресорні клітини, що
пригнічує імунні реакції як на антигени найпростіших, так і на будь-які інші антигени. Так, вірус
Епштейн-Барр у 90 % людей зумовлює доброякісний перебіг інфекційного мононуклеозу, а на фоні
інфікування плазмодіями цей вірус переважно стимулює розвиток лімфоми Беркіта. При
імуносупресіях, спричинених протозойними інфекціями, відбувається значне зниження
ефективності вакцинації, особливо у дітей. Так, низький рівень поствакцинального імунітету
спостерігається у дорослих і дітей, які хворіли на малярію або трипаносомоз, а після виліковування
формується нормальна імунна відповідь на вакцинацію.
Слід зазначити, що антигенна мінливість багатьох найпростіших, що паразитують упродовж їхнього
існування, наявність окремих стадій розвитку з набором специфічних для них антигенів та
превалювання клітинних механізмів імунної відповіді ускладнює створення ефективних вакцин
проти збудників протозойних захворювань.
15.5. АНТИҐЕЛЬМІНТНИЙ ІМУНІТЕТ.
Роль факторів природної резистентності при гельмінтозах. Способи проникнення, міграція та
місця існування гельмінтів в організмі неоднакові. Значна частина їх проникає аліментарним
шляхом (яйцями) — збудники аскаридозу, трихуріозу, після укусів комах — збудники філяріатозу,
онхоцеркозу, крізь шкіру — збудники анкілостомозу, церкарії шистосом та ін. Вони певний час
можуть існувати в крові, кишках, легенях, лімфатичній системі, підшкірній тканині, м'язах, нервовій
системі. Гельмінтози переважно виникають в осіб із певними вадами імунної системи, в разі
неповноцінного харчування та наявності хронічних захворювань. Деякі особини мають природжену
резистентність організму до інвазії гельмінтами. Вона виявляється у швидкій інкапсуляції та
руйнуванні личинок після їх проникнення і може бути зумовлена особливістю будови й
функціонування слизових покривів і шкіри, наявністю активних протигельмінтних неспецифічних
факторів у крові й тканинах, певними фізіологічними особливостями організму.
Для гельмінтів характерна наявність стійкості до природних і специфічних факторів захисту. Ця
стійкість характеризується значними розмірами патогенів, наявністю покривів, великої кількості
антигенів, стадійністю розвитку, здатністю змінювати свій антигенний склад упродовж свого життя
і включати до складу своєї поверхні антигени хазяїна або подібні до них речовини, наявністю
спільних антигенів, особливими властивостями деяких антигенів гельмінтів тощо. Важливу роль у
захисних реакціях проти гельмінтів відіграють слизові оболонки. Келихоподібні епітеліальні
клітини постійно виділяють слиз, який містить низку глікопротеїдів і цитотоксичних речовин.
Клітини імунної системи, що містяться в субепітеліальній ділянці слизових, постійно виділяють
фактори захисту — цитокіни, компоненти комплементу та неспецифічні антитіла, здатні блокувати
рецептори паразита, що відповідають за прикріплення гельмінтів. На поверхню слизових оболонок
постійно мігрують макрофаги, нейтрофіли, еозинофіли, мастоцити, кількість яких різко зростає при
гельмінтозах. Ці клітини беруть участь у знешкодженні паразитів. Дія цих факторів та постійний
рух слизу сприяє швидкій евакуації гельмінтів. У перші чотири години від ефективності дії цих
факторів залежить подальший розвиток інвазійного процесу — чи патоген буде знешкоджено, чи
він успішно переборе природні захисні сили і колонізує макроорганізм, що призведе до виникнення
патологічного процесу.
Фагоцити поглинають невеликі об'єкти і знешкоджують їх. У разі проникнення великих гельмінтів
фагоцити можуть включатися в груповий фагоцитоз або здійснювати позаклітинний фагоцитоз.
Активовані макрофаги беруть активну участь у руйнуванні трихінел, шистосом, філярій. Значна
роль макрофагів у знешкодженні гельмінтів зумовлюється як поглинальною активністю, так і
здатністю продукувати ФНП, синтез якого індукується певними антигенами гельмінтів, а також
ІФН-γ, що синтезується НК, та лімфоцитами. Крім прямої дії на гельмінти ФНП стимулює
макрофаги, еозинофіли, тромбоцити для їх знешкодження. Про важливу роль макрофагів, що
містяться в підшкірному шарі, свідчать дані про значне підсилення сприйнятливості мишей до
шистосом у разі експериментального видалення макрофагів, ПМЯЛ та еозинофілів зі шкіри. ПМЯЛ
беруть активну участь у знешкодженні гельмінтів у місцях їх проникнення та існування внаслідок
виділення в навколишнє середовище кисневозалежних та кисневонезалежних факторів, а під час їх
руйнування — комплексу цитоцидних речовин із внутрішньоклітинних гранул лейкоцитів. Крім
того, вони можуть ефективно брати участь в антитілозалежних цитотоксичних реакціях, особливо
для знешкодження шистосом і трихінел. Еозинофіли порівняно з макрофагами й нейтрофілами
мають значно меншу поглинальну активність, але вони здатні швидко дегранулюватися під час
контакту з паразитами (особливо за наявності ФНП-α, ГМ-КСФ) і виділяти значну кількість
цитоцидних речовин, у тому числі головного основного білка еозинофілів — високоефективного
цитоцидного фактора і відіграють важливу роль у знешкодженні багатьох гельмінтів, передусім
шистосом і трихінел.
Деякі поверхневі структури паразитів здатні активувати комплемент за альтернативним шляхом з
утворенням лізуючого комплексу, опсонінів і хемотаксичних факторів. Останні подають сигнали
фагоцитам та іншим клітинам імунної системи Для їх міграції у місця появи патогенів виникає
запальний процес і формується специфічна імунна відповідь.
Формування адаптивної імунної відповіді. Гельмінти можуть індукувати гуморальну і клітинну
специфічну імунну відповідь залежно від запуску диференціювання Тх0 в Тх1 або Тх2. Вибір
запуску диференціювання і проліферації Тх1 або Тх2 та запуску відповідних реакцій залежить від
антигенної будови гельмінта, його здатності індукувати синтез тих чи інших цитокінів та його
місцезнаходження, а також від генотипу хазяїна, активності його антигенпрезентувальних клітин і
костимулювальних молекул у місці взаємодії антигену з Тх0-клітинами. Так, гельмінти, які певний
час знаходяться в крові, в міжклітинному просторі або на слизових оболонках, індукують
переважно гуморальну імунну відповідь, тоді як гельмінти, для яких характерне
внутрішньоклітинне або ізольоване міжклітинне існування, індукують клітинні фактори захисту.
Однак здебільшого найефективнішою є спільна дія гуморальних і клітинних специфічних факторів
захисту. Про важливу роль Т-клітин у звільненні організму від деяких гельмінтів свідчить ряд
експериментальних даних. Наприклад, щури з дефектом Т-клітин не звільняються від нематод
упродовж тривалого часу, тоді як нормально розвинені щури звільняються від них у перші 13 діб.
Однією з особливостей гельмінтів є їхня здатність ініціювати імунну відповідь за гуморальним
типом — запускати диференціювання Тх0 в Тх2. Активовані Тх2 продукують ряд цитокінів, які
беруть участь у формуванні та реалізації багатьох ланок захисних реакцій організму. Слід
зазначити, що при різних гельмінтозах спостерігається неоднакова роль Тх2 у формуванні захисних
реакцій, що зумовлено різними біологічними властивостями й активностями антигенів паразитів.
Так, за наявності великої кількості Тх2 при шистосоматозах та ехінококозі спостерігається тяжкий
перебіг захворювання, тоді як за такого самого рівня Тх2 при трихінельозі та гіменолепідозі
відбувається активне звільнення від паразитів.
Роль антитіл у захисті проти гельмінтів. На ранніх стадіях гельмінтозів формується
сенсибілізація до антигенів паразита та запускається синтез специфічних імуноґлобулінів —
насамперед IgE та IgG4, які активно фіксуються на мембрані мастоцитів і еозинофілів. У процесі
розвитку гельмінтів синтезуються також IgM та деякі ізотипи IgG, особливо при аскаридозах,
шистосоматозах, цестодозах, філаріозах.
Характерним для гельмінтозів є масивний синтез IgE. Переключенню синтезу імуноглобулінів на
IgE сприяє ІЛ-4, а надлишок цього цитокіну сприяє виробленню великої кількості IgE, що зумовлює
формування алергічних реакцій. Основними продуцентами IgE є плазматичні клітини, локалізовані
у лімфоідній тканині слизових оболонок травного каналу і дихальних шляхів.
У міру накопичення IgE він фіксується на мастоцитах і базофілах за допомогою високоафінних
FcεRI, які через IgE взаємодіють з антигенами гельмінтів, що зумовлює дегрануляцію цих клітин.
Деґрануляція мастоцитів і базофілів відбувається внаслідок перехресного зв'язування двох і більше
сусідніх молекул IgE, зв'язаних з FcεRI, і супроводжується виходом з клітин біологічно активних
речовин — активних учасників алергічних реакцій і розвитку запалення (гістаміну, серотоніну,
брадикініну, хемотаксичних факторів, у тому числі еозинофільного хемотаксичного анафілаксину,
цитокінів ІЛ-3, ІЛ-4, ІЛ-5, фактора агрегації тромбоцитів, простагландинів, лейкотрієнів).
До комплексу IgE — гельмінт — мастоцит можуть приєднуватися IgM і IgG, що супроводжується
активацією комплементу, внаслідок чого відбувається лізис патогену та утворення хемотаксичних
факторів (С5а, С3а). Ці фактори індукують міграцію клітин імунної системи і тромбоцитів у місця
знаходження патогену. Клітини, що мігрують, формують навколо гельмінта інфільтрат, основним
компонентом якого є еозинофіли. Крім того, IgG та IgM самі фіксуються на гельмінтах та їхніх
яйцях і запускають активацію системи комплементу, значно збільшуючи надходження клітин
імунної системи. Отже, IgE при гельмінтозах сприяє формуванню як протективної імунної відповіді,
так і алергічних реакцій.
Клітинні фактори захисту організму. Важливою, а під час деяких гельмінтозів і головною ланкою
захисту організму, є клітинна цитотоксична активність яка здійснюється активованими в процесі
контакту зі збудниками макрофагами ПМЯЛ, еозинофілами, тромбоцитами, НК, мастоцитами,
цитотоксичними Т-клітинами слизових оболонок.
У знешкодженні гельмінтів бере участь АЗКЦ, переважно зумовлена комплексом еозинофіл—
антитіло. Майже для всіх гельмінтозів характерна еозинофілія — кількість еозинофілів
збільшується до 10 тис в 1 мл за норми — 150 — 300 і супроводжується, як правило, ознаками
алергії — кропив'янкою, набряком Квінке, пропасницею еозинофільними інфільтратами.
Еозинофіли мають рецептори до IgE (FсεRІІ), зв'язуючись з якими IgE сприяють фіксації
еозинофілів на паразитах. Еозинофіли мають також рецептори і до IgA (FcαRII), які також
відіграють певну роль в АЗКЦ.
При гельмінтозах еозинофіли відіграють основну роль як в антитіло-, так і в комплементзалежних
цитотоксичних реакціях. На гельмінтах ефективно відбувається активація комплементу
альтернативним шляхом. Цитотоксична дія комплементу щодо гельмінтів може відбуватися двома
способами — утворенням мембраноатакуючого комплексу або активацією компонентом С3b
відповідного рецептора еозинофілів. Активація еозинофілів може бути зумовлена і комплексом
антиген — IgG через відповідний рецептор. У результаті активації еозинофіли вивільнюють у
навколишнє середовище вміст гранул — головний основний білок еозинофілів, катіонні білки,
пероксидазу, катепсини та інші біологічно активні речовини, які чинять пряму токсичну дію на
паразитів, або активують цитотоксичну активність іншими способами.
Ефективно знешкоджують молоді личинки трематод комплекси еозинофіл — антитіла IgE до
поверхневих антигенів личинок Schistosoma manconi, тоді як дорослі трематоди стійкі до
спричиненої цим комплексом цитотоксичності, що пов'язано з наявністю в них неімуногенних або
малоімуногенних структур.
Значну роль у протиґельмінтних захисних реакціях відіграють базофіли. Вони мають низькоафінні
рецептори до IgE (FсεRІІ), які здатні приєднувати IgE, що зумовлює за наявності специфічного
антигену їх активацію і викид низки біологічно активних речовин. Унаслідок цього відбуваються
певні неспецифічні протективні реакції (підвищення рухливості кишкової стінки, збільшення
продукування слизу келихоподібними епітеліальними клітинами слизових оболонок, злущування
епітелію, підвищення проникності капілярів і притоку цитоцидних речовин тощо), що прискорює
евакуацію гельмінтів.
У знешкодженні гельмінтів беруть участь тромбоцити, виявляючи цитотоксичну дію щодо
трематод, особливо за наявності ІФН і ФНП. Вважають, що при шистосоматозах щурів
цитотоксична активність тромбоцитів виявляється ще до появи специфічних антитіл, але лише за
наявності в крові білків гострої фази. Завдяки наявності на тромбоцитах поверхневих
низькоафінних рецепторів до IgE (FcεRII) вони беруть активну участь в АЗКЦ. Деякі цитокіни, такі

65
як ФНП-α, ІФН-γ, особливо за сумісної їх дії, здатні активувати тромбоцити, а також інші клітини –
макрофаги й еозинофіли та знешкоджувати збудників шистосоматозу.
При кишкових формах гельмінтозів важливу роль відіграють Тх2, які у відповідь на дію
паразитарних антигенів продукують низку цитокінів, що індукують проліферацію В-клітин і синтез
ними антитіл (ІЛ-4, ІЛ-5), проліферацію мастоцитів слизових оболонок (ІЛ-3, ІЛ-4, ІЛ-9, ІЛ-10),
гіперплазію келихоподібних клітин та підвищене продукування ними слизу. Ураження гельмінтів у
кишках відбувається специфічними антитілами, продуктами дегрануляції сенсибілізованих IgE
мастоцитів, антитілозалежною цитотоксичністю еозинофілів, макрофагів, нейтрофілів. Продукти
дегрануляції мастоцитів можуть зумовити цитотоксичний ефект, підвищувати проникність
кровоносних судин, мати хемотаксичну активність, прискорювати скорочення гладких м'язів,
підсилювати виділення слизу келихоподібними клітинами, спричинювати злущування клітин
епітелію. Взаємодія цих факторів сприяє швидкій евакуації з кишок аскарид і трематод.
Показано також, що цитокіни у деяких випадках можуть сприяти розвитку гельмінтів. Так, ФНП-α
стимулює відкладання яєць статевозрілими шистосомами, а ІФН-γ стимулює ріст трихінел.
Індукування гельмінтами алергічних реакцій. Гельмінтози супроводжуються виникненням
алергічних реакцій всіх чотирьох типів та аутоімунних процесів. Алергічні реакції виконують
переважно патогенетичну роль, але в деяких випадках здійснюють захист — за повторних інвазій
прискорюється евакуація гельмінтів, виникають перешкоди для міграції личинок з наступною їх
інактивацією. Алергенами є функціональні та соматичні антигени паразитів, до яких виробляються
гомоцитотропні антитіла, здебільшого класів IgE, IgG та IgA. Ці антитіла здатні фіксуватися на
поверхні клітин хазяїна і запускати алергічні реакції. Ушкодження тканин імунного характеру
можуть індукуватися всіма чотирма типами гіперчутливості. Гіперчутливість негайного типу
виникає при гострому шистосоматозі, філяріатозному лімфангоїті, трихінельозному міозиті,
аскаридозній легеневій патології. Алергічні реакції другого типу — комплемент- і антитілозалежні
цитолітичні реакції зумовлюють гемоліз еритроцитів при шистосоматозах. Реакції третього типу
імунокомплексної етіології індукуються трихінелами, філяріями. Гіперчутливість сповільненого
типу виникає при токсоплазмозі, трихінельозі, трипаносомозах, філяріатозах.
Індукування гельмінтами гранульом. Однією з важливих захисних реакцій організму є утворення
і функціонування гранульом. У разі нездатності захисних сил організму знешкодити локалізовані в
певних тканинах або органах гельмінти, які постійно виділяють фактори, що індукують виникнення
запального процесу з утворенням різних цитокінів, індукується процес ізоляції збудника і
формування гранульом. Активовані макрофаги стимулюють утворення гранульом, що має як
позитивне (ізоляція патогену), так і негативне (втрата частини функціонально активних клітин)
значення. Слід зазначити, що за дефіциту Т-клітин гранульоми не утворюються.
Механізми уникнення дії захисних сил організму гельмінтами. У процесі еволюційного
розвитку в гельмінтів сформувалися різні механізми обходу природних і специфічних факторів
захисту організму, щоб забезпечити своє існування. Одним із таких важливих факторів є великі
розміри гельмінтів та значна кількість у них поверхневих антигенів. Більшість дорослих трематод
містять поверхневі неімуногенні або малоімуногенні структури і стійкі проти антитілозалежної
цитотоксичної дії комплексів IgE — еозинофіл. Для деяких гельмінтів характерне формування
захисту поверхневих антигенів шаром еритроцитарного глікопротеїну, молекул МНС та IgG хазяїна.
Для аскарид характерне формування міцної кутикули та наявність антигенної мімікрії — поверхневі
антигени перехресне реагують із колагеном людини, що зумовлює нерозпізнавання захисними
факторами антигенів паразита. На інвазійних личинках Т. spirallis експресуються антигени з
детермінантами 33 кД до C1q-рецептора, які зв'язують C1q на епітеліальних клітинах тонкої кишки,
що сприяє проникненню личинок.
Деякі гельмінти здатні виробляти антигени, подібні до А- і В-проаглютиногенів крові, тобто
сприяти маскуванню паразитів від захисних сил організму. Уникнути дії захисних сил організму
гельмінтам допомагають часта зміна і низька імуногенність поверхневих антигенів та включення до
складу поверхневих антигенів молекул хазяїна фібронектину, гліколіпідів зі специфічністю
антигенів групи крові АВ0, ряду глікопротеїнів, що кодуються генами МНС, специфічних і
неспецифічних імуноглобулінів. Певну роль у захисті від імунної системи організму відіграє
злущування антитіл з поверхні гельмінтів.
Імуномодулювальні активності гельмінтів. Деякі паразитарні інвазії супроводжуються
імуносупресією різних ланок природної та адаптивної імунної відповіді, яка може бути зумовлена, з
одного боку, продукуванням гельмінтами різних імуносупресивних речовин, з другого, —
iндукуванням синтезу і виділенням клітинами імунної системи факторів, що інгібують певні ланки
захисних реакцій. Так T.hepatica виділяють цинковмісні цистеїнпротеїнази, які блокують
антитілозалежне прикріплення еозинофілів до личинок гельмінтів, а личинки Onchocerca volvulus,
A. galli та інші секретують глутатіон-С-трансферазу, що здатна гальмувати активацію Тх0, і при
цьому спостерігається тяжкий перебіг захворювання. Збудники шистосоматозу виробляють
низькомолекулярний інгібітор, який гальмує дегрануляцію мастоцитів і проліферацію Т-клітин, та
продукують протеїнази, що пригнічують активацію макрофагів і знижують комплементзалежну
цитотоксичність.
Показано, що при трихінельозі, шистосоматозі, ехінококозі виділяються фактори, що індукують
лімфоцитотоксичний ефект. Встановлено також, що сироватка крові хворих на опісторхоз та
шистосоматоз in vitro пригнічує активність макрофагів. Збудники шистосоматозів пригнічують Т-
залежну імунну відповідь на будь-які антигени, в тому числі й паразитарні. Збудники ехінококозу
здатні поліклонально активувати В-клітини. При цьому можуть масово продукуватися неспецифічні
імуноглобуліни, особливо IgE і IgG4, які зв'язують відповідні рецептори на мастоцитах та не дають
змоги приєднуватися специфічним антитілам і таким чином гальмують специфічні реакції.
Одним із механізмів обходу захисних реакцій організму є здатність гельмінтів індукувати
надлишковий синтез IgG4, оскільки цей імуноґлобулін не має своїх рецепторів на еозинофілах, але
може приєднуватися до FcRII і блокувати приєднання специфічного IgE, що зумовлює гальмування
дегрануляції еозинофілів і активації комплементу альтернативним шляхом.
На фоні розвитку інвазії гельмінтів різко підвищується тяжкість і летальність багатьох
бактеріальних і вірусних інфекцій. Так, при кишкових гельмінтозах у 2 – 5 разів частіше виникають
гострі кишкові захворювання бактеріальної і вірусної природи. При опісторхозах у 4 рази частіше
виявляється цукровий діабет, частіше реєструється рак печінки і підшлункової залози. Алергізація
паразитарними антигенами ускладнює перебіг алергодерматозів і бронхіальної астми.
Наслідком гельмінтозних захворювань є значне зниження ефективності вакцинації, особливо у
дітей. Так, при вакцинації дітей і дорослих, які хворіли на онхоциркоз спостерігався низький рівень
формування імунітету. Попередня дегельмінтизація тварин сприяє формуванню нормальної імунної
відповіді при вакцинації.
При гельмінтозах у багатьох випадках виявляють антитіла проти еритроцитів, лімфоцитів, ДНК.
Наявність перехресних антигенів у гельмінтів і в тканинах хазяїна може бути причиною виникнення
аутоімунних патологічних процесів. Надлишкове продукування цитокінів, що індукуються при
гельмінтозах, також може спричинювати виникнення деяких патологій (гарячка, анемія, діарея,
зміни в легенях), які зумовлюються переважно гіперпродукуванням ФНП-α.
ВИСНОВКИ.
Механізми формування захисних реакцій проти патогенів різних груп мають свої особливості. При
вірусних інфекціях на ранніх стадіях проникненню збудника в організм та поширенню в ньому
протидіють фактори природної резистентності, насамперед інтерферони та природні кілери.
Утворені в процесі імунної відповіді антитіла нейтралізують інфекційність вірусів, перешкоджаючи
інфікуванню нових клітин, тоді як генеровані ЦТЛ здатні руйнувати інфіковані клітини на ранній
стадії репродукції вірусу, запобігаючи тим самим утворенню нових вірусних частинок. Звільнені зі
зруйнованих клітин (сформовані) віруси знешкоджуються під впливом нейтралізуючих антитіл.
Важливу роль відіграють антитіла у захисті від повторної інфекції.
При бактеріальних інфекціях серед факторів природної резистентності найефективніші фагоцити,
які знешкоджують більшість бактерій, як грампозитивних, так і грамнегативних, а деякі з останніх
чутливі також до літичної дії комплементу і НК. Антитіла самостійно або разом з комплементом
забезпечують захист від патогенів, сприяючи фагоцитозу їх шляхом опсонізації. Бактерії, що
пристосувалися до внутрішньоклітинного паразитування, можуть знищуватися самими
інфікованими макрофагами після їх активації Тх1 унаслідок продукування цитокінів або
руйнуватися разом з інфікованими клітинами цитотоксичними Т-лімфоцитами.
У протигрибному природному захисті важливу роль відіграє система комплементу (компоненти
іС3b та С3d як опсонізувальні субстанції), а також клітинні фактори (фагоцити, природні кілери, Т-
клітини, В1-лімфоцити, еозинофіли, епітеліальні та ендотеліальні клітини). Імунітет при мікозах
опосередкований переважно клітинами.
Природну стійкість проти паразитарних інфекцій забезпечують різні ефекторні клітини —
макрофаги, нейтрофіли, еозинофіли і тромбоцити, здатні знищувати як найпростіших, так і
гельмінтів за допомогою виділення цитотоксичних речовин (метаболітів кисню, оксиду нітрогену
(II)), і ця здатність посилюється після активації їх цитокінами. У створенні імунітету проти
позаклітинних паразитів провідну роль відіграють антитіла, які самі або в поєднанні з
комплементом значно посилюють цитотоксичну (і фагоцитарну) активність ефекторних клітин. В
евакуації кишкових гельмінтів особливе значення має цитотоксичність, що зумовлена комплексами
еозинофіл – IgE. Захист від внутрішньоклітинних найпростіших пов'язаний з функціонуванням Т-
лімфоцитів популяцій CD4 (Тх1) та CD8 (ЦТЛ).
Контрольні запитання.
1. Назвіть основні фактори патогенності інфекційних агентів – представників різних систематичних
груп.
2. Які основні фактори природного імунітету беруть участь у знешкодженні патогенів?
3. Назвіть етапи і особливості формування протиінфекційного адаптивного імунітету.
4. У захисті від яких інфекційних агентів провідна роль належить клітинному імунітету?
Схарактеризуйте особливості існування цих патогенів та механізми їх елімінації.
5. Назвіть інфекції, при яких провідну роль у захисті організму відіграють антитіла, та обгрунтуйте
механізми їхньої дії.
6. Схарактеризуйте роль клітинних реакцій та антитіл у противірусному імунітеті в різні періоди
його розвитку.
7. Які механізми забезпечують імунітет до бактеріальних інфекцій та інфекцій, спричинюваних
грибами?
8. Які особливості формування імунітету до паразитарних інвазій?
9. Як уникають дії захисних факторів патогени, що локалізуються внутрішньоклітинно, в крові та
міжклітинному просторі?
РОЗДІЛ 16. ПРОТИПУХЛИННИЙ ІМУНІТЕТ.
Онкологічні захворювання є серйозною медико-соціальною проблемою в усьому світі, оскільки
вважаються серед хвороб другою (після серцево-судинних захворювань) причиною смертності
населення земної кулі.
Причиною виникнення злоякісних пухлин є соматичні мутації, що виникають під впливом ендо- та
екзогенних канцерогенів: фізичних, хімічних, біологічних. Ріст злоякісних новоутворень
визначається проліферативною активністю пухлинних клітин, а також їх здатністю проникати в
здорові тканини й давати метастази у віддалені органи. Крім того, злоякісні пухлини здатні
виходити з-під імунного контролю хазяїна.
Ідея про роль імунної системи в захисті від пухлин була висловлена ще на початку XX ст. П.
Ерліхом, а згодом розвинена ф. Бернетом у створеній ним у 60-х роках теорії імунного нагляду як
основної фізіологічної функції імунної системи. Ця теорія ґрунтується на постулаті про еволюційне
формування системи імунітету для збереження антигенного гомеостазу шляхом елімінації всіх
генетично чужорідних клітин і передусім трансформованих. Згідно з цією теорією, імунна система,
особливо її Т-клітинна ланка, здебільшого знищує пухлини на стадії бластомного зародка, ще до
появи клінічних проявів, однак має велике значення, як припускав автор, також для затримання
росту пухлин, що розвиваються, і для регресії вже розвинених пухлин.
Для підтвердження ролі імунної системи в захисті від пухлин наводилися факти клінічних та
експериментальних спостережень:
зародки пухлин в органах і тканинах виявляються при патолого-гістологічних дослідженнях у
десятки разів частіше, ніж клінічно визначувані пухлини. Досить часто пухлини, що не
метастазують, інфільтруються лімфоцитами, а лімфатичні вузли, які дренують ділянку їх росту,
зазнають гіперплазії аналогічно тим, що відповідають на антигенне подразнення;
можлива спонтанна регресія пухлин, яка частіше реєструється щодо більш імуногенних пухлин;
злоякісні пухлини частіше виникають у ранньому дитячому віці, коли імунна система ще повністю
не сформувалася, і в похилому віці, коли вона вже ослаблена;
пухлини часто розвиваються в осіб з природженою та індукованою імуносупресією. Пригнічення
імунної реактивності в експериментальних тварин збільшує частоту виникнення пухлин і
прискорює їх ріст.
Асоціація імуносупресії з підвищеною частотою онкозахворювань є основним положенням теорії
імунного нагляду. Воно ґрунтується на результатах спостережень над двома групами хворих з
імуносупресією — реципієнтами чужорідних органів та хворими з природженими імунодефіцитами,
в яких значно підвищена частота виникнення злоякісних пухлин. Проте результати експериментів
на імуносупресованих тваринах показали, що роль імунного нагляду може бути різною при різних
типах пухлин, що підтвердилося також під час аналізу типів пухлин у пацієнтів з тривалою
імуносупресією.
Слід зазначити, що взаємозв'язки між імунною системою і пухлиною та результуючий ефект
визначаються багатьма факторами. Імунна відповідь при злоякісному рості та формування імунітету
до пухлин мають свої особливості.
Створення імунітету, а отже, і ефективність імунного нагляду залежатиме, з одного боку, від того,
чи експресує пухлина чужорідні антигени, що здатні індукувати імунну відповідь з утворенням
ефекторних факторів, а з другого — визначатиметься тим, наскільки ця пухлина чутлива до
цитотоксичної дії цих факторів і чи спроможна вона їх уникати.
Деякі характеристики антигенів пухлин та імунної відповіді на пухлини є фундаментальними для
розуміння протипухлинного імунітету та розвитку стратегій протипухлинної терапії.
Пухлини експресують антигени, що розпізнаються імунною системою носія як чужорідні.
Клінічними дослідженнями та дослідами на тваринах доведено, що хоча пухлинні клітини походять
від клітин хазяїна, пухлини можуть індукувати імунну відповідь.
Перші докази того, що пухлини можуть індукувати розвиток протективної імунної відповіді,
отримано в експериментах з трансплантації пухлин. У мишей за допомогою втирання в шкіру
канцерогену метилхолантрену (MXА) було індуковано розвиток саркоми. Якщо таку МХА-
індуковану пухлину видалити і трансплантувати іншій сингенній тварині, така пухлина
ростиме далі. І навпаки, якщо пухлину ретрансплантувати первинному хазяїну, відбувається її
відторгнення. Тварина стає імунною до цієї пухлини, але не здатна до відторгнення МХА-
індукованих пухлин інших носіїв. Більше того Т-клітини, узяті від тварин, що мали пухлини,
можуть переносити протективний імунітет до пухлини іншим безпухлинним тваринам. Такі
відповіді на пухлини мають ознаки адаптивної імунної відповіді специфічності та пам'яті й
опосередковані лімфоцитами.
Імунна відповідь часто не перешкоджає росту пухлин.
Існує кілька причин, чому протипухлинний імунітет недостатній для елімінації трансформованих
клітин. По-перше, пухлинні клітини багато в чому нагадують нормальні клітини. Більшість пухлин
експресують лише незначну кількість антигенів, що можуть бути розпізнані як «не свої», і, як
наслідок, більшість пухлин є слабкоімуногенними. Пухлини, що індукують сильну імунну
відповідь, експресують чужорідні антигени чи мутовані форми власних білків. Розвиток таких
пухлин індукується онкогенними вірусами, в яких вірусні білки є чужорідними антигенами, а також
канцерогенами, які часто спричинюють мутації в нормальних клітинних генах. Багато спонтанних
пухлин індукують слабку імунну відповідь, що, зрозуміло, викликає скептицизм щодо концепції
імунного нагляду. По-друге, швидкий ріст і поширення пухлин можуть значно випереджати
здатність імунної системи знищувати пухлинні клітини, а для контролю пухлини потрібно, щоб усі
пухлинні клітини було еліміновано. По-третє, багато пухлин мають спеціалізовані механізми для
уникнення імунної відповіді.
16.1. АНТИГЕНИ ПУХЛИН.
Пухлинні антигени визначають чужорідність пухлини для організму і є матеріальним субстратом
розвитку імунної відповіді. Пухлинні агенти – основний предмет імунології пухлин. Однак пошуки
пухлинних агентів упродовж тривалого часу не мали успіху, що пояснюється відсутністю
чистолінійних тварин та відповідних методів досліджень. Уперше існування пухлинних агентів
було доведено в 50-х роках ХХ ст. (Пен, Мейн) в експериментах з трансплантації індукованої
метилхолантреном пухлини в інбредних мишей. А на початку 60-х років був ідентифікований
перший пухлинний антиген, що асоціюється з карциномою печінки.
Методи ідентифікації пухлинних антигенів. Згідно з сучасними уявленнями, певну субстанцію
можна назвати пухлинним антигеном, якщо вона продукується пухлинною клітиною і розпізнається
специфічними ефекторними Т-клітинами та/чи антитілами. З урахуванням цього розроблено методи
ідентифікації пухлинних антигенів.
Антигени пухлин, які розпізнаються Т-лімфоцитами, можна виявити ідентифікацією пептидів, які
розпізнаються пухлиноспецифічними ЦТЛ, чи генів, які кодують ці пептиди. В обох випадках
ідентифікацію антигенних пептидів на поверхні клітини проводять за допомогою клонових ліній
ЦТЛ, які отримують з лімфоцитів периферичної крові пацієнта чи з лімфовузлів, що дренують
пухлину, кокультивуючи їх з пухлинними клітинами і стимулюючи ІЛ-2. Зазначимо, що пухлинні
антигени, які розпізнаються ЦТЛ, є невеликими пептидами, що процесуються з клітинних білків і
представляються в комплексі з молекулами МНС І.
Для ідентифікації антигенів пухлин, які розпізнаються Т-лімфоцитами, використовують два підходи
– прямий і непрямий.
Прямий, біохімічний, підхід полягає у виділенні пептидів, зв'язаних з МНС І пухлинних клітин (у
буфері з низьким рН), фракціонуванні суміші їх за допомогою високороздільної рідинної
хроматографії зі зворотною фазою (high-perfoтапсе liquid chromatography-HPLC) з наступним
тестуванням отриманих пептидних фракцій на здатність сенсибілізувати непухлинні клітини з
відповідними МНС І до лізису пухлиноспецифічними клонами ЦТЛ. Пептидні фракції, які
індукували лізис цих клітин ЦТЛ, аналізують за допомогою методу масспектроскопії, визначають їх
амінокислотну послідовність і, порівнюючи її з даними про амінокислотну послідовність відомих
білків, ідентифікують пептид пухлинного антигену.
Основою непрямого, генетичного, підходу ідентифікації пухлинних антигенів є молекулярне
клонування генів, що кодують ці антигени. Він полягає у приготуванні кДНК-бібліотек з клітин
пухлин та молекулярних конструктів генів бібліотеки, які сприяють експресії цих генів при внесенні
в лінії клітин. Пулами ДНК таких бібліотек трансфекують нормальні клітини, ідентичні з
пухлинними за алелями МНС І, і тестують трансфековані клітини на чутливість до лізису
специфічними ЦТЛ. Якщо клітини лізуються ЦТЛ, то це свідчить про те, що привнесені гени
кодують антигенні пептиди, які розпізнаються ЦТЛ.
Унаслідок багатьох таких послідовних трансфекцій, в яких використовують все більш обмежений
набір фракцій пулу ДНК, виділяють окремі гени, які кодують антигени пухлин, і проводять
ідентифікацію їх, порівнюючи з генами відомих антигенів.
Біохімічний і генетичний підходи були успішно застосовані для виявлення антигенів меланоми, які
індукують ЦТЛ-залежну відповідь у хворих з цією пухлиною.
Антитіла, на відміну від Т-клітин, розпізнають пухлинні антигени в нативній конформації
незалежно від молекул МНС, зв'язуючись як з пептидними, так і з непептидними епітопами.
Пухлиноспецифічні антитіла виявляються в сироватці крові онкологічних хворих. З урахуванням
цього розроблено стратегію пошуку пухлинних антигенів, яку назвали SEREX (serological analysis
of recombinant cDNA expression libraries). Технологія SEREX полягає у виділенні з пухлинної
тканини пулу загальної мРНК, створенні з нього фагової ДНК-експресуючої бібліотеки антигенів
пухлини з наступним інфікуванням отриманими фагами Е.соlі. Продуковані бактеріями різні
антигени пухлинних клітин досліджують на реактивність із сироваткою хворого–донора пухлини і
сироватками хворих з подібною патологією на наявність специфічних до пухлинних антигенів
антитіл. За SEREX-технологією було визначено кілька антигенів пухлин, як відомих, так і
невідомих, зокрема карциноми стравоходу і меланоми (Nr-ESO-1, HOM-MEL-40, MAGE-1).
Характеристика антигенів пухлин. На сьогодні ідентифіковано багато антигенів, що
еспресуються в пухлинах різних типів і різняться за походженням та ступенями специфічності для
пухлин. Традиційно антигени пухлин поділяють на дві великі категорії: пухлиноспецифічні
антигени (ПСА) та пухлиноасоційовані антигени (ПАА).
Пухлиноспецифічними називають антигени, що експресуються лише на пухлинних, але не на
нормальних клітинах. Деякі з цих антигенів унікальні для індивідуальних пухлин, а деякі
експресовані також на пухлинах того самого походження. ПСА утворюються в разі опосередкованої
вірусами трансформації клітин або випадкових порушень геному. До ПСА належать антигени,
утворені внаслідок точкових мутацій в онкогенах чи генах-супресорах пухлин, транслокації ДНК
(химерні білки), порушення сплайсингу РНК (аберантні білки), а також ідіотипічні антигенні
детермінанти.
Пухлиноасоційованими називають пухлинні антигени, що експресовані також на нормальних
клітинах. ПАА в основному представлені надмірно експресованими в пухлинах білками нормальних
клітин. До ПАА відносять онкофетальні антигени, антигени певних ліній клітин, вірусні білки,
продукти онкогенів та генів-супресорів.
Сучасна класифікація антигенів пухлин ґрунтується на особливостях їхньої молекулярної
структури. Характеристика пухлинних антигенів на молекулярному рівні дає змогу краще зрозуміти
генетичні процеси, що сприяють їх утворенню. Так, ПСА можуть бути кодовані первинною
відкритою рамкою зчитування певних продуктів генів, які по-іншому експресуються в пухлинах,
ніж у нормальних клітинах, або трансльованими альтернативними рамками зчитування, мутованими
генами, псевдогенами, послідовностями інтронів, антисмисловими послідовностями чи генами, що
утворилися внаслідок транслокацій. Коротко розглянемо основні групи пухлинних антигенів.
Пухлинні антигени, що кодуються геномами онкогенних вірусів. Продукти онкогенних вірусів
виконують роль пухлинних антигенів та індукують специфічні Т-клітинні відповіді. На відміну від
МХА-індукованих пухлинних антигенів, що є продуктами випадково мутованих клітинних генів,
кодовані вірусом антигени не є унікальними для кожної пухлини, а експресуються різними
пухлинами, індукованими одним і тим самим вірусом.
ДНК-вмісні віруси є причиною розвитку різних пухлин у експериментальних тварин і людей. У
більшості індукованих ДНК-вмісними вірусами пухлин кодовані вірусом антигени містяться в ядрі,
цитоплазмі чи плазматичній мембрані пухлинних клітин. Ці ендогенно синтезовані білки можуть
бути процесовані, а комплекси їхніх пептидів з молекулами класу МНС І — експресуватися на
поверхні пухлинних клітин. Оскільки вірусні пептиди є чужорідними антигенами, ДНК-вірус-
індуковані пухлини є найбільш імуногенними.
Здатність адаптивного імунітету запобігати розвитку ДНК-вірусіндукованих пухлин було доведено
в багатьох експериментах та клінічних спостереженнях. Показано, що паповавіруси (в тому числі
поліомавіруси і мавпячий вірус SV40) та аденовіруси індукують розвиток злоякісних пухлин у
неонатальних тварин та дорослих тварин з імунодефіцитом.
У людей асоційовані з герпесвірусом Епштейн-Барр В-клітинні (ВЕБ) лімфоми та асоційовані з
вірусом папіломи людини (HPV) раки шкіри найчастіше виникають у імуносупресованих пацієнтів,
таких як реципієнти алографних трансплантатів та хворі на СНІД.
Імунізація імунокомпетентних тварин вірусом SV40 та аденовірусом сприяє розвитку
протективного імунітету до пухлин, індукованих дією кожного вірусу.
Отже, компетентна імунна система здатна розпізнавати та елімінувати вірусіндуковані пухлинні
клітини. Сильна імунна відповідь проти вірусіндукованих пухлин відображає той факт, що ДНК-
вмісні віруси продукують білки, які є чужорідними для хазяїна і розпізнаються ЦТЛ, фізіологічна
функція яких — захист від вірусної інфекції.
РНК-вмісні віруси (ретровіруси) є однією з основних причин розвитку онкологічних захворювань у
тварин. Продукти ретровірусних онкогенів теоретично мають ті самі потенційні антигенні
властивості, що й мутовані клітинні онкогени. До цих антигенів експериментально спостерігалися
гуморальні та клітиноопосередковані імунні відповіді. Один з добре вивчених РНК-вірусів людини
є Т-клітинний лімфотропний вірус людини (HTLV-1), етіологічний агент Т-клітинного
лейкозу/лімфоми дорослих людей. Незважаючи на те що наявність специфічної до антигенів HTLV-
1 імунної відповіді було виявлено в інфікованих вірусом індивідів, невідомо, чи відіграють вони
будь-яку роль у протективному імунітеті проти розвитку пухлин. Більше того, пацієнти з гострим Т-
клітинним лейкозом дуже часто мають сильну імуносупресію, можливо, через те, що вірус інфікує
СD4-Т-клітини й індукує в них функціональні порушення.
Продукти мутованих онкогенів та генів–супресорів пухлин. Багато пухлинних клітин
експресують гени, продукти яких потрібні для злоякісної трансформації або для підтримання
злоякісного фенотипу. Часто такі гени утворюються внаслідок точкових мутацій, делецій чи
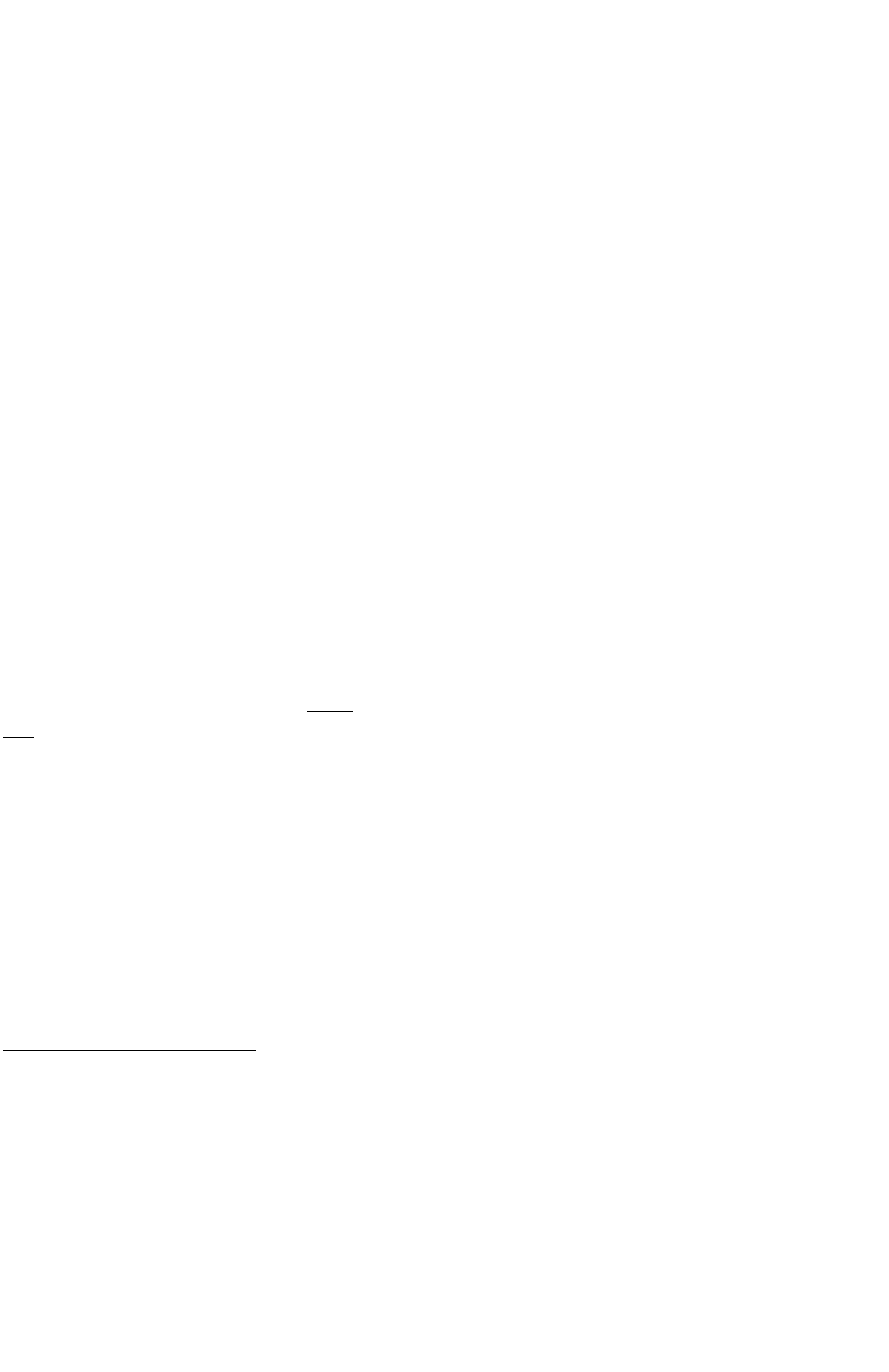
66
хромосомних транслокацій або вставок вірусних генів, що включають клітинні протоонкогени чи
гени-супресори, що в результаті формують онкогени, продукти яких мають трансформівну
активність. Продукти цих змінених протоонкогенів та генів-супресорів пухлин синтезуються в
цитоплазмі пухлинних клітин і подібно до інших цитозольних протеїнів вступають на МНС І-шлях
презентації антигенів. Вони можуть вступати також на МНС ІІ-шлях презентації антигену в
професійних антигенпрезентувальних клітинах (АПК), які фагоцитували мертві пухлинні клітини.
Оскільки ці змінені гени відсутні в нормальних клітинах, вони не індукують толерантність і тому
пептиди, синтез яких вони кодують, можуть стимулювати Т-клітинну відповідь у тварини-хазяїна. У
крові деяких онкологічних хворих виявляються CD4 та CD8 Т-клітини, які можуть відповідати на
продукти мутованих онкогенів, таких як Ras, P53, Всr-Аbl.
Нормальні клітинні білки, що аберантно експресуються. Пухлинні антигени можуть бути
нормальними білками клітин, що гіперекспресуються або аберантно експресуються пухлинними
клітинами.
Одним з таких антигенів є тирозиназа — ензим, що бере участь у біосинтезі меланіну й
експресується лише в нормальних меланоцитах і при меланомі. Як МНС I-рестриктовані CD8 ЦТЛ,
так і МНС II-рестриктовані СD4Т-клітинні клони від пацієнтів з меланомою розпізнають пептиди —
похідні тирозинази. Видається дивним, що у пацієнтів взагалі існує імунна відповідь на нормальні
власні антигени. Можливе пояснення цього полягає в тому, що за нормальних умов тирозиназа
продукується в дуже малій кількості й у незначного відсотка клітин, які не можуть бути розпізнані
імунною системою. Виявлення у пацієнтів специфічної відповіді Т-клітин на тирозиназу відкриває
можливості використання тирозиназних вакцин для стимуляції імунної відповіді на меланому. Нині
такі вакцини проходять клінічні випробування.
Ще одним прикладом гіперекспресії білка на поверхні трансформованих клітин є експресія значної
кількості рецептора для епідермального фактора росту людини HER-2/neu-l, особливо при певних
типах раку яєчника та молочної залози, а також збільшення експресії продукту онкогену Ras, що
виявляється при певних типах раку простати, підшлункової залози.
Інші асоційовані з пухлинами антигени можуть походити від генів, що не експресуються в нормі в
цих тканинах дорослих осіб, однак експресуються в інших тканинах на певних етапах розвитку
організму. Регуляція експресії цих генів змінилася внаслідок злоякісної трансформації клітини.
Проте якщо такі асоційовані з пухлиною антигени експресуються в нормі в імунопривілейованих
тканинах, то вони можуть індукувати розвиток імунної відповіді, оскільки до них немає імунної
толерантності, і вони сприймаються імунною системою як чужорідні. Зрозуміло, що антигени,
експресовані в пухлині і в нормальній іншій тканині, що не належить до імунопривілейованих, не є
імуногенними. Експресовані в пухлині антигени, характерні для інших нормальних тканин,
називають пухлинними нетканиноспецифічними антигенами. Кілька типів пухлинних
нетканиноспецифічних антигенів (MAGE, BAGE, GAGE), а також гени, що їх кодують, були
ідентифіковані при меланомі. Ці антигени розпізнаються специфічними до меланоми клонами ЦТЛ,
які було отримано від різних пацієнтів з меланомою. MAGE — протеїни, крім меланоми
експресуються на карциномах сечового міхура, молочної залози, шкіри, легенів, простати та деяких
саркомах. У нормальних тканинах експресія антигенів меланоми рестриктована за
імунопривілейованими сайтами: MAGE — яєчку і плаценті, BAGE і GAGE — яєчку. Тому спроби
підвищити імунну відповідь за участю ЦТЛ на ці антигени за допомогою вакцин у пацієнтів з
меланомою становлять значний інтерес.
Онкофетальні антигени. Онкофетальні антигени є білками, що у значній кількості експресуються
в пухлинних клітинах і нормальних тканинах, які розвиваються. Вважають, що невдовзі після
народження відбувається репресія генів, які кодують онкофетальні білки. Вони «мовчать» у нормі і
дерепресуються під час злоякісної трансформації. Рівень експресії цих білків зростає в тканинах та у
циркуляції під час різних запальних процесів, їх можна також знайти у невеликій кількості навіть у
нормальних тканинах. Немає доказів того, що онкофетальні антигени є важливими індукторами чи
мішенями для протипухлинного імунітету. Найповніше схарактеризованими онкофетальними
антигенами є раковий ембріональний антиген (PEA) та альфа-фетопротеїн (АФП).
PEA (CD66) — високоглікозильованйй інтегральний мембранний протеїн, що належить до
суперродини імуноглобулінів. Це молекула адгезії, яка допомагає зв'язуванню пухлинних клітин
між собою. У нормі висока експресія PEA характерна для клітин кишок, підшлункової залози й
печінки плоду під час перших двох триместрів вагітності. Невеликий рівень експресії цього білка
спостерігається у дорослих в епітелії товстої кишки та в молочній залозі в період лактації. Експресія
PEA підвищується при більшості карцином товстої кишки, підшлункової залози, шлунка, молочної
залози. У таких хворих підвищений також рівень PEA у крові. Показники рівня PEA в сироватці
крові використовують для моніторингу персистенції чи рецидиву метастатичної карциноми після
лікування. Разом з тим використання PEA як діагностичного маркера для раку лімітована тим
фактом, що сироватковий рівень експресії PEA може бути збільшений при таких захворюваннях
неонкологічної природи, як хронічні запалення жовчного міхура та печінки.
АФП — це циркулюючий глікопротеїн, що в нормі синтезується і секретується під час
ембріонального розвитку в жовтковому міхурі та печінці. Фетальні сироваткові концентрації білка
можуть бути високі (2 – 3 мг/мл), але у дорослих цей білок заміщується на альбумін, і АФП
виявляється в сироватці крові в слідових кількостях. Сироваткові рівні АФП можуть бути значно
підвищені у пацієнтів з гепатоцелюлярною карциномою й іноді при раку шлунка та підшлункової
залози. Збільшення рівня АФП може бути індикатором поширеного раку печінки або
репродуктивних органів чи рецидиву процесу після лікування. Виявлення АФП у тканинах за
допомогою методів імуногістохімії може допомогти в гістологічній ідентифікації пухлинних клітин.
Діагностичне значення АФП як маркера пухлин обмежується тим, що підвищення його рівня в
сироватці спостерігають також при злоякісних захворюваннях печінки, таких як цироз.
Змінені гліколіпідні та глікопропротеїдні антигени. Більшість експериментальних пухлин тварин
і пухлин людини експресують збільшені кількості та/або ненормальні форми поверхневих
глікопротеїдів або гліколіпідів, що можуть бути діагностичними маркерами й мішенями для терапії.
Зміна синтезу глікокон'югатів (як наслідок порушення регуляції експресії ензимів) призводить до
появи нових пухлинних антигенів. Частина з них може стати чужорідними. Їх утворенню сприяють
такі процеси, як неповний синтез або реорганізація в структурі глікокон'югатів. Ці змінені молекули
містять гангліозиди, антигени груп крові та муцини. Деякі ознаки злоякісного фенотипу пухлин, у
тому числі інвазія в тканини й метастатична поведінка, можуть бути опосередковані зміненими
властивостями клітинної поверхні, що є наслідком зміненого синтезу гліколіпідів чи глікопротеїдів.
Серед гліколіпідів, що експресовані в значній кількості при меланомах, є гангліозиди GM2, GD2 та
GD3. Нині у пацієнтів з меланомою проводять клінічні випробування анти-GМ2 та анти-GD3
МкАТ, а також імунізацію вакцинами, що містять антиген GM2.
Муцини — глікопротеїди з великою молекулярною масою, що містять численні О-сполучені
вуглеводні бічні ланцюги. Кілька муцинів мають діагностичну цінність, наприклад СА-125 та СА-
19-9, які експресуються при карциномах яєчника, а також MUC-1, що експресується при
карциномах молочної залози. На відміну від інших муцинів MUC-1 є інтегральним мембранним
протеїном, який у нормі експресований на апікальній поверхні епітелію проток молочної залози,
ізольованої від імунної системи. У карциномах молочної залози, що походять з епітелію проток,
спостерігається деполяризація експресії муцину, а також експресія нових вуглеводів. Ці нові
антигени індукують розвиток гуморальної й Т-клітинної імунної відповіді в онкохворих і тому є
можливими кандидатами для отримання протипухлинних вакцин. У пухлинних клітинах часто
спостерігається порушення регуляції експресії ензимів, які синтезують вуглеводні бічні ланцюги,
що призводить до появи пухлиноспецифічних епітопів на бічних ланцюгах вуглеводів.
Пухлиноспецифічні антигени диференціювання. Пухлинні клітини часто експресують молекули,
що за нормальних умов наявні на клітинах, з яких вони походять. Ці антигени називають
антигенами диференціювання, оскільки вони є специфічними для певної стадії диференціювання
різних типів клітин. Наприклад, лімфоми можуть бути діагностовані як В-клітинного походження за
наявністю поверхневих маркерів, характерних для цієї лінії, таких як CD10 (common acute
lymphoblastic leukemia antigen, CALLA) та CD20. Специфічні до цих молекул МкАТ можна
використовувати для імунотерапії лімфом. Ідіотипічні детермінанти поверхневих імуноґлобулінів
популяції В-лімфоцитів є маркерами певних клонів, оскільки кожний клон експресує певні ідіотипи.
Отже, ідіотипи імуноґлобулінів є дуже високоспецифічними пухлинними антигенами при В-
клітинних лімфомах та лейкозах. Антигени диференціювання є нормальними власними антигенами
і тому не індукують розвиток імунної відповіді у носія пухлини.
Отже, антигени, що експресуються в пухлинах, мають різне походження і різняться за ступенем
специфічності для пухлини, а також за ступенем чужорідності для організму та імуногенністю.
Серед них є продукти нормальних генів (тканиноспецифічні й нетканиноспецифічні для пухлини),
експресія яких різко збільшена в пухлинах, однак вони також експресуються постійно чи на певних
етапах розвитку організму в нормальних тканинах. Одні з цих антигенів не є чужорідними і не
здатні індукувати імунну відповідь, проте в зв'язку з гіперекспресією можуть використовуватися як
діагностичні маркери (онкофетальні антигени) і/або як мішені для терапії (антигени
диференціювання). Разом з тим імуногенністю характеризується нормальний білок тирозиназа, що
гіперекспресується при меланомі, але в малій кількості і лише в незначної частини нормальних
меланоцитів, чим, очевидно, і можна пояснити цей парадокс. Імуногенність виявляють також
аберантно експресовані в пухлині нетканиноспецифічні білки, оскільки в нормі вони експресуються
в імунопривілейованих тканинах й імунної толерантності до них немає. Проте найважливішими
щодо індукування імуцітету є пухлинні антигени — продукти мутованих (під дією хімічних та
фізичних канцерогенів) нормальних клітинних генів і продукти онкогенних вірусів.
16.2. МЕХАНІЗМИ ЗНИЩЕННЯ ПУХЛИННИХ КЛІТИН.
У забезпеченні протипухлинного захисту беруть участь обидві складові імунної системи —
антигенспецифічна, переважно її Т-ланка і меншою мірою — В-ланка, та неспецифічна (природні
фактори захисту), основою якої є функціонування макрофагів і природних кілерів. Специфічна
реактивність імунної системи залежить від пухлинного антигену і виявляється щодо вже
сформованого пухлинного зародка. Фактори природного імунітету можуть реагувати проти окремих
пухлинних клітин, і їх реакції не залежать від антигену. У боротьбі з пухлинами (як і в боротьбі з
агентами зовнішньої біологічної агресії — мікробами) між цими двома складовими імунної системи
встановлюються двоспрямовані взаємозв'язки, їх дійові фактори вступають у тісну взаємодію, що
посилює інтенсивність відповіді організму. Так, макрофаги є важливими для ініціювання імунної
відповіді, а продуковані Т-лімфоцитами цитокіни та В-лімфоцитами антитіла стимулюють
протипухлинну активність макрофагів і НК-клітин, спрямовуючи їхні функції на знищення
пухлинних клітин.
При цьому слід зазначити, що роль різних ефекторних факторів у знищенні пухлин є
нерівнозначною, залежить від типу пухлин і в системі in vivo на сьогодні ще з'ясована не повністю.
Далі стисло описано механізми знищення пухлин за участю імунних та неспецифічних факторів.
Т-лімфоцити. Головний механізм імунітету до пухлин — вбивство пухлинних клітин за допомогою
CD8 ЦТЛ.
Здатність ЦТЛ розвивати ефективну протипухлинну імунну відповідь in vivo дуже добре видно в
експериментах на тваринах, що є носіями пухлин, індукованих дією канцерогенів та ДНК-вмісних
вірусів. ЦТЛ можуть виконувати функцію нагляду, розпізнаючи та вбиваючи злоякісні клітини, що
експресують пептиди які походять з мутантних клітинних білків чи вірусних протеїнів і
презентуються в комплексі з молекулами МНС класу І. Роль імунного нагляду в запобіганні появі
спонтанних, не індукованих вірусом пухлин ставиться дещо під сумнів, оскільки такі пухлини не
виникають частіше у Т-клітинодефіцитних тварин і людей. Однак пухлиноспецифічні ЦТЛ можна
ізолювати у тварин і людей з виявленими пухлинами, наприклад меланомами. Більше того,
мононуклеарні клітини з інфільтратів ділянки запалення, які називають пухлиноінфільтрівними
лімфоцитами (ПІЛ), містять також ЦТЛ зі здатністю лізувати пухлину, з якої їх виділяють.
CD8 Т-лімфоцити визрівають у тимусі, а коли виходять з нього і проникають у периферичні
лімфоїдні тканини, — вони ще не повністю диференційовані CD8 цитотоксичні Т-клітини. їх часто
називають «пре-ЦТЛ». Ініціювання відповіді ЦТЛ потребує активації наївних пре-ЦТЛ до
проліферації та диференціювання в ефекторні клітини. Як відомо, перший сигнал до активації наївні
CD8 Т-клітини отримують через розпізнавання антигену, що завжди асоційований з МНС класу І у
вигляді процесованого пептиду на АПК. Другий сигнал клітина отримує через цитокіни або
костимуляторні молекули. ЦТЛ зв'язуються з АПК через рецептор до антигену і допоміжні
молекули, такі як CD8 та LFA-1-інтегрин.
Значний інтерес становить питання, за яким механізмом пухлини стимулюють специфічну до
пухлинних антигенів активність CD8T-клітин. Річ у тім, що більшість пухлинних клітин не
експресують костимуляторних молекул, які необхідні для ініціювання первинної Т-клітинної
відповіді, або МНС ІІ-молекул, необхідних для активації CD4 Т-клітин, що сприяють
диференціюванню CD8 Т-клітин. Ймовірна можливість полягає в тому, що пухлинні клітини чи їхні
антигени підбираються АПК хазяїна; пухлинні антигени потім процесуються всередині АПК, а
отримані з них пептиди представляються в комплексі з МНС класу І для розпізнавання CD8 Т-
клітинами. Ці професійні АПК експресують костимуляторні молекули, що надають сигнали,
необхідні для диференціювання CD8T-клітин у протипухлинні ЦТЛ. АПК експресують МНС класу
II, що презентують пептиди поглинутих пухлинних антигенів, і активують також CD4 Т-клітини.
Останні продукують цитокіни, зокрема ІЛ-2, який забезпечує сигнал, необхідний для проліферації
ЦТЛ.
Після генерації ефекторних ЦТЛ останні здатні розпізнавати і вбивати пухлинні клітини-мішені без
костимуляторної стимуляції. Розпізнавання ЦТЛ своєї мішені призводить до змін, наслідком яких є
загибель клітини-мішені. Клітина-мішень гине впродовж наступних 2 — 6 год. Це відбувається
навіть тоді, коли ЦТЛ відійшов від неї.
Принциповий механізм ЦТЛ-індукованого лізису — це доставляння гранул з цитотоксичними
протеїнами до клітини-мішені. Коли рецептори ЦТЛ розпізнали МНС І-асоційовані пептиди на
клітини-мішені, відбувається реорганізація цитоскелета ЦТЛ і організований мікротрубочками
центр переміщується до зони контакту клітин. Гранули з перфорином і гранзимами концентруються
в місці контакту, їхні мембрани зливаються з мембраною ЦТЛ, що призводить до екзоцитозу гранул
(див. розд. 11). Власне клітина ЦТЛ не ушкоджується вмістом гранул, оскільки її захищає
протеоглікан хондроїтинсульфат А, який також міститься в гранулах.
Другий механізм індукування загибелі пухлинних клітин включає взаємодію між білками Fas та
FasL відповідно на поверхні пухлинної клітини й Т-лімфоцита з наступною активацією апоптичної
програми в клітині-мішені.
У протипухлинній імунній відповіді значну роль відіграють і СD4Т-лімфоцити. Вони стимулюють
ЦТЛ завдяки здатності синтезувати лімфокіни, а також активують АПК до презентації антигену
через взаємодію CD40L —CD40. У багатьох модельних системах спостерігалось порушення імунної
відповіді на пухлини, якщо після вакцинації антигенами пухлин у тварин виснажували вміст СD4Т-
лімфоцитів, а потім уводили пухлинні клітини. Адоптивне перенесення пухлиноспецифічних СD4Т-
лімфоцитів згодом відновлювало протипухлинну імунну відповідь. Крім активації ЦТЛ та АПК CD4
Т-лімфоцити здатні активувати також неспецифічну протипухлинну активність макрофагів та
еозинофілів. СD4Т-лімфоцити є важливим компонентом протективного й довготривалого імунітету.
Секреція специфічними до пухлинних антигенів СD4Т-клітинами таких цитокінів, як ФНП і ІФН-γ
призводить до підвищення рівня експресії молекул МНС класу І на поверхні пухлинних клітин і
збільшує їхню чутливість до дії ЦТЛ.
Антитіла. Індивіди — носії пухлин продукують антитіла проти різних пухлинних антигенів.
Наприклад, сироватка крові пацієнтів з ВЕБ-асоційованими лімфомами містить антитіла, специфічні
проти ВЕБ-кодованих антигенів, що експресуються на поверхні клітин лімфоми. Антитіла можуть
індукувати знищення пухлинних клітин через активацію комплементу або через механізм
антитілозалежної клітиноопосередкованої цитотоксичності, коли макрофаги та НК, що несуть
рецептор до Fc-фрагментів антитіл, здійснюють кілінг. Однак здатність антитіл індукувати
елімінацію пухлинних клітин було доведено в основному in vitro, і небагато є доказів на користь
ефективного гуморального імунітету проти пухлин in vivo.
НК-клітини. НК-клітини вбивають багато типів пухлинних клітин, особливо клітини, що мають
знижений рівень експресії молекул МНС І і можуть уникати опосередкованого ЦТЛ лізису. In vitro
НК-клітини можуть лізувати інфіковані вірусами клітини, а також певні лінії пухлинних клітин,
особливо гемопоетичні пухлини. НК-клітини реагують також на відсутність молекул МНС І,
оскільки розпізнавання/взаємодія з молекулами МНС І призводить до генерації інгібіторних
сигналів для НК-клітин. Відомо, що деякі пухлини втрачають експресію молекул МНС І, можливо,
як результат селекції, оскільки МНС І
+
-клітини розпізнаються ЦТЛ. Ці імунні зміни роблять
пухлини особливо зручними мішенями для НК-клітин. Крім того, НК-клітини можуть бути залучені
до кілінгу вкритих IgG клітин-мішеней через свої рецептори до Fc-фраґментів (CD16). Основним
механізмом кілінгу клітин-мішеней НК-клітинами є перфоринзалежний цитоліз. Цитотоксична
активність НК-клітин збільшується за допомогою цитокінів, включаючи ІФН, ІЛ-2, ІЛ-12.
Протипухлинні ефекти цих цитокінів частково зводяться до стимулювання активності НК. ІЛ-2-
активовані НК-клітини, які називають ЛАК (лімфокін-активовані кілери), отримують
культивуванням клітин периферичної крові чи пухлино-інфільтруючих лімфоцитів (ПІЛ) від
онкохворих з ІЛ-2 у високих концентраціях.
Макрофаги. Роль макрофагів у протипухлинному імунітеті в основному доведено за допомогою
експериментів in vitro. Активовані макрофаги можуть лізувати багато пухлинних клітин
ефективніше, ніж вони вбивають непухлинні клітини. Як саме макрофаги активуються пухлинами,
невідомо. Можливі механізми включають пряме розпізнавання деяких поверхневих антигенів
пухлинних клітин і активацію макрофагів ІФН-γ, який продукується пухлиноспецифічними Т-
клітинами. Макрофаги можуть вбивати клітини-мішені за допомогою різних механізмів, можливо,
таких самих, як механізми знищення інфекційних мікроорганізмів. Ці механізми включають
вивільнення лізосомальних ферментів, реактивних кисневих похідних та NO. Активовані макрофаги
продукують також цитокін ФНП, який може індукувати загибель пухлинних клітин. ФНП може
вбивати пухлинні клітини прямо й опосередковано, через порушення васкуляризації. Прямий
токсичний вплив здійснюється через зв'язування ФНП з рецепторами пухлинних клітин, що
активують сигнальні шляхи, які призводять до апоптозу. Непрямий спосіб ФНП-залежного некрозу
пухлин полягає в індукуванні тромбозу кровоносних судин.
В експериментах на тваринах було отримано непрямі свідчення можливої протипухлинної
активності макрофагів in vivo. Так, введення тваринам речовин, що активують макрофаги,
призводило до пригнічення росту трансплантованих пухлинних клітин, а порушення функції
макрофагів шляхом ін'єкції антимакрофагальної сироватки — до стимулювання їх росту. В
онкохворих макрофаги часто інфільтрують солідні пухлини, причому у високоімуногенних і
неметастазуючих пухлинах їх кількість більша, ніж у слабкоімуногенних та метастазуючих. Однак
макрофаги, виділені безпосередньо з пухлини, виявляють in vitro знижену протипухлинну
активність порівняно з активованими макрофагами, отриманими від здорових тварин, що зазнавали
впливу стимулювальних агентів. Вважають, що активність макрофагів in vivo може пригнічуватися
самою пухлиною внаслідок виділення супресивних факторів або блокувальними факторами,
зокрема комплексами розчинного пухлинного антигену з антитілами, надлишок яких може
насичувати FcR макрофагів і зумовлювати їх параліч (позбавляти макрофаги протипухлинної
активності). Показано, що у людей і тварин пухлинний ріст часто супроводжується пригніченням
тестованого in vitro хемотаксису моноцитів. Очевидно, пухлини можуть гальмувати міграцію
моноцитів, протидіючи їх зосередженню в ділянці локалізації новоутворення.
Таким чином, усі типи ефекторних клітин (Т-лімфоцити, НК-клітини, макрофаги) здатні чинити
цитолітичну дію на пухлинні клітини. А специфічні протипухлинні антитіла можуть
опосередковувати цитолітичні реакції макрофагів та НК-клітин. Цитотоксичний ефект усіх цих
клітин чітко продемонстрований in vitro. У механізмах цитолізу, що здійснюються різними
клітинами, є як спільні ознаки, так і відмінності. З усіх типів клітин, що характеризуються
кілінговою активністю, найважливіша роль у протипухлинному імунітеті належить ЦТЛ.
Здатність імунної системи онкохворого реагувати на пухлину показана in vitro в змішаній культурі
лімфоцитів і пухлинних клітин (ЗКЛПК). Суть методу полягає в тому, що в такій культурі, як і в
змішаній культурі лімфоцитів (ЗКЛ), на стимулювання специфічним антигеном відповідають лише
заздалегідь праймовані цим антигеном лімфоцити. Отже, в ЗКЛПК вилучені з організму хворого
лімфоцити розвиватимуть реакцію за наявності аутологічних пухлинних клітин (вводяться в
культуру інактивованими) лише в тому разі, якщо вони in vivo були сенсибілізовані антигенами
пухлини. Генеровані в такій системі проліферувальні Т-хелперні СD4-клітини визначають, як у ЗКЛ
(в проліферативному тесті), за включенням радіоактивне міченого тимідину, а цитотоксичну
активність ЦТЛ (у цитотоксичному тесті) — за звільненням
51
Сr.
У результаті досліджень у ЗКЛПК лімфоцитів, виділених з периферичної крові, лімфовузлів, що
дренують пухлину, та самої пухлини, і різних типів клітин-мішеней (аутологічних пухлинних,
аутологічних нормальних і алогенних пухлинних) пухлиноспецифічні Т-лімфоцити (Т-хелпери і
ЦТЛ) було виявлено у хворих з різними типами пухлин. Отримані ЦТЛ знищували клітини
аутологічних пухлин. Крім того, лімфоцити деяких хворих були здатні лізувати також нормальні
аутологічні клітини або алогенні пухлинні клітини, або клітини обох цих типів, що, можливо,
частково пояснюється дією НК-клітин. Водночас у модельних експериментах на тваринах
культивовані специфічні до пухлинних антигенів цитотоксичні Т-лімфоцити здатні спричинити
прогресування пухлин. Значення цитотоксичних реакцій in vivo, виявлених in vitro, залишається
нез'ясованим, однак цілком очевидно, що вони будуть результативними не для всіх хворих і не для
всіх типів пухлин.
Роль імунного нагляду в запобіганні не індукованих вірусами пухлинам ставиться під сумнів,
оскільки такі пухлини, як вже зазначалося, не виникають частіше у Т-клітинодефіцитних тварин і
людей. Концепція імунного нагляду виразніше вимальовується для пухлин, що індуковані ДНК-
вмісними вірусами, ніж для інших типів пухлин. Ефективність імунного нагляду щодо пухлин,
індукованих дуже поширеними ДНК-вмісними вірусами, пояснюється тим, що в процесі тривалого
співіснування вірусів з їхнім хазяїном відбувся такий відбір (на наявність відповідних генів імунної
відповіді) серед останніх, що їх нащадки здатні розвивати ефективну імунну відповідь на індуковані
вірусом пухлинні антигени. Спонтанні пухлини у людей часто здатні інтенсивно рости і призводити
до смерті хазяїна. І хоча на сьогодні специфічні пухлинні антигени ідентифіковано лише для деяких
пухлин, усе-таки, очевидно, причиною прогресування пухлин не завжди є відсутність таких
антигенів і навіть не їхня неімуногенність. Навіть за умови імуногенності пухлини імунна відповідь
може виявитися неефективною, що зумовлено здатністю пухлини мобілізувати захисні та
імуносупресивні механізми, за допомогою яких вона може виходити з-під імунного нагляду.
16.3. ВИХІД ПУХЛИНИ З-ПІД ІМУННОГО НАГЛЯДУ.
Пухлинні клітини мають механізми уникнення чи резистентності до імунної системи хазяїна.
Пухлинні клітини використовують кілька захисних пристосувань, які дають їм змогу уникати
імунного нагляду і в основі яких лежать різні механізми. Деякі з цих механізмів запобігають
розпізнаванню пухлинних клітин цитотоксичними Т-лімфоцитами або ж значно ускладнюють цей
процес. Це може бути пов'язано з втратою пухлиною, що інтенсивно росте, пухлинних антигенів,
маскуванням їх або втратою чи значним зниженням експресії допоміжних молекул, що беруть
участь у розпізнаванні.
Механізми уникнення пухлинами імунного нагляду характеризуються певними ознаками.
1. На пухлинних клітинах знижується, іноді до повного зникнення, експресія молекул МНС класу І,
і вони не розпізнаються ЦТЛ. У дослідах на тваринах було показано, що збільшення експресії МНС
класу І на пухлинних клітинах за допомогою обробки цитокінами, наприклад ІФН-γ, та трансфекції
генів МНС І призводить до підвищення чутливості цих клітин до лізису ЦТЛ in vitro та зниження
пухлинного навантаження in vivo. Віруси мають механізми для зменшення експресії МНС І чи
асоціації з ними власних молекул, тобто вони блокують презентацію антигену для ЦТЛ. Наприклад,
білок аденовірусів Е1А є інгібітором транскрипції білків МНС І. Деякі білки вірусу герпесу
гальмують функцію ТАР (білків-транспортерів, що асоційовані з процесингом антигену). Ці самі
механізми можуть спрацьовувати в індукованих дією вірусів пухлинах, що стають резистентними
до дії ЦТЛ. Навіть за відсутності вірусної інфекції різні пухлини відрізняються зниженим синтезом
молекул МНС І і β2 -мікроглобуліну чи компонентів антигенпроцесувального механізму, в тому
числі димеру ТАР та деяких субодиниць протеасоми. При цьому іноді спостерігається втрата
експресії антигенів МНС І лише певного типу (найчастіше — кодованих локусом HLA-A, як,
наприклад, при раку товстої кишки) при збереженні експресії інших, що більш «вигідно» для
пухлинних клітин, оскільки у разі повного зниження експресії молекул МНС І вони стають
чутливими до цитотоксичної дії НК-клітин. Зниження експресії МНС І у хворих із пухлинами часто
поєднується зі зниженням рівня диференціювання та раннім метастазуванням пухлин (рак легенів).
Ці механізми є адаптаціями пухлин, що виникають у відповідь на тиск імунітету хазяїна, і дають
можливість пухлинним клітинам уникати імунної відповіді.
2. У процесі росту пухлини можуть втрачати експресію антигенів, що індукують імунну відповідь.
Така втрата часто трапляється в пухлинах, що швидко ростуть, і може бути індукована в пухлинних
клітинах при сумісному культивуванні з пухлиноспецифічними антитілами або ЦТЛ. Враховуючи
високий мітотичний потенціал пухлинних клітин та їх генетичну нестабільність, мутації й делеції
генів що кодують пухлинні антигени, є звичайним явищем. Якщо ці антигени не є необхідними для

67
росту пухлин чи підтримання трансформованого фенотипу, такі антигеннегативні пухлинні клітини
мають переваги для росту в організмі хазяїна. Аналіз пухлин, які серійно трансплантують від однієї
тварини до іншої, показав, що втрата антигенів, які розпізнаються ЦТЛ, корелює зі збільшенням
росту та метастатичного потенціалу. В динаміці росту пухлин може відбуватися не тільки втрата
пухлинних антигенів, а й зміна антигенної структури, що зумовлено генетичною нестабільністю та
постійною мінливістю пухлини. Відмінності в антигенній структурі визначаються як у межах однієї
пухлини, так і в метастазуючих пухлинах. Клітини зі зміненим антигенним фенотипом нечутливі до
імунних факторів, що індукувалися раніше експресованими пухлиною антигенами. Відбувається
нібито селекція клонів клітин, резистентних до імунних факторів, що і є причиною росту пухлини за
наявності імунної відповіді.
3. Антигени поверхні пухлинних клітин можуть бути сховані від імунної системи молекулами
глікокаліксу, такими як глікозамінглікани, що містять сіалові кислоти. Цей процес називають
маскуванням антигену. Він може бути наслідком того, що пухлинні клітини часто експресують
більше молекул глікокаліксу, ніж нормальні клітини, як, наприклад, хоріонепітеліома, що
розвивається з ембріональної тканини. Так само, деякі пухлини можуть «ховатися» від імунної
системи через активацію систем коагуляції, утворюючи так званий «фібриновий кокон».
Протипухлинні антитіла, що взаємодіють із поверхневими структурами пухлинних клітин, але не
активують при цьому ефекторні механізми (в яких вони беруть участь — АЗКЦ, фагоцитоз), можуть
також екранувати пухлинні антигени чи прискорювати ендоцитоз цих антигенів і тому роблять
пухлини резистентними до імунної атаки.
4. Причиною пригнічення імунної відповіді вже в індуктивну її фазу може бути анергія Т-клітин, що
розвивається внаслідок відсутності на пухлинних клітинах костимуляторних молекул, що,
очевидно, може розглядатися як варіант периферичної толерантності. Як відомо, костимуляторні
молекули В7-1 (CD80) та В7-2 (CD86) необхідні для активації Т-клітин та ініціювання імунної
відповіді. Пухлинні клітини не експресують костимуляторні молекули і не індукують активність
ЦТЛ. Більше того, під час взаємодії з пухлинними клітинами попередники Т-лімфоцитів не тільки
не диференціюються у функціонально активні (ефекторні) Т-клітини, а переходять у стан анергії,
що виявляється в їх неспроможності розвивати відповідь під час наступної стимуляції.
5. Пухлинні антигени можуть індукувати специфічну імунну толерантність. Толерантність до
пухлинних антигенів може встановитися тому, що пухлинні антигени є «власними» антигенами, що
стикаються з імунною системою в стадії ембріонального чи раннього постнатального розвитку, або
тому, що пухлинні клітини представляють свої антигени в толерогенній формі зрілим лімфоцитам.
Як свідчать деякі експериментальні дані, толерантність до пухлинних антигенів призводить до
сильного росту пухлин, які репресують подібні антигени. Так, новонароджені миші можуть
отримувати онкогенні віруси від своєї матері під час вигодовування. Миші стають толерантними до
вірусу та кодованих ним антигенів і є його носіями впродовж життя. Коли такі миші дорослішають,
у них часто розвивається рак молочної залози, і такі пухлини не індукують імунної відповіді. Однак
ці пухлини є імуногенними, оскільки відторгаються, коли їх трансплантовано в організм вільної від
вірусу неінфікованої сингенної тварини. Описаний приклад є варіантом центральної толерантності,
зумовленої, очевидно, елімінацією специфічних до пухлинних антигенів клонів Т-лімфоцитів під
час селекції в тимусі. Під час пухлинного росту може формуватися також периферична
толерантність. В її індукуванні провідну роль відіграють розчинні пухлинні антигени в низьких
толерогенних дозах.
6. Продукти синтезу пухлинних клітин можуть гальмувати протипухлинні імунні відповіді. Приклад
імуносупресорного продукту пухлин — це трансформівний фактор росту β (ТФР-β), що в значній
кількості секретується багатьма пухлинами і гальмує проліферацію та ефекторні функції лімфоцитів
і макрофагів. Пригнічення протипухлинної імунної відповіді може зумовити також продукований
пухлиною ІЛ-10. З цим цитокіном, як відомо, пов'язана супресивна дія Тх2- відносно Тх1-клітин, що
ініціюють і контролюють цитотоксичні реакції Т-лімфоцитів. Здатністю пригнічувати
протипухлинну імунну відповідь характеризується також простагландин Е-2.
Деякі пухлини експресують FasL, що взаємодіє з Fas-антигеном лімфоцитів, які намагаються
знищити пухлинні клітини. Зв'язування Fas-антигену призводить до апоптозу лімфоцитів.
Важливість цього механізму виходу з-під імунного контролю ще остаточно не з'ясовано, оскільки
FasL було виявлено лише на деяких спонтанних пухлинах. Крім того, трансфекція FasL у пухлинні
клітини не завжди призводить до загибелі лімфоцитів in vitro.
Таким чином, пухлинні клітини можуть використовувати різні механізми для виходу з-під імунного
нагляду й уникнення ушкодження. Подальші дослідження в цьому напрямі важливі для розробки
підходів з метою підвищення імуногенності пухлин та ефективності протипухлинної відповіді.
16.4. ІМУНОТЕРАПІЯ ПУХЛИН.
Імунотерапія як метод протипухлинної терапії виникла близько 100 років тому зі спроб використати
імунну сироватку для лікування хворих на остеосаркому. З того часу для імунотерапії почали
використовувати велике розмаїття імунопотенціювальних агентів, у тому числі фракції
бактеріальних клітин, цитокіни, гормони тимуса, антитіла, модифіковані пухлинні клітини та
клітини імунної системи організму-хазяїна.
Імунотерапію використовують для стимулювання активності слабкої імунної відповіді хазяїна
(активна імунотерапія) або пасивного забезпечення ураженого онкологічним процесом організму
певними факторами імунітету у вигляді пухлиноспецифічних антитіл або Т-клітин (пасивна
імунотерапія).
Активна імунотерапія пухлин. Активна імунотерапія полягає у введенні протипухлинних вакцин,
цитоткінів і костимуляторних молекул для стимулювання специфічної відповіді, а також індукторів
запалення та поліклональних активаторів лімфоцитів для неспецифічного стимулювання імунної
системи.
Вакцинація пухлинними клітинами та антигенами пухлин. Нині завдяки сучасним методам
молекулярної біології стало можливим ідентифікування пептидів, що розпізнаються
пухлиноспецифічними ЦТЛ, та клонування генів що кодують ці антигени. Імунізація очищеними
антигенами пухлин разом з ад'ювантами є одним з найпоширеніших підходів у створенні
протипухлинних вакцин (табл. 57).
Нещодавно було розроблено новий метод імунізації онкохворих дендритними клітинами,
отриманими від пацієнтів та інкубованими з пухлинними антигенами або трансфекованими генами,
що кодують ці антигени. Для антигенів, унікальних для індивідуальних пухлин, таких як антигени,
що виникають унаслідок випадкових точкових мутацій клітинних генів, такі методи вакцинації
неперспективні, оскільки потребують ідентифікування антигенів з кожної пухлини. Такі антигени,
як MAGE, gp 100 — відповідно антигени меланом і гліобластом, а також мутовані Ras і р53-білки
багатьох пухлин є потенційними корисними імуногенами для всіх пацієнтів з певними типами раку.
Розвиток індукованих вірусами пухлин може бути заблокований за допомогою запобіжної
вакцинації вірусними антигенами або ослабленими живими вірусами, цей підхід ефективний у
зменшенні частоти виникнення лейкозу у котів та запобіганні герпесвірусіндукованим лімфомам
(які називають хворобою Марека) у курчат. У людей таку вакцинацію проводять проти гепатиту В,
що може зменшити частоту виникнення гепатоцелюлярних карцином та асоційованого з
інфікуванням HBV раку печінки.
Підвищення імунітету хазяїна до пухлин за допомогою цитокінів та костимуляторних
молекул. Пухлинні клітини індукують слабку імунну відповідь, оскільки не несуть на своїй
поверхні костимуляторні молекули й молекули МНС II. Тому пухлинні клітини не здатні
безпосередньо активувати Т-хелпери. Нині існує два потенційних підходи для підвищення імунної
відповіді хазяїна на пухлини: штучне надання костимуляторних сигналів для пухлиноспецифічних
Т-клітин та надання екзогенних цитокінів, які збільшують Т-клітинний ріст і активацію, виконуючи
таким чином функції Т-хелперних клітин. Багато цитокінів також мають такий потенціал для
збільшення неспецифічних запальних відповідей з протипухлинною активністю.
Ефективність посилення Т-клітинної костимуляції для протипухлинної терапії було
продемонстровано в експериментах на тваринах. Пухлинні клітини було трансфековано генами, що
кодують В7-костимуляторні молекули, і використано для вакцинації тварин. Ці В7-експресувальні
пухлинні клітини індукували розвиток протективного імунітету проти немодифікованих пухлинних
клітин, які вводили у віддалені сайти організму тварини. Успішне використання нового підходу на
експериментальних моделях тварин продовжили клінічні випробування. Зразок пухлини пацієнта
вирощують in vitro, потім трансфекують генами костимуляторних молекул, опромінюють і знову
вводять хворому. Показано, що такий метод може бути успішним навіть тоді, коли імуногенні
антигени пухлини невідомі.
Для підвищення адаптивної та природної імунної відповіді на пухлини можна використовувати
цитокіни. Пухлинні клітини безпосередньо трансфекують генами цитокінів, щоб досягти ефекту
саме в тому сайті, де це потрібно (табл. 58). Наприклад, коли пухлинні клітини гризунів
трансфекували генами ІЛ-2, ІЛ-4, ІФН-γ або ГМ-КСФ, пухлини відторгалися чи починали рости, а
потім регресували. У деяких випадках інтенсивні запальні інфільтрати формувалися навколо
цитокінсекретувальних пухлин. Природа інфільтрату залежала від типу цитокіну. Слід зазначити,
що в деяких із цих досліджень ін'єкція цитокінсекретувальних пухлин індукувала специфічний Т-
клітиноопосередкований імунітет до немодифікованих пухлинних клітин, які вводили в організм
пізніше. Отже, локальне продукування цитокінів пухлинними клітинами може посилити Т-клітинну
відповідь. Нині у пацієнтів з поширеним раком різних локалізацій проводять клінічні випробування
з використанням клітин пухлин, трансфекованих генами цитокінів.
Цитокіни вводять також системно для лікування різних типів пухлин людини. Найбільший
клінічний досвід отримано в разі застосування ІЛ-2. Після введення ІЛ-2 в крові значно
збільшується кількість Т- і В-лімфоцитів, а також НК-клітин. Підвищується активність НК-клітин і
збільшуються сироваткові рівні ФНП, ІЛ-1 та ІФН-γ. Вважають, що ІЛ-2 стимулює проліферацію та
протипухлинну активність НК-клітин і ЦТЛ. Обмеженням для застосування цього методу лікування
можуть бути токсичні ефекти ІЛ-2, що призводить до розвитку пропасниці, легеневої едеми та
васкулярного шоку. Описані побічні ефекти трапляються через стимулювання ІЛ-2 продукування
інших цитокінів Т-клітинами, таких як ФНП та ІФН-γ. Ці цитокіни діють на ендотелій судин та інші
типи клітин. ІФН-α ефективний також для лікування пухлин, оскільки має антипроліферативний
вплив на клітини, збільшує цитолітичну активність НК-клітин, збільшує експресію молекул МНС І
на різних типах клітин. Клінічні випробування цих цитокінів довели, що вони можуть індукувати
регресію карцином нирок, меланом, сарком Капоші, різних лімфом, волохатоклітинного лейкозу.
Нині ІФН-α використовують поряд з хіміотерапією для лікування меланоми. Інші цитокіни, такі як
ФНП та ІФН-γ, є ефективними протипухлинними агентами в моделях на тваринах, однак їх
використання для хворих лімітовано серйозними токсичними побічними ефектами. У деяких
клінічних випробуваннях ФНП вводять ізольовано (перфузія кінцівок) пацієнтам з меланомами чи
саркомами кінцівок. Останнім часом зріс інтерес до ІЛ-12, що підвищує протипухлинну активність
Т- та НК-клітиноопосередкованої відповіді. Проводять клінічні випробування з використанням,
цього цитокіну. Гематопоетичні ростові фактори, зокрема ГМ-КСФ, Г-КСФ та ІЛ-11,
використовують для скорочення періодів нейтропенії або тромбоцитопенії після хіміотерапії чи
трансплантації аутологічного кісткового мозку.
Неспецифічне стимулювання імунної системи. Імунну відповідь на пухлини можна стимулювати
локальним введенням субстанцій, що спричинюють запалення, або системним застосуванням
агентів, що мають ефект поліклональних активаторів лімфоцитів. Неспецифічне стимулювання
імунітету в онкохворих унаслідок ін'єкції субстанції, що спричинює запалення, —
протитуберкульозної вакцини з мікобактерій туберкульозу бичачого типу (BCG) у сайти росту
пухлин використовували впродовж багатьох років. Вакцина BCG активує макрофаги і, отже,
підвищує їх здатність вбивати пухлинні клітини. Крім того, бактерії працюють як ад'юванти і
можуть стимулювати Т-клітинні відповіді на пухлинні антигени. Інший спосіб для стимулювання
імунітету — це введення в низьких дозах активуючих анти-СD3-антитіл. У дослідженнях на
тваринах із трансплантованими пухлинами застосування цього методу лікування сприяло
поліклональній активації Т-клітин і як наслідок — запобіганню росту пухлин. Нині проводять ранні
клінічні випробування з анти-СD3-антитілами У пацієнтів зі значними (дисемінованими)
пухлинами.
Пасивна імунотерапія пухлин. Пасивна імунотерапія включає перенесення до пацієнтів
ефекторних компонентів імунної відповіді, в тому числі пухлиноспецифічних Т-клітин та антитіл.
Пасивна імунізація проти пухлин не зумовлює тривалого імунітету, оскільки введені імунні
ефекторні фактори швидко елімінуються.
Клітинна імунотерапія включає перенесення культивованих імунних клітин, що мають
протипухлинну активність, в організм носіїв пухлин і називається адоптивною. Клітини, які
переносять, спочатку отримують із лімфоцитів онкохворих. Один із поширених підходів терапії –
отримання ЛАК-клітин. Лімфоцити отримують із периферичної крові хворих і культивують їх з ІЛ-2
у високих концентраціях. Потім вводять ЛАК-клітини в організм пацієнта. ЛАК-клітини містять в
основному НК-клітини. При адоптивній терапії аутологічними ЛАК-клітинами в комплексі з
введенням in vivo ІЛ-2 чи протипухлинних препаратів спостерігали вражаючі результати у мишей, у
яких відмічали регресію солідних пухлин. Спроби ЛАК-терапії людей досі були обмежені і
проводилися лише для пацієнтів з дуже великими метастатичними пухлинами. Тому ефективність
цього методу варіює від пацієнта до пацієнта. Однією з модифікацій цього методу є ізоляція
лімфоцитів (ПІЛ), що інфільтрують пухлину, із запального інфільтрату, який оточує солідну
пухлину (отримують під час хірургічного видалення зразків пухлини), і культивування ПІЛ in vitro з
добавлянням ІЛ-2. Перевагою цього методу є те, що ПІЛ збагачені на пухлиноспецифічні ЦТЛ і
активовані НК-клітини. Нині проводять клінічні випробування використання культивованих з ІЛ-2
ПІЛ у людей.
Терапія антитілами до антигенів пухлин. Потенційна можливість використовувати антитіла як
«магічні кулі» досліджується вченими вже багато років і нині також є актуальною. Протипухлинні
антитіла знищують пухлини за тим самим ефекторним механізмом, що застосовується для елімінації
мікробів, у тому числі опсонізацією, фагоцитозом та активацією системи комплементу. МкАТ,
специфічні до продукту онкогену Her2/neu1, що експресується деякими пухлинами в значній
кількості, успішно зарекомендували себе в терапії хворих на пухлини молочної залози. Крім
активації імунних ефекторних механізмів анти-Неr2/neu1-антитіла порушують функцію
передавання сигналів через Her2/neu1-рецептор. Оскільки протипухлинні антитіла, які спочатку
використовували для терапії людей, були мишачого походження, імунна відповідь часто виникала
на мишачі імуноглобуліни, що призводило до прискореного виведення протипухлинних антитіл чи
блокування їх зв'язування зі своєю мішенню. Подолати цю перешкоду можна за допомогою
«гуманізованих» антитіл, що складаються з варіабельної ділянки мишачих антитіл, специфічної до
певного пухлинного антигену, комбінованої з Fc-фраґментом антитіл людини (див. розд. 22).
Найсерйознішою проблемою у використанні протипухлинних антитіл є здатність пухлинних клітин
втрачати експресію антигену, до якого специфічні антитіла. Цю проблему можна подолати,
використовуючи «коктейль» антитіл, специфічних до різних антигенів, які експресуються однією
пухлиною.
Для підвищення ефективності антитілотерапії використовували різні кон'югати протипухлинних
антитіл. Пухлиноспецифічні антитіла кон'югували з токсичними молекулами, радіонуклідами та
протипухлинними лікарськими засобами, щоб поліпшити специфічну доставку цих цитотоксичних
агентів до пухлини. Такі токсини, як рицин чи дифтерійний токсин, є потенційними інгібіторами
синтезу протеїнів і можуть бути ефективними в дуже низьких дозах, коли їх доставляють до
пухлини в кон'югованому з МкАТ вигляді. Такі кон'югати називають імунотоксинами. Цей підхід
потребує ковалентного зв'язування токсину з протипухлинним антитілом без порушення
токсичності токсину й специфічності антитіла. Імунотоксини, які вводять систематично,
ендоцитуються пухлинними клітинами, і частина токсину доставляється до своєї
внутрішньоклітинної мішені для реалізації активності. Застосування цього методу пов'язане з
певними труднощами. Токсини, лікарські засоби та радіонукліди, зв'язані з антитілами, можуть мати
системний ефект унаслідок циркуляції через нормальні тканини. Наприклад, при терапії
імунотоксинами часто спостерігають гепатотоксичність та порушення проникності капілярів.
Введення імунотоксинів може призводити до імунної відповіді проти токсинів і введених антитіл.
Через ці практичні труднощі клінічні випробування імунотоксинів мають помірний успіх.
Антитіла до антигенів пухлин використовують також для видалення пухлинних клітин з кісткового
мозку перед аутологічною трансплантацією кісткового мозку.
Терапевтична ефективність імунотерапії пухлин нестійка і нетривала, тому її використовують у
комбінації з основними пухлинознищувальними заходами, такими як хірургічна операція, хіміо- та
радіотерапія Проте висока специфічність імунотерапії а також сприяння подовженню тривалості та
підвищенню якості життя хворих роблять цей підхід актуальним і важливим компонентом
комплексу заходів сучасної терапії онкохворих.
ВИСНОВКИ.
Імунна система здійснює нагляд за гомеостазом соматичних клітин в організмі і, згідно з теорією Ф.
Бернета, забезпечує знищення латентних осередків пухлинних клітин, запобігаючи тим самим
розвитку більшості пухлин. Проте ефективному контролю, очевидно, піддаються не всі типи
пухлин. Імунний нагляд, можливо, ефективний щодо пухлин, асоційованих з онкогенними вірусами,
особливо ДНК-вмісними. Підтвердженням цього є встановлений факт, що у Т-імунодефіцитних
людей і тварин з підвищеною частотою виникнення новоутворень більшість пухлин асоційовані з
онкогенними вірусами.
Основою протипухлинного захисту є Тх1-залежна клітинна відповідь за участю цитотоксичних Т-
лімфоцитів, продукти яких підвищують протипухлинну активність клітин — ефекторів природного
імунітету (НК-клітин і макрофагів). Індукторами адаптивної ланки імунної відповіді є експресовані
на пухлинних клітинах антигени, що є продуктами вірусних генів або змінені чи неадекватно
експресовані продукти власних генів. Експресовані на клітинах пухлин деякі нормальні антигени,
передусім антигени диференціювання, можуть використовуватися для діагностики або як мішені
для моноклональних антитіл — для терапії пухлин. Імунотерапія пухлин з використанням різних
підходів та засобів є перспективною, оскільки спрямована на специфічне підвищення ефективності
системи протипухлинного захисту.
Контрольні запитання.
1. Які докази можна навести на користь того, що саме імунна система здійснює контроль над
виникненням пухлинних клітин?
2. Які антигени пухлин ви знаєте? В чому особливості їх утворення?
3. Які ланки природного й адаптивного імунітету беруть участь у знищенні пухлинних клітин?
4. Які механізми використовують пухлинні клітини для уникнення імунного контролю?
5. Які імунологічні підходи використовують для лікування онкологічних хворих? Чи можна
застосовувати імунотерапію як самостійний метод терапії?
РОЗДІЛ 17. ТРАНСПЛАНТАЦІЙНИЙ ІМУНІТЕТ.
Дослідження в галузі імунобіології трансплантації значно розширили уявлення про значення і
функціонування імунної системи. Внаслідок вивчення відторгнення шкірних трансплантатів у
мишей було відкрито явище імунної толерантності, головну систему гістосумісності (МНС) та
отримано основні відомості про функції Т-лімфоцитів, яким належить провідна роль у
трансплантаційному імунітеті. Велике значення мали ці дослідження і для клінічної
трансплантології.
Методи сучасної хірургії дають змогу пересаджувати будь-які органи. Однак незважаючи на
досконалу техніку пересаджування, поки що не подолано перешкоду на шляху розвитку
трансплантології — біологічний бар'єр у вигляді трансплантаційного імунітету. Трансплантаційний
імунітет — це реактивність клітин імунної системи, що спрямована проти чужорідних антигенів,
експресованих на поверхневих мембранах клітин трансплантата, і зумовлює їх руйнування та
відторгнення трансплантата.
У медичній практиці найпершим і найпоширенішим різновидом трансплантації тканин є
переливання крові. Для запобігання руйнуванню введених еритроцитів аглютинінами, що містяться
в крові, проводять перевірку на сумісність груп крові Донора і реципієнта за антигенами систем
АВ0 і Rh. Оскільки кількість зазначених еритроцитарних антигенів є невеликою (4 головних АВ0-
типи та 2 Rh-типи), то це здійснюється відносно легко.
Слід зазначити, що ця процедура значно ускладнюється в разі пересаджування тканин та органів,
що містять клітини з ядрами. Ядровмісні клітини експресують антигени системи МНС (HLA у
людини та Н-2 у миші), що є полігенною і поліморфною (див. розд. 5). Імунна відповідь проти
антигенів МНС майже завжди призводить до відторгнення трансплантата. Антигени, що
відповідають за відторгнення генетично чужорідних тканин, називають антигенами
гістосумісності (антигенами тканинної сумісності), або трансплантаційними антигенами.
Антигени гістосумісності є в усіх клітинах, але їх кількість у різних тканинах неоднакова. У людини
найбільша їх кількість міститься в лімфоїдній тканині селезінки і лімфовузлах. Інші органи за
низхідною концентрацією в них антигенів системи HLA розміщуються у такому порядку: печінка,
легені, кишки, нирки, серце, шлунок, аорта, мозок. Найменше HLA-антигенів на кришталику ока та
68
еритроцитах. Водночас на мишачих ерироцитах антигени системи Н-2 експресовані досить
компактно. Із клітинних органел антигени
МНС у найбільшій кількості містяться в
цитоплазматичних мембранах.
У дослідженнях на мишах чистих лінії,
яким пересаджували шкіру в межах
інбредної лінії, між представниками
різних ліній та їх гібридів були відкриті
генетичні закони трансплантації (G. D.
Snell). Tpaнсплантати, пересаджені
мишам усередині лінії (від АА до АА та
від ВВ до ВВ), приживаються, а
пересаджені мишам різних ліній (від АА
до ВВ та від ВВ до АА) — відторгаються.
Тканини від обох батьківських ліній після
пересаджування гібридам першого
покоління (від АА і ВВ до (AxB)F1)
приживаються, тоді як тканини гібридів
F1 відторгаються тваринами обох
батьківських ліній (мал. 97). З цих
закономірностей випливає, що антигени
системи МНС успадковуються
кодомінантно.
Отже, виживання трансплантата залежить
від генетичної тотожності чи генетичної
відмінності донора (суб'єкт, що є
джерелом органа або тканини) і
реципієнта (суб'єкт, якому пересаджують
трансплантат), оскільки ступінь їх
генетичної спорідненості визначає ступінь антигенної спорідненості. На генетичній спорідненості
донора і реципієнта ґрунтується сучасна номенклатура трансплантатів (трансплантацій).
Розрізняють ауто-, ізо-, ало- та
ксенотрансплантати (відповідно різновиди
трансплантації) (мал. 98).
Аутотрансплантація — пересаджування
тканини (аутотрансплантата) з однієї
ділянки на іншу в однієї й тієї самої
особини.
Ізотрансплантація, або сингенна
трансплантація, — пересаджування органа
або тканини (ізотрансплантата,
синтрансплантата) від однієї особини
(індивіда) іншій, відторгнення
трансплантат. Цю реакцію називають
реакцією хазяїна проти трансплантат
(РХПТ).
У випадку пересаджування кровотворної й
лімфоїдної тканини реципієнту, що має
антигени, відсутні у трансплантаті,
трансплантовані лімфоїдні клітини донора
розвиватимуть реакцію проти чужорідних
антигенів реципієнта. Цю реакцію
називають реакцією трансплантата
проти хазяїна (РТПХ).
Останнім часом завдяки появі ефективних
імуносупресивних препаратів
трансплантація органів і тканин для заміни
хворих на здорові набула значного
поширення. Найбільшого успіху досягнуто у трансплантації нирок. Уперше в світі операцію з
пересаджування алогенної нирки на судини стегна провів професор Ю. Воронов у 1935 р. в Харкові,
а вдалу гомотипну трансплантацію цього органа — Murray в 1954 р. в США. Нині щороку в усьому
світі пересаджується понад 10 000 нирок, тривалість виживання яких упродовж 5 років становить 80
– 90 %. Досить поширеними, хоча і менш успішними (показники виживання нижчі порівняно з
нирками), є пересаджування кісткового мозку, печінки, серця, легень. Із застосуванням
імуносупресивної терапії кількість випадків відторгнення трансплантатів значно зменшилася, але
вони ще повністю не ліквідовані.
Підбір донора і реципієнта за антигенами МНС підвищує відсоток успіху трансплантації, але навіть
у разі повної сумісності за МНС, як, наприклад, між рідними братами і сестрами (сибсами),
відторгнення може бути зумовлене генетичними відмінностями за іншими локусами. Основними
підходами до подолання трансплантаційної реакції є пошуки нових, ефективніших
імуносупресивних засобів та розробка способів індукування толерантності до трансплантованих
тканин.
У цьому розділі буде розглянуто механізми трансплантаційних реакцій (РХПТ і РТПХ) та способи
їх пригнічення для запобігання відторгненню пересаджуваних органів і тканин.
17.1. РЕАКЦІЯ ВІДТОРГНЕННЯ ТРАНСПЛАНТАТА.
Реакція відторгнення розпочинається з розпізнавання імунною системою (Т-лімфоцитами)
реципієнта чужорідних антигенів (алоантигенів) трансплантата (аферентна фаза) та створення
ефекторних механізмів і закінчується атакою ними трансплантата (еферентна фаза).
17.1.1. Розпізнавання алоантигенів трансплантата Т-клітинами реципієнта.
Відторгнення алотрансплантата зумовлюється імунною реакцією реципієнта, що спрямована проти
чужорідних антигенів донора. Найсильнішими індукторами реакції відторгнення є чужорідні
молекули МНС, які можуть активувати велику кількість Т-клітин реципієнта. Як уже зазначалося
(див. розд. 7), кількість Т-клітин в організмі, специфічних до будь-якої алогенної молекули МНС і
здатних відреаґувати на неї сильніше, ніж на звичайний білок, становить від 1 до 10 %. Саме через
провідну роль у відторгненні трансплантата головний комплекс гістосумісності початкове дістав
свою назву.
Слід зазначити, що крім антигенів генетичної системи МНС відторгнення трансплантата, хоча і
повільніше, можуть зумовити антигени, що кодуються іншими генетичними локусами. Поліморфні
антигени, що зумовлюють відторгнення трансплантатів, ідентичних за МНС, називають мінорними
антигенами гістосумісності, або мінорними Н-антигенами. Мінорні Н-антигени — пептиди
поліморфних клітинних білків, що презентуються молекулами МНС клітин трансплантата.
Більшість мінорних Н-антигенів зв'язуються і презентуються молекулами МНС І, хоча у відповіді
проти ідентичних за МНС трансплантатів можуть брати участь також комплектовані з молекулами
МНС II пептиди. Одиничні мінорні Н-антигени індукують значно слабкіші порівняно з антигенами
МНС відповіді (що пов'язано з невеликою кількістю специфічних до них Т-клітин), однак реакції
проти кількох мінорних Н-антигенів можуть спричинити відторгнення трансплантата. Реакціями
проти мінорних Н-антигенів зумовлюється відторгнення трансплантатів між ідентичними за МНС
(Н-2) інбредними лініями мишей, що різняться за численними мінорними Н-антигенами, а також
між ідентичними за HLA-сибсами. Велике значення мають мінорні Н-антигени у відторгненні
кісткового мозку.
Прикладом мінорних Н-антигенів є білки, що кодуються локусами Y-хромосоми. Ці білки
експресуються лише в чоловіків і відсутні в жінок, що зумовлює розвиток відповіді імунної системи
жінки проти мінорних антигенів гістосумісності чоловіка. Що стосується мінорних Н-антигенів, що
кодуються аутосомними генами, то природа більшості їх невідома, за винятком одного, НА-2, який
є пептидом, що утворюється з білка міозину.
Імунне розпізнавання алоантигенів, що експресуються на клітинах трансплантата, здійснюється Т-
клітинами реципієнта двома способами — прямим і непрямим.
Пряме алорозпізнавання (direct allorecognition). У разі прямого алорозпізнавання наївні
алореактивні Т-клітини реципієнта розпізнають безпосередньо алогенні молекули МНС
пересадженого органа, які не ідентичні з власними МНС. Функцію презентації алоантигенів та
активації Т-клітин виконують АПК донора (раніше описані як «лейкоцити-пасажири», що
залишилися в трансплантованому органі), які мають молекули МНС класів І і II та костимуляторні
молекули (мал. 99, а). Завдяки експресії АПК молекул МНС обох класів створюються умови для
активації як CD8 Т-клітин (Т-кілерів), так і CD4 Т-клітин (Т-хелперів). Донорські АПК залишають
трансплантат і мігрують лімфою до реґіонарних лімфовузлів, де активують ті Т-клітини реципієнта,
що несуть рецептори до алогенних молекул МНС трансплантата. Припускають два можливих
механізми розпізнавання Т-клітинами алоантигенів на АПК донора: зв'язування Т-рецептора
безпосередньо з молекулою МНС, з унікальною її структурою або зі структурою, у формуванні якої
бере участь також асоційований з МНС пептид (див. розд. 7) Після активації алореактивні ефекторні
Т-клітини мігрують з кров'ю до трансплантата і безпосередньо атакують його та швидко руйнують
(мал. 100). Про роль донорських АПК у сенсибілізації свідчать експериментальні дослідження, в
яких елімінація АПК обробленням пересаджуваної тканини моноклональними антитілами
призводила до сповільненого відторгнення трансплантата. При цьому умовою відторгнення
трансплантата є наявність у ділянці трансплантації лімфовідтоку.
Необхідність лімфатичного дренажу для сенсибілізації Т-клітин було експериментально доведено в
дослідженнях з використанням природних і штучно створених імунопривілейованих місць.
Імунопривілейованими називають такі анатомічні місця в організмі, в яких пересаджений
алотрансплантат може тривало приживатися, оскільки реакція відторгнення не відбувається
внаслідок відсутності лімфатичного дренажу (передня камера ока, тестикули, мозок та ін.). Серед
них найбільш вивченою є сполучна тканина защічного мішка (дуплікатора слизової, що може
впинатися) золотистого хом'ячка.
Якщо алогенну шкіру пересадити безпосередньо в защічний мішок, то вона приживеться. Якщо
цьому самому реципієнтові пересадити шкіру на поверхню грудної клітки, то обидва трансплантати
відторгнуться за первинним типом. Тканина защічного мішка виконує роль біологічного бар'єра,
перешкоджаючи сенсибілізації реципієнта, що зумовлюється відсутністю в ній лімфатичних судин
(за наявності кровоносних). Утворені (внаслідок сенсибілізації) при пересаджуванні шкіри на
грудну клітку ефекторні фактори проникають через кровоносні судини до локалізованого в тканині
защічного мішка трансплантата і зумовлюють його відторгнення. Аналогічні результати отримані
також при створенні штучних імунопривілейованих місць — виділення у гвінейської свинки (за
допомогою чашки Петрі) шматка шкіри, який з'єднувався з твариною через судинну ніжку («пучок»
кровоносних судин). Пересаджувані на виділений шматок несумісні трансплантати відторгалися
лише після відновлення лімфатичного дренажу. Отже, при пересаджуванні шкіри сенсибілізація
реципієнта здійснюється за участю лімфатичних судин, через які донорські АПК (клітини
Лангерганса) мігрують до реґіонарних лімфовузлів, де презентують алоантигени Т-клітинам
реципієнта. Лімфатичний дренаж має першочергове значення для сенсибілізації реципієнта
антигенами трансплантата шкіри.
Непряме алорозпізнавання (indirect allorecognition). Цей спосіб розпізнавання полягає у
захопленні, процесингу алогенних білків трансплантата власними АПК реципієнта і презентації Т-
клітинам їх пептидів у комплексі з власними МНС реципієнта (мал. 99, б). Серед презентованих
АПК реципієнта пептидів є мінорні Н-антигени та пептиди, вилучені з донорських молекул МНС.
Презентація пептидів алоантигенів АПК реципієнта власним Т-клітинам і їх активація відбуваються
в реґіонарних лімфовузлах, звідки утворені алореактивні ефекторні Т-клітини мігрують до
трансплантата і руйнують його.
В експериментах на конгенних мишах встановлено, що коли з трансплантатів, які є ідентичними
реципієнту за антигенами МНС, але відмінними за мінорними Н-антигенами, елімінувати власні
АПК, то вони відторгаються швидше, ніж позбавлені власних АПК трансплантати, які ідентичні
реципієнту за мінорними Н-антигенами, але відрізняються за МНС. Повільне відторгнення
відмінних за МНС трансплантатів свідчить про те, що АПК реципієнта не можуть індукувати пряму
відповідь проти чужорідних молекул МНС трансплантата. Відторгнення цих трансплантатів, як
вважають, здійснюється, ймовірніше, внаслідок запалення, індукованого Т-клітинами,
активованими розпізнаванням пептидів алоантигенів у комплексі з МНС на АПК (макрофагах)
реципієнта.
Значення прямого і непрямого механізмів алорозпізнавання для відторгнення трансплантата
залишається невідомим Вважають, що головним індуктором гострого відторгнення є пряме
алорозпізнавання, особливо у разі
відмінностей донора і реципієнта за МНС,
оскільки воно активує велику кількість
алореактивних Т-клітин, які здійснюють
пряму цитотоксичну атаку на трансплантат.
Т-клітини, активовані непрямим
розпізнаванням алоантигенів, реалізують
дію на трансплантат опосередковано,
активуючи макрофаги та індукуючи синтез
антитіл.
17.1.2. Основний феномен
трансплантаційного імунітету.
Для вивчення реакцій відторгнення в
експерименті зазвичай мишам
пересаджують на ділянку спини
трансплантати шкіри розміром 1 см
2
.
Дослідженнями на різних тваринах
встановлено, що ауто- та ізотрансплантати
шкіри приживаються без застосування
імуносупресивної терапії.
Алотрансплантати спочатку також
приживаються, але через певний час
починають некротизуватися і відторгатися
в результаті розвитку імунних реакцій
реципієнта проти чужорідних антигенів
трансплантата.
Упродовж перших двох діб
пересаджуваний шматок шкіри зростається
краями зі шкірою реципієнта і
встановлюється кровообіг між тканинами
донора та реципієнта (васкуляризація
трансплантата) у результаті вростання в
трансплантат кровоносних судин
реципієнта. Васкуляризація трансплантата
індукується ангіогенними факторами
(ТФР). Трансплантат покривається шаром
регенерувального епітелію донора і набуває
вигляду нормальної шкіри.
Патологічні зміни в алотрансплантатах
шкіри за первинного пересаджування
зазвичай виникають через 5 — 7 діб.
Спостерігаються набряклість, інфільтрація
трансплантата лімфоцитами і моноцитами,
припинення кровотоку, крововиливи.
Трансплантат стає синюшним, твердим,
відбуваються дегенеративні зміни в
епідермісі та волосяних фолікулах. Епітелій
руйнується, дерма оголюється і висихає,
поверхня вкривається струпом. Через 10-12
діб трансплантат відмирає і не регенерує
навіть після пересаджування донору. Відповідь реципієнта на первинно пересаджену тканину, що
зумовлює її відторгнення, називають первинною реакцією відторгнення. Вона опосередковується Т-
клітинами. У мишей nude, які не мають Т-клітин, шкіра не відторгається.
За повторного пересаджування від того самого донора шкіри чи іншої тканини розвивається реакція
за типом прискореного відторгнення (second-set rejection) приблизно вдвічі швидше (через 6 —7
діб). При цьому васкуляризація трансплантата є короткочасною і швидко змінюється тромбозом
судин та некрозом. Іноді розвивається відторгнення за типом білого трансплантата (white graft),
коли процеси деструкції розпочинаються відразу після пересаджування до настання васкуляризації
трансплантата. Цю прискорену відповідь на повторно пересаджений трансплантат називають
вторинною реакцією відторгнення. Якщо цьому самому реципієнту пересадити шкіру від іншого
донора, то відторгнення розвивається не прискорено, а як первинна реакція відторгнення.
Підсилення реакції на повторне пересаджування трансплантатів від того самого донора та
прискорення термінів їх відторгнення стали підставою для висновків, що основою цього явища є
імунні механізми. У 1944 р. імунну природу реакцій відторгнення трансплантата вперше
експериментально довів П. Медавар.
Прискорений розвиток вторинної реакції відторгнення може бути відтворений у нормальної,
інтактної або опроміненої тварини перенесенням їй Т-клітин від реципієнта, який відторгнув
попередньо пересаджений трансплантат. Такий спосіб перенесення трансплантаційного імунітету
називають адоптивним, і він свідчить про імунну специфічність реакції відторгнення. Під час
первинного пересаджування відбувається імунізація реципієнта антигенами донора, утворення
клітин пам'яті, які зумовлюють прискорене (за типом вторинної відповіді) відторгнення повторно
пересадженого трансплантата.
17.1.3. Механізми відторгнення трансплантата.
За алогенної трансплантації між реципієнтом і пересадженою тканиною розвивається імунний
конфлікт. Інтенсивність його переважно залежить від ступеня відмінностей за антигенами
гістосумісності та реактивності реципієнта, від кількості антигенів гістосумісності в
трансплантованій тканині.
На відмирання і відторгнення трансплантата впливає розвиток судинних анастомозів між
трансплантатом і тканиною реципієнта. Чим інтенсивніше васкуляризується алогенний
трансплантат, тим швидше він відторгається. Це наочно демонструється в експерименті з
пересаджування трансплантата в передню камеру ока. Оскільки рогівка ока прозора, можна бачити,
що руйнування трансплантата збігається з моментом проростання судин.
Відторгнення трансплантата (еферентна ланка трансплантаційного імунітету) зумовлюється
ефекторними механізмами, що сформувалися внаслідок сенсибілізації реципієнта антигенами
донора. Для з'ясування ролі клітиноопосередкованих та антитілоопосередкованих механізмів у
відторгненні алогенних трансплантатів в експериментальній трансплантації використовувалися
різні методичні прийоми. На ранніх етапах досліджень здійснювали пересаджування тканин у
мікродифузійних камерах, крізь пори яких проходять антитіла, але не клітини. Інший підхід полягав
у введенні реципієнту готових імунних факторів — антитіл (сироватки) чи ефекторних лімфоїдних
клітин, специфічних до антигенів трансплантата (попередньо отриманих від тварин, в яких уже
відбулося відторгнення трансплантата), і наступному пересаджуванні йому тканини без камери.
Прискорене (за типом вторинної відповіді) відторгнення трансплантата у реципієнта з введеним
йому певним ефекторним фактором свідчить про провідну роль останнього в трансплантаційному
імунітеті.
Останнім часом трансплантації проводять на реципієнтах з вибірково виснаженими популяціями
(субпопуляціями) власних лімфоцитів уведенням їм цитотоксичних моноклональних антитіл, а
також на мишах, нокаутних за лімфоїдними клітинами або за їх ефекторними молекулами. Інша
експериментальна модель — уведення безтимусним мишам або тимектомованим реципієнтам
несенсибілізованих або сенсибілізованих антигенами трансплантата субпопуляцій Т-лімфоцитів
(CD4 або CD8 Т-клітин).
Виявилося, що відторгнення алотрансплантатів можуть зумовлювати як клітинні ефекторні
механізми, так і механізми за участю антитіл. При цьому вирішальне значення у відторгненні мають
69
клітинні реакції, які можуть опосередковуватися цитотоксичними CD8 Т-клітинами, Тх1-клітинами
або клітинами обох типів. Участь антитіл у відторгненні значною мірою визначається як природою
трансплантата, так і ступенем сенсибілізації організму реципієнта до алоантигенів донора. В
експериментах з використанням мікродифузійних камер показано, що антитіла руйнують первинно
пересаджувані так звані дисоційовані трансплантати (клітини кровотворної й лімфоїдної тканин) і
не спричинюють істотного пошкоджувального впливу на солідні трансплантати. Зазначимо, що у
разі пересаджування солідних трансплантатів мішенню дії антитіл є судинний ендотелій. Антитіла
лише за певних умов можуть зумовити відторгнення первинно пересаджуваних солідних
трансплантатів. Однак їхня роль значно зростає за повторного пересаджування, оскільки організм
реципієнта вже сенсибілізований до антигенів донора і відповідь на трансплантат розвивається за
вторинним типом. У клінічних спостереженнях доведено, що у разі попередньої сенсибілізації
(природної чи індукованої внаслідок певних клінічних маніпуляцій) реципієнта алоантигенами і
наявності в його крові специфічних антитіл останні можуть відігравати провідну роль у реакції
відторгнення.
Реакцію відторгнення алотрансплантата в клініці називають кризом відторгнення. За клінічною
картиною і швидкістю розвитку кризу розрізняють три типи відторгнення — надгостре, гостре,
хронічне кожний з яких характеризується певними імунними особливостями.
Надгостре відторгнення. Відторгнення цього типу розвивається дуже швидко — від кількох
хвилин до кількох годин після трансплантації. Причиною відторгнення є преформовані
(передіснуючі) антитіла до антигенів груп крові та антигенів МНС. На відміну від природних
гемаглютинінів до антигенів системи АБО антитіла до антигенів системи МНС (HLA) у людей в
нормі не трапляються. Вони можуть утворюватися внаслідок попередніх трансплантацій,
гемотрансфузій, вагітності або після лікування програмним діалізом.
На моделі надгострого відторгнення серця у щурів показано, що після попереднього руйнування
комплементу введенням реципієнту фактора отрути кобри трансплантат не відторгається до
моменту відновлення звичайного його рівня в крові. Це свідчить про участь у надгострому
відторгненні антитіл і комплементу. В процесі розвитку реакції відторгнення рівень імуноґлобулінів
і комплементу в крові реципієнта знижується, а їх відкладання можна виявити в судинах
відторгнутого трансплантата імунофлуоресцентним методом.
Преформовані антитіла можуть зумовити дуже швидке відторгнення васкуляризованих
трансплантатів, реагуючи з антигенами на поверхні судинних ендотеліоцитів. Утворені комплекси
антиген — антитіло зв'язують та активують комплемент і активують систему згортання крові.
Пошкодження ендотелію відбувається за механізмом комплементзалежного лізису або
комплементзалежного імунного запалення. В результаті запалення відбувається активація
тромбоцитів, відкладання фібрину, утворення тромбів у судинах та крововиливи в тканину. Ці
процеси призводять до порушення мікроциркуляції й кровопостачання трансплантата, його
відмирання і відторгнення. Терапевтичних засобів для призупинення надгострого відторгнення
немає.
Слід зазначити, що у більшості людей є антитіла, здатні реагувати з антигенами ендотелію інших
ссавців і спричинювати надгостре відторгнення трансплантованих від них органів. Це розглядається
як найістотніша перешкода для використання ксенотрансплантатів, зокрема від свиней, які є
найбільш придатним потенційним джерелом органів для людини. Проблема надгострого
відторгнення під час ксенотрансплантацій є особливо актуальною (порівняно з
алотрансплантаціями), оскільки у зв'язку з існуванням міжвидового бар'єра
комплементрегулювальні білки, що експресуються ендотеліальними клітинами трансплантата, не
можуть захистити їх від атаки комплементу людини. Зауважимо, що людські Т-лімфоцити
розвивають слабшу імунну відповідь на ксеногенні антигени МНС, ніж на алогенні молекули МНС.
Гостре відторгнення. Цей тип відторгнення розвивається впродовж кількох днів або тижнів (до
трьох тижнів) після трансплантації і
виникає за відсутності або недостатньої
імуносупресивної терапії. Первинною й
основною причиною відторгнення є Т-
клітинний імунітет, хоча пізніше (коли
терміни відторгнення подовжуються) в
реакцію можуть залучатися також інші
ефекторні механізми. У руйнуванні
трансплантата можуть бути задіяні всі
відомі ефекторні механізми імунного
запалення, як залежні від Т-хелперних
клітин (реакції за участю Т-кілерів,
макрофагів, еозинофілів), так і
антитілозалежні (активація комплемента,
АЗКЦ) (мал. 101).
Клітиноопосередкована відповідь на
алотрансплантат здійснюється за участю
CD8T-клітин та СD4Т-клітин. У
механізмах відповіді можуть
превалювати ознаки цитотоксичної
реакції або поєднуватися її прояви з
рисами запалення, характерного для
сповільненої гіперчутливості. Як вже
зазначалося, головним індуктором
гострого відторгнення є пряме
алорозпізнавання, особливо у разі
відмінностей донора і реципієнта за
антигенами МНС, які індукують велику
кількість алореактивних Т-клітин,
здатних прямо розпізнавати МНС
трансплантата. Антигени МНС класів І і
II презентуються CD8 і CD4 Т-клітинам
реципієнта АПК донора, тобто клітинами
Лангерганса при трансплантації шкіри та
інтерстиціальними ДК («клітинами-
пасажирами») при трансплантації
органів.
Гостре відторгнення характеризується
широкомасштабною інфільтрацією
трансплантата мононуклеарними
клітинами (лімфоцитами, моноцитами,
макрофагами, плазмоцитами), серед яких
переважають Т-лімфоцити. Утворені в
регіонарних лімфовузлах ефекторні Т-
клітини потрапляють у циркуляцію,
проникають у трансплантат й індукують реакції, що призводять до його відторгнення. У
відторгненні трансплантата беруть безпосередню участь як CD4, так і CD8 Т-клітини. Важливими
доказами ролі цитотоксичних CD8 Т-лімфоцитів у руйнуванні клітин трансплантата є переважання
цих клітин в інфільтратах; виявлення в біопсійному матеріалі мРНК перфорину та гранзимів;
можливість адоптивного перенесення гострого відторгнення алореактивними CD8 Т-клітинами.
CD8 Т-клітини (Т-кілери) здійснюють безпосередню цитотоксичну дію на клітини трансплантата.
Цитотоксичний ефект підсилюється завдяки участі у руйнуванні трансплантата природних кілерів,
стимулом до активації яких є відсутність на поверхні клітин-мішеней молекул МНС класу І хазяїна.
Підтвердженням ролі CD4 Т-лімфоцитів у відторгненні трансплантата є можливість гострого
відторгнення у мишей, нокаутних за CD8 Т-клітинами чи перфорином, та у реципієнтів, яким
здійснювали адоптивне перенесення алореактивних СD4Т-клітин. CD4 Т-клітини (Тх1)
опосередковують реакцію за типом ГСТ, основою якої є залучення й активація макрофагів та
розвиток місцевого запалення. В результаті запальної реакції виникає закупорення (тромбоз) судин,
що призводить до порушення живлення та некрозу тканин.
Експериментальні дослідження свідчать про те, що провідну роль в ініціюванні (і регуляції) реакції
гострого відторгнення відіграють СD4-клітини субпопуляції Тх1, активовані алогенними
молекулами МНС II на АПК донора. Продуковані Тх1 цитокіни беруть участь у запуску різних
ефекторних механізмів. Так, ІЛ-2 сприяє активації ЦТЛ, а ІФН-γ стимулює НК-клітини, підвищує
активність АПК і разом з ФНП-β активує макрофаги. Крім того, ІФН-γ сприяє підсиленню реакції
відторгнення завдяки підвищенню експресії молекул МНС II на судинному ендотелії та індукує
появу молекул МНС класів І і II на паренхіматозних клітинах. ІФН-γ та ФНП-β підвищують також
експресію молекул адгезії на ендотелії, які забезпечують прилипання лейкоцитів, що циркулюють у
крові, до стінки судин під час трансендотеліальної міграції.
У формуванні запального інфільтрату беруть участь також синтезовані місцеве хемокіни (CXCL5,
CXCL8, CCL2). Отримано докази кореляції експресії CXCL8 і хемокіну CINC та гострого
відторгнення трансплантата. Експресія високого рівня CXCL8 (на рівні мРНК та білка) під час
трансплантації нирок і серця в людини збігалася в часі з ознаками відторгнення органів, і рівень
його значно знижувався після досягнення імуносупресії. Аналогічно рівень хемокіну CINC у щурів
(гомолог GRO-α людини і КС мишей) зростав, починаючи з третьої доби після трансплантації
печінки, значно підвищуючись упродовж наступних 7 діб, а попереднє введення реципієнту
імуносупресанту FK-506 зумовлювало значне зниження рівня хемокіну. Гостре відторгнення
можуть зумовити також антитіла. Це можливо тоді, коли у реципієнта антитіла утворюються до
антигенів стінок судин трансплантата, зв'язуються зі стінками та активують комплемент.
Розвивається гостре запалення, що зумовлює некроз стінок судин без тромбозу.
Хронічне відторгнення. В умовах імуносупресивної терапії та у разі наявності відмінностей між
донором і реципієнтом за слабкими (мінорними) антигенами гістосумісності процес відторгнення
трансплантата може затягуватися на багато місяців і навіть років. Таке хронічне відторгнення може
зумовлюватися як гуморальними, так і клітиноопосередкованими реакціями з млявим перебігом. На
нокаутних мишах показано, що CD4 Т-клітини та В-лімфоцити відіграють важливішу роль у
хронічному відторгненні, ніж CD8 Т-клітини.
Пошкодження трансплантата клітинною реакцією пов'язане з інфільтрацією судин та тканини
макрофагами, які на ранній стадії залучаються (у формі моноцитів) за допомогою хемокінів (CCL5
— RANTES та ін.) алореактивними CD4 Т-лімфоцитами (Тx1) та активуються секретованими ними
цитокінами (ІФН-γ), а пізніше рекрутування їх посилюється під впливом продуктів самих
макрофагальних клітин (ІЛ-1, ІФН-α, хемокіну CCL2 – MCP-1). Цитокіни зумовлюють хронічне
запалення, що призводить до розвитку концентричного атеросклерозу кровоносних судин
трансплантата — характерної ознаки хронічного відторгнення. Показано, що в ІФН-γ-дефіцитних
реципієнтів атеросклероз судин не розвивається. Клітинна інфільтрація за хронічного відторгнення
на відміну від гострого виражена слабко.
Важливу (нерідко провідну) роль у патогенезі хронічного відторгнення відіграють антитіла та
комплекси антиген — антитіло, але через низьку їх концентрацію масивні фібринові тромби в
судинах, що характерні для надгострого відторгнення, не утворюються. Однак фібрин утворюється,
але, очевидно, відразу лізується, про що свідчить підвищення в сечі продуктів його розщеплення.
Імунні реакції супроводжуються активацією і пошкодженням ендотелію та звільненням різних
факторів росту (серед них велике значення має ТФР-β), з активністю яких пов'язані розвиток і
регуляція двох основних ознак хронічного відторгнення — рубцювання тканини (фіброз) та
закриття просвіту судин (облітерація) трансплантата. Облітерація кровоносних судин відбувається
внаслідок розмноження гладком'язових клітин інтими, що мігрували в судинну стінку, та
відкладання компонентів матриксу. Поступове зменшення кровопостачання і заміщення паренхіми
фіброзною тканиною призводить до згасання аж до повної втрати функції трансплантата.
17.2. РЕАКЦІЯ ТРАНСПЛАНТАТ ПРОТИ ХАЗЯЇНА.
Особлива ситуація виникає під час трансплантації кровотворної тканини (кісткового мозку),
оскільки в клінічній практиці її переважно здійснюють імунонекомпетентним (або зі зниженою
реактивністю) реципієнтам. Кровотворна тканина містить зрілі лімфоїдні клітини, і за умови
ослаблення імунної реактивності реципієнта вони можуть розвивати спрямовану проти нього
реакцію, яку називають реакцією трансплантат проти хазяїна (РТПХ). У процесі цієї реакції
трансплантат відторгає організм реципієнта, зумовлюючи його виснаження і навіть загибель. У 1957
р. РТПХ було відтворено у різних лабораторіях і на різних генетичних системах, але прояви цієї
реакції в експериментах спостерігали значно раніше. У 1916р. І. Murphy спостерігав, що після
нанесення на хоріоналантоїсну мембрану курячого ембріона клітин кісткового мозку або селезінки
дорослих курей на мембрані з'являлися скупчення лейкоцитів у вигляді білуватих плям і в ембріонів
виникала спленомегалія (збільшення маси селезінки). Слід зазначити, що синдром розвивався лише
після введення клітин дорослих птахів. М. Сімонсен (1957) припустив, що цим феноменом є РТПХ.
Він уперше відтворив хворобу, що розвивалася як наслідок РТПХ, після внутрішньовенного
введення 16-денним курячим ембріонам алогенних клітин селезінки дорослих курей. Через кілька
діб після вилуплення у реципієнтів розвивалася анемія, відмічалося збільшення маси селезінки і
печінки та інші патологічні зміни й вони гинули впродовж одного – двох тижнів (феномен
Сімонсена). Виявлено приживання донорських клітин та колонізацію ними лімфоїдних органів
реципієнта. З явищем РТПХ у ссавців уперше зіткнувся П. Медавар у 1953 р. під час відтворення
трансплантаційної толерантності у мишей, спостерігаючи загибель більшості ембріонів після
введення їм алогенних лімфоїдних клітин, однак розцінив це як невдалу спробу відтворення
толерантності. Через кілька років (1957) співробітники П. Медавара — Р. Біллінгхем і Л. Брент
(учасники експериментів відтворення толерантності) — індукували РТПХ у результаті
трансплантації новонародженим мишам алогенних клітин селезінки дорослих тварин та описали
супутню цій реакції хворобу. У реципієнтів клітин розвивалося захворювання, відоме під назвою
«хвороба рант» (runt diseases) — карликовість (малорослість). Основними проявами рантингу в
мишей є затримка росту і відставання приросту маси тіла, пронос, дерматити. Хвороба
супроводжується клітинним, або кров'яним, химеризмом — співіснуванням в організмі клітин
різних генотипів унаслідок наявності донорських клітин. Спостерігаються гістологічні зміни в
органах і тканинах: осередки некрозу в печінці та осередки екстрамедулярного кровотворення в
селезінці, гіперплазія кісткового мозку, стоншення епідермісу та відділення його від дерми,
інфільтрація дерми одноядерними клітинами (лімфоцитами, гістіоцитами, плазмоцитами).
Однією з характерних ознак хвороби є спленомегалія, що зазвичай виявляється після
внутрішньовенного введення клітин (системна РТПХ). Збільшується також маса лімфатичних
вузлів, що особливо чітко виявляється після підшкірного або внутрішньом'язового введення клітин
у ступню кінцівки (локальна РТПХ). З урахуванням цього РТПХ в експерименті оцінюють за
збільшенням маси селезінки або лімфатичних вузлів, визначаючи індекс РТПХ. У разі системної
РТПХ цей показник (селезінковий індекс) є відношенням маси селезінки до загальної маси тіла
тварини і дорівнює 1,5 — 2,5 (отримані дані множать на 100, щоб уникнути дробових чисел), тоді як
у нормі він менший за 1. Для оцінювання локальної РТПХ реципієнту — гібридній миші (АхВ) F1 в
ступню однієї задньої кінцівки вводять лімфоїдні клітини одного з батьків, А або В (дослід), а в
ступню протилежної кінцівки – сингенні клітини гібрида (контроль). Через 7 діб визначають індекс
РТПХ як відношення маси підколінного (або пахового) дослідного лімфовузла до маси підколінного
(або пахового) контрольного лімфовузла. За позитивної реакції значення індексу становить від 1,5
до 10, а в нормі дорівнює 1.
У дорослих реципієнтів (тварин, людини) хвороба, що виникає як наслідок РТПХ, називається
алогенною хворобою, оскільки вона зумовлена алогенним трансплантатом. Прояви цієї хвороби
подібні до проявів хвороби рант, за винятком затримки росту. Це захворювання може розвинутися
після трансплантації не лище алогенних, а й ксеногенних лімфоїдних клітин, з врахуванням чого
було запропоновано називати всі його різновиди трансплантаційною хворобою (А. С. Шевельов,
1976). Останнім часом для позначення цього захворювання використовують (особливо в іноземній
літературі) термін хвороба трансплантат проти хазяїна (ХТПХ).
У дорослих тварин РТПХ і супутня їй хвороба відтворені на різних генетичних системах, які будуть
описані нижче. Однак в усіх випадках для розвитку цієї реакції як в ембріонів і новонароджених,
так і в дорослих тварин необхідні однакові принципові умови.
17.2.1. Умови відтворення РТПХ.
Як уже зазначалося, РТПХ відтворюється за трансплантації алогенної кровотворної та лімфоїдної
тканини. Трансплантовані клітини містять чужорідні антигени гістосумісності, здатні індукувати
імунні реакції реципієнта, а також зрілі лімфоїдні клітини, що можуть, у свою чергу, здійснювати
реакції проти антигенів реципієнта. Тому РТПХ розвивається за певних умов.
1. Трансплантат має містити достатню кількість лімфоїдних клітин, що здатні розпізнавати антигени
реципієнта і реагувати проти них. Найактивнішими в РТПХ є клітини лімфатичних вузлів.
Активність лімфоцитів інших лімфоїдних органів і тканин знижується у такій послідовності:
лімфатичний вузол → селезінка → кров → тимус → кістковий мозок.
2. Реципієнт має бути чужорідним в антигенному відношенні для імунокомпетентного донора, тобто
містити антигени, яких немає в трансплантаті. Реакція відбувається у разі відмінності донора і
реципієнта як за антигенами МНС класів І і II, так і за кількома мінорними Н-антигенами. Реакція
розвивається після трансплантації кісткового мозку між сибсами, які зазвичай відрізняються один
від одного за багатьма мінорними Н-антигенами.
3. Основною умовою розвитку РТПХ є знижена здатність реципієнта відторгати трансплантовані
клітини. Ареактивність реципієнта може бути зумовлена різними причинами. Зважаючи на це,
розрізняють кілька форм РТПХ.
Основні форми РТПХ. РТПХ в ембріонів і новонароджених відносно легко відтворюється в
результаті незрілості імунної системи. За цієї умови відтворено описані вище феномен Сімонсена в
курячих ембріонів і хвороба рант у новонароджених мишей.
РТПХ у гібридів. У дорослих реципієнтів РТПХ легко відтворюється, коли вони генетично не
можуть здійснювати реакцію — при введенні гібридам (C57BLxCBA) F1 лімфоїдних клітин
(найчастіше лімфатичних вузлів) одного з батьків (СВА або C57BL). Гібриди F1 не реагують проти
антигенів трансплантата, оскільки в їхньому організмі містяться антигени обох батьків, тоді як
введені клітини одного з батьків можуть
реагувати проти антигенів іншого батька,
що експресовані в тканині гібрида (мал.
102).
Гібриди інбредних ліній мають природну
генетично зумовлену толерантність до
антигенів батьківських ліній, тому вони
не відторгають тканини батьків. Ця
генетична система, запропонована
Шварцом і співавторами (1957), є
найкращим способом відтворення РТПХ.
Однак навіть у цій системі реакція легко
відтворюється на гібридах-сисунках, а в
дорослих гібридів — після опромінення
їх сублетальними дозами радіації, яка
значною мірою руйнує їхню власну
лімфоїдну тканину.
РТПХ у реципієнтів зі штучною
толерантністю. У дорослих тварин У
разі двосторонньої генетичної
несумісності донора і реципієнта РТПХ
можна відтворити за умови індукування
у реципієнта в період ембріонального розвитку або відразу після народження толерантності до
антигенів гістосумісності донора. Для успішного індукування толерантності та зменшення загибелі
ембріонів (унаслідок РТПХ) зазвичай вводять частково несумісні клітини, наприклад тваринам
батьківської лінії А клітини гібридів (АхВ) F1. Дорослі тварини, що розвинулися з таких ембріонів,
не відторгають клітини лінії В, але ці клітини розвивають РТПХ проти алоантигенів А.
РТПХ у смертельно опромінених реципієнтів. У дорослих тварин у разі двосторонньої генетичної
несумісності донора і реципієнта РТПХ відтворюється за умови смертельного опромінення
реципієнта, яке руйнує кровотворну і лімфоїдну його тканини. Якщо опроміненому смертельною
дозою дорослому реципієнту трансплантувати алогенний кістковий мозок, він приживається і
заміщує уражену кровотворну тканину. У таких тварин, названих радіохимерами, клітини крові
мають донорське походження. У повних химер усі 100 % клітин крові (еритроцитів, лейкоцитів)
походять із клітин кісткового мозку донора, тоді як усі інші клітини (різних органів і тканин) мають
генотип реципієнта. В організмі химер формується толерантність до антигенів донора. Тому
радіохимери є зручною моделлю для вивчення механізмів індукування імунної толерантності.
Трансплантацію кісткового мозку застосовують як спосіб лікування променевої хвороби, однак у
більшості випадків урятований організм гине через два-три тижні або значно пізніше від зумовленої
РТПХ вторинної алогенної хвороби. При цьому під первинною хворобою мають на увазі наслідки
самого опромінення.
17.2.2. Механізми РТПХ і патогенез хвороби ТПХ.
У механізмах РТПХ і в патогенезі зумовленої нею хвороби (хвороби ТПХ, або ХТПХ) основну роль
відіграють Т-клітиноопосередковані реакції та секретовані Т-клітинами (та іншими клітинами)
цитокіни.
Реакція трансплантат проти хазяїна ініціюється наявними в кістковому мозку Т-клітинами, які
розпізнають алоантигени хазяїна. Індукторами реакції можуть бути як антигени МНС, так і мінорні
Н-антигени. Однак у людей переважно розвивається реакція проти мінорних Н-антигенів, оскільки
трансплантація зазвичай не проводиться, якщо донор і реципієнт відрізняються за МНС.
Експериментальними дослідженнями показано, що розвиток зумовленої РТПХ хвороби призводить
до значних патологічних змін в організмі реципієнта. Для патогенезу хвороби характерні фазні
зміни в лімфоїдній тканині, які найбільш виражені при гострій формі захворювання, що
розвивається після внутрішньовенного (або внутрішньочеревного) введення великих доз лімфоїдних
клітин і закінчується загибеллю більшої частини тварин. У ранню фазу ХТПХ спостерігається
інтенсивна проліферація клітин у лімфоїдній тканині, що призводить до значного збільшення маси
лімфатичних вузлів, селезінки і печінки. У цей період реєструється найбільш виражена форма
спленомегалії, але виникнення її не зумовлюється збільшенням загальної кількості клітин, оскільки
одночасно з проліферацією клітин у селезінці відбувається деструкція лімфоїдних фолікулів.
Ймовірно, що спленомегалія зумовлюється збільшенням розмірів клітин унаслідок перетворення
лімфоцитів на великі бластні форми і набряком органа.
У пізню фазу захворювання відбувається поступове зниження проліферативної активності клітин,
що пов'язано з виснаженням клонів донорських лімфоцитів у результаті реакції проти надмірної
кількості антигенів реципієнта і з руйнуванням клітин реципієнта. Заміщення втрат зруйнованих
власних лімфоїдних клітин утворенням нових у зв'язку зі зниженням лімфопоезу не компенсується.
Розвивається значна атрофія лімфоїдної тканини реципієнта. В лімфатичних вузлах і селезінці у
лімфоїдних фолікулах збільшується кількість гістіоцитарних та зменшується кількість лімфоїдних
клітин аж до повного виснаження лімфоїдної тканини. В тимусі атрофічні процеси розвиваються
вже через 10 діб, тобто у період максимального збільшення маси селезінки, а через 25 — 40 діб
залозу важко виявити на аутопсії. Атрофія лімфоїдної тканини призводить до пригнічення імунної
реактивності, внаслідок чого різко знижується резистентність до мікробів, у тому числі й до
представників аутофлори. Виникають тяжкі аутоінфекції, які нерідко супроводжуються
аутоімунними процесами. Інфекції часто є причиною загибелі реципієнтів. За гострої форми
хвороби спостерігається також некроз слизової оболонки кишок та утворення виразок. Як результат
ураження кровотворних клітин та аплазії кісткового мозку розвивається гемолітична анемія, іноді
виникають лейкопенія і тромбоцитопенія. Загибель реципієнта настає через 1 — 2 міс.
За певних умов, зокрема після введення невеликих доз лімфоїдних клітин, може розвиватися
хронічна форма ХТПХ. Цю форму хвороби найдокладніше вивчено у гібридів при трансплантації
клітин батьківської лінії, оскільки в їхньому організмі створюються умови для розвитку тривалого
імунного конфлікту. Для неї характерний тривалий інкубаційний період, слабкі прояви клінічних
симптомів та відносно низька смертність. За хронічної хвороби спостерігається більшість симптомів
гострої хвороби, але основними ознаками її є: зниження маси тіла, латергія, сколіоз, скуйовдження
шерсті, облисіння, набряк морди, гіпотермія. В крові відмічаються анемія, лейкопенія,
тромбоцитопенія, зниження вмісту гемоглобіну. У частини тварин, що довго хворіють, розвивається
тяжкий гломерулонефрит, що подібний до гломерулонефриту при імунних комплексах,
виявляються анти-МНС-антитіла, відмічається надлишок виділення кортикостероїдів, що
70
призводить до зниження резистентності до інфекцій. Головною особливістю хронічної хвороби
ТПХ у дорослих гібридів, що відрізняє її від гострої, є відсутність атрофії лімфоїдної тканини,
зокрема тимуса, і наявність чітко вираженої лімфоїдної гіперплазії.
У людини зумовлена РТПХ хвороба розвивається після трансплантації алогенного кісткового мозку
для заміщення власного, зруйнованого внаслідок опромінення під час радіаційних аварій або
введення цитотоксичних препаратів з лікувальною метою, наприклад при лейкемії. Хвороба ТПХ
може мати гострий і хронічний перебіг. Гостра ХТПХ виникає у понад половини реципієнтів з
другої декади впродовж 100 днів від пересаджування кісткового мозку. Основні симптоми хвороби
пов'язані з ураженням шкіри, слизових оболонок, печінки, що виявляється появою в них запальних і
некротичних осередків, масивним руйнуванням епітеліальних клітин. Симптоми хронічної хвороби
з'являються у частини реципієнтів (20 — 30 %) впродовж року після пересаджування. Ризик
виникнення хронічної хвороби зростає після кількаразово (більше двох) перенесеної гострої.
Хронічна ХТПХ спричинює гематологічний розлад (порушення гемо- і лімфопоезу) з наступним
розвитком імунодефіциту — Т-клітинної недостатності. Хвороба часто супроводжується розвитком
інфекцій та лімфопроліферативних процесів, які можуть бути причиною смерті реципієнтів.
Ефекторні клітини, що зумовлюють руйнування тканин, зокрема епітелію слизових оболонок кишок
та шкіри, нині вивчені ще недостатньо. Прийнято вважати, що головними клітинами,
відповідальними за руйнування тканин, є запальні клітини хазяїна, які залучаються у місце розвитку
реакції цитокінами, що продукуються активованими CD4 Т-клітинами (Тх1) донора. Залучені
клітини, активуючись, також продукують цитокіни. Секретовані задіяними в запальній реакції
клітинами цитокіни підтримують їх проліферацію й індукують апоптоз клітин епітелію. Під час
гістологічних досліджень виявляються НК-клітини, які щільно прилягають до епітеліоцитів, що
гинуть. Можливо, природні кілери є важливими ефекторними клітинами РТПХ.
Розвиток РТПХ супроводжується ушкодженням кровотворної тканини. На моделі РТПХ,
індукованої введенням гібридам F1 клітин кісткового мозку батьківської лінії, показано, що РТПХ
знижує кількість КУО в селезінці. Стовбурові кровотворні клітини і Т-лімфоцити є первинними
мішенями активованих ЦТЛ. Утворені донорські ЦТЛ руйнують СКК і Т-лімфоцити реципієнта,
тому РТПХ у гібридів F1 розглядають як аналог односпрямованої реакції в змішаній культурі
лімфоцитів in vivo. РЗКЛ — спрощений феномен загального стану інтенсивності РТПХ.
Слід зазначити, що РЗКЛ in vivo, незважаючи на безсумнівну шкоду її для здоров'я реципієнта, може
мати в певних випадках, зокрема при лейкемії, деякий терапевтичний ефект. Т-клітини донорського
кісткового мозку, розпізнаючи мінорні Н-антигени або пухлиноспецифічні антигени, що
експресовані на лейкозних клітинах реципієнта, активуються і вбивають ці клітини (модель
трансплантат проти лейкемії). Елімінація Т-клітин з кісткового мозку хоча і має переваги для
реципієнта, але зменшує ефект трансплантат — проти лейкемії.
Видалення Т-клітин з кісткового мозку перед трансплантацією є одним із способів пригнічення
РТПХ, однак при цьому знижується можливість приживання трансплантата. Вважають, що механізм
цього феномену пов'язаний з тим, що зрілі Т-клітини продукують цитокіни, передусім КСФ, які
сприяють відновленню популяції СКК. Тому нині під час трансплантації кісткового мозку
проводять видалення Т-клітин з одночасним додаванням Г-КСФ і М-КСФ, які сприяють
приживанню трансплантата.
В останні роки для відновлення кровотворної системи застосовують трансплантацію СКК
(аутологічних або алогенних), виділених з периферичної крові, з використанням МкАТ анти-СD34
та стимульованих для збільшення їх кількості цитокінами (КСФ). При цьому відновлення гемопоезу
відбувається швидше, ніж у разі трансплантації кісткового мозку.
17.3. ПОДОЛАННЯ ТРАНСПЛАНТАЦІЙНОГО ІМУНІТЕТУ.
Подолання тканинної несумісності під час пересаджування органів і тканин у клініці досягається
підбором донора та пригніченням імунних реакцій реципієнта.
17.3.1. Підбір донора.
Для трансплантації здійснюють підбір донора, найбільш сумісного за антигенним набором з
реципієнтом. Під час підбору пар донор — реципієнт враховують такі показники: сумісність за
антигенами систем AB0, Rh та HLA, наявність у реципієнта преформованих антитіл до антигенів
донора. Підбір донора, сумісного за антигенами системи АВ0, має особливо велике значення для
трансплантації нирки.
Основний метод підбору донора — визначення антигенів системи HLA in vitro (HLA-типування). Як
уже зазначалося у розд. 5, система HLA контролюється трьома локусами генів (HLA-A, HLA-B,
HLA-C), які кодують антигени HLA класу І, та трьома локусами генів (HLA-DR, HLA-DQ, HLA-
DP), що кодують антигени HLA класу II. Визначення антигенів HLA донора і реципієнта дає змогу
встановити ступінь їх HLA-сумісності, отже, передбачити наслідки трансплантації.
Оцінити ступінь HLA-сумісності донора і реципієнта можна двома способами — вимірюванням
реакції між їхніми лімфоцитами (реакція у змішаній культурі лімфоцитів — РЗКЛ) та проведенням
серологічного визначення антигенів. Антигени HLA класу І визначають за допомогою
діагностичних анти-НLА-сироваток серологічними методами, а антигени HLA класу II — ще й
клітинними тестами, зокрема РЗКЛ.
Змішана культура лімфоцитів. Реакція змішаних лімфоцитів широко використовується для
виявлення алоантигенів лімфоцитів. Суміш лімфоцитів донора і реципієнта культивують in vitro
впродовж кількох (від 3 до 5) діб. Якщо лімфоцити донора містять Т-клітини, специфічні до
алоантигенів, експресованих на клітинах реципієнта, то вони будуть активуватися і
розмножуватися. Аналогічно Т-клітини реципієнта реагуватимуть на алоантигени на клітинах
донора. Описаний варіант реакції за двосторонньої гістонесумісності донора і реципієнта називають
двоспрямованою реакцією в ЗКЛ.
Частіше використовують односпрямовану реакцію в ЗКЛ, в яку клітини однієї особини вводять
інтактними, їх називають реагуючими, а клітини іншої особини пригнічують йонізуючим
випромінюванням або мітоміцином С. Оброблені таким способом клітини втрачають здатність
синтезувати ДНК і розмножуватися, зберігаючи здатність стимулювати інші клітини, їх називають
стимулювальними. У разі трансплантації солідних тканин у ЗКЛ пригнічуються клітини донора,
отже, перевіряється реактивність лише клітин реципієнта проти алоантигенів донора. При
трансплантації кісткового мозку реципієнту з пригніченою імунною системою мітогенним
інгібітором обробляють клітини реципієнта і таким чином перевіряють реактивність лише клітин
донора.
За допомогою ЗКЛ можна не лише виявляти алоантигени, а й визначати їх, інкубуючи тест-клітини
з гомозиготними стимулювальними клітинами (лімфоцитами) відомої HLA ІІ-специфічності, які
несуть відомі антигени HLA-DP, HLA-DQ і HLA-DR від гомозиготних за ними донорів. Якщо тест-
клітини не реагують бласттрансформацією і проліферацією на стимулювальні клітини певного типу,
то це свідчить про те, що вони несуть антиген цієї специфічності. Отже, ЗКЛ дає змогу оцінити
сумісність донора і реципієнта без аналізу антигенів HLA та виявити відмінності за антигенами
HLA-DQ, і особливо HLA-DP, які не виявляють серологічними методами в зв'язку зі складністю
отримання діагностичних сироваток до них.
Реакція в ЗКЛ трактується як відповідь in vitro Т-лімфоцитів на алоантигени HLA. В ЗКЛ CD4 Т-
клітини стимулюються антигенами HLA класу II на макрофагах, В-лімфоцитах, ДК і розвивають
проліферативну відповідь, яку оцінюють за включенням
3
Н-тимідину. Реакція ЗКЛ супроводжується
також активацією CD8 Т-клітин антигенами HLA класу І, які диференціюються на ЦТЛ, здатні
вбивати клітини-мішені. Кілерний ефект Т-клітин можна протестувати у пробі
лімфоцитотоксичності in vitro з міченими
51
Сr лімфоцитами-мішенями. Цитотоксичний ефект
генерованих у ЗКЛ Т-кілерів визначають за вивільненням
51
Сr з клітин-мішеней.
ЗКЛ є індикатором ступеня гістосумісності донора і реципієнта. Чим сильніше виражена реакція в
ЗКЛ, тим більша невідповідність між донором і реципієнтом за антигенами HLA, передусім класу II,
яка є найважливішим фактором відторгнення трансплантата. Однак цей метод дає результати тільки
через кілька діб і може використовуватися лише за умови планових операцій. Реакція в ЗКЛ —
основний метод підбору донора для трансплантації кісткового мозку і лімфоїдної тканини.
При пересаджуванні органів (особливо від осіб, що загинули) проводять тканинне типування —
серологічне визначення антигенів HLA за допомогою антисироваток.
Серологічне визначення антигенів HLA. Цей метод типування полягає у серологічному визначенні
фенотипу HLA донора і реципієнта та встановленні ступеня їх гістосумісності. Фенотип
визначають, типуючи лімфоцити периферичної крові, на яких щільно експресовані антигени HLA,
за допомогою набору діагностичних aнти-HLA-сироваток, що містять антитіла до всіх відомих
антигенів системи HLA, або моноклональних антитіл МкАТ. Великий набір діагностичних реагентів
необхідний у зв'язку зі значною кількістю ізоантигенів у цій системі. Ідентифіковано близько 80
різних молекул класу І (HLA-A, HLA-B, HLA-C) і близько 40 молекул класу II (HLA-DP, HLA-DQ,
HLA-DR). В Україні типування найчастіше проводять за антигенами локусів HLA-A, В, С і DR.
Антигени гістосумісності зазвичай визначають за допомогою цитотоксичного тесту, основою якого
є здатність сироватки (антитіл), специфічної до певного антигену HLA, зумовлювати за наявності
комплементу лізис лімфоцитів, що мають цей антиген. Загибель клітин реєструють за фарбуванням
їх вітальними барвниками, найчастіше — трипановим синім (див. розд. 5). Для визначення
антигенів класу І використовують нерозділену суспензію лімфоцитів, а для визначення антигенів
класу II — суспензію, збагачену В-лімфоцитами, на поверхні яких є ці антигени. Лімфоцити донора
і реципієнта лізуються набором (групою) тих сироваток, які є специфічними до експресованих на
їхній поверхні антигенів. За результатами реакції з різними сироватками (антитілами)
встановлюють серологічний тип кожного антигену HLA на клітинах.
Слід зазначити, що в зв'язку зі складністю отримання діагностичних сироваток (для серологічного
типування) до рідкісних антигенів HLA II (особливо HLA-DP) і тривалим перебігом реакції в ЗКЛ
останнім часом проводять типування генів HLA класу II, використовуючи молекулярно-генетичний
метод — полімеразну ланцюгову реакцію, принципи якої описано у розд. 21.
Лімфоцитотоксичний тест використовується також для визначення у реципієнта преформованих
антитіл до антигенів HLA донора. Цю реакцію з лімфоцитами донора і сироваткою реципієнта
називають перехресною пробою на індивідуальну сумісність, або крос-матч (cross-match). Наявність
преформованих антитіл є фактором ризику надгострого відторгнення трансплантата. Однак відомі
випадки надгострого відторгнення трансплантата за негативної перехресної проби, однією з причин
якого може бути пресенсибілізація реципієнта до інших (не HLA) антигенів, особливо до тих, що
експресуються на клітинах ендотелію.
Зауважимо, що цитотоксичною активністю характеризуються антитіла проти антигенів HLA класу І,
які експресуються на всіх клітинах організму і трансплантата. Високі титри цих антитіл
зумовлюють руйнування трансплантата за механізмом комплементзалежного лізису. Ці антитіла
визначають у цитотоксичному тесті з Т-лімфоцитами за температури 37 °С і їх називають
тепловими анти-Т-антитілами. Антитіла проти антигенів HLA класу II зумовлюють не
цитотоксичний, а блокуючий ефект: екранують антигени HLA (зокрема, DR-антигени) на АПК і
запобігають імунному розпізнаванню, сприяючи таким чином виживанню трансплантата. Ці
антитіла визначають у цитотоксичному тесті з В-лімфоцитами за температури 8—10 °С і називають
холодовими анти-В-антитілами.
Наявність у сироватці крові реципієнта преформованих цитотоксичних анти-HLA-антитіл проти
антигенів HLA донора є протипоказанням для використання органа цього донора для
трансплантації. За відсутності цитотоксичних антитіл висновок про можливість трансплантації
роблять з урахуванням ступеня сумісності донора і реципієнта. Оптимальним варіантом є сумісність
донора і реципієнта за антигенами системи AB0, Rh та HLA. Однак практично неможливо підібрати
повністю сумісних донора і реципієнта, тому селекція, по суті, зводиться до підбору
найприйнятнішого донора. Вірогідність знайти повністю HLA-сумісного донора найбільша серед
родичів і становить 1:4 серед рідних братів і сестер (сибсів). Підбір оптимального співвідношення
між донором і реципієнтом значно подовжує тривалість виживання трансплантата. Найкращі
результати отримують у разі сумісності донора і реципієнта за антигенами HLA класу II, особливо
за антигенами HLA-DR. Серед антигенів HLA класу І найбільше значення мають ті, що кодуються
локусом В. Клінічні спостереження дали змогу встановити, що наслідки типування HLA впливають
на тривалість життя трансплантата залежно від попередньо проведених реципієнту трансплантацій,
гемотрансфузій.
Оскільки в клініці допускають пересаджування і за несумісності за одним-двома антигенами
системи HLA, то підбір донора в багатьох випадках повністю не виключає розвитку реакції (кризу)
відторгнення. Кризи відторгнення можуть повторюватися і супроводжуються руйнуванням частини
паренхіми трансплантата (органа), що призводить до поступового згасання його функцій. Водночас
вдалий підбір дає змогу коригувати кризи відторгнення пригніченням імунної системи реципієнта за
допомогою імуносупресивної терапії.
17.3.2. Пригнічення імунних реакцій.
Для подовження виживання трансплантата велике значення має виявлення ранніх симптомів кризів
відторгнення і своєчасна корекція імуносупресивної терапії. З цієї метою після трансплантації
здійснюється імунологічний моніторинг реципієнта — спостереження за імунною реактивністю.
Найнадійнішим методом діагностики кризу відторгнення трансплантанта нині є тонкоголкова
аспіраційна біопсія. Дослідження біоптату (аспірату) дає змогу спостерігати за процесами, що
відбуваються в самому трансплантаті, ідентифікувати типи клітин імунної системи за їх
поверхневими маркерами (імунофлуоресцентним методом) або за біохімічною (ферментативною)
активністю (гістохімічними методами). Розвиток кризу відторгнення супроводжується клітинною
інфільтрацією трансплантата, при цьому клітинний склад інфільтрату змінюється в динаміці
процесу. Зміна лімфоїдної інфільтрації на макрофагальну і нейтрофільну свідчить про розвиток
незворотного гострого кризу відторгнення.
Для діагностики кризу відторгнення визначають також показники, які є критерієм активації імунної
відповіді: співвідношення лімфоцитів CD4 і CD8 та рівень цитокінів, насамперед ІЛ-2, який, як
відомо, продукується активованими Т-лімфоцитами, є фактором їх росту і стимулює утворення
ЦТЛ. Однак підвищення цих показників у реципієнта не завжди відображає активність імунної
відповіді на трансплантат, оскільки вони підвищуються і під час багатьох захворювань, зокрема
інфекційних.
Дані імунологічного моніторингу реципієнта — критерій для проведення корекції імуносупресивної
терапії та оцінювання її ефективності. Існує два види імуносупресивної терапії —
антигеннеспецифічна та антигенспецифічна імуносупресія.
Неспецифічна імуносупресія зумовлює загальне пригнічення імунної системи, знижуючи її
активність до всіх антигенів. Загальна супресія імунної системи завжди призводить до зниження
резистентності організму реципієнта до інфекційних захворювань.
На ранніх етапах розвитку трансплантації для пригнічення імунних реакцій проводили загальне
опромінення організму реципієнта рентгенівським випромінюванням. Однак для повного
пригнічення імунних реакцій необхідні високі дози випромінювання, які хоча і запобігають
відторгненню, але одночасно спричинюють небажані побічні ефекти (некроз слизових оболонок,
порушення кровотворення, безплідність), оскільки діють на всі клітини, що діляться. Тому для
пригнічення імунної системи загальне опромінення у практиці не застосовують.
Нині для пригнічення трансплантаційного імунітету широко і досить успішно використовують
імуносупресивні агенти — препарати, різні за походженням, хімічною природою, механізмами дії,
які тією чи іншою мірою вибірково впливають на імунну систему. У клінічній практиці найчастіше
застосовують імуносупресивні агенти чотирьох типів — кортикостероїди (преднізолон,
дексаметазон та ін.), антиметаболіти (азатіоприн), антибіотики (циклоспорин та ін.), антитіла (табл.
59).
Кортикостероїди характеризуються вираженими протизапальними властивостями. При
застосуванні їх у клінічній трансплантації спостерігається супресія імунної запальної реакції, яка
має вирішальне значення у відторгненні трансплантата. Імуносупресивна дія стероїдів пов'язана з
інгібуванням секреції запальних цитокінів (ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-8, ФНП-α, ІФН-γ), а також експресії
антигенів МНС та молекул міжклітинної адгезії (CD62E, ІСАМ-1), наслідком якого є пригнічення
активації і функціонування Т-лімфоцитів і макрофагів та міграції лейкоцитів до ділянок запалення.
Завдяки здатності індукувати зазначені ефекти кортикостероїди можуть призупинити гостру стадію
розвитку кризу відторгнення. Терапевтичний ефект кортикостероїдів залежить від їх дози. Так,
преднізолон для профілактики кризу вводять відразу після трансплантації й до стабілізації
клінічного стану хворого в дозі 3 — 4 мг/кг маси тіла, а надалі в підтримувальній дозі — 0,5 мг/кг.
Для лікування вже розвиненого гострого кризу доза стероїдів значно збільшується і становить для
метилпреднізолону до 1000 мг на добу впродовж однієї — чотирьох діб. Високі дози
кортикостероїдів зумовлюють сильні токсичні ефекти — затримку рідини, збільшення маси тіла,
діабет тощо.
Азатіоприн — імуносупресивний агент з антипроліферативною дією. Продукт метаболізму
азатіоприну — тіоінозинова кислота діє як антиметаболіт, конкуруючи з інозином монофосфату і
блокуючи синтез пуринових основ — аденозинта гуанозинмонофосфату. Включаючись у ДНК
клітин, що діляться, вона перешкоджає їх проліферації. При застосуванні в трансплантації
(терапевтична доза становить 2 — 3 мг/кг маси тіла на добу) азатіоприн пригнічує проліферацію
лімфоцитів, що активуються алоантигенами трансплантата. Антипроліферативний ефект препарату
не обмежується лімфоцитами, а поширюється на інші клітини, що діляться, чим зумовлюється його
побічна дія, зокрема на кістковий мозок та печінку.
Антибіотики — циклоспорин, FK 506 і рапаміцин, що отримані з мікроорганізмів ґрунту (див. розд.
21), різняться за структурою, пригнічують клітинні реакції імунітету.
Всі три препарати блокують активацію та проліферацію Т-клітин, інгібуючи внутрішньоклітинне
передавання сигналу цитокіну після зв'язування зі своїми рецепторами — цитоплазматичними
білками імунофілінами. Циклоспорин зв'язується з циклофіліном, a FK 506 і рапаміцин з FK-
зв'язувальними білками (FK-binding protein) - відповідно FK BP12 і FK BP25.
Після зв'язування циклоспорин і FK 506 блокують фосфатазну активність сигнального білка
кальциневрину, що є необхідним для транскрипційної активації ІЛ-2 гена, і пригнічують
продукування ІЛ-2 Т-клітинами та експресію його рецептора (CD25). Рапаміцин зумовлює
інактивацію протеїнкінази, що бере участь в активації гена α-ланцюга рецептора ІЛ-2, і таким чином
блокує сприйняття індукованого ІЛ-2
сигналу.
Циклоспорин та його функціональні аналоги
виявляють цілеспрямовану інактивувальну
дію на ті Т-клітини, що активуються
антигенами трансплантата, і в цьому їхня
перевага над іншими імуносупресантами.
Впровадження в клінічну практику
циклоспорину (1982) відкрило нову еру в
трансплантації — «еру циклоспорину».
Застосування циклоспорину (в дозі 5 мг/кг
маси тіла на добу) значно подовжило
виживання трансплантатів упродовж перших
років після пересаджування (хоча і не
вирішило проблеми хронічного відторгнення)
і знизило частоту інфекційних ускладнень.
Однак циклоспорин (як і його функціональні
аналоги) має нейро-, нефро- і гепатотоксичні
властивості, а тривале застосування його пов'язане зі збільшенням ризику злоякісних пухлин у
реципієнтів, що значною мірою може бути зумовлено, як це припускають, ТФР-β-стимулювальними
властивостями антибіотика. Отже, імуносупресивні агенти трьох типів діють на різні етапи реакції
відторгнення, а тому для мінімізації побічних ефектів, які могли б спричинитися високими дозами
кожного з них у випадку застосування їх як монотерапевтичних засобів, їх комбінують,
використовуючи менші (менш токсичні) дози. Циклоспорин, такролімус і рапаміцин, хоча і діють
більш селективно, ніж азатіоприн та ін антиметаболіти, однак є токсичними для багатьох тканин.
Менш токсичними є антитіла, які характеризуються чітко вибірковою дією.
Антитіла. Упродовж багатьох років для лікування гострого відторгнення трансплантата
використовувалися і нині використовуються, але з певними обмеженнями, поліклональні антитіла
(ПкАТ) – антилімфоцитарний імуноґлобулін (AЛГ) та антитимоцитарний імуноґлобулін (АТГ), які
отримують внаслідок імунізації тварин (кролів, коней) лімфоцитами або клітинами тимуса людини.
Терапевтичний ефект ПкАТ полягає в тому, що вони зумовлюють комплементзалежний лізис Т-
