Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.


41
ГМ-КСФ стимулює протипухлинну і антимікробну активність макрофагів, нейтрофілів,
еозинофілів, індукує синтез ними цитокінів ФНП-α, ІЛ-1, М-КСФ; інгібує міграцію нейтрофілів і
тим самим сприяє їх накопиченню в зоні запалення.
При нокауті гена виникають патологічні зміни альвеол легень.
Тест визначення — підтримання клонального росту кістковомозкових попередників гранулоцитів-
макрофагів.
Гранулоцит-колонієстимулювальний фактор (Г-КСФ). Г-КСФ, або колонієстимулювальний
фактор β, — глікозильований білок з молекулярною масою 19 кД і 174 або 177 амінокислотними
залишками; остання форма має в 20 разів більшу активність. Кодуються обидві форми в хромосомі
17. За характером просторової структури належать до родини чотириспіральних цитокінів. Видова
специфічністі відсутня; з мишачим аналогом має 70 % гомології.
Продуцентами цього цитокіну є макрофаги, фібробласти, клітини ендотелію та строми кісткового
мозку.
Рецептор Г-КСФ має молекулярну масу 150 кД і містить 759 або 812 амінокислотних залишків, має
46 % гомології з β-ланцюгом ІЛ-6. Рецептор Г-КСФ виявляється на клітинах кісткового мозку,
нейтрофілах, ендотеліоцитах.
Біологічний ефект — підтримання росту, диференціювання нейтрофілів у кістковому мозку,
підсилення активності зрілих нейтрофілів. Виявляється в кровотоці. У разі блокади гена — дефект
мієлопоезу, нейтропенія.
Тест визначення — колонієутворення у напіврідкому агарі та стимулювання проліферації клітин
лінії NFS 60.
Макрофаго-колонієстимулювальний фактор (М-КСФ). М-КСФ, або колонієстимулювальний
фактор 1 (КСФ-1), існує в трьох формах, що різняться за кількістю амінокислотних залишків (522,
406, 224), з молекулярною масою білкової частини 45 — 90 кД. Усі три форми є продуктами одного
гена в 5-й хромосомі і не різняться за біологічною активністю.
Молекула М-КСФ є дисульфідзв'язаним гомодимером, біологічна активність якого тісно пов'язана з
першими 149 амінокислотними залишками з N-кінця молекули. Просторова будова М-КСФ подібна
до такої ГМ-КСФ, ІЛ-2, ІЛ-3, ІЛ-4. Рецептор М-КСФ (CD 115) належить до родини Ig-подібних
рецепторів, має молекулярну масу 150 кД з 953 амінокислотними залишками. Цей рецептор
виявляється на моноцитах, макрофагах та їх попередниках. Цитоплазматична ділянка рецептора має
тирозинкіназну активність. Зв'язування М-КСФ із рецептором індукує димеризацію останнього. Під
час взаємодії М-КСФ з відповідним рецептором (CD115) індукується кіназна активність та
фосфорилювання як самого рецептора, так і низки білків клітин. Рецептор М-КСФ сполучений з G-
білком і при активації рецептора відбувається переміщення протеїнкінази С до клітинної мембрани.
Продуцентами М-КСФ є багато клітин: моноцити, макрофаги, фібробласти, ендотеліальні клітини
тощо. В кровотоці М-КСФ не виявлено. Він стимулює ріст макрофагальних колоній з
кістковомозкових попередників, а також індукує проліферацію макрофагів in vitro і активує зрілі
макрофаги, які секретують ІЛ-1, Г-КСФ, інтерферони, простагландини; підсилює їх цитоцидність
відносно інфікованих та пухлинних клітин. М-КСФ людини активує мишачі клітини, але не
навпаки. Тест на виявлення — колонієутворення в напіврідкому агарі та використання М-КСФ-
залежної лінії клітин мишей M-NFS 60.
Стовбурово-клітинний фактор (СКФ). Відомий також під назвами «фактор Стіла», «c-Kit-ліганд»,
«фактор росту мастоцитів». Виявлено дві форми СКФ — розчинний та мембранозв'язаний.
Рецептором для СКФ є CD-I 17 (c-Kit, який був відкритий як онкоген).
Продуценти — різні стромальні клітини кісткового мозку: фібробласти, епітеліальні клітини,
ендотеліальні клітини судин; утворюються переважно локально у великій кількості; їх активність
значно підвищується при сумісній дії з іншими цитокінами (ІЛ-3, ІЛ-7, ГМ- і Г-КСФ, ери-
тропоетин).
СКФ належить до головних регуляторів кровотворення. Він підтримує існування, проліферацію та
диференціювання поліпотентних стовбурових кровотворних клітин, клітин-попередників різних
рядів кровотворення. Сумісна дія СКФ і ІЛ-6 або ІЛ-3 ефективно стимулює диференціацію
поліпотентних стовбурових кровотворних клітин у бік комітованих попередників з подальшим
утворенням імунокомпетентних та кровотворних клітин.
Існує синергізм між СКФ і ІЛ-11 при їх дії на поліпотентні стовбурові кровотворні клітини, а також
між СКФ і ІЛ-2 при дії на природні кілери.
Для мастоцитів він є основним фактором росту і хемокіном.
Еритропоетин. Еритропоетин — глікопротеїн з молекулярною масою 34 кД і 166 амінокислотними
залишками. Молекула еритропоетину містить два дисульфідних зв'язки, що забезпечує активну
конформацію трьох сіаловмісних N-глікозидних та О-глікозидних ланцюгів. Деглікозилювання
підвищує спорідненість еритропоетину до відповідного рецептора і його активність in vitro, проте
зовсім відміняє активність in vivo. Існує дві форми еритропоетину — α і β, які різняться тільки
кількістю вуглеводів, але при цьому мають однакову біологічну активність. Виявлено високу
гомологію (80 — 95 %) між еритропоетином людини та інших ссавців, що зумовлює відсутність
видової специфічності. Ген еритропоетину знаходиться в 7-й хромосомі.
В неонатальному періоді він утворюється в основному в печінці, у постнатальному — синтезується
епітелієм нирок і в незначній кількості (10—15 %) печінкою. За нормальних умов концентрація його
в крові становить 0,01 мМ; при гіпоксії його рівень підвищується. Нокаут гена еритропоетину або
його рецептора спричинює загибель організму в ембріональному періоді.
Рецептор еритропоетину належить до суперродини цитокінових рецепторів і має масу 85—100 кД і
444 амінокислотних залишки.
Основна функція еритропоетину — регуляція разом з іншими цитокінами (ІЛ-3, ІЛ-6, ІЛ-11, ГМ-
КСФ) утворення еритроцитів із незрілих кістковомозкових попередників. Він також захищає від
апоптозу еритроїдні клітини-попередники на пізніх стадіях розвитку і перспективий щодо
застосування при різноманітних анеміях.
Тест на виявлення еритропоетину — його здатність викликати утворення еритроцитарних колоній з
кістковомозкових попередників у метилцелюлозі або стимуляція проліферації клітинної лінії TF-1.
Трансформівний ростовий фактор β (ТФР-β). ТФР-β являє собою родину близьких за структурою
молекул (β1, β2, β3), поліпептидна частина яких складається з 112 амінокислотних залишків з
молекулярною масою 25 кД. Основною формою є ТФР-β1 — дисульфідзв'язаний гомодимер з
молекулярною масою близько 25 кД, який синтезується в латентній формі й активується в процесі
протеолітичного розщеплення. Привертає увагу консерватизм ТФР-β1 — ці білки у людини і бика
ідентичні, а мишачий відрізняється одним амінокислотним залишком. Виявлено три гени, які
кодують цей цитокін. ТФР-β1 і ТФР-β2 відрізняються певною мірою за структурою, але в прояві
функціональної активності відмінності не виявлено. Гени ТФР-β знаходяться в 19-й хромосомі.
Клітинами-продуцентами є широкий набір клітин і тканин — активовані Т-лімфоцити, макрофаги,
тромбоцити, клітини нирок і плаценти тощо.
Рецептори до ТФР-β виявлено на тих самих клітинах, які його секретують, ще свідчить про
можливість його аутокринної дії. Відомо три типи рецепторів де ТФР-β — два високоафінні та
низькоафінний, які зв'язують усі три ізоформи цього цитокіну і мають молекулярну масу відповідно
55, 80 і 250 — 350 кД.
ТФР-β має широкий спектр біологічно дії. Він викликає in vitro трансформацій фібробластів,
супресує проліферацію Т- і В-клітин, інгибує утворення цитотоксичних Т-лімфоцитів і активацію
макрофагів та ПМЯЛ. Отже, він діє антизапально, і справді, у мишей, які позбавлені гена ТФР-β,
розвиваються неконтрольовані запальні процеси. Разом з тим ТФР-β відіграє важливу роль у
розвитку гуморальної імунної відповіді — він переключає біосинтез імуноґлобулінів на IgA-ізотип.
Він здатний індукувати ріст судин, а також виявляти іn vitro антипроліферативну активність
відносно ендотеліальних, епітеліальних і ранніх стовбурових гемопоетичних клітин.
ТФР-β визначають за його здатністі гальмувати ріст клітин лінії MV-1-Lu.
9.4. ЦИТОТОКСИЧНІ ФАКТОРИ.
Фактори некрозу пухлин та інші цитотоксичні фактори. Важливими гуморальними факторами
неспецифічної резистентності є фактори некрозу пухлин – ФНП-α і ФНП-β (лімфотоксин). Вони
здатні лізувати великий набір пухлинних клітин in vitro та in vivo.
Нещодавно виявлено ще один член цієї родини – мембранний лімфотоксин ЛТβ, а ФНП-β (ЛТ)
почали називати ЛТα. Крім розчинної форми лімфотоксину α існує ще мембранозв'язана його
форма. Всі три представники родини факторів некрозу пухлин мають багато спільних ознак —
спричинюють подібний біологічний ефект — цитоліз пухлинних клітин, мають загальні рецептори
на чутливих клітинах, гомологію на 34 %, гени всіх трьох факторів розміщені тандемно в хромосомі
6. Всі три фактори гомологічні з Fas-лігандом, мембранними молекулами CD30 і CD40, фактором
росту нервів і створюють особливу родину білків, для яких на чутливих клітинах існують дві форми
спільних рецепторів — gp55 і gp75. Слід зазначити, що Fas-ліганд індукує апоптоз і виявляється в
gp55, але не в gp75. ЛТβ має особливий рецептор на стромальних клітинах лімфоїдних органів, який
сприймає сигнал від мембранного ЛТ.
ФНП-α продукується моноцитами, макрофагами, ендотеліоцитами, мастоцитами, клітинами
нейроглії і в окремих випадках — Т- і В-лімфоцитами і має 157 амінокислотних залишків з
молекулярною масою 17 кД. Основними індукторами ФНП-α є мікроорганізми, їхні продукти
життєдіяльності та інші фактори, що активують фагоцити.
Основними продуцентами ФНП-α є Т-лімфоцити - як CD4, так і CD8. ФНП-β має молекулярну масу
близько 20 кД і 171 амінокислотний залишок. Індукторами ФНП-β є специфічні антигени або
мітогени.
ФНП-α і ФНП-β різняться за швидкістю їх секреції — ФНП-α секретується вже через 40 хв після
стимуляції, а ФНП-β — тільки через 2 — 3 доби після дії на Т-клітини специфічних антигенів або
мітогенів.
У сироватці крові здорових людей ні ФНП-α, ні ФНП-β не виявляються. Проте під час інфекційних
захворювань, онкозахворювань та деяких неінфекційних патологій у сироватці крові з'являються
ФНП.
Спектр біологічної дії ФНП дуже широкий. Основні — це лізис пухлинних, трансформованих та
вірусінфікованих клітин і регуляція багатьох функцій організму. Цитотоксична активність ФНП
проявляється у двох формах — індукції апоптозу та індукції на клітинній мембрані цитоцидних
факторів — активних форм кисню, азоту, супероксидрадикалів. ФНП-α бере активну участь у
здійсненні цитоцидної функції НК і ЛАК-клітин. Дія ФНП спрямована в основному на змінені
(трансформовані) й пухлинні клітини. Проте не всі пухлини in vivo і не всі лінії культивованих
пухлинних клітин чутливі до дії ФНП. Деякі пухлини та лінії клітин стійкі до цієї дії. Попередня
обробка таких клітин γ-ІФНом надає їм чутливості до ФНП, і вони лізуються ними. Основним
механізмом підвищення цитоцидної активності ФНП ІФНами є підсилення ними експресії
рецепторів до ФНП на пухлинних клітинах.
Під час взаємодії з пухлинними клітинами ФНП здатні індукувати експресію на них антигенів
гістосумісності класу І, що сприяє розпізнаванню їх ефекторними клітинами. Вони також можуть
підвищувати проникність ендотелію судин, що зумовлює збільшення міграції ефекторних клітин до
пухлин або до осередку запалення. ФНП також здатні активувати ефекторні клітини (природні
кілери, макрофаги, поліморфноядерні лейкоцити), які можуть руйнувати пухлинні клітини.
Цитотоксична дія ФНП зумовлена в основному деградацією ДНК і порушенням функціонування
мітохондрій. Слід зазначити, що до дії факторів некрозу пухлин чутливі й нормальні клітини, однак
ця чутливість виражена в них набагато менше.
Показано, що тумороцидна активність макрофагів тісно пов'язана з наявністю в клітинній мембрані
ФНП-α, кількість якого різко збільшується після обробки ІФН-γ, що призводить до значного
зростання цитоцидної активності. ФНП-α має противірусну активність — він гальмує
репродукування деяких вірусів. Ця дія, можливо, зумовлена індукуванням ІНФ-γ, оскільки
моноклональні антитіла до останнього відміняють антивірусну дію ФНП-α.
ФНП-α гальмує також ріст рикетсій, особливо під впливом ІНФ-γ, стимулює кандидоцидну
активність поліморфно-ядерних лейкоцитів. Крім того, ФНП-α може діяти як ростовий фактор, як
індуктор диференціювання пухлинних клітин, регулювати функції нейтрофілів, еозинофілів,
макрофагів, Т- і В-лімфоцитів, ендотелію судин, стимулювати каскад арахідонової кислоти з
утворенням простагландинів і лейкотрієнів, спричинювати хемотаксис нейтрофілів і стимулювати їх
адгезію до ендотелію судин, підвищувати температуру, зумовлювати експресію рецепторів до
інтерлейкінів.
ФНП відіграють важливу регулювальну роль у функціонуванні захисних сил організму. Так, вони
індукують продукування імунокомпетентними клітинами багатьох біологічно активних речовин, що
регулюють функціональну активність певних ланок захисних сил організму. Це ІЛ-1, ІЛ-6, КСФ-
ГМ, простагландин Е2, ІФНи. Крім того, деякі біологічно активні речовини (ІФН-γ, ІЛ-1, КСФ-1),
що виробляються імунокомпетентними клітинами, індукують синтез ФНП.
У багатьох випадках дія фактора некрозу пухлин більш виражена при взаємодії з ІФН-γ та з ІЛ-1.
Разом з ІЛ-1 вони стимулюють проліферацію макрофагів, продукування фібробластами людини
фактора стимуляції виникнення колоній гранулоцитів-макрофагів і гранулоцитів,
трансмодифікують рецептори епідермального фактора росту на фібробластах.
Рекомбінантний ФНП-α має радіопротекторні властивості, викликає пірогенний ефект, діючи
безпосередньо на органи-мішені за межами гематоенцефалічного бар'єра.
Отже, ФНП є одними з первинних медіаторів у патогенезі різних патологічних процесів —
ушкодження, запалення, в захисних реакціях організму й тканинного гомеостазу. Біологічні ефекти
ФНП можуть бути захисними або ушкоджувальними залежно від взаємодії з іншими медіаторами,
клітинного оточення, концентрації й тривалості взаємодії з клітинами.
Слід мати на увазі, що ФНП мають також низку токсичних ефектів на рівні організму, що стримує
їх клінічне застосування. Так, вони є основними медіаторами летального шоку при
експериментальному введенні бактеріального ендотоксину, сприяють резорбції хряща й кісток, що
зумовлює їх патогенетичну роль при деяких захворюваннях.
Онкостатин М — глікопротеїн, який містить 227 амінокислотних залишків з молекулярною масою
16 кД, має широкий спектр біологічної дії. Він здатний гальмувати ріст клітин пухлинних ліній та
солідних пухлин, моделювати ріст і диференціювання гемопоетичних клітин, сприяти утворенню
ІЛ-6, гострозапальних білків, регулювати різноманітну функціональну активність цитокінів родини
ІЛ-6, що продукуються макрофагами й моноцитами.
Специфічні рецептори до онкостатину М виявлено на різних клітинах. Встановлено, що до складу
рецептора для онкостатину М входить компонент CD130, який є спільним для ІЛ-6, ІЛ-11, ЛІФ, та
цитокінспецифічний ланцюг OSMR-β. Онкостатин М зв'язується з рецептором ЛІФ й активує його,
тоді як ціла молекула ЛІФ не може зв'язатися з рецептором онкостатину М.
Лейкемієінгібівний фактор (ЛІФ). ЛІФ, або фактор інгібування мієлоїдної лейкемії, має понад 10
назв. Це глікозильований білок із молекулярною масою 58 кД і 179 амінокислотними залишками.
Виділяють ЛІФ-А і ЛІФ-В, які відрізняються за ступенем глікозилювання, але останній не впливає
на біологічну активність фактора. ЛІФ людини і мишей мають 79 % гомології за амінокислотними
залишками. Існують фіксовані на клітинах, розчинні та зв'язані з позаклітинним матриксом ЛІФ.
Ген ЛІФ містить три екзони. Він розміщений у хромосомі 22q12 людини недалеко від гена
онкостатину М. Ген ЛІФ мишей знаходиться в хромосомі 11 і має близько 75 % гомології з
аналогічним геном людини.
ЛІФ продукується активованими моноцитами і фібробластами, антигенстимульованими Т-
клітинами та мітогенстимульованими спленоцитами, асцитними клітинами Кребса й Ерліха.
Фібробласти легень людини продукують ЛІФ постійно. Синтез ЛІФ індукують ІЛ-1α, Т-ростовий
фактор β.
Рецептор ЛІФ складається з двох компонентів. Один із них, глікопротеїн gp130, є також
компонентом цітокінів субродини ІЛ-6 і функціонує як сигнальна трансдукувальна одиниця
рецептора. Альфа-ланцюг відповідає за зв'язування рецептора з цитокіном. Із сироватки мишей
виділено глікопротеїн з молекулярною масою 90 кД, який специфічно зв'язує ЛІФ і позначається як
ЛІФ Р-β, або ЛІФ-зв'язувальний протеїн. Він є розчинною формою α-ланцюга клітинного рецептора
й, очевидно, є інгібітором зв'язування цитокіну з клітинними рецепторами. На моноцитах і
макрофагах та їх попередниках експресується приблизно 300—500 високоафінних рецепторів на
одну клітину. ЛІФ людини з великою афінністю може зв'язувати рецептори ЛІФ мишей, але останні
не здатні зв'язувати ЛІФ людини.
Біологічна активність ЛІФ деякою мірою зумовлена його здатністю зв'язуватися з позаклітинним
матриксом і діяти на сусідні клітини. Ряд фактів свідчать про різну біологічну активність розчинних
і мембранозв'язаних форм ЛІФ. ЛІФ гальмує ріст багатьох мієлоїдних лейкемічних клітин та індукує
їх диференціювання на макрофаги. ЛІФ не виявляє колонієстимулювальну активність для ранніх
СD34-клітин кісткового мозку і не впливає на колонієутворення, що індукується ГМ-КСФ, Г-КСФ,
М-КСФ, ІЛ-3. Це свідчить про те, що ЛІФ регулює розвиток уже досить зрілих гемопоетичних
клітин. Нормальні клітини строми кісткового мозку при культивуванні постійно експресують ЛІФ і
при дії ІЛ-1, ТФР-β і ФНП-α значно збільшують рівень мРНК ЛІФ. ЛІФ сам або разом з іншими
цитокінами в кістковомозковому мікрооточенні можуть впливати на нормальні й малігнізовані
гемопоетичні процеси. ЛІФ інгібує проліферацію ендотеліальних клітин і утворення адипоцитів,
стимулює накопичення остеобластів у кістковому мозку, бере участь у рості й розвитку нервової
системи, регулює ріст і розвиток трофобластів та ембріональних стовбурових клітин. Він у процесі
диференціювання дуже рано експресується на ембріональних стовбурових клітинах. Експресія ЛІФ
на клітинах стінки матки є показником закріплення бластоцита і може регулювати ріст бластоциста
й імплантованого ембріона. ЛІФ необхідний для виживання нормального пулу стовбурових клітин,
але він не впливає на кінцеве їх диференціювання. ЛІФ є важливим фактором для культивування
ембріональних клітин та розмноження трансгенних тварин. ЛІФ індукує синтез білків гострої фази
гепатоцитами, відіграє важливу роль у функціонуванні епітелію тимуса, що сприяє Т-клітинному
дозріванню.
У трансгенних мишей, позбавлених гена ЛІФ, відсутні мезодермальні клітини, інгібується
гаструляція ембріона, що супроводжується летальністю. Видалення гена ЛІФ у Т-клітинах індукує
порушення функції тимуса і лімфовузлів. Епітелій тимуса значно дезорганізується, кортикальні Т-
лімфоцити (CD4 і CD8) із тимуса зникають, але число В-лімфоцитарних фолікулів збільшується. У
тварин, позбавлених гена ЛІФ, різко зменшується число стовбурових клітин у селезінці й
кістковому мозку.
Виявляють ЛІФ за допомогою ліній клітин, які залежать або відповідають на ЛІФ (Da, Ml, NBEL), в
ЕЛІЗА-тестах, у полімеразно-ланцюговій реакції.
9.5. ХЕМОКІНИ.
До цитокінів належить велика група хемокінів, які регулюють міграцію лейкоцитів. Загальну
характеристику їх наведено в розд. 1. Крім регулювання руху лейкоцитів багато хемокінів беруть
участь у регуляції запалення та аутоімунних процесів, росту й диференціювання імунокомпетентних
та інших клітин, у тому числі й пухлинних, тощо. Кілька конститутивних рецепторів хемокінів
експресуються специфічно при деяких захворюваннях (СНІД, онкозахворювання, бронхіальна
астма). Експресія низки хемокінів може бути пов'язана з певними захворюваннями. Так, у мишей,
позбавлених гена хемокіну CCL3 (МІР-1), вірус Коксакі В3 не здатний індукувати міокардит.
Значну роль відіграють хемокіни в розвитку атеросклерозу. На певну увагу заслуговують хемокіни
CXCL (1-3), вони ж GROα (MSGA-α, NAP-3), CROβ (MSGA-β, MIP-2α, HSF), GROγ(MIP-2 αβ).
За амінокислотним складом вони на 90 % ідентичні. Кожний фактор містить 73 амінокислотних
залишки. Гени розміщені в хромосомі 4q21 і складаються з чотирьох екзонів. У мишей і щурів
виявлені також подібні білки (відповідно КС і CIN), які мають гомологію з CXCL (1 — 3)-
факторами людини. Всі три форми CXCL-факторів за біологічною активністю подібні до CXCL 8 і
зв'язуються з тим самим рецептором (CXCR 2), що й CXCL 8, але з різною афінністю.
Хемокіни CXCL (1—3) продукуються багатьма клітинами — різними лініями пухлинних клітин,
моноцитами периферичної крові, фібробластами, астроцитами Вони експресуються на моноцитах
після їх активації, на фібробластах, на ендотеліальних, синовіальних та деяких лініях пухлинних
клітин. Культивовані пухлинні клітини продукують повноцінні за довжиною CXCL (1—3) білки,
тоді як моноцити периферичної крові продукують переважно лише термінальні ділянки, які в 30
разів активніші за цілі молекули цитокінів.
Хемокіни CXCL (1—3) належать до прозапальних і рістрегулювальних білків. Вони є сильними
хемоатрактантами для нейтрофілів, підвищують їх дегрануляцію і вихід лізосом, стимулюють ріст
фібробластів та ендотеліальних клітин, є аутостимуляторними ростовими факторами меланомних
клітин (аутокринна активність).
ІЛ-1, ІЛ-6 і ФНП стимулюють експресію GRO-білків приблизно в 100 разів.
ВИСНОВКИ.
До цитокінів належить велика кількість біологічно активних речовин, які продукуються переважно
клітинами імунної системи, активованими різними факторами екзо- й ендогенного походження, а
також соматичними клітинами (епітеліальними, фібробластними, ендотеліальними, нервовими та
ін.).
Цитокіни мають широкий спектр біологічної дії: індукція формування та регуляції імунної
відповіді, активація або гальмування функцій різних клітин, пряма участь в антиінфекційному та
протипухлинному захисті. Слід зазначити, що при деяких захворюваннях може відбуватися
перепродукування окремих цитокінів, що може бути причиною розладу регуляторних процесів,
погіршення стану хворого і навіть летального кінця.
Отримано рекомбінантні форми більшості цитокінів, ряд цитокінів знайшли практичне застосування
при лікуванні інфекційних та онкологічних захвор вань.
Контрольні запитання.
1. Що таке цитокіни? Які види цитокінів вам відомі?
2. Які механізми дії цитокінів?
3. Які цитокіни належать до гемопоетичних і яка їхня роль в онтогенезі окремих популяцій клітин
імунної системи?
4. Яка роль цитокінів у формуванні запальних процесів?
5. Яка роль цитокінів у протипухлинному захисті?
6. Схарактеризуйте властивості та функціональну активність ІЛ-1.
7. Яка роль ІЛ-2 у захисних реакціях організму?
8. Які особливості функціональної активності ІЛ-6 у формуванні протективних реакцій організму?
9. Які властивості має ІЛ-12 і яка його роль у розвитку імунної відповіді?
РОЗДІЛ 30. АКТИВАЦІЯ ЛІМФОЦИТІВ.
Активація — це процес, що зумовлює перехід клітини під впливом стимулювального сигналу з фази
G
0
у фазу G1. Наївні лімфоцити, що мігрували з центральних лімфоїдних органів на периферію,
перебувають на стадії G
0
клітинного циклу.
Під активацією лімфоцитів розуміють процеси, що зумовлюють поділ клітин та їх
диференціювання.
Повноцінна активація лімфоцитів, що супроводжується процесами проліферації і диференціювання,
відбувається за участю кількох послідовних сигналів, які індукуються, крім антигену, ще й
додатковими стимулами, що сприяють проходженню і завершенню циклу. Відсутність додаткових
стимулювальних сигналів може призвести до клональної анергії або апоптозу (мал. 69).
Рецепторний апарат лімфоцитів пов'язаний із певними внутрішньоклітинними біохімічними
системами. Взаємодія рецепторів з антигеном визначає подальший функціональний стан
специфічного до цього антигену лімфоцита. Хоча, який саме «шлях» обере лімфоцит, залежить від
багатьох факторів: стадії розвитку лімфоциті, наявності додаткових сигналів від клітинного
мікрооточення, а також від кількості антигену та афінності специфічних до нього рецепторів.
У цьому розділі буде детально розглянуто, які біохімічні процеси відбуваються під час взаємодії
специфічних до антигену рецепторів наївних Т- і В-клітин з відповідним антигеном та які додаткові
сигнали потребує лімфоцит для повноцінної активації.
10.1. БУДОВА РЕЦЕПТОРНОГО АПАРАТУ Т- І В-КЛІТИН.
Специфічне розпізнавання антигену клітинами імунної системи є центральним моментом запуску та
регуляції імунної відповіді. Розпізнавання антигену лімфоцитами здійснюється завдяки
притаманним лише їм специфічним структурам — антигенрозпізнавальним рецепторам. Взаємодія
рецепторів з антигеном запускає процес активації клітини, стимулюючи диференціювання і
виконання її ефекторної функції.
Антигенспецифічні рецептори несуть як Т-, так і В-лімфоцити, Т-клітинні рецептори (ТкР) і В-
клітинні рецептори (ВкР) різняться за молекулярною структурою та особливостями розпізнавання.
На поверхні Т- і В-клітин антигенспецифічні рецептори експресуються поряд з додатковими
поліпептидними ланцюгами, формуючи разом з ними рецепторний комплекс. Функції складових
цього комплексу різні, власне рецептор виконує функцію розпізнавання і зв'язування антигену
(епітопу), а додаткові молекули — функцію передавання сигналу всередину клітини.
Рецепторний комплекс В-клітин. Головною частиною В-клітинного рецепторного комплексу, що
специфічно взаємодіє з антигеном, є структурно пов'язані з клітинною мембраною молекули
імуноглобулінів (mІg). Імуноґлобуліни всіх класів можуть бути в мембранозв'язаній формі, але на
наївних В-лімфоцитах, що не контактували з антигеном, рецептори представлені тільки
імуноґлобулінами двох класів: IgM та IgD, і їхня кількість становить приблизно 150 000 на клітину.

42
Мембранні форми імуноґлобулінів з'являються в результаті альтернативного сплайсингу їх
матричних РНК. На відміну від
секреторних, mІg мають гідрофобну С-
кінцеву ділянку, яка затримує ці
імуноґлобуліни в мембрані. Мембранний
IgM має мономерну форму, на відміну від
сироваткової пентамерної форми.
Додаткові компоненти В-клітинного
рецептора, що виконують функцію
передавання сигналу про зв'язування
антигену всередину клітини, представлені
двома подібними за структурою ланцюгами
— Igα (CD79a) і Igβ (CD79P) з
молекулярною масою відповідно 39 000 і
33 000. У формі гетеродимерів вони
безпосередньо пов'язані з основною
частиною рецептора (мал. 70). Ланцюги Iga
і Igp мають по одному позаклітинному
домену імуноглобулінової природи та
великі цитоплазматичні хвости, на яких
знаходяться специфічні послідовності
(ITAM), необхідні для запуску процесів
активації клітини. Вважають, що з одним
імуноглобуліном зв'язано по одній
молекулі Igα і Igβ.
Рецепторний комплекс Т-клітин. Як уже
зазначалося, існує два типи Т-клітинного
рецептора — αβ і γδ. Кожний Т-лімфоцит
несе рецептори тільки одного типу. На
клітинній поверхні як αβ-ТкР, так і γδ-ТкР
асоційовані з поліпептидним комплексом
CD3.
Поліпептидні ланцюги αβ і γδ, що
складають власне ТкР, мають аналогічну
молекулярну структуру. Кожний із
ланцюгів містить у надмембранній частині
один варіабельний (V) та один константний
(С) домен, трансмембранний сегмент (12 —
20 залишків) і короткий цитоплазматичний
хвіст (3 — 5 залишків). Між С-доменом і
трансмембранним сегментом у гнучкій
шарнірній ділянці міститься дисульфідний
зв'язок, що з'єднує ланцюги димеру. У
людини виявлено один із різновидів γδ-
ТкР, ланцюги якого з'єднані нековалентно,
а не дисульфідним зв'язком. У
надмембранній частині ланцюгів є дві
ділянки N-глікозилювання (одна у V-
домені, друга в С-домені).
V-домени ТкР подібні до V-доменів
імуноглобулінів, характеризуються
різноманітністю амінокислотної
послідовності і містять гіперваріабельні
ділянки з найбільш мінливою
послідовністю амінокислот, які утворюють
активний центр, що зв'язує антиген.
Гіперваріабельні ділянки V-домена ТкР, як
і в молекулі імуноглобуліну, стабілізовані
каркасними ділянками з відносно
постійною амінокислотною послідовністю.
СD3-комплекс. Як уже зазначалося,
димери αβ- і γδ-Т-клітинного рецептора
розміщуються на клітинній поверхні поряд
з поліпептидними ланцюгами, що
об'єднуються в комплекс під назвою CD3.
До складу комплексу CD3 входить п'ять
видів поліпептидних ланцюгів, з них три (γ,
δ і ε) експресуються у формі мономерів, два
інші (ζ і η) — у формі з'єднаних
дисульфідним зв'язком гомо- або
гетеродимерів (ζ-ζ, η-η, ζ-η). Не слід
плутати ланцюги γ і δ СD3-комплексу з
ланцюгами γδ-ТкР.
Поліпептиди СD3-комплексу є
трансмембранними білками і мають
однакову послідовність амінокислот у всіх
Т-клітин.
Ланцюги γ, δ і ε кодуються тісно
зчепленими генами, гомологічними між
собою, і належать до суперродини імуноглобулінів. Кожен з ланцюгів має в надмембранній частині
один домен (подібний до імуноглобулінового С-домену), трансмембранний сегмент і
цитоплазматичний хвіст (40 і більше залишків) з висококонсервативною послідовністю
амінокислот. Як і на цитоплазматичних частинах Igα/Igβ, на ланцюгах СD3-комплексу знаходяться
активаційні послідовності ІТАМ.
Ланцюги ζ і η кодуються одним геном, експресуються в результаті альтернативного сплайсингу і
різняться між собою за наявністю або відсутністю в молекулі продуктів останнього екзону. Вони не
належать до суперродини імуноглобулінів. Характерною особливістю їх структури є короткий
надмембранний домен і дуже довгий цитоплазматичний хвіст (із 143—185 амінокислотних
залишків). На відміну від ланцюгів γ, δ і ε, ланцюги ζ і η мають не по одній, а по три послідовності
ІТАМ.
Поліпептиди CD3-комплексу виконують таку саму функцію, що й додаткові молекули ВкР, і
призначені для передавання сигналу про зв'язування антигену Т-рецептором у середину клітини.
Дослідження топології та визначення молекулярної маси солюбілізованого ТкР-СD3-комплексу
дають змогу припустити, що на поверхні Т-клітин повний антигенрозпізнавальний комплекс
представлений у вигляді димеру. Його формула (αβ)
2
, γ, δ, ε
2
, η
2
(ζ
2
). Модель структури ТкР-СD3-
комплексу наведено на мал. 71.
Складання більшості компонентів ТкР-СD3-комплексу відбувається в ендоплазматичному
ретикулумі, однак повністю завершується на мембрані. Вважають, що для складання та експресії
рецепторного комплексу на поверхні клітини велике значення мають взаємодії протилежно
заряджених амінокислотних залишків у складі трансмембраних сегментів поліпептидних ланцюгів:
позитивно заряджених залишків лізину (або аргініну) в αβ- і γδ-ланцюгах ТкР та негативно
заряджених залишків аспарагінової кислоти в CD3-ланцюгах.
На поверхні зрілих наївних Т-клітин, що не контактували з антигеном, міститься 30 000-40 000
молекул ТкР.
Корецептори Т- і В-клітин — рецептори, що знаходяться поряд з ТкР або ВкР і розпізнають
структури, просторово наближені до антигену. Вони збільшують авідність взаємодії рецепторів з
антигеном, а також підсилюють інтенсивність сигналу про розпізнавання антигену, який
передається в клітину. До корецепторів Т-клітин належать молекули CD8 у Т-кілерів і CD4 у Т-
хелперів. На В-клітинах корецептор представлений комплексом з трьох молекул –
CD19/CD21/TAPA.
Корецептори Т-клітин мають специфічність до константних доменів МНС. Причому корецептор Т-
кілерів CD8 розпізнає константний домен α3 МНС І, а корецептор Т-хелперів CD4 — константний
домен β2 МНС II. Таким чином, наявність корецепторів на Т-клітинах зумовлює той факт, що Т-
кілери розпізнають антиген у комплексі з МНС І, а Т-хелпери — в комплексі з МНС II.
Корецепторний комплекс CD19/CD21/TAPA В-клітин взаємодіє з C3dg-компонентом комплементу,
який сорбується на бактеріальних клітинах, циркулюючих комплексах антигенів з антитілами,
агрегованих антигенах тощо. Отже, розпізнавання антигену Т- і В-клітинами часто супроводжується
розпізнаванням додаткових структур, що безпосередньо контактують з антигеном — МНС та C3dg
за допомогою корецепторів цих клітин.
Корецептори Т-лімфоцитів асоційовані в цитоплазматичній частині з кіназою Lck, а корецептор В-
клітин — з кіназою Fyn або Lyn, а також з РІ-3-кіназою та білком Vav. Функцію цих молекул у
сигнальній трансдукції буде описано далі.
10.2. ПЕРЕДАВАННЯ СИГНАЛУ ВІД РЕЦЕПТОРІВ ЛІМФОЦИТІВ
Повноцінна активація лімфоцитів відбувається за участю складної сигнальної системи, яка
забезпечує індукування та передавання сигналів у середину клітини як від антигену, так і від
костимуляторних мембранних молекул та розчинних факторів. Головний, специфічний, сигнал
клітина отримує від антигензв'язувальних рецепторів. Передавання сигналу від рецепторів
супроводжується формуванням сигнального каскаду з послідовним залученням ферментів і
адапторних білків, що пов'язані з рецепторним апаратом лімфоцита.
Основні класи тирозинових кіназ, що беруть участь у передаванні сиґналу від рецепторів
лімфоцитів. Тирозинові кінази, що беруть участь у передаванні сиґналу від антигенспецифічного
рецептора Т- і В-клітин, поділяють на чотири родини за спільними ознаками будови та гомологією
амінокислотних послідовностей. Слід підкреслити, що всі тирозинові кінази, крім каталітичної,
мають консервативні домени, які визначають взаємодію кіназ з певними субстратами, а також їх
локалізацію в сигнальному комплексі. Це, як правило, домени SH2 та SH3, а також домен РН, який є
характерним для кіназ Тес-родини.
Кінази Src-родини. Кінази Src-родини завжди сполучені з мембраною клітини за допомогою
залишків міристинової кислоти. У такому положенні їх активні центри знаходяться на рівні
цитоплазматичних частин СD3-комплексу в Т-лімфоцитах або Igα/β-комплексу в В-лімфоцитах.
Кінази Src-родини першими «відповідають» на розпізнавання антигену. Вони фосфорилюють
спеціальні послідовності ІТАМ (від англ. Immunoreceptor tyrosine based activation motive)
цитоплазматичних частин CD3- або Igα/β-комплексу. Кожний ІТАМ — це послідовність, що містить
два залишки тирозину на відстані 9—11 інших амінокислотних залишків. Обидва залишки тирозину
в ІТАМ мають бути фосфорильовані для успішного проходження сигналу.
У В-лімфоцитах тирозинові залишки, що входять до складу ІТАМ, фосфорилюються такими
кіназами Src-родини, як Lyn, Fyn, Blk і, можливо, Lck, тоді як у Т-лімфоцитів цю функцію
виконують в основному кінази Lck та Fyn.
Кінази Src-родини, як правило, нековалентно сполучені з цитоплазматичною частиною
корецепторів Т- і В-клітин. У Т-клітинах вони перебувають в асоціації з молекулами CD4 або CD8
(залежно від субпопуляції Т-клітин), а у В-клітинах — з корецепторним блоком, що складається з
трьох субодиниць – CD19, CD21 та ТАРА. Наближення корецептора до рецептора під час
розпізнавання антигену призводить до того, що кінази Src-родини розміщуються біля
послідовностей ІТАМ і фосфорилюють їх.
Розглянемо регуляцію функцій кіназ цієї родини на прикладі Src-кінази. Нормальна Src-кіназа
складається з кількох доменів: N-кінцевого SH3-домену, SН2-домену, каталітичного домену і С-
кінцевого «хвоста». З N-кінця до Src-кінази ковалентно приєднаний залишок міристинової кислоти,
необхідний для «заякорення» кінази в мембрані. Домени Src-кінази здатні до інтрамолекулярної та
міжмолекулярної взаємодії. Домени SH3 і SH2 пригнічують активність Src-кінази внаслідок
взаємодії з залишками, розміщеними по різні боки від каталітичного центру SН2-домен взаємодіє з
фосфотирозином рТуr527 хвостової ділянки. Цей залишок фосфорилюється іншою
цитоплазматичною кіназою Csk, яка є
негативним регулятором Src-кінази.
Внаслідок такої взаємодії каталітичний
центр Src-кінази позбавляється доступу до
субстратів. Утворюється замкнена
структура, яка стабілізується взаємодією
SН3-домену з послідовністю між SН2-
доменом і каталітичним доменом. Ця
послідовність містить тільки один залишок
проліну, тому SН3-домен зв'язується з нею
з невеликою афінністю (мал. 72).
У такій замкненій конформації кіназа
знаходиться в клітинах у нормі і є
неактивною, тому що субстрат не може
потрапити до активного центру кінази.
Активація кінази відбувається при
витісненні доменів SH3 та SH2, які беруть
участь в інтрамолекулярній взаємодії,
внаслідок міжмолекулярної взаємодії з
більш афінними лігандами. Для цього
повинно відбутися відщеплення
фосфатного залишку від Туr527 за
допомогою фосфатази. Як правило,
дефосфорилювання кіназ Src-родини в
клітинах імунної системи здійснює
фосфатаза CD45, тобто CD45 є активатором
кіназ Src-родини.
Кінази Syk/Zap-70-родини. Кінази Syk/Zap-
70-родини представлені в клітинах імунної
системи двома видами: Syk (у В-
лімфоцитах) і Zap-70 (у Т-лімфоцитах),
завдяки яким родина й дістала свою назву.
Ці кінази не містять залишків міристинової
кислоти, тому в нормі вони не асоційовані з
мембраною, тобто є цитоплазматичними
протеїнкіназами. Характерною ознакою
кіназ цієї родини є наявність розміщених один за одним двох SН2-доменів.
За допомогою тандему з двох SН2-доменів кінази Syk/Zap-70-родини здатні специфічно взаємодіяти
з двома фосфорильованими тирозинами, що входять до складу ІТАМ. По суті, фосфорильовані
послідовності ІТАМ є специфічними сайтами для взаємодії з кіназами Syk/Zap-70-родини. Після
того як кінази Src-родини фосфорилюють цитоплазматичні частини CD3 або Igα/Igβ, до цих частин
приєднуються кінази Syk/Zap-70-родини.
Кінази Tec-родини. Представники кіназ Тес-родини за будовою дуже нагадують кінази Src-родини,
однак, на відміну від останніх, вони не містять N-кінцевого залишку міристинової кислоти. Замість
нього у них є N-кінцевий РН-домен. РН-домени здатні приєднуватися до мембрани під час взаємодії
з ФІФ3, тому кінази Тес-родини можуть знаходитися як у цитоплазмі, так і в контакті з мембраною
клітини, залежно від наявності у клітинній мембрані ФІФ3. Отже, при активації в клітині РІ3-кінази,
яка утворює ФІФ3, кінази Тес-родини приєднуються до мембрани і залучаються в процес
передавання сигналу.
У пацієнтів із тяжкими формами імунодефіцитів, наприклад з хворобою Брутона, знайдено мутації в
генах, що кодують кінази Тес-родини (Btk). Можливою функцією кіназ цієї родини є активація
фосфоліпази Сγ, причому різні представники Тес-родини активують різні ізоформи фосфоліпаз.
У Т-клітинах знайдено щонайменше три представники кіназ Тес-родини — Тес, Itk і Rlk/Txk. У В-
клітинах найважливішу функцію в процесі передавання сигналу виконує інший представник цієї
родини — кіназа Btk.
Кінази Csk-родини. Csk-Родина тирозинових кіназ у клітинах імунної системи представлена однією
кіназою Csk (від англ. C-terminal Src kinase — кіназа С-кінця Src) — негативним регулятором кіназ
Src-родини. За своєю будовою Csk нагадує кінази Src-родини, однак вона не має залишку тирозину
на С-кінцевому «хвості» і міристинової кислоти на N-кінці молекули. Тому вона є
цитоплазматичною кіназою і постійно перебуває в активованому стані.
Формування сигнального комплексу. Розпізнавання антигену рецепторами Т- і В-клітин
супроводжується змінами конформацій цих рецепторів, які передаються до цитоплазматичних
частин допоміжних молекул CD3 або Igα/Igβ, та латеральною транслокацією корецепторів до
рецепторних комплексів. Ці зміни призводять до передавання сигналу всередину клітини. Для
нормального проходження сигналу потрібна участь сотень рецепторів на поверхні лімфоцита.
Залучення корецепторів до процесів розпізнавання антигену значно зменшує необхідну кількість
рецепторів. Усі рецептори, що розпізнали антиген, скупчуються на мембрані разом
(олігомеризуються), що є передумовою активації клітини.
Етапи передавання сигналу від ТкР і ВкР загалом дуже подібні. Вони відрізняються лише
специфічними представниками тих чи інших класів білків, що діють у різних клітинах. Для
прикладу розглянемо передавання сиґналу від антигенспецифічного рецептора Т-хелпера.
Антигенспецифічний рецептор Т-хелпера розпізнає антигенний пептид у комплексі з МНС II на
поверхні клітини, що презентує антиген. При цьому корецептор CD4 розпізнає константний домен
β2 молекули МНС II, внаслідок чого цитоплазматична частина CD4 розміщується безпосередньо
біля цитоплазматичних частин СD3-комплексу та ζ-ланцюгів. З цитоплазматичного боку з
молекулою CD4 сполучена кіназа Lck (представник Src-родини). Внаслідок просторового
наближення CD4 до CD3 кіназа Lck фосфорилює послідовності ІТАМ цитоплазматичних частин
CD3 комплексу та ζ-ланцюгів. Кожна субодиниця CD3 комплексу має по одній, а ζ-ланцюг — три
послідовності ІТАМ. Після фосфорилювання обох тирозинів у послідовності ІТАМ до кожної такої
послідовності приєднується кіназа Zap-70. Кіназа Lck також фосфорилює кіназу Zap-70, що
призводить до активації останньої. Можливо, що кінази Zap-70 активуються також у результаті
аутофосфорилювання та перехресного гомофосфорилювання. Активовані кінази Zap-70
фосфорилюють значну кількість інших білків, що входять до складу сигнального комплексу,
наприклад великі адапторні білки LAT та SLP-76 (мал. 73).
43
У Т-кілерів єдиною відмінністю від наведеної схеми є те, що кіназа Lck у них асоційована з
корецептором CD8.
Головним пусковим моментом активації В-лімфоцитів, як вважають, є перехресне зв'язування
рецепторів антигеном. Унаслідок цього кінази Src-родини активуються і фосфорилюють
цитоплазматичні частини Igα/Igβ. Цитоплазматичні частини молекул Igα/Igβ мають по одній
послідовності ІТАМ кожна. Замість ZAP-70 до фосфорильованих ІТАМ у В-клітинах приєднуються
кінази Syk. Активація кіназ Syk супроводжується приєднанням та фосфорилюванням великих
адапторних білків BLNK/SLP-65, що призводить до формування необхідного сигнального
комплексу. Роль корецепторів CD19/CD21/ ТАРА В-лімфоцитів пов'язана передусім з підсиленням
сиґналу, що надходить від рецепторів. Вважають, що залучення корецепторів дає змогу зменшити
потрібну для активації кількість IgM-рецепторів, що взаємодіють з антигеном, у 100 разів. В
асоціації з цитоплазматичною частиною комплексу CD19/CD21/TAPA можуть перебувати кінази
Fyn, Lyn та Blk, а також кіназа РІ-3К та білок Vav.
Важливо, що процеси активації В1- і В2-лімфоцитів дещо різняться. Для активації В1-лімфоцитів
головним є сигнал про розпізнавання антигену за допомогою ВкР, тоді, як В2-лімфоцити після
розпізнавання й інтерналізації антигену переходять лише в стан готовності до активації. Вони
представляють поглинутий антиген і «очікують» його розпізнавання активованими Т-хелперами.
Отже, для активації В2-лімфоцитів необхідний сигнал про розпізнавання на їх поверхні молекул
МНС II з процесованим антигеном. Чи може МНС II виступати як активаційний рецептор на
поверхні В-клітин, остаточно ще не з'ясовано. Однак певні дані свідчать на користь цього
припущення. Сиґнал від МНС II у В2-лімфоцитах, можливо, нагадує сигнал від ВкР і разом з
костимуляторними сигналами, які В-клітина отримує від Т-клітини, є необхідним для остаточної
активації цих клітин.
Залучення до складу сигнального комплексу великих адапторних білків LAT та SLP-76 у Т-
лімфоцитів та BLNK/SLP-65 у В-лімфоцитів є важливим ключовим моментом передавання сиґналу,
оскільки до цих білків приєднується ціла низка ферментів, кожний з яких зумовлює свій власний
шлях передавання сиґналу. Це, насамперед, фосфоліпаза Сγ, яка ініціює фосфатидилінозитольний
шлях передавання сиґналу, фосфатидилінозитол-3-кіназа, що зумовлює приєднання до мембрани
білків, які несуть РН-домени, та маленькі g-білки, які активують шлях МАР-кіназ. Розглянемо
кожний із цих шляхів подальшого передавання сиґналу детальніше.
Активація фосфоліпази Сγ та фосфатидилінозитольний шлях передавання сиґналу. У клітинах
вищих хребетних виявлено дві ізоформи фосфоліпази Сγ (PLСγ) — Сγ1 і Сγ2. Перша ізоформа
експресована в клітинах усіх типів, а друга характерна виключно для імунокомпетентних клітин.
Отже, у клітинах імунної системи, на відміну від інших типів клітин, експресовані обидві ізоформи
цього ферменту.
PLCγ приєднується до адапторних білків після їх фосфорилювання кіназами Syk/Zap-70-родини.
Субстратом PLCy є фосфоліпіди, які входять до складу плазматичної мембрани клітин. Наближення
каталітичного домену фосфоліпази до мембрани є необхідною умовою для потрапляння ФІФ2 до
активного центру PLCγ. Таке наближення стає можливим після зв'язування SH2- та SН3-доменів
фосфоліпази з адапторними білками, а РН-домену — з ФІФ3 мембрани.
Після зв'язування PLCγ з примембранним сигнальним комплексом відбувається її активація. В
цьому процесі беруть участь тирозинові кінази сигнального комплексу. Вважають, що в активації
PLCγ можуть брати участь тирозинові кінази трьох родин – Src, Syk/Zap-70 і Тес. Активація
фосфоліпази Сγ є ключовим моментом передавання сиґналу від антигенспецифічних рецепторів Т- і
В-клітин, оскільки вона продукує найважливіші вторинні месенджери ДАГ та ІФ3, які потрібні для
активації клітини. ДАГ залишається зв'язаним з мембраною, а ІФ3 потрапляє в цитозоль. ДАГ
активує мембранозв'язану форму протеїнкінази С (РКС), яка може фосфорилювати низку білків за
залишками серину й треоніну. Субстратами протеїнкінази С є деякі транскрипційні фактори,
рецептори та примембранні білки, а також
кіназа Raf-1. Активуючи кіназу Raf-1,
протеїнкіназа С здатна запускати інший шлях
передавання сигналу — шлях МАР-кіназ.
ІФ3 зв'язується з кальцієвими каналами
гладенького ендоплазматичного ретикулуму,
внаслідок чого канали відкриваються і йони
Са
2+
надходять у цитозоль. Слід зазначити,
що кожний канал відкривається тільки на
мілісекунди, після чого переходить у
неактивний стан. Саме тому для істотного
збільшення в цитоплазмі концентрації йонів
Са
2+
потрібна значна кількість молекул ІФ3.
Йони Са
2+
зв'язуються з кальмодуліном, який
активує кальмодулінзалежну серин-
треонінову фосфатазу кальциневрин, у
результаті чого остання активується і
дефосфорилює транскрипційний фактор NF-
AT. Після дефосфорилювання NF-AT мігрує
в ядро, де ініціює транскрипцію певних генів.
Крім того, йони Са
2+
зв'язуються з
цитоплазматичною формою РКС, унаслідок
чого РКС сполучається з мембранним ДАГ.
Отже, в активації РКС беруть участь обидва
вторинні месенджери, продуковані
фосфоліпазою Сγ: ДАГ — безпосередньо, а
ІФ3 — опосередковано, через йони Са
2+
(мал.
74).
Активація фосфатидилінозитол-3-кінази.
Фосфатидилінозитол-3-кіназа (РІ3-кіназа)
складається з двох субодиниць —
регуляторної р85 та каталітичної р110.
Регуляторна субодиниця містить кілька
доменів, які беруть участь у білок-білкових
взаємодіях: SН3-домен, два SН2-домени та
дві ділянки, багаті на залишки проліну. Ці
домени зв'язуються з багатьма
внутрішньоклітинними білками, внаслідок
чого регулюється локалізація та
функціональна активність РІ3-кінази. Так,
пролінбагаті послідовності зв'язуються з SH3-
доменами тирозинових кіназ Src-родини: Lyn та Fyn, SН2-домени р85 зв'язуються з
фосфорильованими тирозинами адапторних білків і відіграють важливу роль в активації кінази.
Зв'язування РІ3-кінази з при мембранними білками потрібне для розміщення каталітичної
субодиниці р110 біля мембрани, що забезпечує потрапляння субстрату до активного центру кінази.
Активацію РІ3-кінази підсилюють також g-білки, зокрема ГТФаза Ras, яка взаємодіє безпосередньо
з каталітичною субодиницею РІ3-кінази. Активована РІ3-кіназа фосфорилює інозитольне кільце
похідних фосфатидилінозитолу в положенні 3, перетворюючи, наприклад, фосфатидилінозитол-4,5-
дифосфат (ФІФ2) на фосфатидилінозитол-3,4,5-трифосфат (ФІФ3). ФІФ3 залишається в складі
мембрани, де він виконує функцію сайту зв'язування деяких сигнальних білків, що містять РН-
домени. Нагадаємо, що РН-домени входять до складу тирозинових кіназ Тес-родини (Btk, Itk та ін.),
фосфоліпази Сγ, а також фактора Vav, що активує ГТФази родини Rho. Отже, при активації РІ3-
кінази і накопиченні ФІФ3 у мембрані всі ці білки приєднуються до мембрани, що є необхідною
умовою для подальшого проходження сигналу.
У клітинах, що не містять РІ3-кіназу, спостерігається дуже слабка активність фосфоліпази Сγ у
відповідь на стимуляцію рецепторів. Це пов'язано з тим, що для активації фосфоліпази Сγ потрібні
кінази Тес-родини, а для активації кіназ Тес-родини та їх наближення до фосфоліпази Сγ потрібний
ФІФ3, який продукується РІ3-кіназою. Тому РІ3-кіназа підсилює сигнал, що передається
фосфоліпазою Сγ. Проте, з іншого боку, РІ3-кіназа та фосфоліпаза Сγ «працюють» з одним
субстратом — ФІФ2 і здатні конкурувати за нього. Така конкуренція за субстрат є важливою для
регулювання інтенсивності й тривалості передавання сигналу, а також може зумовлювати зміни
концентрації йонів Са
2+
в цитоплазмі при відповіді на подразнення рецептора. Отже, основною
функцією РІ3-кінази є модуляція активності фосфоліпази Сγ, яка є ключовим ферментом
передавання сигналу від антигенспецифічних рецепторів Т- і В-клітин.
Активація каскаду МАР-кіназ. Приєднання адапторних білків до сигнального комплексу та їх
фосфорилювання тирозиновими кіназами призводить також до активації маленьких g-білків Ras і
Rho. Зв'язані з ГТФ форми Ras- і Rho-ГТФаз активують каскад МАР-кіназ (від англ. Mitogen-
activated protein kinase — активовані мітогенами кінази).
Каскад МАР-кіназ — це послідовна активація трьох різних серин-треонінових кіназ, які активують
одна одну шляхом фосфорилювання. Їх позначають відповідно МАР-кіназа (МАРК), кіназа МАР-
кінази (МАРКК) та кіназа кінази МАР-кінази (МАРККК). Каскад МАР-кіназ починається з активації
МАРККК, яка здійснюється за допомогою маленьких g-білків, таких як Ras і Rho. Ці білки
активують різні каскади МАР-кіназ, які спричинюють експресію різних транскрипційних факторів.
При зв'язуванні з ГТФ Ras- і Rho-ГТФ-ази набувають конформації, необхідної для безпосередньої
взаємодії з МАРККК та їх активації. Однак Ras і Rho швидко розщеплюють ГТФ до ГДФ і фосфату
й переходять у неактивний стан. У цьому стані вони можуть існувати досить довго, оскільки самі не
здатні звільнятися від ГДФ і зв'язувати нову молекулу ГТФ.
Для заміни ГДФ на ГТФ потрібні додаткові білки — так звані фактори, що заміщують гуанін.
Заміщення ГДФ на ГТФ для білка Ras здійснює фактор Sos, для білка Rho — фактор Vav, причому
ці фактори сполучаються з маленькими g-білками Ras і Rho за допомогою спеціалізованих
адапторів. Маленькі адаптори приєднуються до великих адапторів, таких як LAT та BLNK, що
входять до складу сигнальних комплексів. Тому початкові етапи передавання сигналу, які
призводять до приєднання і фосфорилювання адапторних білків, потрібні також для активації
каскаду МАР-кіназ.
Схематично послідовність подій, пов'язаних із передаванням сигналу по шляху МАР-кіназ, можна
подати так:
Великі адапторні білки (LAT, BLNK та ін.) → Маленькі адапторні білки (Grb2 та ін.) → Фактори,
що заміщують гуанін (Sos, Vav) → g-Білки (Ras, Rho) → МАРККК → МАРКК → МАРК →
Активація генів транскрипційних факторів.
У клітинах імунної системи МАРККК представлені кіназами Raf та Mekk. Кожна з них активує різні
МАРКК, тому можна записати два основних шляхи передавання сигналу за допомогою МАР-кіназ.
1. Перший шлях передавання сигналу:
МАР-Кіназа Erk (від англ. extracellular activated kinase — кіназа, що активується позаклітинними
сигналами, спричинює активацію фактора транскрипції Elk, який, у свою чергу, ініціює
транскрипцію гена Fos.
2. Другий шлях передавання сигналу:
МАР-Кіназа Jnk (від англ. Jun-N-terminal kinase — кіназа N-кінця фактора Jun) зумовлює активацію
протоонкогена Jun.
Продукти протоонкогенів Jun і Fos об'єднуються, внаслідок чого утворюється фактор транскрипції
АР-1, що є головним наслідком передавання сигналу по каскаду МАР-кіназ та ініціює транскрипцію
генів, необхідних для поділу клітини.
Слід додати, що існують й інші шляхи активації каскаду МАР-кіназ, наприклад за допомогою
протеїнкінази С (див. мал. 74).
Процеси реорганізації цитоскелета. Цитоскелет бере участь у регуляції процесів
внутрішньоклітинного переміщення білкових молекул та мембранних везикул. Він також регулює
форму й рухливість клітини, формує випинання та інвагінації мембрани, зумовлює формування
ендоцитозних везикул та поглинання рецепторів. Існує складна система білків, які контролюють
процеси реорганізації цитоскелета в клітині. Функціонування цих білків регулюється процесами, які
супроводжують передавання сигналу в середину клітини. В регуляції процесів полімеризації актину
беруть участь як продукти фосфатидилінозитидного шляху, так і йони кальцію. Важливу функцію в
регуляції реорганізації цитоскелета виконують g-білки, зокрема ГТФази родини Rho.
Отже, завдяки зв'язку з мембранними рецепторами цитоскелет може регулювати форму клітини,
положення рецепторів на мембрані, їх олігомеризацію (кепінг), а також тривалість «життя»
рецепторів на мембрані.
Вважають, що деякі молекули, які передають сигнал від рецепторів, зокрема кінази Src-родини, а
також молекули, що несуть РН-домени, асоційовані з ліпідними острівцями із цитоплазматичної
частини мембрани. Після перехресного зв'язування рецепторів з антигеном на поверхні клітини
ліпідні плотики збираються разом, утворюючи ділянку, необхідну для проходження сигналу в
клітину. В такій ліпідній ділянці крім рецепторів знаходяться заякорені, наприклад, за допомогою
залишків міристинової кислоти ферменти, що здатні передавати сигнал, а також попередники
вторинних месенджерів — фосфатидилінозитолдифосфати та їхні метаболіти. Отже, агрегація
рецепторів на поверхні клітини призводить до того, що з цитоплазматичного боку мембрани
збираються ферменти, необхідні для передавання сигналу.
Активація транскрипційних факторів. Усі розглянуті сигнальні шляхи ведуть до активації певних
транскрипційних факторів і експресії певних генів у клітині. Те, які транскрипційні фактори і в
якому співвідношенні активуються у відповідь на стимуляцію рецепторів, визначає подальшу долю
клітини.
Для активації лімфоцитів необхідно, щоб у результаті стимуляції рецепторів активувалися
принаймні три головних транскрипційних фактори — NF-AT (від англ. nuclear factor of activated T-
cells — ядерний фактор активованих Т-клітин), NF-кВ (від англ. nuclear factor for к-chain expression
in B_-cells — ядерний фактор, необхідний для експресії к-ланцюга імуноґлобулінів у В-клітинах) та
АР-1.
NF-AT активується в кінці фосфатидилінозитидного шляху внаслідок дії на нього фосфатази
кальциневрину, NF-кВ — завдяки активації специфічною фосфатазою фактора NF-кВ, яка
активується протеїнкіназою С, а фактор АР-1 утворюється внаслідок поєднання факторів Fos і Jun,
які активуються в кінці різних каскадів МАР-кіназ. Ці фактори активують експресію генів, які
необхідні для переходу клітини в активний стан, тобто на початок клітинного циклу. Такими генами
є насамперед гени цитокінів, їх рецепторів та костимуляторних молекул. Цитокіни й
костимуляторні молекули потрібні для подальшого проходження клітиною цього циклу —
проходження так званої точки рестрикції, яка знаходиться приблизно в середині G1-фази клітинного
циклу. Проходження цієї точки безповоротно детермінує клітину до поділу. Головним геном,
експресія якого активується внаслідок проходження сигналу від рецепторів клітин, є ген ІЛ-2.
ІЛ-2 зумовлює подальші процеси активації лімфоцита внаслідок аутокринної дії на рецептори
клітини, яка продукує цей інтерлейкін. Таким чином, клітина сама себе стимулює до повної
активації та проходження клітинного циклу.
10.3. ДОДАТКОВІ СИГНАЛИ, НЕОБХІДНІ ДЛЯ АКТИВАЦІЇ ЛІМФОЦИТІВ.
Для повноцінної активації лімфоцитів потрібно три сигнали. Перший сигнал клітина отримує, як
зазначалося вище, при розпізнаванні антигену за допомогою специфічних до антигену рецепторів за
участю корецепторних молекул. Цей сигнал називають специфічним, тому що антиген
розпізнається лише певними клонами лімфоцитів за допомогою специфічних до нього рецепторів.
Другий сигнал клітина отримує при безпосередньому контакті з іншою клітиною, яка також
розпізнала той самий антиген і є вже активованою. Цей сигнал зумовлений взаємодією мембранних
костимуляторних молекул обох клітин, і для його отримання необхідний щільний контакт між
мембранами клітин, що взаємодіють. Зону контакту між клітинами називають імунним синапсом. Як
правило, імунний синапс формується між АПК і Т-клітиною.
Третій сигнал клітина отримує від цитокінів — розчинних білкових факторів, що діють на
спеціалізовані рецептори клітин. Цитокіни, по суті, є гормонами, які регулюють функції клітин
імунної системи. Проте, на відміну від гормонів, концентрація цитокінів у крові та лімфі дуже мала,
тому вони діють локально в місці їх синтезу. Цитокіни продукуються лейкоцитами і можуть діяти
як на власне клітину-продуцента (аутокринно), так і на інші клітини (паракринно): безпосередньо в
«щілині» імунного синапсу або дистантно в разі відсутності тісного контакту між клітинами.
Потреба в такій складній трисигнальній системі активації зумовлена тим, що костимуяторні
молекули експресуються тільки активованими клітинами, а рецептори до них існують ще на наївних
клітинах. Отже, активувати наївний Т-лімфоцит може лише активована АПК, а активувати АПК
(зокрема, В-лімфоцит) може лише активований Т-лімфоцит (зокрема, Т-хелпер). Більшість
антигенів розпізнають двома типами клітин – АПК і Т-лімфоцитами. Між цими двома типами
установлюються функціональні зв'язки, які називають клітинною кооперацією. АПК і Т-лімфоцит,
що потенційно здатні відповідати на певний антиген, повинні знайти один одного й утворити
імунний синапс. Такий синапс потрібний як для активації неактивованої АПК активованим Т-
хелпером, так і для активації наївних Т-лімфоцитів активованими АПК. Якщо обидва партнери
неактивовані, контакт між ними не відбудеться, і вони не зможуть активувати один одного. Таке
розпізнавання антигенів одночасно двома клітинами, що взаємодіють, — АПК і Т-лімфоцитом —
підвищує надійність системи імунітету та запобігає помилковій активації ефекторних клітин.
У процесі взаємодії клітин костимуляторні молекули та їхні рецептори утворюють пари, які
забезпечують формування міжклітинних контактів і обмін сигналами, що призводять до активації
клітин (в активації бере участь значна кількість пар молекул). У кожній парі одна молекула є
постійною — експресується на наївній клітині, інша — індукованою і експресується лише на
активованій клітині. Сигнал, що виникає внаслідок взаємодії молекул, передається в напрямі від
індукованої до постійної, тобто постійна молекула є рецептором, а індукована — її лігандом.
Особливе значення в обміні сигналами між
АПК (ДК, МФ, В-клітинами) і Т-
лімфоцитами мають дві пари молекул:
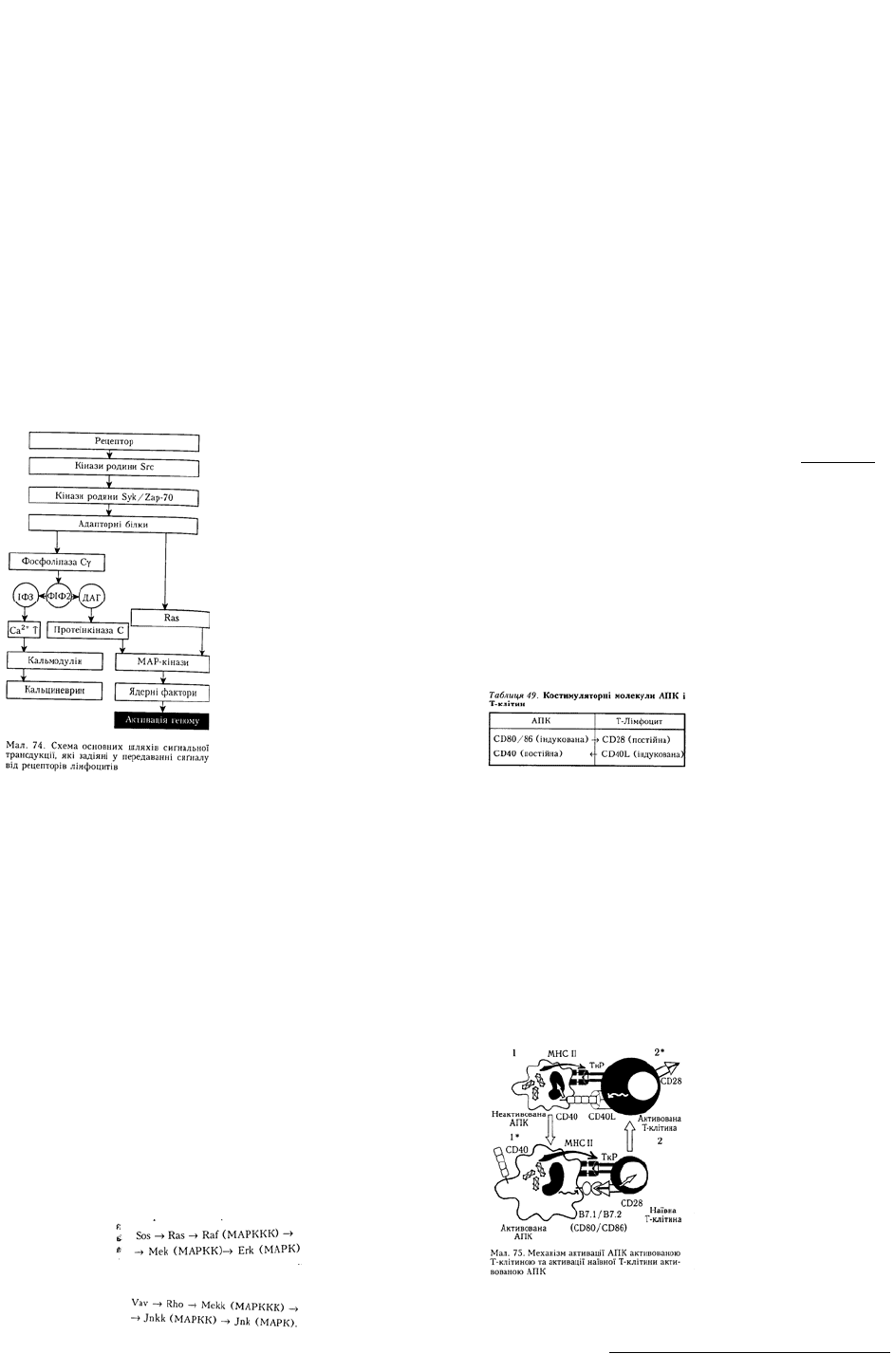
CD80/86 і CD28 та CD40L і CD40 (табл. 49).
Костимуляторні молекули, потрібні для
активації АПК. Першим сиґналом, що
активує АПК, є перехресне зв'язування
поверхневих рецепторів антигеном. При
цьому В-лімфоцити розпізнають антиген
специфічно, за допомогою
імуноґлобулінових рецепторів. Макрофаги і
дендритні клітини можуть розпізнавати антиген як за допомогою лектинових рецепторів, так і за
допомогою рецепторів до опсонінів (FcR, C3bR). Після перехресного зв'язування поверхневих
рецепторів антигеном відбувається поглинання та процесинг антигену. На поверхні такої АПК
з'являються МНС II з пептидними фрагментами антигену, які можуть бути сайтами для зв'язування з
рецепторами Т-клітин.
Другий сиґнал — сиґнал від рецептора CD40 — наївні АПК отримують при взаємодії з
активованими Т-лімфоцитами, які несуть на поверхні ліганд до цього рецептора – CD40L. Взаємодія
CD40 з CD40L зумовлює наступний етап активації АПК, внаслідок чого АПК починає експресувати
костимуляторні молекули CD80 (В7.1) та CD86 (В7.2) і секретувати залежно від типу АПК низку
цитокінів: ІЛ-1, ІЛ-6, ІФН-γ та ін. На такій АПК підвищується також рівень експресії рецепторів до
цитокінів, внаслідок чого вона стає чутливішою до сприйняття третього сигналу і вже сама може
активувати наївні Т-клітини.
Після сприйняття третього сигналу від цитокінів АПК (зокрема, В-лімфоцит) повністю активується,
проходить кілька клітинних циклів і диференціюється в ефекторну клітину. Слід зазначити, що саме
цитокіни остаточно визначають напрям диференціювання активованої АПК, наприклад, ІЛ-4 та ІЛ-5
переключають синтез антитіл В-лімфоцитами з IgM на IgE, а ІЛ-2 – з IgM на IgG.
Костимуляторні молекули, необхідні для активації Т-лімфоцитів. Т-лімфоцити при взаємодії з
АПК отримують перший і другий активаційні сигнали одночасно. Перший сиґнал — це сиґнал від
ТкР, який розпізнає представлений на АПК комплекс антигенного пептиду з МНС, другий сиґнал —
від костимуляторних молекул CD80 (В7.1) та CD86 (В7.2), що містяться на активованих АПК.
Наївні Т-лімфоцити несуть рецептор до цих костимуляторних молекул, який позначається CD28.
Взаємодія CD28 з В7.1/В7.2 є важливою для подальшого проходження процесу активації Т-клітин.
Вона індукує експресію Т-клітиною костимуляторних молекул CD40L, які потрібні для активації
АПК, а також ІЛ-2 та високоафінних рецепторів до ІЛ-2. Подальший процес диференціювання Т-
лімфоцитів залежить від дії цитокінів. У разі відсутності зовнішніх впливів Т-клітини можуть
активувати самі себе за допомогою ІЛ-2, який діє аутокринно через рецептор до ІЛ-2. Інші цитокіни,
що надходять із клітинного оточення, регулюють диференціювання Т-хелперів у Т-хелпери І і II
класу. Активовані СD4Т-хелпери можуть активувати різні типи неактивованих АПК, а CD8T-кілери
— знищувати інфіковані клітини. Важливо, що Т-клітини, які не мають рецептора CD28, можуть
специфічно пригнічувати активацію АПК, зумовлюючи цим супресію імунної відповіді.
Загальна схема активації АПК і Т-
клітин. З наведеного вище випливає, що
для активації Т-клітин головним
костимуляторним сиґналом є сиґнал через
рецептор CD28, а для активації АПК —
через рецептор CD40. Загальну схему
активації АПК та Т-клітин наведено на мал.
75. Наївна АПК (1) експресує МНС II з
антигеном та рецептор CD40. Активований
Т-хелпер (2*) експресує специфічний для
взаємодії з МНС II та пептидом ТкР, а
також CD40L, за допомогою якого він
активує АПК. У відповідь на активацію
АПК починає експресувати CD80 та CD86 і
переходить в активований стан (І*). У
такому стані вона може взаємодіяти з
наївним Т-лімфоцитом (2), який несе
рецептор CD28 до CD80/ CD86 та ТкР
необхідної специфічності. Така Т-клітина
починає експресувати CD40L і переходить
у стан активації (2*). Отже, у системі
активаційних взаємодій виникає
позитивний зворотний зв'язок, який
призводить до збільшення кількості
активованих клітин у ході імунної
відповіді.
Виникає запитання, яким чином
починаються імунні реакції? Справді,
наївні Т-хелпери можуть бути активовані тільки за допомогою активованих АПК, а ці АПК
активуються, в свою чергу, за допомогою активованих Т-хелперів. Однак виявляється, що дендритні
клітини є винятком з цього правила. Вони переходять в активний стан при поглинанні чужорідних
субстанцій. Активацію дендритних клітин зумовлюють імунні комплекси природних антитіл з
антигеном, перехресне зв'язування поверхневих лектинових рецепторів полімерними структурами
антигенів, а також різні медіатори запалення. Для того щоб дендритна клітина почала експресувати
достатню кількість костимуляторних молекул CD80 та CD86, вона не потребує попередньої
взаємодії з Т-хелпером. Тому дендритні клітини — це єдиний тип АПК, який може ініціювати
імунну відповідь. Отже, система природного імунітету першою вступає у взаємодію з антигеном та
ініціює специфічні імунні реакції.

44
Формування імунного синапсу. Формування контакту між Т-клітиною та АПК відбувається за
участю різних молекул клітинної поверхні. У цьому процесі, безперечно, важливу роль відіграє
взаємодія між МНС та ТкР, між МНС та CD4, а також між костимуляторними молекулами та їх
лігандами.
Проте якщо в АПК миші ввести гени людини, що кодують МНС та костимуляторні молекули, то
такі АПК не спроможні активувати наївні Т-клітини людини. Для того щоб АПК миші набули
здатності формувати імунний синапс з лімфоцитами людини, в них потрібно також ввести гени
людини, що кодують молекули адгезії. Молекули адгезії — це мембранні глікопротеїни клітин, які
зумовлюють міжклітинні контакти або взаємодію клітин з позаклітинним матриксом. Відомі
молекули адгезії мають імуноґлобулінову, лектинову та інтегринову природу. Для взаємодії Т-
лімфоцитів та АПК найважливішими є дві пари молекул адгезії: LFA-1, які взаємодіють з ІСАМ-1,
та LFA-3, які взаємодіють із CD2. Молекули ІСАМ-1 та CD2 належать до рецепторів
імуноґлобулінової, а молекули LFA-1 та LFA-3 — до рецепторів інтегринової суперродини. LFA-1
та ІСАМ-1 представлені як на Т-клітинах, так і на АПК, тоді як CD2 характерний виключно для Т-
клітин. До речі, саме цю ознаку Т-клітин використовують для підрахунку кількості Т-клітин людини
за допомогою методу утворення розеток з еритроцитами барана, оскільки еритроцити барана несуть
рецептор, специфічний до CD2 людини.
Формування імунного синапсу — це багатостадійний процес, у ході якого послідовно
встановлюються зв'язки між різними парами молекул обох клітин. Молекули адгезії — це досить
великі за розмірами молекули, через що вони виділяються серед інших рецепторів на поверхні
клітини і вступають у контакт першими. Під час контакту, що відбувається за допомогою молекул
адгезії, одна клітина ніби котиться по поверхні іншої. Важливо, що молекули адгезії інтегринового
типу LFA-1 та LFA-3 можуть перебувати у «відкритому» або «закритому» стані залежно від стадії
активації клітини, причому в різних станах молекули LFA мають різну афінність до своїх лігандів.
Активовані клітини здатні до активнішого контакту з іншими клітинами, ніж неактивовані, що є
необхідним для пошуку клітин — партнерів по взаємодії.
Під час взаємодії клітин за допомогою молекул адгезії стає можливим контакт різних пар
костимуляторних молекул: В7.1/В7.2 з CD28 та CD40 з CD40L. Взаємодія за допомогою цих
молекул наближує ТкР і корецептори CD4 (CD8) до МНС II (МНС І), тобто розпізнавання антигену
стає можливим тільки після взаємодії молекул адгезії й костимуляторних молекул. Таким чином,
молекули адгезії та костимуляторні молекули сприяють контакту МНС з ТкР, підсилюють авідність
взаємодії двох клітин. Однак остаточне формування імунного синапсу відбувається після
специфічного контакту МНС з ТкР. Якщо такий контакт не відбувся, клітини «розходяться» для
пошуку інших партнерів по взаємодії.
Нещодавно виявилося, що в зоні контакту
молекули розміщуються не рівномірно, а у
вигляді концентричних кілець (мал. 76).
Центральне коло займають МНС з
антигенними пептидами, навколо нього
розміщується кільце з костимуляторних
молекул, а по периферії — молекули адгезії.
Отже, під час формування імунного синапсу
відбувається агрегація однакових
рецепторів, яка є важливою для активації
клітини.
Усі сигнали, які потрібні для активації
клітини, зокрема перехресне зв'язування
рецепторів антигеном, зв'язування
мембранних костимуляторних молекул та
висока локальна концентрація цитокінів
спостерігаються саме в зоні контакту двох
клітин. Тому імунний синапс можна вважати
ще одним засобом запобігання помилковій
активації клітин імунної системи.
Сиґналінг від костимуляторних молекул.
Сигнал, який передається від
костимуляторних молекул, найімовірніше,
лише підсилює сигнал від специфічних до
антигену рецепторів. На користь такого
припущення свідчить той факт, що за
відсутності стимуляції деяких
костимуляторних молекул активація клітин
може відбуватися, але за допомогою значно
більших доз антигену. Наприклад, миші, в
яких було зруйновано гени CD40 і CD40L, все-таки могли утворювати плазматичні клітини, однак у
відповідь на введення значно більших доз антигену.
Було показано, що рецептори костимуляторних молекул пов'язані з низкою сигнальних білків, які
активуються при зв'язуванні лігандів з цими рецепторами. Ймовірно, під час агрегації корецепторів
у зоні контакту клітин відбувається їх фосфорилювання мембранозв'язаними кіназами Src-родини,
що формує сайти зв'язування для різних сигнальних молекул: великих адапторних білків, РІ-3-
кінази, а також фактора Vav, який активує маленькі ГТФази Rho та Ras. Отже, костимуляторні
рецептори збільшують розміри сигнального комплексу за допомогою залучення додаткових
адапторних білків, завдяки чому збільшується інтенсивність передавання сигналу. Крім того,
активація РІ-3-кіназа потрібна для залучення до мембрани більшої кількості кіназ Тес-родини, що
важливо для посилення активації фосфоліпази Сγ. Фактор Vav підсилює каскад МАР-кіназ.
Важливо також, що ГТФази Rho і Ras можуть активувати фосфатидилінозитол-4-фосфат-5-кіназу
(РІР-5К — від англ. phosphatidylinositol-4-pliosphate 5-kinase), яка генерує ФІФ2 — субстрат для
фосфоліпази Сγ та РІ-3-кіназу. РІР-5К фосфорилює попередник фосфатидилінозитол-4,5-дифосфату
— фосфатидилінозитол-4-фосфат. Тому активація РІР-5К важлива для підтримання тривалої роботи
PLC-γ та РІ3-кінази.
Деякі дослідники вважають, що роль костимуляторних рецепторів полягає лише в збільшенні
ліпідних острівців унаслідок агрегації більшої кількості мембранних рецепторів. Це призводить до
залучення більшої кількості кіназ Src-родини в зону контакту клітин та їх активації, що підсилює
сигнал від ВкР та ТкР.
Отже, усі відомі на сьогодні сигнальні шляхи, пов'язані зі стимуляцією костимуляторних
рецепторів, ведуть до підсилення різних ланок передавання сигналу від ВкР та ТкР. Однак важливо,
що сама по собі стимуляція костимуляторних рецепторів не призводить до активації клітин і навіть
не спричинює помітних змін у метаболізмі цих клітин.
Сигнальна трансдукція від цитокінових рецепторів. Першим етапом дії цитокінів є зв'язування зі
специфічним рецептором на поверхні клітини-мішені. А індукція й передавання сигналу від
цитокінових рецепторів пов'язана з їх олігомеризацією. Особливістю внутрішньоклітинних доменів
цитокінових рецепторів (передусім рецепторів до гемопоетичних цитокінів, яким залежить важлива
роль у проліферації клітин імунної системи, — інтерлейкінів 2, 3, 4, 5, 6, 7, 9, 11, 15, Г-КСФ, ГМ-
КСФ) є відсутність власної протеїнкіназної активності. Проте вони, як правило, нековалентно
асоційовані з кіназами Jak.
У середині 90-х років XX ст. було запропоновано відносно просту модель сигнальної трансдукції,
яка полягала в тому, що кінази Jak активуються при олігомеризації рецепторів, яка індукується
після зв'язування ліганду. Після цього вони фосфорилюють транскрипційні фактори STAT за
тирозиновими залишками, що дає змогу молекулам STAT димеризуватися. Димеризація стимулює
їх транслокацію в ядро, підвищує їх здатність зв'язуватися з ДНК і регулювати експресію генів.
Було показано, що для багатьох цитокінових рецепторів (наприклад, до ІЛ-2, ІЛ-3, ІЛ-5, Епо, КСФ-
ГМ) ця базова модель відповідає дійсності.
Пізніше було відкрито альтернативні шляхи сигнальної трансдукції від цитокінових рецепторів.
Найпоширенішим є шлях сигнальної трансдукції: цитокіновий рецептор /Ras/Raf/Mek/Erk(MAPK-
каскад), який може призводити до фосфорилювання та активації в подальшому додаткових кіназ і
транскрипційних факторів.
Встановлено, що більшість рецепторів до цитокінів є багатосубодиничними, причому одна
субодиниця (зазвичай α) важлива для специфічного зв'язування цитокіну, а друга (або іноді й третя)
важлива для передавання сигналу в клітину. Часто ця друга субодиниця входить до складу
рецепторів до різних цитокінів. Наприклад, у разі природженої відсутності γ-ланцюга рецептора ІЛ-
2, спільного з низкою інших рецепторів, імунна система значно ушкоджується внаслідок відсутності
функціональних цитокінових рецепторів до ІЛ-4, -7, -9. Це призводить до розвитку тяжкого
комбінованого імунодефіциту.
Багато цитокінових рецепторів існують як у зв'язаній з мембраною, так і у вільній формах. Вільна
форма рецептора може утворюватися внаслідок протеолітичного відщеплення трансмембранного
домену рецептора або альтернативного сплайсин-гу мРНК-рецептора. Ці вільні рецептори можуть
діяти як інгібітори цитокінів.
10.4. РЕГУЛЯЦІЯ ПРОЦЕСІВ АКТИВАЦІЇ. РЕЦЕПТОРИ, ЩО ПРИГНІЧУЮТЬ
АКТИВАЦІЮ ЛІМФОЦИТІВ.
На кожному етапі існує негативна регуляція процесів активації за допомогою біохімічних
механізмів, які можуть за певних умов пригнічувати передавання сиґналу від ТкР та ВкР після
розпізнавання антигену. Так, кінази Csk фосфорилюють кінази Src-родини, внаслідок чого останні
переходять у неактивний стан. Протеїнові фосфатази SHP-1 та SHP-2 (англ. SН2-domain containing
protein phosphatase — протеїнова фосфатаза, що містить домен SH2) відщеплюють фосфатні
залишки від цитоплазматичних частин CD3 та Іgα/Igβ, які були попередньо фосфорильовані
кіназами Src-родини. Фосфатази SНІР та SHIP-2 (англ. SH2-domain соntaining phosphatidyl-inositol
phosphatase -- фосфатаза фосфатидилінозитолу, що містить домен SH2) є фосфатазами
фосфоліпідів. Вони дефосфорилюють субстрат фосфоліпази Сγ — фосфатидилінозитол-4,5-
дифосфат (ФІФ2), переводячи його в неактивний фосфатидилінозитол-5-фосфат (ФІФ).
Передавання сиґналу від рецепторів також може негативно регулюватися за допомогою механізмів
ендоцитозу рецепторів, зібраних разом на мембрані.
Отже, кінцевий результат активації клітини залежить від співвідношення активаційних та
інгібіторних сигналів, які виникають у ході розпізнавання антигену. Це важливо як для контролю за
кількістю активованих клітин в організмі, так і для індукції толерантності «на периферії» у
потенційно аутоімунних лімфоцитів, що помилково уникли негативної селекції в в первинних
лімфоїдних органах. Індукування толерантності може відбутися в разі недостатньої кількості
костимуляторних сигналів. У такому випадку гальмівні механізми в процесі передавання сиґналу
випереджають активаційні.
Крім того, існують спеціалізовані рецептори, функція яких полягає в інгібуванні процесів активації
клітин імунної системи. Сигнал через ці рецептори клітини отримують при надмірній активації
клітин в організмі та дефіциті антигену. Нині відомо кілька інгібіторних рецепторів Т- і В-клітин,
однак ми розглянемо два найбільш вивчені представники цієї групи: інгібіторний рецептор Т-клітин
— CTLA-4 та інгібі-торний рецептор В-клітин — FcγRIIB.
Усі інгібіторні рецептори мають у цитоплазматичній частині спеціальну послідовність, яка дістала
назву ІТІМ (від англ. immunocorector tyrosine based inhibition motive — ітібіторна послідовність
імунних рецепторів, що містить залишок тирозину), яка трохи відрізняється за амінокислотним
складом від ІТАМ. ІТІМ, як і ІТАМ, також може бути фосфорильованим за допомогою кіназ Src-
родини. Фосфорильований ІТІМ може слугувати місцем зв'язування для SН2-доменів фосфатаз
родин SHIP та SHP. Отже, якщо інгібіторні рецептори CTLA-4 та FcγRIIB потраплять до складу
активаційного комплексу, вони притягнуть туди фосфатази SHIP та SHP, і активація клітини
гальмуватиметься.
Лігандом для зв'язування з CTLA-4 є костимуляторні молекули CD80 та CD86, що експресуються на
активованих АПК. CTLA-4 має більшу афінність до них, ніж CD28, тому за наявності невеликої
кількості CD80 та CD86 на поверхні АПК з ними зв'яжеться переважно CTLA-4, а не CD28, і
інгібіторний сиґнал переважатиме над активаційним. Отже, активовані АПК з недостатнім рівнем
експресії CD80 та CD86 можуть бути інгібіторами імунної відповіді.
Рецептор FcγRIIB є, по суті, рецептором до Fc-фраґмента IgG, який може зв'язувати IgG у складі
циркулюючих імунних комплексів. Якщо ВкР має специфічність до того самого антигену, що й IgG,
який зв'язався з FcγRIIB, це може призвести до перехресного зв'язування ВкР та FcγRIIB одним
антигеном (мал. 77). У цьому випадку
фосфатази SHIP та SHP будуть
підтягнуті рецептором FcγRIIB до
цитоплазматичних частин Igα/Igβ, що
гальмуватиме проходження
активаційного сигналу. Тому наявність в
організмі значної кількості специфічних
до антигену IgG може бути сигналом для
припинення активації нових В-клітин
цієї специфічності. Таким чином вдалося
пояснити давно відомий факт, що велика
кількість екзогенних антитіл, введених
проти будь-якого антигену, пригнічує
утворення організмом власних антитіл.
До речі, цей факт покладено в основу
способу запобігання резус-конфлікту,
який давно застосовується і полягає у
введенні резус-негативним матерям після
пологів великої кількості антитіл до
резус-фактора. Це гальмує імунізацію
самої матері еритроцитами дитини, які
могли потрапити в її кров під час
пологів.
Отже, в процесах активації лімфоцитів
беруть участь як позитивні, так і
негативні зворотні зв'язки, які регулюють
кількість активованих клітин.
Яким чином призупиняються імунні
реакції? Річ у тім, що всі зрілі активовані
ефекторні клітини характеризуються
певною тривалістю існування в
активному стані: для плазматичних
клітин це 3 — 4 доби, для Т-хелперів —
до 10 діб, а Т-кілерів — менше доби.
Така невелика тривалість життя
потрібна, ймовірно, для того, щоб помилково активовані лімфоцити не завдали організму значної
шкоди. За час свого життя клітини встигають виконати певну кількість роботи зі звільнення
організму від антигену, після чого в них включаються механізми запрограмованої загибелі —
апоптозу. Велика кількість активованих клітин у ході імунної відповіді підтримується процесами
постійної активації нових лімфоцитів антигеном та проліферації подібно до того, як під час війни до
армії постійно набирають нових рекрутів. Коли в організмі вже немає антигену, активація нових
лімфоцитів припиняється, а вже активовані живуть недовго. Так згасає імунна відповідь, однак
залишаються клітини пам'яті, які живуть досить довго (див. розд. 11) і здатні дуже швидко
реагувати на повторне потрапляння антигену в організм.
10.5. ІНДУКОВАНИЙ АКТИВАЦІЄЮ АПОПТОЗ ЛІМФОЦИТІВ.
В основі імунної відповіді лежить експансія певних клонів активованих антигеном специфічних
лімфоцитів. Тому дуже важливо, щоб організм міг швидко позбавлятися від цих клонів, оскільки
неконтрольована проліферація лімфоцитів може спричинити загрозу розвитку
лімфопроліферативних чи аутоімунних захворювань. Щоб уникнути цих негативних наслідків,
імунна система використовує певні механізми елімінації «надлишку» активованих клітин. Цей
процес дістав назву «індукованої активацією клітинної загибелі» AICD (від англ. activaton induced
cell death) і є неминучим для активованих антигеном лімфоцитів, якщо вони не отримали всі
необхідні активаційні стимули. У разі будь-яких порушень нормального перебігу процесів активації
лімфоцитів вони, як правило, переходять у стан анергії чи гинуть шляхом апоптозу. Стан анергії
здебільшого через 3 — 4 доби закінчується також апоптозом. Отже, апоптоз є універсальним
засобом запобігання помилковій активації лімфоцитів.
Правильно активовані лімфоцити, якщо вони не перетворяться на клітини пам'яті, після
проліферації, диференціювання та виконання ефекторних функцій також гинуть апоптозом. Отже,
можна сказати, що, активуючись, лімфоцит отримує інструкцію самоліквідуватися через певну
кількість поділів. Це дає змогу організму зберігати сталу кількість лімфоїдних клітин і реаґувати на
кожне наступне потрапляння антигену проліферацією нових клонів лімфоцитів.
Загальні уявлення про апоптоз. Фізіологічні механізми клітинної загибелі існують у
багатоклітинних організмах для забезпечення нормального розвитку та морфогенезу, для контролю
кількості клітин та з метою знищення інфікованих, мутантних і ушкоджених клітин.
Апоптоз — це засіб самознищення клітин багатоклітинного організму, який реалізується на
молекулярному рівні через певну детерміновану низку подій.
Після запуску програми апоптозу в цитоплазмі активуються ферменти, які до того перебували в
клітині у неактивному стані. При індукуванні апоптозу може також змінюватися експресія певних
генів, відбуватися синтез потрібних білків de поvо. Тому загибель клітин унаслідок апоптозу
супроводжується затратами енергії клітини. В регуляції апоптозу беруть участь спеціалізовані
білки, одні з яких підвищують, а інші знижують чутливість клітини до дії проапоптичних факторів.
Тому говорять, що апоптоз — це генетична запрограмована загибель клітин, оскільки всі потрібні
біомолекули, які запускають і реалізують цей процес, клітина здатна синтезувати сама.
Фізіологічні функції апоптозу. Апоптоз дуже важливий для функціонування багатоклітинних
організмів та підтримання клітинного гомеостазу.
Кількість клітин багатоклітинного організму визначається процесами клітинного поділу та
клітинної загибелі. В здоровому організмі ці процеси чітко збалансовані. Отже, головною функцією
апоптозу є контроль над кількістю та співвідношенням клітин у різних органах і тканинах, а також у
цілому організмі.
Другою функцією апоптозу, що тісно пов'язана з першою, є видалення клітин, які старіють або які
втратили здатність виконувати свою функцію. Цей процес характерний у нормі, очевидно, для всіх
тканин, крім тих, клітини яких не діляться. Апоптоз відіграє винятково важливу роль у морфогенезі
в процесі індивідуального розвитку організму. Наприклад, шляхом апоптозу елімінуються клітини
хвоста пуголовків, міжпальцевих перетинок у вищих хребетних тощо.
Апоптоз елімінує не тільки зайві, а й небезпечні клітини організму. Він запускається при перших
ознаках вірусного ураження або неконтрольованого поділу. Тому, гинучи шляхом апоптозу, кожна
клітина з певними порушеннями захищає організм від можливої вірусної інфекції або утворення
пухлин. У літературі апоптоз часто називають «смертю заради життя».
Апоптоз і некроз. Існують два альтернативних шляхи загибелі клітин — апоптоз і некроз. Саме
апоптоз є нормальною фізіологічною загибеллю, тоді як некроз є формою примусової, або
насильницької, смерті клітин. Апоптоз і некроз мають низку протилежних ознак. По-перше, апоптоз
викликається рядом фізіологічних, генетично детермінованих або патологічних стимулів. До
фізіологічних стимулів можна віднести сигнали від клітинного мікрооточення, до патологічних —
вірусну інфекцію, УФ- або радіаційне опромінення, недостатність поживних речовин, до генетично
детермінованих — загибель старих клітин. При апоптозі не розвивається запалення, оскільки не
пошкоджується цілісність клітинних мембран. Некроз, навпаки, спричинюється лише
патологічними стимулами, такими як фізичні ушкодження, зумовлені температурою або
механічними подразненнями та дією агресивних хімічних речовин — кислот, розчинників, токсинів.
Некроз, як правило, індукує місцеві запальні реакції, оскільки при ньому порушується цілісність
клітинних мембран і мембран лізосом, унаслідок чого лізосомальний уміст виділяється в
позаклітинне середовище.
Деякі дослідники виділяють ще один окремий шлях загибелі клітин — автоліз, або автофагію, який
за проявами нагадує некроз, однак подібно до апоптозу також є фізіологічне детермінованою
формою загибелі. При автолізі, як і при некрозі, спостерігається вивільнення вмісту лізосом у
цитоплазму і перетравлювання вмісту клітини лізосомальними ферментами, однак таке вивільнення
індукується певними фізіологічними сигналами або запрограмоване генетично.
Характерні ознаки апоптоёзу. Апоптоз був описаний J. Кеrr зі співавторами у 1972 р. за
характерною морфологією загиблих клітин. Апоптичні клітини мають зморщену форму, містять
фрагментований хроматин. Закінчується апоптоз формуванням характерних структур —
апоптичних тілець, що є фрагментами клітини, оточеними мембраною. Фосфоліпідний склад
апоптичних тілець змінюється, на зовнішньому боці мембрани з'являється у значній кількості
фосфатидилсерин, унаслідок чого вони легко розпізнаються і фагоцитуються макрофагами.
Після індукування апоптозу певні морфологічні зміни можна спостерігати через 5 — 6 год, а
біохімічні — вже через 1 – 2 год.
Термін «апоптоз» походить від грецького apoptosis, що в перекладі означає «опадання листя»,
оскільки загиблі клітини зморщуються і зменшуються в розмірах, як опале листя. Цікаво, що
обпадання листя справді супроводжується процесами апоптичної загибелі клітин. Тому вважають,
що першим роль апоптозу як «альтруїстичного самогубства» описав давньоримський лікар Гален (II
ст. н. е.), який вважав, що дерева самі скидають на зиму листя для того, щоб захистити гілки від
надмірної ваги снігу.
Порівняльні характеристики некрозу та апоптозу наведено в табл. 50.
Фактори, що індукують апоптоз. Апоптоз контролюється системою відповідних сигналів від
внутрішніх (ендогенних) та зовнішніх (екзогенних) факторів, які сприймаються через так звані
рецептори «смерті». Сигнали, що можуть призводити до розвитку апоптозу, називають
апоптогенними, або проапоптичними, стимулами.
Найважливішими ендогенними стимулами, що запускають апоптоз, є неправильний перебіг
клітинного циклу, наявність вірусного ураження, наявність у клітині фрагментів ушкодженої ДНК,
«надлишок» мітогенних факторів.
Екзогенні стимули, що призводять до апоптозу, являють собою різні сигнали, що надходять до
рецепторів клітин, наприклад сигнал від рецепторів ФНП-родини (Fas-, ФНП-рецептора тощо).
Одним з важливих механізмів контролю за ростом клітинних популяцій є залежність клітин від
сигналів, що надходять з клітинного мікрооточення. Клітини, які не отримують цих сигналів,
наприклад у разі, якщо вони потрапили в інше мікрооточення, гинуть щляхом апоптозу. Тому до
апоптозу можуть призводити певні мітогенні стимули, якщо вони діють у надлишковій кількості або
клітина не готова до їх сприйняття. З другого боку, відсутність потрібних ростових факторів також
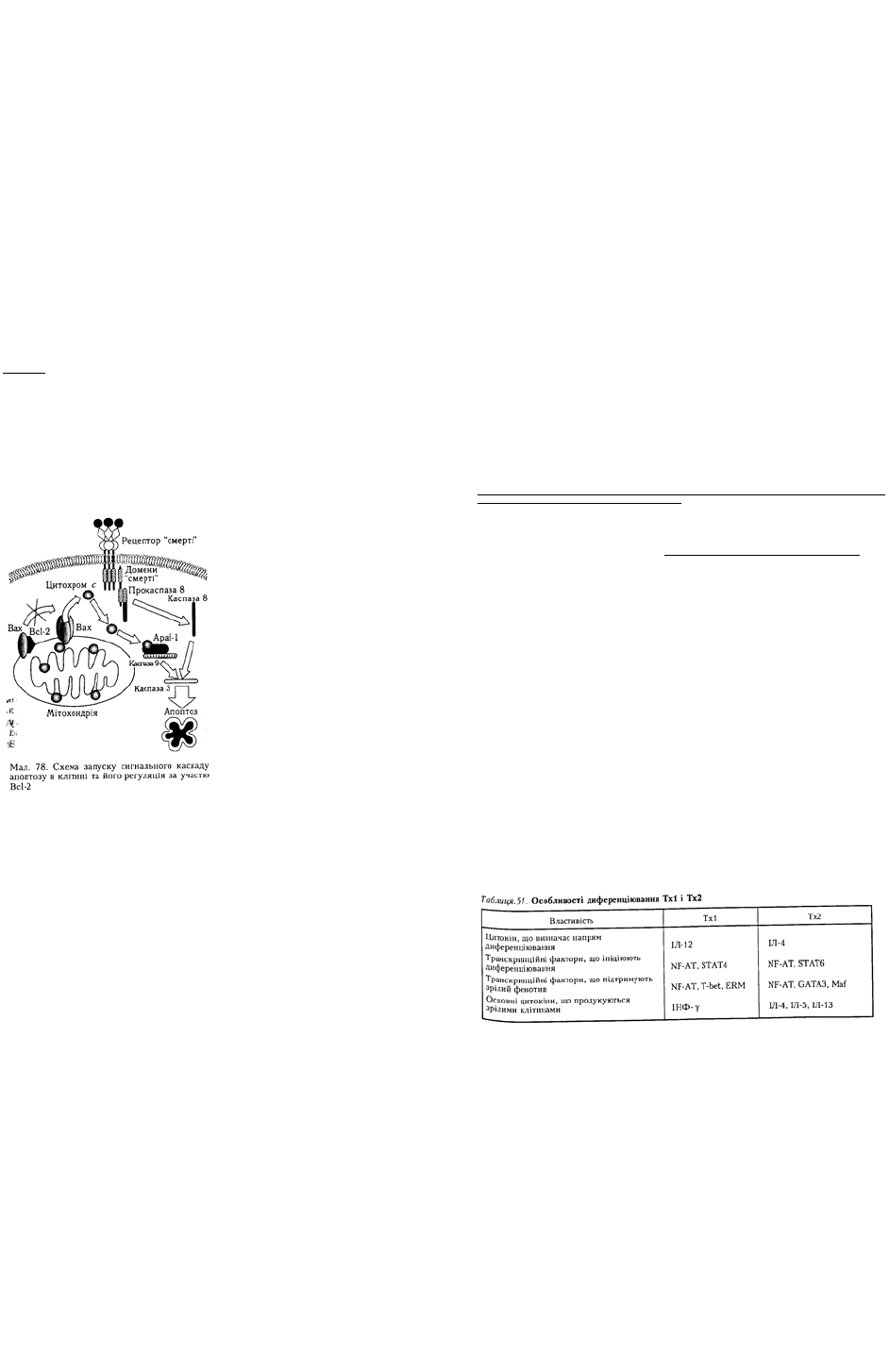
45
призводить до апоптотичної загибелі активованої клітини. Серед зовнішніх чинників, що можуть
призводити до апоптозу, слід також назвати низку ушкоджувальних впливів, таких як токсини,
радіація, УФ-опромінення, вплив сублетальних температур, механічні пошкодження. У разі сильно
вираженого впливу ці фактори спричинюють некроз тканин, за слабкого — апоптоз окремих клітин.
Рецептори «смерті» та їхні ліганди. Рецептори «смерті», взаємодія яких з відповідними лігандами
призводить до запуску апоптозу, є членами суперродини рецепторів фактора некрозу пухлин ФНП-
Р. Найважливішим і тому добре вивченим рецептором «смерті» є Fas (CD95/APO-1). До рецепторів
родини ФНП-Р крім Fas належать власне рецептори до фактора зу пухлин ФНП-Р1 та ФНП-Р2, а
такожє багато інших молекул: CD30, CD40, фактор до фактора росту нервів ФРН-Р тощо.
Рецептори «смерті» характеризуються наявністю 60 — 80-го амінокислотного цитоплазматичного
домену, який називають доменом «смерті» (DD - від англ. death domein). Для ефективного
ініціювання сигналу «смерті» від мембрани клітини потрібна тримеризація рецепторів, що й
відбувається при зв'язуванні рецепторів із відповідними лігандами чи агоністичними антитілами.
Після зв'язування рецептора домени «смерті» асоціюються з певними адапторними молекулами і
таким чином ініціюється сигнал до запуску програми апоптозу.
Виявилося, що фізіологічним лігандом до рецептора Fas є білок Fas-ліганд (FasL), який
експресується на поверхні клітин з цитотоксичною функцією. Деякі клітини можуть експресувати
як рецептор Fas, так і Fas-ліганд і в такий спосіб самознищуватися.
Мембранна форма білка Fas представлена майже на всіх клітинах організму, які здатні до поділу. Це
дає змогу клітинам імунної системи індукувати в разі необхідності апоптоз у своїх «мішеней».
Особливо щільно молекула Fas експресована на клітинах у кишках, тимусі, печінці, легенях тощо.
Основне призначення мембранного Fas — це запуск програми апоптозу з клітинної поверхні. Проте
останнім часом з'явилися дані про деякі інші функції Fas. Зокрема, було показано, що зв'язування
Fas на мембрані поліморфноядерних нейтрофілів призводить до хемотаксису цих клітин. Більше
того, в деяких випадках Fas може виступати як рецептор до ростових факторів.
Глікопротеїн Fas може існувати як в асоційованій з мембраною (mFas), так і в розчинній (sFas)
формах. Розчинна форма Fas утворюється шляхом альтернативного сплайсингу і може існувати у
вигляді кількох ізоформ. Розчинна форма рецептора взаємодіє з Fas-лігандом на поверхні
цитотоксичних клітин і таким чином нейтралізує останні. Вважають, що в деяких випадках за
допомогою секреції розчинної форми Fas-рецептора пухлинні клітини уникають імунного
контролю.
Фізіологічний ліганд до рецептора Fas (FasL, CD95L) є трансмембранним білком з молекулярною
масою 40 кДа, що експресується у вигляді тримеру. FasL є членом родини цитокінів, що включає
фактор некрозу пухлин α (ФНП-α), лімфотоксини α і β, CD30L, CD40L та багато інших.
FasL експресується на активованих цитотоксичних Т-лімфоцитах та природних кілерах, а також на
клітинах кишок, ока, легенів, нирок, нервової тканини, плаценти. FasL, як і Fas, може існувати у
зв'язаній із мембраною та розчинній формі (sFasL та mFasL). Показано, що розчинний FasL має
молекулярну масу 27 кД, існує у вигляді тримеру, що утворюється з мембранної форми в результаті
відщеплення трансмембранної частини певною протеїназою. Розчинна форма FasL біологічно
активна, тобто здатна індукувати апоптоз у чутливих клітинах, що експресують рецептор Fas.
Реалізація апоптозу. Головним «учасником» процесу апоптозу є родина 14 цистеїнових протеїназ,
які розщеплюють білки за пептидними зв'язками після аспарагінової кислоти і які називають
каспазами.
Каспази гомологічні між собою за амінокислотними послідовностями й структурою. Вони
експресуються як проферменти і містять такі структурні елементи: N-кінцевий варіабельний домен,
велику (20 кД) і малу (10 кД) субодиниці. Активація каспаз відбувається внаслідок протеолітичного
розщеплення зв'язку між доменами та асоціації великої й малої субодиниць із утворенням
гетеродимеру. Гетеродимери, в свою чергу, асоціюються і утворюють тетрамер з двома
каталітичними центрами, що працюють незалежно.
Апоптичний сиґнал з поверхні клітини зумовлює активацію ініціаторних каспаз, які розщеплюють і
активують ефекторні каспази. Останні, в свою чергу, розщеплюють внутрішньоклітинні білки, що й
призводить до розвитку апоптозу. До ініціаторних каспаз відносять каспази 8, 9, 10, а до ефекторних
— 2, 3, 6, 7. Активація ініціаторних каспаз потребує зв'язування зі специфічними кофакторами та
адапторними молекулами.Наприклад, активація прокаспаз 8 і 10 відбувається після їх асоціації з
доменом DED (death effector domain) молекули FADD (Fas-associated death domain). Прокаспаза 9
активується через утворення комплексу з адапторною молекулою APAF-1, цитохромом с та дАТФ.
Ефекторні каспази розщеплюють різні внутрішньоклітинні мішені: структурні білки, сигнальні
білки, регулятори транскрипції, білки, що регулюють метаболізм ДНК, гістони та інші білки з
різними функціями. Серед гістонів
найчутливішим до дії ефекторних каспаз є
гістон Н1. Розщеплення цього гістону
робить певні ділянки ДНК доступними для
дії ендонуклеаз. Каспази також
розщеплюють інгібітор каспазоактивованої
ДНКази, що спричинює активацію цього
ферменту і розщеплення ДНК на
олігонуклеосомні фрагменти.
Існує багато шляхів індукування апоптозу,
які можна згрупувати в три категорії: від
рецепторів, від мітохондрій та від ядра.
Перший шлях активації апоптозу
починається після перехресного
зв'язування рецепторів ФНП-родини
(рецепторів «смерті») відповідними
лігандами. Такі рецептори тримеризуються,
внаслідок чого на них з'являються сайти
зв'язування для адапторних білків родини
FADD (мал. 78).
З ефекторними доменами «смерті» DED
молекули FADD безпосередньо
асоціюється прокаспаза 8. Олігомеризація
прокаспаз 8 призводить до того, що вони
розщеплюють одна одну і таким чином
самоактивуються.
Каспаза 8 активує інші каспази — 3, 4, 6, 7
і 13. Каспаза 3, в свою чергу, активує
каспази 6 і 9. Каспази 3 та 6 беруть
безпосередню участь у ядерному апоптозі.
Припускають, що каспаза 4 активує
мітохондрії, що призводить до виходу з
них у цитоплазму цитохрому с.
Другий шлях активації апоптозу пов'язаний
із порушенням функцій мембран мітохондрій, внаслідок чого цитохром с може виходити в цитозоль
і разом з іншими факторами активувати прокаспази. Цитохром с зв'язується з адапторною
молекулою APAF-1. За наявності дезоксіаденозинтрифосфату (дАТФ) відбувається взаємодія
комплексу з каспазою 9 і активація останньої. Інгібування апоптозу на цьому рівні може
відбуватися за участю білка Всl-X
L
, який приєднується до комплексу APAF-1 та каспази 9 і блокує
його. Деякі протеїнкінази, наприклад протеїнкіназа В (Akt), можуть гальмувати розвиток апоптозу
шляхом фосфорилювання певних каспаз.
Вихід цитохрому с з мітохондрій контролюють деякі білки родини Всl, які вбудовані в мембрану
мітохондрій (будуть розглянуті далі).
Третій шлях активації апоптозу пов'язаний з експресією певних проапоптичних генів. Головним
транскрипційним фактором, що визначає експресію цих генів, є білок Р53 — продукт гена р53
супресора пухлин. Активація р53 пов'язана з різними метаболічними порушеннями в цитоплазмі
клітини, підвищенням рівня йонів Са
2+
, появою коротких фрагментів ДНК тощо. Активація р53
спостерігається також у разі порушень клітинного циклу. Під дією Р53 збільшується експресія
понад 20 генів, у тому числі білка Вах, рецептора Fas та ін. Отже, шлях запуску апоптозу від ядра
тісно пов'язаний з іншими шляхами його індукування.
Крім розглянутих шляхів активації апоптозу існує ще шлях безпосередньої активації прокаспаз у
цитозолі за допомогою інших протеолітичних ферментів — гранзимів та гранулізину, які доставляє
в клітину-мішень активований ЦТЛ або натуральний кілер. Цей шлях детально розглянуто у розд.
11.
Суперечливі дані отримано про те, що в деяких типах клітин апоптоз може відбуватися без участі
ініціаторних чи ефекторних каспаз. Такий тип загибелі клітин називають каспазонезалежним
(caspase independent form of cell death).
За здатністю проводити апоптичний сигнал клітини можна розподілити на два типи. Апоптоз у
клітинах першого типу відбувається незалежно від мітохондрій і не блокується гіперекспресією
білка Всl-2. Апоптоз у клітинах другого типу залежить від активації мітохондрій. Гіперекспресія
білків Всl-2 і Всl-X
L
у таких клітинах повністю блокує розвиток апоптозу. Т-клітини належать до
клітин першого типу, а В-лімфоцити — до клітин другого типу.
Внутрішньоклітинні білки—регулятори апоптозу. Показано, що CD95-опосередкований каскад
запуску апоптозу може позитивно або негативно регулюватися активністю білків Р53 та білків
родини Всl, а також активністю певних кіназ чи фосфатаз.
Р53 — білковий продукт гена р53, що відіграє важливу роль у клітинній відповіді на ушкодження
ДНК у ссавців. Після ушкодження ДНК відбувається накопичення білка Р53 в ядрі. Далі цей білок
активує транскрипцію низки генів, продукти яких важливі для репарації ДНК або апоптозу. До них
належать гени fas, bах, ген цикліну G та ін. (всього близько 25). Цікаво, що індукування експресії
генів, важливих для репарації ДНК й клітинного циклу, відбувається через 2 год після дії радіації, а
гени, важливі для апоптозу (bах і fas) експресуються через 4 год. Можливе пояснення цього явища
полягає в тому, що якщо клітина не здатна виправити ушкодження ДНК в перші години після
опромінення, то в ній запуститься програма самознищення.
Білки родини Всl є модуляторами апоптозу. Деякі з них (Bcl-2, Bcl-X
L
, Bag) інгібують розвиток
апоптозу, тоді як інші (Bcl-X
S
, Вах, Bad, Bid), навпаки, виконують функцію позитивних регуляторів
цього процесу. Активність Bcl-2-подібних білків регулюється різними механізмами. Ці білки через
власні ВН-домени (bd-homology) можуть утворювати гомо- і гетеродимери.
Антагоністи апоптозу димеризуються з білком Вах і пригнічують розвиток апоптозу, тоді як
агоністи апоптозу утворюють гетеродимери з білками Всl-2 та Bcl-X
L
й інгібують активність
останніх. Деякі з членів родини Всl-2 (крім білків Bid, Bad, Вak, Bim та Noxa) мають
трансмембранний домен, що дає їм змогу вбудовуватись у зовнішню мембрану мітохондрій та інші
клітинні мембрани. Ці білки регулюють вихід з мітохондрій цитохрому с, який бере участь в
активації каспаз.
Білок Всl-2 порушує активність фактора Cif (cytochrome c-efflux inducing factor), який індукує
вивільнення цитохрому с з мітохондрій. У разі надходження різних проапоптичних сигналів у
клітині збільшується рівень експресії Вах, який може утворювати гетеродимери з Всl-2 в
мітохондріальній мембрані. Білок Вах, зв'язуючись із білком Всl-2, інактивує останній, у результаті
чого цитохром с вивільнюється з мітохондрій у цитозоль. Порушення балансу між кількістю
молекул Всl-2 і Вах може індукувати чи, навпаки, повністю супресувати апоптоз, особливо у
клітинах другого типу.
Білок Всl-ХL може фізично взаємодіяти з адапторною молекулою APAF-1 і блокувати в такий
спосіб активацію каспази 9.
Апоптоз і проліферація. Між процесами клітинної проліферації й клітинної загибелі існують
зворотні зв'язки. Це потрібно для контролю над кількістю клітин у різних органах і тканинах, а
також для запобігання розвитку злоякісних новоутворень.
Будь-які мутації, що можуть індукувати спонтанний поділ, як правило, мають призводити до
апоптозу. Підвищена експресія в клітинах мітогенних факторів, таких як циклін D, протоонкогенів
mус-родини, фактора транскрипції E2F-1, а також інактивація гена —супресора ретинобластоми
RB1 тощо має призводити швидше не до поділу, а до загибелі цих клітин. І навпаки, підвищена
експресія в клітині антиапоптичних факторів, наприклад білка Всl-2, має гальмувати клітинний
цикл і затримувати клітини у фазі G0, тобто коли клітина втрачає здатність до поділу, вона «може
дозволити собі» бути стійкою до зовнішніх апоптогенних стимулів. Наприклад, добре відомо, що
плазматичні клітини, які є термінальною ланкою розвитку В-клітин, у десятки разів стійкіші до дії
йонізуючого випромінювання, ніж їхні попередники. І навпаки, при інтенсивній проліферації
завжди підвищується чутливість клітин до дії апоптогенних стимулів, що можна спостерігати,
наприклад, під час тимічної селекції тимоцитів, які стають дуже чутливими до дії радіації та
кортикостероїдів.
Накопичення подальших мутацій, що блокують розвиток апоптозу чи індукують проліферацію за
підвищеної експресії антиапоптичних факторів, можуть призводити до злоякісного переродження
клітин.
Отже, апоптоз індукується паралельно з активацією клітини до поділу. Чому ж нормальні (не
перероджені) клітини не гинуть під час проліферації? Ймовірно, що лише в разі поступового
надходження всіх ростових і антиапоптичних сигналів у клітині блокується система апоптозу і
відбувається перебіг усіх фаз клітинного циклу.
Роль апоптозу у функціонуванні імунної системи. У функціонуванні імунної системи апоптоз
виконує низку характерних функцій. По-перше, внаслідок апоптозу знищуються аутореактивні
лімфоцити під час негативного відбору в первинних лімфоїдних органах. Апоптозом гинуть також
клітини, що виявились не здатними коректно перебудувати гени рецепторів і пройти позитивну
селекцію. За допомогою апоптозу контролюється проліферація клітин у різних гілках гематопоезу.
Апоптоз запобігає також неправильній активації наївних лімфоцитів. Така загибель клітин настає
внаслідок недостатнього надходження костимуляторних сигналів. Крім того, апоптоз важливий для
елімінації активованих ефекторних клітин, що вже виконали свою функцію, тобто апоптоз
контролює припинення імунних реакцій.
Система білків Fas та FasL відіграє важливу роль принаймні в трьох видах фізіологічної загибелі
клітин, пов'язаної з функціонуванням імунної системи. По-перше,це участь у пригніченні
активованих Т-клітин периферичної крові в кінці імунної відповіді, а також елімінація
периферичних аутореактивних В-клітин. За допомогою Fas — FasL-системи відбувається позитивна
селекція Т-лімфоцитів у тимусі в ембріогенезі.
По-друге, за участю системи білків Fas і FasL відбувається знищення клітин, інфікованих вірусом,
чи пухлинних клітин цитотоксичними Т-лімфоцитами й натуральними кілерами. Клітини, що
загинули шляхом апоптозу, не спричинюють запалення і миттєво фагоцитуються тканинними
макрофагами та іншими фагоцитами.
По-третє, Fas — FasL-система забезпечує захист імунопривілейованих сайтів організму (ока,
нервової системи) від шкідливого ефекту запальних імунних процесів. Відомо, що клітини, які
експресують FasL в оці, нервовій системі, плаценті, здатні індукувати апоптоз в імунних клітинах-
ефекторах, запобігаючи розвитку небажаного в цих органах і системах запального процесу, який
може призвести до сліпоти, порушення функції нервової системи або відторгнення плоду.
Показано, що клітини деяких типів пухлин – меланоми, раку легенів, астроцитоми, карциноми
шлунка й товстої кишки — також експресують FasL. Очевидно, це дає змогу пухлинним клітинам
уникати імунного контролю шляхом індукування апотозу в цитотоксичних клітинах-ефекторах, що
експресують Fas-рецептор.
Апоптозом гинуть також нейтрофіли в осередку запалення. Після цього рештки нейтрофілів
фагоцитуються макрофагами.
Роль апоптозу при патологіях. Будь-яка функція організму, що виходить з-під контролю, може
стати причиною певних патологій. Це саме стосується й апоптозу. В разі надмірної активації
система апоптозу може стати причиною дегенеративних процесів у певних органах і клітинах. З
апоптозом пов'язують патологічні процеси, що супроводжують певні захворювання, наприклад
міокардити, ішемічну хворобу серця, нейродегенеративні ушкодження, різні лейкопенії тощо.
Шляхом апоптозу гинуть клітини-мішені аутореактивних ЦТЛ при аутоімунних захворюваннях, а
також при реакціях трансплантат проти хазяїна. Характерним проявом апоптозу є вікова інволюція
тимуса, інші атрофічні процеси, що спостерігаються при старінні. Певні інфекційні агенти можуть
спричинити апоптоз клітин хазяїна за допомогою своїх факторів патогенності. Так, показано, що
здатність індукувати апоптоз мають дифтерійний, ботуліновий, правцевий та інші токсини. Деякі
віруси також можуть індукувати апоптоз уражених клітин, що є фізіологічною відповіддю клітин на
вірусну інфекцію. Вважають, наприклад, що зменшення кількості СD4-лімфоцитів у хворих на
СНІД є проявом апоптичної загибелі уражених вірусом клітин.
10.6. ПОСТАКТИВАЦІЙНЕ ДИФЕРЕНЦІЮВАННЯ ЛІМФОЦИТІВ. УТВОРЕННЯ
ЕФЕКТОРНИХ КЛІТИН І КЛІТИН ПАМ'ЯТІ.
Після розпізнавання антигену та отримання необхідних костимуляторних сиґналів відбувається
проліферація активованого наївного лімфоцита. Внаслідок проліферації утворюється клон клітин,
які мають однакову специфічність рецепторів до антигену та здатні виконувати функції, необхідні
для елімінації цього антигену. Отже, проліферація активованих лімфоцитів збільшує кількість
клітин, здатних відповідати на антиген.
Крім того, під час проліферації відбувається постактиваційне диференціювання лімфоцитів, яке є
необхідним для перетворення наївних лімфоцитів на ефекторні клітини та клітини пам'яті.
Ефекторні клітини відрізняються від наївних лімфоцитів деякими властивостями, а саме: вони
мають високий рівень метаболічної активності та експресують певні молекули, які необхідні для
виконання ефекторних функцій. Клітини пам'яті також експресують усі необхідні ефекторні
молекули, але характеризуються зниженим рівнем метаболічної активності та порівняно великою
тривалістю життя.
Клон повністю диференційованих ефекторних клітин утворюється через 6 — 7 поділів після
активації наївного лімфоцита. Вважають, що з кожним поділом відбуваються певні зміни в експресії
генів і клітина все більше набуває ознак ефекторної клітини. Так, показано, що активовані наївні Т-
лімфоцити починають експресувати ІЛ-2 ще до входження в клітинний цикл, ІНФ-γ — у фазі S
клітинного циклу, а ІЛ-4 — після 3 — 4 поділів.
Процес диференціювання лімфоцитів на ефекторні клітини супроводжується змінами в структурі
хроматину, модифікацією гістонів, метилюванням і деметилюванням ДНК.
Наївні В-лімфоцити експресують на своїй поверхні зв'язані з мембраною форми імуноґлобулінів
класів М та D. На термінальному етапі проліферації та диференціювання з наївних В-клітин
утворюються плазматичні клітини, здатні синтезувати розчинні форми імуноґлобулінів — антитіла.
Плазматичні клітини відрізняються від наївних В-лімфоцитів певними морфологічними
особливостями та інтенсивнішою роботою біосинтетичного апарату. Плазматичні клітини, як
правило, не діляться, середня тривалість їх життя не перевищує 3 — 4 діб, але існують і плазматичні
клітини-«довгожителі», які живуть роками.
Дещо відрізняються і процеси формування різних субпопуляцій ефекторних Т-клітин. Так, ЦТЛ, які
утворюються з наївних CD8 Т-клітин, набувають ознак, необхідних для здійснення цитотоксичних
функцій. У повністю диференційованому стані ефекторні ЦТЛ мають морфологію великих
гранулярних лімфоцитів, гранули яких містять перфорини, гранзими та гранулізин. Крім того,
диференційовані ЦТЛ експресують на своїй поверхні велику кількість молекул Fas-ліганду. Всі ці
молекули необхідні для запуску апоптозу в клітинах-мішенях. Поділ активованих CD8 Т-клітин
відбувається кожні 8 год. Тому вже через 3 доби після проникнення вірусної інфекції в організмі
накопичується досить велика кількість ЦТЛ. Живуть ефекторні ЦТЛ, як правило, не більше 5 діб і
майже повністю зникають з організму через 2 — 3 тижні після виведення антигену.
CD4 Т-клітини, на відміну від ЦТЛ, розмножуються не так швидко і гинуть повільніше.
Диференціювання на ефекторні Т-хелпери може відбуватися як з утворенням субпопуляцій Тх1 і
Тх2, що відрізняються за експресією цитокінів, так і без поляризації Т-клітин за цитокіновим
профілем. Субпопуляція Т-хелперів 1 продукує ІНФ-γ, тоді як субпопуляція Т-хелперів 2 продукує
ІЛ-4, ІЛ-5 та ІЛ-13, хоча індивідуальні Т-клітини у межах цих популяцій можуть різнитися між
собою за спектром цитокінів, які вони експресують.
Який шлях розвитку обере активований CD4 Т-лімфоцит, залежить від фази імунної відповіді,
природи АПК та щільності представленого на її поверхні антигену, афінності ТкР, а також
локального контакту з певними цитокінами під час активації (табл. 51). Наприклад, Тх2, як правило,
утворюються наприкінці імунної відповіді внаслідок контакту з «виснаженими» АПК.
За певних умов CD8T-клітини, як і Т-хелпери, також можуть поляризуватися за цитокіновим
профілем на дві субпопуляції, аналогічні субпопуляціям Тх1 і Тх2, але функціональна роль такої
поляризації ЦТЛ менш зрозуміла. Можливо, що за певних обставин ЦТЛ здатні виконувати деякі
функції Т-хелперів. Тому наведені далі (див. розд. 11) механізми диференціювання Тх1 і Тх2,
можливо, характерні також для Т-кілерів.
Наївні CD4 Т-клітини після першого контакту з антигеном починають продукувати лише ІЛ-2, а
поляризація за цитокіновим профілем відбувається через кілька поділів після наступного контакту з
антигеном та додаткової стимуляції цитокінами.
Клітини пам'яті. Більшість ефекторних клітин гинуть через кілька діб після активації і
фагоцитуються макрофагоподібними клітинами селезінки та печінки, але невелика частина виживає
і стає клітинами пам'яті. Загибель ефекторних клітин після звільнення організму від антигену має
велике біологічне значення, оскільки запобігає гіпертрофії лімфоїдної тканини і створює умови для
відповіді наївних клітин на нові антигени. В-клітини пам'яті утворюються лише з тих В-клітин, які
пройшли переключення ізотипу антитіл і процеси дозрівання афінності рецепторів. Саме тому
вторинна імунна відповідь завжди більш специфічна, ніж первинна, і зумовлюється переважно
антитілами класу G.
Вважають, що персистенція в організмі антигену, адсорбованого на поверхні ФДК, відіграє важливу
роль у підтриманні життєздатності В-клітин пам'яті. Показано, що у видаленні активованих CD8 Т-
клітин з організму головну роль відіграє ІНФ-γ, оскільки у мишей із дефіцитом інтерферону
спостерігається дуже повільна елімінація ефекторних ЦТЛ. У видаленні ефекторних CD4 Т-клітин
головну роль, ймовірно, відіграє Fas-залежний апоптоз, хоча гіперплазія популяції CD4 Т-клітин
спостерігається також у мишей, дефіцитних за генами CTLA-4, ІЛ-2, ТФР-β тощо.
На відміну від В-клітин у Т-клітинах соматичні гіпермутації не відбуваються Однак рецептори до
антигену у Т-клітин пам'яті відрізняються від рецепторів Т-клітин, які беруть участь у первинній
імунній відповіді, більшою афінністю. Можливо існують механізми, які контролюють відбір у
клітини пам'яті саме тих клітин, що мають найбільшу афінність рецепторів.
Клітини пам'яті змінюють експресію певних маркерів, а саме, мають низький рівень експресії
CD62L і CD45RA/B/C, але високий рівень CD45R0. Для ідентифікації клітин пам'яті мишей
найчастіше застосовують маркери CD44, Ly6C та CD122. Хоча клітини пам'яті характеризуються
високою гетерогенністю поверхневих маркерів: одні з них можуть нагадувати ефекторні клітини, а
інші — наївні. Існують дві субпопуляції Т-клітин пам'яті, які відповідно зумовлюють центральну і
периферичну імунну пам'ять. Клітини центральної пам'яті (центральні Т-клітини пам'яті)
перебувають у неактивованому стані, мають високий рівень експресії хемокінового рецептора
CCR7, який зумовлює їхню міграцію у лімфатичні вузли. За експресією цитокінів ці клітини не
поділяють на Тх1 і Тх2. Клітини центральної пам'яті повільно реагують на проникнення антигену,
але все-таки набагато швидше за наївні Т-клітини. Вони мають високий рівень експресії мРНК і під
час активації діляться через короткий проміжок часу. Вважають, що клітини центральної пам'яті
перебувають у стадії G1 клітинного циклу, тобто у стані «передпорогової» активації.
Клітини периферичної пам'яті (ефекторні Т-клітини пам'яті) перебувають у більш активованому
стані, ніж клітини центральної пам'яті, діляться кожні 1 — 3 тижні, мають низький рівень експресії
46
рецептора CCR7, завдяки чому вони покидають лімфатичні вузли і потрапляють у селезінку та
нелімфоїдну тканину на периферії. Лише клітини периферичної пам'яті можуть поляризуватися за
цитокіновим профілем, експресують активаційні маркери CD69 та CD25 і можуть безпосередньо
виконувати ефекторні функції. Наприклад, CD8T-клітини пам'яті мають цитотоксичну активність і
можуть вбивати клітини-мішені. Можливо, що клітини периферичної пам'яті першими реагують на
повторне проникнення антигену в організм і забезпечують першу «лінію оборони» за повторної
інфекції.
Для підтримання життя Т-клітинам пам'яті, на відміну від В-клітин пам'яті, очевидно, не потрібний
постійний контакт з антигеном. Так, Т-клітини пам'яті живуть тривалий час при перенесенні
сингенним мишам, у яких зруйновано гени МНС. Навіть існує гіпотеза, що виведення антигену з
організму є сигналом, що призводить до перетворення активованих Т-клітин, які перебувають на
певній стадії диференціювання, на Т-клітини пам'яті. Причому саме стадія диференціювання Т-
клітини визначає її майбутню належність до певної популяції клітин пам'яті: клітини периферичної
пам'яті утворюються з клітин, близьких до термінальної стадії диференціювання, а клітини
центральної пам'яті — зі слабкодиференційованих Т-клітин.
Слід зазначити, що кількість Т-клітин пам'яті залишається майже незмінною впродовж усього життя
організму, незважаючи на кількість імунізацій. Одним з найважливіших факторів, що визначають
кількість класичних CD44/CD122 Т-клітин пам'яті, є наявність ІЛ-15 і, можливо, деяких інших
цитокінів (ІЛ-2, ІЛ-4, ІЛ-7, ІЛ-9). Саме маркер CD 122 Т-клітин пам'яті є β-ланцюгом рецептора до
ІЛ-2, який входить також до складу ряду інших рецепторів, зокрема рецептора до ІЛ-15 та інших
цитокінів. Показано, що у генетично модифікованих мишей, які експресують надлишок ІЛ-15 чи ІЛ-
7, утворюється більше Т-клітин пам'яті, ніж у нормальних мишей. Ймовірно, гомеостаз популяції
клітин пам'яті залежить від функціонального балансу кількох цитокінів.
Механізм, який зумовлює виживання CD4 та CD8T-клітин пам'яті, дещо відрізняється, оскільки
головну роль у запобіганні апоптозу в CD8T-клітин відіграє білок Всl-2, а у CD4 — білок Всl- X
L
.
Тому, можливо, для підтримання життєздатності CD4 і CD8T-клітин пам'яті потрібна дія різних
цитокінів.
ВИСНОВКИ.
Активація лімфоцитів є складним біохімічним процесом, який пов'язаний з розпізнаванням
антигену. Активація лімфоцитів лежить в основі розвитку специфічної ланки імунної відповіді на
антиген, оскільки внаслідок активації відбувається збільшення кількості клітин, що взаємодіють з
антигеном. Одночасно процес активації лімфоцитів перебуває під суворим контролем багатьох
сигнальних систем. Щоб запобігти помилковій активації клітин імунної системи, природа
використовує механізм подвійного або навіть потрійного розпізнавання антигену. Для того щоб
антиген, який потрапив в організм, міг зумовити імунну відповідь, його мають Розпізнати як
ефекторні клітини (ЦТЛ або В-лімфоцити), так і регуляторні Т-клітини (відповідно Тх1 або Тх2).
Самі регуляторні Т-клітини активуються внаслідок взаємодії з дендритними клітинами, які були
попередньо активовані антигеном. Кооперація всіх зазначених типів клітин відбувається у процесі
міжклітинної взаємодії, яка супроводжується утворенням імунного синапсу. Імунний синапс
формується між АПК і Т-клітинами. Механізми активації АПК і Т-клітин загалом подібні, але
різняться способом розпізнавання антигену та сигналами, необхідними для їх активації.
Кожний лімфоцит має сприйняти кілька сигналів для переходу в активований стан. Перший і
головний сигнал — це сигнал від антигенспецифічних рецепторів, наступні два сигнали —
костимуляторні, які клітина отримує від мембранних костимуляторних молекул, що знаходяться на
поверхні іншої клітини, та від розчинних костимуляторних факторів — цитокінів Передавання
сигналу від мембранних рецепторів супроводжується формуванням сигнального комплексу, до
складу якого мають входити різні ферменти та адапторні білки. Важливим етапом в активації
лімфоцитів є приєднання до мембрани фосфоліпази Сγ, яка продукує важливі вторинні месенджери
— ІФ3 та ДАГ. Сигнали від костимуляторних молекул підсилюють основний сигнал від
антигенспецифічних рецепторів та зумовлюють додаткові сигнальні каскади. Лише за
збалансованого надходження всіх сигналів клітина може перейти з G
0
- у G1-стадію клітинного
циклу і пройти точку рестрикції. У разі неадекватності отриманих сигналів програмі розвитку
клітини відбувається інактивація клітин, як правило внаслідок апоптозу. Активовані клітини
проліферують і диференціюються на ефекторні клітини, а за умови нестачі антигену — також на
клітини пам'яті. Клони клітин, що відпрацювали, знищуються апоптозом.
Контрольні запитання.
1. Порівняйте будову рецепторного апарату Т- і В-клітин. У чому полягає їхня подібність та
відмінність? Яке значення мають ці відмінності для розпізнавання антигену Т- і В-клітинами? Яку
роль відіграють корецептори Т- і В-клітин у процесі розпізнавання антигену?
2. Як формується сигнальний комплекс після розпізнавання антигену рецепторами лімфоцитів? Що
таке імунний синапс і як він формується? Які сигнали необхідні для повноцінної активації Т- і В-
лімфоцитів? Які є маркери активації Т- і В-клітин?
3. Які сигнальні шляхи активують фосфоліпаза Сγ, фосфатидилінозитол-3-кіназа та маленькі g-
білки?
4. Які особливості передавання сигналу від цитокінових рецепторів?
5. Чи існують механізми пригнічення активації лімфоцитів?
6. В яких випадках активація лімфоцитів призводить до їх апоптозу? Схарактеризуйте індуктори,
механізми та регулятори апоптозу.
РОЗДІЛ 11. ІМУННА ВІДПОВІДЬ.
Імунна відповідь — реакція імунної системи, спрямована на елімінацію чужорідного антигену екзо-
чи ендогенного походження, який потрапив у внутрішнє середовище організму. Вона здійснюється
клітинами імунної системи (лімфо- та мієлоїдного походження) із залученням інших клітин
організму (фібробластів, ендотеліальних клітин, кератино-, тромбо- та еритроцитів тощо), а також
розчинних факторів (антитіл, білків гострої фази запалення, комплементу, цитокінів, хемотаксичних
факторів тощо), здатних безпосередньо взаємодіяти з антигеном або регулювати функцію інших
клітин.
Розрізняють реакцію системи неспецифічного імунітету на потрапляння антигену (запалення),
зумовлену лейкоцитами мієлоїдного ряду і низкою гуморальних факторів, та реакцію системи
специфічного імунітету, зумовлену Т- і В-лімфоцитами та їх розчинними продуктами (антитілами і
цитокінами) — природну та адаптивну ланки імунної відповіді. Адаптивну ланку імунної відповіді
поділяють на гуморальну та клітинну залежно від типу ефекторних реакцій, спрямованих на
елімінацію антигену.
Реакцію запалення без залучення специфічних механізмів можна спостерігати лише у перші години
(4 — 10 год) після первинного потрапляння антигену до організму. Якщо за цей час не відбулося
звільнення організму від антигену, то до боротьби з антигеном залучаються клітини специфічного
захисту. Розвиток реакції системи специфічного імунітету значно стимулює реакцію системи
природного імунітету, оскільки антитіла та Т-лімфоцити здатні підсилювати ефекторні функції
лейкоцитів мієлоїдного ряду. У разі залучення специфічних механізмів до елімінації антигену в
осередку запалення виникає імунне запалення.
Ймовірно, що за певних умов специфічна реакція на антиген може не супроводжуватися вираженим
запальним процесом. Це може бути тоді, коли організм уже зустрічався з цим антигеном і
попередньо сформовані клітини пам'яті та антитіла можуть реагувати на наступне потрапляння
антигену швидше, ніж розвинеться запальний процес. Специфічна реакція організму на
потрапляння в його внутрішнє середовище чужорідних субстанцій здебільшого значно зменшує
руйнівний потенціал факторів неспецифічного захисту щодо власних клітин організму. На думку
деяких дослідників, специфічна реакція у більшості випадків є набагато безпечнішою для організму,
ніж реакція системи природного імунітету, оскільки вона спрямована не лише на звільнення від
чужорідних субстанцій, а й на зменшення запальних процесів в осередку проникнення патогену.
Реакцію запалення як прояв природного (неспецифічного) захисту було детально розглянуто в розд.
2, тому в цьому розділі основну увагу зосередимо на розвитку адаптивної (специфічної) ланки
імунної відповіді (далі — просто імунної відповіді) на потрапляння антигену у внутрішнє
середовище організму.
Стадії розвитку реакцій імунної системи. Реакцію системи неспецифічного захисту умовно можна
поділити на реакцію, яка забезпечуються «локальними силами» природного захисту, що знаходяться
у місці проникнення антигену, та реакцію, яка потребує додаткового залучення «допоміжних сил» з
кровотоку. В першому випадку реакція включає три етапи: розпізнавання антигену (І етап),
взаємодія факторів природного захисту з антигеном (II етап) та елімінація антигену (III етап). У
другому випадку неспецифічна реакція складатиметься з таких етапів: розпізнавання антигену (І
етап), формування осередку запалення та залучення додаткових лейкоцитів у осередок запалення (II
етап), активація лейкоцитів під час взаємодії з антигеном (III етап) та елімінація антигену (IV етап).
Специфічна реакція на антиген складається з більшого ряду послідовних етапів: транспортування
антигену в лімфоїдні органи (І етап), розпізнавання антигену лімфоцитами та активація (II етап),
проліферація і клональна експансія цих лімфоцитів (III етап), диференціювання активованих
антигеном клітин, кількість яких збільшилася внаслідок проліферації (IV етап), утворення
ефекторних клітин та розвиток реакцій за їх участю (V етап). Тому умовно імунну відповідь можна
поділити на індуктивну (І і II етапи), продуктивну (III і IV етапи) й ефекторну (V етап) фази.
Вдалим завершенням специфічної реакції є повна елімінація антигену з організму.
Отже, імунна відповідь є наслідком метаболічних процесів, що відбуваються в лімфоїдній тканині
переважно на рівні АПК та лімфоцитів після активації останніх антигеном, і завершується
утворенням ефекторних факторів, що характеризуються суворою реактивністю щодо антигену.
Процеси, які супроводжують розвиток імунної відповіді, — процесинг і розпізнавання антигену,
активація, проліферація, диференціювання лімфоцитів з утворенням ефекторних клітин і молекул, а
також індукований унаслідок активації апоптоз — детально описано в розд. 6, 7 10. В цьому розділі
розглянемо умови індукції, закономірності розвитку та регуляції імунної відповіді, механізми
реалізації ефекторних функцій клітинами і молекулами, ефекторні реакції імунітету Імунна
відповідь розвивається за участю лімфоцитів та допоміжних клітин у спеціалізованій лімфоїдній
тканині, об'єднаних у єдину лімфоїдну систему. Лімфоїдна система забезпечує концентрування
антигену у вторинних лімфоїдних органах і рециркуляцію лімфоцитів між цими органами. Завдяки
цьому створюється оптимальна можливість для кожного антигенспецифічного лімфоцита знайти
антигенпрезентувальну клітину, яка представляє відповідний антиген.
Шляхи проникнення антигенів в організм. Від шляху потрапляння антигену в організм залежить
перебіг імунної відповіді та розвиток необхідних ефекторних реакцій, спрямованих на елімінацію
цього антигену. Теоретично можна розмежувати два основні шляхи появи чужорідного антигену в
організмі: «виникнення антигену» у внутрішньому середовищі організму і потрапляння антигену із
зовнішнього середовища (ендо- та екзогенне походження антигену).
Ендогенне походження антигену. Зрозуміло, що антиген або чужорідна щодо певного організму
речовина може «несподівано» з'явитися в середовищі організму навіть без пошкодження зовнішніх
покривів унаслідок мутацій, індукованих радіаційним опроміненням або хімічними речовинами, або
відповідних метаболічних змін у життєдіяльності клітин організму. Часто ефект таких впливів може
бути кумулятивним, наприклад, під час накопичення радіонуклідів або йонів важких металів в
організмі. Мутаційні зміни в геномі клітин організму можуть супроводжуватися змінами
антигенності власних білків. які кодуються мутантними генами. Наприклад, зміни лише однієї
амінокислоти (глутаміну) в структурі білка нейронних кальцієвих каналів P/Q-типу внаслідок
мутаційних процесів перетворюють його на генетично чужорідний білок і зумовлюють розвиток
специфічної імунної відповіді проти такого зміненого білка, що є причиною аутоімунного
захворювання — міастенії Ламберта—Ітона.
Джерелом ендогенних антигенів може бути спонтанна активація латентної вірусної інфекції,
зумовленої вірусом, який перебував в організмі у неактивній формі у ядрі або навіть вбудованим у
ДНК хазяїна. Прикладом можуть бути вірус герпесу, Епштейн-Барр, а також ряд ретровірусів, які
можуть потрапляти в організм дитини внаслідок вертикального перенесення від батьків і тривалий
час перебувати в неактивному стані. Вважають, що клітини імунної системи, переважно НК-клітини
та ЦТЛ, виконують функцію імунного нагляду в організмі, запобігаючи розвитку хвороб, пов'язаних
із активацією ендогенних вірусних інфекцій.
Екзогенне походження антигенів. Проникнення антигенів ззовні до внутрішнього середовища
макроорганізму може бути двох типів: «примусовим» та фізіологічним.
«Примусове» проникнення антигенів супроводжується порушенням цілісності зовнішніх покривів
організму (шкіри і слизових), яке може бути наслідком травм, опіків, порізів тощо, а також
парентерального введення вакцинних препаратів або імунізації тварин в експерименті. Іноді деякі
комахи також здатні сприяти «примусовому» введенню (внаслідок укусів) антигенів патогенних
мікробів в організм хазяїна.
Однак антигени проникають до внутрішнього середовища організму і без руйнування поверхні
епітелію. Це фізіологічне проникнення антигенів є найцікавішим і ще недостатньо вивчене.
Джерелом антигенів можуть бути компоненти їжі та представники нормальної мікрофлори.
З'ясувалося, що в організмі є «ворота» для постійного проникнення антигену в організм — так звані
М-клітини — різновид епітеліальних клітин слизових оболонок (див. розд. 1). У разі небажаного
збігу обставин ці самі ворота для антигену можуть стати «воротами інфекції», але в нормі вони
виконують дуже важливу функцію — сприяють стимуляції імунної системи.
Найбільше М-клітин у тонкій кишці (в ділянках розміщення пейєрових бляшок), де вони
локалізуються між ентероцитами — клітинами, що поглинають розщеплені низькомолекулярні
компоненти їжі. Конститутивною функцією М-клітин є транспортуання корпускулярних антигенів
(бактерій, вірусів, яєць гельмінтів тощо) з просвіту кишок до внутрішнього середовища організму.
Отже, імунна система сама себе постійно імунізує незначними дозами всіх антигенів, які потенційно
можуть бути небезпечними для організму. Відбувається «природна вакцинація» організму.
Під час імунізації тварин було з'ясовано, що найсильнішу імунну відповідь на антиген можна
очікувати після його введення з ад'ювантом під шкіру або в шкіру, імунізація внутрішньом'язова або
внутрішньочеревна також достатньо ефективна, а от введення антигену безпосередньо в кров іноді
може призводити навіть до специфічної супресії імунної відповіді на цей самий антиген. Крім того,
інтраназальне та пероральне введення антигенів, як правило, супроводжується формуванням
толерантності, але в деяких випадках може зумовити імунну відповідь (переважно — синтез IgA).
Основою цих явищ є розпізнавання антигену різними типами АПК і відповідь різних лімфоїдних
органів на потрапляння антигену різними шляхами. Після потрапляння антигену через шкіру, як
правило, імунна відповідь розвивається в реґіонарних лімфовузлах, куди антиген зі шкіри
доставляють КЛ. У разі потрапляння антигену через слизові імунна відповідь може розвиватися
безпосередньо в лімфоїдній тканині слизових оболонок або в реґіонарних (мезентеріальних)
лімфовузлах. Потрапляння антигену в кров під час генералізованої інфекції, бактеріемії або
токсинемії супроводжується залученням до імунної відповіді селезінки і за потреби — інших
вторинних лімфоїдних органів та утворів.
Персистенція антигенів. За деяких умов антиген може досить довго перебувати у внутрішньому
середовищі організму, незважаючи на достатній розвиток імунної відповіді проти нього. Таке
перебування антигену в організмі називають персистенцією антигену. Вважають, що персистенція
антигену має велике значення для підтримування імунної пам'яті на цей антиген та для
довготривалого існування специфічних до нього клітин пам'яті. Основним місцем, де антиген може
достатньо довго зберігатися в організмі, є лімфоїдні фолікули. В них антиген міститься переважно в
адсорбованому стані на поверхні фолікулярних дендритних клітин.
11.1. ІНІЦІЮВАННЯ ІМУННОЇ ВІДПОВІДІ.
Залежно від того, як антиген потрапляє в організм, відбувається подальший розвиток імунних
реакцій, спрямованих на його виведення. Важливою умовою для розвитку первинної імунної
відповіді на появу антигену, як уже зазначалося, є розвиток місцевої реакції запалення. Саме реакція
запалення є пусковим механізмом для розвитку специфічної ланки імунної відповіді. Здебільшого,
якщо не завжди, без попереднього розвитку процесу запалення формування специфічної реакції стає
неможливим.
Місцева запальна реакція у зоні проникнення антигену чи його носіїв — інфекційних агентів —
індукується субстанціями мікробних клітин та виділюваними ними продуктами, а також
компонентами пошкоджених тканин. Розвиток реакції супроводжується активацією комплементу та
деяких клітин (резидентних макрофагів, мастоцитів, фібробластів, епітеліоцитів тощо),
вивільненням великої кількості біологічно активних речовин з прозапальною і хемотаксичною дією.
Ці речовини зумовлюють підвищення проникності судин та міграцію з крові в осередок запалення
спочатку нейтрофілів (клітин гострого запалення), а потім моноцитів і лімфоцитів (клітин
хронічного запалення) (див. розд. 2). В осередку запалення моноцити, що диференціюються у
макрофаги, здійснюють фагоцитоз антигену та апоптичних тілець, що залишилися від загиблих
нейтрофілів, і продукують цитокіни, потрібні для подальшого розвитку запалення й індукування
специфічних імунних реакцій. У запуску специфічної ланки імунної відповіді беруть участь і
цитокіни, і процесовані антигени — продукти клітин, що були задіяні в запальній реакції.
Умова розвитку імунної відповіді – проникнення антигену в лімфоїдний орган. Якщо антиген
не був повністю елімінований з осередку проникнення в результаті місцевої реакції та розвитку
запальних процесів, частина антигенного матеріалу може потрапити до лімфоїдних тканин, де і
починається розвиток специфічної реакції. Відомо, що специфічна реакція може індукуватися лише
в спеціалізованій лімфоїдній тканині, зокрема у вторинних лімфоїдних органах, де забезпечуються
оптимальні умови для розпізнавання антигену специфічними рецепторами Т-лімфоцитів.
Вважають, що серед наївних Т- і В- лімфоцитів лише незначна частина (не більше 0,001 %) мають
рецептори, специфічні до одного певного антигену. Тому ймовірність «зустрічі» відповідних Т- і В-
лімфоцитів, що розпізнали один і той самий антиген, дуже невелика (менша за 1•10
-8
). Отже, для їх
зустрічі необхідні численні контакти між різними лімфоцитами, які стають можливими лише за
певних умов у разі підвищення рециркуляції через лімфоїдні органи, в які потрапив антиген.
Шляхи потрапляння антигену у вторинні лімфоїдні органи. Залежно від типу антигену, його
кількості та місця проникнення в організм він потрапляє в лімфоїдні органи різними шляхами.
Антиген може потрапляти до вторинних лімфоїдних органів як пасивним транспортуванням — з
течією крові, лімфи, тканинної рідини, так і активним цілеспрямованим транспортуваннм за
допомогою антиген-презентувальних клітин.
За пасивного транспортування антигени потрапляють у лімфоїдні органи у нативному вигляді, а за
активного транспортування — у переробленому вигляді (у формі комплексів з молекулами МНС на
поверхні АПК). Нативні антигени часто перебувають не у вільному стані, а у формі імунних
комплексів з антитілами та деякими компонентами комплементу. Імунні комплекси адсорбуються
на поверхні певних клітин за допомогою FcR (Fc-рецепторів) та CR (рецепторів до комплементу),
що може призводити до наступного їх фагоцитозу та розщеплення до фрагментів, які також
знаходитимуться з МНС на поверхні фагоцитарних клітин (наприклад, макрофагів крайової зони
селезінки). Фолікулярні дендритні клітини (ФДК), які не здатні до фагоцитозу, концентрують
антиген на своїй мембрані (на FcR та CR), де він може зберігатися досить тривалий час (навіть
кілька років). Отже, у вторинних лімфоїдних органах антиген може бути як у нативному вигляді
(Імунні комплекси на поверхні ФДК), так і у вигляді пептидних фрагментів у комплексі з
молекулами МНС (на поверхні ІДК, макрофагів та В-клітин).
Активно транспортувати антиген до лімфоїдних органів здатні В-клітини та ДК. Причому В-
клітини, на відміну від ДК, можуть зв'язувати антиген не лише на периферії, а й у лімфоїдних
органах, після чого відбувається процесинг і презентація цього антигену. ДК зв'язують антиген
лише на периферії, а в лімфоїдному органі відбувається презентація поглинутого раніше і
процесованого антигену.
Резидентні макрофаги лімфоїдних органів, як вважають, поглинають і представляють лише ті
антигени, які у вільному стані або у формі імунних комплексів потрапляють до лімфоїдного органа
(це стосується насамперед корпускулярних антигенів, що циркулюють у крові). Макрофаги інших
тканин не можуть транспортувати антигени з периферії у лімфоїдний орган, тобто не здатні до
активного транспортування антигенів.
Розглянемо активне транспортування антигенів у вторинні лімфоїдні органи на прикладі ДК після
потрапляння антигену через шкіру та роль різних типів АПК в розпізнаванні та презентації
антигенів.
Презентація антигену різними типами АПК. Залежно від місця проникнення антигену,
лімфоїдного органа, характеру та хімічної структури антигену в його розпізнаванні й презентації
беруть участь різні АПК. Презентація антигену, що проник через шкіру, здійснюється ДК.
Попередники ДК — клітини Лангерганса (КЛ) знаходяться в шкірі (див. розд. 1). Розміщені в шкірі,
КЛ постійно поглинають позаклітинну рідину з навколишнього середовища (процес називають
макропіноцитозом), захоплюють антигени з рідини і презентують після процесингу їхні пептидні
фрагменти з молекулами МНС II лімфоцитам. Однак достатня кількість молекул МНС II на
поверхні з'являється лише після того, як КЛ буде активована та емігрує зі шкіри у вторинні
лімфоїдні органи, де перетворюється на ДК. Лише у такому разі ДК можуть активувати наївні Т-
лімфоцити та ініціювати імунну відповідь. Отже, активація КЛ є ключовим моментом, який
запускає первинну імунну відповідь після проникнення антигену через шкіру.
Головною умовою активації КЛ є наявність процесу локального запалення, яке може бути
спричинене як безпосередньою дією чужорідних мікробних субстанцій на рецептори цих клітин, так
і дією прозапальних речовин, що виділяються клітинним мікрооточенням. Вважають, що особливо
стимулює активацію КЛ контакт із Т-хелперами, навіть з наївними.
Після активації у клітині Лангерганса відбуваються важливі зміни.
1. Поступово припиняється процес поглинання речовин із навколишнього середовища, а всі
антигени, які були поглинуті за цей період, накопичуються у процесованому вигляді в МІІС-
компартменті.
2. Протеасома повністю заміщується імунопротеасомою, внаслідок чого збільшується ефективність
презентації вірусних білків.
3. Створюються умови для перехресної презентації поглинутих антигенів разом як з МНС II, так і з
МНС І, очевидно, завдяки транспортуванню в цитозоль пептидних фрагментів антигенів з
ендосомального компартменту.
Після цього КЛ «знімається з місця» і мігрує в найближчий лімфовузол з течією аферентної лімфи,
перетворюючись під час міграції в лімфі на вуалеподібну клітину. Напрям міграції переважно
визначає хемокін CCL21 (SLC — від англ. secondary lymphoid-tissue chemokine — хемокін вторинних
лімфоїдних органів). Потрапляючи до лімфовузла, вуалеподібна клітина мігрує в Т-залежну
паракортикальну зону, де перетворюється на ІДК. При цьому в ІДК відбуваються важливі
метаболічні й морфологічні зміни:
— значно збільшується площа поверхні плазматичної мембрани, як вважають, за рахунок
цитоплазматичного ламелярного пулу;
— різко збільшується експресія на поверхні попередньо синтезованих молекул МНС І та МНС II у
комплексі з антигенними пептидами переважно екзогенного походження;
— майже повністю втрачається здатність поглинати і представляти інші антигени;
— підвищується здатність утворювати міжклітинні контакти завдяки активації інтегрину LFA-1 та
збільшення експресії ІСАМ-1 та ІСАМ-2;
— збільшується експресія костимуляторних молекул В7.1 та В7.2 на поверхні, а також секреція
прозапальних цитокінів – ІЛ-1, ІЛ-8, ФНП тощо.
У такому стані ІДК стають ідеальними АПК, оскільки забезпечують високу щільність молекул МНС
та достатню кількість костимуляторних молекул на своїй поверхні. Саме ІДК є найважливішими
стимуляторами активації Т-клітин, особливо під час первинної імунної відповіді, зокрема на
антигени, що проникають через шкіру. У разі проникнення антигену через слизові оболонки
головну роль у його розпізнаванні та презентації, як вважають, відіграють В-лімфоцити і ДК, що
знаходяться в слизових під епітелієм (у власній пластинці). ДК слизових на відміну від КЛ після
активації можуть не емігрувати з них, а реалізувати функцію презентації антигену в місцях
постійної локалізації, хоча частина ДК і В-лімфоцитів слизових, мабуть, все-таки мігрує в реґіонарні
лімфовузли що зумовлює системність імунної відповіді.
У селезінку антиген переважно потрапляє з течією крові, тому основну функцію первинного
розпізнавання і захоплення антигену в цьому органі відіграють макрофаги крайової зони, які
вловлюють корпускулярні антигени та імунні комплекси й презентують їх пептидні фрагменти на
своїй поверхні. В селезінці є також місцеві ДК, які вловлюють антигени менших розмірів із
кровотоку і представляють їх. Можливо, функцію презентації антигену в селезінці можуть
виконувати також В-лімфоцити, особливо ті, які були попередньо активовані Т-хелперами. Якому
типу АПК належить головна роль у стимуляції імунної відповіді в селезінці, остаточно ще не
з'ясовано.
Макрофаги тканин і місцеві макрофаги лімфовузлів, як правило, не так активно представляють
антиген для стимуляції наївних Т-клітин, оскільки вони виконують у цих органах скоріше функцію
«санітарів», звільняючи їх від апоптичних тілець, детриту та іншого «сміття».
Головною функцією різних типів АПК, що презентують антиген у вторинних лімфоїдних органах, є
активація Т-лімфоцитів, особливо Т-хелперів, які відіграють основну роль в ініціації та регуляції
імунної відповіді. Реалізація цієї функції можлива лише за умови забезпечення контакту Т-хелперів
47
з АПК. Оскільки в популяції лімфоцитів кількість Т-клітин, специфічних до кожного
індивідуального антигену, є незначною, можливість здійснення активації досягається уловлюванням
клонів антигенспецифічних Т-клітин у місцях локалізації АПК. Цей процес чітко простежується в
реґіонарних лімфовузлах, де роль АПК виконують ІДК.
Уловлювання клонів Т-клітин у лімфоїдних органах. Після того як «навантажена» антигеном
вуалеподібна клітина потрапляє у Т-клітинну зону вторинного лімфоїдного органа, в ньому
починається процес, відомий як «уловлювання клонів Т-клітин». Суть цього явища полягає у
збільшенні рециркуляції лімфоцитів через лімфоїдний орган, внаслідок чого підвищується
ймовірність специфічного розпізнавання наївними Т-лімфоцитами антигенного пептиду, що
знаходиться на ІДК. Відомо, що важливу роль при цьому відіграє синтез ДК прозапальних цитокінів
ІЛ-1, ІЛ-8, ФНП та певних хемокінів, після чого змінюється експресія адгезивних молекул на
венулах з високим ендотелієм (ВЕВ), що проходять через вторинні лімфоїдні органи, а також
підвищення проникності ВЕВ.
Після потрапляння активованої АПК у лімфоїдний орган спостерігається «арешт»
антигенспецифічних лімфоцитів. Експериментально встановлено, що за дві доби після введення
антигену в певний лімфатичний вузол у ньому можуть зосередитися всі антигенспецифічні Т-
лімфоцити, які вилучаються з циркуляції. «Арештовані» в лімфовузлах та інших лімфоїдних
органах Т-лімфоцити активуються локалізованими в них АПК.
Активація антигенспецифічних лімфоцитів за участю АПК. Для активації Т-лімфоцитів на
поверхні АПК має бути представлена достатня кількість молекул МНС II з відповідним антигенним
пептидом, а також костимуляторні молекули (В7.1/7.2 та ін.), тобто АПК має бути повністю
активованою. Контакт АПК з Т-клітинами відбувається в Т-зонах вторинних лімфоїдних органів,
куди Т-клітини потрапляють унаслідок процесу рециркуляції. Наївні Т-лімфоцити розпізнають
активовані АПК і встановлюють контакт з ними за допомогою взаємодії на їхній поверхні з
інтегрином LFA-1, лігандом якого є лімфоцитарна молекула ІСАМ-1. На активованих АПК і Т-
клітинах інтегрин LFA-1 експресується у «відкритій» конформації, а на наївних — у «закритій»,
тоді як його ліганд ІСАМ-1 наявний в однаковому стані як на наївних, так і на активованих
клітинах. Тому контакт між двома неактивованими клітинами є, як правило, слабкішим або зовсім
неможливим.
Під час активації наївного Т-хелпера активована АПК надає йому антигенспецифічний сигнал за
допомогою молекул МНС II з пептидами, а також костимуляторний сигнал за допомогою молекул
В7.1/7.2. Антигенспецифічний сигнал сприймається ТкР Т-хелпера, а костимуляторний —
молекулою CD28, що конститутивно наявна на мембрані наївного Т-лімфоцита. Обидва сигнали
забезпечують достатній рівень активації Т-хелпера, що супроводжується підвищенням рівня
секреції ІЛ-2 та експресії α-субодиниці CD25 високоафінного рецептора для цього інтерлейкіну.
Далі аутокринна секреція Т-клітиною ІЛ-2 забезпечує наступний етап активації та проходження
клітинного циклу. Активований Т-лімфоцит набуває ознак, потрібних для виконання його
ефекторних функцій:
— здатності продукувати деякі з цитокінів: ІЛ-2, -4, -5, -6, -7, -10, -12, ТФР, ФНП, ІФН тощо, які
необхідні для активації інших клітин;
— здатності експресувати костимуляторну молекулу CD40L, що необхідна для активації наївних
АПК через взаємодію з рецептором CD40;
— здатності взаємодіяти з неактивованими АПК завдяки переходу експресованого на його поверхні
LFA-1 у «відкриту» конформацію.
Отже, під час взаємодії Т-хелперів з АПК одна клітина може активувати іншу, якщо вона сама
активована. Первинна імунна відповідь, за якої в організмі відсутні активовані АПК та активовані
Т-хелпери, запускається за допомогою ДК, що активувалися в зоні локального запалення.
Активовані на АПК Т-хелпери проліферують (кількість їх збільшується), диференціюються і
починають виходити з лімфатичного вузла (лімфоїдного органа) на четверту добу після
потрапляння антигену в організм. Залежно від умов активації диференціювання Т-хелперів
відбувається на Тх1 або Тх2.
Диференціювання Т-хелперів, умови й особливості. Гуморальний і клітинний типи імунної
відповіді взаємопов'язані, проте існують механізми, що зумовлюють їх поляризацію та деяку
автономність. Центральна роль в індукції імунної відповіді того чи іншого типу належить різним
субпопуляціям Т-хелперів, що беруть участь в імунних реакціях: Тх1 беруть участь в активації
реакцій клітинного типу, а Тх2 — гуморального.
Тх1 і Тх2 відрізняються за набором цитокінів, які вони синтезують. Цей процес називають
поляризацією Т-хелперів за цитокіновим профілем. Спочатку наївні Т-клітини (пре-Тх),
активуючись на АПК, перетворюються на Тх0 і продукують лише ІЛ-2, після кількох поділів — ІЛ-
4 та ІФН-γ, а після диференціювання на Тх1 і Тх2 — характерний для них набір цитокінів.
Тх1 продукують ІЛ-2, ІФН-γ і ФНП-α, a Тх2 — ІЛ-4, -5, -6, -10, -13. Слід зазначити, що ІЛ-2, -12 і
ІФН-γ важливі для активації попередників ЦТЛ, а ІЛ-4, ІЛ-5, ІЛ-10 — для активації В-клітин та
переключення синтезу ізотипів антитіл.
Тх1 та Тх2 різняться також за спектром чутливості до хемокінів. Тх2 експресують хемокінові
рецептори CCR3, CCR4 та CCR8, а Тх1 — експресують переважно CCR5 та CXCR3. Це може
пояснювати переважну акумуляцію Тх1 у зоні запалення під час багатьох гострих і хронічних
запальних процесів та акумуляцію Тх2 у зоні алергічного запалення дихальних шляхів, шкіри й
тканин слизових оболонок.
Напрям диференціювання Т-хелперів визначають різні фактори: умови локального мікрооточення,
особливості АПК, кількість антигену, наявність певних цитокінів тощо. Так, показано, що ІДК, які
потрапили в лімфовузол зі шкіри, активують насамперед Тх1, а ДК слизових — Тх2. На
активованих В-клітинах активуються переважно Тх2, а на макрофагах – Тх1. Висока щільність
антигенів на поверхні АПК або висока афінність їхньої взаємодії з ТкР призводить до переважного
утворення Тх1, а низька щільність і афінність — до утворення Тх2. Локальне продукування
цитокінів ІЛ-4 та ІЛ-5 НКТ-клітинами та мастоцитами в лімфоїдній тканині слизових підсилює
продукування Тх2, а синтез ІФН-γ макрофагами або НК-клітинами в лімфовузлах зміщує рівновагу
в бік утворення Тх1.
Популяції Тх1 Тх2 перебувають в
антагоністичних взаємовідносинах, оскільки
ІФН-γ (продукт Тх1) може пригнічувати
утворення Тх2, а ІЛ-10 (продукт Тх2) –
утворення Тх1. Схему розвитку і взаємного
впливу субпопуляцій Т-хелперів наведено на
мал. 79.
Молекулярні механізми, що зумовлюють
диференціювання Т-хелперів у тому чи
іншому напрямі, було розглянуто у розд. 10.
Слід зазначити, що в «чистому вигляді»
поляризацію Т-хелперів на Тх1 і Тх2 можна
спостерігати лише у мишей і лише у
відповідь на певні антигени. Зазвичай процес
активації Т-хелперів супроводжується їх
диференціюванням на Т-клітини, які мають
«змішаний» фенотип, тобто експресують
певні цитокіни як Тх1-, так і Тх2-ряду. Тому у
відповідь на потрапляння антигену
розвиваються як клітинні, так і гуморальні
реакції імунітету (мал. 80). Однак у кожному випадку провідна роль в елімінації антигену належить
одній з двох імунних реакцій. Розвиток клітинної чи гуморальної імунної відповіді визначається
сукупністю факторів, серед яких головним є сам антиген, його характер та особливості хімічної
структури, а також шляхи надходження його в організм. Розглянемо, як відбувається розвиток
імунної відповіді при проникненні інфекційних агентів через слизові оболонки та шкіру.
Мал. 80. Загальна схема розвитку клітинної і
гуморальної імунної відповіді: 1 – захоплення
чужорідного антигену АПК; 2 – презентація
на АПК антигенного пептиду (АгП) у
комплексі з МНС II; 3 – розпізнавання Т-
хелпером на АПК комплексу МНС ІІ + АгП
та його активація; 4 – розпізнавання
чужорідного антигену імуноглобуліновим
рецептором В-клітини і презентація В-
клітиною антигенного пептиду в комплексі з
МНС II; 5 – розпізнавання активованим Т-
хелпером на В-клітині АгП в комплексі з
МНС II; 6 – активація В-клітини і
диференціювання її в плазматичну клітину; 7
– синтез плазматичною клітиною
специфічних антитіл; 8 – розпізнавання
активованим Т-хелпером на АПК-містку АгП
в комплексі з МНС II, активація цієї АПК та
розпізнавання ЦТЛ па АПК-містку-АгП в
комплексі з МНС І; 9 – активація ЦТЛ; 10 –
знищення активованим ЦТЛ клітини-мішені.
Імунна відповідь у слизових оболонках та шкірі. Елімінація патогенних мікроорганізмів, що
надходять у слизов оболонки, забезпечується переважно розвитком гуморальної імунної відповіді
продукуванням секреторних IgA. У пей' єрових бляшках (нижче епітелію купола бляшки) та інших
фолікулярних структурах, куди потрапляє антиген з поверхні епітелію, відбувається праймування
наївних Т- і В-лімфоцитів, активація, проліферація та детермінація шляхів наступного їх
диференціювання. Продуковані клітинами мікрооточення цитокіни спрямовують диференціювання
CD4Т-клітин у Тх2 та Тх3 і переключення синтезу імуноґлобулінів В-лімфоцитами з IgM-ізотипу на
IgA-ізотип. Переключення ізотипу антитіл, вірогідно, індукує ТФР-β, що продукується Тх3. Так
іноді називають субпопуляцію Т-хелперів, що локалізуються в слизових, продукують крім ТФР-β
також ІЛ-4 та ІЛ-10 і є важливими для стимуляції утворення IgA-антитіл В-лімфоцитами слизових.
Праймовані Т- і В-лімфоцити виходять з пейєрової бляшки, входять через аферентну лімфоїдну
судину в реґіонарний мезентеріальний лімфовузол, звідки через грудну протоку потрапляють у
кров'яне русло, а з кров'ю — в селезінку, де затримуються на кілька діб (упродовж яких триває їх
диференціювання), після чого вони знову повертаються у слизову оболонку (мал. 81).
У власній пластинці ІgА
+
В-клітини отримують додаткові стимули, що активують термінальну
стадію диференціювання їх на IgA-плазматичні клітини і підсилюють синтез IgA. Основними
факторами, що стимулюють диференціювання IgA
+
B-клітин на плазмоцити, є ІЛ-4, ІЛ-5 та ІЛ-6,
джерелом яких є Тх2 (останні переважають серед домінуючих у власній пластинці CD4Т-клітин).
ІЛ-4 і ІЛ-5 можуть секретуватися також Тх3 та мастоцитами. Найпотужнішим індуктором синтезу
IgA, як вважають, є ІЛ-6, який діє синергічно з ІЛ-5. Встановлено, що тільки ІgА
+
В-клітини (всі без
винятку) кишок людини експресують високий рівень рецепторів для ІЛ-6. Внесок цього цитокіну в
антитілогенез у слизових оболонках може бути досить істотним, якщо брати до уваги, що
продуцентами його, крім Тх2, є різні типи клітин (моноцити, макрофаги, фібробласти,
ендотеліоцити), а одним з найсильніших індукторів його синтезу є бактеріальний ліпополіцукрид
(ЛПЦ), постійним джерелом якого є мікрофлора слизових оболонок. Встановлено, що після
внутрішньовенного введення ЛПЦ уже через 2 год рівень ІЛ-6 у сироватці крові підвищується на
три порядки (у 1000 разів).
Локалізовані у Lamina propria плазматичні клітини синтезують IgA у димерній формі у вигляді двох
молекул, що з'єднані між собою J-ланцюгом. Цей димер зв'язується на базолатеральній поверхні
епітеліальної клітини синтезованим нею полі-Ig-рецептором (pІgR). Утворений комплекс —
димерний IgA — pІgR потрапляє внаслідок ендоцитозу в епітеліальну клітину, упаковується в
цитоплазматичну везикулу (залишаючись зв'язаним з її мембраною за допомогою pІgR) і
переноситься в ній через клітину до її апікальної поверхні. Тут транспортні везикули зливаються з
плазматичною мембраною епітеліальної клітини, a pІgR розщеплюється за допомогою спеціального
ферменту на дві частини: одна з них залишається зв'язаною з мембраною, а інша — з Fc-фраґментом
IgA та функціонує як секреторний компонент. Останній запобігає розщепленню sІgA
протеолітичними ферментами.
Проникнення і персистенція в шкірі певних патогенів (зокрема, внутрішньоклітинних паразитів)
переважно індукує клітинні імунні
реакції — реакцію ГСТ та реакцію
цитотоксичних Т-лімфоцитів, які
зумовлюють елімінацію або ізоляцію
збудника (мал. 82).
Важливу роль у розвитку захисних
реакцій у шкірі відіграють активовані
кератиноцити, які продукують різні
цитокіни, що запускають активаційні
та міграційні процеси у клітинах
імунної системи. Завдяки індукованій
міграції клітин основні компоненти
асоційованої зі шкірою лімфоїдної
тканини формують функціональний
комплекс, що забезпечує умови для
розвитку імунної відповіді. При
цьому різні фази імунної відповіді
здійснюються в певних місцях. В
епідермісі відбувається сприйняття
антигенного сигналу клітинами
Лангерганса, які, активуючись
цитокінами, продукованими
кератиноцитами, мігрують у
лімфовузли, де, перетворившись на
ІДК, реалізують
антигенпрезентувальну функцію та
запускають індуктивні імунні
механізми і утворення ефекторних
клітин Тх1 і (або) ЦТЛ. Ефекторна
фаза імунної відповіді розвивається в
шкірі (у дермі, менше в епідермісі),
куди мігрують Тх1 і ЦТЛ крізь
високий ендотелій в осередку
запалення. Тут Тх1 виконують
ефекторні функції в реакції ГСТ, а
ЦТЛ — у цитотоксичній реакції.
Розглянемо закономірності й
механізми розвитку клітинної та
гуморальної імунної відповіді.
11.2. РЕАКЦІЇ КЛІТИННОГО
ІМУНІТЕТУ.
Клітинний імунітет здійснюється
сенсибілізованими (імунними) Т-
лімфоцитами проти клітин, які
містять на своїй поверхні вірусні або
мікробні антигени, алоантигени,
специфічні пухлинні антигени. Це
імунітет, що здійснюється клітинами
проти клітин, тобто реакції клітин
імунної системи проти клітин
мікробів, трансплантатів, пухлин.
Унаслідок клітинних реакцій
відбувається елімінація патогенних
мікробів, що проникли в організм,
деструкція пухлинної тканини,
відторгнення трансплантата.
Вперше прояви антигенспецифічної
клітинної реактивності (у вигляді
індукованих туберкуліном місцевих
шкірних реакцій у хворих на
туберкульоз) спостерігав і описав Р.
Кох у 1890 р. Однак лише через півстоліття було доведено, що цей вид реактивності має імунну
природу та клітинну основу, і, отже, було обґрунтовано існування специфічного імунітету
клітинного типу, а механізми клітинного імунітету та форми його прояву з'ясовані лише у другій
половині XX ст.
Існує два типи специфічних імунних клітинних реакцій: цитотоксична реакція Т-лімфоцитів та
реакція гіперчутливості сповільненого типу (ГСТ). Ці реакції різняться за ефекторними
механізмами, що спрямовані на елімінацію клітин, на поверхні яких експресуються чужорідні
антигени. Основою механізмів цитотоксичної реакції є індукування та реалізація цитотоксичної
функції T-кілерів, що знищують інфіковані чи злоякісно трансформовані клітини. У механізмах
реакції ГСТ основна роль належить активації продуктами Т-хелперів інфікованих макрофагів, які
знищують локалізовані у них патогени.
Залучення макрофагів чи Т-кілерів для знищення того чи іншого внутрішньоклітинного патогену
визначається його біологічними властивостями, особливостями паразитизму, локалізацією в клітині
та певною мірою типом інфікованої клітини, тобто механізмом процесингу його антигенів. Часто за
патологічних станів імунна відповідь супроводжується активацією і макрофагів, і Т-кілерів та
паралельним розвитком реакції ГСТ і цитотоксичної реакції Т-кілерів.
Слід зазначити, що імунна відповідь організму на чужорідні антигени ніколи не розвивається за
типом клітинної реакції у «чистому вигляді». Паралельно з розвитком клітинних реакцій завжди
відбувається синтез антитіл, які можуть модифікувати клітинну відповідь. Синтезовані антитіла
виконують, зокрема, важливу функцію в деяких (антитілоопосередкованих) клітинних
цитотоксичних реакціях, забезпечуючи прикріплення ефекторних клітин до клітин-мішеней.
У реакціях клітинного імунітету провідна роль належить Тх1-клітинам. Вони активують (або
підсилюють) за допомогою продукованих ними цитокінів функції ефекторних клітин у реакціях
сповільненої гіперчутливості та клітиноопосередкованої цитотоксичності; Тх2, стимулюючи синтез
антитіл, сприяють запуску реакцій антитілозалежної цитотоксичності.
11.2.1. Цитотоксична реакція Т-лімфоцитів.
Клітинна цитотоксичність — важливий механізм захисту при багатьох інфекційних захворюваннях,
збудники яких є внутрішньоклітинними паразитами (облігатними чи факультативними), а також
при злоякісних новоутвореннях. Цей вид реактивності забезпечує захист організму від патогенів, що
живуть у цитоплазмі інфікованих клітин — насамперед вірусів, а також деяких бактерій та
найпростіших (наприклад, Toxoplasma gondii). Оскільки в клітині ці патогени є недоступними для
дії антитіл, вони можуть бути еліміновані лише у разі знищення інфікованих клітин.
Цитотоксичність можуть виявляти кілька типів клітин як лімфоїдного, так і мієлоїдного (макрофаги,
нейтрофіли, еозинофіли) рядів. Лімфоїдні цитотоксичні клітини мають спільну назву — кілерні
клітини. Вбиваючи клітини-мішені, різні клітини-вбивці різняться між собою як за особливостями
їх розпізнавання, так і за механізмами реалізації цитотоксичної дії. Зважаючи на ці відмінності,
виділяють два типи цитотоксичних лімфоїдних клітин — Т-кілери та природні кілери. Із двох типів
цитотоксичних клітин імунною специфічністю характеризуються лише Т-кілери. Т-кілери, або
цитотоксичні Т-лімфоцити (ЦТЛ), активуються антигеном і вбивають ті клітини-мішені, що несуть
цей самий антиген на своїй поверхні. Антигени розпізнаються ними в комплексі з молекулами
МНС.
Переважну більшість ЦТЛ (90 %) становлять Т-клітини з корецептором CD8, які розпізнають
антигенні пептиди в асоціації з молекулами МНС І, і лише незначна частина їх представлена CD4Т-
клітинами, які рестриктовані за антигенами МНС II. ЦТЛ належить важлива роль у захисті
організму від вірусів та вірусіндукованих пухлин, у відторгненні трансплантованих чужорідних
органів і тканин. Т-кілери легко активуються вірусними, пухлинними або алогенними антигенами і
вбивають клітини-мішені, що несуть відповідні антигени, розпізнаючи експресовані на їхній
поверхні пептиди цих антигенів у комплексі з молекулами МНС.
В експериментальних дослідженнях Т-кілери отримують in vivo, імунізуючи мишей пухлинними
клітинами або вірусами. Цитотоксичну активність виділених (через 10—11 діб після імунізації) із
селезінки тварин лімфоцитів визначають, культивуючи їх in vitro з міченими
51
Сr клітинами-
мішенями — пухлинними, гомологічними тим, що використовувалися для імунізації, або
інфікованими відповідним вірусом. Цитотоксичну активність Т-кілерів оцінюють за виходом у
середовище
51
Сr.
Т-кілери ефективно активуються також алогенними пептидами в асоціації з алогенними молекулами
МНС. Це відбувається в змішаній культурі лімфоцитів (ЗКЛ) від несумісних особин, в якій
унаслідок взаємної антигенної стимуляції генетично чужорідних клітин генеруються Т-кілери

48
різних генотипів. Реакція залежить від наявності в культурі 1 — 2 % макрофагів (моноцитів), що
виконують роль АПК. Отже, у цій системі і ефекторними клітинами, і клітинами-мішенями є
цитотоксичні Т-лімфоцити. В алогенній ЗКЛ на рівні клітинної популяції спостерігається
двоспрямований лізис клітин — кілерну активність виявляють лімфоцити обох генотипів. Однак у
кожній окремій парі лімфоцитів, що взаємодіють між собою, літичну активність вірогідно виявляє
та клітина, рецептори якої мають більшу спорідненість до антигену.
Активація цитотоксичних Т-лімфоцитів. Для вивчення клітинних взаємодій у цитотоксичній
реакції Т-лімфоцитів, зокрема для з'ясування ролі Т-хелперів та АПК у диференціюванні ЦТЛ з
їхніх наївних попередників, було використано так звану «дефектну» ЗКЛ, в якій виключалася
функція Т-хелперів за збереження функції попередників ЦТЛ (пре-ЦТЛ). Для виключення функції
Т-хелперів із ЗКЛ вилучали безпосередньо клітини хелперної групи фенотипу CD4 або інактивували
(прогріванням, обробкою ультрафіолетовим випромінюванням) МНС ІІ
+
антигенпрезентувальні
клітини-стимулятори, що активують Т-хелпери.
У такій «дефектній» ЗКЛ пре-ЦТЛ не диференціювалися в ефекторні ЦТЛ після стимуляції їх як
алогенними, так і модифікованими чужорідними антигенами сингенними клітинами. Утворення
ЦТЛ спостерігалося лише тоді, коли в культуральне середовище «дефектної» ЗКЛ добавляли
надосадову рідину з «повноцінної» ЗКЛ або коли «дефектну» і «повноцінну» культури розділяли у
подвійній мікродифузній камері.
У цих дослідженнях було встановлено існування та умови синтезу розчинних факторів (цитокінів) і
їхню роль у клітинних взаємодіях та в активації субпопуляцій лімфоцитів, що беруть участь у
цитотоксичній реакції. Було зроблено висновок, що для активації пре-ЦТЛ і генерації ЦТЛ потрібно
принаймні два послідовних сигнали, які індукуються антигеном та ІЛ-2. Перший сигнал пре-ЦТЛ
отримує під час розпізнавання ТкР комплексу антигенний пептид — МНС І на клітині-мішені, а
другий сигнал — під час зв'язування експресованим на його поверхні рецептором (ІЛ-2R) ІЛ-2,
секретованого активованим на АПК Т-хелпером. АПК потрібна лише для активації Т-хелпера, але
не пре-ЦТЛ.
Однак сьогодні відомо, що клітини-мішені не можуть активувати наївні CD8T-клітини, як це
вважали раніше, оскільки вони, як правило, не експресують молекули B7(CD80 і CD86) і у зв'язку з
цим не можуть забезпечити костимуляторний стимул через взаємодію з СD28Т-лімфоцита.
Згідно з існуючими нині уявленнями, експансія і диференціювання цитотоксичних CD8T-клітин
може здійснюватися за участю лише АПК або АПК і Т-хелперів. При цьому АПК забезпечують
антигенний і костимуляторний стимули, а Т-хелпери або самі прекілери є джерелом ІЛ-2 (мал. 83).
Найвірогідніше активацію наївних CD8T-клітин (як і СD4Т-клітин) здійснюють «професійні»
активовані АПК, надаючи їм для розпізнавання антигенний пептид у комплексі з МНС І та
забезпечуючи сильний додатковий стимул через взаємодію великої кількості експресованих на їхній
поверхні костимуляторних молекул В7 з лімфоцитарними рецепторами CD28. Під впливом
індукованого розпізнаванням антигену сигналу CD8T-клітини виходять із фази спокою (G
0
) у ранню
фазу G1, трансформуються на бласти і експресують молекулу CD25 — α-ланцюг високоафінного
рецептора для ІЛ-2. Додатковий сигнал стимулює продукування активованими CD8T-клітинами ІЛ-
2, який, зв'язуючись із гомологічними рецепторами, забезпечує їх розмноження за аутокринним
механізмом (див. мал.83, а).
Джерелом ІЛ-2 під час активації CD8Т-клітин можуть бути й активовані T-xeлпери, які
забезпечують розмноження активованих антигеном пре-ЦТЛ за паракринним механізмом. Однак з
урахуванням феномену МНС-рестрикції Т-хелпери не можуть безпосередньо, внаслідок прямого
контакту активувати СВ8Т-клітини, оскільки останні не несуть на своїй поверхні молекул МНС II.
Тому взаємодія між Т-хелперами і CD8T-клітинами опосередковується професійною АПК (ІДК), на
поверхні якої експресуються молекули МНС класу І і II. Активація відбувається на поверхні однієї й
тієї самої АПК, де Т-хелпери і пре-ЦТЛ утворюють кластери (див. мал. 83, б). АПК в такій взаємодії
виконує функцію «містка» між Т-хелпером і пре-ЦТЛ, оскільки представляє антигенні пептиди в
асоціації з молекулами МНС обох класів.
Крім того, активовані у процесі імунної відповіді Т-хелпери можуть посилювати експресію молекул
В7 на АПК за рахунок продукування ІФН-α і, отже, стимулювати їхню здатність активувати СВ8
+
Т-
клітини (див. мал. 83, в).
Активовані антигеном пре-ЦТЛ розмножуються під впливом ІЛ-2 і диференціюються на ефекторні
кілерні клітини. Поділ клітин відбувається кожні 8 годин і вже через 3 — 4 доби після проникнення
інфекційного агента (наприклад, вірусу) в організмі накопичується велика кількість ефекторних
ЦТЛ. Слід зазначити, що ІЛ-2 зумовлює перехід із ранньої фази G
1
у пізню, не впливаючи на
наступний рух клітини по циклу, і підтримує тривалу проліферацію вже активованих CD8 Т-клітин.
Активація ЦТЛ in vivo відбувається в тимусзалежних зонах лімфоїдних органів — паракортикальній
зоні лімфатичних вузлів та періартеріолярних муфтах селезінки. Утворені ЦТЛ надходять у
циркуляцію, звідки можуть мігрувати у місця запалення (завдяки посиленню експресії інтегринів) і
знищувати локалізовані в них інфіковані або трансформовані клітини. ЦТЛ вбивають лише ті
клітини-мішені, які несуть молекули МНС І з тим самим антигенним пептидом, що знаходився на
АПК.
Активовані ЦТЛ здійснюють кілерну функцію після взаємодії ТкР з комплексом антигенний пептид
— МНС І на поверхні клітини-мішені за відсутності костимуляторних молекул, але за участю
корецепторів (CD8) та молекул адгезії, які сприяють установленню щільного контакту між
клітинами. Реалізація цитотоксичної функції пов'язана з набуттям ЦТЛ здатності синтезувати білки
«на експорт» (перфорин, гранзими, гранулізини), а також мембранні молекули (наприклад, Fas-L),
що відіграють важливу роль у механізмах апоптозу клітин-мішеней.
Стадії взаємодії цитотоксичних Т-лімфоцитів з клітинами-мішенями. В експериментальних
дослідженнях Т-клітинного цитолізу з використанням двох тестів — адсорбція лімфоцитів на
моношарі клітин-мішеней та утворення комплексів ЦТЛ — клітина-мішень під час осадження
суміші клітин центрифугуванням з наступним ресуспендуванням осаду у в'язкому середовищі було
з'ясовано послідовність подій, яка призводить до загибелі клітин-мішеней.
Процес взаємодії ЦТЛ і клітини-мішені умовно поділяють на три стадії, що відбуваються
послідовно: стадія 1 — розпізнавання ЦТЛ клітини-мішені і встановлення контакту між клітинами,
що взаємодіють; стадія 2 — програмування лізису (смертельний удар) — запуск літичного
механізму; стадія 3 — лізис клітини-мішені — реалізація літичного механізму.
Кожна стадія взаємодії реалізується за певних умов. Відрізняються вони передусім за ступенем
залежності від двовалентних катіонів. Для встановлення щільного контакту між ЦТЛ і клітиною-
мішенню необхідна наявність катіонів Mg2+. Запуск цитолітичного механізму відбувається тільки
за наявності в середовищі катіонів Са
2+
. Однак лізис клітини може відбуватися і за відсутності
катіонів. Відмінності в потребах катіонів дають змогу відокремлювати стадії одна від одної та
детально їх вивчати.
Під час вивчення літичного циклу використовували так званий Са
2+
-пульсовий метод із
застосуванням катіонів Са
2+
і Mg
2+
та ЕДТА. Якщо у середовище з сумішшю ЦТЛ і клітин-мішеней
добавляли лише катіони Mg
2+
, то відбувалось зв'язування без програмування лізису, а наступне
введення катіонів Са
2+
запускало смертельний удар. Тривалість ціє стадії визначали введенням у
різні періоди часу ЕДТА, який роз'єднує кон'югат ЦТЛ — клітина-мішень.
Розпізнавання клітини-мішені ЦТЛ здійснюється за допомогою ТкР (за участю корецептора CD8),
який зв'язує на поверхні клітини-мішені комплекс антигенного пептида з молекулою МНС І. Ц
зв'язування визначає специфічність взаємодії. Встановленню тісного контакту між клітинами, що є
необхідною умовою реалізації цитотоксичної дії, сприяють взаємодії експресованих на поверхні
обох клітин комплементарних молекул адгезії. Серед останніх найважливіше значення мають
пов'язані з функцією ЦТЛ молекули LFA-1 (CD11a/CD18) та LFA-2 (CD2), які розпізнають
експресовані на клітині-мішені відповідно молекули ІСАМ-1 та LFA-3 (CD58).
Зближення клітин відбувається у два етапи: перший здійснюється за участю мікрофіламентів
(пригнічується цитохолазином А) і не залежить від наявності йонів Mg
2+
, другий – Mg2+-залежний.
Запуск літичного механізму (програмування лізису) — метаболічно активний процес. Він
розвивається за температури 37 °С та наявності енергетичного метаболізму, збереження активності
цитоскелета й ферментів ЦТЛ і пригнічується інгібіторами метаболізму (азидом натрію,
динітрофенолом) й низькими температурами. В ЦТЛ відбувається реорганізація елементів
цитоскелета і цитоплазматичних гранул: переміщення і концентрування гранул під мембраною в
місці контакту з клітиною-мішенню та орієнтація в напрямі до неї апарату Гольджі й центру
організації мікротрубочок. На стадії програмування лізису в клітині-мішені індукуються Т-кілером
процеси, які неминуче призводять її до загибелі, з чим і пов'язана друга назва її — смертельний
удар. Деструкція клітини-мішені відбувається після відокремлення від неї ЦТЛ. Готовність до
лізису після отримання смертельного удару зберігається у клітини-мішені до 5 год за умови
охолодження її до 15 °С. Для здійснення лізису потрібна температура не нижча за 30 °С
(максимальний ефект спостерігається при 37 — 41 °С). Отже, ЦТЛ не бере безпосередньої участі в
деструкції клітини-мішені, а лише запускає в ній цитолітичний механізм.
Механізми цитотоксичної дії Т-кілерів. ЦТЛ реалізують кілерну функцію через індукування
апоптозу (див. розд.10). Найпоширеніший шлях індукування апоптозу в ЦТЛ, як і в НК-клітин, —
перфоринзалежний, що пов'язаний із секрецією літичних гранул і доставлянням усередину клітини-
мішені через утворені перфорином пори індукторів апоптозу гранзимів та гранулізину (див. розд. 2).
Серед низки ідентифікованих гранзимів (А, В, С, D, Е, F, G, Н, К, М), з яких лише кілька
експресуються кожною кілерною клітиною, на найбільшу увагу заслуговують найпоширеніші у
людей і мишей гранзими А і В, особливо В. Механізми індукованої загибелі клітин-мішеней цими
білками досліджено in vitro.
Роль обох білків — перфорину і гранзиму В в загибелі клітин доведено на трансфекованих
мастоцитах, у яких зшивання Fсε-рецепторів та викид літичних гранул відбуваються за подібним до
ЦТЛ механізмом. Мастоцити, трансфековані тільки геном гранзиму В, не здатні вбивати клітини-
мішені, а трансфековані лише геном перфорину здійснюють кілінг недостатньо ефективно, однак
ефективність підвищується (до її рівня в ЦТЛ) після введення їм ще гена гранзиму В. Показано, що
гранзим В за відсутності перфорину може проникати в клітину ендоцитозом, зв'язуючись із
клітинним рецептором (як припускають, манозо-6-фосфатом), проте для виходу його з
ендоцитозного компартменту в цитозоль потрібний перфорин.
Гранзим В індукує як каспазозалежну (див. розд. 10), так і незалежну апоптичну загибель клітин. У
першому випадку гранзим В активує каспазу 3, яка розщеплює інгібітор каспазоактивованої
ДНКази (CAD) білок ICAD, що спричинює активацію ферменту та олігонуклеосомну фрагментацію
ДНК. У другому випадку гранзим В індукує безпосередньо два шляхи олігонуклеосомного
ушкодження ДНК за участю різних нуклеаз: вивільняючи мітохондріальну ендонуклеазу G
(ENDOG) внаслідок порушення зовнішньої мембрани мітохондрій та активуючи CAD
розщепленням її інгібітору.
Гранзим А індукує каспазонезалежний, але інший, ніж гранзим В, тип загибелі клітин через
порушення мембранного потенціалу мітохондрій і активацію нуклеази GAAD (гранзим А-
активована ДНКаза), яка ушкоджує ДНК не з розривами подвійних її ланцюгів, а з утворенням
одноланцюгових надрізів. Каспазонезалежну загибель клітин з однонитковими надрізами ДНК
індукує також гранзим С (експресується у мишей), однак утворені при цьому кінці ДНК мітяться
полімеразами Кленова і TdT, тоді як індуковані гранзимом А — лише полімеразою Кленова.
Гранулізин (експресується ЦТЛ і НК-клітинами людини) за високої концентрації порушує
зовнішню мембрану мітохондрій, вивільняючи AIF (фактор, що індукує апоптоз), цитохром с та
ENDOG, і може індукувати каспазонезалежну, а також залежну від каспаз загибель клітин-мішеней.
Слід зазначити, що високі концентрації перфорину можуть зумовлювати загибель клітин-мішеней in
vitro за відсутності гранзимів і гранулізину, не індукуючи фрагментацію ДНК, тобто не апоптозом, а
некрозом. В умовах організму в перфоринзалежному цитолізі клітин-мішеней переважають ознаки
апоптозу, але формування пор призводить і до певних проявів некрозу.
Т-кілери використовують також інший, незалежний від перфорину, механізм індукування апоптозу,
який полягає у передаванні цитотоксичного сигналу через поверхневі молекули клітини-мішені —
рецептори «смерті»: Fas-рецептор і рецептор для ФНП. Ліганд для Fas — L-молекула FasL (Fas-
ліганд) експресується на цитотоксичних CD8T-клітинах після їх активації, а також на активованих
СD4Т-клітинах (Тх1), які, на відміну від CD8T-клітин, не продукують ні перфорин, ні гранзими.
Зв'язування молекули Fas мембрани клітини-мішені з Fas-лігандом на мембрані ЦТЛ зумовлює
агрегацію молекул Fas і приєднання до їхніх цитоплазматичних «смертоносних» доменів
внутрішньоклітинного «білка смерті» MORT-1. Це призводить до індукування апоптозу через
активацію каспаз аналогічно індукуванню цього процесу перфорином та гранзимами.
Передавання цитотоксичного сигналу через ФНП-рецептор, що експресується на клітині-мішені,
здійснюється опосередковано через взаємодію з цим рецептором продукованого ЦТЛ цитокіну
ФНП. Вважають, що ФНП лише частково відповідає за цитотоксичність Т-клітин. Зв'язування ФНП
з відповідним рецептором потенціює (підсилює) сигналізацію через взаємодію FasL-Fas.
Отже, ЦТЛ використовують різні способи для того, щоб обмежити поширення
внутрішньоклітинних патогенів. При цьому вони вибірково, з великою точністю вбивають
інфіковані клітини, що експресують специфічний антиген, не ушкоджуючи сусідніх нормальних
клітин. Така спрямована дія ЦТЛ на клітину-мішень, що несе специфічний антиген, і чітко
сфокусована в точку контакту з нею має особливо велике значення для мінімізації руйнування тих
тканин, в яких регенерація не відбувається (нейрони ЦНС) або дуже обмежена (острівці
Лангерганса).
Т-кілери є не лише селективними, а й «серійними» вбивцями. Після вбивства однієї клітини-мішені
вони швидко відновлюють свій цитотоксичний потенціал і успішно вбивати інші клітини, що було
продемонстровано в тонких мікроманіпуляційних експериментах (при перенесенні окремих
ефекторних Т-клітин за допомогою мікрокапіляра на нові клітини-мішені). Т-кілери, що встановили
контакт одразу з кількома клітинами-мішенями, вбивають їх по черзі, одну за одною, реорієнтуючи
свій секреторний апарат у напрямі кожної з них. Відновлення цитотоксичного потенціалу пов'язано
з синтезом de novo перфорину і гранзимів, що індукується лігацією рецепторів. Зрілі наївні CD8T-
клітини, що виходять із тимуса, запрограмовані на синтез цих ефекторних білків, але ще не
експресують їх. Ці білки синтезуються під час першого контакту наївних пре-ЦТЛ з антигеном на
АПК і зберігаються у вигляді неактивних молекул-попередників у гранулах. Гранули екзоцитуються
під час взаємодії ефекторних ЦТЛ з клітинами-мішенями. При цьому зв'язування з антигеном і
перехресне зшивання ТкР індукує de novo синтез перфорину та гранзимів, і запаси їх у гранулах
відновлюються. Завдяки екзоцитозу вже преформованих цитотоксичних білків програмування
лізису Т-кілером клітини-мішені здійснюється швидко — впродовж кількох хвилин після
встановлення контакту з нею.
Важливо, що індуковані ЦТЛ апоптичні механізми, вбиваючи клітину-мішень, можуть впливати і на
локалізовані в цитоплазмі патогени. Так, активовані нуклеази можуть руйнувати вірусну ДНК,
запобігаючи формуванню віріонів і виходу із зараженої клітини інфекційного вірусу, який здатний
інфікувати інші клітини. Інші ферменти, зокрема різні протеїнази, що активуються в ході апоптозу,
можуть спричинювати несприятливий вплив (порушуючи тою чи іншою мірою життєздатність) на
такі патогени, як бактерії та найпростіші, що паразитують у цитоплазмі. Відомо, що секретований
ЦТЛ гранулізин вбиває внутрішньоклітинні бактерії (Mycobacterium tuberculosis та ін.), підвищуючи
проникність їхніх мембран. У руйнуванні нуклеїнових кислот і білків не тільки клітини-мішені, а й
патогенів полягає перевага апоптозу над некрозом, оскільки звільнені у процесі осмотичного лізису
(некрозу) клітини інфекційні агенти можуть заражати інші клітини.
11.2.2. Реакція гіперчутливості сповільненого типу.
Гіперчутливість сповільненого типу (ГСТ) постійно розвивається при хронічних бактеріальних
(туберкульоз, бруцельоз, туляремія, сифіліс), зумовлених грибами (бластомікоз, кокцидіоїдоз) і
вірусами (герпес) інфекціях, а також при захворюваннях, спричинюваних найпростішими
(лейшманіоз) та глистовими інвазіями (шистосомоз).
Реакції ГСТ відіграють важливу роль у захисті хазяїна від тих внутрішньоклітинних патогенів, які
паразитують у макрофагах і протидіють знищенню їх неактивованими макрофагами. Класичним
прикладом таких інфекцій є туберкульоз і проказа, збудники яких (мікобактерії) живуть у
фагосомах, протидіючи злиттю їх з лізосомами, або у фаголізосомах, запобігаючи закисленню
їхнього вмісту, що є необхідним для активації лізосомальних ферментів.
За своїми механізмами реакція ГСТ відрізняється від цитотоксичної реакції лімфоцитів. Головна
відмінність полягає в тому, що ефекторну функцію для знищення патогенів у реакції ГСТ
виконують не лімфоцити, а клітини природного імунітету — макрофаги.
Дія захисних механізмів при ГСТ спрямована не на знищення інфікованих клітин – макрофагів, а на
підвищення їхньої функціональної активності, тобто на активацію їх для знищення локалізованих у
них інфекційних агентів. Ключову роль в активації макрофагів відіграють Тх1-клітини.
Антигенспецифічні Тх1-клітини опосередковують реакції ГСТ та відіграють роль у їх запуску, тому
і розглядаються як ефектори реакції ГСТ.
Тх1-клітини накопичуються в організмі внаслідок первинного проникнення в нього антигену
природним (наприклад, у процесі інфікування патогенами) або експериментальним шляхом. При
цьому найефективнішим для індукування ГСТ є проникнення антигену через шкіру. Іншим
важливим фактором, що визначає успіх індукування ГСТ, є наявність у мікробів ліпідних
компонентів (особливо багато їх у мікобактерій туберкульозу та прокази) або введення антигену з
ад'ювантами, що містять мікобактерії й масляні компоненти. Активація наївних СD4Т-клітин і
диференціювання їх у Тх1-клітини відбувається переважно в реґіонарних до місця проникнення
антигену лімфовузлах, у їхніх паракортикальних зонах, де відбувається вловлювання
(рекрутування) антигенспецифічних Т-лімфоцитів. Роль АПК під час першої дії антигену можуть
виконувати ДК або макрофаги. Клони Тх1-клітин, що утворилися внаслідок активації,
бласттранформації і проліферації їх наївних попередників, виходять (у вигляді бластів) на 5 — 7-му
добу після первинного контакту з антигеном із лімфовузлів і надходять у кровотік. Разом із кров'ю
вони розносяться по всьому організму і поселяються в різних відділах імунної системи,
зумовлюючи стан сенсибілізації (підвищеної чутливості) — готовність до підвищеної реакції на
повторний контакт з відповідним антигеном. Ця готовність може бути виявлена за здатністю Тх1-
клітин переносити стан ГСТ до імуногена інтактним особинам, які ще не контактували з ним.
Здатність переносити стан сенсибілізації властива також клітинам пам'яті, що утворюються пізніше
— через 30 діб. Як бластні форми, так і клітини пам'яті практично не продукують цитокіни до
повторного контакту з антигеном.
Після повторного інфікування тим самим патогеном чи виходу його з ізольованого первинного
інфекційного осередку під час рецидиву (або повторного введення антигену експериментально – так
званої роздільної дози антигену) Тх1-клітини, що перебувають у циркуляції, мігрують у ділянку
локалізації антигену (патогену). Тут вони реактивуються, реагуючи на антиген, що знаходиться на
макрофагах, які виконують роль АПК за повторної дії антигену. Слід зазначити, що реактивація
Тх1-клітин може відбуватися і без повторного проникнення (введення) антигену за умови наявності
в організмі первинно прониклого антигену на час виходу Тх1-клітин з лімфовузлів у циркуляцію.
Активовані Тх1-клітини продукують властивий їм профіль цитокінів, за допомогою яких у реакцію
залучаються та активуються клітини інших типів, насамперед макрофаги. Мобілізовані й активовані
Тх1-клітинами макрофаги підвищують у процесі активації свій антимікробний потенціал через
посилення продукування активних метаболітів і самі безпосередньо знищують внутрішньоклітинні
патогени. Тому активовані макрофаги можна розглядати як ефекторні клітини реакції ГСТ, а Тх1-
клітини — як індуктори та регулятори цієї реакції. Існує також інша оцінка ролі задіяних у реакції
ГСТ клітин, згідно з якою Тх1-клітини розглядаються як ефектори цієї реакції, а макрофаги — як
клітини-партнери, що зумовлюють запалення. Слід зазначити, що саме участь запальних клітин —
макрофагів визначає особливість реакції ГСТ, її суть (імунна реакція із запальним компонентом,
імунне запалення).
За внутрішньошкірного введення антигену в сенсибілізований організм розвивається типова для
ГСТ місцева запальна реакція, яка використовується як тест для діагностики сповільненої
гіперчутливості. Реакція розвивається повільно (не раніше, ніж через 6 — 8 год після ін'єкції
антигену), досягаючи максимальної вираженості через 24 — 48 год, чим і пояснюється її назва.
Реакція характеризується появою в ділянці ін'єкції антигену еритеми (почервоніння) та ущільнення
шкірних покривів. З гістологічного погляду головною особливістю реакції є місцеве накопичення
мононуклеарних клітин — Т-лімфоцитів (переважно Тх1) та макрофагів.

49
Активація макрофагів Тх1-клітинами. Активація макрофагів та підсилення антимікробних
механізмів у них є найважливішою ефекторною функцією Тх1-клітин. Цю функцію здатні
виконувати лише активовані Тх1-клітини внаслідок попереднього контакту з відповідним
антигеном.
Активовані Тх1-клітини забезпечують обидва сигнали, необхідні для активації макрофагів (мал. 84).
Один із них генерується ІФН-γ, інший — СD40-лігандом (CD40L). Секреція Тх1-клітиною ІФН-γ та
експресія CD40L індукується розпізнаванням ТкР бактеріального пептиду в асоціації з молекулою
МНС класу II на поверхні інфікованого макрофага. Синтез цитокіну розпочинається впродовж
першої години з часу подразнення рецептора.
ІФН-γ є основним фактором, що стимулює
антимікробну (і протипухлинну)
активність макрофагів. Взаємодія CD40L
Тх1-клітини з молекулою CD40 макрофага
індукує сигнал, що є необхідним для
підвищення чутливості макрофага до ІФН-
γ (очевидно, завдяки посиленню експресії
рецепторів до цього цитокіну). Роль ІФН-γ
та CD40L в активації макрофагів
підтверджена у дослідах на нокаутних
мишах. Руйнування гена ІФН-γ чи CD40L
призводить до ослаблення продукування
макрофагами антимікробних медіаторів і
тварини гинуть від сублетальних доз
Mycobacterium spp., Leishmania spp., вірусу
вісповакцини. Аналогічний до CD40L
ефект зумовлює в дуже малій кількості
бактеріальний ЛПЦ, взаємодіючи з
рецептором CD14 на поверхні макрофага.
Костимуляція макрофага ЛПЦ є частково
важливою тоді, коли джерелом ІФН-γ є
CD8T-клітини, які реагують на наявні на
його поверхні асоційовані з МНС І
пептиди, що походять із цитозольних
білків. Припускають, що мембранозв'язані
ФНП-α та ФНП-β можуть заміняти CD40L
під час активації макрофагів,
акцентуючись на експресованих на їхній
поверхні ФНП-рецепторах (стимулюючи
одночасно секрецію ними ФНП-α). За
недостатньої кількості ФНП-рецепторів
миші виявляють підвищену
сприйнятливість до внутрішньоклітинних
патогенів.
Активовані макрофаги значно підвищують
свій антимікробний потенціал завдяки
підсиленню злиття фагосом з лізосомами, в
яких містяться різні ферменти, та
підсилення утворення високоактивних
метаболітів оксигену (О2
●
) та нітрогену
(NO). Вважають, що токсичний ефект на
бактеріальні та пухлинні клітини
пов'язаний не з самою сполукою NO, а
переважно з пероксинітритами, що утворюються внаслідок взаємодії оксиду нітрогену NO з
перексидом гідрогену Н
2
О
2
. Максимальна продукція NO індукується сумісною дією на макрофаги
різних стимуляторів. Для цього макрофаги миші потрібно послідовно стимулювати ІФН-γ і ФНП-α,
які діють синергічно: ФНП-α запускає утворення оксиду нітрогену, а ІФН-γ активує цей процес.
Джерелом ФНП-α можуть бути самі макрофаги за умови активації їх ІФН-γ і мікробними
продуктами, наприклад ЛПЦ. Активовані продукованим Тх1-клітинами ІФН-γ і бактеріальним ЛПЦ
макрофаги посилюють експресію ФНП-рецепторів і секретують ФНП-α, який забезпечує
аутокринний сигнал для запуску процесу утворення NO. Аналогічного ефекту на макрофагах
людини можна досягти лише за умови стимуляції їх, як правило, кількома цитокінами з одночасним
перехресним зшиванням експресованих на їхній поверхні FcεRII рецепторів (CD23).
Завдяки підсиленню антимікробних механізмів активовані макрофаги набувають здатності
ефективно знищувати внутрішньоклітинні (або недавно фагоцитовані зовнішньоклітинні) патогени,
які не знищуються неактивованими макрофагами. В активованих макрофагах відбуваються також
зміни, які допомагають посилити імунну відповідь залученням нових Тх1-клітин, — підвищення
експресії костимуляторних молекул та секреції цитокінів. Так, завдяки збільшенню експресії
молекул МНС II, CD40 та CD86 (В7.2) макрофаги набувають здатності ефективніше презентувати
антиген, сприймати та індукувати костимуляторні сигнали, сприяючи таким чином активації інших
наївних CD4Т-клітин. Секреція активованими макрофагами ІЛ-12 може спрямовувати
диференціювання первинно активованих CD4Т-клітин у бік Тх1-клітин.
Регуляція активації макрофагів. Індукована розпізнаванням антигену секреція ІФН-γ та експресія
CD40L відбуваються поляризовано — в точці контакту мембран Тх1-клітини і макрофага. Завдяки
такій сфокусованій секреції ІФН-γ активується саме той макрофаг, що презентує антиген Тх1-
клітині, тоді як сусідні, неінфіковані клітини, як правило, не активуються, незважаючи та те що
рецептори до ІФН-γ мають усі макрофаги.
Однак висока концентрація ІФН-γ може зумовити активацію не лише інфікованих, а й
неінфікованих макрофагів. Гіперсекреція ІФН-γ та надмірна активація макрофагів має потенційну
небезпеку ушкодження тканин, оскільки самі інфіковані клітини інших типів (наприклад, при
туберкульозі легень) можуть вбиватися Т-клітинами. Виражені локальні ушкодження тканин, як
правило, супроводжують реакції ГСТ на патогени великих розмірів наприклад на паразитичні
черв'яки, яких макрофаги не спроможні фагоцитувати. Для знищення цих патогенів активовані
макрофаги виділяють назовні активні субстанції (вони зазвичай діють під час руйнування
внутрішньоклітинних патогенів), які є токсичними і для клітин хазяїна.
Для уникнення або принаймні для зменшення небажаних руйнівних ефектів на нормальні тканини
активація макрофагів Тх1-клітинами має чітко регулюватися. Для мінімізації деструктивних
процесів у осередку ГСТ спрацьовують механізми регуляції активації макрофагів, насамперед
механізми контролю синтезу та дії ІФН-γ.
Обмеження періоду синтезу ІФН-γ може бути досягнуто скороченням періоду напіврозпаду мРНК,
що кодує ІФН-γ та інші цитокіни, внаслідок наявності на 3-кінці послідовності (АУУУА)n, що не
транслюється, та руйнуванням цитокінової мРНК унаслідок активації Т-клітин для продукування
іншого білка. Отже, швидке руйнування цитокінової мРНК разом зі сфокусованим
транспортуванням ІФН-γ в точку контакту між клітинами, що взаємодіють, лімітує дію Тх1-клітини
на інфікований макрофаг і унеможливлює активацію сусідніх клітин.
Крім того, самоактивація макрофагів за аутокринним механізмом (секретованими ними самими
ІФН-γ і ФНП-α) може пригнічуватися такими цитокінами, як ТФР-β, ІЛ-4, ІЛ-10, ІЛ-13. Оскільки
більшість цих цитокінів продукуються Тх2-клітинами, (які, до речі, разом з Tx1-клітинами
виявляються в гранульомах при туберкульозі та інших хронічних інфекціях), то індукування цього
типу хелперних клітин вірогідно є важливим метаболічним шляхом, що регулює активність Тх1-
клітин і контролює ефекторні функції активованих макрофагів.
Відомо, що в активації макрофагів і регуляції співвідношення Тх1-/Тх2-клітин у людини бере участь
кальцитріол (1,25-дигідроксикальциферол), який утворюється з неактивної його форми (25-
гідроксихолекальциферолу) за участю ферменту 1-α-гідроксилази, що експресується
стимульованими ІФН-γ макрофагами. Закріплюючись на відповідних рецепторах, кальцитріол
додатково стимулює вже активовані ІФН-γ макрофаги і одночасно за механізмом зворотної
негативної регуляції різко пригнічує Тх1-клітини. З'ясовано, що кальцитріол утворюється у значних
кількостях у хворих на туберкульоз та саркоїдоз.
Існує також негативна регуляція ефекторних функцій макрофагів. Показано, що вже активовані
макрофаги можуть бути дезактивовані. Здатністю відмінити індуковане ІФН-γ підвищення
утворення макрофагами високоактивних радикалів кисню і частково оксиду нітрогену (II)
характеризується фактор, виділений із середовища, в якому культивувалися пухлинні клітини, і з
урахуванням його біологічної дії названий дезактивуючим макрофаги фактором (MDF, від англ.
тасrophage deactivating factor). Таку саму активність — здатність пригнічувати функції макрофагів
— виявлено у ІЛ-4, ТФР-β-подібних цитокінів, а також пептиду, зв'язаного з геном кальцитоніну.
Координування Tx1-клітинами імунної відповіді на внутрішньоклітинні патогени. Активовані
Тх1-клітини крім ІФН-γ секретують інші цитокіни, які без посередньо участі в активації макрофагів
не беруть, але відіграють важливу роль у координуванні імунної відповіді на внутрішньоклітинні
патогени та підвищенні її ефективності. При цьому підвищення ефективності імунної відповіді
досягаєть ся різними способами.
Одні цитокіни сприяють збільшенню кількості клітин, що беруть участь в імунній відповіді: ІЛ-2
індукує проліферацію Т-клітин, а гемопоетичні фактори росту ІЛ-3 та ГМ-КСФ стимулюють
утворення нових макрофагів, діючи на СКК в кістковому мозку. Інші цитокіни акумулюють
макрофаги в осередку інфекції ФНП-α і ФНП-β індукують експресію на васкулярному ендотелії
адгезивних молекул, що зумовлює прилипання до нього макрофагів (моноцитів), а макрофагальний
хемотаксичний фактор сприяє міграції їх із кров'яного русла в тканину.
Слід зазначити, що хронічно інфіковані макрофаги під впливом локалізованих усередині
фаголізосом бактерій можуть втрачати здатність до активації. В таких випадках Тх1-клітини можуть
вбивати ці макрофаги внаслідок індукування апоптозу через взаємодію Fas-ліганду з експресованою
на їх поверхні Fas-молекулою. Біологічний сенс цього явища полягає в тому, щоб забезпечити вихід
патогенів з клітини в позаклітинний простір і створити умови для залучення до боротьби з ними
функціонально повноцінні ефекторні клітини. До вбивства хронічно інфікованих макрофагів (та
інших типів клітин) можуть залучатися і Т-кілери, як це відбувається під час туберкульозної
інфекції.
Звільнені з інфікованих макрофагів, що були вбиті CD4 і CD8T-клітинами, патогени можуть бути
захоплені іншими макрофагами, які ще здатні активуватися й знищувати бактерії. Крім того, є дані,
що активовані CD8Т-клітини спроможні безпосередньо вбивати локалізовані у макрофагах
мікобактерії туберкульозу. Відповідальним за кілінг (вбивство) бактерій є гранулізин, що міститься
в секретованих ЦТЛ літичних гранулах.
Значний селективний тиск, що виникає внаслідок взаємодії мікобактерій з хазяїном, потребує
залучення до захисту різних субпопуляцій Т-клітин для інтенсифікації імунної відповіді. Крім
традиційних МНС-рестриктованих CD8Т-клітин, що стимулюються мікобактеріальними пептидами,
в імунній відповіді проти М. tuberculosis беруть участь і нетрадиційні (мінорні) Т-клітини, що
стимулюються різними компонентами небілкової природи, на які багата клітинна стінка цих
бактерій. Ці субпопуляції Т-клітин після стимуляції продукують ІФН-γ та виявляють цитолітичну
активність і, ймовірно, можуть відігравати важливу роль у відповіді на М. tuberculosis. У людини це
CD8Т-клітини, рестриктовані за некласичними молекулами HLA, які розпізнають наявні у клітинній
стінці мікобактерій гліколіпіди (фосфатидилінозитолманозиди, ліпоарабіноманани, міколові
кислоти, гексозил-1-фосфоізопреноїди), презентовані молекулами CD1, та нерестриктовані Тγδ, які
стимулюються небілковими антигенами, що містять фосфат (фенілпірофосфати, нуклеотидні
кон'югати). Оскільки ці Тγδ, що експресують V-2-2 комбінацію ланцюгів, становлять майже 5 %
усіх Т-клітин периферичної крові дорослої людини і після стимуляції продукують ІФН-γ та
виявляють мікобактерицидну активність, то вважають, що вони можуть виконувати роль першої
ланки захисту при туберкульозі. Показано, що у мишей Тγδ захищають організм від високої
інфікуючої дози мікобактерій туберкульозу і беруть участь у формуванні гранульом.
Ізоляція патогенів у гранульомах. Активовані макрофаги можуть контролювати ріст
внутрішньоклітинних патогенів, однак повне їх знищення досягається рідко. Якщо мікроорганізми
ефективно протистоять впливу активованих макрофагів і не знищуються ними, інфекція набуває
хронічного перебігу з розвитком запального процесу. В місці локалізації збудника формується
гранульома — морфологічна структура зі скупчень клітин, яка є наслідком імунного запалення. При
хронічних реакціях ГСТ в утворенні гранульом провідна роль належить не міграції клітин, а
проліферативним процесам. У центрі гранульом зосереджуються збудник, інфіковані макрофаги і
похідні макрофагів: багатоядерні гігантські клітини (злиті макрофаги) та епітеліоїдні клітини
(сплощені макрофаги великих розмірів). Припускають, що ці змінені морфологічні форми
з'являються внаслідок хронічної стимуляції макрофагів цитокінами і належать до секреторних, а не
до фагоцитарних клітин. Клітини макрофагального ряду оточуються Т-лімфоцитами з
переважанням CD4Т-клітин та клітинами інших типів (залежно від природи збудника). При деяких
інфекціях, наприклад туберкульозі, в центрі гранульоми (туберкули) утворюється зона некрозу, яка
виникає внаслідок цитотоксичних ефектів макрофагів, руйнування самих макрофагів Т-кілерами,
накопичення токсичних метаболітів, трофічної недостатності. Оскільки в зоні некрозу міститься
детрит, то цей процес назвали казеозним («сирнистим») некрозом.
Мікроби можуть тривало виживати в гранульомах, змінюючи свій метаболізм (переключатися на
катаболізм ліпідів та азотисте дихання). Фактично гранульоми утворюються для ізоляції тих
патогенів, які не можуть бути знищені та еліміновані. Важливу роль при цьому відіграють цитокіни
ФНП-α і ФНП-β, які беруть участь у запаленні, регулюючи формування та підтримання структурної
цілісності гранульом. Роль ФНП-α в обмеженні поширення М.tuberculosis у тканинах людини
підтверджується зростанням ризику реактивації туберкульозу в осіб, яким проводилася анти-ФНП-
α-терапія, зокрема у хворих на ревматоїдний артрит.
Індуковані активованими Тх1-клітинами ефекторні механізми зумовлюють затримку поширення
мікробів з малих гранулематозних уражень у тканині, але такий ефект не завжди є довготривалим.
За певних умов бар'єрна функція гранульоми може порушуватися, що сприяє поширенню мікробів у
тканині. Постійна стимуляція макрофагів, активованих антигенами персистувального патогенного
агента, і виділення ними високоактивних метаболітів кисню та ферментів гідролаз може призвести
до ушкодження тканин. Вважають, що після вакцинації БЦЖ або первинного інфікування
М.tuberculosis активація Tx1-клітин є оптимальною. Впродовж первинної туберкульозної інфекції
здебільшого розвивається динамічний баланс між персистенцією бактерій та захистом хазяїна, який
може підтримуватися впродовж усього життя. В гранульомах у зоні некрозу мікобактерії гинуть, що
зумовлено нестачею кисню, факторів живлення (насамперед заліза), сильним закисленням
середовища. В зв'язку з різким зменшенням збудника запальна реакція припиняється. Туберкула
вкривається сполучнотканинною капсулою (внаслідок розмноження активованих фібробластів),
рубцюється і нерідко звапнюється. Точні механізми, завдяки яким цей баланс досягається, і як він
порушується під час розвитку виявленої клінічно форми захворювання, нині ще не з'ясовано. В
умовах надмірної активації Тх1-клітин та секреції запальних цитокінів деструктивні процеси
набувають прогресивного розвитку, казеозна маса в гранульомах руйнується під дією
протеолітичних ферментів макрофагів. Створюються сприятливі умови для розмноження
мікобактерій, і кількість їх у казеозному детриті різко збільшується. Якщо утворені в легенях
некротичні порожнини охоплюють альвеоли, хворі стають джерелом збудника інфекції і становлять
небезпеку для оточуючих, а якщо збудник проникає в кров, створюються умови для генералізації
інфекційного процесу.
Отже, гіперчутливість сповільненого типу, основою якої є активація макрофагів Тх1-клітинами, —
це такий вид імунної реактивності, який має як позитивні, так і шкідливі для організму риси.
Подібно до інших імунних реакцій реакція ГСТ спрямована на захист організму, однак у зв'язку з
участю в ній факторів запального характеру вона нерідко є патологічним компонентом у розвитку
локальних інфекційних процесів. Захисний чи патогенетичний ефект реакції ГСТ визначається
ступенем сенсибілізації організму. В умовах помірної сенсибілізації внаслідок розвитку реакції ГСТ
створюється бар'єр, який забезпечує локалізацію збудника і протидіє його поширенню в організмі. У
разі надмірно високої сенсибілізації реакції ГСТ супроводжуються ушкодженням тканин.
Деструктивні процеси в тканинах, що супроводжують гранулематозну реакцію, зумовлюються не
прямою дією бактерій, а опосередковуються імунними механізмами.
11.3. ГУМОРАЛЬНА ІМУННА ВІДПОВІДЬ.
Гуморальну ланку адаптивної імунної відповіді опосередковують антитіла, які є головними
розчинними захисними факторами організму. Зумовлений антитілами імунітет називають
гуморальним, а процес активації В-клітин і синтезу специфічних імуноґлобулінів — гуморальною
імунною відповіддю.
Антитіла здатні зв'язувати антиген, запобігаючи його поширенню в організмі, нейтралізувати
біологічну активність токсинів та запобігати прикріпленню патогенів до рецепторів клітин-мішеней.
Ці функції антитіла здатні реалізовувати самостійно. Інші функції антитіл пов'язані із залученням
додаткових ефекторних механізмів імунітету. Крім того, антитіла можуть виконувати важливі
функції в регуляції імунної відповіді, процесу запалення тощо.
Виконання різних функцій антитіл пов'язане з різними структурними частинами їхніх молекул:
активні центри антитіл відповідають за специфічне розпізнавання антигену, а Fc-фрагмент — за
реалізацію ефекторних реакцій.
Вчення про гуморальний імунітет сформувалося ще на початку XX ст. В 1904 р. П. Ерліх
сформулював гуморальну теорію імунітету, згідно з якою у відповідь на потрапляння антигену
з'являються розчинні фактори, які специфічно взаємодіють з антигеном і нейтралізують його
біологічну дію. За П. Ерліхом, основою походження специфічності антитіл є селекція антигеном
саме тих рецепторів на поверхні антитілоутворювальних клітин, які здатні специфічно зв'язатися з
ним. Ця теорія (що дістала назву «теорії бічних ланцюгів») добре співвідноситься з сучасними
уявленнями про механізми утворення специфічності антитіл, за винятком того, що антиген
селекціонує не окремі рецептори на одній клітині, а цілі клітини, кожна з яких має однакові
антигенспецифічні рецептори.
Таку поправку до теорії П. Ерліха зробив у 1959 р. Ф. Бернет, який передбачав, що кожний
лімфоцит може продукувати антитіла лише однієї специфічності, і це є генетичне запрограмованим
процесом. В організмі знаходяться мільйони різних наївних лімфоцитів, які потенційно здатні
розпізнавати будь-який антиген. Під час стимуляції наївних лімфоцитів антигеном, до якого вони
специфічні, утворюється клон клітин, що несуть антитіла тієї самої специфічності, яку мав їхній
попередник. Така експансія активованих антигеном клонів лімфоцитів зумовлює формування
специфічного імунітету. Цю теорію Бернета назвали «клонально-селекційною теорією». На теорії
Бернета ґрунтується сучасне уявлення про природу виникнення специфічних імунних реакцій не
лише гуморального, а й клітинного типу, тобто антигеном селекціонуються не тільки клони
специфічних В-лімфоцитів, а й клони специфічних Т-клітин.
У сучасному сприйнятті теорія Бернета має одне істотне доповнення. Як з'ясувалося, не всі клітини
клону В-лімфоцитів, що утворилися від однієї клітини-попередника, мають однакову афінність
рецепторів. У процесі антигензалежної проліферації та диференціювання афінність
імуноґлобулінових рецепторів може зростати і ставати більшою, ніж була у попередника клону. Цей
процес характерний лише для В-клітин, в яких відбувається переключення класів імуноґлобулінів з
IgM на інші ізотипи.
Популяція В-лімфоцитів неоднорідна і поділяється на В1- і В2-субпопуляції, які різняться за
морфологічними маркерами (див. розд. 1) та за умовами активації й особливостями синтезу антитіл.
В1-клітини відповідають на Т-незалежні, а В2-клітини — на Т-залежні антигени (див. розд. 3). В2-
клітини активуються Т-хелперами і для перетворення на АУК потребують когнатної взаємодії з
ними, тоді як В1-клітини активуються безпосередньо антигенами (деякими мікробними
субстанціями) і допомоги Т-хелперів не потребують.
Умови активації В1-клітин ще недостатньо вивчені. Вважають, що антиген має надавати такій В-
клітині мітогенний сигнал, як, наприклад, це робить ЛПЦ (Т-незалежний антиген першого типу),
або мітогенний сигнал у вигляді розчинних цитокінів можуть забезпечувати деякі типи АПК, тоді як
сам антиген перехресно зв'яже велику кількість рецепторів В-лімфоцитів завдяки своїй
полівалентності (Т-незалежні антигени другого типу, такі як капсульні поліцукриди бактерій,
декстрани тощо).
Відповідь на Т-незалежні антигени, як правило, не супроводжується формуванням клітин «пам'яті»
та підвищенням афінності рецепторів. Отже, гуморальну відповідь на Т-незалежні антигени можна
розглядати як прояв реакцій неспецифічного захисту. Тому розглянемо процеси під час гуморальної
імунної відповіді лише на Т-залежні антигени, основою якої є активація В2-клітин.
Розпізнавання антигену В-лімфоцитами. Наївні В-лімфоцити, що утворилися в кістковому мозку
і мігрували з нього на периферію, локалізуються в В-зонах периферичних лімфоїдних органів, де
утворюють первинні фолікули (див. розд. 12). В-лімфоцити, що експресують хемокіновий рецептор
CCR7, можуть заселяти також Т-зони.
Наївні В-лімфоцити розпізнають антиген за допомогою своїх рецепторів, які представлені
антитілами класу М. Після зв'язування з рецептором В-лімфоцит поглинає антиген і представляє
його пептидні фрагменти в комплексі з МНС класу II. Однак такий В-лімфоцит не може активувати
наївні Т-хелпери, оскільки в нього невисокий рівень експресії молекул В7.1(В7.2), необхідних для
надання Т-клітині костимуляторного сигналу. Лімфоцит у такому стані пасивно представляє
антиген, чекаючи на допомогу активованого Т-хелпера, з яким він зможе взаємодіяти.
Постає питання, де наївні В-лімфоцити зустрічаються з антигеном?
В-клітини, які локалізовані у В-зонах лімфовузлів та селезінки, можуть поглинати антиген, який
буде пасивно транспортовано в ці органи. Причому В-клітини лімфовузлів можуть поглинати
нативний антиген, який потрапляє туди з течією аферентної лімфи, а В-клітини селезінки
«виловлюють» антиген, що циркулює в крові. Надалі можливі кілька варіантів перебігу подій.
Локалізовані у В-зонах В-лімфоцити, які поглинули антиген, виходять із цих зон і прямують у Т-
клітинні зони, де активуються відповідними Т-хелперами. Активовані В-лімфоцити повертаються у
В-зони, де утворюють зародкові центри, внаслідок чого первинний фолікул стає вторинним.
Можливо, що деякі В-лімфоцити після поглинання антигену залишаються у В-зонах, процесують і
представляють антиген, виділяють певні цитокіни, які приваблюють до них активовані Т-хелпери з
Т-зон. Якщо Т-клітини знайдуть і активують відповідні В-лімфоцити у В-зонах, то в первинному
фолікулі утворюється зародковий центр і первинний фолікул стає вторинним.
З антигеном можуть взаємодіяти також В-лімфоцити, які поселилися в Т-зонах лімфовузлів. Такі В-
лімфоцити можуть безпосередньо взаємодіяти з Т-клітинами в місці зустрічі з антигеном, а потім
емігрувати в В-зону й утворювати зародкові центри.
Можливо, що з деякими полімерними антигенами В-клітини можуть взаємодіяти під час вільної
циркуляції в крові, але навряд чи кров є головним місцем зустрічі переважної більшості антигенів з
В-лімфоцитами.
Події, пов'язані з розпізнаванням антигену, по-іншому розвиваються в слизових. Наївні В-
лімфоцити, які заселяють лімфоїдну систему слизових, зустрічаються з антигеном також у місці
своєї локалізації. Далі вони поглинають антиген і мігрують у Т-зони слизових або найближчих
мезентеріальних лімфовузлів. Після активації вони мігрують у В-зони, де утворюють зародкові
центри, проліферуютьв і диференціюються, а потім повертаються у формі плазмобластів у lamina
proprіа слизових.
Активація В-клітин активованими хелперами. Слід зазначити, що в будь-якому випадку після
первинної взаємодії з антигеном В-клітина потрапляє в таку зону вторинних лімфоїдних органів, де
можливий контакт з активованими T-хелперами. Т-хелпери активують лише ті В-клітини, які
представили їм пептидні фрагменти антигену на своїй поверхні у комплексі з МНС II. З'ясувалося,
що В- і Т-клітини, які кооперуються під час гуморальної імунної відповіді, розпізнають на молекулі
антигену різні ділянки (В- і Т-епітопи), але не одночасно, а послідовно. Спочатку В-клітини
розпізнають В-епітопи антигену, потім поглинають його, вилучають із білкової частини антигену
антигенні пептиди, презентують їх на своїй поверхні з МНС ІІ, а потім Т-хелпери розпізнають Т-
епітопи, якими і є антигенні пептиди, представлені з МНС ІІ.
Розпізнавання Т-епітопів, зв'язаних із МНС II на поверхні В-клітин, призводить до контактної
взаємодії мембран Т- і В-клітин. Внаслідок такої взаємодії Т-хелпери активують В-лімфоцити за
допомогою мембранозв'язаних і секреторних костимуляторних молекул. Активація В-клітин за
допомогою Т-хелперів потребує встановлення численних контактів між відповідними парами
рецепторів та їхніми лігандами на поверхні двох клітин. Деякі відомі ліганд-рецепторні пари, що
беруть участь у взаємодії Т- і В-клітин, наведено в табл. 52. Кінцевий результат такої взаємодії
залежить від сигналів, які отримує В-клітина. Для утворення В-клітин, здатних формувати зародкові
центри, необхідно, щоб антиген перехресно зв'язав імуноґлобулінові рецептори, а Т-хелпер надав
ліганд CD154(CD40L) для зв'язування з СD40-рецептором В-лімфоцита.

50
За первинної імунної відповіді спочатку ДК активують Т-хелпери, а активовані Т-хелпери (Тх2), у
свою чергу, активують В2-лімфоцити. Після активації В-лімфоцити набувають здатності активувати
наївні Т-хелпери завдяки індукованій експресії на них костимуляторних молекул В7.1 (В7.2). Тому
виникає позитивний зворотний зв'язок в імунній відповіді, що призводить до різкого збільшення
числа активованих лімфоцитів. За вторинної імунної відповіді активація Т-хелперів може
відбуватися також на активованих В-клітинах пам'яті.
Активовані Т-хелпером В-клітини проліферують і диференціюються на плазматичні клітини
(плазмоцити), які виконують функцію продукування антитіл.
Проліферація В-клітин і диференціювання їх на плазматичні клітини. Для того щоб виконати
функцію продуцентів антитіл, активовані В-лімфоцити мають пройти багатостадійний процес
диференціювання в умовах різного мікрооточення. Кінцевою стадією диференціювання
активованих В-лімфоцитів є плазматичні клітини — продуценти антитіл. Слід зазначити, що не всі
наївні В-лімфоцити досягають цієї стадії. Якщо В-лімфоцит тривалий час не зустрічається зі
специфічним антигеном, він може загинути внаслідок апоптозу. Стимульована антигеном В-клітина
проходить 7 — 8 клітинних циклів перед тим, як стане плазматичною клітиною. Тому від однієї В-
клітини потенційно може утворитися клон із 128 — 256 плазмоцитів, які будуть синтезувати
антитіла тієї самої або більшої афінності, ніж мав імуноґлобуліновий рецептор наївних В-клітин.
При цьому може змінитися клас і підклас імуноґлобулінів, що секретуються. Морфологічні
особливості плазматичних клітин описано в розд. 1.
За класом антитіл, що синтезуються, плазматичні клітини поділяють на IgM-синтезувальні
плазматичні клітини та плазматичні клітини, що синтезують усі інші класи імуноґлобулінів, які
різняться диференціюванням їхніх попередників. Для утворення IgM-синтезувальних плазматичних
клітин формування зародкових центрів не потрібно. Ці клітини в своєму розвитку не проходять
етапи підвищення афінності рецепторів та соматичного мутагенезу, їх розмноження здійснюється у
«первинних фокусах» Т-зон, звідки вони мігрують безпосередньо у медулярні тяжі, де і
відбуваються процеси антитілогенезу. Утворення IgM є дуже важливим для подальшого перебігу
імунної відповіді, оскільки IgM дає змогу концентрувати антиген на поверхні ФДК за первинної
імунної відповіді, що є необхідною умовою для повноцінного розвитку зародкових центрів.
Плазматичні клітини, що синтезують усі інші ізотипи імуноґлобулінів, утворюються з В-лімфоцитів
у зародкових центрах вторинних лімфоїдних фолікулів. У своєму розвитку такі В-клітини зазнають
більше поділів, ніж В-клітини — попередники IgM-синтезувальних клітин, і потребують більше
часу для остаточного диференціювання. Тому первинна імунна відповідь за участю IgG- або IgA-
антитіл, розвивається повільніше, але сформовані в зародкових центрах плазматичні клітини
можуть продукувати антитіла з підвищеною афінністю до антигену, що зумовлено процесами
дозрівання афінності рецепторів під час розвитку цих клітин.
Утворення зародкових центрів. В-клітини можна поділити, як уже зазначалося, на такі
функціональні субпопуляції: наївні В1- (IgM
+
CD5
+
CD38-CD23-) і В2-клітини (IgM
+
CD5-CD38-
CD23
+
), які потенційно здатні реагувати відповідно на тимуснезалежні та тимусзалежні антигени.
Крім того, серед В-клітин виокремлюють клітини, здатні безпосередньо перетворюватися на
плазматичні клітини та клітини, які можуть формувати зародкові центри, де відбуваються процеси,
пов'язані зі збільшенням афінності та переключенням ізотипу імуноґлобулінів. Популяцію В2-
клітин, що утворюють зародкові центри, іноді називають В2'- клітинами. Для плазматичних клітин,
що є нащадками В2'- клітин, характерна висока кількість мутацій у V-генах легких і важких
ланцюгів.
Розпізнавання антигену В-лімфоцитом і взаємодія з активованим Т-хелпером – це перша
(індуктивна) фаза гуморальної імунної відповіді. Друга фаза первинної гуморальної відповіді
починається тоді коли активовані В-клітини мігрують у первинні фолікули, де проліферують і
утворюють зародкові центри. Зародкові центри утворюють переважно ті В-лімфоцити, які після
взаємодії з Т-хелпером можуть експресувати мембранні імуноґлобуліни IgD.
Зародкові центри формуються активованими В-лімфоцитами навколо ФДК, що знаходяться у
первинних фолікулах В-зон. ФДК експонують на своїй поверхні нативний антиген у формі імунних
комплексів і надають В-клітинам сигнали, необхідні для виживання.
Міграції активованих В-клітин у первинні фолікули сприяє хемокін BLC, який взаємодіє з
хемокіновим рецептором СХСR5 В-лімфоцитів. Деякі Т-хелпери після активації починають
експресувати рецептор CXCR5, внаслідок чого вони також мігрують до фолікулів. Такі Т-клітини
називають фолікулярними Т-хелперами (Тхф).
У зародкових центрах локалізуються також ІДК, що активують тут Т-хелпери, які, можливо,
входять у зародкові центри і підтримують антигензалежну проліферацію В-лімфоцитів.
Морфологічно зародковий центр поділяють на базальну (нижню) та апікальну (верхню) частини
(мал. 85). У базальній частині відбувається
проліферація В-клітин та відбір репертуару
їхніх рецепторів, а в апікальній частині
збираються перед виходом уже зрілі
плазматичні клітини і клітини пам'яті.
Базальна частина має світлу і темну зони.
Зовні зародковий центр укритий мантією,
що складається з В-клітин пам'яті і
плазмобластів. Навколо мантії розміщені
Т-лімфоцити, які продукують цитокіни,
необхідні для диференціювання В-клітин.
В-клітини зародкових центрів гістологічно
можна розподілити на центроцити (sІgD-
CD38
+
CD77-) і центробласти (sIgD-
CD38
+
CD77
+
). У центроцитах відбуваються
процеси переключення ізотипів антитіл, а в
центробластах активуються процеси
соматичного гіпермутагенезу. Центроцити
розміщені переважно у світлій зоні
зародкових центрів, тоді як центробласти,
які активно проліферують, — у темній зоні.
У світлій зоні розміщені також ФДК, які
забезпечують процес відбору центроцитів.
У темній і світлій зонах відбуваються не
лише процеси проліферації й відбору, а й
активної апоптичної загибелі клітин, що не
здатні розпізнати антиген, представлений
на ФДК. Апоптичні тільця фагоцитуються
розміщеними тут макрофагами.
У зародкових центрах здійснюється активна проліферація В-клітин, під час якої відбуваються
соматичні гіпермутації у V-генах імуноглобулінів та відбираються В-клітини з підвищеною
афінністю рецепторів до антигену. Крім того, в зародкових центрах відбуваються процеси
переключення константних ділянок важких ланцюгів антитіл, що призводить до зміни ізотипу
антитіл, які продукуються.
Переключення синтезу антитіл різних класів. Плазматичні клітини синтезують тільки один
певний клас антитіл. Причому переключення ізотипів імуноглобулінів відбувається під час
диференціювання активованих В-лімфоцитів у плазматичні клітини. Активацію наївних В-клітин,
що експресують лише мембранні IgM-peцептори, можуть зумовити тільки Тх2. Експресія IgD на
поверхні В-клітин індукується, коли активований В-лімфоцит знаходиться ще в Т-зоні лімфовузла.
Переключення інших ізотипів антитіл відбувається переважно в зародкових центрах після активації
В-клітин відповідними Т-хелперними сиґналами або безпосередньо після виходу плазмобластів із
фолікула.
Переключення ізотипу імуноглобулінів залежить від експресії CD40L молекули на хелперній Т-
клітині й спрямовується певними
цитокінами. Переключення ізотипів антитіл
залежить від наявності цитокінів, які
продукують не лише Тх2, а й Тх1 і Тх3.
Отже, в зародкові центри крім Тх2, можливо,
можуть проникати Т-хелпери інших
субпопуляцій або їхні розчинні продукти —
цитокіни. Вплив основних цитокінів на
синтез різних ізотипів антитіл наведено в
табл. 53.
Ізотип антитіл, які синтезує плазматична
клітина, залежить від способу проникнення
антигену та особливостей мікрооточення В-
клітини в лімфоїдному органі, наявності
цитокінів і генотипу організму.
Антитіла класу IgG синтезуються переважно
плазматичними клітинами, що утворилися в
селезінці й функціонують у кістковому мозку, а антитіла класів IgA та IgE — плазматичними
клітинами у слизових. Важливо, що в слизові мігрують В-лімфоцити, які пройшли певний розвиток
у зародкових центрах, але ще не повністю диференціювалися на плазматичні клітини. Ймовірно,
такі плазмобласти можуть змінювати ізотип синтезованих антитіл саме під дією локального
мікрооточення в MALT. Переключення синтезу антитіл на IgA відбувається під дією ТФР-β, який
виділяють Тх3, а переключення на IgE — під дією ІЛ-4 та ІЛ-5, що можуть секретуватися Тх2, Тх3
та мастоцитами.
Збільшення афінності рецепторів. Майже 40 років минуло з того часу, коли Eisen та Siskind
уперше повідомили про феномен дозрівання афінності імунних рецепторів, який можна розглядати,
по-перше, як збільшення афінності рецепторів В-клітин під час перебігу імунної відповіді і, по-
друге, як збільшену афінність рецепторів клітин пам'яті порівняно з середньою афінністю
ефекторних клітин, що брали участь у первинній імунній відповіді.
Виявилося, що процеси дозрівання афінності відбуваються під час утворення плазматичних клітин
та клітин пам'яті у зародкових центрах. Основою цього явища є два процеси — соматичний
гіпермутагенез і відбір, які відбуваються у різних зонах лімфоїдного фолікула зародкового центру.
У темній зоні центробласти активно проліферують, при цьому в їхніх V-генах активуються процеси
соматичного гіпермутагенезу. Частота соматичних гіпермутацій досягає 2 %, що на 6 — 8 порядків
вище, ніж частота спонтанного соматичного мутагенезу. Гіпермутації відбуваються переважно в
гіперваріабельних ділянках, що кодують CDR-райони антитіл. Унаслідок цих процесів можуть
з'являтися В-клітини, які мають як підвищену, так і знижену афінність до антигену.
Наступний процес — відбір утворених центробластів за здатністю зв'язувати антиген. Відбір
відбувається на ФДК, розміщених у світлій зоні зародкового центру. Центробласти стають
центроцитами і намагаються зв'язати антиген, фіксований на поверхні ФДК. Після зв'язування з
антигеном В-клітини отримують від ФДК «дозвіл» на виживання, який полягає у збільшенні в
клітинах антиапоптичного фактора bcl-2. Вважають, що сиґнал для виживання В-клітина отримує
від корецептора CD21, який зв'язується з певним лігандом на поверхні ФДК. У міру розвитку
імунної відповіді кількість В-клітин у зародковому центрі збільшується, а отже, між центроцитами
виникає конкуренція за зв'язування з антигеном. Тілльки ті В-клітини, що мають найбільшу
афінність рецепторів до антигену, зможуть зв'язатися з поверхнею ФДК і продовжити
диференціювання на плазмобласти, а всі інші В-клітини гинуть унаслідок апоптозу або
повертаються для подальшого розмноження в темну зону, де накопичують нові мутації в активних
центрах своїх рецепторів. Плазмобласти, які мають підвищений рівень експресії bcl-2, емігрують з
вторинного лімфоїдного фолікула, заселяють місця в лімфоїдній тканині, в яких вони
диференціюються на плазмоцити.
Стадії диференціювання плазматичних клітин. У зародкових центрах формуються плазмобласти,
плазматичні клітини та клітини пам'яті. Плазматичні клітини розміщуються в лімфоїдній тканині у
місцях синтезу антитіл, а клітини пам'яті рециркулюють.
Перші стадії диференціювання В-клітин під дією антигенного стимулу відбуваються в зародкових
центрах лімфатичних фолікулів. Малі В-лімфоцити трансформуються на плазмоцити через стадію
великого лімфоцита. Плазматичні клітини проходять у своєму розвитку такі етапи: плазмобласт (15
— 20 мкм), юний плазмоцит (10—15 мкм) та зрілий плазмоцит (10—12 мкм). З реґіонарних
лімфатичних вузлів плазмобласти мігрують в інші лімфоїдні органи, де вони диференціюються на
плазматичні клітини, що забезпечує генералізацію імунної відповіді.
Мітотичний цикл плазмобластів триває 8—12 год. Після 3 — 6 поділів плазмобласт переходить у
стадію юного плазмоцита, а через 2 — 4 поділи, що відбуваються впродовж 18 — 24 год, юний
плазмоцит трансформується на зрілий плазмоцит, не здатний до проліферації. Отже, зрілі
плазмоцити утворюються через три доби після початку диференціювання В-клітини. Їх число
досягає максимуму на четверту-п'яту добу і через кілька діб починає зменшуватися.
Плазмоцити у лімфоїдній тканині формують певні клони, які утворюються в результаті проліферації
та диференціювання В-клітини-попередника. Важлива особливість клону — здатність продукувати
антитіла з однаковою специфічністю до певного антигену. Всі клітини клону успадковують цю
властивість від В-клітини-попередника. В умовах гіперімунізації число плазмоцитів з однаковою
специфічністю антитіл, як правило, становить 1 — 2 % загальної кількості лімфоцитів реґіонарного
лімфовузла. Клітини, що продукують один вид антитіл, розміщені клонами навколо однієї
ретикулярної клітини, що свідчить про походження цієї групи клітин від однієї клітини та
підтверджує клонально-селекційну теорію Бернета.
Зрілі плазматичні клітини вже не здатні до поділів і дуже стійкі до зовнішніх впливів. Так,
опромінення плазмоцитів дозами 10 Гр не впливає на синтез антитіл. Тривалість життя більшості
плазмоцитів не перевищує 48 год, і лише частина з них живе в організмі 6 міс. і більше. Однак
завдяки високій синтетичній активності (кожний плазмоцит синтезує (1,25...7,5)·10
13
молекул
антитіл) плазматичні клітини встигають виконати за цей досить короткий час детерміновану їхню
функцію як продуцентів антитіл. Специфічні антитіла виявляються в крові на третю —сьому добу
після першого контакту з антигеном а в разі повторних контактів — значно раніше.
Антитілогенез і функції антитіл. Головними місцями синтезу антитіл є медулярний тяж
лімфовузлів, кістковий мозок та lamina propria слизових. У кістковий мозок мігрують переважно
плазматичні клітини, що утворилися в селезінці, а в lamina propria — ті клітини, що утворилися в
мезентеріальних лімфовузлах або безпосередньо в MALT. Більша частина В-лімфоцитів, що
утворилися в лімфовузлах, здійснюють антитілопродукування в медулярному тяжі і лише 10 %,
ймовірно, емігрує до кісткового мозку.
Властивості й захисні функції антитіл різних класів докладно описано в розд. 4. Тому лише
нагадаємо основні способи елімінації антигенів антитілами та схарактеризуємо Fc-рецептори для
антитіл на різних клітинах імунної системи, за допомогою яких реалізуються ефекторні функції, що
зумовлюються антитілами.
Антитіла різних ізотипів мають різні функції. Наприклад, найбільшу кількість антитіл в організмі
становлять антитіла класу IgG та IgA, причому IgG здійснюють переважно захист внутрішнього
середовища організму, a IgA — захист слизових.
Транспортні білки, які зв'язують Fc-ділянки, здатні переносити імуноґлобуліни IgA та IgM крізь
епітелій. Цю функцію виконує полі-Ig рецептор (pІgR) епітеліальних клітин.
Високоафінні IgA і IgG сприяють нейтралізації бактеріальних токсинів та інгібують інфекційність
вірусів. Антитіла можуть блокувати здатність бактерій прикріплюватися до клітин хазяїна і
запобігати адгезії збудника на епітелії.
Комплекс антигенів з антитілами IgG та IgM може активувати класичний шлях активації
комплементу. Це призводить до лізису клітин-мішеней унаслідок формування МАК. Крім того,
елімінації антигену сприяє зв'язування з ним антитіл та утворення імунних комплексів, які
поглинаються фагоцитами. Цей процес підсилюється комплементом, оскільки фагоцитарні клітини
на своїй поверхні несуть рецептори до певних компонентів комплементу. Багато ефекторних
механізмів, які здійснюються за участю антитіл, залежать від Fc-рецепторів, що розпізнають
специфічно різні ізотипи імуноґлобулінів.
Роль Fc-рецепторів у реалізації ефекторних функцій антитіл. Fc-рецептори експресуються на
різних клітинах імунної системи. Зв'язуючи імунні комплекси (рідше — вільні антигени), Fc-
рецептори можуть сприяти реалізації ефекторних функцій клітинами, що їх утримують.
Для IgM відомий лише один рецептор FcμR, який знаходиться на моноцитах і деяких В-лімфоцитах.
На моноцитах він активує фагоцитоз комплексів IgM з антигеном, а на В-лімфоцитах — стимулює
антитілогенез.
Відомо три типи рецепторів для IgG: FcγRI(CD64), FcγRII(CD32) та FcγRIII (CD16), які мають
кілька ізоформ. Ці рецептори підсилюють фагоцитоз та зумовлюють АЗКЦ. Рецептор FcγRII може
бути гальмівним рецептором В-лімфоцитів, тобто зв'язування імунних комплексів цими
рецепторами може блокувати активацію В-клітин. FcγRII наявний також на ФДК, де він здатний
зв'язувати імунні комплекси, але не зумовлює їх ендоцитоз.
Рецептор для IgA — FcαR здатний активувати фагоцитоз, якщо зв'яжеться з мономерним
сироватковим IgA. Поліімуноґлобуліновий рецептор pІgR здатниі зв'язуватися з димерним IgA та
пентамерним IgM, що зумовлює трансцитоз цих молекул через епітелій слизових.
Існують два типи рецепторів до IgE високоафінний FcεRI та низькоафінни FcεRII. Рецептор FcεeRI
сприяє вивільненню медіаторів запалення мастоцитами і базофілами під час перехресного
зв'язування імунними комплексами IgE з антигеном. Рецептор FcεRII розміщений на поверхні
еозинофілів і моноцитів, завдяки чому він може стимулювати фагоцитоз опсонізованих IgE
патогенів.
Отже, експресовані на клітинах імунної системи Fc-рецептори, зв'язуючи комплекси антиген—
антитіло, можуть не лише підвищувати ефективність опосередкованих цими клітинами ефекторних
реакцій імунітету, а й регулювати імунні реакції.
11.4. РЕГУЛЯЦІЯ ІМУННИХ РЕАКЦІЙ. ПРИЗУПИНЕННЯ ІМУННОЇ ВІДПОВІДІ.
Завдяки механізмам, що забезпечують можливість постійної зміни клонів лімфоїдних клітин,
специфічних до того чи іншого антигену, зберігається постійна готовність лімфоїдної тканини
реагувати на будь-який новий антиген, що потрапляє до організму. Принцип зміни клонів
забезпечує адаптивність лімфоїдної системи, тобто змогу пристосовуватися до боротьби з різними
інфекційними агентами та порушеннями метаболізму власних клітин, зумовлених мутаціями.
Головний механізм, що призупиняє імунну відповідь, — загибель активованих лімфоцитів.
Тривалість життя більшості диференційованих ефекторних клітин дуже короткий — кілька діб.
Після цього вони гинуть унаслідок апоптозу. Цей тип загибелі клітин називають клітинною
смертю, що індукується активацією АІСD (від англ. activation induced cell death). Якщо в організмі
весь антиген буде еліміновано, то AICD призведе до того, що кількість лімфоцитів в організмі
зменшиться до нормального рівня й імунні реакції не відбуватимуться, оскільки нові лімфоцити не
будуть активуватися через відсутність антигенної стимуляції.
Крім того, в імунній системі важливу роль відіграють негативні зворотні зв'язки, які можна
розглядати як інгібування початкових етапів активації неактивованих клітин продуктами вже
активованих клітин тієї самої популяції. Так, відомо, що велика кількість IgG антитіл, специфічних
до певного антигену, призводить до гальмування активації В-клітин, специфічних до цього самого
антигену. Механізм такого гальмівного впливу полягає у перехресному зв'язуванні FcγRII та IgM-
peцепторів на поверхні В-клітини, що можливо лише за умови, коли FcγRII- зв'яже IgG тієї самої
специфічності, яку має IgM-рецептор. Молекулярні механізми цього процесу розглянуто у розд. 10.
Відомо, що активовані ЦТЛ експресують мембранну молекулу CTLA-4, яка є гальмівним
рецептором Т-клітин. CTLA-4, як і CD28, здатний зв'язуватися з В7.1 (В7.2) на АПК, але, на відміну
від CD28, проводить не активаційний, а гальмівний сигнал. Вважають, що за допомогою цієї
молекули ЦТЛ можуть інактивуватися на поверхні АПК, якщо активованих ЦТЛ буде дуже багато.
Крім того, CTLA-4 може продукуватися в розчинному вигляді та блокувати костимуляторні
молекули В7.1 (В7.2) на АПК, необхідні для активації наївних ЦТЛ.
Ще одним важливим механізмом регуляції імунної відповіді є те, що ряд цитокінів та мембранних
молекул ТНФ-родини (ТНФ, CD40L, FasL тощо) у великій концентрації призводять не до активації,
а до апоптичної загибелі імунних клітин.
Важлива імунорегуляторна роль належить Т-клітинам, що активувалися без достатньої
костимуляторної допомоги і тому зазнали стану анергії. Вважають, що такі анергізовані Т-клітини
можуть конкурувати з наївними Т-клітинами за АПК, і це призводить до втрати АПК своїх функцій
як активаторів цих клітин. Припускають, що в деяких випадках активовані ЦТЛ можуть вбивати
АПК, які їх активували, коли кількість активованих лімфоцитів значно перевищує кількість наївних.
Функцію супресорів імунної відповіді, які раніше виділяли в окрему популяцію Т-клітин, ймовірно,
можуть виконувати різні клітини залежно від типу імунної реактивності, яку вони гальмують. Так,
Тх1 виявляють супресорні властивості щодо Тх2, і навпаки. Крім того, ЦТЛ, що також поляризовані
за цитокіновим профілем, можуть інгібувати відповідні ланки імунної відповіді за аналогічним
механізмом.
Вважають, що найбільшу гальмівну активність щодо процесів розвитку імунної відповіді мають
АПК, що не здатні експресувати костимуляторні молекули В7.1(В7.2), але перебувають у стані
активації, тобто здатні до взаємодії з наївними Т-клітинами. Індукувати такі супресорні АПК можна
in vitro за допомогою Т-хелперів або ЦТЛ, які не мають молекули CD28. Отже, фенотип
супресорних Т-клітин може бути CD4
+
CD28- або CD8+CD28-. Чи відбувається така імунорегуляція
in vivo, належить ще з'ясувати.
Отже, розвиток імунної відповіді контролюється різними регуляторними механізмами,
спрямованими на його обмеження. Після видалення антигену ефекторні клітини елімінуються, але
залишаються клітини пам'яті, які здатні швидко поповнити кількість ефекторних клітин після
наступного потрапляння антигену.
11.5. КЛІТИНИ ПАМ'ЯТІ І ВТОРИННА ІМУННА ВІДПОВІДЬ.
Динаміка утворення антитіл за первинної і вторинної імунної відповіді значно різниться, що
пов'язано з різною динамікою утворення антитілоутворювальних клітин (АУК) з наївних В-клітин
та В-клітин пам'яті.
Під час первинної імунної відповіді утворюється відносно невелика кількість плазмоцитів, але їх
кількість значно збільшується під час наступних імунізацій. Наприклад, у процесі первинної
