Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.


162
Часть
1.
Основы
термодинамики
эмпирические
методы для расчета энтальпий (или энергий) образова-
ния
веществ. Подробное обсуждение этих методов выходит за рамки
настоящей
главы, тем не менее авторы сочли полезным дать краткое
описание
их сущности.
В первой модели, предложенной Фаянсом [406] в 1920 г., энергия
молекулы рассматривалась как сумма энергий составляющих свя-
зей.
Метод расчета, основанный на модели Фаянса, безусловно толь-
ко
грубое приближение, поскольку в действительности энергии
связи
не являются строго аддитивными и постоянными при перо-
ходе
от одной молекулы к другой, как это видно из табл. VI. 1. Tafj-
Таблица VI.1
Сравнение
схем
расчета
по
энергиям
связи
а
)
VI.
Приближенный
расчет
термодинамических
величин
163
Соединение
Гексан
2-Метилпентан
З-Метилпентан
2,2-Диметил-
бутан
2,3-Диметил-
бутан
По
методу
средних
энергий
связи
-41,89
—41,89
—41,89
—41,89
—41,89
д
+1,
+0,
+0,
2
-0,
93
23
87
46
60
Наблю-
даемое
значе-
ние
6
)
—39,96
—41,66
—41,02
-44,35
—42,49
д
0
0
+0,
+0,
+о,
00
00
01
01
03
По
схеме
Аллена,
улучшен-
ной
Скин-
нером
в
)
—39,96
—41,66
—41,03
—44,36
—42,52
а
)
В
таблице приведены теплоты образования соединений
в
газо-
образном состоянии
из
элементов
при 298° К,
выраженные
в ккал/моль.— Прим.
перев.
б
)
См.
главу
XIV.
в
)Скиннер
[1361].
лица
энергий связи, предложенная Полингом
[ИЗО],
составлена
в
предположении постоянства и аддитивности энергии связи в моле-
кулах.
Неприменимость
простых аддитивных схем для вычисления тер-
модинамических свойств различных классов органических соедине-
ний
обусловила поиски классификации типов связи. В методе Клд-
геса [765] вклады за счет связей суммируются по типам связей
в
молекуле. Этот метод был использован для оценки энергии резонанс-
ных колебаний. Уиланд ([1602], стр. 86) для этих целей предложи]
несколько
улучшенный вариант метода расчета по аддитивноп
схеме. Лейдлер [838] пытался объяснить энергии связи в парафи-
новых углеводородах на основе трех типов связи С — Ни одного
типа связи С — С. Татевский, Бендерский и Яровой
[1468]
в своих
расчетах использовали три типа связи С — Н и 10 типов связи С — С.
Глоклер [494—496], Фейлченфилд [414], Дьюар и Шмейсинг [326],
1ейкл и Охар [905, 907], Кокс [286] и Бернштейн [117] для опре-
деления энергии связей в алкенах и алкинах использовали ряд
кайденных ими соотношений между длиной и энергией связи в моле-
куле. Сомаяюлу [1394], подобно Фоксу и Мартину [437], применил
|ля
определения энергии связи в алкенах и алкинах соотношение
Сатерленда [1448], учитывающее энергию и длину связи, а также сило-
1ые постоянные молекулы. Другие авторы также использовали полу-
тширические методы расчета энергий связи. Так, в 1934 г. Цан
1641] отметил недостаточность предположения о простой аддитив-
ности
энергии связей и предложил
схему
расчета энергии образова-
1ия молекул из атомов, в которой наряду с энергиями связей исполь-
1уются энергии парных взаимодействий связей. Исследования Дьюа-
1а и Петтита [325] подтвердили модель Цана. Эта модель в дальней-
шем была положена в основу схемы расчета, предложенной Алленом
10].
В этой схеме учитывается взаимодействие каждой пары связей
1,4-С — С), расположенных
друг
относительно
друга
в скошенной
•онфигурации.
Скиннер
[1361]
уточнил метод оценки величины сте-
раческого отталкивания с помощью так называемого «механизма
азмыкания
угла».
Ряд
других
методов
учета
стерических факторов
ял
предложен Татевским и Папуловым [1470], Татевским, Бендер-
ким
и Яровым [1468], Гриншилдсом и Россини [543], Платтом
1169, 1170], Мулликеном
[1035]
и Соудерсом, Маттюзом и Хардом
1396, 1397]. Сравнение результатов этих методов было проведено
"киннером
и Пилчером [1363], а также Сомаяюлу, Кудхадкером
Зволинским
[1395].
Скиннер
[1361]
применил
схему
Аллена для расчета энергии ато-
азации
многих типов алканов, а также замещенных алканов. Схема
асчета Аллена была соответствующим образом распространена
рлчером, Пеллом и Колеманом
[1145]
на простые эфиры. Мак-
аллох и Гуд [957] использовали соотношение Аллена для расчета
йергии атомизации алкантиолов и
других
типов серусодержащих.
рединений.
В связи с этим представляет интерес метод корреляции
кектронного
строения и свойств связи в ряду серусодержащих соедине-
Вй, предложенный Бентом [109]. Следует также отметить монографию
•ортимера
[1029]
по взаимосвязи теплот реакций и прочности связи
! молекулах. Схема Лейдлера [838] с учетом как энергий связи
Гомов, так и энергий групп атомов в молекуле, была применена
яя
расчета энергии атомизации алкантиолов, тиаалканов, дитиаалка-
|>в,
а также для спиртов, простых эфиров и перекисей алкилов.
^ Схема Бенсона и Басса [108], предложенная для расчета величин
^/гэв'
^2
9
8
и С
Р°
в
интервале температур
300—1500°
К на основе
Ьмпилированных
значений атомных и групповых вкладов, а также
Цладов связей в молекуле, была усовершенствована Голденом.
Шилом
и Бенсоном [504]. При расчете по этой схеме в интервале
Чшератур до
1500°
К среднее отклонение от экспериментальных
-пых для энтропии и теплоемкости составляет +0,5
кал/(молъ-°К),
11*

164
Часть
1.
Основы
термодинамики
VI.
Приближенный
расчет
термодинамических
величин
165
для энтальпии образования
до
±0,5
ккал/моль
*.
Энтальпии обра-
зования
фторуглеводородов
и
фторгалогенированных углеводородов
были пересчитаны
в
связи
с
последним пересмотром принятых ранее
стандартных энтальпий образования водной фтористоводородной
кислоты
и
газообразного четырехфтористого
углерода.
Эти данные,
повторно пересмотренные Лейчером
и
Скиннером [833], были про-
верены по аддитивной
схеме
и
схеме
расчета
с
учетом
взаимодействия
связей,
предложенной Алленом.
В
случае
галогензамещенных мета-
на
и
фторуглеводородов корреляция оказалась вполне удовлетвори-
тельной,
что же
касается галогензамещенных этапов
и
олефинов.
то
в
этом
случае
совпадение оказалось несколько
хуже.
Лейчер
и
Скиннер предположили,
что в
последнем
случае
значительную
роль играют стерические факторы отталкивания, возникающие
между
атомами галогена
**.
Овермарс
и
Блиндер
[1096]
рассчитали средние значения энергии
связей
С — С и
С —
Н
методом наименьших квадратов
и с
помощью
этих значений вычислили стандартные энтальпии атомизации
для
50 алканов. Они получили среднюю ошибку ±0,58 ккал/моль,
что
значриельно меньше
тех
отклонений, которые наблюдаются
при
использовании
более сложных
схем
расчета.
Следует
подчеркнуть, что при использовании
схем
расчета по
энер-
гиям
связи,
а
также при сравнении
с
другими значениями энтальпий
атомизации
рассчитанные величины обычно приводят
при
298°
К.
Эти величины, как правило, представляют собой
сумму
термической
энергии
атомов
и
молекул
и
энергии основных видов колебаний ядер
при
0° К.
Поэтому
во
многих случаях было
бы
вполне логично рас-
сматривать значения энергии при какой-либо одной базисной темпе-
ратуре,
т. е.
при
0° К
или
298°
К. Неландер
и
Суннер [1050], рассмот-
рев ряд полициклических молекул, пришли
к
выводу, что, хотя термин
«энергия»
и
употребляется при вычислении энергий связи
(а
также
энергий
деформации), тем
не
менее
во
всех
обычных расчетных
схе-
мах удобнее использовать величины энтальпий. Этот факт необходи-
мо учитывать при анализе процессов, связанных
с
образованием коль-
цевых структур.
Эти
авторы указали также
на
целесообразность
использования
во
всех
возможных случаях
в
качестве базисной
* Правила аддитивности
для
расчета термодинамических свойств различ-
ных классов органических соединений подробно обсуждаются
в
одной из послед-
них работ Бенсона
и
сотр.
[Benson
S. W.,
Gruickshank
F. Д.,
Golden
D. M.,
Had-
gen
G. R.,
O'Neal
H. E.,
Chem.
Rev.,
N>
3,
279—324
(1969)].—
Прим.
перев.
** Некоторые закономерности
в
величинах энтальпии образования фтор-
и
фторхлороргапических соединений были рассмотрены
В. П.
Колесовым.
Оь-
например,
сб.
«Современные проблемы физической химии», вып.
6,
Изд-во МГУ-
М., 1971;
сб.
«Труды
по
химии
и
химической технологии», Изд-во Горьковского
Государственного университета, Горький,
1971.
Результаты эксперименталь-
ных исследований были положены
в
основу выбора энтальпий образования фтор-
и
фторхлорорганпческпх соединений для справочника «Термические константы
веществ», вып.
4
(1970), Изд-во
АН
СССР,
М.—Прим.
перев.
емпературу
0° К.
Исследования Шлейера
и
сотр.
[1289]
показали,
^го
даже
более совершенные схемы расчета приводят
к
трудно объяс-
нимым
значениям энергий деформаций, возникающих
в
случае
высоко-
ийимметричных глобулярных молекул. Очевидно,
это
затруднение
•удастся преодолеть, если проводить сравнение при
0° К.
|< Энергии разрыва связей молекул можно рассчитать
с
помощью
||детода
Франклина [439], поскольку
в
литературе имеются значения
|трупповых инкрементов для свободных радикалов. Для определения
|энергии
разрыва связей С —
Н в
парафиновых
углеводородах
по
(
методу
Воеводского
[1541]
используется корреляция, основанная
на
эффекте стабилизации метальных групп. Этот метод был распро-
странен Веденеевым
[1530]
на
соединения, содержащие
не
только
['связи С
—
Н, но
и
другие
связи.
,
Методы расчета с учетом групповых вкладов
Ранее
указывалось, что для простого приближенного расчета чис-
ленных значений термодинамических свойств
с
помощью небольшого
числа данных Парке
и
Хаффман предложили ряд методов, основан-
ных
на
вкладах определенных групп атомов или связей
в
молекуле.
Метод, разработанный Андерсоном, Бейером
и
Уотсоном
[18],
несколько
сложнее
других
методов, однако он позволяет более коли-
чественно проанализировать строение углеродного скелета молеку-
лы.
Согласно этому
методу,
молекула каждого соединения рассмат-
ривается
как
некоторое производное, полученное путем замещения
ряда атомов
в
исходной молекуле определенными группами.
Так,
например,
структуру
парафинов можно построить
из
исходной
молекулы метана путем замещения атомов водорода соответствую-
щими
атомными группами. Аналогичным образом можно получить
значения
свойств
для
всех
эфиров, используя
в
качестве исходного
соединения
диметиловый эфир
и
суммируя инкременты
и
термоди-
намические
величины
в
соответствии
со
структурными модифика-
циями,
возникающими
в
процессе замещения отдельных групп.
Отклонения
от
простого принципа аддитивности
следует
принимать
во внимание
в тех
случаях,
когда
для
каждого инкремента может
существовать некоторый набор соответствующих структурных окру-
жений.
В
связи
с
этим обычно рассматривают вклады
от
первичного
метильного замещения, вторичного замещения метильных групп
и
вклады кратных связей (включая поправку
за
счет сопряженных
Двойных связей
и
двойных связей, сопряженных
с
кольцом). Термо-
динамические инкременты обычно связывают
со
структурой молекул
ЧРИ
определении
трех
параметров:
AHfl
9S
,
S°
298
и Ср°,
где Ср°'
= а +
~т~"Т
-\-сТ
2
.
Корреляция теплоемкости, зависящей
от
температуры,
DBVY
дру
ГИХ
параметров позволяет рассчитать величины энергий
энтальпий
образования
и
энтропии газообразных молекул
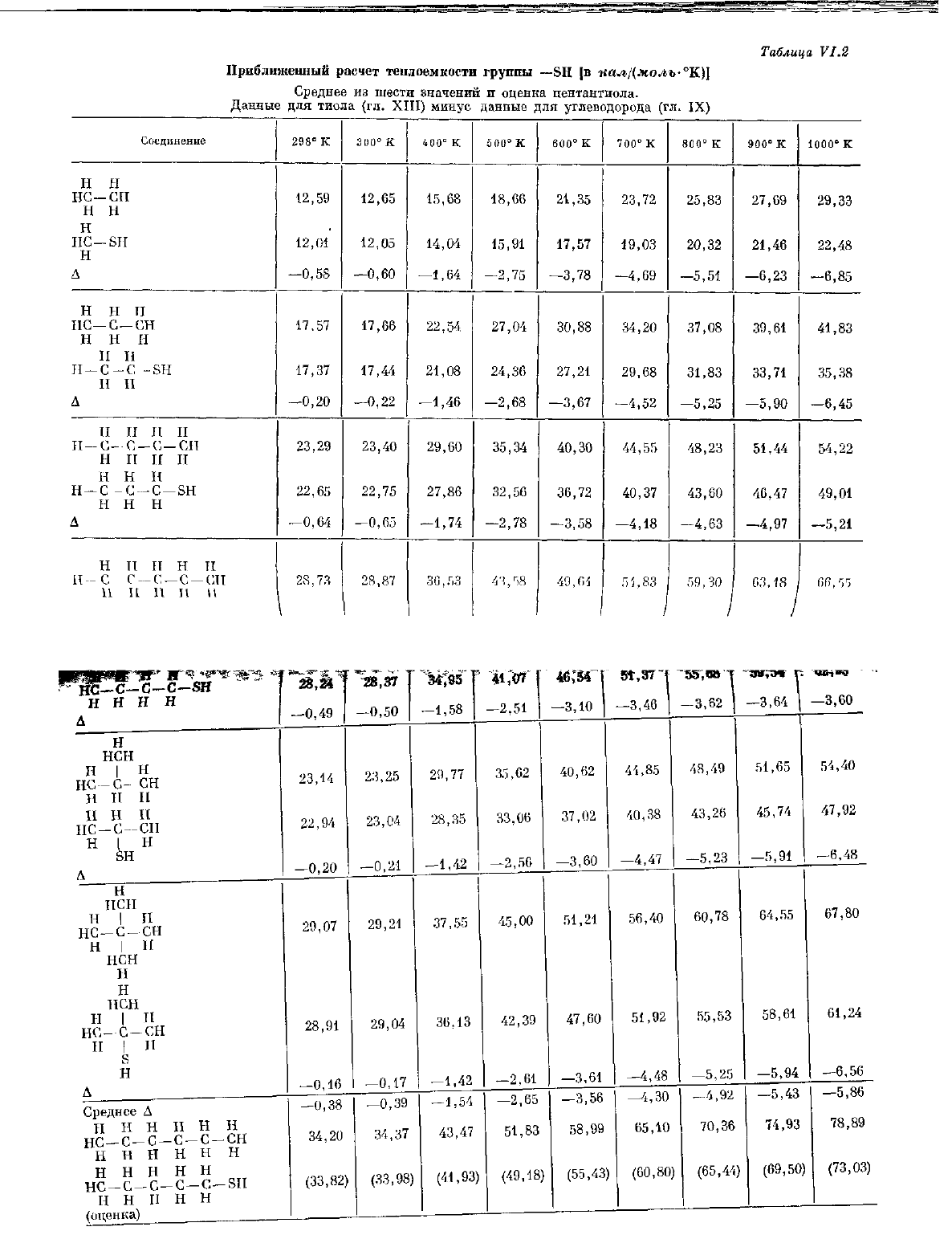
Приближенный расчет теплоемкости
группы
—SH
|в
кал/(моль-°К)\
Среднее
из
шести
значений
и
оценка
пентантиола.
Данные
для
тиола
(гл.
XIII)
минус
данные
для
углеводорода
(гл.
IX)
Таблица
VI.2
Соединение
н
и
НС—
СН
н
н
н
HC-SH
н
д
н
н н
НС—
С-СН
н
н н
II
II
II
—С —С —SH
II
II
д
н
н н н
Н—С—С
—С—СН
н
н н и
н
н н
Н
—С
-С
—C-SH
н
н н
д
Н
Н II Н Н
Н-С С
—С —С
—СН
11
И 11 П II
298°
К
12,59
12,01
—0,58
17,57
17,37
—0,20
23,29
22,65
—0,64
28,73
300°К
12,65
12,05
—0,60
17,66
17,44
—0,22
23,40
22,75
—0,65
28,87
400°
К
15,68
14,04
—1,64
22,54
21,08
—1,46
29,60
27,86
—1,74
500°К
18,66
15,91
-2,75
27,04
24,36
—2,68
35,34
32,56
—2,78
600°
К
21,35
17,57
—3,78
30,88
27,21
—3,67
40,30
36,72
—3,58
700°
К
23,72
19,03
—4,69
34,20
29,68
—4,52
44,55
40,37
-4,18
800°
К
25,83
20,32
—5,51
37,08
31,83
—5,25
48,23
43,60
—4,63
59,30
900°
К
27,69
21,46
—6,23
39,61
33,71
—5,90
51,44
46,47
—4,97
03,18
1000°К
29,33
22,48
-6,85
41,83
35,38
—6,45
54,22
49,01
—5,21
вв,
г
>
г
>
с-с-с-
н
н н н
н
,
НС—С-
СН
н
н н
II
Н II
НС—С—СН
Н
| Н
SH
н
нсн
н
| н
нс-с-сн
н
II
нсн
н
н
нсн
н
| н
НС—С-СН
Н
| Н
S
н
Среднее
Д
н
н н н н н
нс-с-с-с-с-сн
н
н н н н н
н
н н н н
HC-C-C-C-C-SH
н
н п н н
(оценка)
23,14
22,94
—0,20
29,07
28,91
—0,16
—0,38
34,20
(33,82)
23,25
23,04
—0,21
29,21
29,04
—0,17
-0, *
34,37
(33,98)
29,77
28,35
—1,42
37,55
36,13
—1,42
43,47
(41,93)
35,62
33,06
—2,56
45,00
42,39
—2,61
51,83
(49,18)
40,62
37,02
—3,60
51,21
47,60
—3,61
58,99
(55,43)
41,85
40,38
—4,47
56,40
—3,
48
43
—5
62
|
49
,26
,23
-3,
51
45
—5
64
65
74
,91
—3,
54
47
—6
60
40
,92
,48
51,92
—4,48
65,10
(60,80)
60,78
55,53
—5,25
—4,92
70,36
(65,44)
64,55
58,61
—5,94
—5,43
74,93
(69,50)
67,80
61,24
—6,56
—5,86
78,89
(73,03)

168
Часть
1.
Основы
термодинамики
для температур, отличающихся от
298°
К. Андерсон, Бейер и Уотсоц
[18] приводят значения вкладов, обусловленных замещением одноц
или
двух
метальных групп другими атомными группами. Замещение
метильной группы углеводородной молекулы другим атомом или
группой приводит к появлению относительно постоянного инкремента
теплоемкости. Таким образом, величина инкремента может быть рас-
считана по теплоемкости
двух
молекул, для которых имеются доста-
точно надежные данные. Определенный таким образом инкремент
можно использовать для приближенного расчета теплоемкости неизу-
ченного соединения. При этом исходный углеводород структурно дол
жен быть как можно ближе к рассматриваемому соединению. Таким
образом, данные для углеводородов — это фундамент, на котором
построено термодинамическое «здание» органической химии.
Метод расчета по групповым инкрементам можно легко использо-
вать для приближенного расчета теплоемкости газообразного веще-
ства на основании теплоемкости исходного углеводорода. Сравнение
разности в теплоемкостях алкилтиолов и родственных им углеводо-
родов показывает, что при
298,15°
К инкремент теплоемкости —
постоянная
величина в пределах 0,5
кал/(моль-°К).
В качестве при-
мера можно привести значения теплоемкости газообразного пентан-
тиола, рассчитанные из соответствующих данных исходного
угле-
водорода гексана и представленные в табл. VI.2. Приведенные
в
табл. VI.2 значения теплоемкостей удовлетворительно согласуются
с величинами, указанными в гл. XIII.
Метод расчета по групповым инкрементам с учетом соответствую-
щей
корректировки числа симметрии может быть также с успехом
применен
для определения энтропии органических соединений.
Рассмотрим газообразные молекулы пропана
(СН
3
СН
2
СН
3
)
и хлори-
стого этила
(СН
3
СН
2
С1).
Эти молекулы можно представить в виде
этильных групп, к которым присоединены метильная группа и атолг
хлора. Энтропия этильной группы в обоих случаях
будет
почти
одна и та же, а разница энтропии
двух
молекул
будет
обусловлена
различием в таких факторах, как число симметрии [ср. выраже-
ние
(IV.19)], молекулярный вес, структура и внутреннее вращение.
Эти факторы для удобства обычно объединяют в две группы: первая
включает различные элементы симметрии молекулы, вторая — все
другие факторы. Россини, Питцер, Арнетт, Браун и Пиментел
[12481
приводят для газообразного пропана значение
S°
MS
,
равное
64,51
кал/(молъ
-°К); Гордон и Джиок [518] для газообразного хлори-
стого этила дают
S°
2gs
=
65,94
калI(моль -°К). Для пропана число
симметрии a
t
= 18, для хлористого этила o
t
= 3.
Пропан
Хлористый этил
S§
98
. . . 64,51 S?
2SS
. . .
65,94
Л In 18 . . .5,74 Д1пЗ . . 2,18
VI.
Приближенный
расчет
термодинамических
величин
169
68,12
S*
9S
— энтропии молекул пропана и хлористого этила, вычис-
ленные без
учета
членов, характеризующих симметрию молекул,
в
выражениях
(IV.22)
и (IV.23). Таким образом, замещение метиль-
ной
группы атомом хлора приводит к инкременту (исходный
угле-
водород минус замещенный углеводород)
А^*
98
=
70,25
— 68,12 =
\=
2,13 кал!(молъ-"К). Следует отметить, что величина
S*
9S
больше
|для исходного углеводорода.
Россини,
Питцер, Арнетт, Браун и Пиментел [1248], используя
[энтропию
исходного углеводорода 2-метилпропана
[(СН
3
)
3
СН,
а< —
\— 81], равную при
298°
К
70,42
кал/(моль-°К),
рассчитали этропию
хлороформа
(СНС1
3
,
o
t
= 3). Используя полученные значения, нахо-
|дим [в кал
/
(моль-°К)]:
£|
98
70,42
Л1п81 8,73
S%
98
. . . .~ 79Й5
—3(2,13)
—6,39
— Д1пЗ —2,18
£
2
°
88
,
СНС1
3
(g) ГГ.
70~58
Вычисленное значение энтропии газообразного хлороформа при;
|298,15°
К хорошо согласуется с величиной
70,66
кал/(молъ
-°К),
аайденной
Джеллсом и Питцером [465] из спектроскопических дан-
Инкременты
энтропии, обусловленные замещением метильных
frpynn (без
учета
симметрии) и обозначаемые символом A<S*
98
, при-
ведены в различных главах книги.
Метод расчета по групповым инкрементам [18] можно использо-
вать для приближенного расчета энтальпии образования органиче-
ских соединений из соответствующих значений инкрементов, опре-
вленных по разности энтальпий образования исследуемого соеди-
вяия
и его исходного углеводорода. В качестве примера рассмотрим
олее подробно два соединения: пропан (Н
3
С — СН
2
— СН
3
) п этан-
аол (Н
3
С — СН
2
— SR). Каждое из этих соединений содержит
гильную и метиленовую группы, образующие общую для обеих
олекул этильную группу. Поэтому различие в энтальпиях образо-
1ния
этих
двух
молекул можно отнести за счет разности в энталь-
образования метильной и тиольной групп. Эта разность, как
из
табл. VI.3, весьма постоянна для определенного ряда
единений.
Замещение метильной группы в исходном углеводороде
тиольную приводит к значению
AHf°
29S
тиолов, отличающемуся
AHf°
ua
исходного углеводорода на величину 13,93 ккал/молъ.
В табл. VI.4 приведены рассчитанные аналогичным образом
гальпии образования алкилсульфидов. Легко видеть, что замеще-
е метиленовой группы на сульфидную также приводит к значе-
АЯ/°
98
сульфидов, отличающемуся от
Ai7/
2
°
98
исходного
угле-
Чорода на величину 15,51 ккал/молъ.
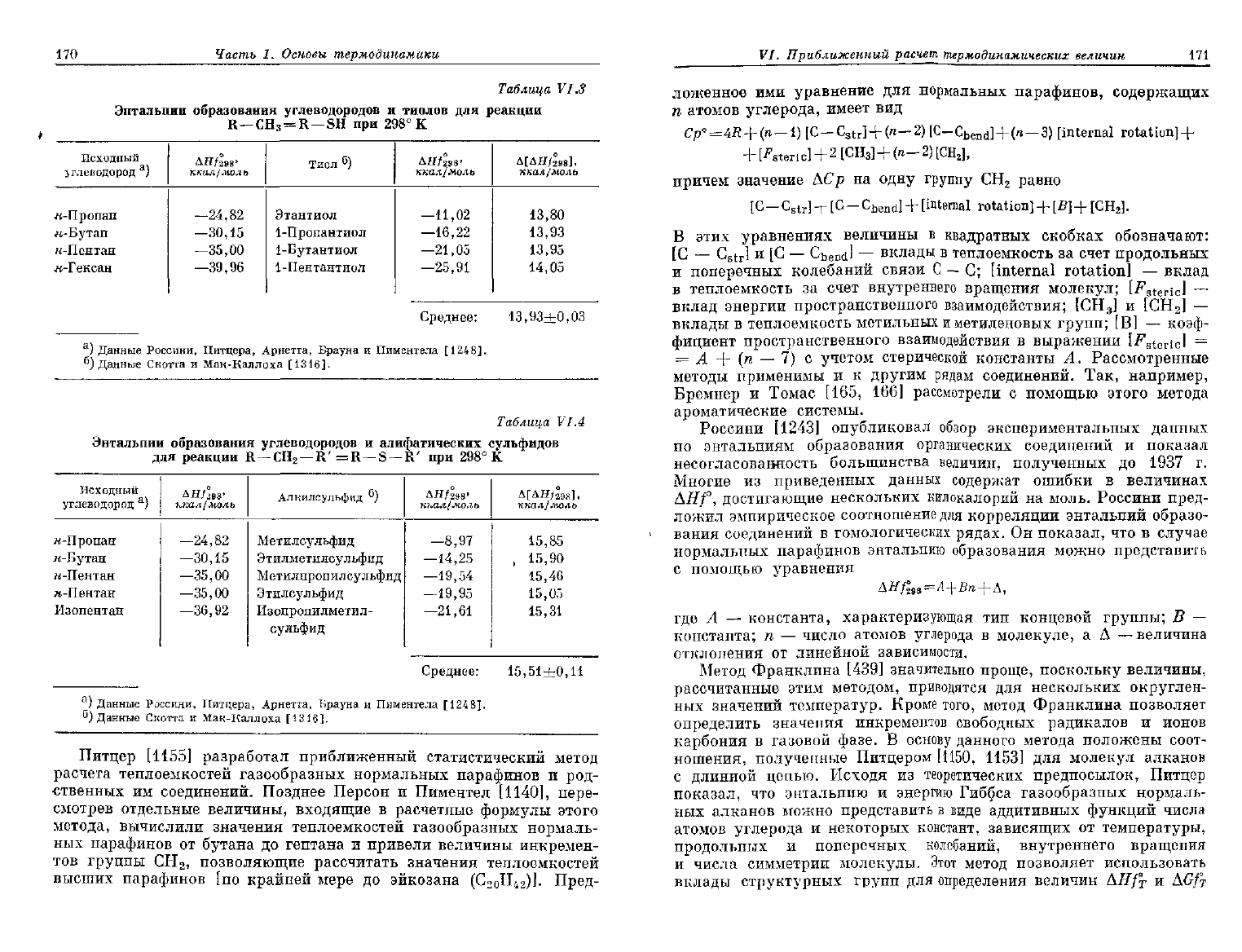
170
Часть
1.
Основы
термодинамики
Таблица
VI.3
Энтальпии
образования
углеводородов
и
тиолов
для
реакции
R—CH
3
=
R—SH
при
298°
К
Исходный
углеводород
а
)
«-Пропан
«-Бутан
к-Пентан
л-Гексан
ДН/298
1
ккал/моль
—24,82
—30,15
—35,00
—39,96
Тиол
б
)
Этантиол
1-Пропантиол
1-Бутантиол
1-Пентантиол
ДН/2Э8-
ккал/моль
—11,02
—16,22
—21,05
—25,91
А[ДЯ/2»8],
ккал/моль
13,80
13,93
13,95
14,05
Среднее: 13,93+0,03
а
) Данные Россини, Питцера, Арнетта, Брауна
и
Пиментела [1248].
б) Данные Скотта
и
Мак-Каллоха [1316].
Таблица
VIA
Энтальпии
образования
углеводородов
и
алифатических
сульфидов
для
реакции
R—CH
2
—R'=R—S—R'
при
298°
К
Исходный
углеводород
а
)
и-Пропан
«-Бутан
м-Пентан
л-Пентан
Изопентан
ДН/298'
ккал/моль
—24,82
—30,15
—35,00
—35,00
—36,92
Алкилсульфид
")
Метилсульфид
Этилметилсульфид
Метилпропилсульфид
Этилсульфид
Изопропилметил-
сульфид
ДН/298'
ккал/моль
—8,97
—14,25
—19,54
—19,95
—21,61
Д[ДЯ/°98],
ккал/моль
15,85
, 15,90
15,46
15,05
15,31
Среднее: 15,51+0,11
а
) Данные Россини, Питцера, Арнетта, Брауна
и
Пиментела [1248].
б
) Данные Скотта
и
Мак-Каллоха [1316].
Питцер
[1155]
разработал приближенный статистический метод
расчета теплоемкостей газообразных нормальных парафинов и род-
ственных им соединений. Позднее Персон и Пиментел [1140], пере-
смотрев отдельные величины, входящие в расчетные формулы этого
метода, вычислили значения теплоемкостей газообразных нормаль-
ных парафинов от бутана до гептана и привели величины инкремен-
тов группы СН
2
, позволяющие рассчитать значения теплоемкостей
высших парафинов [по крайней мере до эйкозана
(С
2
оН
4
2)].
Пред-
VI.
Приближенный
расчет
термодинамических
величин
171
ложенное ими уравнение для нормальных парафинов, содержащих
п атомов
углерода,
имеет вид
[п—1)
[С—-Cstrl +
Cn—2)
[C-C
ben
d] + (i —
3)
[internal rotation] +
причем значение ACp на одну группу СН
2
равно
[С—C
str
]
-r
[С —
C
bend
]
+ [internal rotation] +
[B]
+
[CH
2
].
В этих уравнениях величины в квадратных скобках обозначают:
[G
—
C
str
]
и [С — Cbendl — вклады в теплоемкость за счет продольных
и
поперечных колебаний связи С — С; [internal rotation] — вклад
в
теплоемкость за счет внутреннего вращения молекул; [icteric! —
вклад энергии пространственного взаимодействия; [СН
3
] и [СН
2
] —
вклады в теплоемкость метильных и метиленовых групп; [В] —
коэф-
фициент
пространственного взаимодействия в выражении Icteric! =
=
А + (п — 7) с
учетом
стерической константы А. Рассмотренные
методы применимы и к другим рядам соединений. Так, например,
Бремнер
и Томас [165, 166] рассмотрели с помощью этого метода
ароматические системы.
Россини
[1243]
опубликовал обзор экспериментальных данных
по
энтальпиям образования органических соединений и показал
несогласованность большинства величин, полученных до 1937 г.
Многие
из приведенных данных содержат ошибки в величинах
AHf, достигающие нескольких килокалорий на моль. Россини пред-
ложил эмпирическое соотношение для корреляции энтальпий образо-
вания
соединений в гомологических рядах. Он показал, что в
случае
нормальных парафинов энтальпию образования можно представить
с помощью уравнения
где А — константа, характеризующая тип концевой группы; В —
константа; п — число атомов
углерода
в молекуле, а А —величина
отклонения
от линейной зависимости.
Метод Франклина [439] значительно проще, поскольку величины,
рассчитанные этим методом, приводятся для нескольких округлен-
ных значений температур. Кроме того, метод Франклина позволяет
определить значения инкрементов свободных радикалов и ионов
карбония
в газовой фазе. В основу данного метода положены соот-
ношения,
полученные Питцером
[1150,
1153] для молекул алканов
с длинной цепью. Исходя из теоретических предпосылок, Питцер
показал,
что энтальпию и энергию Гиббса газообразных нормаль-
ных алканов можно представить в виде аддитивных функций числа
атомов
углерода
и некоторых констант, зависящих от температуры,
продольных и поперечных колебаний, внутреннего вращения
и
числа симметрии молекулы. Этот метод позволяет использовать
вклады структурных групп для определения величин
AHf
T
и
AGfj

172
Часть
1.
Основы
термодинамики
при
любой температуре. Влияние структурной симметрии и оптиче-
ских изомеров учитывается путем добавления к значениям энергии
Гиббса дополнительных слагаемых. Вклад числа симметрии уже
обсуждался ранее. Для соединений, содержащих асимметрический
атом
углерода
(т. е. для одного набора оптических изомеров), при
суммировании энергии Гиббса обычно вводят дополнительную
поправку, равную —RT In 2. При наличии
двух
наборов оптических
изомеров этот вклад
будет
составлять —RT In 4. Поправочные
коэф-
фициенты,
учитывающие разветвление цепи и влияние заместителей
в
ароматическом кольце, относят к влиянию кольца.
Соудерс, Маттюз и
Хард
[1396,
1397] применили метод групповых
инкрементов
для расчета колебательных составляющих теплоем-
кости,
теплосодержания и энтропии, а также составляющих этих
функций,
обусловленных внутренним вращением. Анализ структур-
ной
формулы позволяет выбрать те инкременты, которые в наиболь-
шей
степени соответствуют структурному окружению молекулы.
Сумма этих вкладов вместе с поступательными и вращательными
составляющими всей молекулы в целом
дает
желаемое термодинами-
ческое свойство исследуемого соединения. Помимо этого, корреля-
ционный
метод позволяет непосредственно рассчитать величину
энтропии
образования молекулы. Вклады неуглеводородных групп,
по-видимому, не учитывались в этом методе.
Метод, предложенный Ван Кревеленом и Чермином [1528], ана-
логичен
методу
Франклина. Различие заключается лишь в форме
представления конечных результатов. В методе Ван Кревелена
и
Чермида результаты расчета непосредственно выражаются в виде
линейного
уравнения температурной зависимости энергии Гиббса
рассматриваемой молекулы. В связи с появлением более надежных
данных Чермин [220] полностью пересмотрел расчетные формулы
этого метода и распространил их на алканы, алкены, циклоалканы,
циклоалкены,
алкины и ароматические соединения. По сравнению
с другими методами этот метод
дает
наибольшее число инкрементов
для неуглеводородных групп. В значения инкрементов различных
углеводородных групп внесен \ ;;д поправок, учитывающих развет-
вление парафиновых цепей и размеры колец, а также наличие циклов
в
ароматических соединениях.
Глава
VII
ПРИМЕНЕНИЕ
ТЕРМОДИНАМИКИ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
ДЛЯ РЕШЕНИЯ НЕКОТОРЫХ ПРОМЫШЛЕННЫХ ПРОБЛЕМ
Введение
Задача химической промышленности — наиболее полное и целе-
сообразное использование исходного сырья путем превращения
в
определенные химические соединения, которые
могут
быть как
промежуточными, так и конечными продуктами технологического
процесса. Поскольку химические реакции связаны с изменением
расположения атомов в молекулах исходных веществ по сравнению
с расположением тех же атомов в молекулах продуктов реак-
ции,
то перед химиком возникает задача осуществить химическое
превращение в таких условиях (давление, температура и т. д.),
которые способствовали бы преимущественному протеканию рас-
сматриваемой реакции с образованием желаемых продуктов. Тща-
тельный термодинамический анализ реагирующей системы часто
помогает выяснить необходимые условия получения того или иного
продукта, позволяет установить, какие реакции невозможны, и при-
влекает внимание к осуществимым реакциям. Целесообразность
такого термодинамического анализа определяется наличием доста-
точно надежных основных термодинамических свойств веществ,
однако
даже
при отсутствии
всех
необходимых данных часто
оказывается возможным, опираясь на закономерности в термо-
динамических свойствах веществ, сделать некоторые обоснованные
предположения о продуктах реакции. По мере накопления
соответствующих данных применение термодинамического анализа
в
современных исследованиях получает все более широкое рас-
пространение.
Согласно Бергу, Карпентеру, Дейли,
Деву,
Герцелю, Хиппли,
Кинднш
и Поповацу [НО], при планировании хилшческого иссле-
дования
вначале необходимо изучить имеющуюся по этому вопросу
литературу,
зателг, не начиная экспериментальной работы, провести
термодиналшческий анализ системы и оценить возлтожность проте-
кания
той или иной реакции и, наконец, если это выполнимо, прибли-
женно
рассчитать максимальный
выход
продуктов реакции и опре-
делить условия, при которых можно достичь этого выхода. Во избе-
жание неверных выводов необходимо четко представлять себе общие
закономерности,
правила и ограничения термодинамического метода
анализа. Так, например, термодинамика рассматривает только усло-
вия
равновесия системы и ничего не говорит о скорости достижения

174
Часть
1.
Основы
термодинамики
этого равновесия. Даже те реакции, которые характеризуются
значительным отрицательным изменением энергии Гиббса, в
отсут-
ствие подходящего катализатора
могут
протекать исключительно
лхедленно. В то же время реакции, характеризующиеся значитель-
ными
положительными изменениями энергии Гиббса, не
будут
про-
текать самопроизвольно; в таких
случаях
поиски подходящего ката-
лизатора совершенно бесполезны.
Наличие
или отсутствие катализатора может благоприятно
влиять на получение определенного продукта реакции. Так, Фишер
[427] при исследовании процесса получения топлива из водяного
газа рассмотрел следующие реакции:
(VII. 1)
(VII.2)
(VII.3)
2
=
НСНО,
СО+2Н
2
=
СН
3
ОН
СО+ЗН
2
= СН
4
+Н
2
О.
Термодинамический анализ реакций
(VII.1)
— (VII.3) показал,
что при
600°
К и 150 атм равновесная газовая фаза
будет
содержать
большое количество метана и немного метанола. Тем не менее при
введении в систему в качестве катализатора окиси цинка в тех же
условиях образуется значительное количество метанола. Такое
ингибирование реакции (VI 1.3) является предметом рассмотрения
химической кинетики и не может быть предсказано на основании
законов
термодинамики.
Три
рассмотренные выше реакции показывают, что для одних
и
тех же исходных веществ возможно несколько направлений реак-
ции.
Такая картина имеет место для многих органических соедине-
ний.
Поэтому при термодинамическом анализе одной из реакций
обычно предполагают, что все
другие
возможные взаимодействия
не
влияют на равновесный состав газовой фазы рассматриваемой
реакции.
Путем подбора соответствующего катализатора часто
удается
ускорить необходимую реакцию или подавить все нежела-
тельные процессы таким образом, что оказывается возможным иссле-
довать выбранную реакцию независимо от
других
и использовать
ее для получения необходимого продукта. В таких
случаях
обычно
предполагают, что скорости
всех
побочных реакций пренебрежимо
малы по сравнению со скоростью исследуемой реакции. Помимо
этого, необходимо ввести дополнительное предположение о том,
что в состоянии равновесия концентрация промежуточных продуктов
пренебрежимо мала по сравнению с концентрацией продуктов рас-
сматриваемой реакции. Таким образом, при проведении термодина-
лшческого анализа важно понимать, что три отмеченных выше пред-
положения используются в термодинамических расчетах как само
собой разумеющиеся, а надежность получаемых результатов зависит
от степени достоверности этих предположений.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
175
При
решении конкретных практических задач часто возникают
трудности, которые
удается
избежать с помощью дополнительных
упрощающих предположений. Окончательное решение такой задачи
обычно является только грубым приближением сложных процессов,
протекающих в действительности. Промышленная аппаратура часто
обладает такой высокой пропускной способностью, что в ней не
уста-
навливается предполагаемое термодинамическое равновесие; рас-
считанная
постоянная температура процесса может значительно-
измениться,
а сама система, в которой учитывалось только три
или
четыре реагирующих компонента, в действительности может
содержать гораздо большее их число.
Для нахождения
отсутствующих
в литературе термодинамических
данных часто приходится использовать общие приближенные методы
расчета. Полученные таким образом величины часто содержат
ошибку в несколько процентов. Иногда эти ошибки
могут
быть
весьма значительными. Так, например, изменение энергии Гиббса
реакции
CH
3
CHOHCH3(?)=CH
3
COCH
3
(g)
+ H
2
(g),
рассчитанное из данных, приведенных на стр. 479 и 502,
будет
следующим:
AGf
igs
= 4,91
ккал/молъ
и
AG/°
00
= —3,71
ккал/молъ.
Энтальпия
сгорания жидкого пропанола-2 равна
—479,480
ккал/молъ.
Из
табл. VII.1 видно, насколько изменятся энергия Гиббса и кон-
Таблица
VII.1
Зависимость
термодинамических
параметров
реакции
дегидрирования
от
изменения
энтальпии
сгорания
пропанола-2
на 1%
ДНс СзНвО
при 298° К,
ккал/моль
—479,480
(лучшее
значение)
—484,270
(величина, отли-
чающаяся на 1%)
AGr"
дегидрирова-
ния,
ккал/моль
298° К
4,91
0.12
600°К
—3,71
—8,50
Константа равно-
весия
Кр, атм
298° К
2,52-10-4
8,17-10-1
600° К
22,5
12 500
станта равновесия реакции дегидрирования, если истинная величина
энтальпии
сгорания пропанола-2 окажется на 1% больше значения,
использованного в расчетах. Ошибка в этой величине на 1 % приве-
дет к изменению константы равновесия рассматриваемой реакции
более чем в
3000
раз при температуре
298°
К и примерно в 500 раз
при
600°
К. Из этого примера отчетливо видно, насколько важно
использовать в расчетах точные значения термодинамических величин.
В том случае, когда известно изменение энергии Гиббса рассма-
триваемой реакции, нетрудно определить возможность ее самопроиз-

176
Часть
1.
Основы
термодинамики
вольного протекания. Если
при
некоторой температуре
AGr° = О,
то константа равновесия
Кг
равна единице
и
равновесие реакции
в
сильной степени сдвинуто
в
сторону образования конечных
про-
дуктов. При более положительном значении
AGr°
реакция сдвигается
влево,
а
выход
продуктов реакции постепенно уменьшается
до
таких
количеств,
при
которых рассматриваемая реакция
уже не
предста-
вляет практического интереса. Однако, поскольку значение
AGr°,
при
котором нельзя осуществить рассматриваемую реакцию, зависит
от многих факторов,
не
существует
определенного положительного
значения
энергии Гиббса, которое ограничивало
бы
возможность
протекания
той или
иной реакции. Даже если значение
AGr°
реакции
(VII.2)
при 600° К
равно
10,84
ккал/молъ,
эту
реакцию безусловно
можно осуществить
при
указанной температуре.
Для
того чтобы
избежать неблагоприятного влияния положительного значения
изменения
энергии Гиббса
и
сместить равновесие
в
нужную сторону,
в
этом
случае
можно применить высокое давление. Благоприятное
смещение равновесия достигается также путем изменения соотно-
шения
реагирующих веществ
или
удаления одного
из
продуктов
из
зоны реакции. Возможность использовать любой
из
этих способов
для смещения равновесия
требует
детального анализа
в
каждом
конкретном
случае. Данные, приведенные
в
табл. VII.2, являются
Таблица
VII.2
Использование
величины
AGr° как
критерия
осуществимости реакции
AGr
a
< 0
AGr° = 0—10
ккал/молъ
AGr
Q
~>Ю
ккал'молъ
Реакция
возможна
и
про-
текает самопроизволь-
но
Возможность осуществ-
ления
реакции сомни-
тельна; необходимы
дальнейшие исследо-
вания
Реакция
невозможна;
могут
оказаться
по-
лезными специальные
условия
ее
проведения
лишь
грубой оценкой возможности осуществления
той или
иной
реакции
и
должны рассматриваться
в
качестве приближенных
кри-
териев, которые может использовать химик-исследователь перед
постановкой
эксперимента.
В литературе неоднократно описывалось применение термодина-
мики
для
решения проблем химической технологии. (См., например,
работы Доджа
[333] и
Эдмистера [369].
VII.
Применение
термодинамики
для
решения
промышленных
проблем
177
Нефтехимия
*
За
последние
три
десятилетия термохимии углеводородов уделя-
лось большое внимание, поэтому
нет
ничего удивительного,
что
эта область термодинамики нашла широкое применение
при
реше-
нии
многих промышленных проблем. После второй мировой войны
перед нефтехимией была поставлена задача увеличения производства
бензола
и
других
ароматических соединений
для
удовлетворения
потребностей
в
основном сырье промышленности пластических масс,
производства синтетической резины
и
легких авиационных топлив.
Маршалл
[933]
описал процесс каталитического дегидрирования
и
ароматизации нефтепродуктов (гидроформинг), который использо-
вался
на
заводах
«Baytown
Ordnance»
во
время войны
для
получе-
ния
толуола,
а
также
в
послевоенное время
для
производства
аро-
матических растворителей высокой чистоты
и
компонентов авиа-
ционного
топлива. Хенсель
и
Бергер
[559]
рассмотрели применение
универсального процесса крекинга нефтепродуктов
над
платиновым
катализатором
для
производства углеводородов ароматического
ряда
из
различного исходного сырья.
Эти
авторы показали,
что
общий
мольный
выход
ароматических углеводородов
из
коммерче-
ской
единицы составляет
95%
теоретического значения.
Глазго, Уиллингем
и
Россини
[491]
тщательно исследовали
угле-
водородные фракции бензина, полученного каталитическим
кре-
кингом,
и
определили состав ароматической фракции
С
8
.
Предста-
вляет интерес сравнить распределение соединений ароматической
фракции
С
8
,
полученных путем различного каталитического
и тер-
мического крекинга. Количественный состав изомеров
С
8
практи-
чески совпадает
с
величинами, полученными путем термодинамиче-
ского анализа состава равновесной газовой фазы
для
температур
процесса.
Как
указывал Россини [1246], распределение ароматиче-
ских углеводородов такое
же, как и для
ароматических фракций
С
8
,
образующихся
в
естественных условиях
в
нефтях.
В
табл. VII.3
для сравнения приведен рассчитанный
и
определенный экспери-
ментально состав ароматических фракций
С
8
.
Торн,
Мэрфи,
Болл, Стэнфилд
и
Хорн [1497], исследовав
про-
дукты переработки битуминозного сланца
и
сланцевого масла,
при-
водят состав бензино-лигроиновой фракции сланцевого масла (Ршп-
* Подробный обзор отечественной
и
зарубежной литературы
в
области
экспериментального
и
теоретического исследования термодинамики
и
кинетики
нефтехимических реакций
с
участием различных типов углеводородов, анализ
различных закономерностей
в их
свойствах,
а
также конкретные рекомендации
по
выбору оптимальных условий осуществления многих процессов переработки
нефтяных
и
природных газов, производства нефтепродуктов
и
мономеров даны
в
работах
А. В.
Фроста
(Труды
по
кинетике
и
катализу, Изд-во
АН
СССР,
М.,
1956; Избранные научные
труды,
Изд-во
МГУ, 1960) и 'в
монографии
А.
А.
Введенского,
Термодинамические расчеты нефтехимических процессов,
Гостоптехиздат,
М.,
I960.—
Прим.
перев.
12-831
ти-
применение
термодинамики
для
решения
промышленных
проблем
179
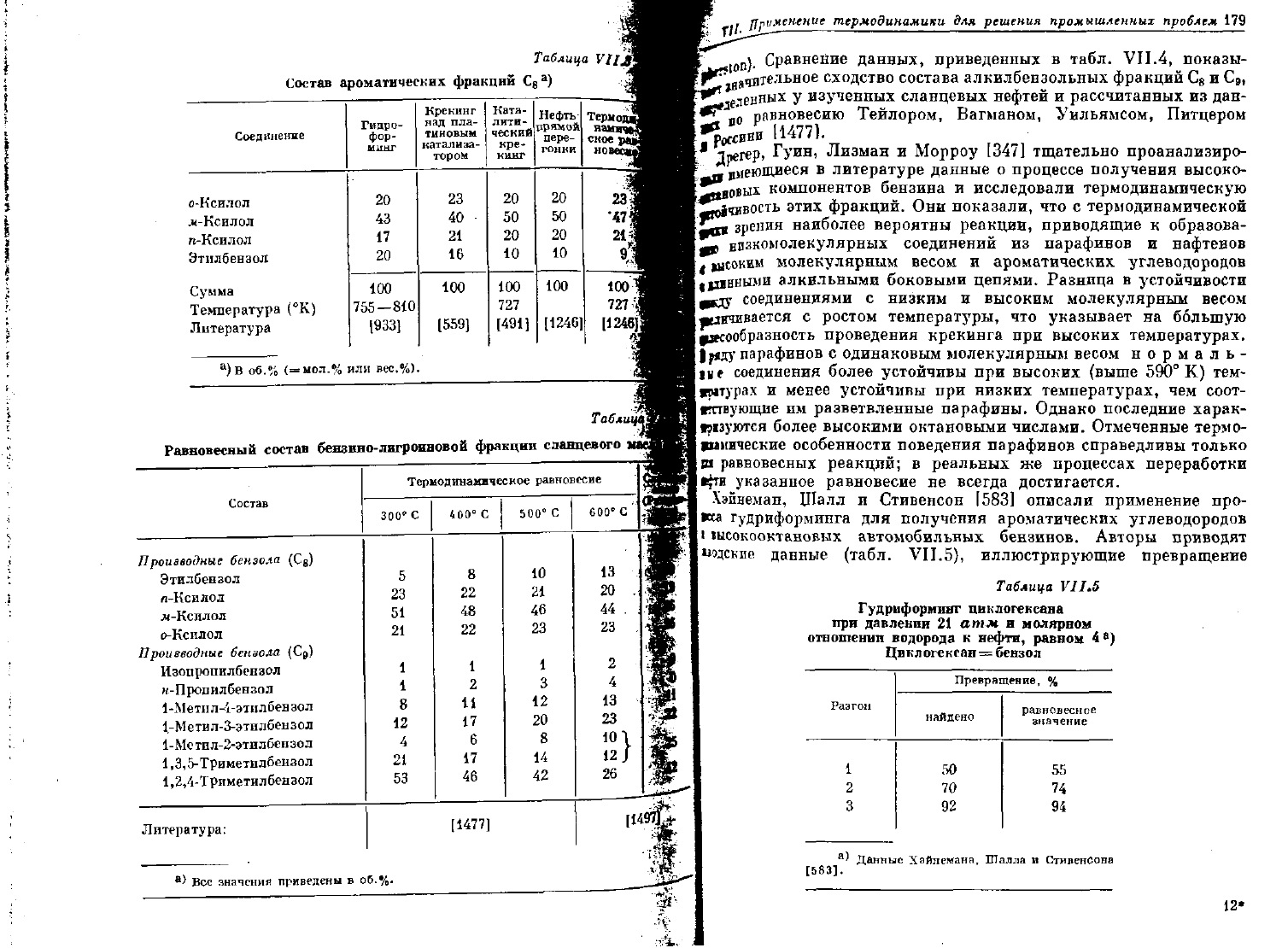
Таблица
VII,
Состав ароматических фракций С
8
а
)
Соединение
о-Ксилол
л-Ксилол
/г-Ксилол
Этнлбевзол
Сумма
Температура (°К)
Литература
Гидро-
фор-
Ы11ЫГ
20
43
17
20
100
755 — 810
[933]
Крекинг
над
пла-
тиновым
катализа-
тором
23
40 •
21
16
100
[559]
Ката-
лити-
ческий
кре-
кинг
20
50
20
10
100
727
[491]
Нефть
прямой
пере-
гонки
20
50
20
10
100
[124G]
Терт
наш
ское
НО1
'47
J
21
;
727^
а
)в
об.%
(=мол.%
или вес.%).
Табл1
Равновесный
состав
бензино-лигроиновой
фракции
сланцевого
Состав
Яроизводные
бензола
(Cg)
Этилбеезол
л-Ксилол
JH-КСИЛОЛ
о-Ксилол
Производные
бензола
(Сд)
Изопропилбепзол
н-Пропилбевзол
1-Метпл-1-этнлбензол
1-Метил-З-этилбензол
1-Мс тил-2-эти
л
беп
зо
л
1,3,5-Триметплбензол
1,2,4-Триметилбензол
Литература:
Термодинамическое равновесие
300°
С
5
23
51
21
1
1
8
12
4
21
53
400°
С
8
22
48
22
1
2
11
17
6
17
46
500°
С
10
21
46
23
1
3
12
20
8
14
42
[1477]
600
е
С'
13
20 -
44 .
23 .
2
4
13
23
10 |
12/
26
ЗЯБ
1
w
[1497U
Ж
8
>
Вес
значения приведены
в об.%.
ton)-
Сравнение данных, приведенных в табл. VII.4, показы-
^
ачВ
хельное
сходство
состава алкилбензольных фракций С
8
и С
в
,
**
е1е
цных у изученных сланцевых нефтей и рассчитанных из дан-
* "
0
равновесию Тейлором, Вагманом, Уильямсом, Питцером
&
и
„
[4/771
Inerep,
Гуин, Лизман и Морроу [3471 тщательно проанализиро-
д
руеюптиеся в литературе данные о процессе получения высоко-
овых компонентов бензина и исследовали термодинамическую
живость этих фракций. Они показали, что с термодинамической
зрения
наиболее вероятны реакции, приводящие к образова-
ипзкомолекулярных соединений из парафинов и нафтенов
-"высоким
молекулярным весом и ароматических углеводородов
••энными
алкнльными боковыми цепями. Разница в устойчивости
соединениями
с низким и высоким молекулярным весом
!*ехичнвается с ростом температуры, что указывает на большую
,0жсообразность проведения крекинга при высоких температурах.
•|р*ду
парафинов с одинаковым молекулярным весом нормаль-
!!ке
соединения более устойчивы при высоких (выше
590°
К) тем-
и
менее устойчивы при низких температурах, чем соот-
ие им разветвленные парафины. Однако последние харак-
более высокими октановыми числами. Отмеченные термо-
[
химические особенности поведения парафинов справедливы только
1и раввовесных реакций; в реальных же процессах переработки
J«^ти
указанное равновесие не всегда достигается.
Хэпнеман,
Шалл и Стивенсон [583] описали применение про-
ка
гудриформинга для получеппя ароматических углеводородов
^высокооктановых автомобильных бензинов.
Авторы
приводят
данные (табл. VII.5), иллюстрирующие превращение
Таблица
VI1,5
Гудриформинт циклогексана
при давлении 21 атм и молярном
отношении
водорода к нефти, равном 4
а
)
Цикл
ore кган = бензол
Разгон
1
2
3
Превращение,
%
найдено
50
70
92
а
'
Данные Хэйпемана,
[583].
равновесное
значение
55
74
94
Шалла
и
Стивенсона
12'

180
Часть
1.
Основы
термодинамики
циклогексана
в бензол над типичным катализатором гудрифор]
(фирма
«Гудри»)
и при избыточном давлении 21 атм и мол*
отношении
водорода к нефти, равном 4.
Три
различных разгона были получены путем изменения:
пературы и объемной скорости процесса. Сравнение рассчитг
степени равновесного превращения с экспериментальными дан
при
одинаковых условиях свидетельствует о практическом
жении
равновесия на каждой стадии разгона. Данные о с
равновесного превращения были получены путем подачи в эк«
ментальную установку чистого углеводорода и анализа npoflj
его распада.
Авторы
отмечают, что выводы, полученные на oci
нии
опытов с чистыми соединениями, позволяют установить ot
ные
направления процесса распада углеводородов, однако эти
BI~
неприменимы
полностью к исходному смешанному сырью, npi
няемому на нефтеперерабатывающих заводах. 1
Используя данные по энергиям образования Гиббса, Гаст!
и
Нихолсон [578] с помощью цифровых счетных машин npoi
детальный анализ равновеспя с участием бензола и 42 метилбе!
лов.
Расчеты равновесного состава в сложных системах свя?^
с большими трудностями, однако, как показали Кандинер и Бр
(712], их можно значительно упростить путем соответствую^
подбора уравнений, связывающих определенные параметры систм
Реакция
диспропорционирования любого метилбензола привоя
к
образованию следующего ряда соединений в равновесной газов
фазе:
•*
Соединение
Бензол
Толуол
1,2- Диме тслбензол
1
,Ь-Диметил6ензол
1,4-Дпметилбеизол
1,2,3-Триметнлбензол
1,2,4-Триметилбензол
1,3,5-Триыетилбензол
1,2,3,4-Тетраметилбензол
1,2,3,5-Тетраметплбензол
1,2,4,5-Тетраметилбензол
П
ен таме тил бензол
Гексаметилбенаол
Мольная
ДОЛ»
\ V
Г
1
)
\ V
}
л
2
J
\ л-
Г
Лб
J
Л'в
Л'
7
N
t
— мольные доли i-ro соединения, находящегося в состо)
равновесия.
Концентрации изомерных соединений, образующий
в
процессе превращения, можно связать с концентрацией некоторо]
VII
При
менение
термодинамики
для
решения
промышленных
проблем
181
бранного
изомера.
Так,
например:
1,3-Диметилбензол
==Ь
1,2-Диметил
бензол
1,3-Дпметилбепзол
-=
1,4-Диметилбензол,
пе Кх
и
%
и
~ константы равновесия рассматриваемых реакций.
Концентрации
этих соединений (в квадратных скобках) можно запи-
сать так:
11,3-Диметплбевзол] = Л
т
1(
[1,
2-Дпме тил бензол] = К
х
•
[1,3-Диме
тил
бензол]
= К
х
.\
ь
[1,4-Дпметплбензол]=А'
у
- [1,3-Диметилбевзол] =
А'
у
Л'
)
.
1(э
этпх уравнений нетрудно рассчитать общую концентрацию
зиметилбенаолов:
Аналогичный
подход
к равновесию с участием три- и тетраметилбен-
эолов
позволяет уменьшить число рассматриваемых соединений
с 13 до 7 и тем самым облегчает расчет равновесного состава. Для
определения семи неизвестных концентраций требуется семь неза-
висимых уравнений. Два из этих уравнений представляют собой
уравнения материального баланса фенильного п метильвого ради-
калов в системе. Для составления этих уравнений выбирается
несколько
независимых компонентов, число которых равно числу
других
радикалов, входящих в уравнение материального баланса.
Остальные пять уравнений, приведенные в табл. VII.6, содержат
Таблица
17/,б
Использование
уравнений
химических
реакций
в
методе
Кандпнера
и
Бринкзп
а
*
[Ki\
етпл
[Nil
3(1,
2 (1,3-Диметилбеезол) + Пептаметилбекаол = 3(1.2.4-Триыетил«пзол)
[Л-,]
Данные
Кандинера и Брвнкли [7J2J.
