Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

222
Часть
2.
Термические
и
термохимические
свойства
веществ
VIII.
Термодинамические
символы,
константы,
методы
расчета
223
зовались константы, отобранные
Коэном,
Кроу и Дюмондом [240].
Как
неоднократно указывалось в тексте, точка плавления льда
была принята равной
273,15°
К. Это изменение может затронуть толь-
ко
наиболее тщательно выполненные работы по определению точек
плавления и
кипения.
Перечень основных констант и их значения,
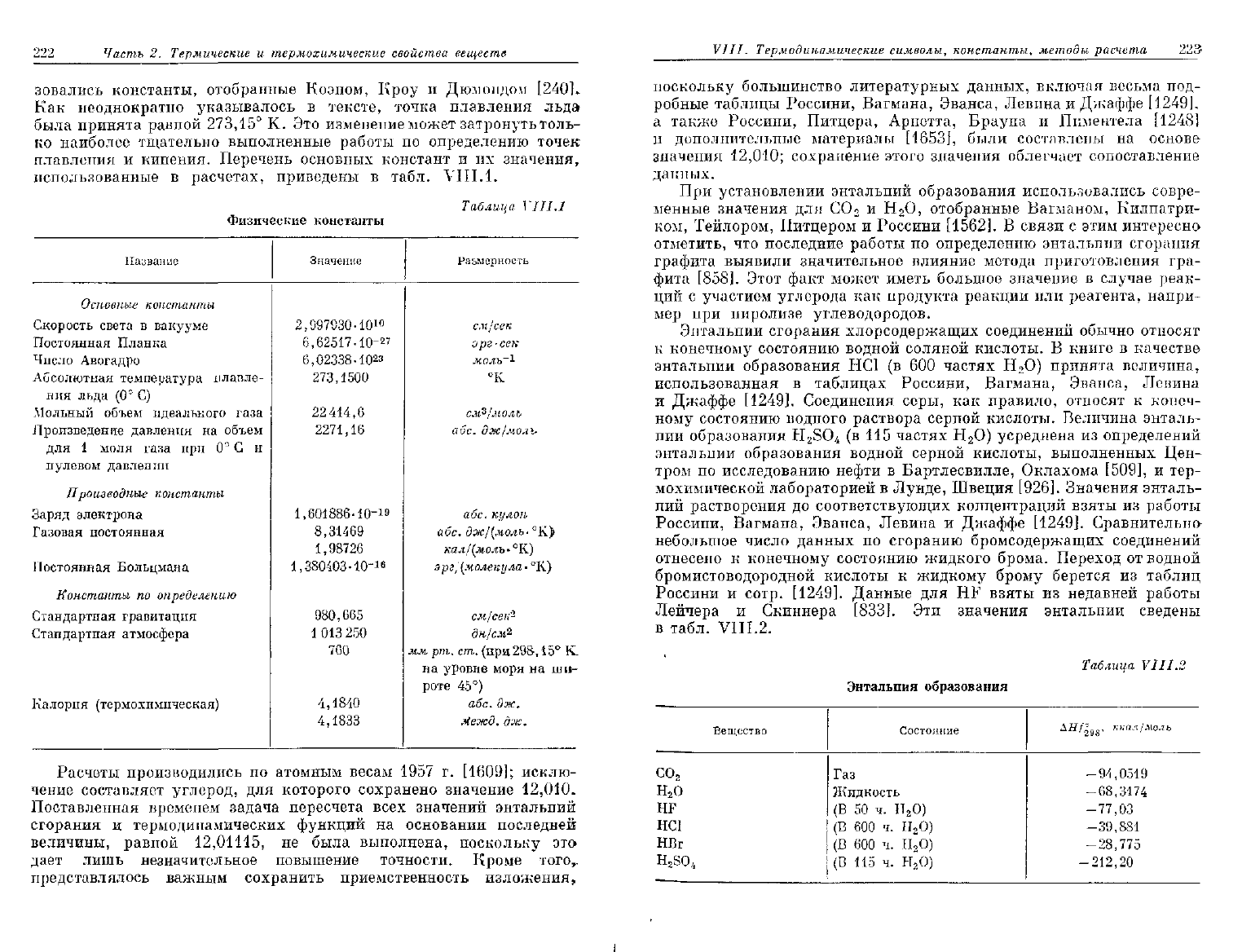
использованные в расчетах, приведены в табл. VIII. 1.
Физические
константы
Таблица
УII
1.1
Название
Основные
константы
Скорость света в вакууме
Постоянная
Планка
Число
Авогадро
Абсолютная температура плавле-
ния
льда (0° С)
Мольный
объем идеального газа
Произведение давления на объем
для 1 моля газа при 0° С и
нулевом давлении
Производные
константы
Заряд электрона
Газовая постоянная
Постоянная
Больцмана
Константы
по
определению
Стандартная гравитация
Стандартная атмосфера
Калория
(термохимическая)
Значение
2,997930-10
10
6,62517-10-27
6,02338-1023
273,1500
22 414,6
2271,16
1,601886-Ю-
1
»
8,31469
1,98726
1,380403-10-"
980,665
1
013 250
760
4,1840
4,1833
Размерность
см/сек
эрг-сек
молъ~1
°К
см^/молъ
абс.
дж/моль
абс. кулон
абс.
дж/(молъ-°К}
кал/(молъ-°К)
эрг,
(молекула
•
°К)
см/сек
2
дн/см%
мм рт. ст. (при
298,15°
К.
на
уровне моря на ши-
роте 45°)
абс.
дж.
Яежд.
дж.
Расчеты производились по атомным весам 1957 г. [1609]; исклю-
чение составляет
углерод,
для которого сохранено значение
12,010.
Поставленная временем задача пересчета
всех
значений энтальпий
сгорания и терлюдинамических функций на основании последней
величины, равной
12,01115,
не была выполнена, поскольку это
дает
лишь незначительное повышение точности. Кроме того,.
представлялось важным сохранить приемстЕенность изложения,
поскольку большинство литературных данных, включая весьма под-
робные таблицы Россини, Вагмана, Эванса, Левина и Джаффе [1249],
а также Россини, Питцера,
Арнетта,
Брауна и Шшеытела
[1248]
и
дополнительные материалы [1653], были составлены на основе
значения
12,010;
сохранение этого значения облегчает сопоставление
данных.
При
установлении энтальпий образования использовались совре-
менные значения для СО
2
и Н
2
О, отобранные Вагманом, Килпатри-
ком,
Тейлором, Питцером и Россини [1562]. В связи с этим интересно
отметить, что последние работы по определению энтальпии сгорания
графита выявили значительное влияние метода приготовления гра-
фита [858]. Этот факт может иметь большое значение в
случае
реак-
ций
с участием
углерода
как продукта реакции или реагента, напри-
мер при пиролизе углеводородов.
Энтальпии сгорания хлорсодержащих соединений обычно относят
к
конечному состоянию водной соляной кислоты. В книге в качества
энтальпии образования НС1 (в 600 частях Н
2
О) принята величина,
использованная в таблицах Россини, Вагмана, Эванса, Левина
и
Джаффе [1249]. Соединения серы, как правило, относят к конеч-
ному состоянию водного раствора серной кислоты. Величина энталь-
пии
образования H
2
SO
4
(в 115 частях Н
2
О) усреднена из определений
энтальпии образования водной серной кислоты, выполненных Цен-
тром по исследованию нефти в Бартлесвилле, Оклахома [509], и тер-
мохимической лабораторией в Лунде, Швеция [926]. Значения энталь-
пий
растворения до соответствующих концентраций взяты из работы
Россини,
Вагмана, Эванса, Левина и Джаффе [1249]. Сравнительно-
небольшое число данных по сгоранию бромсодержащих соединений
отнесено к конечному состоянию жидкого брома. Переход отводной
бромистоводородной кислоты к жидкому брому берется из таблиц
Россини
и сотр. [1249]. Данные для HF взяты из недавней работы
Лейчера и Скиннера [833]. Эти значения энтальпии сведены
в табл. VIII.2.
Таблица
VIII.2
Энтальпия
образования
Вещество
СО
2
Н
2
О
HF
НС1
НВг
H
2
SO
4
Состояние
Газ
Жидкость
(В 50 ч. Н
2
О)
(В 600 ч. Н
2
О)
(В 600 ч. Н
2
О)
(В 115 ч. Н
2
О)
ДН/£
98
,
ккал/моль
-94,0519
-68,3174
-77,03
-39,881
-28,775
-212,20

•224
Часть
2.
Термические
и
термохимические
свойства
веществ
Несмотря
на то
что данные, приведенные
в
табл. VIII.2, счита-
лись наиболее достоверными
из
всех
доступных
к
моменту сдачи
книги
в
печать, необходимо обратить внимание
на
целый ряд иссле-
дований,
проводимых
во
многих лабораториях.
В
результате
этих
работ, возможно, окажется необходимым внести соответствующие
изменения
в
приведенные здесь данные.
Машинный
расчет табличных данных
Данные химической термодинамики чаще находят практическое
применение
в
виде табулированных значений соответствующих
функций
при определенных температурах,
а не
используются каж-
дым исследователем для нахождения по уравнениям своих собствен-
ных значений при той или иной температуре. Для составления соот-
ветствующих таблиц применяется метод, основанный
на
использо-
вании
счетно-вычислительных машин. Ниже дается информация,
показывающая,
какие основные сведения, характеризующие термо-
динамические свойства того
или
иного соединения, содержатся
в
таблицах:
1. Округленные значения теплоемкостей веществ
в
состоянии
идеального газа при
1
атм для девяти температур (298,15, 300, 400,
500, 600, 700, 800, 900
и
1000°
К)
*.
2. Практические величины энтропии веществ
в
состоянии идеаль-
ного газа при
1
атм
и
298,15°
К.
3. Величины энтальпии образования соединений
в
состоянии
идеального газа при
1
атм
и
298,15°
К.
4. Виды атомов
и их
число
в
каждом конкретном соединении.
5. Данные, характеризующие элементы, используемые при рас-
четах
(в этой главе): а) грамм-атомный вес, б) практические величины
грамм-атомной энтропии при каждой из девяти температур
и
в) вели-
чины
грамм-атомной энтальпии при каждой
из
девяти температур
и
ее
стандартное значение при
298,15°
К.
В книге рассматриваются элементы С, Н, Br, Cl,
F, I, N, О и S.
Соответствующие значения величин, указанных
в
пунктах
1—5,
переносились
на
перфокарту как исходные данные для электронно-
счетпой машины типа «Барроус
5500».
Для последующего исполь-
зования
при расчетах величины, определяемые пунктом
5
(данные
об элементах), сохранялись
в
блоке памяти электронно-счетной
машины.
Данные, указанные
в
пунктах 1—4, вводились
в
электрон-
* Органические реакции
редко
проводятся при
температурах
выше
1000°
К.
И
хотя
в
литературе
часто
указываются
значения для
более
высоких
темпера-
тур,
вплоть
до
1500
J
К,
они
не
находят
практического применения, поскольку
промышленные процессы
в
химии органических соединений
осуществляются
при
температурах,
не
превышающих
1000°
К
(исключение
составляет,
пожалуй,
только
крекинг насыщенных
углеводородов
с
целью
получения этилена
и
аце-
тилена).
VIII.
Термодинамические
символы,
константы,
методы
расчета
225
но-счетную машину. Из значений теплоемкостей при 300, 400
и
500°
К
вычислялись коэффициенты квадратного уравнения (11.13),
как
указано
на стр. 64.
Изменения энтальпии
Н°
300
—H°
2SS
и
Н'
Ы0
~—Н
о
зт
рассчитывались путем интегрирования теплоемкости
в
соответствии
с уравнением (11.17); таким образом были получены значения энталь-
пии
при 300
и
400°
К. Соответствующие изменения энтропии рассчи-
тывались путем интегрирования данных по теплоемкостям согласно
уравнению
(IV.25)
и прибавлялись
к
значению, указанному
в
пункте
2
(практическая
энтропия при
298,15°
К),
а
это
и
дает
значения энтро-
пии
при 300 и
400°
К. Затем вычислялись значения приведенной
функции
энергии Гиббса при
300 и
400°
К по
уравнению
(G°
T
—H°
W
)
(H°
T
—H
o
2gs
)
У
=
о
г
—IUUU
У •
Здесь Т — абсолютная температура
для
данного расчета,
а
1000 —
коэффициент
перехода
от
килокалорий
к
калориям. Энтальпии обра-
зования
при
300 и
400°
К рассчитываются
по
формуле
=
AIIfl
ss
-\-(Hj—#29в)
(соединение)—
—Нш) (элементы),
где суммирование производится
по
элементам, входящим
в
состав
данного соединения.
Стандартная энергия Гиббса образования
1
моля вещества
рас-
считывается
по
соотношению
Входящая
в это
соотношение величина
ASfr
— стандартная энтро-
пия
образования данного соединения из элементов при Г°К—вычис-
ляется
по
уравнению
p—Sy
(соединение) —
^
^(элементы).
При
этом суммируются энтропии
всех
элементов, образующих дан-
ное
соединение.
Обычный логарифм стандартной константы равновесия, выражае-
мой
через давления, рассчитывается
по
уравнению
—AGf
T
0j004575845r
.
Затем
на
основании определяемых
в
пункте
1
данных
о
теплоемко-
стях при 400.
500 и
600°
К
рассчитываются коэффициенты уравне-
ния
(11.13),
как
указано выше,
и
получают значения изменений
энтальпии
и
энтропии, относящиеся
к
400°
К. Эти величины при-
бавляются
к
значениям для
400°
К и
дают
новые значения уже
для
500°
К. Таким
же
образом последовательно вычисляются значе-
ния
ДЯ/°,
/\Sf и lg Kp для
более высоких температур, вплоть
До
1000°
К. Молекулярный вес рассчитывается
по
данным, указан-
ным
в
пунктах
4 и 5а.
15-831
226
Часть 2. Термические и термохимические свойства веществ
Такой метод расчета термодинамических функций позволяет
получать таблицы, отличающиеся высокой внутренней согласован-
ностью. Если доступны точные данные
по
теплоемкостям,
то и для
производных функций получаются точные значения.
В
табл. VIII.3
Таблица
VIII.3
Термодинамические функции бензола
Г,
°К
298
300
400
500
600
700
800
900
1000
Л"
— Н° ,
ккал/моль
данные Россини
и
сотр.
[1248]
0,000
0,036
2,361
5,349
8,884
12,866
17,211
21,859
26,762
рассчитано
по
описанному
методу
0,00
0,04
2,36
5,35
8,89
12,87
17,21
21,86
26,76
S°, мга.1/(.чоль-°К)
данные Россини
и
сотр
[
1248]
64,34
64,46
71,10
77,74
84,17
90,30
96,10
101,57
106,73
рассчитано
по
описанному
методу
64,34
64,46
71,11
77,75
84,18
90,31
96,10
101,58
106,74
значения
термодинамических функций бензола, рассчитанные
по
вышеописанному
методу,
сравниваются
с
соответствующими данными,
вычисленными Россини, Питцером, Арнеттом, Брауном
и
Пименте-
лом
[1248]
непосредственно
из
молекулярных
и
спектроскопических
констант. Соответствие данных вполне удовлетворительное.
В то
же время
следует
отметить,
что
ошибки, допущенные
при
опре-
делении теплоемкостей, должны сказываться
на
всех
значениях,
даваемых
в
таблице. Приводимые
в
работе Россини
и
сотрудников
данные
по
теплоемкостям
для
к-алкилзамещенных циклопентанов
(более высоких,
чем
метилзамещенный), по-видимому, неточны.
В табл. VIII.4 указаны значения
Ср, АСр и
А
2
Ср
для
метилци-
клопентана
и
этилциклопентана. Значения
для
этилпроизводного
при
400°
К,
очевидно, слишком завышены. Учитывая такие откло-
нения,
в
этом
случае
не
следует
ожидать столь
же
хорошего соот-
ветствия величин производных термодинамических функций,
как
для бензола. Значения энтальпии
и
энтропии, полученные
по
описан-
ной
выше программе, сравниваются
в
табл. VIII.5
с
соответствую-
щими
данными Россини
и
сотрудников; таблица выявляет ожидаемые
отклонения.
В
данных Россини
и
сотрудников были обнаружены
и
другие
очевидные расхождения такого
же
типа, однако
в
боль-
шинстве случаев различия
в
величинах
не
столь серьезны.
Авторы
тщательно выверили исходные данные
и
проконтроли-
ровали перфорирование, чтобы обеспечить точность табулирования
Таблица
VIII.4
Теплоемкости
двух
алкилциклопентанов
а
)
300
400
500
600
700
800
900
1000
Метилциклопеитан
Ср
26,46
36,11
44,94
52,43
58,68
64,00
68,53
72,44
АСр
9,65
8,83
7,49
6,25
5,32
4,53
3,91
Д2С'л
-0,82
-1,34
-1,24
-0,93
-0,79
-0,62
Этилциклопентан
Ср
31,75
43,89
53,03
61,70
69,02
75,22
80,54
85,16
АСр
12,14
9,14
8,67
7,32
6,20
5,32
4,62
Д2Ср
-3,00
-0,47
-1,35
-1,12
-0,88
-0,70
а
) Данные Россини
и
сотр. [1248].
Таблица
VIII.5
Термодинамические функции этилциклопентана
г,
°к
298
300
400
500
600
700
800
900
1000
—
Н" —
#29;)'
ккал
/
м
°ЛЬ
данные Россини
и
сотр.
[1248]
0,000
0,063
3,791
8,592
14,337
20,898
28,103
35,913
44,187
рассчитано
по
описанному
методу
0,00
0,06
3,87
8,72
14,46
21,01
28,23
36,02
44,31
S°, кал/(могь-°К)
данные Россини
и
сотр.
[1248]
90,42
90,64
101,40
112,18
122,69
132,85
142,53
151,71
160,42
рассчитано
по
описанному
методу
90,42
90,62
101,48
112,27
122,72
132,80
142,43
151,60
160,33
15*
228
Часть
2.
Термические
и
термохимические
свойства
веществ
счетной машиной. При частом использовании электронно-счетной
машины
контроль
за ее
работой можно осуществлять
с
помощью
специальной
системы, которая позволяет немедленно обнаружи-
вать ошибки, допускаемые машиной.
Авторы
выявили больше оши-
бок,
сделанных людьми, чем ошибок машины. Указания
на
любые
погрешности, которые, возможно, обнаружатся
в
этой книге,
будут
приняты
авторами
с
признательностью.
Стандартные состояния элементов
Обычно
в
качестве стандартного состояния элемента (простого
вещества) выбирается такое состояние, при котором данный элемент
устойчив при 1 атм. Выбор стандартного состояния для шести из рас-
сматриваемых здесь девяти элементов очевиден
—
углерод
в
виде
графита, водород, кислород, азот, фтор
и
хлор
в
состоянии идеаль-
ного двухатомного газа при
1
атм
во
всем интервале температур
от 298
до
1000°
К. Бром, иод
и
сера стабильны
в
конденсированных
фазах при
1
атм
в
интервале температур
от
298°
К
до точек кипения
этих элементов. Поэтому мы приняли
в
качестве стандартных состоя-
ний
эти
конденсированные фазы
до
нормальных точек кипения,
а выше этих температур
—
состояния идеального двухатомного
газа. Необходимо отметить, что это обусловливает при температурах
фазовых переходов разрыв непрерывности изменения энтальпии
образования
всех
соединений,
в
состав которых
входят
данные эле-
менты.
В
случае
серы наблюдается также небольшой разрыв непре-
рывности изменения энергии Гиббса
для
процессов образования,
поскольку пар, находящийся
в
равновесии
с
жидкой серой при тем-
пературе кипения, представляет собой сложную смесь многоатом-
ных молекул
S
x
(ж=4,
6, 8,
причем возможны
и
другие
значения).
Испарение
с
образованием молекул
S
2
при
1
атм
и
717,75°
К
не
является равновесным процессом
и.
следовательно, связано
с изменением энергии Гиббса.
Можно
было бы исключить такого рода скачки
в
изменении свойств,
приняв
в
качестве стандартного состояния состояние идеального
двух-
атомного газа во всем интервале температур
от
298 до
1000°
К, однако
это
привело
бы к
путанице
в
интерпретации энтальпии
и
энергии
Гиббса для процессов образования, поскольку выбранное стандарт-
ное
состояние значительно отличалось
бы от
состояния, встречаю-
щегося
на
практике. Такие осложнения привели
бы к
значительно
большей путанице, чем скачки
в
изменении свойств, обусловленные
выбором тех или иных стандартных состояний. Преимущество выбран-
ных стандартных состояний состоит также
и в
том,
что
они
при
298°
К
идентичны
с
теми состояниями, которые были приняты Рос-
сини,
Вагманом, Эвансом, Левином
и
Джаффе [1249]. Значениями,
принятыми
в
результате
расчетов этих авторов, можно непосред-
ственно пользоваться наряду
со
значениями, указанными
в
данной
f VIII.
Термодинамические
символы,
константы,
методы
расчета
229
| книге,
без
утомительных
и
сложных пересчетов, обусловленных
* различием
в
стандартных состояниях.
№
1.
Углерод
(графит), С (твердое состояние).
Ат.
вес
12,010
Г,
"К
298
300
400
500
600
700
800
900
1000
кал/(люль-°К)
Ср°
2,066
2,083
2,851
3,496
4,030
4,430
4,750
4,980
5,140
s°
1,361
1,374
2,081
2,788
3,474
4,127
4,740
5,314
5,846
-<G"-Hj,
8
)/r
1,361
1,361
1,453
1,649
1,896
2,169
2,453
2,739
3,023
ккал]моль
Н
°-
Н
298
0,000
0,004
0,251
0,569
0,947
1,370
1,830
2,318
2,823
дя/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
AGf
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Ig Кр~
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Недавние обзоры, выполненные Келли [736, 738]
и
составителями
термохимических таблиц [1435],
не
выявили значительных измене-
ний
в
термодинамических функциях графита по сравнению со сводкой
Россини,
Питцера,
Арнетта,
Брауна
и
Пиментела [1248]. Поэтому
нами
приняты значения для стандартного состояния, которые были
даны
в
работе Россини
и
сотрудников. Это имеет
то
преимущество,
что предлагаемые здесь таблицы сопоставимы
с
подробными
таб-
лицами
Исследовательского проекта
44
Американского нефтяного
института. Атомный
вес
углерода,
принятый Россини
и
сотрудни-
ками,
также
не
был изменен
во
избежание необходимого пересчета
всех
таблиц Американского нефтяного института без сколько-нибудь
значительного повышения точности.
№
2.
Водород, Н
2
(состояние идеального двухатомного газа).
Мол.
вес
2,0160
298
300
400
500
600
700
800
900
1000
кал/(моль
-°К)
Ср°
6,892
6,895
6,974
6,993
7,008
7,035
7,078
7,139
7,217
8°
31,211
31,253
33,250
34,809
36,085
37,167
38,108
38,946
39,704
-(G°-H°
98
)/r
31,211
31,211
31,482
31.997
32,575
33,156
33,707
34,253
34,762
ккал/моль
я
°-
я
»ч
0,000
0,013
0,707
1,406
2,106
2,808
3,514
4,224
4,9i2
ЛН/°
0,000
0,000
0,000
0,000
0,000
0,000
'
и,
ооо
0,000
0,и00
ДО/
0
0,000
0,000
0,000
0,000
0,000
0,000
о,соо
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
230
Часть
2.
Термические
и
термохимические
свойства
веществ
Термодинамические функции для водорода также взяты из обзора
Россини,
Питцера,
Арнетта,
Брауна и Пиментела
[1248]
с тем, чтобы
можно было сопоставлять данные для углеводородов с более подроб-
ными табличными данными. В значительной части, если не пол-
ностью, приводимые значения основаны на
результатах
тщательной
работы, выполненной Вулли, Скоттом и Брикуеддо*м [1630]. Рос-
сини,
Вагман, Эванс, Левин и Джаффе
[1249]
указывают следующие
значения: Ttp =
13,96°
К,
АНт°
=
0,028
ккал/молъ,
ТЪ =
20,39°
К
и
AHv = 0,216
ккал/молъ.
№
3. Бром, Вг
2
(жидкость от 298 до
332,62°
К; состояние идеального
двухатомного газа от
332,62
до
1000°
К). Мол. вес
159,832
298
300
400
500
600
700
800
900
1000
кал/(люль
°К)
Ср°
18,090
18,077
8,775
8,857
8.908
8,944
8,970
8,992
9,011
S
36,384
36,496
61,2«3
63,172
64,791
66,167
67,363
68,421
69,370
-<G°-ff|
Bg
)/T
36,384
36,384
40,520
44,860
48,051
50,543
52,573
54,276
55,739
ккал/моль
Н
°~~
Н
298
0,000
0,033
8,273
9,156
10,044
10,937
11,833
12,731
13,631
дя/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
AG/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
]g Kp
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Сводка термодинамических функций элементарного брома была
недавно опубликована в Термохимических таблицах [1435]. Данные
о теплоемкости при низких температурах и энтальпии плавления
сообщались Хильдебрандом, Крамером, Мак-Доналдом и Сталлом
[596]. Термодинамические функции для состояния идеального газа
были рассчитаны на основании спектроскопических данных, при-
веденных в работе Герцберга [590], и они хорошо согласуются с соот-
ветствующими значениями, вычисленными Эвансом, Мансоном и Ваг-
маном [398]. После этого термодинамические функции для жидкого
и
газообразного состояния были использованы в сочетании с дан-
ными о давлении паров для расчета величины энтальпии испарения
при
298°
К по методам, основанным на третьем законе термодина-
мики.
Данные Фишера и Бингла [428], а также Шеффера и Воогда
[1280]
показывают, что расчетные значения
Hvl
Q&
сильно зависят
от температуры,
тогда
как данные Рамсея и Юнга
[1212]
свидетель-
ствуют
лишь о незначительной температурной зависимости, что
в среднем хорошо согласуется с калориметрическим значением, ука-
занным Хильденбрандом и сотр. [596]. Приведенные здесь стандарт-
VIII.
Термодинамические
символы,
константы,
методы
расчета
231
ные значения получены на основании калориметрически установлен-
ной
величины 7,39
ккал/молъ.
По расчетным данным точка кипения
332,62°
К.
т,
°к
298
300
400
500
600
700
800
900
1000
№ i
и
Хлор,
С1
2
(состояние
идеального
двухатомного
газа).
Мол.
вес 70,914
кал/(моль'"К)
8,111
8,119
8,437
8,624
8,741
8,821
8,878
8,922
8,956
s°
53,289
53,339
55,724
57,628
59,212
60,565
61,747
62,796
63,737
-<
G
°-
H
29
8
)/
r
53,289
53,289
53,612
54,231
54,933
55,643
56,334
56,995
57,623
ккал/моль
Н
°-
Н
298
0,000
0,015
0,845
1,698
2,567
3,445
4,331
5,221
6,115
дн/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
AG/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
lgJfp
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Мы приняли термодинамические функции, сравнительно недавно
рассчитанные Поттером
[1183]
путем прямого суммирования по энер-
гетическим уровням молекулы хлора. Предшествующие расчеты,
выполненные Эвансом, Мансоном и Вагманом [398] менее строгими
методами, приводили к результатам, мало отличающимся в инте-
ресующей нас области температур. Россини, Вагман, Эванс, Левин
и
Джаффе
[1249]
приводят следующие значения:
Ттп
=
172,16°
К,
АНтп°
= 1,531 ккал/моль, ТЪ =
239,10°
К и AHv =
4,878
ккал/молъ.
№
5.
Фтор,
F
2
(состояние
идеального
двухатомного
газа).
Мол. вес 38,00
т, °к
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
7,490
7.498
7,900
8,207
8,429
8,591
8,713
8,808
8,885
s°
48,447
48,493
50,707
52,505
54,022
55,334
56,489
57,521
58,453
-(G'-B'
Mt
)/T
48,447
48,447
48,746
49,324
49,983
50,656
51,314
51,948
52,553
ккал/моль
H
°~
H
298
0,000
0,014
0,784
1,591
2,423
3,274
4,140
5,016
5,901
дя/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
AGf°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
lg Кр
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
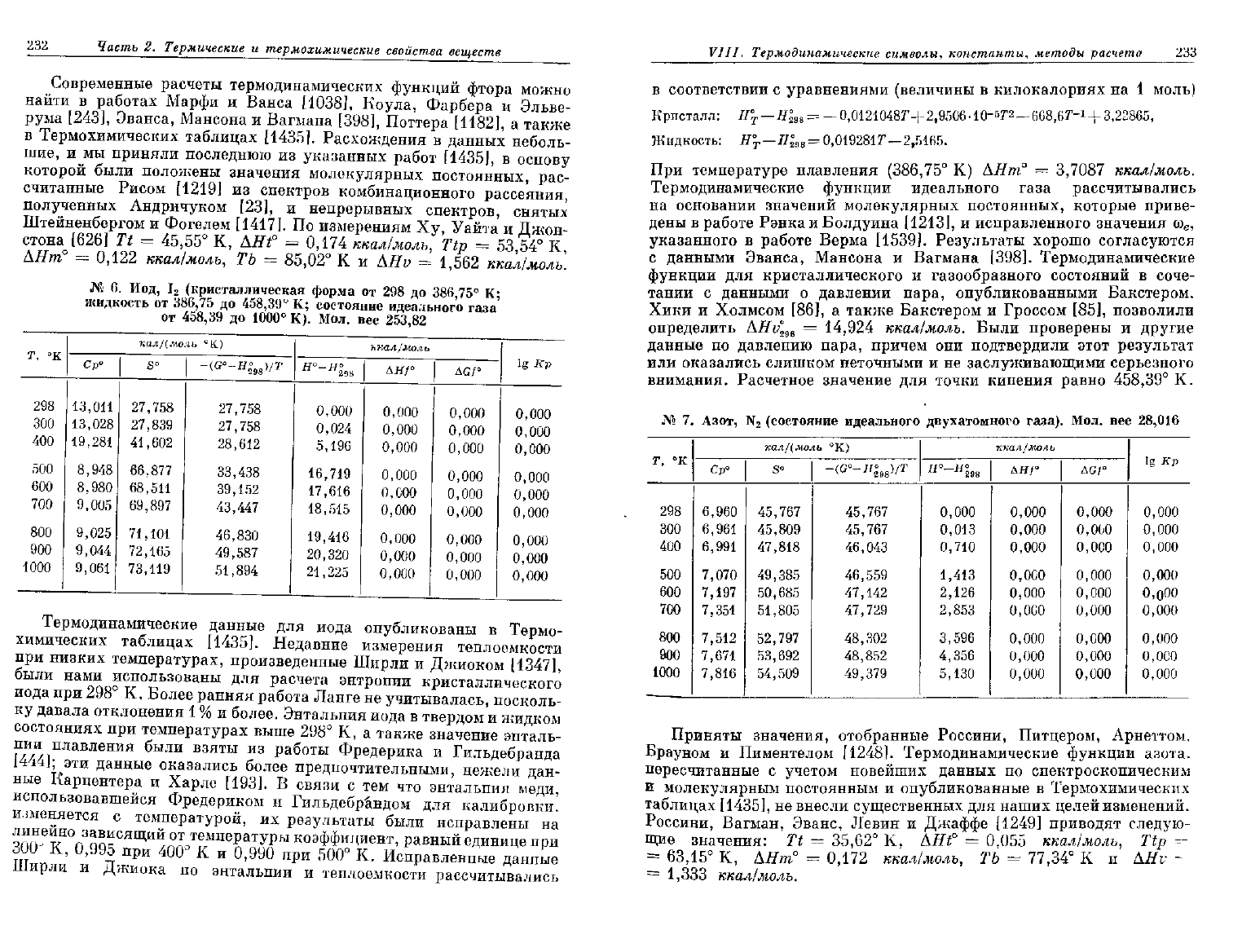
232
Часть
2. Термические и
термохимические
свойства
веществ
Современные расчеты термодинамических функций фтора можно
найти в работах Марфи и Ванса [1038], Коула, Фарбера и Эльве-
рума [243], Эванса, Мансона и Вагмана [398], Поттера [1182], а также
в Термохимических таблицах [1435]. Расхождения в данных неболь-
шие,
и мы приняли последнюю из указанных работ [1435], в основу
которой были положены значения молекулярных постоянных, рас-
считанные Рисом
[1219]
из спектров комбинационного рассеяния,
полученных Андричуком [23], и непрерывных спектров, снятых
Штейненбергом и Фогелем [1417]. По измерениям Ху, Уайта и Джон-
стона [626] Tt =
45,55°
К, AHf = 0,174 ккал/молъ, Ttp =
53,54°
К,
АНт°
= 0,122 ккал/молъ, ТЬ =
85,02°
К и AHv = 1,562 ккал/молъ.
№
6. Иод, 1
2
(кристаллическая форма от 298 до
386,75°
К;
жидкость от
386,75
до
458,39°
К; состояние идеального газа
от
458,39
до
1000°
К). Мол. вес
253,82
VIII.
Термодинамические
символы,
константы,
методы
расчета
233
298
300
400
500
600
700
800
900
1000
пал/(моль °К)
Ср°
13,011
13,028
19,281
8,948
8,980
9,005
9,025
9,044
9,061
1
S"
27,758
27,839
41,602
66,877
68,511
69,897
71,101
72,165
73,119
27,758
27,758
28,612
33,438
39,152
43,447
46,830
49,587
51,894
ккал/моль
Н
°~
Н
298
0,000
0,024
5,196
16,719
17,616
18,515
19,416
20,320
21,225
дн/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
1
AG/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
lg Кр
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Термодинамические данные для иода опубликованы в Термо-
химических таблицах [1435]. Недавние измерения теплоемкости
при
низких температурах, произведенные Ширли и Джиоком [1347],
были нами использованы для расчета энтропии кристаллического
иода при
298°
К. Более ранняя работа Ланге не учитывалась, посколь-
ку давала отклонения 1 % и более. Энтальпия иода в твердом и жидком
состояниях при температурах выше
298°
К, а также значение энталь-
пии
плавления были взяты из работы Фредерика и Гильдебранда
[444]; эти данные оказались более предпочтительными, нежели дан-
ные Карпентера и Харле [193]. В связи с тем что энтальпия меди,
использовавшейся Фредериком и Гильдебр&ндом для калибровки,
вменяется с температурой, их результаты были исправлены на
линейно
зависящий от температуры коэффициент, равный единице при
300
J
К,
0,995
при
400°
К и
0,990
при
500°
К. Исправленные данные
Ширли
и Джиока по энтальпии и теплоемкости рассчитывались
в соответствии с уравнениями (величины в килокалориях на 1 моль)
Кристалл:
Н°
Т
—H°
2sa
= —
0,012104874-2,9506-Ю"^
—668,6т
7
-
1
+
3,22865,
Жидкость: #^—Я£
98
=
0,0192817—2,5165.
При
температуре плавления
(386,75°
К)
АНтп°
=
3,7087
ккал/молъ.
Термодинамические функции идеального газа рассчитывались
на
основании значений молекулярных постоянных, которые приве-
дены в работе
Рэнка
и Болдуина [1213], и исправленного значения со
е
,
указанного в работе Верма [1539]. Результаты хорошо согласуются
с данными Эванса, Мансона и Вагмана [398]. Термодинамические
функции
для кристаллического и газообразного состояний в соче-
тании с данными о давлении пара, опубликованными Бакстером,
Хики и Холмсом [86], а также Бакстером и Гроссом [85], позволили
определить
AHv°
M8
=
14,924
ккал/молъ. Были проверены и другие
данные по давлению пара, причем они подтвердили этот результат
или оказались слишком неточными и не заслуживающими серьезного
внимания.
Расчетное значение для точки кипения равно
458,39°
К.
JV» 7.
Азот,
N
2
(состояние идеального двухатомного газа). Мол. вес
28,016
Т, °К
298
300
400
500
600
700
800
900
1000
кал/(моль °К)
Ср°
6,960
6,961
6,991
7,070
7,197
7,351
7,512
7,671
7,816
S»
45,767
45,809
47,818
49,385
50,685
51,805
52,797
53,692
54,509
-(
GO
-
H
2
%8>/
r
45,767
45,767
46,043
46,559
47,142
47,729
48,302
48,852
49,379
ккал/моль
ЕГО ГГО
Ы
~
Й
298
0,000
0,013
0,710
1,413
2,126
2,853
3,596
4,356
5,130
дя/°
0,000
0,000
0,000
0,000
0,000
о.осо
0,000
0,000
0,000
AG]°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Ig Кр
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Приняты
значения, отобранные Россини, Питцером, Арнеттом.
Брауном и Пиментелом [1248]. Термодинамические функции азота,
пересчитанные с учетом новейших данных по спектроскопическим
и
молекулярным постоянным и опубликованные в Термохимических
таблицах [1435], не внесли существенных для наших целей изменений.
Россини,
Вагман, Эванс, Левин и Джаффе
[1249]
приводят следую-
щие значения: Tt =
35,62°
К, AHf =
0,055
ккал/молъ, Ttp =-
=
63,15°
К,
AHnf
= 0,172 ккал/молъ, ТЬ =
77,34°
К и AHv ~
=
1,333 ккал/молъ.
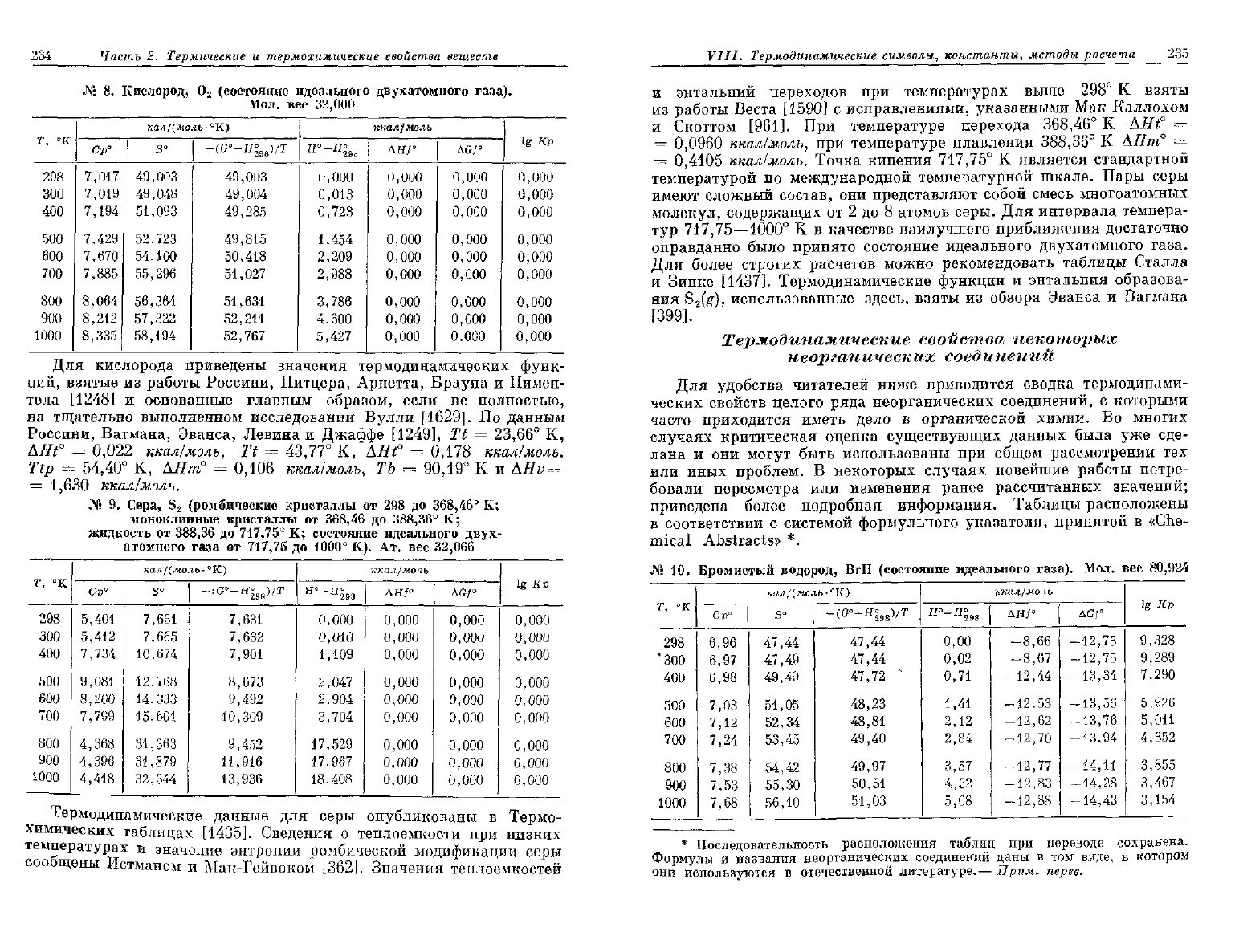
234
Часть
2.
Термические
и
термохимические
свойства
веществ
№
8.
Кислород,
0
2
(состояние
идеального
двухатомного
газа).
Мол.
вес
32,000
т,
°к
298
300
400
500
600
700
800
900
1000
кал/(люль-°К)
Ср°
7,017
7,019
7,194
7,429
7,670
7,885
8,064
8,212
8,335
s°
49,003
49,048
51,093
52,723
54,100
55,296
56,364
57,322
58,194
-(С-Я$
и
)/Г
49,003
49,004
49,285
49,815
50,418
51,027
51,631
52,211
52,767
ккал]моль
0,000
0,013
0,723
1,454
2,209
2,988
3,786
4.600
5,427
АН/»
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
AG/°
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0.000
lg
Kp
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
Для кислорода приведены значения термодинамических функ-
ций,
взятые
из
работы Россини, Питцера, Арнетта, Брауна
и
Пимен-
тела
[1248]
и
основанные главным образом, если
не
полностью,
на
тщательно выполненном исследовании Вулли [1629].
По
данным
Россини,
Вагмана, Эванса, Левина
и
Джаффе [1249],
Tt =
23,66°
К,
AHf
=
0,022
ккал/молъ,
Tt =
43,77° К,
AHf =
0,178
ккал/молъ.
Ttp
=
54,40° К,
АНтп°
=
0,106
ккал/молъ,
ТЪ
=
90,19°
К и
=
1,630
ккал/молъ.
№
9.
Сера,
S
2
(ромбические
кристаллы
от 298 до
368,46°
К;
моноклинные
кристаллы
от
368,46
до
388,36°
К;
жидкость
от
388,36
до
717,75°
К;
состояние
идеального
двух-
атомного
газа
от
717,75
до
1000°
К).
Ат. вес
32,066
Г,
"К
298
300
400
500
600
700
800
900
1000
кал/(молЬ'°К)
Ср°
5,401
5,412
7,734
9,081
8,200
7,799
4,368
4,396
4,418
СО
7,631
7,665
10,674
12,768
14,333
15,601
31,363
31,879
32,344
-<
С
°-
Я
29
8
>/
Т
7,631
7,632
7,901
8,673
9,492
10,309
9,452
11,916
13,936
ккал/могь
0,000
0,010
1,109
2,047
2.904
3,704
17,529
17,967
18,408
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,000
lg
Кр
0,000
0,000
0,000
0,000
0.000
0,000
0,000
0,000
0,000
Термодинамические данные
для
серы опубликованы
в
Термо-
химических таблицах [1435]. Сведения
о
теплоемкости
при
низких
температурах
и
значение энтропии ромбической модификации серы
сообщены Истманом
и
Мак-Гейвоком [362]. Значения теплоемкостей
VIII.
Термодинамические
символы, константы,
методы
расчета
235
и
энтальпий переходов
при
температурах выше
298°
К
взяты
из
работы Веста
[1590]
с
исправлениями, указанными Мак-Каллохом
и
Скоттом [961].
При
температуре перехода
368,46°
К AHf —
—
0,0960
ккал/молъ,
при
температуре плавления
388,36°
К
АНт°
=
=
0,4105
ккал/молъ. Точка кипения
717,75°
К
является стандартной
температурой
по
международной температурной шкале. Пары серы
имеют сложный состав,
они
представляют собой смесь многоатомных
молекул, содержащих
от 2
до
8
атомов серы.
Для
интервала темпера-
тур
717,75—1000°
К в
качестве наилучшего приближения достаточно
оправданно было принято состояние идеального двухатомного газа.
Для более строгих расчетов можно рекомендовать таблицы Сталла
и
Зинке [1437]. Термодинамические функции
и
энтальпия образова-
ния
S
2
(g),
использованные здесь, взяты
из
обзора Эванса
и
Вагмана
[399].
Термодинамические свойства некоторых
неорганических соединений
Для удобства читателей ниже приводится сводка термодинами-
ческих свойств целого ряда неорганических соединений,
с
которыми
часто приходится иметь дело
в
органической химии.
Во
многих
случаях критическая оценка существующих данных была
уже
сде-
лана
и
они
могут
быть использованы
при
общем рассмотрении
тех
или
иных проблем.
В
некоторых случаях новейшие работы потре-
бовали пересмотра
или
изменения ранее рассчитанных значений;
приведена более подробная информация. Таблицы расположены
в
соответствии
с
системой формульного указателя, принятой
в
«Che-
mical
Abstracts»
*.
JVs
10.
Бромистый водород,
ВгН
(состояние идеального газа). Мол.
вес
80,924
т,
°к
298
"300
400
500
600
700
800
900
1000
кал/(моль
'°К)
Ср°
6,96
6,97
6,98
7,03
7,12
7,24
7,38
7,53
7,68
S"
47,44
47,49
49,49
51,05
52,34
53,45
54,42
55,30
56,10
-(
G
°-
H
29
8
Vr
47,44
47,44
47,72
"
48,23
48,81
49,40
49,97
50,51
51,03
пкал/мо
tb
Н
°-
Н
298
0,00
0,02
0,71
1,41
2,12
2,84
3,57
4,32
5,08
АН/°
-8,66
-8,67
-12,44
-12.53
-12,62
-12,70
-12,77
-12,83
-12,88
-12,73
-12,75
-13,34
-13,56
-13,76
-13,94
-14,11
-14,28
-14,43
lg
Кр
9,328
9,289
7,290
5,926
5,011
4,352
3,855
3,467
3,154
*
Последовательность
расположения
таблиц
при
переводе
сохранена.
Формулы
и
названия
неорганических
соединений
даны
в том
виде,
в
котором
они
используются
в
отечественной
литературе.—
Прим. перев.
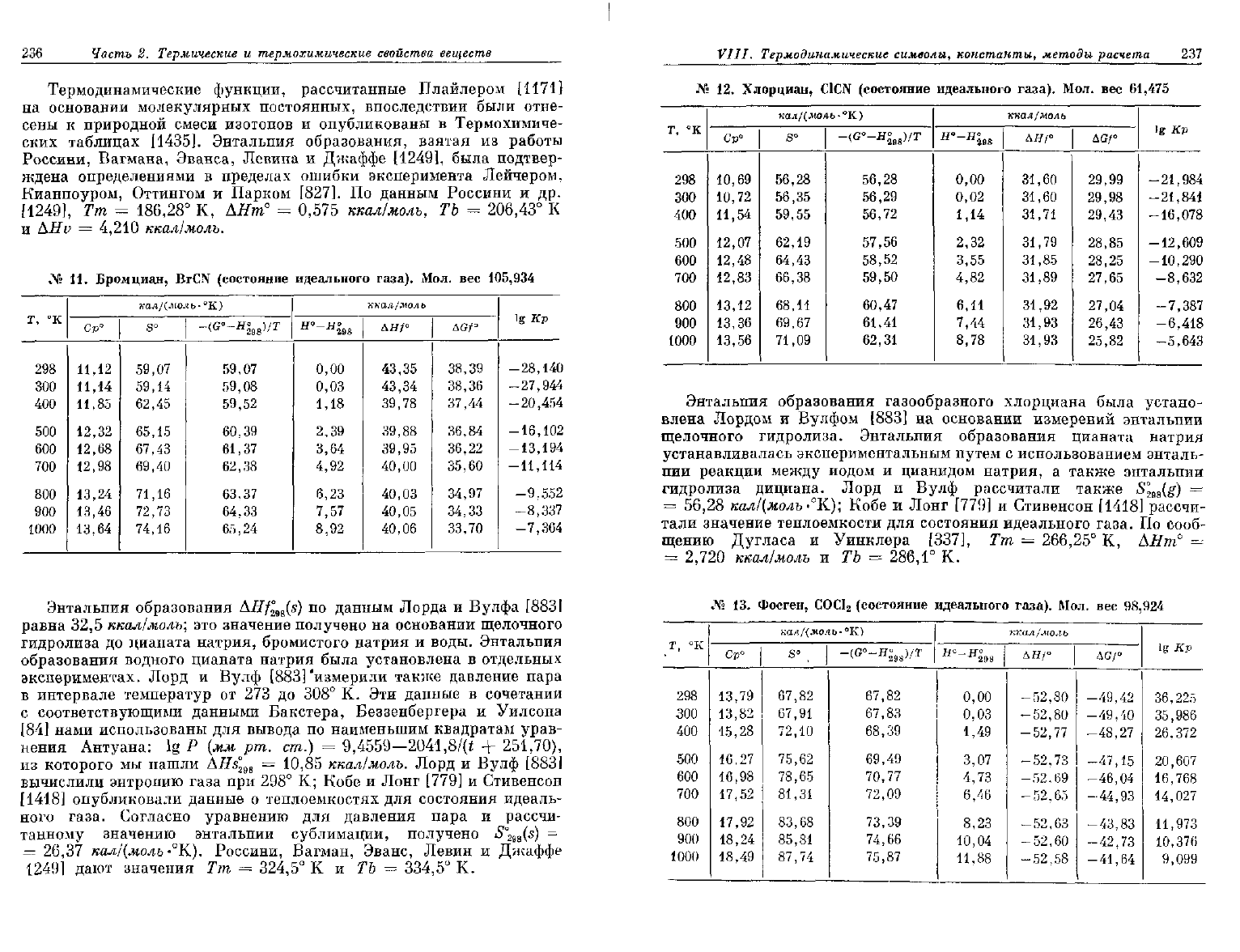
236
Часть
2. Термические и
термохимические
свойства
веществ
Термодинамические функции, рассчитанные Плайлером
[1171}
на
основании молекулярных постоянных, впоследствии были отне-
сены
к
природной смеси изотопов
и
опубликованы
в
Термохимиче-
ских таблицах [1435]. Энтальпия образования, взятая
из
работы
Россини,
Вагмана, Эванса, Левина
и
Джаффе [1249], была подтвер-
ждена определениями
в
пределах ошибки эксперимента Лейчером,
Кианпоуром, Оттингом
и
Парком [827].
По
данным Россини
и др.
[1249],
Тт =
186,28°
К,
АНт°
=
0,575
ккал/моль,
ТЪ =
206,43°
К
и
AHv = 4,210
ккал/молъ.
№
11.
Бромциан,
BrCN
(состояние
идеального
газа).
Мол. вес
105,934
Г,
°К
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
11,12
11,14
11,85
12,32
12,68
12,98
13,24
13,46
13,64
s°
59,07
59,14
62,45
65,15
67,43
69,40
71,16
72,73
74,16
-(в'-Н'
ш
)/Т
59,07
59,08
59,52
60,39
61,37
62,38
63,37
64,33
65,24
икал/моль
0,00
0,03
1,18
2,39
3,64
4,92
6,23
7,57
8,92
AHf
43,35
43,34
39,78
39,88
39,95
40,00
40,03
40,05
40,06
AGf
38,39
38,36
37,44
36,84
36,22
35,60
34,97
34,33
33,70
lg Кр
-28,140
-27,944
-20,454
-16,102
-13,194
-11,114
-9,552
-8,337
-7,364
VIII.
Термодинамические
символы,
константы,
методы
расчета
237
№
12.
Хлорциан,
C1CN
(состояние
идеального
газа).
Мол. вес
61,475
Т, °К
298
300
400
500
600
700
800
900
1000
кал/(молЬ'°К)
Ср°
10,69
10,72
11,54
12,07
12,48
12,83
13,12
13,36
13,56
s°
56,28
56,35
59,55
62,19
64,43
66,38
68,11
69,67
71,09
56,28
56,29
56,72
57,56
58,52
59,50
60,47
61,41
62,31
ккал/моль
Н
°~
Н
298
0,00
0,02
1,14
2,32
3,55
4,82
6,11
7,44
8,78
дя/°
31,60
31,60
31,71
31,79
31,85
31,89
31,92
31,93
31,93
AGf°
29,99
29,98
29,43
28,85
28,25
27,65
27,04
26,43
25,82
lg Кр
-21,984
-21,841
-16,078
-12,609
-10,290
-8,632
-7,387
-6,418
-5,643
Энтальпия образования газообразного хлорциана была устано-
влена Лордом
и
Вулфом
[883] на
основании измерений энтальпии
щелочного гидролиза. Энтальпия образования цианата натрия
устанавливалась экспериментальным путем
с
использованием энталь-
пии
реакции между иодом
и
цианидом натрия,
а
также энтальпии
гидролиза дициана. Лорд
и
Вулф рассчитали также
S°
2ga
(g)
=
=
56,28
кал/(моль -°К); Кобе
и
Лонг
[779] и
Стивенсон
[1418]
рассчи-
тали значение теплоемкости
для
состояния идеального газа.
По
сооб-
щению Дугласа
и
Уинклера [337],
Тт =
266,25°
К,
АНт°
=
=
2,720
ккал/моль
и ТЪ = 286,1° К.
Энтальпия образования AHfl
9g
(s)
по
данным Лорда
и
Вулфа
[883]
равна
32,5
ккал/моль;
это
значение получено
на
основании щелочного
гидролиза
до
цианата натрия, бромистого натрия
и
воды. Энтальпия
образования водного цианата натрия была установлена
в
отдельных
экспериментах. Лорд
и
Вулф [883] 'измерили также давление пара
в интервале температур
от 273 до 308° К. Эти
данные
в
сочетании
с соответствующими данными Бакстера, Беззенбергера
и
Уилсона
[84] нами использованы
для
вывода
по
наименьшим квадратам урав-
нения
Антуана:
lg P (мм рт. ст.) =
9,4559—2041,8/(t
+
251,70),
из
которого
мы
нашли
AHs°
298
= 10,85
ккал/молъ. Лорд
и
Вулф
[883]
вычислили энтропию газа
при 298° К;
Кобе
и
Лонг
[779] и
Стивенсон
[1418]
опубликовали данные
о
теплоемкостях
для
состояния идеаль-
ного газа. Согласно уравнению
для
давления пара
и
рассчи-
танному значению энтальпии сублимации, получено
S°
m
(s)
-
=
26,37
кал/(моль
-
О
К).
Россини, Вагман, Эванс, Левин
и
Джаффе
1249] дают значения
Тт =
324,5°
К и ТЪ =
334,5°
К.
298
300
400
500
600
700
800
900
1000
№
13.
Фосген,
С0С1
2
(состояние
кал/(моль-°К)
Ср°
13,79
13,82
15,28
16,27
16,98
17,52
17,92
18,24
18,49
s
°
67,82
67,91
72,10
75,62
78,65
81,31
83,68
85,81
87,74
-(G°-H°
98
)/r
67,82
67,83
68,39
69,49
70,77
72,09
73,39
74,66
75,87
идеального
газа).
Мол. вес 98,
ккал/моль
Н
°~
Н
298
0,00
0,03
1,49
3,07
4,73
6,46
8,23
10,04
11,88
AHf
-52,80
-52,80
-52,77
-52,73
-52,69
-52,65
-52,63
-52,60
-52,58
AGf
-49,42
-49,
t0
-48,27
-47,15
-46,04
-44,93
-43,83
-42,73
-41,64
924
lg Кр
36,225
35,986
26,372
20,607
16,768
14,027
11,973
10,376
9,099
238
Часть
2. Термические и
термохимические
свойства
веществ
Термодинамические функции, опубликованные
в
Термохимиче-
ских таблицах [1435], основаны
на
данных Робинсона
[1235]
по
моле-
кулярным размерам
и
колебательным отнесениям согласно Каталано
и
Питцеру [203].
Это
новое колебательное отнесение
при
постулиро-
вании
случайного вырождения было подтверждено термическими
данными
для
низких температур, опубликованными Джиоком
и
Оттом
[477]; указанные исследователи обнаружили
три
формы кристалли-
ческого фосгена, характеризующиеся следующими точками плавле-
ния
и
энтальпиями плавления: кристалл
I, Тт = 145,37° К,
АНт°
=
=
1,3715
ккал/молъ; кристаллИ,
Тт = 142,09° К,
АНт°
=•
=
1,3354
ккал/молъ; кристаллШ,
Тт = 139,19° К,
АНт°
=
=
1,131
ккал/моль. Согласно более ранней работе Джиока
и
Джонса
[476],
ТЪ = 280,7° К, при
которой
AHv = 5,832
ккал/моль. Томпсон
[1487]
приводит значения
для
энтальпии образования, выведенные
из
равновесных данных
по
диссоциации фосгена
на
окись углерода
и
хлор. Пересчет
с
использованием приведенных здесь термодинами-
ческих функций дает AHf
29S
(g)
=
—52,7
ккал/молъ. Среднее значе-
ние,
согласно термохимическим данным Томсена [1495], составляет
—52,9
ккал/молъ. Такое хорошее совпадение
в
известной мере можно
считать случайным, если учесть неопределенности. Принято среднее
значение
—52,8
ккал/молъ.
№
14.
Фтористый
карбонил,
CF2O
(состояние
идеального
газа).
Мол.
вес
66,010
т,
°к
298
300
400
500
600
700
800
900
1000.
пал
1
(моль
-
О
К)
11,29
11,33
13,09
14,46
15,51
16,31
16,93
17,41
17,79
s°
61,84
61,91
65,42
68,50
71,23
73,69
75,90
77,93
79,78
61,84
61,85
62,31
63,25
64,36
65,52
66,68
67,82
68,92
ккал/моль
Я
°-
Н
1
98
0,00
0,03
1,25
2,63 .
4,13
5,72
7,39
9,10
10,87
дя/°
-153,00
-153,00
-153,15
-153,26
-153,35
-153,42
-153,48
-153,53
-153,58
AGf°
-149,28
-149,26
-147,99
-146,68
-145,36
-144,02
-142,67
-141,32
-139,98
lg Кр
109,421
108,730
80,851
64,111
52,944
44,963
38,974
34,315
30,590
По
энтальпии гидролиза, измеренной Вартенбергом [1572], была
найдена величина
AHf^g)
=
—153,2
ккал/молъ.
На
основании
значений
констант равновесия реакции 2CF
2
O
= CF
4
+ CO
2
при
разных температурах
(Рафф
и Ли
[1267])
в
сочетании
с
функциями
свободной энергии было установлено,
что
AHf
2S)S
(g)
—
VIII.
Термодинамические
символы,
константы,
методы
расчета
239
=
—152,5
ккал/молъ. Принята величина
—153
ккал/молъ, придаю-
щая
большее значение калориметрическим данным. Расчетные
зна-
чения
термодинамических функций, опубликованные
в
Термохими-
ческих таблицах [1435], основаны
на
молекулярных данных Ловелла,
Стефенсона
и
Джонса [888]. Россини, Вагман, Эванс, Левин
и
Джаффе
[1249]
отобрали следующие значения:
Ttp = 159,2° К, ТЪ = 189,9° К
и
AHv = 3,86
ккал/молъ.
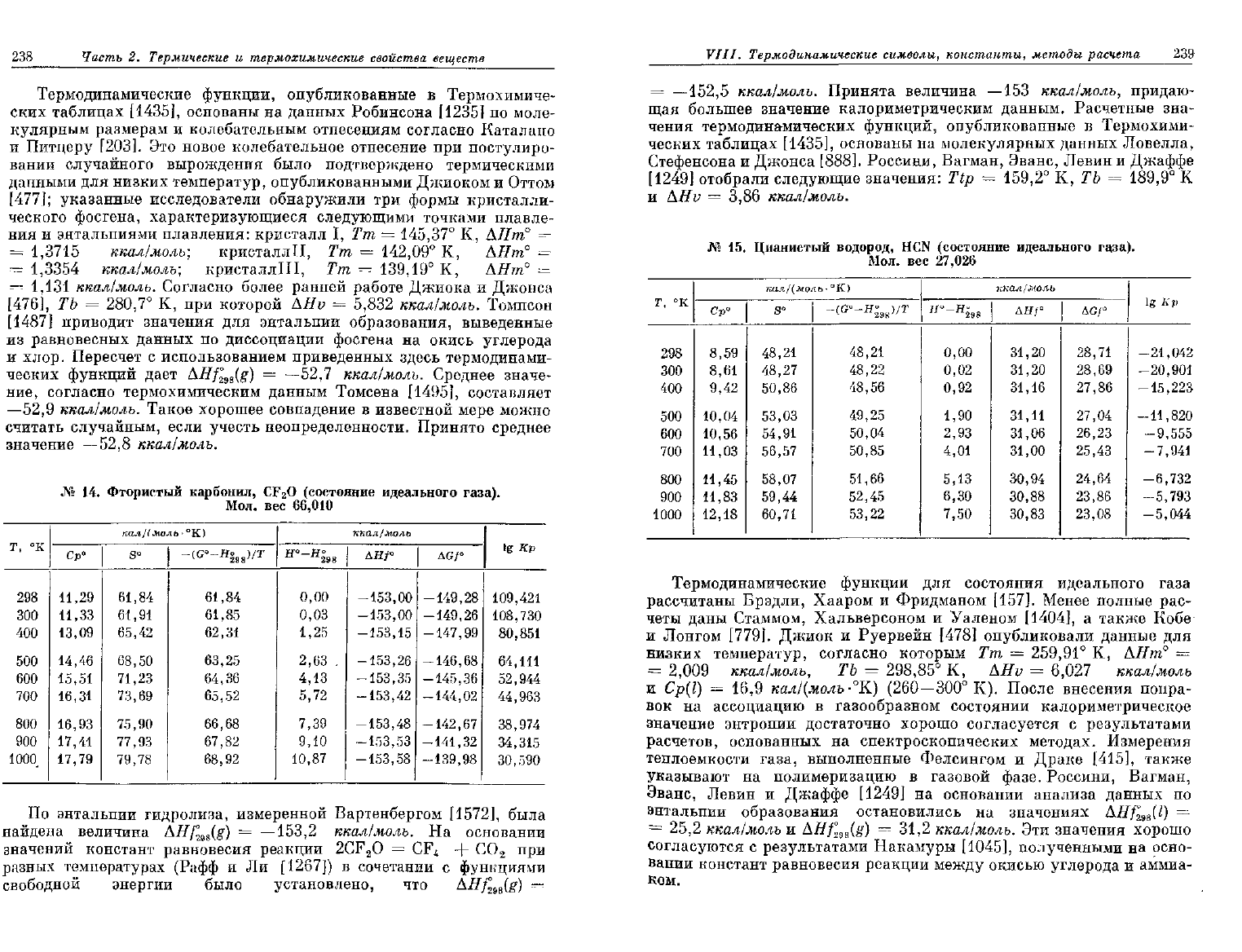
№
15.
Цианистый
водород, HCN
(состояние
идеального
газа).
Мол.
вес
27,026
г,
°к
298
300
400
500
600
700
800
900
1000
кал
1(моль
•
°К)
Ср°
8,59
8,61
9,42
10,04
10,56
11,03
11,45
11,83
12,18
s°
48,21
48,27
50,86
53,03
54,91
56,57
58,07
59,44
60,71
-(G°-H°
98
)/T
48,21
48,22
48,56
49,25
50,04
50,85
51,66
52,45
53,22
ккал/моль
Н
°~
Н
298
0,00
0,02
0,92
1,90
2,93
4,01
5,13
6,30
7,50
дн/°
31,20
31,20
31,16
31,11
31,06
31,00
30,94
30,88
30,83
AGf°
28,71
28,69
27,86
27,04
26,23
25,43
24,64
23,86
23,08
lg Кр
-21,042
-20,901
-15,223
-11,820
-9,555
-7,941
-6,732
-5,793
-5,044
Термодинамические функции
для
состояния идеального газа
рассчитаны Брэдли, Хааром
и
Фридманом [157]. Менее полные
рас-
четы даны Стаммом, Хальверсоном
и
Уаленом [1404],
а
также Кобе
и
Лонгом [779]. Джиок
и
Руервейн
[478]
опубликовали данные
для
низких
температур, согласно которым
Тт = 259,91° К,
АНт°
=
=
2,009
ккал/молъ,
ТЪ = 298,85° К, AHv = 6,027
ккал/молъ
и
Ср(1) = 16,9
кал/(молъ
-°К)
(260—300°
К).
После внесения попра-
вок
на
ассоциацию
в
газообразном состоянии калориметрическое
значение
энтропии достаточно хорошо согласуется
с
результатами
расчетов, основанных
на
спектроскопических методах. Измерения
теплоемкости газа, выполненные Фелсингом
и
Драке [415], также
указывают
на
полимеризацию
в
газовой фазе. Россини, Вагман,
Эванс,
Левин
и
Джаффе
[1249]
на
основании анализа данных
по
энтальпии
образования остановились
на
значениях
AHf°
2s8
(l)
=
=
25,2
ккал/молъ
и
AHf
ws
(g)
= 31,2
ккал/молъ.
Эти
значения хорошо
согласуются
с
результатами Накамуры [1045], полученными
на
осно-
вании
констант равновесия реакции между окисью углерода
и
аммиа-
ком.
240
Часть
2. Термические и
термохимические
свойства
веществ
№
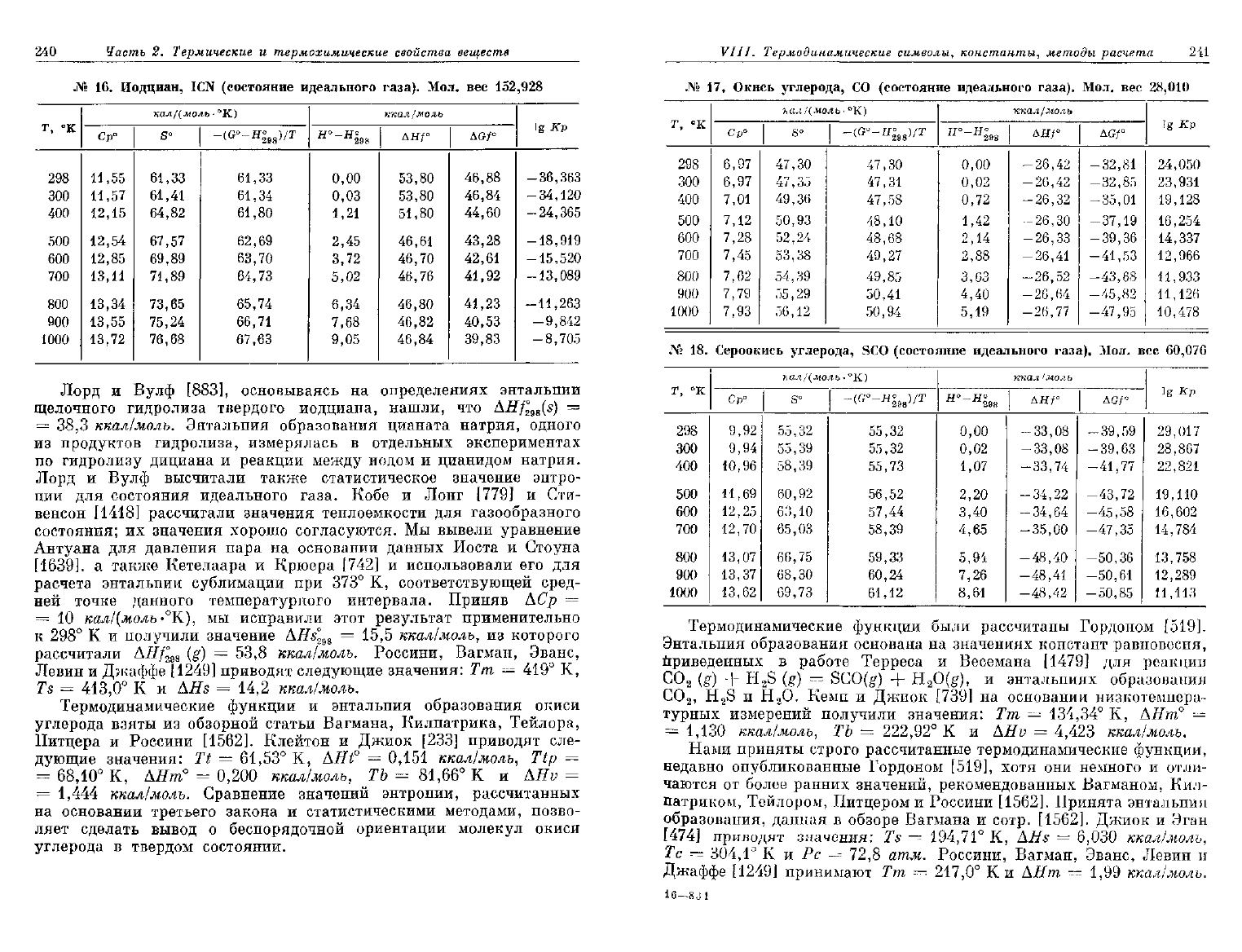
16.
Иодциан,
ICN
(состояние
идеального
газа).
Мол. вес
152,928
Г,
"К
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
11,55
11,57
12,15
12,54
12,85
13,11
13,34
13,55
13,72
s°
61,33
61,41
64,82
67,57
69,89
71,89
73,65
75,24
76,68
-(6->-Я|
и
)/Т
61,33
61,34
61,80
62,69
63,70
64,73
65,74
66,71
67,63
ккал/моль
Н
°-
Н
298
0,00
0,03
1,21
2,45
3,72
5,02
6,34
7,68
9,05
дя/°
53,80
53,80
51,80
46,61
46,70
46,76
46,80
46,82
46,84
AGf°
46,88
46,84
44,60
43,28
42,61
41,92
41,23
40,53
39,83
lg
Кр
-36,363
-34,120
-24,365
-18,919
-15,520
-13,089
-11,263
-9,842
-8,705
Лорд
и
Вулф [883], основываясь
на
определениях энтальпии
щелочного гидролиза твердого иодциана, нашли,
что
AHf
2ii
(s)
=
=
38,3
ккал/молъ. Энтальпия образования цианата натрия, одного
из
продуктов гидролиза, измерялась
в
отдельных экспериментах
по
гидролизу дициана
и
реакции между иодом
и
цианидом натрия.
Лорд
и
Вулф высчитали также статистическое значение энтро-
пии
для
состояния идеального газа. Кобе
и
Лонг
[779] и Сти-
венсон
[1418]
рассчитали значения теплоемкости
для
газообразного
состояния;
их
значения хорошо согласуются.
Мы
вывели уравнение
Антуана
для
давления пара
на
основании данных Иоста
и
Стоуна
[1639],
а
также Кетелаара
и
Крюера
[742] и
использовали
его для
расчета энтальпии сублимации
при 373° К,
соответствующей сред-
ней
точке данного температурного интервала. Приняв
АСр =
=
10
кал/(моль-°К),
мы
исправили этот результат применительно
к
298° К и
получили значение
AHs°
2!)S
= 15,5
ккал/молъ,
из
которого
рассчитали
А///°
98
(g) = 53,8
ккал/молъ. Россини, Вагман, Эванс,
Левин
и
Джаффе
[1249]
приводят следующие значения:
Тт = 419° К,
Ts
= 413,0° К и AHs = 14,2
ккал/молъ.
Термодинамические функции
и
энтальпия образования окиси
углерода взяты
из
обзорной статьи Вагмана, Килпатрика, Тейлора,
Питцера
и
Россини [1562]. Клейтон
и
Джиок
[233]
приводят
сле-
дующие значения:
77 = 61,53° К, AHf = 0,151
ккал/молъ,
Ttp =
=
68,10° К,
АНт°
=
0,200
ккал/молъ,
ТЪ = 81,66° К и AHv =
=
1,444
ккал/молъ. Сравнение значений энтропии, рассчитанных
на
основании третьего закона
и
статистическими методами, позво-
ляет сделать вывод
о
беспорядочной ориентации молекул окиси
углерода
в
твердом состоянии.
VIII.
Термодинамические
символы,
константы,
методы
расчета
241
№
17.
Окись
углерода, СО
(состояние
идеального
газа).
Мол. вес
28,010
Т, °К
298
300
400
500
600
700
800
900
1000
\ал1(моль-°'К)
Ср°
6,97
6,97
7,01
7,12
7,28
7,45
7,62
7,79
7,93
S°
|
-(G°-H°
98
)/r
47,30
47,35
49,36
50,93
52,24
53,38
54,39
55,29
56,12
47,30
47,31
47,58
48,10
48,68
49,27
49,85
50,41
50,94
ккал/моль
0,00
0,02
0,72
1,42
2,14
2,88
3,63
4,40
5,19
ля/°
-26,42
-26,42
-26,32
-26,30
-26,33
-26,41
-26,52
-26,64
-26,77
AG/°
-32,81
-32,85
-35,01
-37,19
-39,36
-41,53
-43,68
-45,82
-47,95
lg
Кр
24,050
23,931
19,128
16,254
14,337
12,966
11,933
11,126
10,478
№
18.
Сероокись
углерода, SCO
(состояние
идеального
газа).
Мол. вес
60,076
Г,
°К
298
300
400
500
600
700
800
900
1000
кал/(моль
•
°К)
Ср°
9,92
9,94
10,96
11,69
12,25
12,70
13,07
13,37
13,62
s° |
-
(
о°-я°
98
)/т
55,32
55,39
58,39
60,92
63,10
65,03
66,75
68,30
69,73
55,32
55,32
55,73
56,52
57,44
58,39
59,33
60,24
61,12
ккал
'моль
н
°-
н
ш
0,00
0,02
1,07
2,20
3,40
4,65
5,94
7,26
8,61
дяг
-33,08
-33,08
-33,74
-34,22
-34,64
-35,00
-48,40
-48,41
-48,42
AGf°
-39,59
-39,63
-41,77
-43,72
-45,58
-47,35
-50,36
-50,61
-50,85
lg
Кр
29,017
28,867
22,821
19,110
16,602
14,784
13,758
12,289
11,113
Термодинамические функции были рассчитаны Гордоном [519].
Энтальпия образования основана
на
значениях констант равновесия,
приведенных
в
работе Терреса
и
Весемана
[1479]
для
реакции
СО
2
(g) + H
2
S (g) =
SCO(g)
+
H
2
O(g),
и
энтальпиях образования
СО
2
,
H
2
S и Н
а
О.
Кемп
и
Джиок
[739] на
основании низкотемпера-
турных измерений получили значения:
Тт — 134,34° К,
АНт°
=
=
1,130
ккал/молъ,
ТЪ = 222,92° К и AHv =
4,423
ккал/молъ.
Нами
приняты строго рассчитанные термодинамические функции,
недавно опубликованные Гордоном [519], хотя
они
немного
и
отли-
чаются
от
более ранних значений, рекомендованных Вагманом,
Кил-
патриком, Тейлором, Питцером
и
Россини [1562]. Принята энтальпия
образования, данная
в
обзоре Вагмана
и
сотр. [1562]. Джиок
и
Эган
[474] приводят значения:
Ts = 194,71° К, AHs =
6,030
ккал/молъ,
Тс
= 304,1° К и Рс = 72,8 атм.
Россини, Вагман, Эванс, Левин
и
Джаффе
[1249]
принимают
Тт = 217,0° К и АНт = 1,99
ккал/молъ.
16-831
