Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

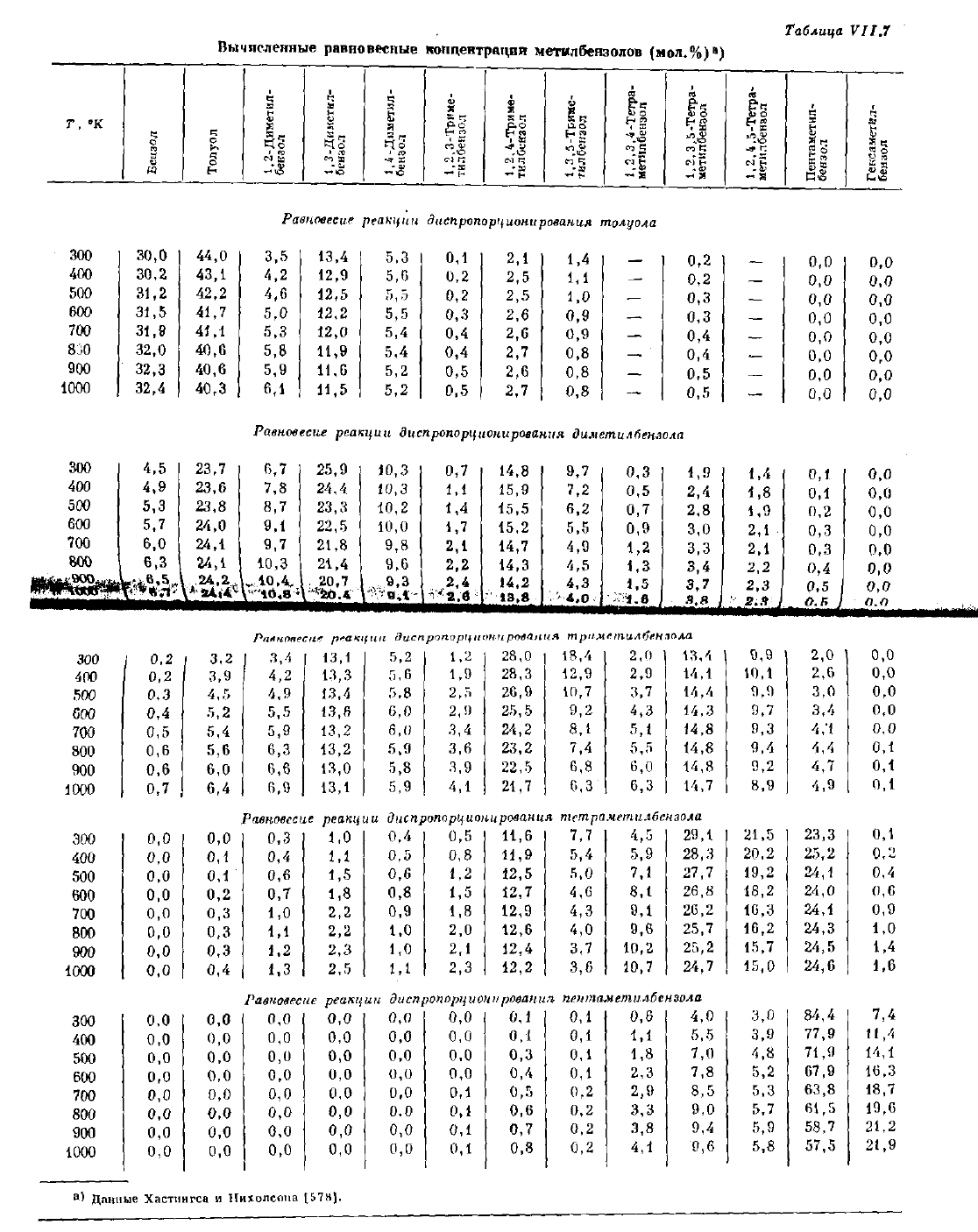
Таблица
VII.7
г, °к
о
W
Вмчпсленяые равновесные
То
ч
С
ж
—
&
i
г;
а
1-
1
Л
-
CJ
•—в
1
Я
-1)
—
о
концентрации
метмлбеязолов (мол.%)
а
)
щ
-о
-а
—
Е-
-Триме-
НЗОЛ
.о
-я
—
н
-Тряме-
наол
1(1
,5
Я
£
К
41 О
[ч «
"=£
га
КЗ
о
V
м
С)
н
-
Я
Л
£*
&>
о
i
Я
-1Й
si
метнл-
™g
S
°
реакции
диспропорционирования
толуола
30,0
30,2
31,2
31,5
31,9
32,0
32,3
32,4
44,0
43,1
42,2
41,7
41,1
40,6
40,6
40,3
3,5
4,2
4,6
5,0
5,3
5,8
5,9
6,1
13,4
12,9
12,5
12,2
12,0
11,9
11,6
11,5
5,3
5,0
5,5
5,5
5,4
5,4
5,2
5,2
0,1
0,2
0,2
0,3
0,4
0,4
0,5
0,5
2,1
2,5
2,5
2,6
2,6
2,7
2,6
2,7
1,4
1,1
1,0
0,9
0,9
0,8
0,8
0,8
—
ц
—
—
0,2
0,2
0,3
0,3
0,4
0,4
0,5
0,5
_
^
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
Равновесие реакции диспропорционирования диметилбеняола
4,5
4,9
5,3
5,7
6,0
6,3
23,7
23,6
23,8
24,0
24,1
24,1
V 24,2
6,7
7,8
8,7
9,1
9,7
10,3
25,9
24,4
23,3
22,5
21,8
21,4
20,7
10,3
10,3
10,2
10,0
9,8
9,6
,-
9,3
''•'У
9 Л-
0,7
1,1
1,4
1,7
2,1
2,2
2,4
14,8
15,9
15,5
15,2
14,7
14,3
14,2
13,8
9,7
7,2
6,2
5,5
4,9
4,5
4,3
>4.0
о,
0
0
0
1,
1,
1,
•
3
5
7
9
2
3
5
в
1
2
2
3
3
3
3
Я
,9
,4
,8
,0
,3
,4
,7
в
1
1
1
2
2
2
2
2
Л
,8
,9
,1
,1
,2
,3
Я
0,1
0,1
0,2
0,3
0,3
0,4
0,5
о.
в ,
0,0
0,0
0,0
0,0
0,0
0,0
0,0
...,.о.о
1
0,2
0,2
0.3
0,4
0,5
0,6
0,6
0,7
3,2
3,9
4,5
5,2
5,4
5,6
6,0
6,4
Ралноаееия
реакции диспропорципнировПпия триметилбенаала
3,4
4,2
4,9
5,5
5,9
6,3
6,6
6,9
13,1
13,3
13,4
13,6
13,2
13,2
13,0
13,1
5,2
5,6
Г>,
8
6,0
6,0
5,9
5,8
5,9
1,2
1,9
2,5
2,9
3,4
3,6
3,9
4,1
28,0
28,3
20,9
25,5
24,2
23,2
22,5
21,7
18,4
12,9
10,7
9,2
8,1
7,4
6,8
6,3
2,0
2,9
3,7
4,3
5,1
5,5
6,0
6,3
13/1
14,1
14,4
14,3
14,8
14,8
14,8
14,7
10,1
а,я
9,7
9,3
9,4
9,2
8,9
2,0 '
2,6
3,0
3,4
4,1
4,7
4,9
Равновесие реакции диспропорционирования тетраметилбснзола
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,1
0,1
0,2
0,3
0,3
0,3
0,4
0,3
0,4
0,6
0,7
1,0
1,1
1.2
1,3
1,0
1,1
1,5
1,8
2,2
2,2
2,3
2,5
0,4
0,5
0,6
0,8
0,9
1,0
1,0
1,1
0,5
0,8
1,2
1,5
1,8
2,0
2,1
2,3
11,6
11,9
12,5
12,7
12,9
12,6
12,4
12,2
7,7
5,4
5,0
4,6
4,3
4,0
3,7
3,6
4,5
5,9
7,1
8,1
9,1
9,6
10,2
10,7
29,1
28,3
27,7
26,8
26,2
25,7
25,2
24,7
21,5
20,2
19,2
18,2
16,3
16,2
15,7
15,0
23,3
25,2
24,1
24,0
24,1
24,3
24,5
24,6
Равновесие
реакции
диспропорционированип
пешпаметилбензола
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0.0
0,0
0,0
0,0
0,0
0,0
0,0
0,1
0,1
0,1
0,1
0,1
од
0,3
0,4
0,5
0,6
0,7
0,8
ол
од
0,1
0,1
0,2
0,2
0,2
0,2
0,6
1,1
1,8
2,3
2,9
3,3
3,8
4,1
4,0
5,5
7,0
7,8
8,5
9,0
9,4
9,6
3,0
3,9
4,8
5,2
5,3
5,7
5,9
5,8
84,4
77,9
71,9
67,9
63,8
61,5
58,7
57,5
0,0
0,0
0,0
0,0
0,0
0,1
0,1
0,1
ои
о,а
0,4
0,6
0,9
1,0
1,4
1.6
7,4
11,4
14,1
16,3
18,7
19,6
21,2
21,9
Данные Хастингса
и
Пихолсопа \ЬТЛ\.
184
Часть
1.
Основы
термодинамики
в
качестве неизвестного концентрацию только одного неизвестного
вещества, выраженную через концентрации
двух
специально выбран-
ных независимых компонентов (1,3-диметилбензол и
1,2,4-триме-
тилбензол).
Типичное уравнение (последняя строка в табл.
VII.6)
приводит к следующему выражению:
Предполагая, что N± и N
2
равны опытным значениям, константу
равновесия К
7
нетрудно рассчитать из данных по энергии Гиббса
ржи
Тримвтил-'А
бензол
у/Л
500 1000 500 1000 500 1000 500
Температура,
°К
1000
500 WOO
Рис.
VII.1.
Равновесие реакций диспропорционирования метилбензолов.
Первоначально присутствовавшие соединения отмечены звездочкой (*). По данпыы Хастингса
и
Нихолсона [5781.
для участников рассматриваемой реакции.
Зная
константу равно-
весия,
из приведенного выше соотношения определяем величину JV
7
-
Полученное значение N^ легко проверить путем подстановки его
в
уравнения материального баланса фенильного или метильного
радикала. Плохое совпадение полученных двумя путями значений N
7
требует
пересмотра величин Ni и N
2
и проведения повторного расчета.
Применение
описанного метода последовательных приближений
облегчается использованием цифровых электронно-вычислительных
машин.
Аналогичным образом можно рассчитать концентрации дру-
гих компонентов равновесной смеси и в конечном счете определить
концентрации
всех
изомеров. Найденные таким путем равновесные
концентрации
всех
метилбензолов приведены в табл.
VII.7
и гра-
фически
представлены на рис. VI 1.1.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
185
Гастингс и Нихолсон [577] сравнили вычисленный и экспери-
ментально найденный состав равновесной газовой фазы процесса
изомеризации
три- и тетраметилбензолов при 300 и
700°
К и пришли
к
выводу, что данные совпадают в пределах, обусловленных воз-
можными
ошибками в анализе продуктов реакции и теми предполо-
жениями,
которые были положены в основу статистических расчетов.
С
первого взгляда кажется весьма трудным определить экономи-
ческую ценность такой информации. Данные по равновесиям про-
цессов,
протекающих при переработке нефти,
могут
быть неодно-
кратно
использованы при решении конкретных технологических
проблем. При этом
следует
отметить, что если для какого-либо соеди-
нения
известна величина энергии Гиббса, то ее можно использовать
в
расчете равновесия любой
другой
реакции, для
всех
остальных
участников которой имеются соответствующие величины энергии
Гиббса. Именно поэтому многократное использование полученных
данных в решении постоянно возникающих задач анализа термо-
динамического равновесия полностью оправдывает первоначальную
затрату на получение исходной информации.
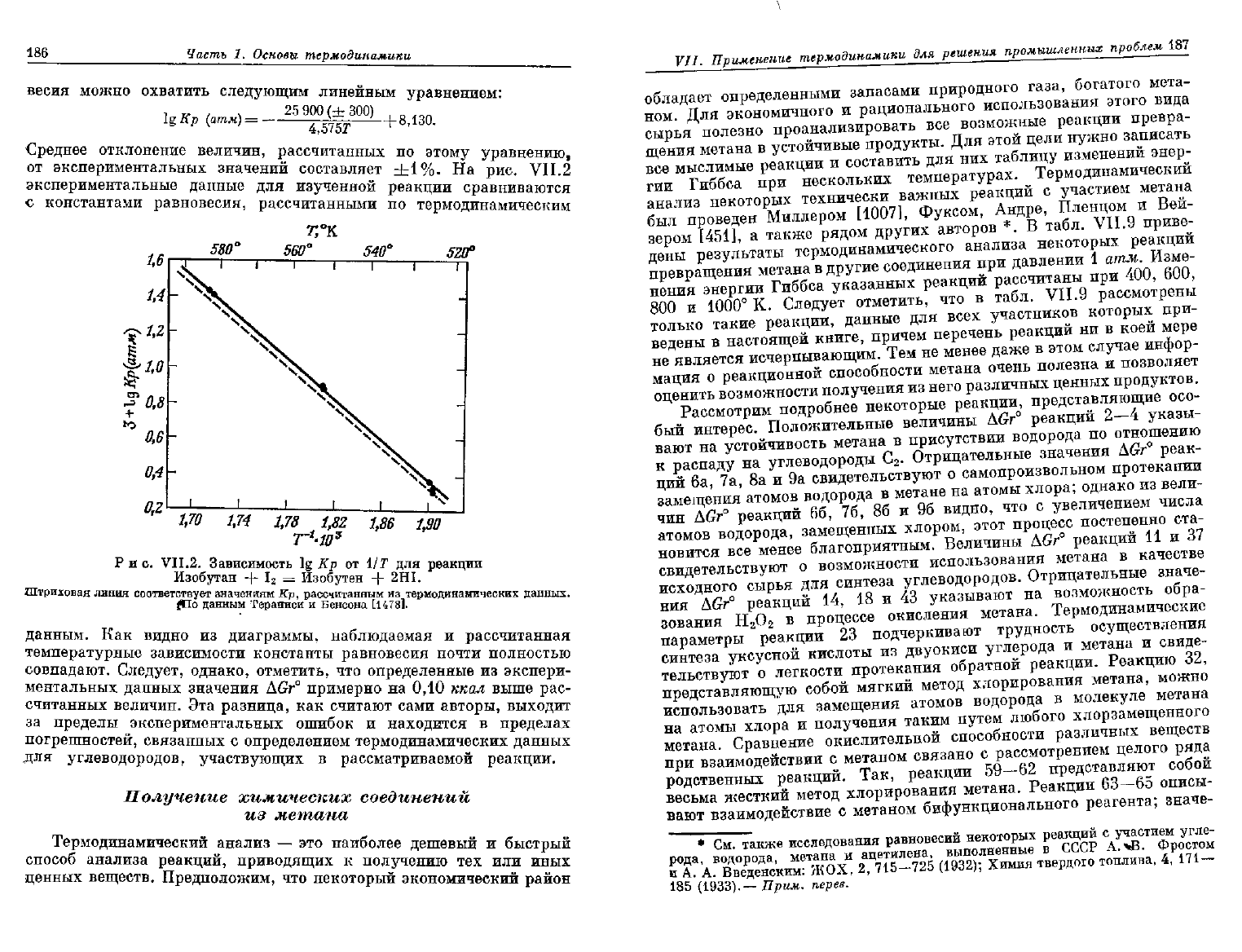
Тераниси
и Бенсон
[1478]
изучили в интервале температур 522,5—
582,9°
К равновесие реакции дегидрирования изобутана иодом в газо-
вой
фазе *. Приведенные в табл.
VII.8
значения констант равно-
Таблица
VI 1.8
Данные
по
равновесию
гомогенной
газофазной
реакции
CH + l0CH+2HI
a
)
Г,
°К
525,1
522,5
525,7
551,9
552,5
552,5
582,7
582,9
582,7
Исходное
давление,
мм
12
1
9,67
14,6
3,89
7,50
14,8
4,32
8,37
3,56
5,95
•Ц30-С4Н10
200,3
119,4
275,4
206,5
121,2
158,7
131,9
136,7
168,8
Равновесное давление,
мм
12
3,24
7,82
0,33
0,88
5,25
0,26
0,72
0,06
0,26
U3O-C4H10
193,9
112,6
271,8
199,9
111,6
154,6
124,3
133,2
163,1
6,35
6,90
3,44
6,35
9,55
3,91
7,60
3,42
5,92
HI
12,7
13,8
6,88
12,7
19,1
7,82
15,2
6,83
11,8
Кр,
атм- 103
ОПЫТ
2,15
1,96
2,34
7,66
7,83
7,83
25,8
26,3
25,5
расчет
2,02
1,79
2,08
6,77
6,95
6,95
23,7
23,9
23,7
а
) Данные Тераниси
и
Бенсона [14781.
* Термодинамика реакций изомеризации, дегидрирования и полимериза-
ции
бутанов и бутиленов, а также гидратации бутиленов подробно рассмотрена
в
работах: А. В.
Фрост
и
сотр.,
ЖОХ,
6,1796
(1936); 7, 122 (1937); 9, 1813 (1939);
Химия твердого топлива, 8, 169 (1937).—
Прим.
перев.
186
Часть
1.
Основы
термодинамики
весия
можно охватить следующим линейным уравнением:
,
гл , л
25 900 (±300)
,
о
...
igKp
{атм)
=
4.575Г
+8,130.
Среднее отклонение величин, рассчитанных
по
этому уравнению,
от экспериментальных значений составляет +1%.
На
рис.
VII.2
экспериментальные данные
для
изученной реакции сравниваются
с константами равновесия, рассчитанными
по
термодинамическим
Т,°К
580° 560°
540"
520°
1
I 1 Г
1,70
JJ4 1,78 1,82 1,86 1,90
T**
Рис.
VII.2.
Зависимость
lg Kp от ЦТ для
реакции
Изобутан -\-
1
2
=
Изобутен
-f-
2HI.
Штриховая линия соответствует значениям Кр, рассчитанным из термодинамических данных.
(По данным Тераниси
и
Бенсона [1478].
данным.
Как
видно
из
диаграммы, наблюдаемая
и
рассчитанная
температурные зависимости константы равновесия почти полностью
совпадают.
Следует,
однако, отметить, что определенные
из
экспери-
ментальных данных значения
AGr°
примерно
на
0,10 ккал выше рас-
считанных величин. Эта разница, как считают сами авторы, выходит
за пределы экспериментальных ошибок
и
находится
в
пределах
погрешностей, связанных
с
определением термодинамических данных
для углеводородов,
участвующих
в
рассматриваемой реакции.
Получение химических соединений
из
метана
Термодинамический анализ
—
это наиболее дешевый
и
быстрый
способ анализа реакций, приводящих
к
получению
тех
или иных
ценных
веществ. Предположим, что некоторый экономический район
обладает определенными запасами природного газа, богатого мета-
ном.
Для экономичного
и
рационального использования этого вида
сырья полезно проанализировать
все
возможные реакции превра-
щения
метана
в
устойчивые продукты. Для этой цели нужно записать
все мыслимые реакции
и
составить для них таблицу изменений
энер-
гии
Гиббса
при
нескольких температурах. Термодинамический
анализ
некоторых технически важных реакций
с
участием метана
был проведен Миллером [1007], Фуксом, Андре, Пленцом
и
Вей-
зером [451],
а
также рядом
других
авторов
*. В
табл.
VII.9
приве-
дены результаты термодинамического анализа некоторых реакций
превращения
метана
в
другие
соединения при давлении
1
атм. Изме-
нения
энергии Гиббса указанных реакций рассчитаны при 400, 600,
800
и
1000°
К.
Следует
отметить,
что в
табл.
VII.9
рассмотрены
только такие реакции, данные
для
всех
участников которых при-
ведены
в
настоящей книге, причем перечень реакций ни
в
коей мере
не
является исчерпывающим. Тем не менее
даже
в
этом
случае
инфор-
мация
о
реакционной способности метана очень полезна
и
позволяет
оценить
возможности получения из него различных ценных продуктов.
Рассмотрим подробнее некоторые реакции, представляющие осо-
бый интерес. Положительные величины
AGr°
реакций
2—4
указы-
вают
на
устойчивость метана
в
присутствии водорода по отношению
к
распаду
на
углеводороды С
2
. Отрицательные значения
AGr°
реак-
ций
6а, 7а,
8а и 9а
свидетельствуют
о
самопроизвольном протекании
замещения
атомов водорода
в
метане на атомы хлора; однако из вели-
чин
AGr°
реакций
66, 76, 86 и 96
видно,
что с
увеличением числа
атомов водорода, замещенных хлором, этот процесс постепенно ста-
новится
все менее благоприятным. Величины
AGr°
реакций
11 и 37
свидетельствуют
о
возможности использования метана
в
качестве
исходного сырья для синтеза углеводородов. Отрицательные значе-
ния
AGr°
реакций
14, 18 и 43
указывают
на
возможность обра-
зования
Н
2
О
2
в
процессе окисления метана. Термодинамические
параметры реакции
23
подчеркивают трудность осуществления
синтеза уксусной кислоты
из
двуокиси
углерода
и
метана
и
свиде-
тельствуют
о
легкости протекания обратной реакции. Реакцию
32,
представляющую собой мягкий метод хлорирования метана, можно
использовать
для
замещения атомов водорода
в
молекуле метана
на
атомы хлора
и
получения таким путем любого
хлор
замещенного
метана. Сравнение окислительной способности различных веществ
при
взаимодействии
с
метаном связано
с
рассмотрением целого ряда
родственных реакций.
Так,
реакции
59—62
представляют собой
весьма жесткий метод хлорирования метана. Реакции
63—65
описы-
вают взаимодействие
с
метаном бифункционального реагента; значе-
* См. также исследования равновесий некоторых реакций
с
участием
угле-
рода, водорода, метана
и
ацетилена, выполненные
в
СССР
А.чВ. Фростом
и
А. А. Введенским: ЖОХ,
2,
715—725
(1932); Химия твердого топлива,
4,
171 —
185 (1933).—
Прим.
перев.
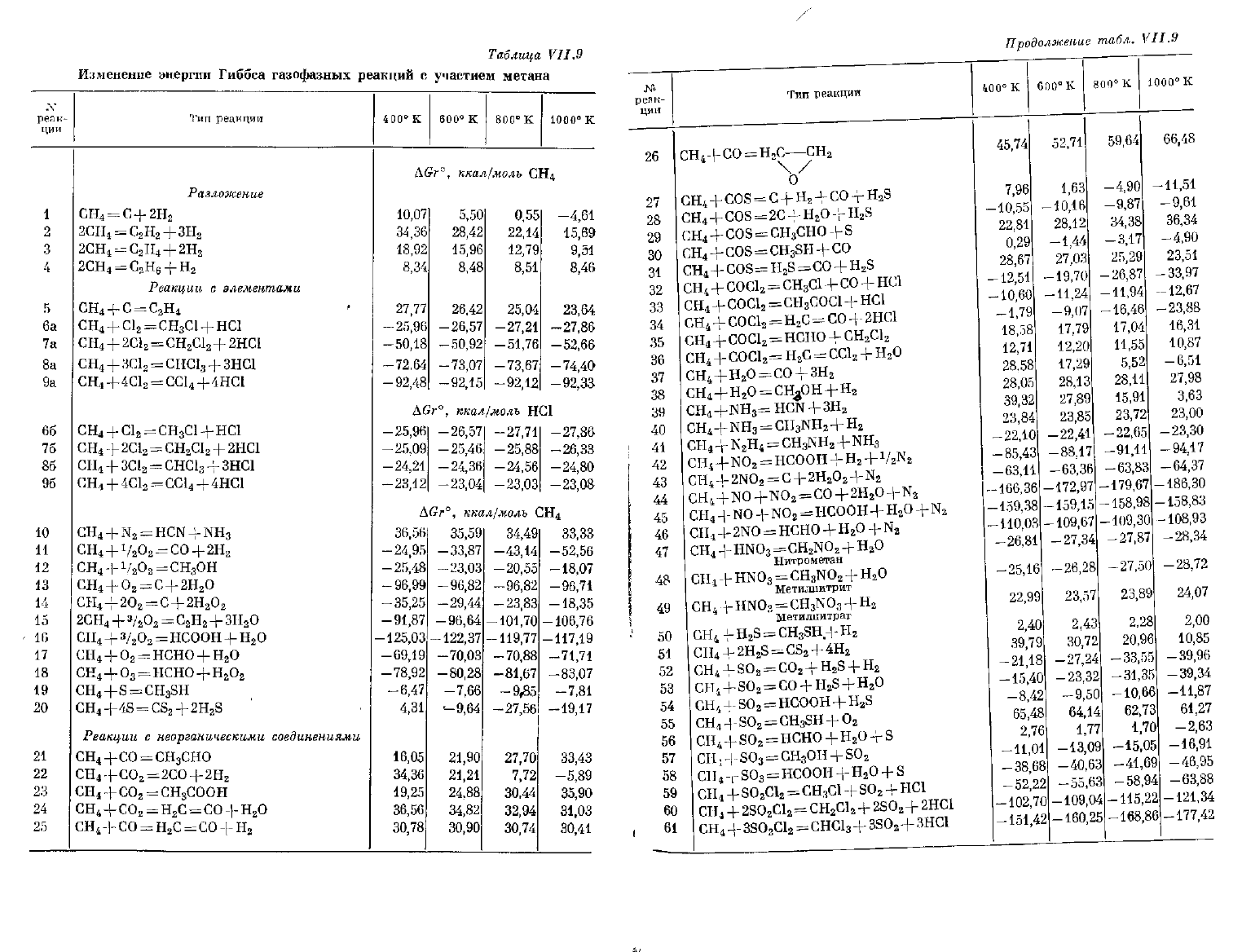
Таблица
VII.9
Изменение энергии
Гиббса
газофазных реакций
е
участием
метана
реак-
ции
1
2
3
4
5
6а
7а
8а
9а
66
76
86
96
10
И
12
13
14
15
10
17
18
19
20
21
22
23
24
25
Тип реакции
Разложение
СН
4
=
С
+
2Н
2
2СН
4
=
С
2
Н
2
+
ЗН
2
2СН4
=
С2Н4
-f-
2H2
2GH4
—
С2Н0
~т Нг
Реакции
с
элементами
СН
4
+
С1
2
=
СН
3
С1
+
НС1
СН
4
+
2С1
2
=
СН
2
С1
2
+
2НС1
СН
4
+
ЗС1
2
=
СНС1
3
+
ЗНС1
СН
4
+4С1
2
=
СС1
4
+4НС1
СН
4
+
С1
2
=
СН
3
С1
+
НС1
СН
4
+
2С1
2
==
СН
2
С1
2
+
2НС1
СН
4
+
ЗС1
2
=
СНС1
3
+
ЗНС1
СН
4
+
4С1
2
=
СС1
4
+
4НС1
CH
4
+
N
2
=
HCN
+
NH
3
СН
4
+
1/
2
О
2
=
СО
+
2Н
2
CH
4
+
V
2
O
2
=
CH
3
OH
СН
4
+ О
2
=
С
+
2Н
2
О
СН
4
+2О
2
=С
+
2Н
2
О
2
2СН
4
+
з/
2
О
2
=
С
2
Н
2
+
ЗН
2
О
СН
4
+
з/
2
О
2
=
НСООН
+
Н
2
О
СН
4
+
О
2
=
НСНО
+
Н
2
О
сн
4
+о
3
=нсно+н
2
о
2
CH
4
+
S
=
CH
3
SH
CH
4
+4S
=
CS
2
+
2H
2
S
Реакции
с
неорганическими
соединениями
СН
4
+СО
=
СН
3
СНО
СН
4
+
СО
2
=
2СО+2Н
2
СН
4
+
СО
2
=
СН
3
СООН
СН
4
+С0
2
=
Н
2
С=СО
+
Н
2
О
СН
4
+СО
=
Н
2
С
=
СО
+
Н
2
400°
К
600°
К
800°
К
1000°
К
Дбг°, ккал/молъ
СН
4
10,07
34,36
18,92
8,34
27,77
-25,96
-50,18
-72,64
-92,48
5,50
28,42
15,96
8,48
26,42
-26,57
-50,92
-73,07
-92,15
0,55
22,14
12,79
8,51
25,04
-27,21
-51,76
-73,67
-92,12
-4,61
15,69
9,51
8,46
23,64
-27,86
-52,66
-74,40
-92,33
AGr°,
ккал/молъ
НС1
-25,96
-25,09
-24,21
-23,12
-26,57
-25,46
-24,36
-23,04
-27,71
-25,88
-24,56
-23,03
-27,86
-26,33
-24,80
-23,08
Д(?г°, ккал/молъ
СН
4
36,56
-24,95
-25,48
-96,99
-35,25
-91,87
-125,03
-69,19
-78,92
-6,47
4,31
16,05
34,36
19,25
36,56
30,78
35,59
-33,87
-23,03
-96,82
-29,44
-96,64
-122,37
-70,03
-80,28
-7,66
•-9,64
21,90
21,21
24,88
34,82
30,90
34,49
-43,14
-20,55
-96,82
-23,83
-101,70
-119,77
-70,88
-81,67
-9,85
-27,56
27,70
7,72
30,44
32,94
30,74
33,33
-52,56
-18,07
-96,71
-18,35
-106,76
-117,19
-71,71
-83,07
-7,81
-19,17
33,43
-5,89
35,90
31,03
30,41
К»
реак-
ции
Тип реакции
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
СНл
+
СО =Н
2
С—СН
2
V
CH
4
+
СН
4
+
COS
=
2С
+
Н
2
О
+
H
2
S
СН
4
+COS
=
CH3CHO
+ S
сн
4
+cos=CH
3
SH4-со
S CO
+
H
СН
4
+СОС1
2
СН
4
+СОС1
2
СН
4
+СОС1
2
СН
4
+•
СОС1
2
СН
4
+СОС1
2
СН
4
+Н
2
О=
СН
4
+
Н
2
О
=
CH
4
+NH
3
=
2
=
СН
3
С1
+
СО
+
НС1
=
СН
3
СОС1
+
НС1
=
Н
2
С=
СО
+
2НС1
=
НСНО
+
СН
2
С1
2
=
Н
2
С
=
СС1
2
+
Н
2
О
CHgOH
+
Н
2
HCN
+
3H
2
4
+
2
CH
4
+2NO
2
=
С
+
2H
2
O
2
-f
N
2
=
CO+2H
2
O-fN
2
CH
4
+
+
2
CH
4
+
2NO
=
HCHO
4- H
2
O 4- N
2
CH
4
4-
HNO
3
=
CH
2
NO
2
4- H
2
O
Нитрометан
сн
4
4-
HNO
3
=CH
3
NO
2
4- н
2
о
Метилнитрит
CH
33
4
Метилвитрат
сн
4
4-
H
2
S=CH
3
SH.+н
2
CS44H
CH
4
4
2
2
4
сн
4
4- so
2
=co
2
4-
H
2
S+н
2
сн
4
4- so
2
=со
4
H
2
S
4-
н
2
о
4
+
SO
2
=HCOOH4-H
2
S
H0
CH
4
4S0
2
4
CH,
4
SO
3
=
CH3OH
4
SO
2
CH
4
-1-
SO
3
=
HCOOH
4- H
2
O
4 S
CH
4
4
SO
2
C1
2
=
CH3CI4
SO
2
4
HC1
CH
4
4
2SO
2
C1
2
=
CH
2
C1
2
4
2SO
2
4
2HC1
CH
4
+
3SO
2
C1
2
=
CHC1
3
4-
3SO
2
4- 3HC1
400°
К
45,74
!
Продолжение
табл.
VII.9
1000°К
600°K
52,71
7,96
•10,55
22,81
0,29
28,67'
-12,51
-10,601
-1,79
18,5!
12,71
28,58'
28,05
39,32
23,84
-22,10
-85,43
-63,11
-166,36
!
-159,38
-110,03!
-26,81
-25,16
22,99
2,40
39,79]
-21,18
-15,40'
-8,42
65,48
2,76
!
-11,01
-38,68
-52,22'
-102,70
-151,42
1,63
800°K
59,64
28,12
-1,44'
27,031
-19,70
-11,24
-9,07
17,79
12,201
17,29
28,13'
27,89
23,85
-22,41
-88,17
-63,361
-172,97
-159,15'
-109,67
-27,34
-26,28'
23,57'
2,43
30,72'
-27,241
-23,32
-9,50
64,141
1,77
-13,09'
—40,63]
-55,63
-109,04'
-160,25
-4,90'
-9,87
34,38
-3,17
25,29
-26,87
-11,94
-16,46'
17,04
11,55
5,52
28,11
15,91
23,72'
•22,65'
-91,11
-63,83!
-179,67
-158,98'
-109,301
-27,87
-27,50
23,89
66,48
-11,51
-9,61
36,34
-4,90
23,51
-33,97
-12,67
-23,88
16,31
10,87
-6,51
27,98
3,63
23,00
-23,30
-94,17
-64,37
-186,30
-158,83
-108,93
-28,34
-28,72
2,28]
20,96
-33,55'
-31,35
-10,66
62,73'
1,70
-15,05
-41,69]
-58,94
-115,22
-168,86
24,07
2,00
10,85
-39,96
-39,34
-11,87
61,27
-2,63
-16,91
-46,95
-63,88
-121,34
-177,42
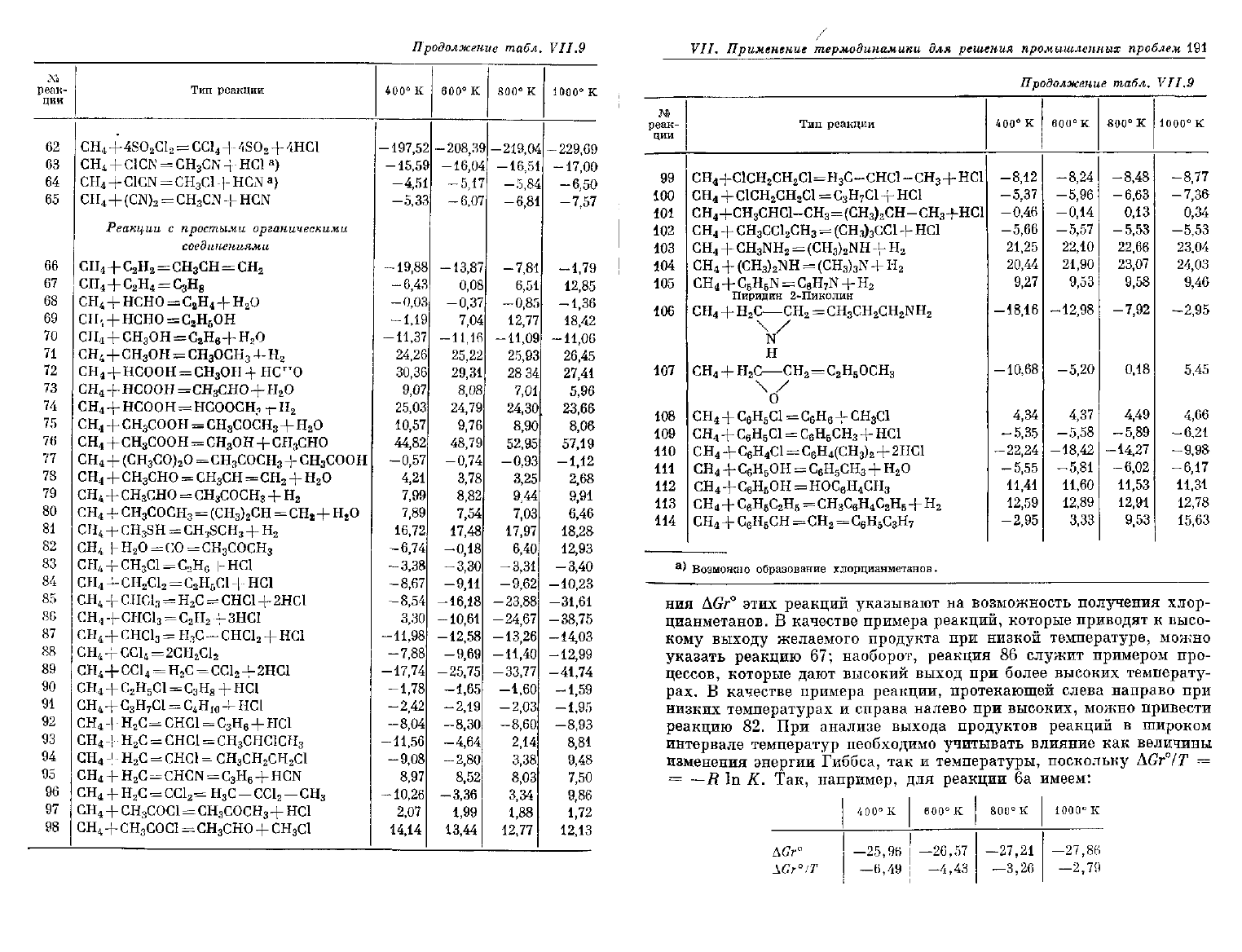
Продолжение
табл.
VII.9
Тип
реакции
400° К
600° К
800° К
1000°К
СН
4
+4SO
2
C1
2
= СС1
4
+4SO
2
+4HC1
СН
4
+ C1CN = CH
3
CN + НС1 а)
СН
4
+ C1CN = СН
3
С1 + HCN
а
)
СН
4
+ (CN)
2
= CH
3
CN + HCN
Реакции
с
простыми
органическими
соединениями
сн
4
+с
2
н
2
=сн
3
сн=сн
2
СН
4
-\-
С
2
Н
4
= С
3
Н
8
СН
4
+НСНО
= С
2
Н
4
+ Н
2
О
=
C
2
H
5
OH
=
С
2
Н
в
+Н
2
О
СН
4
+СН
3
ОН
= СН
3
ОСН
3
-*- Н
2
СН
4
+ НСООН = СН
3
ОН-(- НС
ТТ
О
сн
4
+нсоон=сн
3
сно+н
2
о
СН
4
+ НСООН = НСООСН
? Г
Н
2
СН
4
+ СН
3
СООН = СН
3
СОСН
3
+ Н
2
О
сн
4
+сн
3
соон=сн
3
он+сн
3
сно
СН
4
+ (СН
3
СО)
2
О = СН
3
СОСН
3
+ СН
3
СООН
СН
4
+ СН
3
СНО = СН
3
СН = СН
2
+ Н
2
О
СН
4
+СН
3
СНО
= СН
3
СОСН
3
+ Н
2
СН
4
+ CHgCOCHg = (СН
3
)
2
СН = СН
2
+Н
2
О
сн
4
-+-
CH
3
SH=CH3SCH3
4- н
2
СН
4
(-Н
2
О = СО = СН
3
СОСН
3
СН
4
+ СН
3
С1 = С
2
Н
6
4- НС1
СН
4
4- СН
2
С1
2
= С
2
Н
6
С1 + НС1
СН
4
+ СНС1
3
= Н
2
С = СНС1+2НС1
СН
4
+СНС1
3
= Н
3
С— СНС1
2
+ НС1
4
+ СС1
4
= 2СН
2
С1
2
СН
4
+СС1
4
= Н
2
С = СС1
2
+ 2НС1
СН
4
+ С
2
Н
5
С1 = С
3
Н
8
+ НС1
СН
4
+С
3
Н
7
С1
= С
4
Н
10
4- НС1
СН
4
+ Н
2
С = СНС1 = С
3
Н
8
+ НС1
СН
4
+ Н
2
С = СНС1 = СН
3
СНС1СН
3
СН
4
+ Н
2
С = СНС1 = СН
3
СН
2
СН
2
С1
СН
4
+ Н
2
С = CHCN = С
3
Н
6
-f- HCN
СН
4
+ Н
2
С = СС1
2
= Н
3
С—СС1
2
— СН
3
СН
4
+ СН
3
СОС1 = СН
3
СОСН
3
+ НС1
сн
4
4- CH
3
COCI=сн
3
сно+сн
3
с1
-197,52
-15,59
-4,51
-5,33
-19,88
-6,43
-0,03
-1,19
-11,37
24,26
30,36
9,07
25,03
10,57
44,82
-0,57
4,21
7,99
7,89
16,72
-6,74
-3,38
-8,67
-8,54
3,30
-11,98
-7,88
-17,74
-1,78
-2,42
-8,04
-11,56
-9,08
8,97
-10,26
2,07
14,14
-208,39
-16,04
-5,17
-6,07
-13,87
0,08
-0,37
7,04
-11,16
25,22
29,31
8,08
24,79
9,76
48,79
-0,74
3,78
8,82
7,54
17,48
-0,18
-3,30
-9,11
-16,18
-10,61
-12,58
-9,69
-25,75
-1,65
-2,19
-8,30
-4,64
-2,80
8,52
-3,36
1,99
13,44
-219,04
-16,51
-5,84
-6,81
-7,81
6,51
-0,85
12,77
-11,09
25,93
28 34
7,01
24,30
8,90
52,95
-0,93
3,25
9,44
7,03
17,97
6,40
-3,31
-9,62
-23,88
-24,67
-13,26
-11,40
-33,77
-1,60
-2,03
-8,60
2,14
3,38
8,03
3,34
1,88
12,77
-229,69
-17,00
-6,50
-7,57
-1,79
12,85
-1,36
18,42
-11,06
26,45
27,41
5,96
23,66
8,06
57,19
-1,12
2,68
9,91
6,46
18,28
12,93
-3,40
-10,23
-31,61
-38,75
-14,03
-12,99
-41,74
-1,59
-1,95
-8,93
8,81
9,48
7,50
9,86
1,72
12,13
VII.
Применение
термодинамики
для
решения
промышленных
проблем
191
Продолжение
табл.
VII.9
реак-
ции
99
100
101
102
103
104
105
106
107
108
109
НО
111
112
ИЗ
114
Тип
реакции
сн
4
+асн
2
сн
2
а=н
3
с-сна-сн
3
4-на
сн
4
4-
асн
2
сн
2
а=с
3
н
7
а
4- на
сн
4
+сн
3
снс1-сн
3
=(сн
3
)
2
сн-сн
3
+на
сн
4
4-
сн
3
са
2
сн
3
=(сн
3
)
3
сс14-
на
СН
4
4- CH
3
NH
2
= (CH
3
)
2
NH 4- Н
2
СН
4
4- (CH
3
)
2
NH = (CH
3
)
3
N 4- Н
2
СН
4
4- C
6
H
6
N = CgH
7
N 4- Н
2
Пиридин
2-Пиколин
сн
4
4-
н
2
с—сн
2
=CH
3
CH
2
CH
2
NH
2
V
н
СН
4
4" Н
2
С—СН
2
= С
2
Н
5
ОСН
3
V
сн
4
4-
с
6
н
6
а=с
6
н
6
4-
сн
3
а
сн
4
4-
с
6
н
5
а=с
6
н
5
сн
3
4- на
сн
4
4-
с
6
н
4
а=с
6
н
4
(сн
3
)
2
4- 2на
сн
4
4-
с
6
н
6
он=с
6
н
5
сн
3
4- н
2
о
СН
4
4- С
6
Н
5
ОН = НОС
6
Н
4
СН
3
СН
4
4" СеН
5
С
2
Н5 = CH
3
CgH
4
C
2
H5 4" Н
2
/-1ТТ 1 Г* ТТ ртт ЛП /1 ТТ Гл ТТ
LiXl
4
-р v^gilgOxl = Ъг1
2
= Ligxi5*-*3^7
400° К
-8,12
-5,37
-0,46
-5,66
21,25
20,44
9,27
-18,16
-10,68
4,34
-5,35
-22,24
-5,55
11,41
12,59
-2,95
600°К
-8,24
-5,96
-0,14
-5,57
22,10
21,90
9,53
-12,98
-5,20
4,37
-5,58
-18,42
-5,81
11,60
12,89
3,33
800° К
-8,48
-6,63
0,13
-5,53
22,66
23,07
9,58
-7,92
0,18
4,49
-5,89
-14,27
-6,02
11,53
12,91
9,53
1000°К
-8,77
-7,36-
0,34
-5,53
23,04
24,03
9,46
-2,95
5,45
4,66
-6,21
-9,98
-6,17
11,31
12,78
15,63
Возможно
образование
хлорцианметанов.
ния
AGr°
этих реакций указывают на возможность получения хлор-
цианметанов. В качестве примера реакций, которые приводят к высо-
кому
выходу
желаемого продукта при низкой температуре, можно
указать реакцию 67; наоборот, реакция 86
служит
примером про-
цессов, которые
дают
высокий
выход
при более высоких
температу-
рах. В качестве примера реакции, протекающей слева направо при
низких
температурах
и справа налево при высоких, можно привести
реакцию 82. При анализе
выхода
продуктов реакций в широком
интервале
температур
необходимо
учитывать
влияние как величины
изменения энергии Гиббса, так и температуры, поскольку
AGr°/T
=
=
—R In К. Так, например, для реакции 6а имеем:
\Gr°
IT
400°
—25,
—6,
к
96
49
600°
-26,
-4,
к
57
43
800
е
—27
—3
К
,21
,26
1000
е
—27,
2
К
86
79
192
Часть
1.
Основы термодинамики
Такое соотношение величин
AGr°
и Т
отвечает более высокому
выходу
продукта реакции
при
более низких температурах.
Метод термодинамического анализа, базирующийся
на
использо-
вании
величин энергии Гиббса, позволяет рассмотреть поведение
той или иной системы реагирующих веществ при высоких давлениях
и
температурах. При этом
следует
подчеркнуть, что выводы
о
равно-
весных свойствах системы, полученные
с
помощью термодинамики,
основываются только
на
данных
по
теплотам
и
энергиям образова-
ния
веществ,
участвующих
в
данном процессе.
Производство стирола
Исчерпывающий термодинамический анализ технологических
процессов, связанных
с
производством стирола,
был дан
Сталлом
[1433].
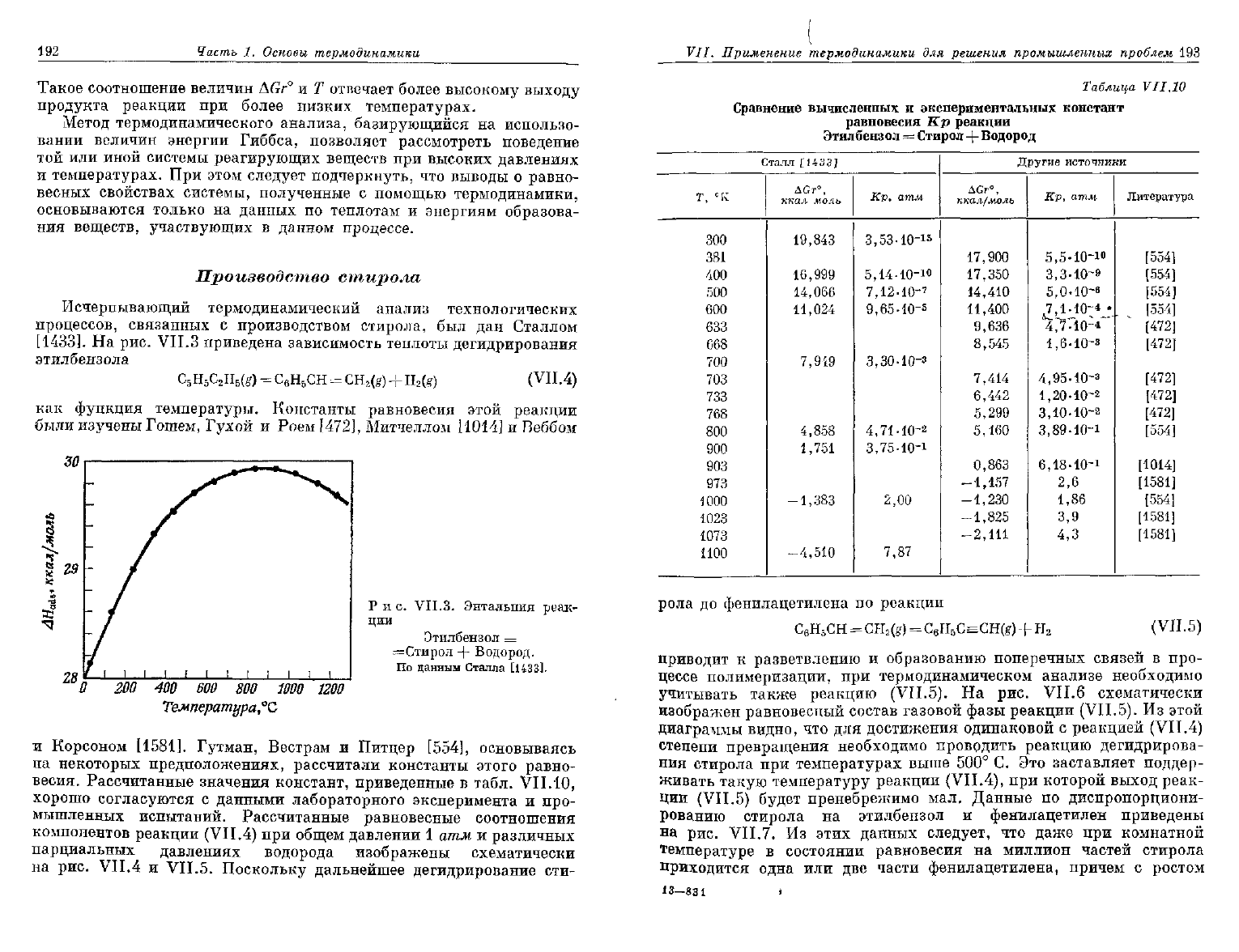
На рис.
VII.3 приведена зависимость теплоты дегидрирования
этилбензола
C
6
H
5
C
2
H
5
(g)
=
С
6
Н
5
СН
=
CH
2
(g)
+
H
2
(g) (VII.4)
как
функция температуры. Константы равновесия этой реакции
были изучены Гошем, Гухой
и
Роем [472], Митчеллом
[1014]
и
Веббом
Р
и с.
VII.3.
Энтальпия
реак-
ции
Этилбензол
=
=Стирол
+
Водород.
По
данным Сталла [1433].
О
200
400
600 800 1000
Температура °Сг
1200
и
Корсоном [1581]. Гутман, Вестрам
и
Питцер [554], основываясь
на
некоторых предположениях, рассчитали константы этого равно-
весия.
Рассчитанные значения констант, приведенные
в
табл.
VII.10,
хорошо согласуются
с
данными лабораторного эксперимента
и
про-
мышленных испытаний. Рассчитанные равновесные соотношения
компонентов
реакции (VI 1.4) при общем давлении
1
атм
и
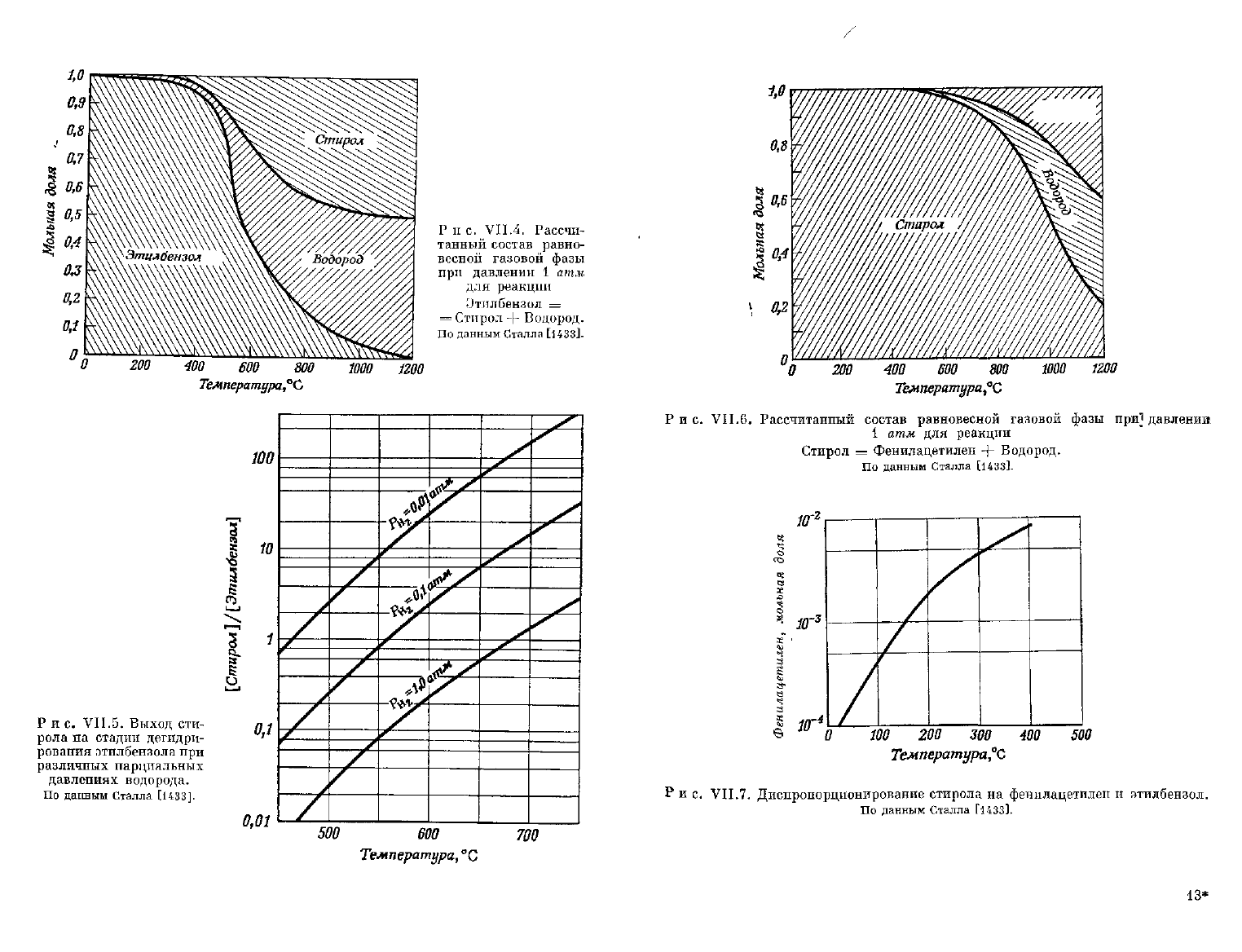
различных
парциальных давлениях водорода изображены схематически
на
рис.
VII.4
и
VII.5. Поскольку дальнейшее дегидрирование сти-
VII.
Применение термодинамики
для
решения промышленных проблем
193
Таблица
VII.10
Сравнение вычисленных
и
экспериментальных констант
равновесия
Кр
реакции
Этилбензол
=
Стирол
+
Водород
г,
°к
300
381
400
500
600
633
668
700
703
733
768
800
900
903
973
1000
1023
1073
1100
Сталл
[1433]
\Gr°,
кпал
моль
19,843
16,999
14,066
11,024
7,949
4,858
1,751
-1,383
-4,510
Кр,
атм
3,53-Ю-"
5,14-10-ю
7,12-Ю-
7
9,65-10-
5
3,30-10-»
4,71-10-
2
3,75-10-1
2,00
7,87
AGr°,
ккал/моль
17,900
17,350
14,410
11,400
9,636
8,545
7,414
6,442
5,299
5,160
0,863
-1,157
-1,230
-1,825
-2,111
Другие источники
Кр,
атм
5,5-10-ю
3,3-10-9
5,0-10-в
7,Ы0-4
•
'4,7Г10
:
^
1,6-10-з
4,95-Ю-з
1,20-10-2
3,10-10-2
3,89-10-1
6,18-10-1
2,6
1,86
3,9
4,3
Литература
[554]
[554]
[554]
.. [554]
[472]
[472]
[472]
[472]
[472]
[554]
[1014]
[1581]
[554]
[1581]
[1581]
рола
до
фенилацетилена
по
реакции
С
6
Н
3
СН
=
CH
2
(g)
=
С
6
Н
5
СЕЕСН(£)
+
Н
2
(VII.5)
приводит
к
разветвлению
и
образованию поперечных связей
в
про-
цессе полимеризации, при термодинамическом анализе необходимо
учитывать также реакцию (VII.5).
На рис.
VII.6
схематически
изображен равновесный состав газовой фазы реакции (VII.5). Из этой
Диаграммы видно, что для достижения одинаковой
с
реакцией (VII.4)
степени превращения необходимо проводить реакцию дегидрирова-
ния
стирола при температурах выше
500°
С. Это заставляет поддер-
живать такую температуру реакции (VII.4), при которой
выход
реак-
ции
(VII.5)
будет
пренебрежимо мал. Данные
по
диспропорциони-
рованию стирола
на
этилбензол
и
фенилацетилен приведены
на
рис. VII.7.
Из
этих данных
следует,
что
даже
при комнатной
температуре
в
состоянии равновесия
на
миллион частей стирола
приходится одна или
две
части фенилацетилена, причем
с
ростом
13—831
<
200
400
600 800
Телтература°С
Р
и с.
VII.4. Рассчи-
танный
состав равно-
весной газовой фазы
при
давлении
1
атм.
для реакции
Этилбензол
=
=
Стирол
+
Водород.
По
данным Сталла [1433].
1000
1200
Рис.
VII.5.
Выход
сти-
рола
на
стадии дегидри-
рования
этилбензола при
различных парциальных
давлениях водорода.
По
данным Сталла [1433].
I
I
»
1
100
10
1
0,1
П1
/
/
/
Г
У
/
A
A
У
V
A
У
/
У
У
*•—
у
а
200 400 еоо то woo 1200
Темпершпура^С
Рис.
VII.6. Рассчитанный состав равновесной газовой фазы при] давлении
1
атм
для
реакции
Стирол
=
Фенилацетилен
+
Водород.
По
данным Сталла [1433].
10
1-2
в
S
3
!
в
ч
/
/
/
f
100
200 300 400
Температура,°С
500
Рис.
VII.7.
Диспропорцпонирование стирола
на
фенилацетилен
и
этилбензол.
По
данным Сталла [1433].
500
600
Температура,
°С
700
13*
196
Часть
1.
Основы
термодинамики
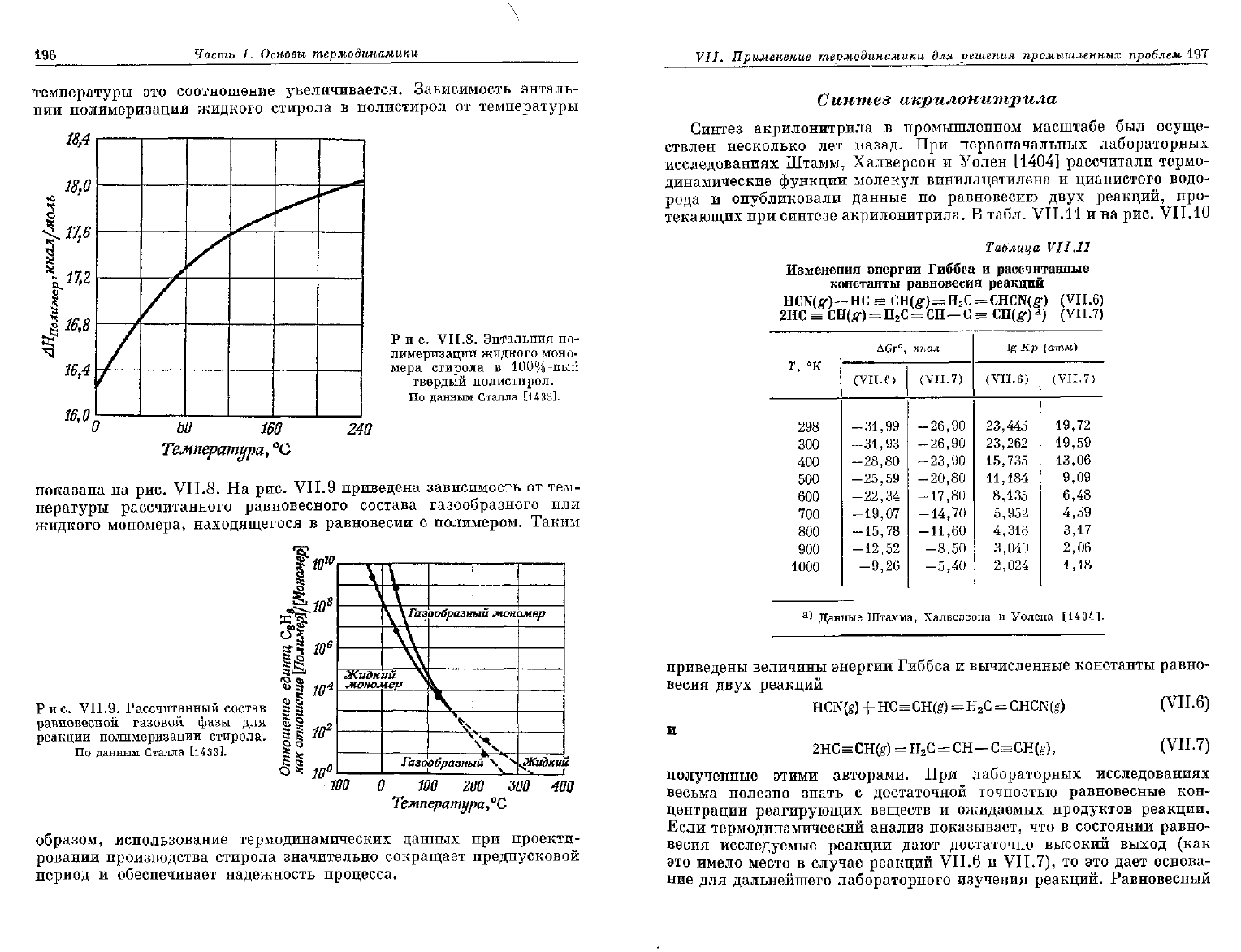
температуры
это
соотношение увеличивается. Зависимость энталь-
пии
полимеризации жидкого стирола
в
полистирол
от
температуры
18,4
18,0
Ц6
\
т
16,8
16,4
16,0
Рис.
VII.8.
Энтальпия
по-
лимеризации
жидкого
моно-
мера
стирола
в
100%
-ный
твердый
полистирол.
По
данным Сталла [1433].
80
160
Температура,
°С
240
показана
на
рис. VII.8.
На рис.
VII.9
приведена зависимость
от тем-
пературы рассчитанного равновесного состава газообразного
или
жидкого мономера, находящегося
в
равновесии
с
полимером. Таким
10*
Рис.
VII.9.
Рассчитанный
состав
равновесной
газовой
фазы
для
реакции
полимеризации
стирола.
По
данным Сталла [1433].
\
\
V
д
\\
Жидкий
X
•мономер
юбразн
\
\
Газообразнъ
ыимон
мер
^Жидкий
-100
0 100 200 300
Температура
°С
400
образом, использование термодинамических данных
при
проекти-
ровании
производства стирола значительно сокращает предпусковой
период
и
обеспечивает надежность процесса.
VII.
Применение термодинамики
для
решения промышленных проблем
197
Синтез
акрилоиитрила
Синтез
акрилонитрила
в
промышленном масштабе
был
осуще-
ствлен несколько
лет
назад.
При
первоначальных лабораторных
исследованиях Штамм, Халверсон
и
Уолен
[1404]
рассчитали термо-
динамические функции молекул винилацетилена
и
цианистого водо-
рода
и
опубликовали данные
по
равновесию
двух
реакций,
про-
текающих при синтезе акрилонитрила.
В
табл.
VII.11
и на
рис.
VII.10
Таблица
VII.11
Изменения
энергии
Гиббса
и
рассчитанные
константы
равновесия
реакций
HCN(g-)+HC
= I
2НС
=
CH()
H
т,
°к
298
300
400
500
600
700
800
900
1000
AGr°,
(VII.6)
-31,99
-31,93
-28,80
-25,59
-22,34
-19,07
-15,78
-12,52
-9,26
ккал
(VII.7)
-26,90
-26,90
-23,90
-20,80
-17,80
-14,70
-11,60
-8,50
-5,40
\g Kp
(атм)
(VII.6)
23,445
23,262
15,735
11,184
8,135
5,952
4,316
3,040
2,024
(VII.7)
19,72
19,59
13,06
9,09
6,48
4,59
3,17
2,06
1,18
a
) Данные Штамма, Халверсона
и
Уолена [1404].
приведены величины энергии Гиббса
и
вычисленные константы равно-
весия
двух
реакций
HCN(g)
+
HC=CH(g)
=
H
2
C
=
CHCN(g)
(VII.6)
2HC=CH(g)=H
2
C
=
CH—C=
полученные этими авторами.
При
лабораторных исследованиях
весьма полезно знать
с
достаточной точностью равновесные
кон-
центрации
реагирующих веществ
и
ожидаемых продуктов реакции.
Если
термодинамический анализ показывает,
что
в
состоянии равно-
весия
исследуемые реакции
дают
достаточно высокий
выход
(как
это
имело место
в
случае
реакций
VII.6
и
VII.7),
то
это
дает
основа-
ние
для
дальнейшего лабораторного изучения реакций. Равновесный
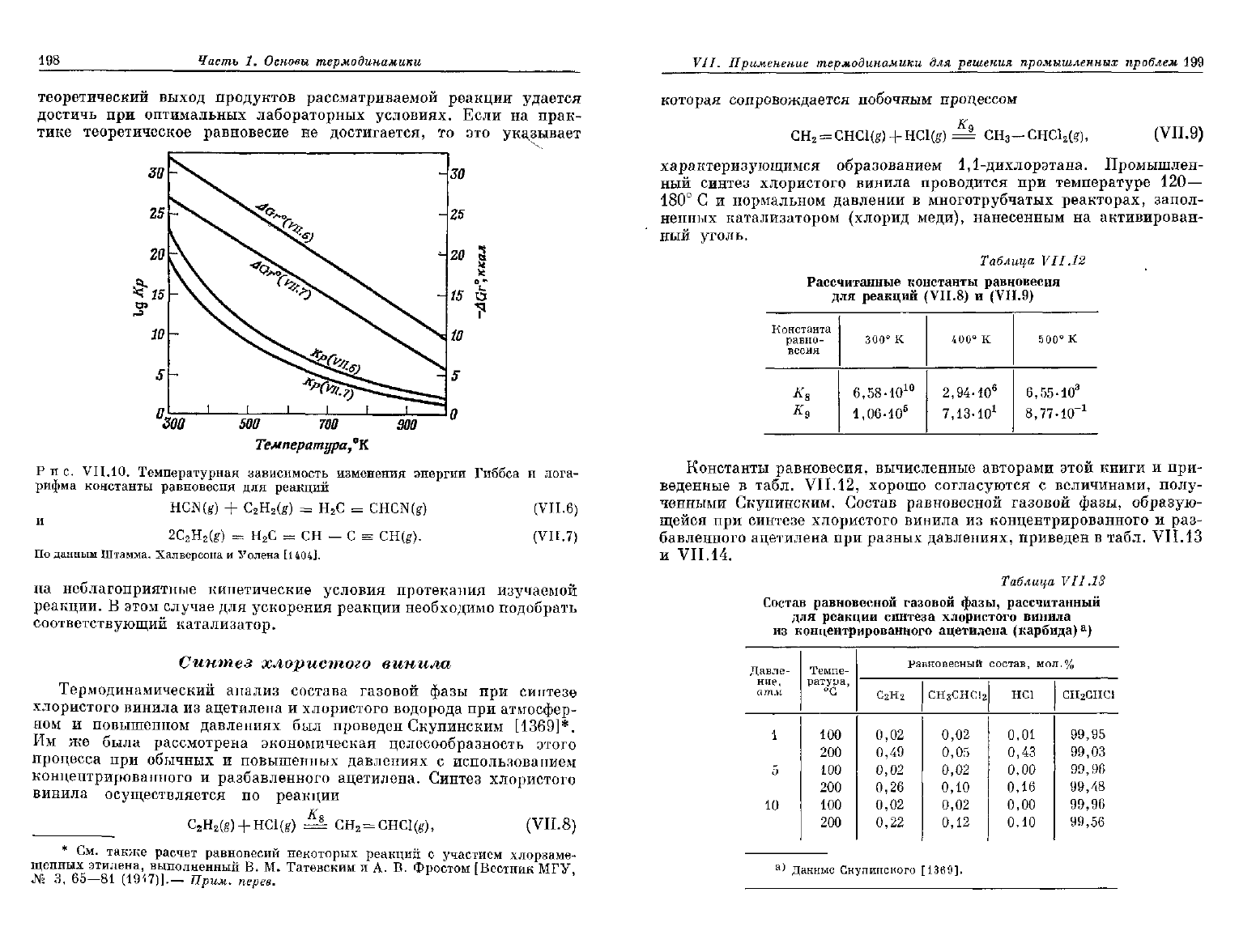
198
Часть
1,
Основы термодинамики
теоретический
выход
продуктов рассматриваемой реакции удается
достичь при оптимальных лабораторных условиях. Если
на
прак-
тике теоретическое равновесие
не
достигается,
то это
указывает
30-
VII. Применение термодинамики
для
решения промышленных проблем
199
500
700 300
Температура,°К
Рис.
VII.10.
Температурная
зависимость
изменения
энергии
Гиббса
и
лога-
рифма
константы
равновесия
для
реакций
HCN(g)
+
С
2
Н
2
(£)
=
Н
2
С
=
CHCN(g)
(VII.6)
и
2C
2
H
2
(g)
=
Н
2
С
=
СН — С
=
CH(g).
(VII.7)
По
данным
Штамма.
Халверсона
и
Уолена
[1404].
на
неблагоприятные кинетические условия протекания изучаемой
реакции.
В
этом
случае
для ускорения реакции необходимо подобрать
соответствующий катализатор.
Синтез хлористого винила
Термодинамический анализ состава газовой фазы
при
синтезе
хлористого винила
из
ацетилена
и
хлористого водорода
при
атмосфер-
ном
и
повышенном давлениях
был
проведен Скупинским [1369]*.
Им
же
была рассмотрена экономическая целесообразность этого
процесса
при
обычных
и
повышенных давлениях
с
использованием
концентрированного
и
разбавленного ацетилена. Синтез хлористого
винила
осуществляется
по
реакции
C
2
H
2
(g)
+
HCl(g)
Jj=
CH
2
=CHCI(g),
(VII.8)
* См.
также расчет равновесий некоторых реакций
с
участием хлорзаме-
щенных этилена, выполненный
В. М.
Татевским
и А. В.
Фростом [Вестник
МГУ
№
3, 65-81
(19*7)].—Ярил»,
перев.
которая
сопровождается побочным процессом
CH
2
=
CHCl(g)
+
HCl(g)
=
CH
3
-CHCl
2
(g),
(VII.9)
характеризующимся образованием
1,1-дихлорэтана.
Промышлен-
ный
синтез хлористого винила проводится при температуре 120—
180° С
и
нормальном давлении
в
многотрубчатых реакторах, запол-
ненных
катализатором (хлорид меди), нанесенным
на
активирован-
ный
уголь.
Таблица
VI
1.12
Рассчитанные константы равновесия
для реакций (VII.8)
и
(VII.9)
Константа
равно-
весия
*9
6
1
300
,58-
,06-
" К
10
10
10
6
2
7
400
,94
,13
°
к
• 10
е
• 10
1
6
8
500
,55-
,77-
10
3
10"
1
Константы
равновесия, вычисленные авторами этой книги
и
при-
веденные
в
табл. VI 1.12, хорошо согласуются
с
величинами, полу-
ченными
Скупинским. Состав равновесной газовой фазы, образую-
щейся
при синтезе хлористого винила из концентрированного
и
раз-
бавленного ацетилена при разных давлениях, приведен
в
табл.
VII.13
и
VII.14.
Таблица VII.13
Состав
равновесной газовой фазы, рассчитанный
для реакции синтеза хлористого винила
из концентрированного ацетилена (карбида)
а
)
Давле-
ние,
атм
1
5
10
Темпе-
ратура,
"С
100
200
100
200
100
200
с
2
н
2
0,02
0,49
0,02
0,26
0,02
0,22
Равновесный
СН
3
СНС1
2
0,02
0,05
0,02
0,10
0,02
0,12
состав,
НС1
0,01
0,43
0,00
0,16
0,00
0,10
мол.%
СН
2
СНС1
99,95
99,03
99,96
99,48
99,96
99,56
Данные Скупииского [1369].

200
Часть
1.
Основы
термодинамики
Таблица
VII.14
Состав равновесной газовой фазы, рассчитанный
для
реакции синтеза
хлористого винила
из
разбавленного (7,7 об.%) ацетилена
а
)
Давление,
агам,
5
10
Темпера-
т>ра,
°С
100
200
100
200
Равновесный состав,
мол.%
инертный
газ
92,31
92,26
92,31
92,27
С
2
Н
2
0,00
0,06
0,00
0,04
СН
3
СНС1
2
о о о о
НС1
0,00
0,06
0,00
0,04
СН
2
СНС1
7,69
7,63
7,69
7,64
Степень
пре-
вращения
С
2
Н
2
в
СН
2
СНС1,
%
100
99,22
100
99,35
Данные Скушшского [1369].
Приведенные
в
таблицах данные позволяют сделать следующие
выводы:
1) суммарная степень превращения ацетилена
в
хлористый винил
несколько
уменьшается
с
ростом температуры
и
очень мало зависит
от повышения давления;
2) количество образующегося
1,1-дихлорэтана
слабо возрастает
с увеличением давления. Поэтому
с
термодинамической точки зрения
синтез хлористого винила выгоднее проводить
при
низких давле-
ниях
и
невысоких температурах. Хотя термодинамический анализ
не
позволяет сделать вывод
о
благоприятном влиянии давления
на
синтез хлористого винила,
тем не
менее,
как
показывает опыт,
выход
хлористого винила
при
добавлении требуемого количества
катализатора почти пропорционально возрастает
с
увеличением
давления
при
использовании
как
концентрированного,
так и
раз-
бавленного ацетилена. Поэтому наиболее экономичные условия
проведения процесса
будут
определяться стоимостью катализатора
и
производственными затратами
на
создание
и
эксплуатацию ком-
прессорных установок.
Термодинамика синтеза метанола
Производство метанола из окиси
углерода
и
водорода
по
реакции
2
(g)=CH
3
OH(g)
осуществляется
на
многих заводах, однако опубликовано весьма
мало данных
о
наилучших условиях этого синтеза
*. В
связи
с
этим
* Подробный обзор имеющихся литературных данных
по
термодинамичес-
ким
параметрам синтеза метанола из СО
и
Н
2
(g) можно найти
в
книге:
А. А.
Вве-
денский,
Термодинамические расчеты нефтехимических процессов, Гостоитех-
издат,
Л.,
1960.—
Прим.
перев.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
201
Томас
и
Портальский
[1486]
применили
для
нахождения оптималь-
ных условий синтеза метанола термодинамический метод
и
опре-
делили влияние давления
и
температуры
на
энтальпию
и
химиче-
ское равновесие реакции (VI
1.10).
Из
уравнения состояния, запи-
санного
в
виде
\дР
)т~
видно,
что
в
случае
идеального газа энтальпия реакции
не
зависит
от давления.
Следует,
однако, отметить, что при повышенных давле-
ниях
смесь газов
не
будет
вести себя как идеальная, поэтому давле-
ние
будет
влиять
на
энтальпию рассматриваемой реакции. Приме-
нение
уравнения Бертло ко всем участникам реакции (VI
1.10),
после-
дующее
суммирование
и
интегрирование окончательного выражения
приводит
к
следующей зависимости изменения энтальпии реакции
от давления при повышенных давлениях:
р
Р
j AVdP-T
j (
p°
P"
Подстановка этой зависимости
в
уравнение Вант-Гоффа
дает
сле-
дующее
выражение:
d In
Ka
dT
Ш
RT2
где
Ка —
константа равновесия, выраженная через активности.
Активность каждого участника реакции
(VII.10)
может быть заме-
нена
летучестью
/, которую
в
свою очередь можно представить
как
произведение парциального давления
р и
коэффициента летучести
у,
так
как / = ру.
Поскольку данные
по
летучести индивидуальных
газов
в
газовых смесях
не
всегда имеются
в
литературе, летучесть-
компонента
в
смеси можно приближенно выразить
с
помощью соот-
ношения
/ a. Nf, где / —
летучесть
компонента
в
смеси,
а /' —
летучесть
чистого компонента при общем давлении
Р, /' = Ру', a N —
мольная
доля компонента
в
газовой смеси.
В
таком
случае
'снзон
\ '-
feffH
2
)
р-г,
(VII.11)
г=
(-
N.
где
2 —
это изменение числа молей
участвующих
в
реакции веществ,
а
Определив значения
у' в
выражении
(VII.11)
из диаграмм активности
и
летучести, построенных Ньютоном
и
Доджем [1063], нетрудно рас-
считать величины константы равновесия
Кр'
при высоких темпера-
