Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

142
Часть
1.
Основы
термодинамики
V
Энергия
Гиббса
и
химическое
равновесие
143
реагирующих веществ, увеличение давления и добавление инертного
газа не
будут
влиять на равновесный состав смеси идеальных газов.
При
выводе соотношения между равновесным составом и измене-
нием
стандартной энергии Гиббса необходимо учитывать также тип
реакции.
Пусть для трех реакций:
А+В =
С,
А+В=2С,
А+В=ЗС
величины
AGr°
будут
равны, причем это значение должно быть выбра-
но
таким образом, чтобы для трех реакций Кр = 0,05. Тогда констан-
ты равновесия этих реакций при давлении 1 атм
будут
иметь сле-
дующий вид:
х(2-х)
К
Р
= -
Кр=
п
А
-п
в
(«с)
3
• = 0,05 =-
d-г/)
2
•
= 0,05=^-
(Зг)з
n
A
-n
B
-n
tot
Решим
эти уравнения, предположив, что количество каждого реаги-
рующего вещества А и В равно 1 молю, и обозначив в выражениях
для констант равновесные значения Nc через х, 2у и 3z:
г =
0,024,
га
с
=
0,024
моля,
у =
0,101,
л
с
=0,202 моля,
z =
0,143,
га
с
=
0,429
моля.
Из
приведенных значений видно, что хотя изменение энергии Гиббса
для всех трех реакций одно и то же, тем не менее выход продукта С
в
случае реакций второго и третьего типа
будет
|гораздо больше,
чем в первом случае.
Расчет
равновесного
состава
газовой
смеси
Расчет равновесных составов с помощью констант равновесия
часто связан с решением уравнений третьей и четвертой степени,
а также уравнений более высоких порядков. Полное решение таких
уравнений во многих случаях
требует
трудоемких и утомительных
расчетов, поэтому часто пользуются упрощенными методами. Один
из
таких методов, значительно сокращающий время и количество
вычислений,—
это метод последовательных приближений, основан-
ный
на так называемых «чувствительных факторах». Анализ констан-
ты равновесия
Усмотренной выше реакции А + В = ЗС показывает, что числен-
значение х — небольшая величина, поэтому значение (1 — х)
|дет почти равно единице, а величина (2 + х) примерно равна
|»ум. Чувствительным фактором в этом случае является функция
с)
3
,
поскольку (1 — х) и (2 + х) очень мало зависят от небольшой
+J
+1
а-
~о
-1
-2
-3
-4
1,0
0
1,0
/
/
/
/
/
/
1
/
/
/
/
1 1
/
/
у
/
/\
О
0,5
х
1,0
1
W
V/
ч/
V
1
1
л
/
>
<
л
ей
У
>
КЗ
г
У
у
/
J
j
t
у
j
/
/i
/J
III
/n\
/ \
l\
(
0,5
х
1,0
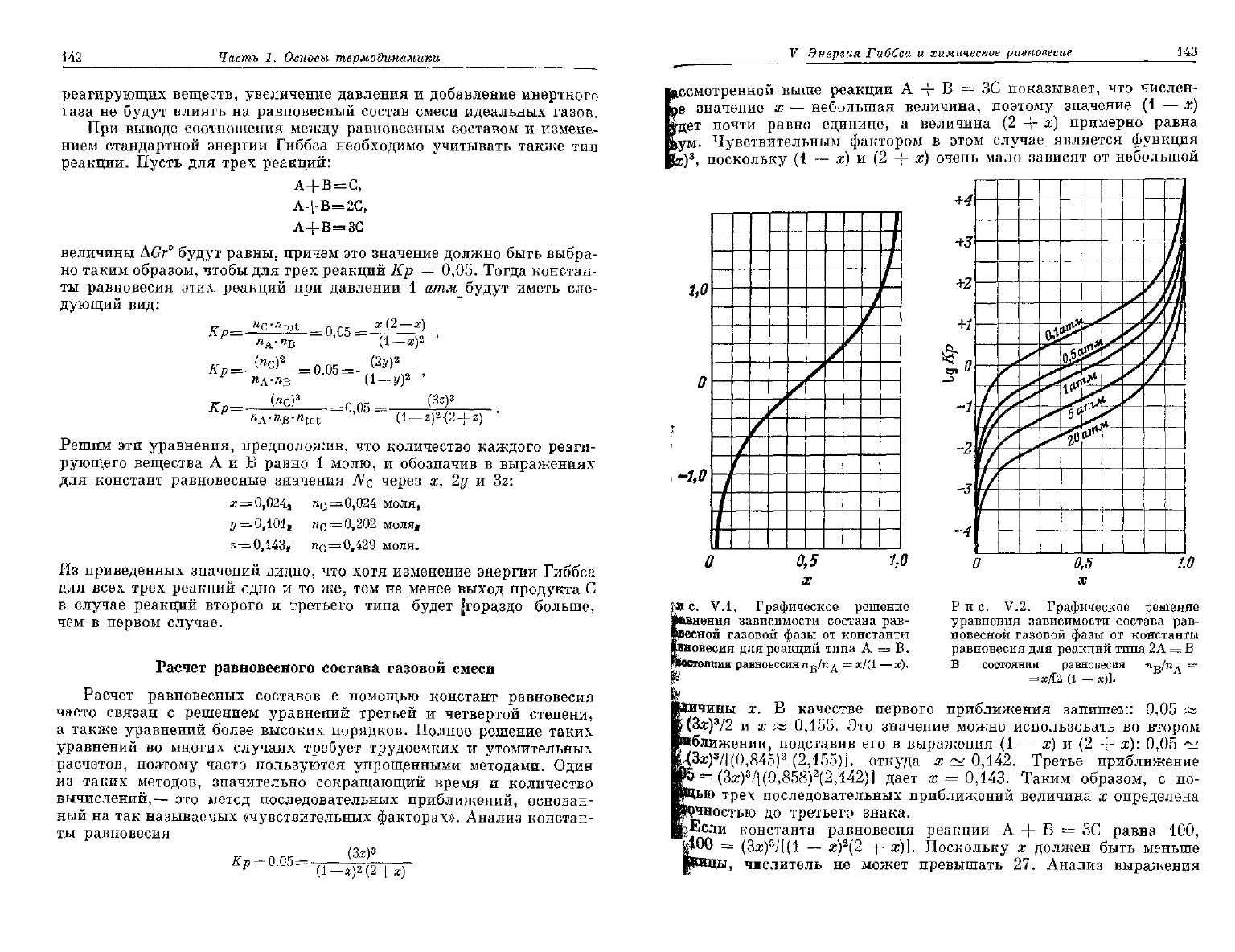
Etc.
V.I. Графическое решение
яения
зависимости состава рав-
сной газовой фазы от константы
вовесия для реакций типа А = В.
ннии
равновесия п
в
/п
А
= х/(1 —ж).
Рис.
V.2. Графическое решение
уравнения зависимости состава рав-
новесной газовой фазы от константы
равновесия для реакций типа 2А = В
В состоянии равновесия
n
^j
n
A
~
гаы
х.
В качестве первого приближения запишем: 0,05 х
i(3a;)
3
/2 и х яа
0,155.
Это значение можно использовать во втором
«ближении, подставив его в выражения (1 — х) и (2 + х):
0,0£»
~
'
3
/f(0,845)
2
(2,155)], откуда х ~
0,142.
Третье приближение
(За:)
3
/[(0,858)
2
(2,142)] дает х = 0,143. Таким образом, с по-
трех последовательных приближений величина х определена
г
?чностью до третьего знака.
,}Если
константа равновесия реакции А + В = ЗС равна 100,
*00 = (Зх)
3
/[(1 — х)
2
(2 + а;)]. Поскольку х должен быть меньше
, чжслитель не может превышать 27. Анализ выражения
144
Часть
1.
Основы
термодинамики
V.
Энергия
Гиббса
и
химическое
равновесие
145
+4
+3
+2
+1
-1
-2
~3
г
/
//
///
if/
If/
l/
у
A
f /
/
//
/
/
>
>
у*.
у
4
у
у
у
й
У^
}У
у*
у
У*
1
/1
/
//
/
+4
о
0,5
х
1,0
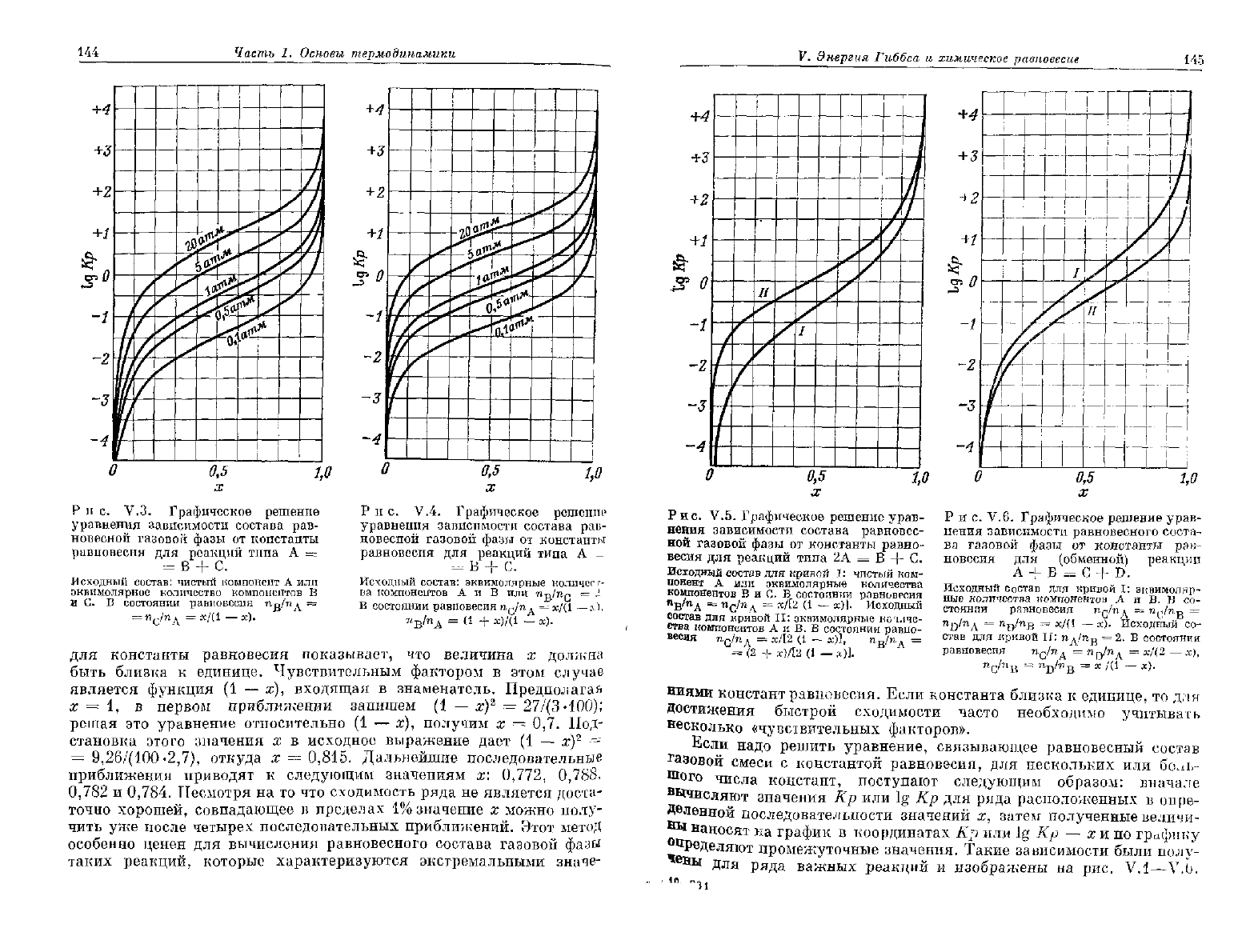
Р ц с. V.3.
Графическое
решение
уравнения
зависимости
состава
рав-
новесной
газовой
фазы
от
константы
равновесия
для
реакций
типа
А =
= В + С.
Исходный
состав:
чистый
компонент А или
эквимолярное
количество
компонентов
В
и С. В состоянии
равновесия
n-o/п д =
d
^
1
)
Р и с. V.4.
Графическое
решение
уравнения
зависимости
состава
рав-
новесной
газовой
фазы
от
константы
равновесия
для
реакций
типа
А -
= В + С.
Исходный
состав:
эквимолярные
количест-
ва
компонентов
А и В или
п-а/пп
= 2
В состоянии
равновесия
п^/п д = ж/(1 —.г),
"
В
М
А
= (1 + х)/(1 — ж).
для константы равновесия показывает, что величина х должна
быть близка к единице. Чувствительным фактором в этом случае
является функция (1 — х), входящая в знаменатель. Предполагая
х
= 1, в первом приближении запишем (1 — х)
2
= 27/(3-100);
решая это уравнение относительно (1 — х), получим х = 0,7. Под-
становка этого значения х в исходное выражение дает (1 — х)
2
•=
=
9,26/(100-2,7), откуда х = 0,815. Дальнейшие последовательные
приближения
приводят к следующим значениям х:
0,772,
0,788,
0,782
и
0,784.
Несмотря на то что сходимость ряда не является доста-
точно хорошей, совпадающее в пределах 1% значение х можно полу-
чить уже после четырех последовательных приближений. Этот метод
особенно
ценен для вычисления равновесного состава газовой фазы
таких реакций, которые характеризуются экстремальными значе-
+4
+3
+2
-2
-3
-4
—
/
/
/
/
у/
/
{
II
у
у.
/
у
у
у
I
у
у у
/
/
/>
1
]
л
7
0,5
х
1,0
Рис. V.5.
Графическое
решение
урав-
нения
зависимости
состава
равновес-
ной
газовой
фазы
от
константы
равно-
весия
для
реакций
типа
2А = В + С.
Исходный
состав
для кривой I:
чистый
ком-
понент А или эквимолярные
количества
компонентов
В и С. В состоянии
равновесия
П
В'
П = П
/
П х
^ ^ *)'
Исходный
В'
П
А
тоянии
равновесия
ВА с/А ^ —
*)'•
Исходный
состав
для кривой II: эквимолярные
нсыче-
ства
компонентов
А и В. В состоянии равно-
весия
п
с
!п
зс/[2 (1 — к)],
п
в
/п
А
=
'=
(2 + ж)/[2 (1 — х)].
+J
U
СП 0
-1
п
-з\
-4\
1
I
I
Г/
f
1
. А
I
'У
у
1
у
У
II
/
s
А
У*
V
/
\
\
1
/
1
1
1
—J
0,5
х
1,0
Рис. V.6.
Графическое
решение
урав-
нения
зависимости
равновесного
соста-
ва
газовой
фазы
от
константы
рав-
новесия
для
(обменной)
реакции
А + В = С + D.
Исходный
состав
для кривой I: эквимоляр-
ные
количества
компонентов
А и В. В со-
стоянии
равновесия
п
с
/п ^ =
n^/n-g
=
п
о'
п
А
=
"г/
п
В —
x
/(
l
~
х
)-
Исходный
со-
став
для кривой II: п^/п
в
= 2. В состоянии
равновесия
п
с
/п
д
*= n
D
M
A
= х/(2 — х),
' ' 1
ниями
констант равновесия. Если константа близка к единице, то для
Достижения быстрой сходимости часто необходимо учитывать
несколько
«чувствительных факторов».
Если
надо решить уравнение, связывающее равновесный состав
газовой
смеси с константой равновесия, для нескольких или боль-
шого числа констант, поступают следующим образом: вначале
вычисляют
значения Кр или lg Кр для ряда расположенных в опре-
деленной последовательности значений х, затем полученные величи-
**
Ь1
наносят на график в координатах Кр или lg Кр — х и по графику
еДеЛЯК>Т п
Р
омеж
У
точные
значения. Такие зависимости были полу-
Для ряда важных реакций и изображены на рис.
V.1—V.b.
10-831

146
Часть
1.
Основы
термодинамики
Наиболее простое равновесие реакции изомеризации можно
представить уравнением А = В. В качестве примера можно при-
вести равновесие
между
пропиловым и изопропиловым спиртами или
между
ацетоном и пропионовым альдегидом. В этих реакциях давле-
ние
не влияет на выход, и все они характеризуются одинаковой зави-
симостью
между
энергией Гиббса и составом, приведенной на
рис.
V.I. Для того чтобы использовать этот график, необходимо
найти
в таблицах логарифм равновесного состава В при требуемой
температуре, вычесть из него соответствующий логарифм состава А,
записать полученное значение lg Кр и графически определить число
молей В, находящихся в равновесии с соответствующим числом
молей А. При этом предполагают, что исходным веществом является
1
моль вещества А. В качестве примера вычислим состав равновесной
газовой фазы реакции
цис-CHCl
= CHClfe) =
транс-CRCl
= CHCl(g)
V.
Энергия
Гиббса
и
химическое
равновесие
147
при
500°
К. Из таблиц определяем значение lg Кр этой реакции,
равное
—0,214.
По графику находим, что соответствующее этой кон-
станте равновесия число молей тгаракс-1,2-дихлорэтилена в газовой
фазе
будет
равно 0,38, а число молей умс-1,2-дихлорэтилена — 0,62.
Две одинаковые молекулы
могут
реагировать
друг
с
другом
с обра-
зованием новой молекулы по уравнению 2А = В. Поскольку эта
реакция
сопровождается изменением числа молей
участвующих
в ней
веществ, давление
будет
влиять на выход. Зависимость равновес-
ного
выхода
продукта В от давления графически представлена
на
рис. V,2. В качестве примера такого типа реакции можно привестг
димеризацию тетрафторэтилена в циклооктафторбутан:
Из
таблиц для этих веществ определяем значение lg Кр при
1000°
К,
равное
0,645.
По графику находим, что равновесная газовая фаза
при
давлении 1 атм содержит 0,62 мольной доли димера.
Весьма важными являются реакции типа А = В -\- С, например
реакции
дегидратации, дегидрирования и дегидрогалогенирования.
Выход
в реакциях такого типа зависит как от давления, так и от
исходного состава системы. Весьма важен случай, когда исходная
система состоит из чистого вещества А, при этом равновесная газо-
вая смесь
будет
содержать эквимолярные количества продуктов В
и
С. Составы равновесной газовой смеси при различных давлениям
для этого случая графически изображены на рис. V.3. Если необ-
ходимо подавить диссоциацию исходного вещества А, то в исходную
газовую
смесь нужно добавить некоторое количество вещества В
или
С. На рис. V.4 представлены равновесные составы газовой смеси
при
различных давлениях для исходного эквимолярного соотношения
веществ А и В. Из данных, приведенных в гл. IX для реакции
[при
1000°
К, находим lg Кр =
—0,464.
Из рис. V.3
следует,
что
3 1 моля чистого этана в равновесной газовой фазе при давлении
1
атм образуется 0,50 моля этилена. Если исходная газовая смесь
*' состоит из 1 моля этана и 1 моля водорода, то, как
следует
из рис. V.4,
в
равновесной газовой фазе при давлении 1 атм содержится
*' 0,38 моля этилена.
В некоторых реакциях 2 молекулы исходного вещества
могут
реа-
1
гировать с образованием 2 новых молекул, т. е. 2А
=•
В + С. Дав-
""ление не влияет на
выход
в реакции такого типа, поскольку число
молей не изменяется. В то же время равновесный состав газовой
смеси зависит от соотношения исходных компонентов. Такая ситуа-
ция
представлена графически на рис. V.5. В качестве примера
такого типа реакций рассмотрим распад метилового спирта
2CH
3
OH(g) = (CH
3
)
2
O(g) + H
2
O(g).
Используя данные, приведенные в гл. VIII и X, находим, что
вначение lg Кр этой реакции при
800°
К равно
0,493.
Из рис. V.5
следует,
что из 1 моля чистого метилового спирта в равновесии
образуется 0,39 моля диметилового эфира. Если же исходная смесь
состоит из 1 моля метилового спирта и 1 моля воды, то равновесная
газовая смесь независимо от давления
будет
содержать 0,32 моля
диметилового эфира.
Две различные молекулы А и В
могут
вступать в обменную реак-
цию с образованием совершенно новых молекул С и D: А + В =
=
С + D. Реакции такого типа не зависят от давления, однако соот-
ношение
исходных компонентов А и В
будет
влиять на
выход
про-
дуктов этой реакции. На рис. V.6 приведены зависимости равновес-
ных составов для различных исходных газовых смесей. В качестве
примера рассмотрим реакцию
CH
3
NH
2
=
(CH
3
)
2
NH(g)
+ HC%).
Из
данных, приведенных в гл. VIII, XI и XII, находим значение
Щ Кр при
500°
К, равное —0,671. Из рис. V.6
следует,
что при этом
значении
lg Кр
выход
диметиламина из смеси, состоящей из 1 моля
метиламина и 1 моля хлористого метпла,
будет
составлять 0,31 моля.
Ьсли
же исходная смесь состоит из 2 молей метиламина и 1 моля хло-
Ристого метила, то в равновесной базовой фазе
будет
находиться
«»44
моля диметиламина.
Существует
ряд
других
типов реакций,
выход
которых не зависит
* объемных факторов. Для таких реакций графическое решение
Управлений, связывающих константы равновесия с равновесным
вом, проводится аналогичным образом. Решения подобного
Уравнений, выполненные на цифровых электронных машинах,
WHO
изложены в книге Ноддингса и Мулле «Handbook of Compo-
по
at Thermodynamic
Equilibrium»
[1080].
10*

148
Часть
1.
Основы
термодинамики
V.
Энергия
Гиббса
и
химическое
равновесие
149
Равновесия
в
газах
при
высоких
давлениях
*
Для большинства паров органических веществ, находящихся по [
давлением менее 2—3 атм, закон идеальных газов и допущение / =
=
Р эквивалентны. При более высоких давлениях отклонения
от идеальности становятся весьма заметными, поэтому в термодина-
мические расчеты необходимо вводить поправочный коэффициент,
называемый коэффициентом летучести у:
f=yP.
Коэффициент
летучести можно рассчитать путем интегрирования
уравнений (V.8) и (V.7), представленных в дифференциальной
форме,
и использования соотношения (V.6):
р
Подставляя в это выражение уравнение состояния реального газа
(если оно известно) и интегрируя, получим коэффициент летучести.
Для определения коэффициента летучести можно использовать также
графические методы. Поскольку уравнения состояния для большин-
ства газов отсутствуют, обычно пользуются более общими методами.
Например,
уравнение
(V.14)
с большой точностью можно выразить
с помощью приближенного соотношения
' Р* >
где Р* — гипотетическое давление, которое оказывает идеальный
газ, занимающий объем реального газа, т. е. Р* = RTIV. Другой
метод, предложенный Гамсоном и Уотсоном [458], используется для
решения
многих технических проблем. Этот метод основан на пред-
положении,
что газы при одинаковых приведенных температурах
и
давлениях в пределах 10% обладают примерно одним и тем же
коэффициентом
летучести. По определению приведенные температура
и
давление соответственно равны Тг = Т/Тс и Pr = PIPc, где Тс —
критическая
температура, выраженная в °К, а Рс — критическое
давление. Используя рис. V.7, можно определить значения
коэффи-
циента
летучести в широком диапазоне давлений и температур.
* В советской
литературе
вопросы о фазовых равновесиях в
pacTBOpav
при высоких давлениях подробно рассматриваются в
MOHOIрафии:
И. Р. Кри-
чевский,
Фазовые равновесия в растворах при высоких давлениях, Госхимиздат,
1952; проблеме химического равновесия при высоких давлениях;
уделено
значи-
тельное внимание в книгах: В. В.
Коробов,
А. В.
Фрост,
Свободные энер-
гии органических соединений, Изд-во Всесоюзного химического общества
им. Д. И. Менделеева, М., 1950; А. А.
Введенский,
Термодинамические расчеты
нефтехимических процессов, Гостоптехиздат, М.—JL, 1960; М. Г.
Гоникбер^
Химическое равновесие и скорости реакций при высоких давлениях, 2-е изД->
Изд-во АН СССР, М., 1960 и в ряде
других
книг.—
Прим.
перев.
0,1
1,0
0,9
0,8
0,7
0,6
==
г
низ
бласг
кого
us
1
ч
щ
=~=
5-
==:
г
1
.
3
0,1 0,2 р
г
0,3
==
==
-
—•
.^
ч.
ч
ч
=
X
•—,
;>
ч
^_
ч
"
V
у
s
s
\
ч
ч
ч
ч
N
\'
4^N
ч
\
ч
ч
ч
ч
ч
т
ч
ч
\
ч
\
ч
ч
-1,1
-—-
3,95-
1,6-
- 1,2.
0,90-
—-—,
,
• .
--
0,4 0,5
ч,
4N
ч
ч
\
\
ч
=:
ч
Ч"
\
ч
ч
ч
В
Г
44N
Ч
Ч
Ч "
\ Ч
^ Ч
, ч
ч
ч
ч
ч
„ ч
——_
. i
ч^
?ч$
:<>•
ч '
ч
ч
'
ч
"'
N
^
ч
\
ч
N.
ч
N
ч
--—
_^
ч
ч
ч
N
—.
^z
ч
4
i
ч
ч
S
\*
\
\
i
чЧ
—i
1
—
и
-
-
-
S *-
я
<
'Л
__,
—•
:—
/*
V
/
-
,'
.0
—
У/,
4/
'/А
1
•/
17
/
у
ч*
^'
г-
0
»'
ш
Г
у/
-/-
т
1
%
ш,
W-
71
/
2
у-
^*
7
и
0,2 0,3 0,4 0,6 0,8 1,0 2 3 4 5 6 8 10
Приведенное
давление,
Pr-P/Pc
20 30 40
Рис.
V.7. Зависимость коэффициента
летучести
газов от приведенных давления
и
температуры.
По
данным Гамсона и Уотсона [458].
При
анализе термодинамических свойств смесей газов в прибли-
жении
Льюиса и Ренделла [861] обычно полагают, что летучесть
каждого газообразного компонента в смеси равна его летучести
при
общем давления системы, умноженной на его мольную долю, т. е.
В таком случае точное выражение для константы равновесия реаль-
ных газов можно записать в виде
Kf=KpKy,
где множитель Ку = (Иу^
1
— константа, выраженная через
коэф-
фициенты
летучести при давлении ^tot- Рассмотрим снова в качестве
примера реакцию диссоциации хлористого этила
ротекающую при
400°
К и давлении 20 атм. Для этой реакции
РУДно рассчитать величины приведенных давлений и температур
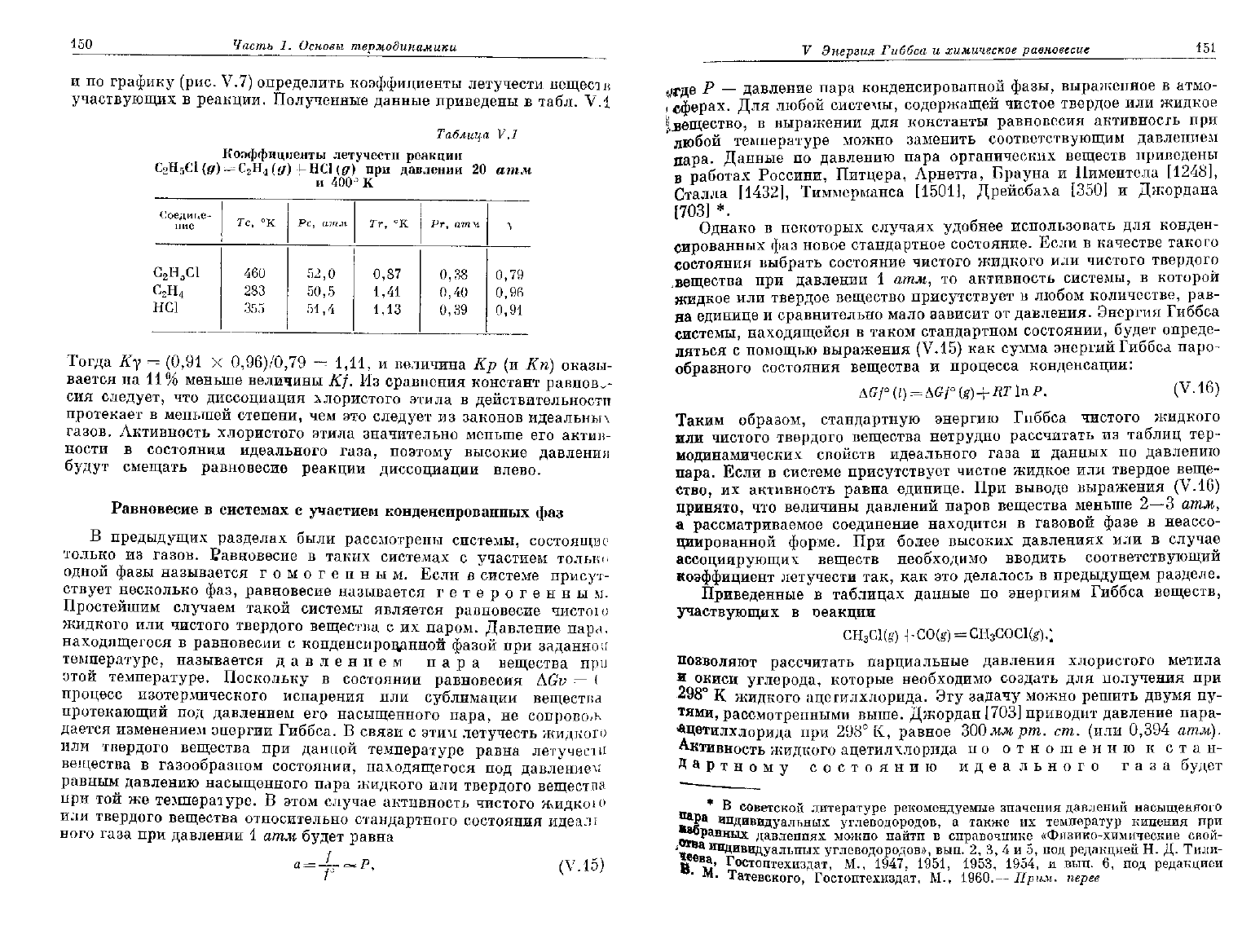
150
Часть
1.
Основы
термодинамики
и
по
графику (рис.
V.7)
определить коэффициенты летучести веществ
участвующих
в
реакции. Полученные данные приведены
в
табл.
V.1
Таблица
V.1
Коэффициенты
летучести
реакции
"
ЧС1{д) при
давлении
20 атм
и
400° К
V
Энергия
Гиббса
и
химическое
равновесие
151
Соедине-
ние
С
2
Н
О
С1
с
2
н
4
НС1
Тс,
°К
460
283
355
Рс,
52
50
51
атм
,0
,5
,4
Тг
0,
1,
1,
"К
87
41
13
Рт,
0,
0,
0,
агпч
38
40
39
0,
0,
0,
79
96
91
Тогда
Ку =
(0,91
X
0,96)/0,79
= 1,11, и
величина
Кр (и Кп)
оказы-
вается
на
11% меньше величины
Kf.
Из сравнения констант равнове-
сия
следует,
что
диссоциация хлористого этила
в
действительности
протекает
в
меньшей степени,
чем это
следует
из
законов идеальных
газов. Активность хлористого этила значительно меньше
его
актив-
ности
в
состоянии идеального газа, поэтому высокие давления
будут
смещать равновесие реакции диссоциации влево.
Равновесие
в
системах
с
участием конденсированных
фаз
В предыдущих разделах были рассмотрены системы, состоящие
только
из
газов. Равновесие
в
таких системах
с
участием только
одной
фазы называется гомогенным. Если
в
системе присут-
ствует
несколько фаз, равновесие называется гетерогенным.
Простейшим
случаем такой системы является равновесие чистою
жидкого
или
чистого твердого вещества
с их
паром. Давление пара,
находящегося
в
равновесии
с
конденсированной фазой при заданной
температуре, называется давлением пара вещества
при
этой
температуре. Поскольку
в
СОСТОЯНИИ
равновесия &Gv
= (
процесс изотермического испарения
или
сублимации вещества
протекающий
под
давлением
его
насыщенного пара,
не
сопрово/Ь
дается изменением энергии Гиббса.
В
связи
с
этил!
летучесть
жидкого
или
твердого вещества
при
данной температуре равна летучесаи
вещества
в
газообразном состоянии, находящегося
под
давлением
равным давлению насыщенного пара жидкого или твердого вещества
при
той же
температуре.
В
этом
случае
активность чистого жидкою
или
твердого вещества относительно стандартного состояния идеал!
ного газа при давлении
1 атм
будет
равна
а
= —-
<=«
Р
(V.15)
и,^
Р
~~ Давление пара конденсированной фазы, выраженное
в
атмо-
сферах.
Для
любой системы, содержащей чистое твердое или жидкое
р|.вещество,
в
выражении
для
константы равновесия активность
при
* любой температуре можно заменить соответствующим давлением
пара. Данные
по
давлению пара органических веществ приведены
в
работах Россини, Питцера,
Арнетта,
Брауна
и
Пиментела [1248],
Сталла [1432], Тиммерманса [1501], Дрейсбаха
[350] и
Джордана
1703]
*.
Однако
в
некоторых случаях удобнее использовать
для
конден-
сированных фаз новое стандартное состояние. Если
в
качестве такого
состояния
выбрать состояние чистого жидкого
или
чистого твердого
.вещества
при
давлении
1 атм, то
активность системы,
в
которой
жидкое или твердое вещество присутствует
в
любом количестве,
рав-
на
единице
и
сравнительно мало зависит
от
давления. Энергия Гиббса
системы, находящейся
в
таком стандартном состоянии,
будет
опреде-
ляться
с
помощью выражения
(V.15)
как сумма энергий Гиббса паро-
образного состояния вещества
и
процесса конденсации:
AGf°(l)
=
AGf°(g)
+
RTlnP.
(V.16)
Таким
образом, стандартную энергию Гпббса чистого жидкого
или
чистого твердого вещества нетрудно рассчитать
из
таблиц
тер-
модинамических свойств идеального газа
и
данных
по
давлению
пара. Если
в
системе присутствует чистое жидкое или твердое веще-
ство,
их
активность равна единице.
При
выводе выражения
(V.16)
принято,
что
величины давлений паров вещества меньше
2—3 атм,
а рассматриваемое соединение находится
в
газовой фазе
в
неассо-
пдированной
форме.
При
более высоких давлениях
или в
случае
ассоциирующих веществ необходимо вводить соответствующий
коэффициент
летучести так,
как это
делалось
в
предыдущем разделе.
Приведенные
в
таблицах данные
по
энергиям Гиббса веществ,
участвующих
в
реакции
CH
3
Cl(g)
f
CO(g)=CH
3
COCl(g),:
позволяют рассчитать парциальные давления хлористого метила
и
окиси
углерода,
которые необходимо создать
для
получения
при
298
К
жидкого ацегилхлорида.
Эту
задачу
можно решить двумя
пу-
тями,
рассмотренными выше. Джордан [703] приводит давление пара-
«Цетилхлорида
при
298°
К,
равное 300
мм рт. ст.
(или
0,394
атм).
Активность жидкого ацетилхлорпда
по
отношению
к
стан-
дартному состоянию идеального газа
будет
В советской литературе рекомендуемые значения давлений насыщенного
щ^ра индивидуальных углеводородов,
а
также
их
температур кипения
при
у
удрд,
рур р
давлениях можно найти
в
справочнике «Физико-химические свой-
индивидуальных
углеводородов»,
вып.
2, 3, 4 и 5, под
редакцией
Н. Д.
Тили-
iw'
Гостоптехи
здат,
М., 1947, 1951, 1953, 1954, и вып. 6, под
редакцией
' Татевского, Гостоптехиздат,
М.,
I960.—
Прим.
перев

152
Часть
1.
Основы
термодинамики
V.
Энергия
Гиббса
и
химическое
равновесие
153
постоянной
и равной
0,394.
Из соответствующих таблиц свойств
газообразных хлористого метила, окиси
углерода
и ацетилхлорида,
рассматриваемых как идеальные газы, при
298°
К находим-
lg Кр =
37,804
-
10,960
-
24,046
=
2,078.
Откуда
а
СНзСОС!
0,394
- = 120
0,394
120
=
0,00328.
Из
последнего выражения видно, что любая комбинация давлений
СН
3
С1
и СО, произведение которых больше
0,00328,
будет
приводить
к
образованию жидкого ацетилхлорида, находящегося в равнове
сии
с газообразными компонентами при
298°
К.
С
другой
стороны, энергию образования Гиббса жидкого ацетил-
хлорида можно рассчитать по уравнению
(V.8):
AG
f
(I)
= AGf
(g)
л-
RT
In
Kp =
=
— 50,59 + (4,5758x298,15xlgP) = — 51,14
ккал/молъ.
Тогда
стандартная
энергия
Гиббса и константа равновесия
реакции
CH
3
Cl(g)
+ COfe) =
CH
S
COC1(0
будут иметь следующие
значения:
AGr°
= —51,14 — (—14,95) —
- (-32,80) = -3,39 ккал и lg £>' = — (—3 390)/(4,5758 X 298,15) =
= 2,485. Поскольку активность жидкого ацетилхлорида по
отно-
шению
к стандартному состоянию чистой
жидкости
равна
единице,
Кр' = -
-=305
=-4г =
0,00328,
что
полностью согласуется с предыдущим результатом.
Для
многокомпонентных
систем, образующих идеальный жидкий
(или
твердый) раствор, активность каждого
компонента
в смеси
по
отношению к стандартному состоянию чистого жидкого (или
чистого
твердого) вещества равна его мольной доле N
t
в жидкой
(или
твердой)
фазе.
Это вытекает из определения идеального рас-
твора,
который подчиняется закону Рауля
где Р, — парциальное давление
компонента
над раствором, а Р\ —
давление
насыщенного пара вещества над чистым жидким веще-
ством.
В случае неидеальных растворов активность можно опреде-
лить
экспериментально путем
измерения
давления и состава газо-
>й
фазы, находящейся в равновесии с раствором. Примером такого
|типа измерений является исследование Халфордом и Брандеджем
'{564]
реакции уксусной кислоты и этилового спирта в растворе.
,* В качестве
других
примеров можно привести исследование неидеаль-
ных растворов, выполненное Парксом и Хаффманом [1105], и обзор-
ч
ну
ю
статью Уоринга
[1571]
по термодинамическим свойствам
муравьиной кислоты.
Другие
методы определения коэффициентов активности, такие,
как
криоскопический или метод растворения, рассмотрены в книге
Льюиса и Ренделла [861] и ряде
других
классических работ [321,
492, 1129, 1245, 1410]. Если данные по активности
отсутствуют,
то для
определения приближенных термодинамических величин и проверки
их необходимо пользоваться законом идеальных растворов. Для
смесей подобных соединений, таких, как смеси спиртов и кетонов,
идеальный раствор является хорошим приближением. Для водных
растворов
следует
ожидать значительных отклонений от идеальности.
Сложные равновесия
Процессы^
участием органических веществ часто сопровождаются
побочными
реакциями, которые иногда
удается
подавить подбором
селективных катализаторов. Иногда побочные реакции
могут
приводить к образованию полезных продуктов. Для процесса,
состоящего из нескольких реакций, концентрации реагирующих
частиц должны удовлетворять одновременно константам равновесия
всех
реакций. Расчет равновесного состава становится весьма трудо-
емким,
если необходимо решить более
двух
или
трех
уравнений.
Особый интерес представляет проблема расчета равновесного состава
газов в
струе
ракетного двигателя, где приходится учитывать до 10
или
более констант равновесия. Решение такой задачи с помощью
настольных вычислительных машин является весьма трудоемким
делом, поэтому за последнее время были разработаны специальные
методы с применением быстродействующих электронных вычисли-
тельных машин [170, 640, 1605]. Эти методы полезны при расчете
равновесий изомеров и
других
сложных смесей, часто являющихся
предметом исследования органической химии.
В качестве простого примера сложного равновесия рассмотрим
°ледующую
систему:
(1) CH
3
Cl(g)+H
2
O(g)==CH
3
OH(g)-J-HCl (g),
(2)
2CH
3
OH(g)
=
(CH
3
)
2
O(g)
+
H
2
O(g).
етанол, образующийся в
результате
первой реакции, может
всту-
-
ать в
о
вторую
реакцию с образованием диметилового эфира,
соответствующих таблиц находим константы равновесия этих
и
при
600°
К: Кр (1) =
0,00154;
Кр (2) = 10,6. Поскольку

154
Часть
1.
Основы
термодинамики
обе реакции протекают без изменения числа молей
участвуют,^
в
реакциях веществ, константы равновесия этих реакций можно
записать следующим образом:
"сн
3
сг
п
н
2
о
К
Р
(2) =
"сн
3
он
Обозначим через х количество хлористого водорода, образующегося
из
исходной смеси, содержащей 1 моль хлористого метила и 1 моль
воды, а через у — количество образующегося диметилового эфира.
Тогда
Пензой = х — 2у, п
НС1
= х,
п
СЪз
осн
3
= У,
«н
2
о
= 1 — а; —
+
У,
"CH
3
CI
= 1 — х. Подставляем эти величины в выражения д ш
констант равновесия:
Кр{\) =
-
- =
0,00154
Решая
эти уравнения методом последовательных приближений,
получим х =
0,048
и у =
0,009.
Из этих данных нетрудно рассчитать
равновесный состав газовой фазы реакций (1) и (2). Иногда полезно
вычислить для каждого уравнения значения у при различных х.
Построив
графическую зависимость у от х, получим две кривы?,
соответствующие
двум
уравнениям. Точка пересечения этих кривых
даст
значения х и у, являющиеся решением обоих уравнений, свя-
зывающих константы равновесия с составом равновесной газо-
вой
фазы.
Зависимость констант равновесия от температуры
Дифференцирование
уравнения (V.5) по температуре приво
UIT
к
следующему выражению:
Аналогичное соотношение для процесса или реакции имеет вид
V.
Энергия
Гиббса
и
химическое
равновесие
155
дделив выражение (V.2) на Т и продифференцировав его по тем-
фатуре, получим
Vd{AGr/T)
1 Г д I АНг
у-^т—\p
=
[rw\-f—
Al
дТ )Р
=
1т
АСгр
—
АНг—
'J
АСгр
-АНг
7*2
(V.20)
-Подставляя в это уравнение выражение
(V.11),
окончательно имеем
Г д In Kp -[ _
АНг°
L дт \Р~
(V.21)
Это важное уравнение впервые было получено Вант-Гоффом
ж с тех пор носит его имя. Из уравнения
(V.21)
следует,
что измене-
,ние
константы равновесия с температурой зависит только от стандарт-
ной
энтальпии реакции. Для реакций, протекающих с поглощением
тепла, константа равновесия возрастает с увеличением температуры,
т. е. повышение температуры способствует протеканию реакции.
И
наоборот, понижение температуры благоприятствует протеканию
«изотермических реакций. Наиболее интересным примером, иллю-
стрирующим важность эндотермических реакций при высоких
температурах, является расчет состава пламен, аналогичных тем,
которые возникают в
струе
реактивных двигателей. Так, например,
пары воды, степень диссоциации которых при комнатных темпера-
турах
ничтожно мала, в значительной степени диссоциируют при
температурах порядка
4000°
К. В качестве
другого
примера можно
привести обычную реакцию дегидрирования, которая широко
используется на нефтехимических заводах. Термический распад
бутана с отщеплением водорода является сильно эндотермической
реакцией
и не протекает при комнатной температуре. Однако,
согласно уравнению
(V.21),
путем повышения температуры равно-
весие этой реакции можно сдвинуть в сторону образования водорода
в
при температуре около
900°
К достичь заметных выходов.
В гл. III уравнение Вант-Гоффа было проинтегрировано и приме-
нено
для определения энтальпии реакции с помощью измеренных
Констант
равновесия. Первые два метода, рассмотренные в этой
"лаве,
могут
быть использованы для расчета констант равновесия
°° Данным энтальпии реакции при условии, если известно экспери-
ментальное значение константы равновесия при какой-либо одной
мпературе. Поскольку в таких расчетах используются только изме-
«ения энтальпий и энтропии реакций и не используются абсолютные
«л
Чения
энтропии
участвующих
в них веществ, эти два метода обыч-
Называют методами определения термодина-
4 е
с к и х
свойств
по
второму закону термо-
н
а ми к и.

156
Часть
1.
Основы
термодинамики
Функции
энергии Гиббса
Третий метод расчета констант равновесия по энтальпии реакций
использует функцию энергии Гиббса, отнесенную к 0° К и опреде-
ляемую соотношением
'•)-'
(V.22)
Функция
энергии Гиббса весьма мало изменяется с температурой
(в
противоположность, например, функции G°), что позволяет про-
водить табличную интерполяцию в интервалах 100°. Для газов
эту функцию можно рассчитать непосредственно, если из спектро-
скопических данных известны энергетические уровни молекул.
Функции
энергии Гиббса более удобны в употреблении, чем анали-
тические выражения для G° или для
AGr°.
В
случае
кристаллических
твердых тел, подчиняющихся третьему закону термодинамики,
функцию энергии Гиббса можно легко рассчитать графически из
двух
двойных интегралов
г
т г- [
Cp°dT
О
L
"О
О
dT
или определить по разности
двух
интегралов
т т
Cp°dT
так как
О
Функции
энергии Гиббса можно также отнести к базисной темпера-
туре
298°
К:
/"то TJ° TJ° fjo
со
(\т O4N
Поскольку эти две функции отличаются только базисной темпера-
турой, при которой приводится значение энтальпии, переход от одной
функции
к
другой
осуществляется с помощью соотношения
Все функции энергии Гиббса, приведенные в виде таблиц в последую"
щих
главах
книги, рассчитаны относительно температуры
298°
К-
В литературе табличные значения функций энергии Гиббса часто
указаны относительно базисной температуры 0° К, поскольку
V.
Энергия
Гиббса
и
химическое
равновесие
157
гатистические методы расчета или низкотемпературные данные
теплоемкости позволяют непосредственно рассчитать значения
й
функции относительно 0° К. Для решения задач, рассматривае-
мых в данной книге, более удобны функции, основанные на базис-
ной
температуре
298°
К, так как большинство данных по энтальпиям
образования приведено именно для этой температуры. Легко видеть,
что изменение этих функций в
результате
реакции связано с ее кон-
стантой равновесия следующим уравнением:
29SJ
£
(V.24)
Таким образом, если известны функции энергии Гиббса при темпе-
ратуре
Т и энтальпия реакции при
298°
К, по уравнению
(V.24)
нетрудно вычислить константу равновесия и рассчитать состав
равновесной газовой фазы. Как указывалось в гл. Ill, часто более
удобно вычислять значения [A (G°
T
— #°
98
)/Я при округленных зна-
чениях температур, обычно указанных в таблицах, и затем интер-
полировать их к другим температурам. При температурах выше
400°
К такая линейная интерполяция часто оказывается достаточно
точной.
Следует
отметить, что табличные значения функций энергии
Гиббса практически полезны в тех
случаях,
когда энтальпии обра-
зования
определены с большими погрешностями или являются
оценочными величинами. Если энергии образования Гиббса при
всех
температурах содержат ошибки
даже
в тех
случаях,
когда имеются
более точные значения энтальпий образования, то функции энергии
Гиббса в значительно меньшей степени зависят от точности определе-
ния
энтальпий. Уравнение
(V.24)
оказывается наиболее удобным
для составления приведенных в приложении табличных значений
термодинамических функций в сочетании с новыми значениями энталь-
пий
образования.
Поскольку энтропии, которые в большинстве случаев опреде-
ляются с помощью третьего закона термодинамики,
входят
в функ-
ции
свободных энергий, метод расчета констант равновесия из данных
До энтальпиям реакций с использованием функций энергий Гяббса
и
наоборот называется методом расчета тер-
Мо
Динамических свойств по третьему
закону термодинамики.

Глава
VI
МЕТОДЫ ПРИБЛИЖЕННОГО РАСЧЕТА
ТЕРМОДИНАМИЧЕСКИХ
ВЕЛИЧИН
Введение
В предыдущих
главах
было отмечено,
что
энтальпии образование
большого числа органических веществ известны
по
крайней мерс
со средней точностью.
Ввиду
того что для различных типичных термо-
химических расчетов,
как
правило, требуются данные
по
энтропиям
и
теплоемкостям, часто возникает необходимость оценить
эти
вели-
чины
с
помощью приближенных термодинамических расчетов.
Несмотря
на то что
число исследований
по
определению энтропии
органических соединений значительно возросло
с
момента открытия
и
широкого использования третьего закона термодинамики [1598],
тем
не
менее
существует
еще
большое число веществ,
для
которых
известны энтальпии образования,
а
значения энтропии
не
опре-
делены. Отсюда вытекает практическая необходимость приближен-
ных расчетов энтропии
с
точностью, соответствующей точности
тер-
мохимических данных.
В
ранних работах термохимические величи-
ны
обычно определяли
с
точностью
в
несколько десятых килокало-
рии
на
моль. Такую
же
погрешность
в
величинах изменений энергии
Гиббса
и
константах равновесия
при
комнатной температуре
дает
ошибка
в
величине энтропии
на 1—2
кал/(моль-°К),
поскольку
ДС° = ДЯ°—Т AS° (VI. 1)
и
AG°=—RTlnKp.
(V.9)
При
вычислении энергии Гиббса
для
других
температур необхо-
димы значения теплоемкости
как
реагирующих веществ,
так и
про-
дуктов реакции. Поэтому часто необходимо
и
вполне возможно при-
ближенно рассчитать
эти
значения
в тех
случаях,
когда
отсутствуют
экспериментальные значения теплоемкостей газообразных веществ.
Методы приближенного расчета теплоемкостей, рассматривае-
мые
в
последующих разделах этой главы, применимы также
для
нахождения энтропии.
С
помощью известного соотношения
г
S
T
—
S
0
= \
CpdlnT
о
эти
величины тесно связаны
друг
с
другом.
С
ростом температуры
влияние
энтропийного члена заметно возрастает, поскольку,
как
VI.
Приближенный
расчет
термодинамических
величин
159
из
выражения (VI.1), величина
AS
умножается
на
темпе-
Йногда
необходимо наряду
со
значениями энтропии
и
теплоемко-
оценить
величину энтальпии реакции.
В
этих случаях также
можно использовать некоторые методы приближенного расчета.
Следует
подчеркнуть, что при анализе термодинамических свойств
«авличных соединений
и
оценки
их
«важности»
с
термодинамиче-
ской
точки зрения
в
условиях, представляющих наибольший интерес
|{дя исследователя, вначале
следует
применить наиболее простой
щ грубый метод приближенного расчета энергий связи, полностью
Пренебрегая величиной
AGp, и
использовать
грубые
правила оценки
Изменений
энтропии реакции. После того
как
удастся ограничить
число возможных соединений, требующих дальнейшего рассмотре-
ния,
для еще
более детального термодинамического анализа поведе-
ния
этих веществ
в
конкретных условиях можно использовать более
точные методы приближенного расчета энтальпий образования этих
соединений
и их
энтропии. Если
грубые
расчеты покажут,
что
боль-
шая
часть рассмотренных соединений исследована ранее
и для них
имеются надежные термодинамические данные,
то в
этом
случае
точ-
ные
значения термодинамических параметров вполне можно опре-
делить
с
помощью стандартных термодинамических расчетов,
рас-
смотренных
в
предыдущих
главах.
Если
же
предварительные
расчеты показали,
что при
термодинамическом анализе необходимо
учитывать неизученные соединения,
то в
термодинамических расчетах
можно ограничиться оценочными величинами.
При
этом
не
следует
делать ошибки, предполагая,
что в
расчетах можно ограничиться
только веществами
с
хорошо изученными термодинамическими свой-
ствами.
С
помощью описанного выше подхода удается избежать
серьезных ошибок
при
термодинамическом анализе.
В настоящее время имеется целый
ряд
монографий
и
работ,
в
кото-
.рых излагаются методы приближенных расчетов термодинамических
свойств соединений, поэтому
в
настоящей главе дается скорее обзор
этих методов,
а не их
глубокий анализ
*. С
приближенными мето-
дами расчета, предложенными Янцем
[681] и
Рейдом
и
Шервудом
11220], более подробно можно ознакомиться
по
таблицам, составлен-
ием этими авторами,
тем не
менее некоторые
из
этих методов кратко
обсуждаются
в
данной главе.
п
—•—.—
^
и
советской литературе методы расчета основных термодинамических
"•этров реакций
и
свойств химических соединений
(в том
числе
и
органпче-
ур, •
по
Дробно изложены
в
книгах:
В. М.
Татевский, Химическое строение
МГУ°м
>
]
ЭОДОВ
и
закономерности
в их
физико-химическнх свойствах, Изд-во
^^•'1953;
В. М.
Татевский,
В. А.
Бендерский
и С. С.
Яровой,
Методы
Ф
изи
ко-химических свойств парафиновых углеводородов, Гостоптех-
1960;
М. X.
Карапетъянц,
Методы сравнительного расчета физико-
^^^вских свойств, изд-во
«Наука»,
М., 1965; В. А.
Киреев,
Методы практи-
Под
Расчетов
в
термодинамике химических реакций, изд-во
«Химия»,
М.,
JJ""—Прим.
перев.

160
Часть
1.
Основы
термодинамики
Методы расчета с учетом вкладов валентных связей
Многие
органические вещества способны легко испаряться, поэто-
му теплоемкость этих веществ
в
газообразном состоянии представ-
ляет особый интерес. Поскольку данные
по
теплоемкостям газооб-
разных веществ относительно скудны, разработка методов
их
при-
ближенного расчета весьма желательна. Экспериментальные данные
показывают,
что
группы атомов
в
соединениях, принадлежащих
к
одному гомологическому ряду, обладают почти одинаковыми
свойствами. Так, например, колебания метильной группы почти оди-
наковы
в
молекуле пропана, бутана
и
октана;
во
всех
этих случаях
вклад мегильной группы
в
теплоемкость
будет
почти одинаков. Этот
факт
позволяет предположить, что теплоемкость газообразной моле-
кулы можно представить
в
виде суммы теплоемкостей
ее
компонен-
тов. Такое предположение
в
значительной степени справедливо.
Как
показал Меке [980], колебательные частоты молекулы можно
приписать
определенным валентным связям атомов,
из
которых
|
построена данная молекула. Каждая валентная связь характери-
:
зуется определенной частотой продольных
и
поперечных колебаний,
направленных перпендикулярно связи.
Эти два
типа частот коле-
бательного движения называются валентными
(v) и
деформацион-
ными
(б)
частотами. Далее, Меке показал,
что
частоты, связанные
с определенными связями
в
органических молекулах, очень незна-
чительно изменяются
при
переходе
от
одной молекулы
к
другой.
Бенневиц
и
Росснер [103] использовали такие обобщенные частоты
для расчета теплоемкостей газообразных молекул, содержащих
углерод,
водород
и
кислород,
с
помощью эмпирического уравнения
Cp° = 4R+S
ii\+
(
3ra
-
6
- 2 9t) у' *'
•
(
VL2)
В этом уравнении
п —
число атомов
углерода,
q
t
—
число валент-
ных связей,
a E
v
. и
Eg.
—
функции Эйнштейна для i-й связи, харак-
теристические валентные
и
деформационные частоты которой соот-
ветственно
v,- и 6,.
Бенневиц
и
Росснер [103], Добрац [331]
и
Сталл
и
Мейфилд
[1436]
обозначают валентное колебание буквой
v.
Поскольку
в
данной книге частота (сек""
1
) тоже обозначена
v, в
этой
главе валентные (v)
и
деформационные (б) частоты во избежание
пута-
ницы
определяются
в
волновых числах (см'
1
).
Следует
отметить, что
для температур около
400°
К
приведенное выше уравнение
(VI.2)
воспроизводит экспериментальные значения теплоемкостей
Бенне-
вица
и
Росснера
с
точностью
5—15%.
Бенневиц
и
Росснер рассматривали молекулу органического
соединения
как
жесткий ротатор,
что
привело
к
плохому совпаде-
нию
рассчитанных
и
экспериментальных величин при низких тем-
пературах. Учитывая связи, вокруг которых может осуществляться
VI.
Приближенный
расчет
термодинамических
величин
161
бодное вращение (связи
С — С
или
им
подобные), Добрац [331]
добиться большего совпадения рассчитанных величин
с
экспе-
ментальными. Полученное
им на
основе уравнения
(VI.2)
новое
•равнение
имеет
вид
C"iR++^
C Щ^
|-де
а —
число связей, вокруг которых может осуществляться сво-
" Годное вращение,
а
функции
C
v
. и
Cg.
—
квадратичные выражения,
Отвечающие валентному
и
деформационному вкладам
в
теплоемкость.
Квадратичные выражения такого типа несколько отклоняются
от экспериментальной зависимости при температурах выше
700°
К;
серьезное расхождение наблюдается при температурах выше
800°
К.
Добрац предложил распространить свой метод расчета
на
органиче-
ские
молекулы, содержащие
серу,
азот
и
галогены, путем составле-
ния
таблиц частот валентных связей этих веществ.
Сталл
и
Мейфилд
[1436]
расширили границы применимости этого
метода до температур выше
700°
К
путем
учета
колебательных вкла-
дов различных связей, основанных
на
уравнении Эйнштейна
(11.10)
и
представленных
в
виде таблиц,
и
для согласования
с
прежними дан-
ными
заново провели отнесение некоторых частот. Теплоемкости,
рассчитанные этими авторами, совпадают
с
экспериментальными
данными
в
пределах
4%
или лучше.
Караш
и Шер [745] предполагали, что энтальпия сгорания обуслов-
лена обменом электронов
между
атомами
и
молекулами,
и
пред-
ложили эмпирическое соотношение
для
расчета энтальпии сгорания
органических веществ.
В
качестве исходного было использовано
предположение
о
том, что
в
процессе сгорания органического соеди-
нения
в
газообразном кислороде происходит переход электронов
Из
«группировки метана»
в
«группировку двуокиси
углерода»
с
выде-
лением количества тепла, равного
26,05
ккал/моль. Для расчета авто-
ры предложили уравнение типа
ДЯс =
26,05ге
+ »,
(VI.4)
где ДЯс
—
определяемая энтальпия сгорания,
п —
число электро-
нов,
участвующих
в
процессе замещения,
и w —
эмпирическая кон-
станта, учитывающая отклонение электронного распределения
от
распределения электронов
в
исходной
«модели».
Для простых арома-
тических соединений
и
насыщенных углеводородов
w = 0,
однако
Для олефинов
w = 13
ккал.
В
1929
г.
Караш [744] опубликовал свод-
К
У данных
по
теплотам сгорания
для
более
чем 1500
органических
соединений
всех
типов. Сравнение экспериментальных значений
* рассчитанными
по
уравнению
(VI.4)
показало
в
большинстве
слу-
чаев согласование
в
пределах
1—2%.
За
последние несколько десятилетий было сделано много попыток
пользовать квантовомеханические, полуэмпирические
и
чисто
831
