Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

202
Часть
1.
Основы
термодинамики
Таблица
VII.15
Вычисленные
значения
степени
равновесного
превращения
для
реакции
\
O()+
р,
атм
100
200
300
400
500
600
700
800
9С0
1000
Мольная
доля СНзОН
в
равновесной
<
=
200°
С
(•101)
1,2
1,8
2,4
2,9
3,4
3,8
4,2
4,5
—
—
реакционной
смеси
t
=
300° С
(•103)
1,4
2,0
2,9
3,8
4,8
5,9
6,9
7,7
8,8
9,8
<=
400° С
(•105)
5,5
6,9
8,3
10,8
12,8
15,1
17,2
19,3
21,8
24,2
t
=
500° С
(•106)
4,8
5,6
6,8
7,9
8,9
10,2
11,4
12,5
13,6
15,6
Данные Томаса
и
Портальского [1486].
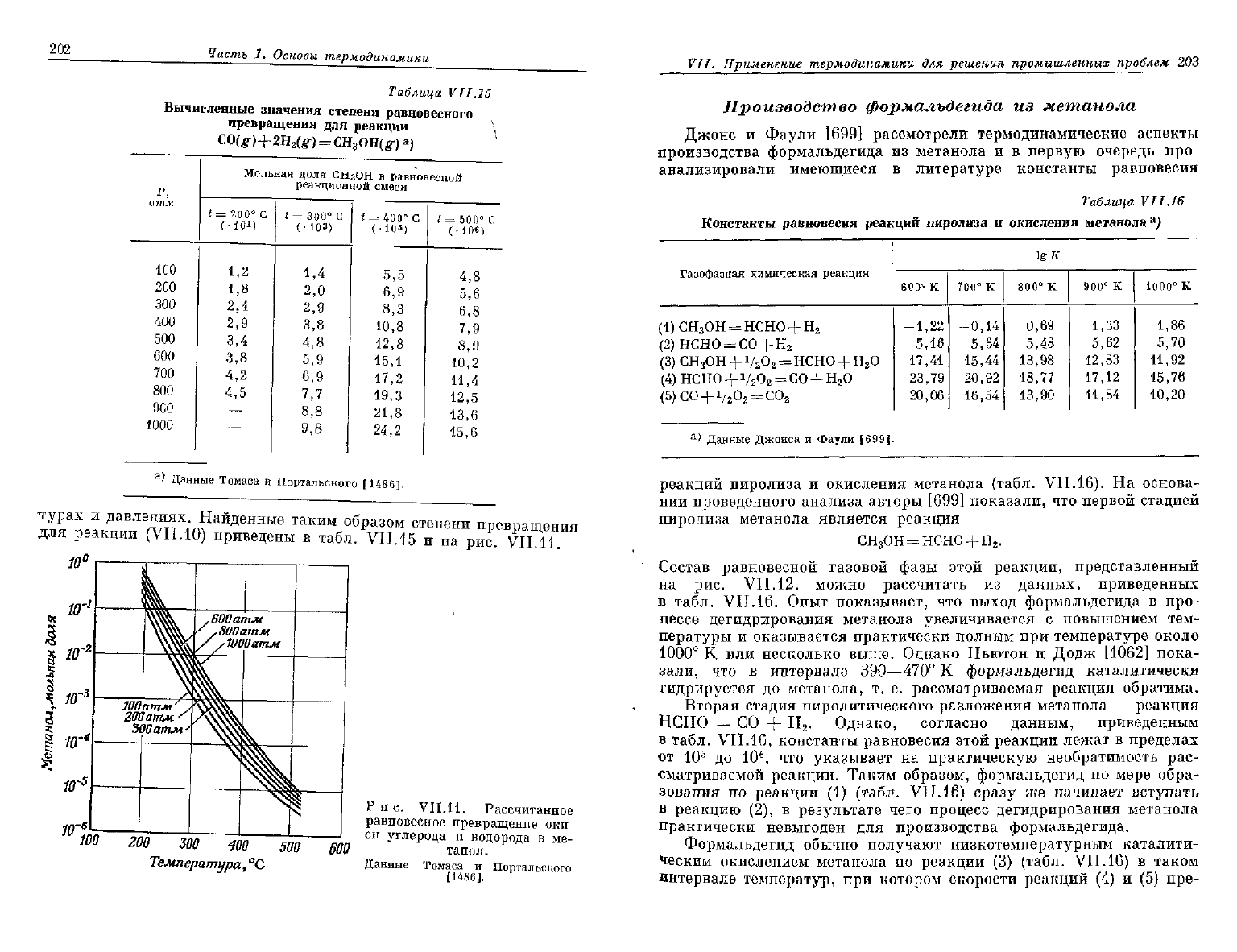
турах
и
давлениях. Найденные таким образом степени превращения
для реакции
(VII.10)
приведены
в
табл.
VII.15
и на
рис. VII.
11.
I
,600 атм
У
У
800 атм
/
,1000 атм
100 атм.
Z00 атм.'
300 атм-
Температура,
"С
Рис.
VII.11.
Рассчитанное
равновесное
превращение
оки-
си
углерода
и
водорода
в
ме-
танол.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
203
Производство формальдегида из метанола
Джонс
и
Фаули
[699]
рассмотрели термодинамические аспекты
производства формальдегида
из
метанола
и в
первую очередь
про-
анализировали имеющиеся
в
литературе константы равновесия
Таблица
VI
1.16
Константы
равновесия
реакций
пиролиза
и
окисления
метанола
а
)
Газофазная
химическая реакция
(1)СН
3
ОН
=
НСНО
+
Н
2
(2)НСНО
=
СО
+
Н
2
(3) СН
3
ОН
+
1
/
2
О
2
=
НСНО
+
Н
2
О
(4) НСНО
+
1/
2
О
2
=
СО
+
Н
2
О
(5)CO
+
i/
2
O
2
=
CO
2
lg-K
600°
К
-1,22
5,16
17,41
23,79
20,06
700°
К
-0,14
5,34
15,44
20,92
16,54
800°
К
0,69
5,48
13,98
18,77
13,90
900°
К
1,33
5,62
12,83
17,12
11,84
1000°
К
1,86
5,70
11,92
15,76
10,20
Данные Джонса
и
Фаули [699].
Данные
Томаса
и
Портальского
[1486].
реакций
пиролиза
и
окисления метанола (табл. VII.16).
На
основа-
нии
проведенного анализа авторы
[699]
показали,
что
первой стадией
пиролиза
метанола является реакция
СН
3
ОН
=
НСНО
+
Н
2
.
Состав равновесной газовой фазы этой реакции, представленный
на
рис.
VII.12, можно рассчитать
из
данных, приведенных
в
табл.
VII.16.
Опыт показывает,
что
выход
формальдегида
в
про-
цессе дегидрирования метанола увеличивается
с
повышением
тем-
пературы
и
оказывается практически полным
при
температуре около
1000°
К
или
несколько выше. Однако Ньютон
и
Додж
[1062]
пока-
зали,
что в
интервале
390—470°
К
формальдегид каталитически
гидрируется
до
метанола,
т. е.
рассматриваемая реакция обратима.
Вторая стадия пиролитического разложения метанола
—
реакция
НСНО
=
СО
+
Н
2
.
Однако, согласно данным, приведенным
в
табл.
VII.16,
константы равновесия этой реакции лежат
в
пределах
от
10
5
до 10
е
, что
указывает
на
практическую необратимость
рас-
сматриваемой реакции. Таким образом, формальдегид
по
мере обра-
зования
по
реакции
(1)
(табл.
VII. 16)
сразу
же
начинает вступать
в
реакцию
(2),
в
результате
чего процесс дегидрирования метанола
практически
невыгоден
для
производства формальдегида.
Формальдегид обычно получают низкотемпературным каталити-
ческим окислением метанола
по
реакции
(3)
(табл.
VII.16)
в
таком
интервале температур,
при
котором скорости реакций
(4) и (5)
пре-

204
Часть
1.
Основы
термодинамики
небрежимо малы. Поскольку пары чистого формальдегида начинают
разлагаться при температуре около
573°
К, эта температура является
верхним пределом процесса окисления метанола. Известно, что
воздух
— весьма выгодный промышленный окислитель метанола,
поэтому рассматриваемую реакцию запишем в виде
СН
3
ОН
+ V
2
(O
2
+4N
2
) =
НСНО
+ Н
2
О + 2N
2
.
(Воздух)
Взятая в таких пропорциях реакционная смесь взрывоопасна, однако
при
ее разбавлении дополнительным количеством
воздуха
темпе-
ратура протекания реакции
будет
ниже температуры распада, а кон-
центрация реагирующей смеси окажется вне области концентраций,
700 800 300
Температура,
"К
1000
Рис.
VII.12.
Рассчитанный состав равновесной газовой фазы реакции
CH
3
OH(g) = HCHOQ?) + H
2
(g).
Данные
Джонса
и
Фаули [699].
при
которых происходит ее самопроизвольное воспламенение. Учи-
тывая сказанное, приведенное уравнение реакции с учетом раз-
бавления реагирующей смеси можно представить в виде
2
(*-l)O
2
-2*N
2
, (VII.12)
где х — количество
воздуха,
в два раза превышающее необходимое
для протекания реакции. Данные по энтальпиям реакций и энталь-
пиям
газов, которые
следует
учитывать при термодинамическом
анализе синтеза формальдегида, приведены в табл.
VII.17
и VII.18.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
205
Таблица
VII.17
Энтальпии
при
постоянном
давлении
для
реакций,
протекающих
при
синтезе
формальдегида
а
)
Газофазная
реакция
(1) СН
3
ОН = НСНО + Н
2
<2)НСНО=СО
+ Н
2
(3) СН
3
ОН + i/
2
O
2
= НСНО + Н
2
О
<4) НСНО +
1
1
2
О
г
= СО -f Н
2
О
<5)СО-Р/
2
О
2
= СО
2
Энтальпия
реакции, ккал/моль
500°К
21,5
2,2
-36,8
-56,1
-67,80
600°К
21,8
2,6
-36,7
-55,9
-67,79
700°К
22,0
2,8
-36,7
-55,9
-67,76
800°К
22,1
3,0
-36,8
-55,9
-67,70
900°К
22,2
ЗД
-36,9
-56,0
-67,64
1000° К
22,3
3,1
-36,9
-56,1
-67,55
Данные
Джонса
и
Фаули [699].
Таблица
VI 1.18
Энтальпии газов
Газ
Кислород
Водород
Азот
Пар
Окись
углерода
Двуокисьуглерода
Метанол
Формальдегид
,
участвующих
при синтезе
300° К
0,013
0,013
0,013
0,016
0,014
0,017
0,021
0.017
400° К
0,722
0,708
0,710
0,828
0,712
0,958
1,181
0,906
в реакциях, протекающих
формальдегида
а
)
Энтальпия,
500° К
1,
1,
1,
1,
1,
1,
2,
1,
454
407
413
659
418
986
541
896
600° К
2,209
2,106
2,126
2,516
2,138
3,086
4,081
2,993
ккал/моль
700°К
2
2
2
3
2
4
5
4
988
808
853
405
874
244
771
,194
800° К
3,786
3,514
3,597
4,324
3,628
5,453
7,631
5,483
900° К
4,
4,
4,
5,
4,
6,
9,
6,
600
225
356
269
399
702
621
865
1000° К
5,427
4,943
5,131
6,242
5,185
7,985
11,711
8,314
Данные
Джонса
и
Фаули [699].
Используя эти данные, изменение энтальпии участников реакции
(VII.12) в интервале температур от 298 до
573°
К можно записать так:
3,665
+
V
2
«(l,995+4x
1,933)
= 3,665+4,8631.
Приняв
энтальпию реакции при
573°
К равной 36,7
ккал/молъ
и
приравняв ее к приведенному выражению, получим х — 6,8. Если
сделанные предположения справедливы, то полученные для реакции
(VI 1.12) данные показывают, что состав идеальной реагирующей
смеси
будет
[СН
3
ОН + 3,4(О
2
+
4N
2
)],
т. е. в
воздухе
должно содер-

206
Часть 1.
Основы
термодинамики
VII.
Применение термодинамики для решения промышленных проблем 207
жаться около 5,6% метанола. Если проводить синтез формальдегида
при
673°
К, то х = 4,6; в таком
случае
реагирующая смесь содер-
жит 8,0% метанола. В патентах, выданных Крейве [294] на метод
прямого
окисления метанола, приведены рабочие температуры от 250
до
450°
С при содержании метанола в
воздухе
5—10 %
•
Как
видно из табл. VII.17, реакции дегидрирования эндотермич-
ны,
а реакции окисления экзотермичны. Если соответствующим
образом скомбинировать эти два типа реакций, то можно добиться
равенства их энтальпии при некоторой температуре процесса. Осу-
ществляемый по такому принципу технологический процесс обычно
проводят при некоторой оптимальной температуре и контролируют
его путем подачи реагирующих веществ, взятых в соответствующем
соотношении.
Из табл.
VII.16
видно, что константа равновесия
реакции
окисления (3) в области рассматриваемых температур имеет
значение
порядка
10
11
—10
17
.
Это указывает на полноту протекания
реакции
окисления в сложном процессе производства формальдегида
и
на ее необратимость в области рассмотренных температур. Однако
ввиду того, что константа равновесия реакции дегидрирования (1),
приведенная
в табл. VII.16, имеет значения от 10"
1
до 10
2
, при всех
температурах процесса в состоянии термодинамического равновесия
в
газовой фазе вместе с избытком метанола
будут
находиться продук-
ты этой реакции: метанол, формальдегид, водяной пар, водород и азот.
Если
отношение количества формальдегида к избытку метанола
в
продуктах выразить через (1 + х)1у, то суммарный процесс синтеза
можно
представить в виде реакции
СН
3
ОН
+ V
2
(O
2
+
4N
2
)
+ (
х
+
2/)СН
3
ОН
=
которую в общем виде можно записать следующим образом:
В табл.
VII.16
приведены значения константы равновесия как
функции
от температуры для реакции дегидрирования (1). Записав
константу равновесия реакции (1)
Л=
V
CH
3
OH
tOt)
получим связь
между
величинами х и у. Приравнивая энтальпии
участников рассматриваемой реакции (табл.
VII.18)
к изменению
энтальпии
этой же реакции при температурах, указанных
в
табл. VII.17, нетрудно получить
другое
соотношение, связываю-
щее х и у. Таким образом, х и у можно рассчитать при любой тем-
пературе и определить
выход
формальдегида при различных тем-
пературах и составах газовой смеси.
Управление режимом сложного процесса
требует
более высоких
концентраций
метанола, т. е. такого условия, которое может быть
достигнуто путем перегрева реагирующих газов до темпера-
туры
383°
К. Полагая, что реакция протекает при температуре
1000°
К
и
давлении 1 атм, получим
Энтальпия
реагирующих веществ в интервале от 383 до
1000°
К
будет
равна сумме энтальпий реакций окисления и дегидриро-
вания
при
1000°
К. Используя данные по энтальпиям, приве-
денные в табл. VII.18, находим
36,9—22,3х=(1 + х+у) 10,73-1-1/
2
(4,825)
+ 2 (4,539),
откуда
у = 1,369 —
3,078г.
(VII.14)
Совместное решение уравнений
(VII.13)
и
(VII.14)
дает
# =
0,443
и
у =
0,004.
Следовательно, суммарную реакцию, протекающую
при
1000°
К, можно записать в виде
1,447СН
3
ОН +
i/
2
(O
2
+4N
2
)
= 1,443НСНО + 0,004СН
3
ОН + 0,443Н
2
+
Н
2
О+2N
2
.
Результаты аналогичных расчетов для
других
температур приведе-
ны
в табл. VII.19. Анализируя эти данные, можно отметить несколько
Таблица
VII.19
Влияние
температуры на
состав
при
газофазном
синтезе
формальдегида
по
реакции
(VII.12)
а
)
Т, °К
600
700
800
900
1000
600
700
800
900
1000
а
-
X
0,83
0,92
0,77
0,61
0,44
0,78
0,83
0,65
0,46
0,22
V
2,92
0,35
0,051
0,004
0,004
2,73
0,285
0,020
0,008
0,003
Реагенты
моли
К
о
М
о
4,75
2,27
1,82
1,61
1,45
4,51
2,11
1,67
1,46
1,22
'
Данные
Джонса
и
'
1
моль
воздуха =
£-
и
и
о
2,50
2,50
2,50
2,50
2,50
2,50
2,50
2,50
2,50
2,50
Фаули
о
К
1,00
1,00
1,00
1,00
1,00
[699]
%
и
о
м
о
65,5
47,6
42,2
39,2
36,7
56,3
37,6
32,3
29,5
25,9
3,2 (О
2
+ 4N
2
)
Продукты
моли
О
in
1,83
1,92
1,77
1,61
1,44
1,78
1,83
1,65
1,46
1,22
И
м
о
2,92
0,35
0,051
0,004
0,004
2,73
0,285
0,020
0,008
0,003
и
0,83
0,92
0,77
0,61
0,44
0,78
0,83
0,65
0,46
0,22
Q
с-
Я
1,00
1,00
1,00
1,00
1,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
2,00
%
о
о
21,3
31,0
31,7
30,8
29,5
19,2
26,3
26,1
24,6
22,4
.208
Часть
1,
Основы
термодинамики
интересных особенностей.
Так, при
высоких температурах
тре-
буется меньшее количество
участвующего
в
реакции метанола.
Согласно
Уайту
[1604], верхний предел воспламенения метанола
в
воздухе
составляет около 36,5%,
что
указывает
на
взрывоопас-
ность реакционной смеси выше
1000°
К. Таким обрАзом, условия
проведения реакции выше этой температуры неблагоприятны.
Из
последней графы табл.
VII.19
видно, что наибольшее количество
формальдегида образуется при температурах около
750°
К из
смеси,
содержащей 45% метанола
и
55%
воздуха,
в
то же время максималь-
ная
степень превращения метанола
в
формальдегид может быть
достигнута при температуре около
1000°
К в
смеси 37 % метанола
и
63%
воздуха.
Отсюда
следует,
что оптимальные условия проведе-
ния
этого процесса лежат
в
области
между
указанными двумя пре-
делами.
Подача пара
—
удобный способ подогрева реакционной смеси,
хотя
в
этом процессе пар является продуктом реакции. Добавление
пара
к
реакционной смеси приводит
к
новым уравнениям баланса
типа
(VII.13)
и
(VII.14), цифровое решение которых дано
в
нижней
части табл. VII.19. Использование пара снижает температуру сум-
марной
реакции,
т. е.
вызывает эффект, который наблюдался
бы
при
разбавлении.
Следует
отметить, что, хотя
с
помощью пара удается
регулировать температуру процесса, это не повышает выхода желае-
мого продукта.
Производство уксусной кислоты
При
осуществлении синтеза жидких топлив
из
водяного газа
Фишер
[427] среди продуктов каталитических реакций обнаружил
уксусную
кислоту
и
метанол. Харди [570], исследовав несколько
позднее каталитическое взаимодействие окиси
углерода
и
метанола,
пришел
к
выводу,
что
образование уксусной кислоты
по
реакции
) = CH
3
COOH(g)
при
комнатной температуре является экзотермическим процессом.
Харди провел термодинамический анализ этой реакции
и
показал,
что при давлении
1
атм
до
температуры около
643°
К в
состоянии
равновесия образуется значительное количество уксусной кислоты;
при
увеличении давления
от 1 до 50
атм при
600°
К
выход
уксусной
кислоты уменьшается
с 25 до
4%. Харди изучил влияние темпера-
туры
(до
643°
К), давления (до
200
атм), скорости газового потока
над катализатором
и
количества катализатора
на
выход
уксусной
кислоты.
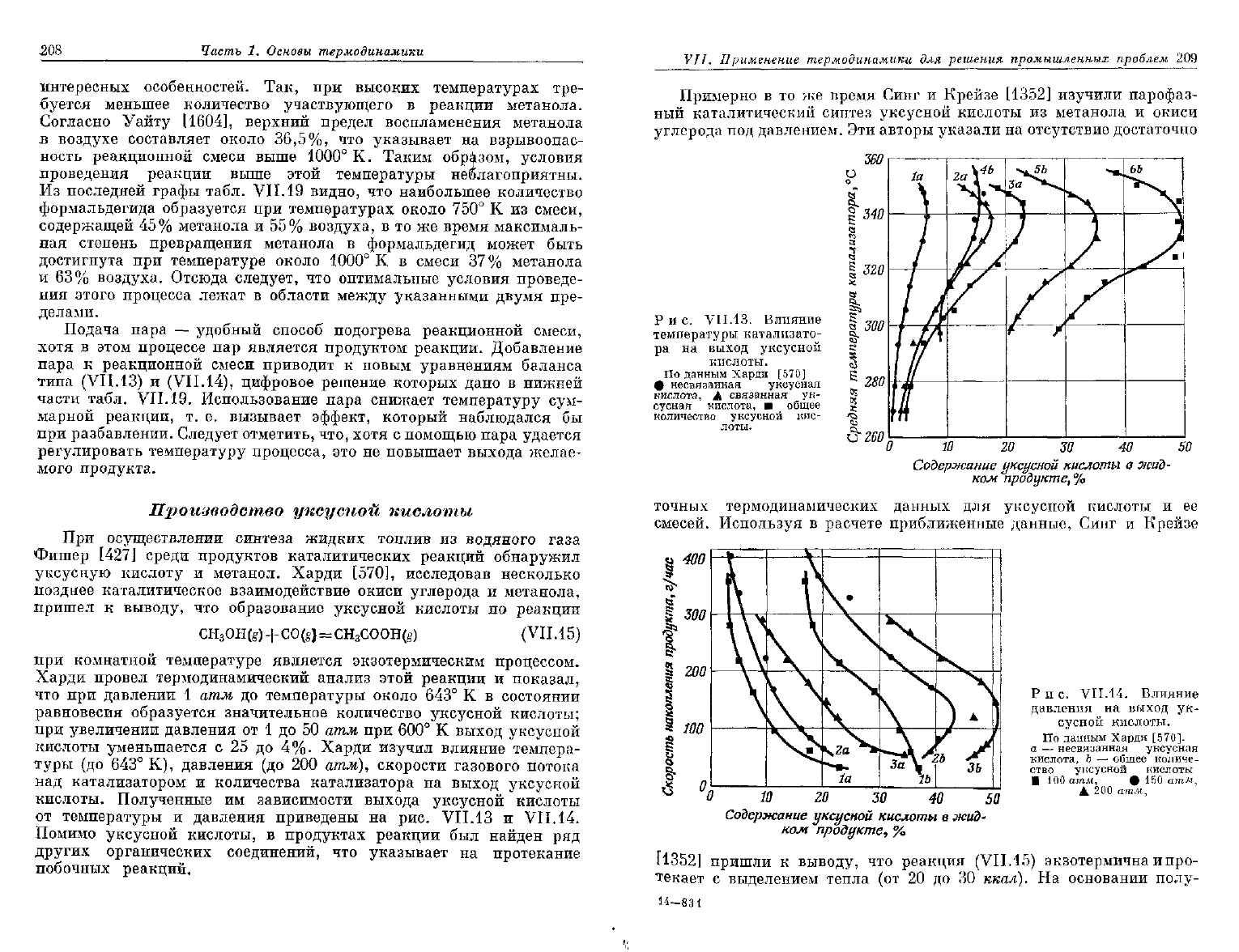
Полученные
им
зависимости выхода уксусной кислоты
от температуры
и
давления приведены
на
рис.
VII.13
и
VII.14.
Помимо
уксусной кислоты,
в
продуктах реакции
был
найден
ряд
других
органических соединений,
что
указывает
на
протекание
побочных реакций.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
209
Примерно
в то же
время Синг
и
Крейзе
[1352]
изучили парофаз-
ный
каталитический синтез уксусной кислоты
из
метанола
и
окиси
углерода
под давлением. Эти авторы указали на отсутствие достаточно
Рис.
VII.13. Влияние
температуры катализато-
ра
на
выход
уксусной
кислоты.
По
данным Харди
[570]
ф несвязанная уксусная
кислота,
А
связанная
ук-
сусная кислота,
•
общее
количество уксусной
кис-
лоты.
ISZ60
Содержание
уксусной
кислоты
в
жид-
ком
продиктв,%
точных термодинамических данных
для
уксусной кислоты
и ее
смесей. Используя
в
расчете приближенные данные, Синг
и
Крейзе
0
10 20 30 40 50
Содержание
уксусной
кислоты
в
жид*
Р
и
с. VII.14. Влияние
давления
на
выход
ук-
сусной кислоты.
По
данным Харди [570].
а
—
несвязанная уксусная
кислота, Ь
—
общее количе-
ство уксусной кислоты
• 100 атм,
•
150 от.»,
А 200
атм,
11352]
пришли
к
выводу,
что
реакция
(VII.15)
экзотермична и про-
текает
с
выделением тепла
(от 20 до 30
ккал).
На
основании полу-
14-831

210
Часть
1.
Основы
термодинамики
VII.
Применение
термодинамики
для
решения
промышленных
проблем
211
ченных результатов Синг
и
Крейзе отмечают,
что в
интервале тем-
ператур от 300 до
500°
С
даже
при давлениях ниже 300 атм
в
равно-
весной
газовой фазе образуется значительное количество уксусной
кислоты.
Синг
и
Крейзе изучили влияние температуры
(до
500°
С),
давления
(до 280
атм), объемной скорости
над
катализатором,
относительных количеств реагирующих веществ
и
рециркуляции
побочных продуктов на
выход
уксусной кислоты. Авторы показали,
что определенные экспериментально побочные продукты
могут
образоваться
в
результате следующих реакций:
2СН
3
ОН=СН
3
ОСН
3
+Н
2
О,
СН
3
ОН
+
СО
=
НСООСНз,
СН
3
ОН
+
СО
= СО
2
+ СН
4
или
СН
3
СООН
= СО
г
+ СН
4
.
Условия процесса получения уксусной кислоты можно подобрать
таким
образом, что нерастворимые
в
воде масла не
будут
получаться,
а образующиеся побочные продукты
будут
полностью превращаться
в
уксусную кислоту.
Кутепов, Химмель
и
Хоеншутц [818] опубликовали некоторые
параметры технологического процесса получения уксусной кислоты
непрерывным
методом
в
жидкой фазе при давлении около
100 атм
и
300°
С
в
присутствии карбонилиодида кобальта
в
качестве ката-
лизатора; метод применен
на
заводе производительностью 1000
т
в
месяц. При таком способе получения
на
каждые 100
кг
СН
3
СООН
(чистота более
99,8%)
образуется около
4 кг
побочных продуктов;
половину
из них
составляет пропионовая кислота, остальное
—
этилацетат, бутилацетат
и
2-этилбутаналь. Энтальпия реакции
промышленного синтеза уксусной кислоты
на
этом заводе равна
—29,03
ккал/молъ
(считая
на
уксусную кислоту). Заводы по синтезу
уксусной кислоты
и ее
очистке полностью автоматизированы.
Реакция
Гаттермана
—
Коха
Дилке
и
Элей [328] исследовали термодинамические параметры
реакции
Гаттермана
—
Коха.
Эта
реакция относится
к
такому
классу превращений,
в
результате которых группа —СНО
с
по-
мощью катализаторов типа (НС1
+
А1С1
3
)
вводится
в
молекулы
ароматических соединений. Некоторые исследователи предполагали,
что хлористый формил, хотя
его и не
удалось выделить, предста-
вляет собой промежуточное соединение. Используя данные по изме-
нениям
энергии Гиббса для уксусной кислоты, хлористого ацетила
и
муравьиной кислоты, нетрудно вычислить значение
AG/°
98
C1CHO
{g)
y
равное
—43,17
ккал/молъ.
Отсюда для реакции
HCl(g)
+
СО(
?
)
=
ClCHO(g)
-22,78
-32,82
-43,17
получим
8
=
12,43
ккал/молъ.
Как
видно
из
приведенных данных, положительное значение
AG/298
этой
реакции свидетельствует
о
том,
что
хлористый формил нельзя
получить таким способом.
Записав
вторую стадию реакции
AG/
2
°
находим
43,17
30,99
8
=—11,67
ккал/молъ.
HCl(g),
—1,07
—22,78
Отрицательное значение
AGr^ss
этой стадии свидетельствует
о
том,
что хлористый формил способен реагировать
с
бензолом
с
образова-
нием
бензальдегида
и
хлористого водорода.
В связи
с
трудностью получения хлористого формила (хотя
он
известен
и
может быть выделен) Дилке
и
Элей [328] провели термо-
динамический
анализ реакции образования каталитического ком-
плекса. Использованные
в
расчете термодинамические свойства
веществ, участвующих
в
реакции
приведены
в
табл. VII.20.
Из
этих данных нетрудно рассчитать
изменения
энтальпии, энтропии
и
теплоемкости вышеприведенной
Таблица
VII.20*
Термодинамические
свойства
бензола,
окиси
углерода
и
бензальдегида
а
)
Соединение
Бензол (1)
Окись
углеро-
да
(g)
Бензальде-
гид (1)
ДНс
298
б
)
-781,0
—
67,6
—841,3
Литера-
тура
[1194]
[1244]
[744]
АН/298
б
)
11,737
-26,452
-22,015
go
В)
°298
'
41,5
47,3
57,4
г)
Литера-
тура
[1477]
[1244]
[1105]
Ср°298
31,9
7,0
45,4
Лите-
ратура
[1577]
[1577]
[1577]
а
) Данные Дилке
и
Элея [328].
б)
В
ккал/моль.
в
)
В
кал/(моль-"К).
г
) Рассчитано из данных, приведенных
в
работе [1105].
реакции:
АНг°
2
д
8
=
—7,3
ккал/молъ,
ASrl
9S
=
—31,4
кал/(молъ
-°К)
и
ДСр298
=
6,5
кал/(молъ
'
С
К).
В
табл. VII.21 приведены рассчитан-
14*

212
Часть
1.
Основы
термодинамики
ные
из
этих данных по формуле
—RT In
К =
\G°
T
=
Т
8
+
ДСр (Т— 298)
—ТACpin
—-
величины изменения энергии Гиббса
и
константы равновесия рас-
сматриваемой реакции
при
разных температурах.
Из
данных
табл.
VII.21
следует,
что
выход
бензальдегида при комнатной тем-
Таблица
VII.21
Термодинамические
параметры
реакции
C
6
H
e
(J)
+
CO(gr)
=
C
6
H
5
CHO(J)
а
)
Т, °К
298
323
373
2,06
2,83
4,35
«(•103)
31,6
12,6
2,9
а
)
Данные
Дилке
и
Элея
[328],
рассчитано
из
данных
табл.
VII.20.
пературе составляет около
2% (в
расчете
на
бензол)
и
уменьшается
с увеличением температуры. Поскольку рассчитанные значения
К
очень чувствительны
к
небольшим изменениям
АНг,
погрешность
в
определении энтальпии образования бензальдегида
в
значительной
степени затрудняет детальное сравнение этих величин.
Пытаясь
выяснить роль промежуточного комплекса, Дилке
и
Элей
[328]
определили изменение энергии Гиббса процесса
образования смеси бензальдегида
с
некоторыми галогенидами,
катализирующими эту реакцию. Для этой цели авторы провели две
серии измерений:
а)
калориметрическое определение энтальпии
смешения
твердой катализирующей соли галогеноводородной кис-
лоты
с
жидким бензальдегидом,
т. е.
энтальпии образования ком-
плекса, например, по реакции (VII.16),
и
б) измерение концентрации
частиц, находящихся
в
равновесии
и
определяющих константу рав-
новесия
К
каждой реакции,
для
которой, как указывалось выше,
определяли энтальпии смешения, например
С
в
Н
5
СНО
(0
+1/
2
Al
2
Cl
6
(s)
=
С
6
Н
6
СНО
•
А1СВД.
(VII. 16)
Эти данные, приведенные
в
табл. VII.22, показывают, что изменения
энтальпии,
энергии Гиббса (или констант равновесия)
и
энтропии
рассмотренных реакций позволяют расположить катализаторы
в
такой
же
последовательности, которая соответствует
их
катали-
тической активности
в
однотипных реакциях. Единственное исклю-
VII.
Применение
термодинамики
для
решения
промышленных
проблем
213
Таблица
VI 1.22
Термодинамический
порядок
активности
катализатора
в
реакции
(VII.16)
при
298°
К
а
)
Комплекс
(C
e
H
5
.CHO)
2
.SnCl
4
С
6
Н
5
-СНО.А1С1
3
C
6
H
5
-CHO-FeCl
3
C
e
H
5
-CHO-SbCl
3
ккаi
/моть
-28,0
-24,7
-12,8
-3,9
к
3,6-105
60
30
9
AG",
ккал/моль
-7,6
-2,4
-2,0
-1,3
AS»,
кал/(моль
°К
-68
-75
-36
-9
а
)
Данные
Дилке
и
Элея
[328].
чение
—
это изменение энтропии хлористого алюминия.
В
этом
случае
аномальную величину
А5°
реакции (VI 1.16) нетрудно объяс-
нить,
если
учесть
возможность участия хлористого алюминия
в
рав-
новесии
реакции диссоциации: А1
2
С1
6
—
2А1С1
3
.
Из
полученных
данных видно, что образование промежуточного комплекса приводит
к
таким изменениям энергии Гиббса, которые благоприятствуют
протеканию реакции Гаттермана
—
Коха.
Таким
образом, данные, приведенные
в
этом разделе, показывают
необходимость дальнейшего термохимического исследования роли
катализатора
в
подобных процессах.
Использование термодинамики
при
подборе
катализаторов
Отсутствие достаточно полной общей теории гетерогенного ката-
лиза не позволяет
в
настоящее время осуществить подбор катализа-
тора на основании только теоретических представлений. Тем не менее
термодинамические характеристики каталитически активных
веществ
и
катализируемых реакций
могут
оказаться полезными при
выборе соответствующих катализаторов. Поскольку химические
силы
действуют
между
реагирующими веществами
и
катализато-
ром,
последний должен обладать определенным химическим срод-
ством
по
крайней мере
к
одному
из
участников реакции. Поэтому
при
подборе катализатора можно сразу исключить
из
рассмотрения
вещества, химически инертные
к
данной системе. Взаимодействие
катализатора
с
реагирующими веществами должно характеризо-
ваться менее отрицательными значениями изменения энергии Гиббса
по
сравнению
с
изменением энергии Гиббса катализируемой реак-
ции.
При подборе катализаторов этот критерий позволяет исключить
из
рассмотрения
те
вещества, которые образуют устойчивые соеди-

214
Часть
1.
Основы
термодинамики
нения
с
реагирующими веществами.
В
связи
с
вышесказанным
кажутся весьма необходимыми поиски такой взаимосвязи
между
термодинамическими
и
каталитическими свойствами соединений,
которая
показывала
бы
целесообразность использования данного
вещества
как
катализатора
в
рассматриваемой реакции. Попытки
использовать термодинамические данные
при
подборе катализаторов
были сделаны
в
работах Шваба [1293], Франкенбурга [438],
Бика
[97],
Курина
и
Захарова [815], Кульковой
и
Темкина [813],
а
также
в
обзорной работе Голодеца
и
Ройтера
[506] *. |
Пример,
иллюстрирующий применение величин изменения
энер-
гии
Гиббса реакции
для
выбора катализатора, приведен
на
рис. VII.15.
Рис.
VII.15. Зависимость изме-
нения
энергии Гиббса
от
темпе-
ратуры
для
процесса образования
промежуточных соединений
с ка-
тализаторами.
а
—
температурная зависимость
1
/2
AGr°
для всей реакции,
бив
—
температур-
ные
зависимости
AGr"
образования
гипотетических промежуточных соеди-
нений
с
катализаторами
В и
С
соответ-
ственно.
Данные Голодетца
и
Ройтера
[506].
Температура
Прямая
а
соответствует температурной зависимости
l/2AGr°
неко-
торой суммарной реакции, прямые
б и в
отвечают температурной
зависимости
AGr°
предполагаемых промежуточных стадий этой
реакции,
протекающих
с
участием катализаторов
В и С
соответ-
ственно.
Диаграмма, приведенная
на рис.
VII.15, соответствует
большей активности катализатора
В в
интервале температур ниже
7"i
и
выше
Т
2
;
катализатор
С
более активен
в
интервале темпера-
тур Т±
— Т
2
.
Если
структура
промежуточных продуктов реакции
приводит
к
изменению энтропии, примерно равному нулю,
то,
соглас-
* Значительный вклад
в
теорию
и
практику рационального подбора ката-
лизаторов
был
сделан
А. А.
Баландиным
и его
учениками
на
основе пршщшгов
структурного
и
энергетического соответствия.
Эти
принципы, положенные
в
основу мультиплетной теории катализа, позволили систематизировать боль-
шой
экспериментальный материал, накопленный
в
гетерогенном органическом
катализе,
и
предсказать каталитическую активность большого числа соедине-
ний
и
элементов.
См.,
например,
А. А.
Баландин,
Мультиплетная теория ката-
лиза,
ч. I
(1963), часть
II
(1964), Изд-во МГУ,
М.; А. А.
Баландин,
Современное
состояние мультиплетной теории гетерогенного катализа, изд-во
«Наука»,
М. (1968).—
Прим.
перев.
VII.
Применение
термодинамики
для
решения
промышленных
проблем
215
но
соотношению
изменение
энтальпии такой реакции также можно рассматривать
как
весьма надежный показатель каталитической активности.
Макисима,
Ионеда
и
Сайто
[915] на
ряде примеров подтвердили
принцип
энергетического соответствия
в
катализе, показав,
что
наиболее подходящими катализаторами оказываются такие веще-
ства,
для
которых изменение энтальпии
в
процессе образования
промежуточного комплекса
с
участниками катализируемой реакции
примерно
в два
раза меньше изменения энтальпии самой реакции
*.
В качестве примера рассмотрим реакцию окисления
и
предположим,
что
действие катализатора
К
описывается двумя
стадиями:
=
СО
2
+К.
(VII.18)
В этом
случае
самым активным катализатором
будет
тот,
который
обеспечивает наиболее равное распределение изменения энергии
Гиббса
между
двумя промежуточными реакциями
(VII.17)
и
(VII.18).
Этим требованиям удовлетворяют, например, соединения
СиО
и
Си
2
О, которые
в
действительности являются эффективными ката-
лизаторами рассматриваемой реакции окисления.
Фаренфорт,
Рейен
и
Захтлер
[403]
изучили каталитический
рас-
пад муравьиной кислоты
над
различными металлами
и
обнаружили
линейную зависимость энтальпии образования формиата металла,
отнесенной
к
грамм-эквиваленту этого соединения, взятого
в
боль-
шом
объеме,
от
температуры
Тг, при
которой скорость катализи-
руемого распада достигает определенного значения
г. Из
этих данных,
приведенных
на рис.
VII.16,
видно,
что для
формиата металла опти-
мальное значение энтальпии образования
на
грамм-эквивалент
примерно
равно
80
ккал.
При
этом значении каталитическая актив-
ность металла максимальна,
о чем
можно судить
по
низким темпе-
ратурам, которые необходимы
для
достижения данной скорости.
Согласно мультиплетной теории катализа,
на
поверхности ката-
лизатора образуется промежуточное соединение.
Для
реакции,
* Принцип энергетического соответствия, сформулированный
А. А.
Балан-
диным,
при
подборе активного катализатора
для
эндотермической реакции
требует,
чтобы адсорбционный потенциал катализатора (сумма энергий связи
атомов
в
молекуле, соприкасающейся
с
активными центрами катализатора)
был
бы
по
возможности ближе
к
половине суммы энергий реагирующих связей
—
среднему
из
энергий разрываемых
и
вновь возникающих связей. См.:
А. А. Ба-
ландин,
Современное состояние мультиплетной теории гетерогенного катализа,
изд-во
«Наука»,
М.,
1968.—
Прим.
перев.

216
Часть
1.
Основы
термодинамики
VII.
Применение
термодинамики
для
решения
промышленных
проблем
217
протекающей по дублетному механизму, имеем
А
В (I)
А— В
(II) А —В
I I +к :£ '• к : £
D
I
I
С
D
:£ к
ДЯ
Ш
С—-В-
к
С
—D
Стадия I отвечает образованию промежуточного соединения реаги-
рующих веществ на поверхности катализатора К, а стадия II —
распаду образовавшегося промежуточного соединения на продукты
реакции.
Баландин [66], исходя из теоретических предпосылок,
700
650
600
550
£'500
450
400
350
300
\
yAu
\
•Ад
V
Pdi
•Ад
\
Pd^
Ir
• *
Pt
/
Си/
Со
/
У
А
•Ni
/
/
Р
и с.
VII.16. Связь между
энтальпиями образования,
от-
несенными
к
грамм-эквивален-
ту формиата металла,
и
катали-
тической активностью металлов
в процессе разложения
му-
равьиной кислоты.
Точки
верхней кривой полечены для
значения
lnr = 1,0, точьи нижней
кривой
— для значения lnr, рав-
ного 0.8 Данные Фаренфорта, Рей-
ена
и Захтлера [403 J
60 70 80 90 100 ПО ПО
AHf°,
ккал/г-экв
показал,
что в этом
случае
для оптимального протекания каталши-
ческого процесса энтальпия первой стадии реакции (AHi) должна
быть равна энтальпии второй стадии реакции (АН
и
), а значение
энтальпии
всей реакции (VII. 19) должно равняться сумме энталь-
пий
первой и второй стадии:
А—С+В —
D
=
A—B
+
C—D
(VII.19)
Принцип
энергетического соответствия можно распространить
на
любой каталитический процесс, протекающий в несколько ста-
дий.
Кроме того, этот принцип позволяет выбрать наиболее благо-
приятный
путь взаимодействия, для которого термические эффекты
всех
стадий процесса примерно равны.
Следует
отметить, что такое
рассмотрение каталитических реакций влечет за собой выбор соот-
ветствующих термодинамических функций, связанных с каталити-
ческой активностью и другими подходящими критериями для каж-
дой стадии реакции. Однако часто оказывается недостаточно рас-
сматривать только термодинамические аспекты этой проблемы.
Во многих случаях большое значение имеют кинетические факторы,
такие,
как образование электронных связей или соответствие атом-
ной
структуры катализатора геометрическим параметрам молекул
реагирующих веществ и продуктов реакции. Подобные факторы
позволяют объяснить зависимость каталитической активности ката-
лизатора от способа его получения, различную каталитическую
активность граней монокристаллов, а также роль активаторов
и
модификаторов и позволяют проверить, являются ли вещества,
выбранные в качестве катализаторов на основании термодинами-
ческого анализа, эффективными катализаторами реальных процессов.

Часть
2
Термические
и
термохимические свойства
веществ
в
состоянии идеального газа
при
температурах
от 298 до
1000°
К
Глава
VIII
ТЕРМОДИНАМИЧЕСКИЕ
СИМВОЛЫ, КОНСТАНТЫ, МЕТОДЫ
РАСЧЕТА, ДАННЫЕ ДЛЯ ПРОСТЫХ ВЕЩЕСТВ И НЕКОТОРЫХ
НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Практическое применение термодинамики
требует
последова-
тельного использования определенной системы обозначений
и
одних
и
тех же
численных значений постоянных.
Это
особенно важно
в связи
с тем, что
расчеты термодинамических свойств соединений
основываются
на
соответствующих данных
для
химических элемен-
тов.
Вот
почему
в
начале этой главы описана система обозначений,
приведены численные значения постоянных
и
определены стандарт-
ные состояния для ряда элементов
(все это
использовано
при
соста-
влении таблиц, помещенных
в
последующих главах). Рассмотрен метод
расчета табличных данных
и
приведены таблицы
для
ряда неорга-
нических соединений, часто используемых
в
органической химии.
Определение термодинамических символов
Путаница
в
обозначениях термодинамических функций, отме-
чавшаяся
еще в 1932 г.
Парксом
и
Хаффманом [1105], сохранилась
и
по сей день. Очень жаль, что
в
американской
и
европейской химиче-
ской
литературе
существуют
расхождения
в
отношении функции,
известной
в США как
свободная энергия,
а в
Европе
как
свободная энтальпия
и
обозначаемой соответ-
ственно
F и G.
Питцер
и
Брюер [861] предложили принять символ
G
и
называть
эту
функцию энергией Гиббса. Такая
же
рекомендация была сделана Комиссией по символам
и
номенклатуре
физико-химической секции Международного союза чистой
и
приклад-
ной
химии [1656]. Будучи твердо уверенными
в
том,
что все
после-
дующие сводки термодинамических данных
будут
основываться
на
вышеуказанных рекомендациях,
мы
приняли
эту
терминологию.
Остальные символы
не
столь противоречивы; важнейшие
из них
перечислены ниже (более полный перечень
дан в
приложении
1):
Е
—
энергия (внутренняя),
Н
—
энтальпия
(Н = Е + PV),
VIII.
Термодинамические
символы,
константы,
методы
расчета
219
G
—
энергия Гиббса
(G = Н — TS),
43р —теплоемкость
при
постоянном давлении.
В книге приводятся мольные величины; исключения оговорены.
Знак
градуса
в
верхнем индексе
(°)
того
или
иного термодинами-
ческого символа означает,
что
указанная величина относится
к
стан-
дартному состоянию.
В
качестве стандартного состояния для газов
нами
принято состояние идеального газа при давлении
1
атм,
а для
конденсированных
фаз —
состояние чистого вещества
в
виде
жидкости
или
твердого тела
при
давлении
1 атм. Так,
например,
AHv обозначает энтальпию процесса превращения жидкой фазы
в реальный
газ при
давлении насыщенного пара,
тогда
как
AHv
0
означает энтальпию процесса превращения чистой жидкости
в идеальный
газ при
давлении
1 атм.
Курсивными строчными буквами
/, t, m, v, s, с, г
при символах
термодинамических свойств обозначены соответственно процессы:
образование
из
элементов
(/),
полиморфное превращение (переход)
в твердом состоянии
(t),
плавление
(т),
испарение (превращение
жидкости
в
пар)
(v),
сублимация (превращение твердой фазы
в пар)
%s),
сгорание
(с) и
протекание реакции
(г).
Числами
в
индексах (например,
298,15
или 0)
обозначена абсо-
лютная температура (°К).
Во
всех
таблицах
и в
тексте индексом
298
обозначена температура, равная
298,15°
К.
Н°
Т
—
Я°
98
—
разность
между
энтальпией
в
стандартном состоя-
Тнии
при
температуре
Т и
энтальпией
в
стандартном состоянии
при
I'
температуре
298,15°
К.
(G°
T
—
Щ
да
)/Т
—
приведенная функция энергии Гиббса. Опреде-
ление
ее
дается уравнением
(V.22),
согласно которому
она
равна
fiH^
—
H°
2W
)/T
— S
o
j.
Значения этой функции приведены
в
таблицах
г наряду
с
собственными значениями энергии Гиббса, причем интер-
• поляция функции облегчена, поскольку
ее
зависимость
от
темпера-
1
"туры
не
столь сильная
и по
характеру приближается
к
линей-
ной.
•'_ 8°—«практическая» энтропия
в
стандартном состоянии
при ука-
занной
температуре
без
учета
вклада
от
изотопного смешения
и
ядер-
' ных спинов.
А обозначает изменение данного свойства
для
процесса или реак-
• Ции. Это разность
между
значением той или иной функции для конеч-
ного состояния
и
соответствующим значением
для
исходного состоя-
ния.
Например,
AHf —
энтальпия образования
—
изменение энталь-
пии
при
химической реакции образования данного соединения
из
3
»5Влементов, входящих
в это
соединение, причем каждое вещество
|,»*Яолжно быть
в
определенном термодинамическом состоянии
при
и-
данной температуре.
В то же
время
AHf —
стандартная энтальпия
У образования
—
изменение энтальпии, относящееся
к
той
же
реакции,
Яричем каждое вещество должно находиться
в
стандартном
состоянии при данной температуре.

220
Часть
2.
Термические
и
термохимические
свойства
веществ
Кр
—
константа равновесия
для
данного процесса
или
реакции,,
выраженная через парциальные давления.
Для
схематически записан-
ной
реакции
сС +
сШ 5±
^М + rcN
константа равновесия
К
дается
соотношением
v
_iflw_
(«N)
где
а, —
активность
£-го
вещества.
Для
чистой конденсированной
фазы
эта
активность может быть принята
за
единицу;
для
газа актив-
ность может быть приравнена летучести.
В
случае
идеального газа
летучесть
равна давлению;
для
реального газа
при
относительно
низких
давлениях
и при
обычной
или
более высоких температурах
давление приблизительно равно летучести; следовательно,
при
этих
условиях
Иа
основании уравнения
(V.11)
можно записать следующее соотно-
шение
между
логарифмом константы равновесия
и
энергией Гиббса:
lg
Кр —
десятичный логарифм константы равновесия (выражен-
ной
через давления) реакции образования
1
моля веществ
из эле-
ментов, причем каждое
из
участвующих
в
реакции веществ должно
находиться
в
стандартном состоянии
при
данной температуре.
В
этом
случае
логарифм константы равновесия можно следующим образом
выразить через стандартную энергию образования Гиббса:
—
АНт
и ASm —
изменение энтальпии
и
энтропии
в
процессе
плавления;
при
этом предполагается,
что
каждое вещество должно
находиться
в
определенном термодинамическом состоянии, обычно
при
давлении насыщенного пара. Поскольку
в
данных процессах
участвуют
вещества только
в
конденсированной фазе, различия
между
изменениями
стандартных величин энтальпии
и
энтропии
АНт°
и
ASm°
и
соответствующими изменениями величин
АНт и ASm
незначительны,
за
исключением процессов, протекающих при высоких
давлениях.
Для
чистых веществ
в
жидком
и
твердом состояниях
влияние средних давлений
на
термодинамические свойства почти
всегда пренебрежимо мало.
Так,
например, теплоемкость
при
низких
температурах того
или
иного соединения обычно определяют при
дав-
лении насыщенного пара плюс зависящее
от
температуры давление
гелия, вводимого
для
ускорения достижения теплового равновесия,
VIII.
Термодинамические
символы,
константы,
методы
расчета
221
при
этом результаты оказываются
в
пределах точности эксперимен-
тальных измерений теплоемкости
при
постоянном давлении, равном
1
атм.
Однако существенная зависимость
между
температурой плав-
ления
и
давлением вызывает необходимость принятия специального
символа
ftp для
часто встречающегося случая тройных точек,
так
называемых «точек плавления», измеряемых
при
давлении насыщен-
ного пара данного соединения.
AHv и ASv —
изменения энтальпии
и
энтропии
в
процессе испа-
рения
жидкости
и
газа
при
определенном давлении (чаще всего
используются значения давлений насыщенного пара). Обычно
раз-
ница
между
AHv (при
нормальной точке кипения)
и
AHv
0
небольшая,
но
бывает
и
значительной
для
некоторых паров, состоя-
щих
из
ассоциированных частиц,
как это
показано
на
примерах,
рассмотренных
в
предшествующей главе. Энтропия газа, конечно,
сильно зависит
от
давления. Даже
при
давлении
1 атм
часто наблю-
дается значительное расхождение
между
данными, относящимися
к
состояниям реального
и
идеального газа, особенно когда суще-
ствует
тенденция
к
ассоциации
или
диссоциации. Следовательно,
можно ожидать различия
между
значениями
ASv и
ASv
0
как в
резуль-
тате
того,
что
давление насыщенного пара
не
равно
1 атм, так и в
результате
неидеальности газа.
AHs
и ASs —
изменения энтальпии
и
энтропии
для
процесса
сублимации
(т. е.
процесса превращения твердой фазы
в
газооб-
разную). Соотношение
между
этими величинами
и
стандартными
аналогично соответствующей взаимосвязи
для
процесса испарения.
АНс°
—
изменение энтальпии
для
реакции сгорания определен-
ного вещества
в
газообразном кислороде
с
образованием продуктов
сгорания
при
постоянной температуре
и
давлении, причем
все
реаген-
ты
и
продукты реакции должны находиться
в их
стандартных состоя-
ниях.
АНг
—
изменение энтальпии
для
реакции, особенности которой
должны быть указаны
в
тексте. Часто
это
изменение энтальпии назы-
вается «теплотой реакции».
Температуры,
даваемые
в
градусах
Цельсия
(°С) в
эксперимен-
тальных работах
и
соответствующие международной температурной
шкале
[183, 1034,
1423], пересчитаны
в
градусы
Кельвина
(°К)
по
формуле
°К =
273,15
-f- °C.
Отличие международной шкалы
от термодинамической описано Мюллером
[1034]
и
Стимсоном [1423].
Константы
Данная работа
не
преследовала цели пересчета упоминающихся
в литературе термодинамических функций
на
основании современ-
ных значений констант.
К
счастью, изменения важнейших констант
в этом отношении были незначительными.
В тех
случаях,
когда
тер-
j
модинамические функции рассчитывались непосредственно, исполь-
