Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

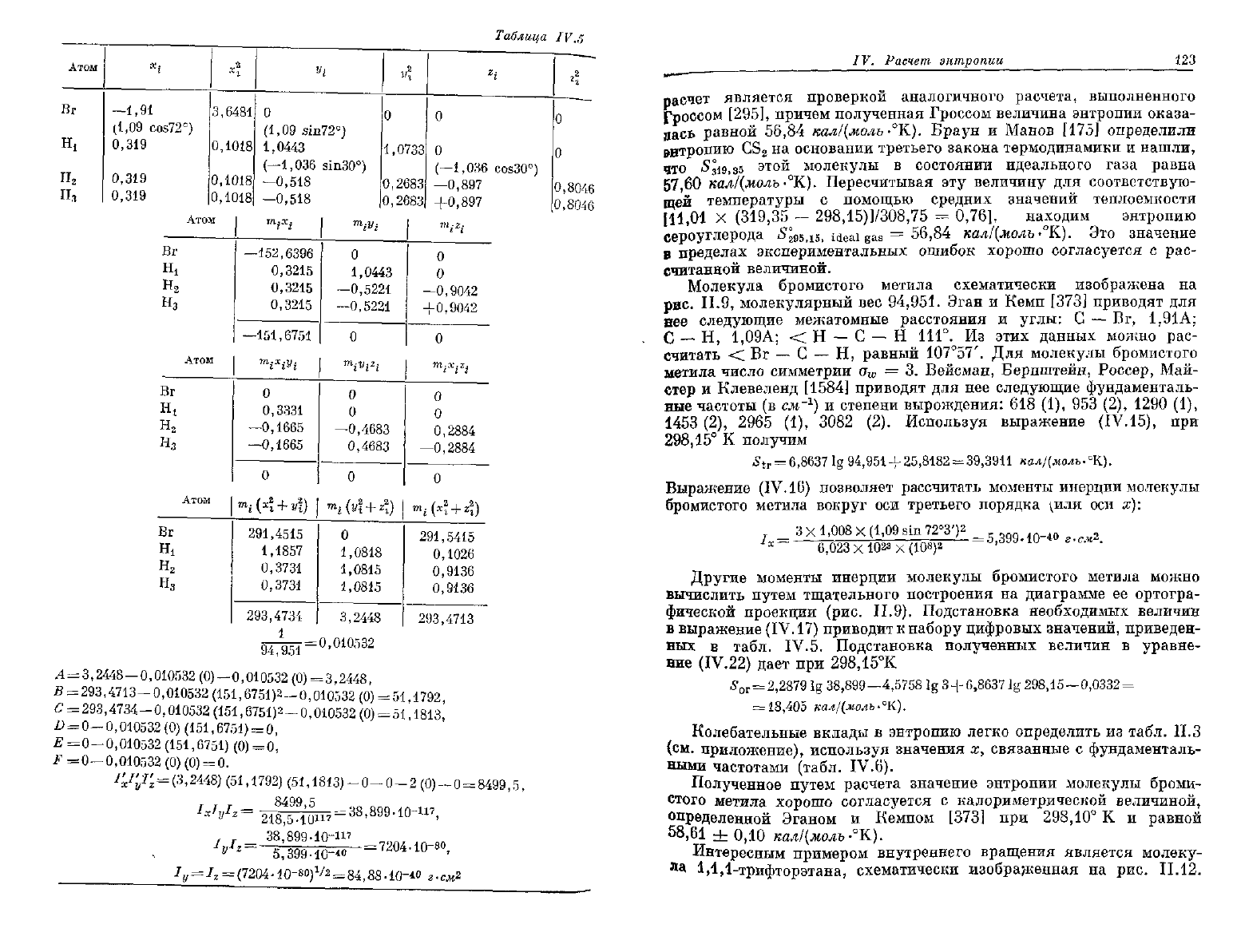
Атом
Br
Hi
н
2
Н
3
x
i
—1,91
(1,09 cos72°)
0,319
0,319
0,319
3,
0,
0,
0,
A
6481
1018
1018
1018
0
(1,0
v
i
9 sin72°)
1,0443
(-1
-о,
-о,
,036 sin30°)
518
518
0
1,
0,
0,
v\
0733
2683
2683
0
0
(-1
-o,
+0,
z
,036
897
897
Таблица
i
cos30°)
IV.r,
л
U
0
0
0
8046
8046
Атом
Вг
Hi
н
2
Нз
m-.
—152,
0,
0,
0,
—151,
с
г
6396
3215
3215
3215
6751
т
0
1,
-о,
—о,
0
iVi
0443
5221
5221
т
0
0
-о,
+0,
0
14
9042
9042
Атом
Вг
Hi
н
2
Нз
m
i
x
iVi
0
0,3331
—0,1665
—0,1665
0
m
iVi4
0
0
—0,4683
0,4683
0
m
i
x
ih
0
0
0,2884
—0,2884
0
Атом
Br
Hi
н
2
H
3
т.(х
291
1
0
0
293
?
+ i/!)
,4515
,1857
,3731
,3731
,4734
1
m
i(
0
1,
1,
1,
з,
0818
0815
0815
2448
?)
291,5415
0,1026
0,9136
0,9136
293,4713
94,951
=
0,010532
С
=
D
=
Е
=
F
=
3,2448—0,010532(0)—0,010532(0)
=3,2448,
293,4713-0,010532
(151,6751)2-0,010532(0)
=51,1792
293,4734-0,010532
(151,6751)2-0,010532 (0) = 51,1813,
0—0,010532(0)
(151,6751) =
О,
0—0,010532 (151,6751) (0) =0,
0—0,010532 (0) (0) = 0.
^
7
^г
=
(3.2448)
(51,1792) (51,1813)-0-0-2 (0)-0 =
8499,5,
8494
5
7
V= 388991<Н"
218,5-
38,899
5,399-10-40
-
=
7204-10-80,
1,88-10"*°
г-см
2
IV. Расчет энтропии
123
^расчет является проверкой аналогичного расчета, выполненного
'Гроссом [295], причем полученная Гроссом величина энтропии оказа-
лась равной
56,84
кал/'{моль
-°К). Браун и Манов [175] определили
энтропию
CS
2
на основании третьего закона термодинамики и нашли,
что
£319,35
этои
молекулы в состоянии идеального газа равна
57,60
кал/(моль-°К). Пересчитывая эту величину для соответствую-
щей
температуры с помощью средних значений теплоемкости
[11,01 X (319,35 —
298,15)1/308,75
= 0,76], находим энтропию
сероуглерода
S°
ig&il5
,
i^ai gas =
56,84
кал/'(моль -°К). Это значение
в
пределах экспериментальных ошибок хорошо согласуется с рас-
считанной
величиной.
Молекула бромистого метила схематически изображена на
рис.
П.9, молекулярный вес 94,951. Эган и Кемп [373] приводят для
нее следующие межатомные расстояния и углы: С — Вг, 1,91 А;
С
— Н,
1,09А;
< Н — С — Н 111°. Из этих данных можно рас-
считать < Вг — С — Н, равный
107°57'.
Для молекулы бромистого
метила число симметрии а
ш
= 3. Вейсман, Бернштейн, Россер, Май-
стер и Клевеленд
[1584]
приводят для нее следующие фундаменталь-
ные
частоты (в см'
1
) и степени вырождения: 618 (1), 953 (2), 1290 (1),
1453 (2),
2965
(1),
3082
(2). Используя выражение (IV.15), при
298,15°
К получим
S
tl
=
6,8637
lg
94,951
+
25,8182
=
39,3911
кал/'(моль•
°К).
Выражение (IV. 16) позволяет рассчитать моменты инерции молекулы
бромистого метила вокруг оси третьего порядка \или оси х):
Т
ЗХ 1,008 X (1,09 sin
72°3')2
6,023
X
1023
Х
(Ю8)2
-
=
5,399-10-40
Другие
моменты инерции молекулы бромистого метила можно
вычислить
путем
тщательного построения на диаграмме ее ортогра-
фической проекции (рис.
II.9).
Подстановка необходимых величин
в выражение
(IV.17)
приводит к набору цифровых значений, приведен-
ных в табл. IV.5. Подстановка полученных величин в уравне-
ние
(IV.22)
дает
при
298,15°К
5
ОГ
=
2,2879
lg
38,899—4,5758
lg 3 +
6,8637
lg
298,15—0,0332
=
=
18,405 кал/(моль-°К).
Колебательные вклады в энтропию легко определить из табл. П.З
(см. приложение), используя значения х, связанные с фундаменталь-
ными частотами (табл.
IV.6).
Полученное
путем
расчета значение энтропии молекулы броми-
стого метила хорошо согласуется с калориметрической величиной,
определенной Эганом и Кемпом [373] при
298,10°
К и равной
58,61
±0,10
кал/{молъ-°К).
Интересным примером внутреннего вращения является молеку-
ла 1.4,1-трифторэтана, схематически изображенная на рис.
11.12.
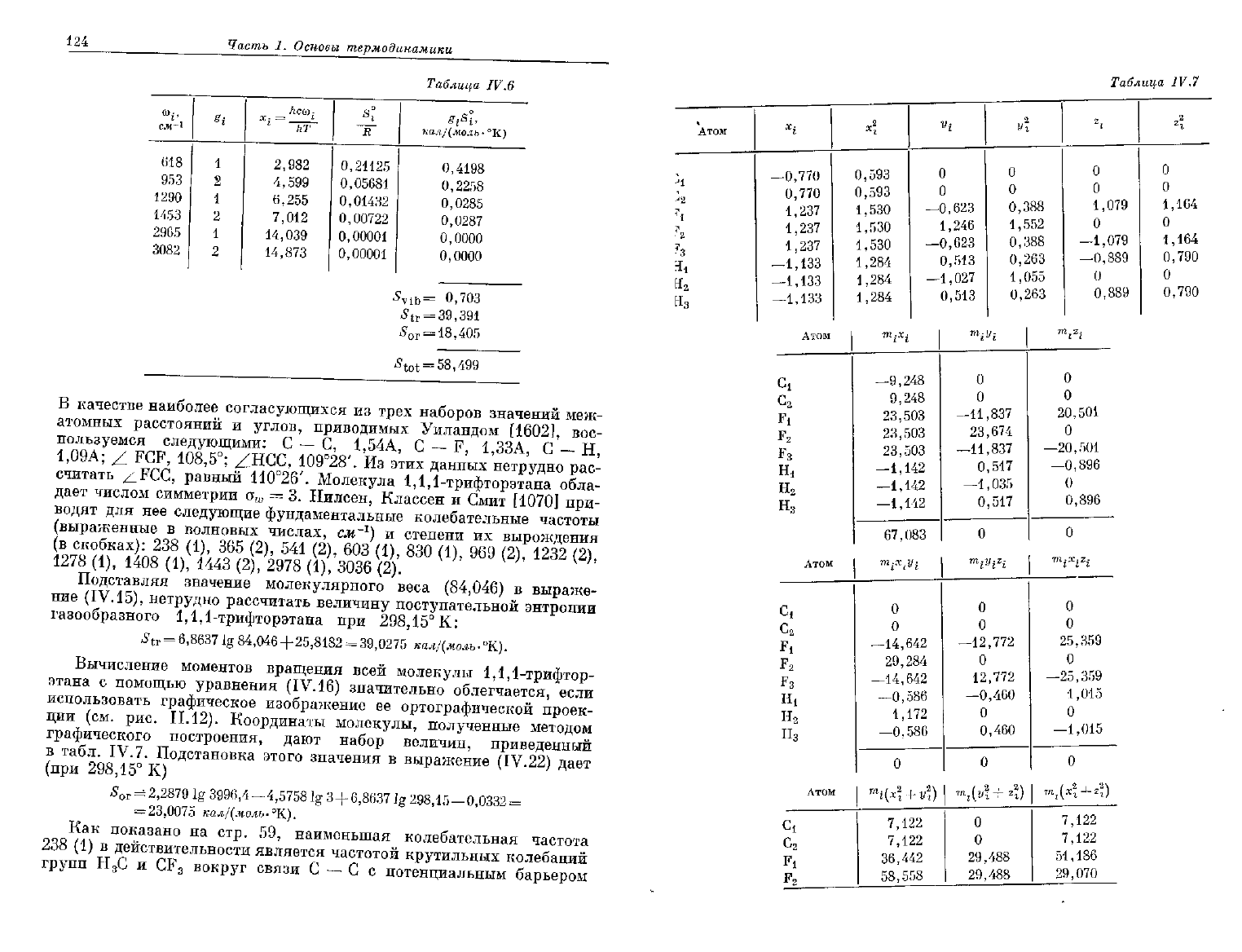
124
Часть
1.
Основы
термодинамики
Таблица
IV.6
618
953
1290
1453
2965
3082
Si
1
2
1
2
1
2
X;
=
2
4
6
7
14
14
ЛС
М
;
kT
,982
,599
,255
,012
039
873
0
0
0,
0,
0,
о,
si
R
21125
05681
01432
00722
00001
00001
&
кал/(моль •
°K)
0,4198
0,2258
0,0285
0,0287
0,0000
0,0000
\
lb
=
0,703
S
or
=
18,405
5
t0t
=
58,499
В качестве наиболее согласующихся
из
трех наборов значений меж-
атомных расстояний
и
углов, приводимых Уиландом [1602],
вос-
пользуемся следующими:
С — С,
1,54А,
С — F,
1,ЗЗА,
С — Н,
1,09А;
/L
FCF,
108,5°;
ZHCC,
109°28'.
Из
этих данных нетрудно рас-
считать
/iFCC,
равный
110°26'.
Молекула 1,1,1-трифторэтана обла-
дает числом симметрии
e
w
=
3.
Нилсен, Классен
и
Смит
[1070]
при-
водят
для нее
следующие фундаментальные колебательные частоты
(выраженные
в
волновых числах,
см~
г
)
и
степени
их
вырождения
(в
скобках):
238 (1), 365
(2),
541 (2), 603
(1),
830
(1),
969
(2),
1232 (2),
1278 (1),
1408 (1), 1443
(2),
2978
(1),
3036
(2).
Подставляя значение молекулярного веса (84,046)
в
выраже-
ние
(IV.15), нетрудно рассчитать величину поступательной энтропии
газообразного 1,1,1-трифторэтана
при
298,15°
К:
5
tr
=
6,8637
lg
84,046+25,8182
=
39,0275
кал/(моль-°К).
Вычисление моментов вращения всей молекулы 1,1,1-трифтор-
этана
с
помощью уравнения (IV. 16) значительно облегчается, если
использовать графическое изображение
ее
ортографической проек-
ции
(см. рис.
11.12). Координаты молекулы, полученные методом
графического построения, дают набор величин, приведенный
в
табл.
IV.7.
Подстановка этого значения
в
выражение (IV.22) дает
(при
298,15°
К)
5
or
=i
2,2879
lg
3996,4—4,5758
lg
3
+
6,8637
Ig
298,15—0,0332
=
=
23,0075
кал /
(моль-°К).
Как
показано
на
стр.
59,
наименьшая колебательная частота
238
(1)
в
действительности является частотой крутильных колебаний
групп
Н
3
С
и
CF
3
вокруг связи
С — С
с
потенциальным барьером
Атом
Ci
Со
Z
г.
1
V,
*
2
Ft
Hi
н,
Нз
x
i
—0,770
0,770
1,237
1,237
1,237
—1,133
—1,133
—1,133
0
0
1
1
1
1
1
1
А
,593
,593
,530
,530
,530
,284
,284
,284
«г
0
0
-0,
1,
—0,
0,
-1,
0,
623
246
623
513
027
513
у
0
0
0,
1,
0,
0,
1,
0,
2
г
388
552
388
263
055
263
h
0
0
1,
0
-1,
-о,
0
0,
Таблица
079
079
889
889
0
0
1
0
1
0
0
0
IV.7
А
,164
,164
,790
,790
Атом
Ci
с
2
Ft
F
2
FT
о
Hi
н
2
Н
3
m
i
x
i
—9,248
9,248
23,503
23,503
23,503
—1,142
—1,142
—1,142
67,083
0
0
—11,837
23,674
—11,837
0,517
—1,035
0,517
0
m
i4
0
0
20,501
0
—20,501
—0,896
0
0,896
0
Атом
c
2
Ft
F
2
F<!
О
Hi
H
2
H
3
m
i
x
i4i
0
0
—14,642
29,284
—14,642
—0,586
1,172
—0,586
0
т
еЧЧ
0
0
—12,772
0
12,772
—0,460
0
0,460
0
m
i
x
i4
0
0
25,359
0
—25,359
1,015
0
—1,015
0
ATOM
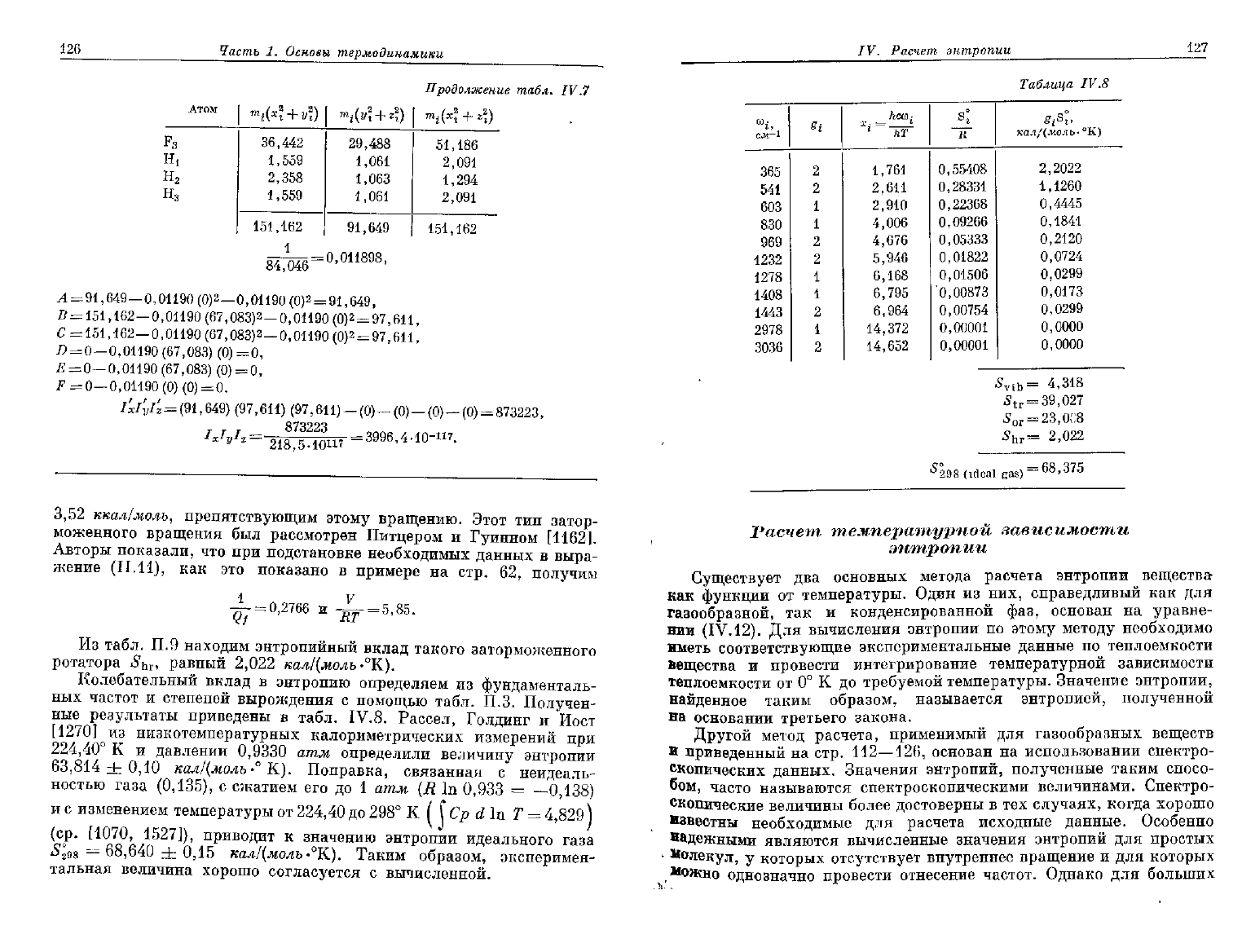
126
Часть
1.
Основы
термодинамики
IV. Расчет энтропии
127
Продолжение
табл.
IV.7
Атом
Рз
Hi
н
2
Нз
т.(х
36,
1,
2,
1,
151,
\
+
у\)
442
559
358
559
162
29,
1,
1,
1,
91,
!
+
*?)
488
061
063
061
649
51,186
2,091
1,294
2,091
151,162
1
84,046
=
0,011898,
Л
=
91,649—0,01190(0)2—0,01190(0)2
=
91,649,
5
=
151,162—0,01190(67,083)2—0,01190(0)2
=
97,611,
С=151,162—0,01190(67,083)2—0,01190(0)2
=
97,611,
D =
0—0,01190(67,083)
(0)=0,
£
=
0—0,01190(67,083)
(0)
=
0,
F
=0—0,01190 (0)(0)=0.
1'
х
1у1г
=
(Ш,6Щ
(97,611)
(97,611)
—
(0)
—
(0)
—
(0)-
873223
)
=
873223,
218,5-10"'
=
3996,4-10-1".
3,52
ккал/молъ,
препятствующим этому вращению. Этот тип затор-
моженного вращения был рассмотрен Питцером
и
Гуинном [1162].
Авторы
показали, что при подстановке необходимых данных
в
выра-
жение (11.11),
как это
показано
в
примере
на
стр.
62,
получим
Из
табл. П.9 находим энтропийный вклад такого заторможенного
ротатора
S
hv
,
равный
2,022
кал/(молъ-°К).
Колебательный вклад
в
энтропию определяем
из
фундаменталь-
ных частот
и
степеней вырождения
с
помощью табл. П.З. Получен-
ные результаты приведены
в
табл. IV.8. Рассел, Голдинг
и
Иост
[1270]
из
низкотемпературных калориметрических измерений
прл
224,40°
К и
давлении
0,9330
атм определили величину энтропии
63,814
+
0,10
кал/(моль-°
К). Поправка, связанная
с
неидеаль-
ностью газа (0,135),
с
сжатием его
до 1
атм
(R
In
0,933
=
—0,138)
и
с изменением температуры от
224,40
до
298°
К ( I
Ср
d
In T
=
4,829)
(ср.
[1070,
1527]), приводит
к
значению энтропии идеального газа
^298
=
68,640
±
0,15
кал/(моль'°К).
Таким образом, эксперимен-
тальная величина хорошо согласуется
с
вычисленной.
Таблица
IV.8
CM
L
1
365
541
603
830
969
1232
1278
1408
1443
2978
3036
0.
&
l
2
2
1
1
2
2
1
1
2
1
2
Леш.
х.
= г
'
hT
1,761
2,611
2,910
4,006
4,676
5,946
6,168
6,795
6,964
14,372
14,652
В'г
R
0,55408
0,28331
0,22368
0,09266
0,05333
0,01822
0,01506
0,00873
0,00754
0,00001
0,00001
erf.
кал/(моль-°К)
2,2022
1,1260
0,4445
0,1841
0,2120
0,0724
0,0299
0,0173
0,0299
0,0000
0,0000
S
vib
=
4,318
5
hr
=
2,022
298(1с1еа1
Расчет температурной зависимости
энтропии
Существует
два
основных метода расчета энтропии вещества
как
функции
от
температуры. Один
из
них, справедливый как для
газообразной,
так и
конденсированной фаз, основан
на
уравне-
нии
(IV. 12). Для вычисления энтропии по этому
методу
необходимо
иметь соответствующие экспериментальные данные
по
теплоемкости
вещества
и
провести интегрирование температурной зависимости
теплоемкости от
0° К до
требуемой температуры. Значение энтропии,
найденное таким образом, называется энтропией, полученной
на
основании третьего закона.
Другой метод расчета, применимый
для
газообразных веществ
и
приведенный на стр.
112—126,
основан
на
использовании спектро-
скопических данных. Значения энтропии, полученные таким спосо-
бом, часто называются спектроскопическими величинами. Спектро-
скопические величины более достоверны
в
тех
случаях,
когда хорошо
известны необходимые
для
расчета исходные данные. Особенно
надежными являются вычисленные значения энтропии для простых
•
**°лекул,
у
которых
отсутствует
внутреннее вращение
и
для которых
Можно однозначно провести отнесение частот. Однако для больших

128
Часть
1.
Основы
термодинамики
IV.
Расчет
энтропии
129
молекул, а также для молекул сложного строения надежность спект-
роскопического метода несколько понижается за счет неопределен-
ности
в исходных величинах и их толковании. Такими факторами
являются:
1) отнесение частот [неполное или неоднозначное за счет сложно-
сти и (или) неточностей в эксперименте или расшифровке спектров);
2) детальная, точная конфигурация молекулы (т. е. наличие
скошенных,
цис- и
транс-язомеров,
а также правовращающей, лево-
вращающей, рацематной и мезоформ для оптически активных
веществ);
3) межатомные расстояния и углы;
4) энергии и формы потенциальных барьеров для внутреннего
вращения
(неизвестные или неточно определенные).
Если
известно значение энтропии, полученное на основании
третьего закона или из спектроскопических данных при какой-либо
одной
температуре, то величину энтропии при любой другой тем-
пературе нетрудно рассчитать по уравнению (IV.4). Как уже отмеча-
лось выше, за исключением некоторых особых случаев, в данной
книге
в качестве стандартного состояния органических веществ
выбрано состояние идеального газа. Подставляя уравнения теплоем-
кости
для газообразных веществ
(11.13)
и
(11.15)
в уравнение (IV.4),
получим
iS
m = к
(IV.25)
Тг
•и-
b"T+c"T-2
\ dT =
(IV.26)
3
где константы а, Ъ, с, а", Ъ" и с" имеют те же значения, что и в урав-
нениях
теплоемкости.
Так,
например, теплоемкость жидкого этанола описывается урав-
нением
Ср= — 10,83 +
0,118Г
+
0,000025Г2
кал/(молъ-°К).
Согласно измерениям Келли [733], энтропия жидкого этанола
при
300°
К равна
38,56
кал/(молъ
.°К). Подставляя эти данные в урав-
нение
(IV.24), при
350°К
получим
5
350
=
38,56
—10,83
In
|^4-0,118
(350—300)+ 1,25 X
X 10-5 [(350)2 — (300)2]=43,20
кал/(молъ-°К).
Рассчитанное на стр. 67 для такого же интервала температур изме-
нение
энтальпии жидкого этанола равно 1508 кал/моль. Для неболь-
• ших интервалов температур по сравнению с Т (средней темпера-
турой интервала) AS да АН/Т или
S
350
—
S
300
=
1508/325
=
=
4,64 кал/(моль-"К.). Как видно, такой расчет служит быстрой
и
полезной проверкой рассмотренного выше метода.
Согласно Барроу [76], энтропия газообразного этанола при
I
500°
К равна
77,40
кал/(моль *°К), а его теплоемкость может быть
| представлена уравнением
Ср
=
51,84—2,023-10*r-i
+
2,843-10«r-2
кал/(моль-°К).
Используя выражение (IV.25), находим для
600°
К:
^+2,023.104[(600)i —(500)-!] —
—1,421-10»
[(600)-2 — (500)-2] = 81,84
кал/(молъ-°К).
Определенное Барроу уравнение теплоемкости приводит в том же
интервале температур к изменению энтальпии газообразного этанола,
0,078
I
0,074 -
Рис. IV.3. Интегри-
рование
энтропии по
Правилу
парабол
Симпсона.
0,070 -
0,066
600
Т°К
равному
2444
кал/молъ.
Эта величина позволяет провести проверку
полученных величин: б^оо —
S
500
~
2444/550
= 4,44 кал/(моль-"К).
При
расчете на скоростных электронно-вычислительных маши-
Вах
удобно представлять значения теплоемкостей в форме таблиц
Для одинаковых интервалов температур (см. гл. II, стр. 67). Такие
значения
можно получить из сглаженных кривых, проходящих через
экспериментальные точки, или определить аналитически методом
•^Ятерполяции для значений температур, отличающихся
друг
от дру-
w
На
одинаковые интервалы. Правило парабол Симпсона позволяет
ов
ести быстрое интегрирование набора таких значений. Как видно
Рис.
IV.3, отношение каждого значения теплоемкости к соответ-

130
Часть
7.
Основы
термодинамики
ствующему ему значению температуры
дает
набор величин
S
o
, £
ь
S
2
,
. . .
при температурах
Т
о
, Т
г
, Т
2
. . .,
отделенных
друг
от
друга
одинаковыми
интервалами
AT.
Интегрирование на этом участке лег-
ко
осуществить путем построения параболических дуг, одновременно
проходящих через три точки. Так, для температур
Т
о
, Т
1
и Т
2
изме-
нение
энтропии
в
области
двух
интервалов
AT
будет
равно
S
T2
- S
To
= AT (S
o
+
AS,
+
S
t
)/3.
В
случае
небольших интервалов температур отклонение от линей-
ной
зависимости может быть достаточно мало. Это позволяет про-
вести прямое вычисление величины
AS
для данного интервала темпе-
ратур
с
помощью соотношения
О
fyr_
——
i_> m_ = "
н
Тг
—н
Tl
Например,
таким образом можно рассчитать величину
S
Tl
— S
To
и,
вычтя
ее из
величины
S
T2
— S
To
,
получить значение
S
T2
— S
Tl
и
т. д.
С
другой
стороны, для этой цели можно использовать интер-
валы температур
AT
12.
Энтропия
газообразного
w-бутана
при
298,15°
К
равна
74,12
кал/(моль
-"К).
Изменение энтальпии к-бутана
в
интервале
температур
от
298,15
до
300°
К
было рассчитано ранее
и
равно
43
кал/моль;
таким образом,
43/299,07
=
0,14
кал/(молъ°
К). Изме-
нение
энтальпии
в
интервале
300—400°
К
равно
2650
кал/моль,
откуда
2650/350
=
7,57
кал/(моль-°К).
Используя значения теплоем-
костей,
приведенные
в
табл.
IV.9, и
применяя правило парабол
Симпсона,
в
интервале
300—500°
К
находим
[0.07800+4
о-^зоо=ЮО
[
Таблица
IV .9
Теплоемкость
и
энтропия
газообразного
и-бутана
а
)
Т,
°К
298,15
300
400
500
600
Ср
23,29
23,40
29,60
35,34
40,30
0
0
0
0
0
а
)
В кал/(моль-"К).
б)
По
Ср/Т
07811
07800
07400
07068
06717
вычислено
74
74
81
89
9>
цанным
Персона
и
Пиментела
,12
,26
,83
,08
,96
[1140].
S
литератур-
ные
данны*
")
74
74
81
89
95
,12
,27
,66
,10
,97
IV.
Расчет
энтропии
131
образом, (S
M0
—
S
300
)
— (S
i00
—
S
m
) =
(S
500
—
S
m
) =
14,82 —
•
7,57
=
7,25
кал/(молъ-°К).
Следующий двойной интервал равен
"0,07400
+ 4 (0,07068)+
0,06717-]
_
о
— ^400
=
Ю0
-
3
J
=
14,129
кал/(моль-°К)
— ^4Оо)
—
(^500
—
^4Оо)
—
("600
—
"5Оо)
—
14,13
—
7,25
—
6,88
кал/(молъ-°К).
Значения энтропии, вычисленные таким спо-
рбом, приведены
в
четвертом столбце табл. IV.9.
В
последнем столб-
этой
таблицы
для
сравнения представлены значения энтропии,
олученные Персоной
и
Пидгентелом [1140].
Изменение энтропии химической реакции
Переход простого вещества из состояния
А в
состояние
В
сопро-
ождается изменением энтропии
S
B
— SA =
Л£. Аналогичная кар-
юа имеет место для химической реакции. С помощью обозначений,
ринятых
в
гл. III, изменение энтропии
в
общем виде можно пред-
1авить следующим образом:
ASr=y
i
v
l
S
l
.
(IV.27)
При
рассмотрении процессов
и
реакций необходимо учитывать
остояние
веществ,
участвующих
в
превращениях. Для элементар-
х веществ
в
качестве стандартного состояния выбирается конден-
ированное
состояние вплоть
до
таких температур,
при
которых
пара элемента достигает
1
атм. При более высоких темпе-
ратурах
в
качестве стандартного выбирают состояние идеального
*аза. Практические величины энтропии элементов
в
стандартном
Состоянии
приведены
в
гл. VIII
и
XIV. Как уже отмечалось
в
гл.
I,
В настоящей книге,
за
исключением специальных случаев,
в
качестве
Стандартного
состояния
органических соединений при
всех
темпера-
турах
выбрано состояние идеального газа при давлении
1 атм
(обозначаемое знаком градуса).
Другие
состояния, которые
могут
Представлять интерес, нетрудно связать со стандартным состоянием.
В табл. IV. 10 приведены практические значения энтропии, полу-
ченные путем расчета
на
основании спектроскопических данных,
* также из измерений теплоемкостей
в
интервале температур
от
абсо-
лютного нуля
до
298,15°
К
(температура, удобная для сравнения).
Иа
этих данных нетрудно вычислить изменение энтропии гипотети-
ческой реакции:
С
{graphite)
+2H
2
(£)
=
CH
4
(rf,
A£r!
M
=
AS/£
e8
CH
4
(g)
=
44,50
— [1,36
+
2(31,21)]
=
—19,28
кал/(молъ.°К).
В
этом примере надстрочный индекс
«градус»
указывает
на то,
каждое вещество находится
в
своем определенном стандартном
""** Символ
f
обозначает,
что
рассматриваемая реакция
реакцией
образования
из
элементов
при
опреде-
9*

132
Часть 1.
Основы
термодинамики
IV. Расчет энтропии
133
Таблица
IV.10
Практические
значения
молярной
энтропии
при
298,15°
К
й
)
Вещество
Графит
Водород
Метан
Кислород
Двуокись
углерода
Зода
Состоя-
ние
(»)
(б)
(*)
(е)
(8)
(S)
S
298
1,36
31,21
44,50
49,00
51,07
45,11
а
)
В пал/(моль °К); см главу
VIII.
ленной
температуре. Следует отметить,
что
энтропия системы
будет
уменьшаться, если система переходит
из
состояния, характеризую-
щегося меньшей степенью упорядоченности
(в
приведенном
при-
мере
—
реагирующие вещества),
в
более упорядоченное состояние
(продукты).
В качестве примера
других
реакций, изменение энтропии кото-
рых нетрудно рассчитать
из
данных табл.
IV.
10, можно привести
следующие:
С
(gra
p
hite) + O
2
(g) = CO
2
(g),
8
= 51,07 —[1,36 + 49,00] = 0,69 кал/(моль.°К);
8
= 45,11 — [31,21 + 24,50]= —10,60 кал/(молъ-°К);
5,11) —[44,50 +
2(49,00)]=
—1,23 кал/(молъ.°К).
Следует отметить,
что
выигрыш
в
энтропии упорядоченной твер
дой фазы (графита), превращающейся
в
результате реакции сгорания
в
кислороде
в
газообразное соединение
СО
2
, не
может быть скомпен-
сирован
за
счет уменьшения числа молей кислорода
в
такой
же сте-
пени,
как это
имеет место
в
случае реакции образования метана
из
элементов.
1з этого выражения следует,
что для
средней температуры
Т в
сравни-
ельно небольшом интервале температур
1
/J
ка
л1{молъ.°Щ.
(IV.28)
Гхош,
Гуха
и Рой
[4=72] изучили равновесие реакции дегидрирова-
этилбензола
с
образованием стирола
С
6
Н
5
СН
2
СН
3
(£)
=
C
6
H
5
CHCH
2
(g)
+ H
2
(g)
получили следующие значения констант равновесия:
Кр
ш
=
:4,95-ю-
3
и
Кр
133
= 1,20-10"
2
(давление
в
атмосферах). Подстановка
(
3»тих
значений
в
выражение
(IV.28)
дает
=
32,45 кал/(моль-°К).
Используя данные
для
участников рассматриваемой реакции,
приведенные
в
таблицах термических свойств, нетрудно рассчи-
тать изменение стандартной энтропии этой
же
реакции
при 700
и
800° К.
Полученные величины равны соответственно
30,87
и
81,07
кал/(молъ-°К).
Учитывая экспериментальные трудности измере-
ния
констант равновесия
при
исследованных температурах, такое
Совпадение
следует
считать вполне удовлетворительным.
Расчет изменения энтропии реакции
из
констант
равновесия
при
двух
температурах
Связь
между константой равновесия
и
изменением энтропии
реакции,
протекающей
при
постоянном давлении, нетрудно опреде-
лить, дифференцируя соотношение
AG° = —RT In Kp:
dlnKp

Глава
V
ЭНЕРГИЯ
ГИББСА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
V.
Энергия
Гиббса
и
химическое
равновесие
135
Энергия
Гиббса
Протекание
«активных», самопроизвольных реакций, например
реакции
сгорания углеводородов, сопровождается выделением
тепла. Поэтому вполне естественно, что такие исследователи, как
Бертло [121] и Томсен [1495], пришли к выводу, что количество выде-
ляющегося в процессе реакции тепла является мерой ее «движущей
силы». Путем термохимических измерений и применения закон?
Гесса эти ученые пытались предсказать возможность протекания
любой предполагаемой реакции, не проводя никакого лабораторного
эксперимента.
Однако позднее стало очевидным, что как энтропия.
так
и энтальпия являются составными частями движущей силы
реакции.
Новая функция, первоначально носившая название сво-
бодной энергии, а в последнее время переименованная
в
энергию Гиббса, была предложена И. В. Гиббсом [479].
Физико-химический
смысл новой функции в дальнейшем был рас-
крыт в работах Г. Льюиса и М. Ренделла [860]. Эта функция, обо-
значаемая буквой G, математически определяется соотношением
G = H—TS. (V.I)
Поскольку
функции Н и S относятся к экстенсивным свойствам
системы, функция G также является однозначным экстенсивным свой-
ством системы, а ее значение не зависит от пути перехода системы
из
начального состояния 1 в конечное состояние 2. Для изотермиче-
ского процесса или реакции
Go — G\ =^
AGr^=
AHr—ТASr,
у » •"/
Это выражение является одной из форм уравнения Гиббса -
Гельмгольца, а величина AGr представляет собой изменение
энергии
Гиббса или свободную энергию реак-
ции.
Таким же образом можно определить аналогичную фунК'
цию
А, выражая ее через энергию и энтропию
A=E-TS.
(V.3)
Функция
А носит название энергии Гельмгольца или функ-
ции
работы. Поскольку условия постоянства давления в ЗВ'
чительно большей степени используются на практике, функция
оказывается более полезной. Часто эту функцию просто называют
энергией
Гиббса.
Следует
отметить, что в ранних работах америкаН-
I
ских и советских исследователей функцию G обычно обозначали
\ буквой F; в
других
странах
букву
G обычно применяли для обо-
значения
энергии Гиббса (см. обсуждение в гл. VIII).
Функция
AGr является истинной мерой движущей силы реакции
]или
процесса. В принципе любая самопроизвольная реакция должна
[сопровождаться уменьшением энергии Гиббса системы. Если энергия
| Гиббса системы минимальна, то в системе не происходит никаких
| дальнейших изменений.
Абсолютные значения энергии Гиббса системы определить невоз-
[можно,
поскольку в энергию Гиббса
входит
величина энтальпии.
[Величину энергии Гиббса можно лишь выразить в виде разности
[энергий
Гиббса
двух
различных состояний, одно из которых принято
[за стандартное. В гл. VIII приведены термодинамические величины
для стандартного состояния каждого из элементов, входящих в орга-
[нические
соединения, а также данные для некоторых важных неор-
ганических соединений. Аналогичные величины для стандартных
[состояний
органических веществ представлены в виде таблиц в после,
[дующих
главах.
Эти таблицы содержат величины энергии Гиббса,
[отвечающие образованию соединения в его стандартном состоянии
1из элементов, находящихся в своих стандартных состояниях. Для
[соединений
в качестве стандартного желательно выбирать такое
[состояние,
которое отвечало бы наибольшему
удобству
при исполь-
зовании,
поэтому для большинства приведенных соединений в каче-
[стве стандартного используется состояние гипотетического идеаль-
[ного газа при давлении 1 атм. Для некоторых соединений, обладаю-
щих очень низким давлением пара, термодинамические данные
[указаны для твердого или жидкого состояния. В принципе стандарт-
Гное состояние идеального газа можно использовать непосредственно
|в расчетах при малых давлениях газовой фазы; при расчете термоди-
I
намических свойств веществ при более высоких давлениях нетрудно
[внести соответствующие поправки к свойствам вещества в состоянии
[идеального газа, обусловленные его неидеальным поведением при
(высоком
давлении. Энергия Гиббса, связанная с образованием соеди-
1нения
в стандартном состоянии идеального газа, чистой жидкости
шли
в твердом состоянии при давлении 1 атм из элементов, взятых
Ев
их стандартных состояниях, называется стандартной
(энергией
образования Гиббсаи обозначается над-
[строчным индексом
«градус»:
AGf.
В качестве примера рассмотрим термодинамические параметры
|реакции
) = С
2
Н
4
(?) + HCl(g),
|вычисленные для температуры
298°
К на основании термодинами-
1еских величин, приведенных в последних
главах
книги:
АНг°—17,14
ккал/молъ,
Д5г°=31,15
кал/(молъ.°К),
AGr°
=7,86
ккал/молъ.

136
Часть
1.
Основы
термодинамики
Следовательно,
в
процессе записанной таким образом реакции
про-
исходит увеличение энтальпии
и
энергии Гиббса. Если использовать
в качестве критерия направления процесса
и
равновесия
любую
из
этих функций,
то
нетрудно видеть,
что
рассматриваемая реакция
при
данных условиях невозможна. Другими словами, хлористый
этил
при
298°
К
устойчив
по
отношению
к
распаду
на
этилен
и
хло-
ристый водород. Рассмотрим теперь термодинамические параметры
этой реакции
при
температуре
1000°
К:
Д#г°
=
17,07 ккал/моль,
Д5т-°=31,50
кал/(молъ-°К),
AGr°=—14,42
ккал/молъ.
Как
видно, величины изменений энтропии
и
энтальпии реакции изме-
нились
незначительно,
тем не
менее
при
1000°
К
реакция сопрово-
ждается значительным уменьшением энергии Гиббса
за
счет возрос-
шего вклада члена TASr.
С
практической точки зрения
это
означает,
что хлористый этил при высоких температурах
будет
самопроизволь-
но
диссоциировать
на
этилен
и
хлористый водород. Таким образом,
приведенный пример подтверждает,
что
в
качестве критерия
движу-
щей силы реакции
AGr
превосходит
АНг. Для
многих реакций значе-
ние
ASr
невелико, поэтому величина
АНг
будет
для
этих реакций
близка
к
AGr. Если рассматриваемая реакция сопровождается умень-
шением энтропии,
то в
этом
случае
изменение энергии Гиббса
будет
меньше изменения энтальпии. Например,
для
реакции
С
(graphite)+
2H
2
(g)
=
CH
i
(g)
V.
Энергия
Гиббса
и
химическое
равновесие
137
при
298°
К AHf =
-17,89
ккал/молъ,
ASf =
-19,29
кал/(моль°
•
К)
и
AGf =
—12,14
ккал/молъ.
Если изменение энтропии мало,
то
AGr
~
АНг.
Например,
для
реакции
С
[graphite)
+
O
2
(g)
=
CO
2
(g)
AHf=
—94,05
ккал/молъ,
ASf =
0,68
кал/(молъ-°К),
AGf
--=
=
—94,27
ккал/молъ.
Если
в
процессе реакции происходит увеличе-
ние
энтропии,
то
энергия Гиббса уменьшается
в
большей степени,
чем энтальпия реакции.
Например,
для
реакции
С
(graphite)
+
1
/
2
O
2
fe)
=
CO(g)
AHf
=
—26,42
ккал/молъ,
ASf =
21,42
кал/(моль-°К)
и AGf =
=
—32,80
ккал/молъ.
Таким образом, метан менее устойчив,
а
окись
углерода
более устойчива,
чем это
следует
из
величин энтальпий
соответствующих реакций.
Как
указывалось ранее, протекание химических реакций зави-
сит, помимо энергии Гиббса,
от
ряда
других
факторов. Огромное
значение имеет кинетика процессов.
Так,
например, высшие члены
ряда алифатических углеводородов характеризуются положитель-
ными
значениями энергии образования Гиббса (см. таблицы
в
гл.
IX)
с термодинамической точки зрения должны самопроизвольно
рас-
1адаться
на
углерод
и
низшие соединения, такие,
как
метан. Однако
1ри
298°
К
скорость подобных реакций пренебрежимо мала,
и
такие
вмеси углеводородов,
как
керосин
и
смазочные масла, можно
хра-
1ть длительное время. Однако
при
пропускании этих углеводоро-
цов
над
нагретой кирпичной кладкой скорость реакций распада
Значительно возрастает
и
образуются большие количества метана,
{ля протекания органических реакций
с
достаточно высокими
для
фактических целей скоростями часто необходимо использовать ката-
шзаторы
и
повышенные температуры.
Начинающие исследователи часто стремятся слишком упростить
критерий
AGr°
и
рассматривают реакции, характеризующиеся поло-
штельными изменениями стандартной энергии Гиббса,
как
невыгод-
ше
с
практической точки зрения. Такой упрощенный
подход
едва
|ли является правильным, поскольку
при
оценке возможности
про-
екания
реакции необходимо учитывать
как
величину
AGr°,
так
1и
тип
самой реакции. Некоторые реакции, характеризующиеся
•небольшими положительными значениями
AGr°,
могут
давать
зна-
чительный
выход
желаемого продукта
при
вполне осуществимых
{экспериментальных условиях,
в то
время
как
реакции
с
небольшими
{отрицательными значениями
AGr
0
протекают
с
практически низкими
{выходами.
Количественный расчет равновесного состава реагирую-
щей системы
на
основании данных энергий Гиббса обсуждается
в
сле-
|дующем разделе этой главы. Здесь
следует
лишь отметить,
что при
Iкачественном анализе практической целесообразности осуществления
гтой
или
иной реакции предпочтение
следует
отдавать реакциям
[с отрицательными изменениями стандартной энергии Гиббса; реак-
\ ции, характеризующиеся небольшими положительными
или
близ-
|киыи
к
нулю значениями
AGr°,
могут
оказаться практически выгод-
[
ными
и
поэтому
требуют
дальнейшего исследования. Реакции
с
поло-
\ жительным значением, превышающим
10
ккал/молъ,
возможны
I
только
в
особых условиях.
Энергия
Гиббса и равновесный состав
В главе
I
дано определение равновесной системы
как
такой
системы,
в
которой
не
происходит заметных изменений.
Там же рас-
смотрены
два
типа равновесия: устойчивое равновесие, при котором
система вообще
не
претерпевает изменений,
и
замороженное,
или
метастабильное, равновесие,
при
котором система изменяет свое
состояние
с
очень малой скоростью. Устойчивое равновесие
—
это такое состояние,
при
котором энергия Гиббса системы минималь-
на
по
сравнению
со
всеми возможными состояниями системы
при
условии постоянства давления
и
температуры. Неустойчивым равно-
весием называется такое состояние,
при
котором энергия Гиббса
системы минимальна относительно некоторых,
но не
всех

/38
Часть
].
Основы
термодинамики
возможных состояний системы. Примером устойчивого равновесия
является газообразное состояние двуокиси
углерода
при температу-
ре около
300°
К, поскольку не
существует
других
химических частиц,
состоящих из
углерода
и кислорода, которые обладали бы еще мень-
шими
значениями энергии Гиббса. В качестве примера метастабиль-
ного равновесия можно привести смесь окиси
углерода
и кислорода
при
комнатной температуре. Эта система обладает более низким зна-
чением энергии Гиббса, чем свободный
углерод
и кислород, и, таким
образом, является равновесной по сравнению со смесью этих элемен-
тов. Однако, поскольку реакция образования двуокиси
углерода
из
СО и О
2
сопровождается уменьшением энергии Гиббса, в системе
должно происходить дальнейшее самопроизвольное превращение
окиси
углерода
в двуокись. Однако при комнатной температуре эта
реакция
протекает настолько медленно, что с практической точки
зрения
можно считать, что реакция не идет, а сама система находится
в
состоянии покоя. Изучить метастабильное равновесие эксперимен-
тально не всегда возможно, поскольку реакция может не остановиться
на
промежуточной стадии. В этом
случае
кинетические факторы
являются определяющими.
Для количественного использования величин энергии Гиббса
в
химических проблемах полезно вывести выражение для обратимых
процессов,
содержащее только член PV и связывающее первый и вто-
рой
законы термодинамики в дифференциальной форме, т. е. dE =
=
8Q — Р dV и dS = 8Q/T. Путем подстановки второго соотноше-
ния
в первое получаем
dE
=
TdS—PdV.
(V.4)
Поскольку
Н = Е + PV (см. гл. II), dH = dE + d(PV). Далее,
добавляя член d(PV) — d(TS) к правой и левой частям урав-
нения
(V.4),
получим dE + d(PV) — d(TS) = Т dS - Р dV +
+
d(PV) —
d(TS).
Сравнивая выражение (V.I) в дифференциаль-
ной
форме, т. е. dG = dH —
d(TS),
с полученным выражением, нахо-
дим, что его левая часть равна dG,
тогда
V.
Энергия
Гиббса
и
химическое
равновесие
139
dG= —
SdT+VdP.
При
постоянной температуре (dT = 0)
dG=VdP.
Для идеального газа V = RT/P, откуда
(V.5)
(V.6)
Интегрируя это выражение в пределах от P
t
до Р, получим
G(
P
) = RT In-^-
Если
произвольно принять давление Р
4
равным единице (выразив
его, как обычно, в атмосферах), это выражение примет вид:
(V.7)
Полученное выражение связывает энергию Гиббса идеального газа
[G (р)] при давлении Р с энергией Гиббса идеального газа в стандарт-
ном
состоянии (G°).
Выражение для свободной энергии реальных газов можно полу-
чить аналогичным образом, используя соответствующее уравнение
состояния.
Однако все математические выкладки значительно упро-
щаются, если использовать новую формальную функцию, впервые
предложенную Льюисом и названную им
летучестью
(/). Эта функция
позволяет сохранить простую форму записи выражения (V.7)
даже
для реальных, газов при условии, если выбрано соответствующее
состояние с летучестью, равной единице (/ = 1 атм). Таким образом,
G(f) = RTlnf +
G°.
(V.8)
Как
видно из приведенных выражений, для идеальных газов
лету-
честь и давление равны. Для реальных газов
летучесть
можно рассчи-
тать с помощью методов, описанных в следующем разделе этой главы.
В некоторых
случаях,
особенно при рассмотрении равновесий
с участием конденсированных фаз, выгоднее использовать
другое
стандартное состояние, отличное от стандартного состояния веще-
ства при давлении, равном единице. Для этих целей Льюисом [859]
была предложена
другая
функция, названная активностью
(а) и определяемая как а = ///°. Отсюда
следует,
что
(V.9)
В этом
случае
стандартному состоянию вещества
будет
соответство-
вать такое состояние, при котором его активность равна единице
(а = 1), а
летучесть
/
будет
равна стандартной летучести /°, причем
последняя
величина выбирается произвольно и может быть не равна
единице.
Записав
еще раз химическую реакцию в общем виде,
представим выражение для энергии Гиббса реакции как
Для реакции с участием только идеальных газов (или в первом
приближении
реальных газов при низких давлениях) значение G
t
каждого компонента описывается выражением
(V.7).
Отсюда

140
Часть
1.
Основы
термодинамики
V.
Энергия
Гиббса
и
химическое
равновесие
141
В этом уравнении, часто называемом изотермой химической реакции,
функция
П {PiY
1
представляет собой отношение произведения давле-
ний
газообразных продуктов реакции к произведению давлений газо-
образных исходных веществ, взятых в степенях, соответствующих
стехиометрическим коэффициентам, и в связи с этим напоминает
выражение константы равновесия, указанной в атмосферах. Однако
только в состоянии равновесия эта функция равна константе равно-
весия.
В состоянии равновесия AGr = 0 и
Д<7г°
= — RT In [П (Л) v,]
e
q = — RT In К p. (V. 11)
Уравнение (V. И) позволяет вычислить константы равновесия инте-
ресующих нас реакций, поскольку изменения их стандартной
энер-
гии
Гиббса легко определить по таблицам, приведенным в последую-
щих
главах.
Из константы равновесия нетрудно рассчитать парциаль-
ные
давления исходных веществ и продуктов реакции в состоянии
равновесия,
если известны начальные давления реагирующих
веществ и общее давление системы.
Часто удобнее выражать
выход
продуктов реакции не в пар-
циальных давлениях, а в молях. В смеси идеальных газов пар-
циальное давление компонента Pi равно его мольной доле Ni, умно-
женной
на общее давление:
Pi=N
t
P
tot
.
(V.12)
В свою очередь мольная доля равна числу молей каждого компонен-
та n
t
, деленному на общее число молей
ra
t
ot»
т. е. N
t
= n
t
/n
iot
.
В таком
случае
константу равновесия Кр можно записать следующим
образом:
(V.13)
V
re
tot
где Кп представляет собой константу равновесия, выраженную через
число молей, a Av равно изменению числа молей газа в процессе
реакции,
т. е. Av = Hv
t
.
Приведем несколько примеров, иллюстрирующих применение
выражений
(V.11)
и
(V.13).
Рассмотрим реакцию диссоциации
Согласно данным таблиц, приведенных в последних
главах,
изменение
стандартной энергии Гиббса этой реакции при
400°
К
равно AGr°= —23,00+17,69 — ( — 9,96) = 4,64 ккал. Отсюда
Кр=
ю-
д
'
3
'-°/(4,5758Г)
=0i
00292
=-
Константу равновесия, выраженную в молях при общем давлении
1
атм, можно записать в виде
Ptot\
Av
^
(*HCl)("c
2
H
4
) / 1 П
«tot
/ (
га
С
2
Н
5
С)) \
K
tot /
IПредполагая,
что в системе, в которой первоначально находился
f 1 моль
С
2
Н
5
С1,
образовалось х молей НС1 и С
2
Н
4
, получим re
H
ci =
=
"с
2
н
4
= я, Яс
2
н
5
с1 = (1 — х), га tot = (1 + х) и
- =
0,00292.
Решая
это уравнение с помощью квадратичной формулы или методом
последовательного приближения, получим х —
0,054.
Таким обра-
зом,
несмотря на положительное значение AGr°, составляющее более
4 ккал, в равновесной газовой фазе содержится значительное коли-
чество этилена и хлористого водорода, так как в
результате
реакции
диссоциирует около 5,4% хлористого этила. Поскольку реакция
сопровождается увеличением объема системы, повышение давления
будет
уменьшать степень диссоциации. Так, при общем давлении,
равном 2 атм,
Присутствие в начале реакции одного или обоих продуктов (хлори-
стого водорода или этилена) также
будет
способствовать уменьше-
нию
степени диссоциации исходного вещества. Пусть первоначально
в
системе присутствует 1 моль хлористого этила и 1 моль хлористого
водорода,
тогда
в системе в состоянии равновесия
будут
находиться
х
молей этилена, (1 + х) молей хлористого водорода, (1 — х) молей
хлористого этила. Общее число молей
будет
равно (2 + х). Полагая,
что общее давление системы равно 1 атм, получим
Таким
образом, диссоциация хлористого этила в значительной
степени подавляется присутствием одного из продуктов реакции
в
первоначальной концентрации, равной концентрации диссоции-
рующего вещества.
И
наконец, рассмотрим влияние инертного газа (например, неона
Или
гелия) на равновесные концентрации газообразных веществ.
Пусть в исходной смеси присутствует 1 моль хлористого этила
И
1 моль инертного газа,
тогда
в состоянии равновесия
будут
нахо-
диться х молей этилена, х молей хлористого водорода и (1 — х)
нолей
хлористого этила. Общее число молей смеси
будет
равно
(2 + х). Если общее давление в системе равно 1 атм, то
Х%
— =
0,00292
и х=
0,076.
)
л
Таким образом, добавление инертного газа при постоянном давле-
**-вии
способствует протеканию реакции, сопровождающейся увеличе-
объема системы. Если реакции
идут
без изменения числа молей
