Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

//.
Теплоемкость и энтальпия
фазовых
переходов
61
Таблица II.6
ац ,
см-1
365
541
603
830
969
1232
1278
1408
1443
2978
3036
Si
2
2
1
1
2
2
1
1
2
1
2
C°/R
1,5590
1,1788
0,5265
0,3074
0,4200
0,1908
0,0825
0,0527
0,0948
0,0001
0,0002
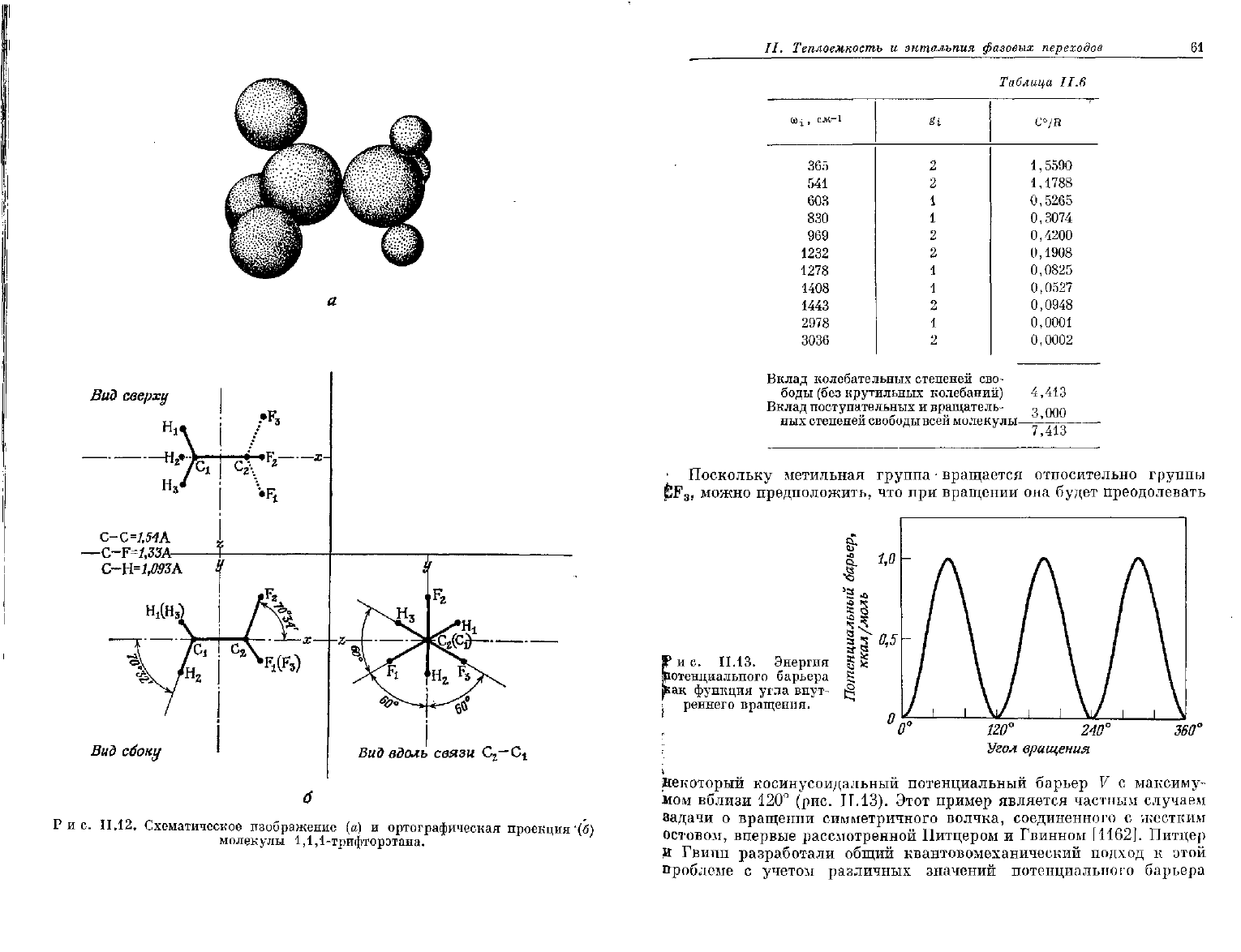
Вид
сверху
С-С=/,54А
—C~F=1,33A-
Вид
сбоку
Вклад колебательных степеней сво-
боды (без крутильных колебаний) 4,413
Вклад поступательных и вращатель-
о
QQQ
ных степеней свободы всей молекулы- °'
7,413
Поскольку метальная группа
•
вращается относительно группы
BF
S
,
можно предположить, что при вращении она
будет
преодолевать
и
с. 11.13. Энергия
Потенциального
барьера
как
функция
угла внут-
реннего
вращения.
0°
Вид
вдоль
связи
C
z
-C
t
120°
240°
Угол
вращения
360°
Рис.
11.12. Схематическое изображение (а) и ортографическая
проекция
"(б)
молекулы 1,1,1-трифторэтана.
аекоторый косинусоидальный потенциальный барьер V с максиму-
1
вблизи 120° (рис. 11.13). Этот пример является частным случаем
[задачи о вращении симметричного волчка, соединенного с жестким
ростовом, впервые рассмотренной Питцером и Гвинном [1162]. Питцер
Гвинн разработали общий квантовомеханический подход к этой
^проблеме с учетом различных значений потенциального барьера

62
Часть
1.
Основы
термодинамики
и
рассчитали вклады такого заторможенного волчка в различные
термодинамические функции. Полученные ими значения термодина-
мических функций приведены в приложении (табл. П.7 — П. 10)
как
функции безразмерных величин (V/RT) и
llQj,
причем
ha
r
_
Qf
где Qf — сумма по состояниям волчка с числом симметрии о>, п —
число максимумов потенциальной энергии, возникающих при одном
полном
обороте вращающейся группы, и 1
Т
— приведенный момент
инерции
двух
вращающихся групп А и В *. Если А и В симметричны
относительно оси вращения, то
= 4
Момент инерции / по определению равен сумме произведений
вращающихся масс mi на квадрат кратчайших расстояний центров
этих масс di от оси вращения:
/=2
т
*№)
2
.
(И.12)
Обычно принято вычислять момент инерции, используя значение
межатомных расстояний в единицах Ангстрема (1 А = 10~
8
см)
и
атомные веса, выраженные в граммах на молекулу. Поскольку
связи
в метильнои группе расположены под тетраэдрическими углами
(109°28')
и длина связи С — Н равна 1,08 А, момент инерции вокру!
оси
внутреннего вращения
будет
равен
ЗХ 1,008 (1,08 sin 71°)2
6,023
х 1023 х
10
г
'
см
•
Бранд
и Ливингстон [161] методом дифракции электронов опре-
делили длину связи С — F и < CCF в молекуле
1,1,1-трифтор-
метана; они оказались равны 1,33 А и
111,5°
соответственно. Исполь-
зуя эти данные, нетрудно вычислить момент инерции группы
—CF
3
:
3
X 19,00 (1,33 sin 68,5°)2 _
7
CF
3
-
6,023X1023X10" -
144
-
у
0Х10 г см.
Отсюда для приведенного момента инерции находим
Подставляя эти значения в выражение (11.11), получим для
300°
К
1
3
2,7935
X 10"
(5,050
X Ю"
40
X 300)
У 2
=
0,2759.
* Подробнее об этом см.: И. Н .
Годнее,
Вычисление термодинамических
функций по молекулярным данным, ГОНТИ, М.,
1956.—
Прим.
перев.
//.
Теплоемкость
и
энтальпия
фазовых
переходов
63
табл. П.7 (см. приложение) величине вклада за счет заторможен-
ного внутреннего вращения, равного 2,10
кал/'(моль
-°К), соответ-
Цетвует значение V/RT, равное 3,76 или 5,91, и величина потенциаль-
ного барьера, равная
2242
или
3523
кал/моль.
Для окончательного
ьвыбора необходимы дополнительные данные, которые были полу-
Гчены Расселом, Голдингом и Иостом
[1270]
из измерений теплоемко-
$т при низких температурах. Найденная ими величина потенциаль-
ного барьера, равная
3450
кал/моль,
хорошо согласуется с одним
Ff из значений, приведенных выше, а также с величинами потенциаль-
|*дого барьера
3290
кал/молъ
(Нилсен, Классен и Смит
[1070]}
|i
3250
кал/моль
(Томпсон и Темпл [1493]).
Щ Питцер
[1156]
рассмотрел более сложный случай расчета термо-
v-динамических свойств несимметричных волчков, связанных с жест-
цим
остовом. Приведенные выше таблицы применимы и здесь. Позднее
Килпатрик
и Питцер [752] предложили методику расчета термодина-
мических функций для общего случая одного или нескольких волч-
ков
любой симметрии. Астон [31] рассмотрел методики расчета для
молекул, обладающих некоторой разностью энергии
между
вращаю-
щимися
изомерами. Скотт и Мак-Каллох
[1317]
предложили таблицы
- таких вкладов в термодинамические функции для ряда изомеров.
В последнее время были разработаны два полезных метода опре-
деления величин барьеров внутреннего вращения. Так, Лин и Свуо-
лен [875] рассмотрели применение микроволновой спектроскопии
к
проблемам внутреннего вращения. Фатели и Миллер [407, 408,
410] разработали теорию и предложили практический метод расчета
барьеров на основании данных инфракрасной спектроскопии.
Вулф
[1632]
предложил метод определения высоты барьеров
в
потенциальных функциях, препятствующих внутреннему враще-
нию
метальных групп, или, другими словами, спектроскопически
неактивных колебательных частот на основании только термических
Данных для твердой фазы. Он показал, что величины потенциальных
барьеров, найденные этим методом, согласуются со значениями, рас-
•3*итанными
из сравнения энтропии в газовой фазе, и
могут
быть
Получены с большей точностью.
Величины потенциальных барьеров для некоторых классов орга-
вических соединений приведены в табл. П.4. Данные для большин-
ства изученных молекул получены методами термохимии и спектро-
скопии.
Как видно, найденные разными методами величины потен-
циальных барьеров, за исключением данных для уксусной кислоты
и
метилнитрата, хорошо согласуются
друг
с другом.
Ряд
других
методов расчета вкладов заторможенного вращения
термодинамические функции был предложен Прайсом [1186],
у
илсоном
[1620]
и Халфордом [563].
'Зценка
теплоемкости газов по эмпирическим и полуэмпириче-
формулам для тех случаев, когда не
хватает
экспериментальных
™,,
описана в гл
. vi.

64
Часть
1.
Основы
термодинамики
Уравнения теплоемкости
Поскольку
данные
по
теплоемкостям являются основой
для
многих термических
и
термохимических расчетов, полезно предста-
вить
их в
наиболее удобном
для
расчетов виде. Температурная зави-
симость теплоемкости сложна, поэтому
в
настоящее время
не
суще-
ствует
«наилучшего»
математического выражения, описывающего
такую зависимость.
В
ограниченном интервале температур теплоем-
кость любой фазы можно представить адекватно
в
виде
Gp = fl + yi + с/^,
^ll»loj
где
а,
Ъ
и с —
эмпирические константы. Эмпирические коэффициенты
параболического уравнения (П.13) легко определить, подставляя
Таблица
II.7
Теплоемкость
м-б^ана
а
)
т,
°к
298,15
300
400
500
600
а
) Данные
нетта, Брауна
[кал/(моль
°К)]
Ср
23,29
23,40
29,60
35,34
40,30
Россини,
Питцера,
Ар-
и
Пиментета
[1248]
в
это
уравнение экспериментальные значения теплоемкостей
при
трех
температурах
{Т
и
Cp
t
) (Т
2
, Ср
2
) и (Т
3
, Ср
3
) и
решая систему
трех
уравнений
с
тремя неизвестными.
В
Таком
случае
имеем
Cpi
, Ср
2
. Срз
Ср
1
—
Ср
2
Подставив
в эти
уравнения приведенные
в
табл.
II.7
экспери-
ментальные значения теплоемкости бутана
при
трех
температурах,
//.
Теплоемкость
и
энтальпия
фазовых
переходов
65
<ШМ
1
=
300,
С
Р1
=
23,40,
Ср
2
=
29,60,
Ср
3
=
35,34.
23,40
100x200"
по /л ОО fift
300-400
X
[-(300+400)
(-0,000023)]
=
0,0781
=
Ь,
(23,40—23,43)+
2,07
=
2,04
= а,
откуда
Ср
==
2,04+0.0781Г—0.000023Г2.
Проверка
(при 400°
К):
Ср
=
а+Ы-1-сГ2
=
2,04
+31,24—3,68
=
29,60
кал/(молъ-°К).
Параболическая зависимость такого типа используется
как при
интерполяции
экспериментальных данных (особенно сглаженных
зна-
чений
теплоемкости
для
ряда последовательных значений темпера-
тур),
так и для
интегрирования.
Обе
операции можно легко выпол-
нить
на
обычной счетной машине. Исходя
из
теоретических соображе-
ний,
Бернштейн
[116]
показал,
что
теплоемкость газообразных
веществ лучше описывается эмпирической зависимостью типа
П ~i I г/т— \ I /ф 9 /ТТ 4 /\
6р
= а
-\-Ь
Т
*
+
с
Т «,
(11.14)
где
о', V и с' —
эмпирические константы, отличающиеся
от
соот-
ветствующих констант
в
выражении (11.13). Наиболее удобным
для
описания
зависимости теплоемкостей
от
температуры
всех
фаз,
особенно
выше
300° К,
оказалось выражение
Ср
= а' +
ЬТ+
С
"Г-2.
(И.15)
Простая
единообразная математическая запись таких уравнений
вначительно упрощает операции сложения, вычитания
и
интегриро-
вания.
Кроме того, некоторые члены этих уравнений удобнее
других
Яри
использовании эмпирических уравнений теплоемкостей
в рас-
чете
энергий Гиббса.
В
настоящей книге
для
удобства
данные
по
теплоемкостям, обработанные методами, описание которых дано
> гл.
VIII, приведены
в
виде таблиц.
Энтальпия
Энтальпия,
обозначаемая буквой
Н и
определяемая
Соотношением
Н = Е + PV,
используется
для
решения многих
теоретических
и
практических задач. Подобно энергии, энталь-
Оня
является термодинамической функцией состояния системы.
Абсолютное значение энтальпии определить нельзя, поскольку
оно
включает абсолютную величину внутренней энергии. Часто припи-
5—831
68
Часть
1.
Основы
термодинамики
Начиная
интегрирование с температуры Т
о
, получим
Л.
Теплоемкость
и
энтальпия
фазовых
переходов
69
it
rp
— id
rp
— -
(11.20)
Обычно часть кривой зависимости теплоемкости газообразного веще-
ства от температуры в некотором интервале температур AT можно
аппроксимировать прямой линией, что позволяет непосредственно
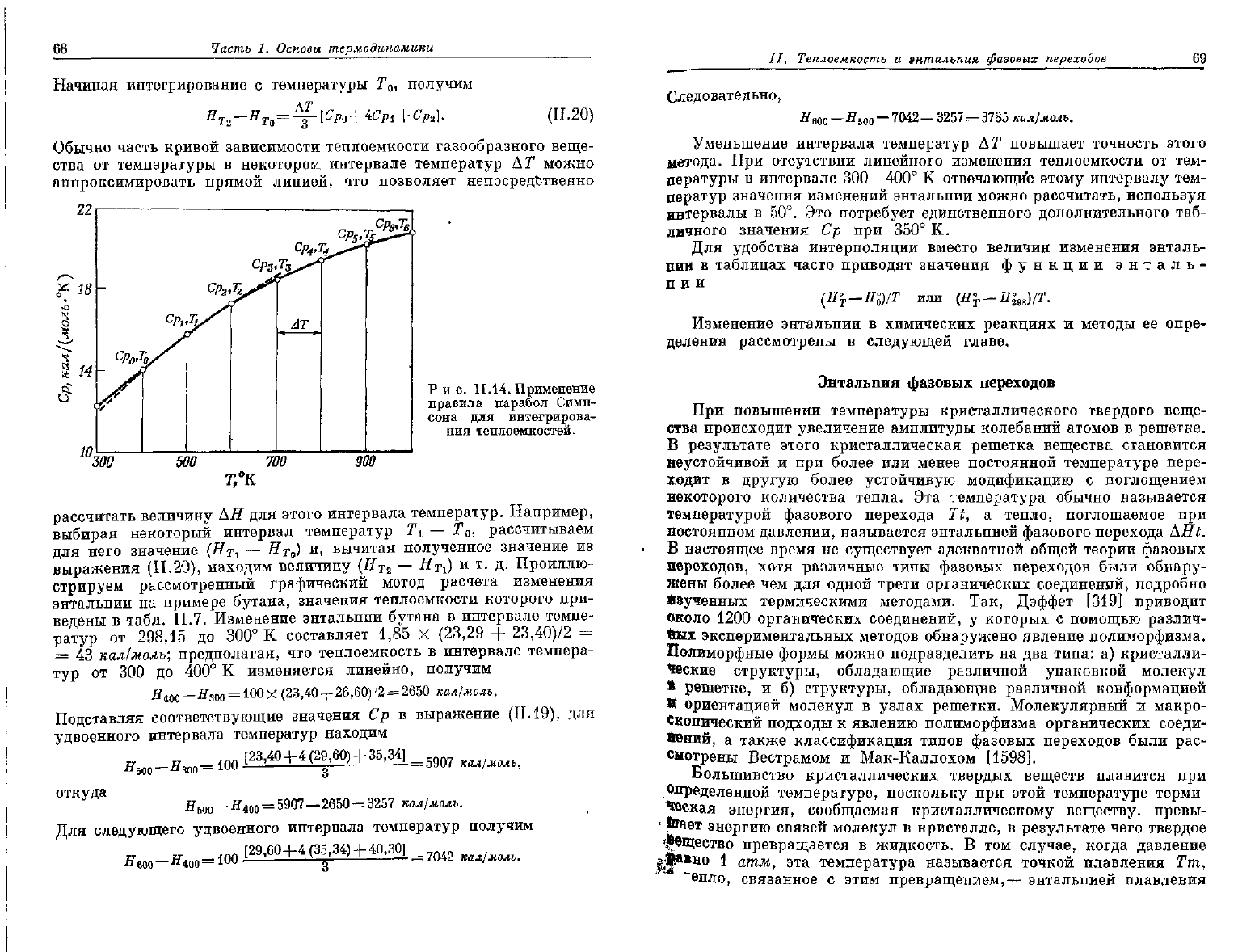
Рис.
11.14.
Применение
правила парабол Симп-
сона
для интегрирова-
ния
теплоемкостей.
рассчитать величину АН для этого интервала температур. Например,
выбирая некоторый интервал температур T
t
— Т
о
, рассчитываем
для него значение (H
Tl
— #г
0
) и, вычитая полученное значение из
выражения (11.20), находим величину (Н
Т2
— H
Tl
) и т. д. Проиллю-
стрируем рассмотренный графический метод расчета изменения
энтальпии
на примере бутана, значения теплоемкости которого при-
ведены в табл. II.7. Изменение энтальпии бутана в интервале темпе-
ратур
от
298,15
до
300°
К составляет 1,85 X
(23,29
+
23,40)/2
=
=
43
кал/молъ;
предполагая, что теплоемкость в интервале темпера-
тур от 300 до
400°
К изменяется линейно, получим
Я
400
—Язоо = ЮОх (23,40+26,60)'2 =
2650
кал/молъ.
Подставляя соответствующие значения Ср в выражение (11.19), для
удвоенного интервала температур находим
=5907
«ал/моль,
откуда
Я
600
—Я
400
=
5907—2650
=
3257
кал/молъ.
Для следующего удвоенного интервала температур получим
и -™ Г29,60+4
(35,34)
+40,30] _
#600
—"400
—
1UU
• 3
Следовательно,
#
в
оо—#500 =
7042—
3257
=
3785
кал/моль.
Уменьшение интервала температур AT повышает точность этого
метода. При отсутствии линейного изменения теплоемкости от тем-
пературы в интервале
300—400°
К отвечающие этому интервалу тем-
ператур значения изменений энтальпии можно рассчитать, используя
интервалы в 50°. Это потребует единственного дополнительного таб-
личного значения Ср при
350°
К.
Для
удобства
интерполяции вместо величин изменения энталь-
пии
в таблицах часто приводят значения функции энталь-
пии
(Н°
т
—Н°
0
)/Т
или
(Н°
Т
-Щ
9В
)/Т.
Изменение
энтальпии в химических реакциях и методы ее опре-
деления рассмотрены в следующей главе.
Энтальпия
фазовых переходов
При
повышении температуры кристаллического твердого веще-
ства происходит увеличение амплитуды колебаний атомов в решетке.
В
результате
этого кристаллическая решетка вещества становится
неустойчивой и при более или менее постоянной температуре пере-
ходит
в
другую
более устойчивую модификацию с поглощением
некоторого количества тепла. Эта температура обычно называется
температурой фазового перехода Tt, а тепло, поглощаемое при
постоянном
давлении, называется энтальпией фазового перехода AHt.
В настоящее время не
существует
адекватной общей теории фазовых
переходов, хотя различные типы фазовых переходов были обнару-
жены более чем для одной трети органических соединений, подробно
изученных термическими методами. Так, Дэффет [319] приводит
Около 1200 органических соединений, у которых с помощью различ-
ЙЫх
экспериментальных методов обнаружено явление полиморфизма.
Полиморфные
формы можно подразделить на два типа: а) кристалли-
ческие структуры, обладающие различной упаковкой молекул
• решетке, и б) структуры, обладающие различной конформацией
И
ориентацией молекул в
узлах
решетки. Молекулярный и макро-
скопический
подходы к явлению полиморфизма органических соеди-
нений,
а также классификация типов фазовых переходов были рас-
смотрены Вестрамом и Мак-Каллохом [1598].
Большинство
кристаллических твердых веществ плавится при
Определенной температуре, поскольку при этой температуре терми-
ческая энергия, сообщаемая кристаллическому веществу, превы-
' Й1ает энергию связей молекул в кристалле, в
результате
чего твердое
•Цфцество
превращается в жидкость. В том случае, когда давление
аво 1
апгм,
эта температура называется точкой плавления Ттп,
тепло, связанное с этим превращением,— энтальпией плавления

70
Часть
1.
Основы
термодинамики
АНт. Если кристаллы плавящегося вещества находятся в равнове-
сии
только с жидкой и газообразной формами чистого вещества при!
давлении его насыщенного пара, то такая равновесная температура
называется тройной точкой Ttp.
Обычно энтальпии ^фазовых переходов и энтальпии плавления
непосредственно определяются методами адиабатной калориметрии
или рассчитываются через энтропию на основании третьего закона
(глава IV), тем не менее полезные результаты часто можно получить
с помощью
других
методов. Например, энтальпия плавления веще-
ства может быть найдена по понижению его температуры плавления
при
добавлении растворенного вещества, смешивающегося только!
с жидкой фазой исследуемого вещества.
Для систем, подчиняющихся законам идеальных бинарных рас-|
творов, энтальпия (АНт) и температуры плавления чистого раство-
рителя (Тт) и раствора (Г) связаны соотношением *
АНт
/_1 1\
\~Тт ¥) '
Давление пара, находящегося в равновесии с жидкостью, уве-
рчивается с ростом температуры. При давлении пара, равном 1 атм,
идкость закипает и полностью переходит в пар с поглощением
"2,30262?
(11.21)
которое легко можно получить из условия равенства химических!
потенциалов вещества в состоянии равновесия. Например, чистый
мономер стирола, плавящийся при
242,52°
К, при добавлении
0,0375-мольной доли бензола образует идеальный раствор, замер-
зающий при температуре
240,84°
К. Подставляя эти величины
в выражение (11.21), получим
,.0
01660-
240,84
II.
Теплоемкость
и
энтальпия
фазовых
переходов
71
>торое рассматривается в гл. III. Тем не менее в общем случае,
згда
температура и объем
могут
изменяться, уравнение
АНт
угчше
описывает температурную зависимость энтальпии плавления.
;ли не учитывать последний член, то это может внести ошибку
определение
АСтр,
по величине превышающую 40% вклада, кото-
>ш
дает
температурный коэффициент приведенного уравнения.
Энтальпия испарения
ртальпии испарения AHv при
рмпературе ТЪ, называющейся
ормальной точкой
кипения.
Жидкость в замкнутом
сосуде
ожно нагреть выше ТЪ вплоть
о критической температуры
'с. При этой температуре две
азы вещества, находящиеся
термодинамическом равнове-
ии,
будут
тождественными по
воим физическим свойствам,
^ величина AHv становится рав-
7,°К
Рис.
11.15. Энтальпия испарения
бен-
зола.
ной
нулю *. В табл. II.8 приве-
дены значения энтальпии испа-
юния
бензола. Графическая
.ависимость AHv = / (Т) показана на рис.
11.15.
Следует
отметить
резкое уменьшение величины AHv при приближении системы к кри-
ическому состоянию.
Соотношение, описывающее динамическое равновесие
между
газо-
Найденная
отсюда величина АНт, равная
2640
кал/молъ,
согласуется
с калориметрическим значением
2630
кал/молъ,
полученным
Брик-
уедом
[168]. В этом
случае
совпадение величин АНт, найденных
методом понижения температуры идеального бинарного раствор;
и
калориметрически, является хорошим. Однако если изучаемая
система не подчиняется законам идеальных растворов, то расхожде-
ние
между
двумя величинами теплот может быть значительным. Полу-
ченные результаты
могут
быть также искажены за счет частичной
растворимости растворенного вещества в твердой фазе.
Для расчета температурной зависимости AHt и АНт при
постоянном давлении можно использовать уравнение
Кирхгофа
(III.3)
где AHv
_
энтальпия
испарения, a AF- разность объемов газо-
дАНт\
„ (\-кг эбразной и конденсированной фаз. Если конденсированная фаза —
i
P
(s)-iM.mp, [твердое вещество, то изменение энтальпии рассматриваемого процес-
Ьой
и конденсированной фазами чистого вещества, впервые было
ролучено Клапейроном в виде
dP
W
AHv
* Для
разбавленных растворов (мольная доля растворенного вещества
*
т
очка
на
кривой фазового равновесия, отвечающая
Тс,
называется
j
N
2
мала) обычно полагают,
что АНт не
зависит
от
концентрации раствора. Это
гическои
точкой
и
характеризуется критическим давлением
Рс,
критической
допущение позволяет использовать уравнение Клапейрона
—
Клаузиуса
в
соче-
гемпе
р
а
турой
Тс,
критическим объемом
Vc или
критической плотностью
рс.
тании
с
законом Рауля
для
расчета энтальпий плавления
и
кипения чистых
jj
pUM
пе
р
ев
.
веществ.—
Прим.
перев.
TAV
(11.22)
75
ги
3)
)Й
[X
2)
V-
4)
5)
ie
Г
я
е-
а
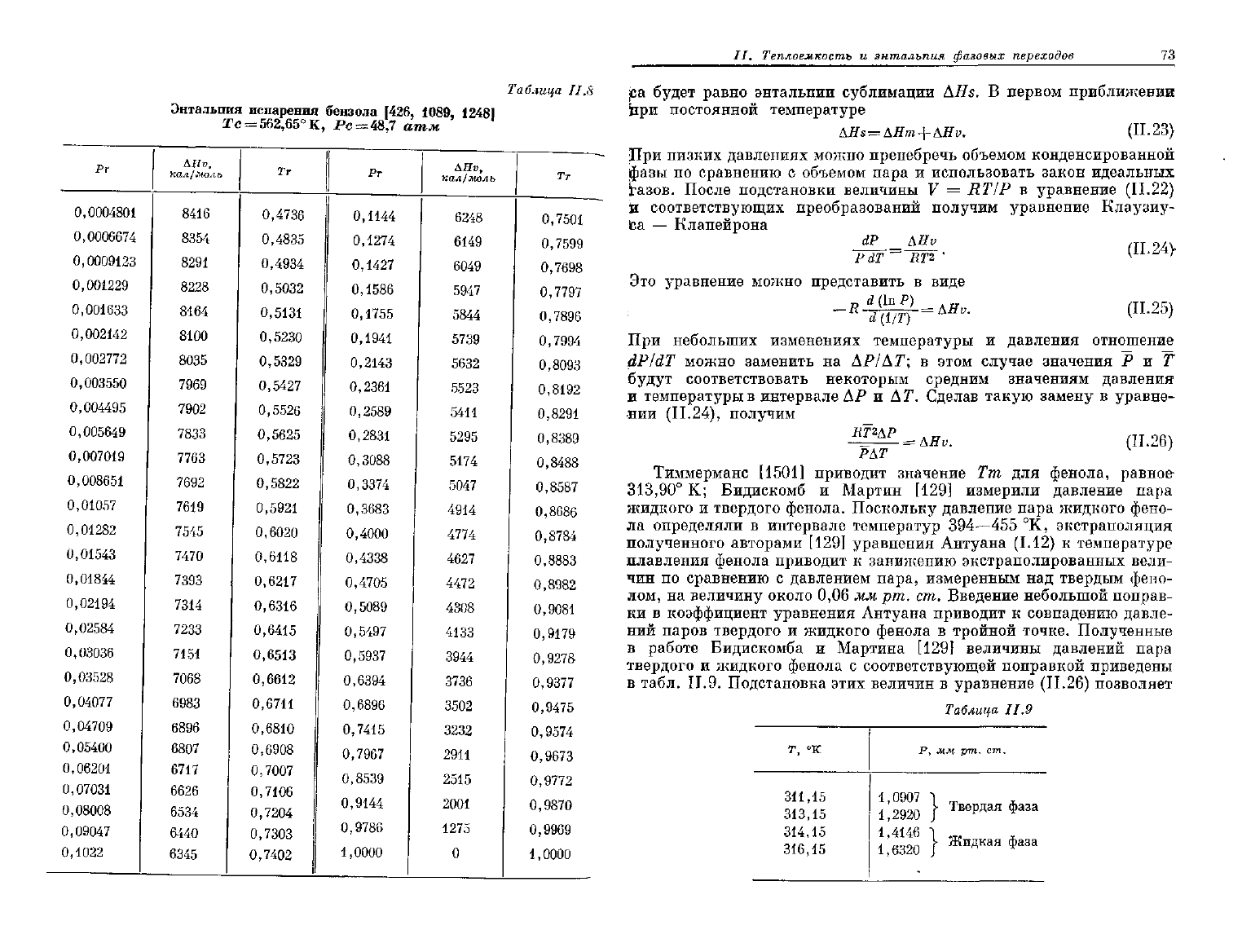
Таблица II.8
Энтальпия
испарения
бензола
Г426,
1089, 12481
Тс =
562,65°
К, Рс = 48,7 атм
Рг
0,0004801
0,0006674
0,0009123
0,001229
0,001633
0,002142
0,002772
0,003550
0,004495
0,005649
0,007019
0,008651
0,01057
0,01282
0,01543
0,01844
0,02194
0,02584
0,03036
0,03528
0,04077
0,04709
0,05400
0,06201
0,07031
0,08008
0,09047
0,1022
ЛЯ»,
кал/моль
8416
8354
8291
8228
8164
8100
8035
7969
7902
7833
7763
7692
7619
7545
7470
7393
7314
7233
7151
7068
6983
6896
6807
6717
6626
6534
6440
6345
Тг
0,4736
0,4835
0,4934
0,5032
0,5131
0,5230
0,5329
0,5427
0,5526
0,5625
0,572а
0,5822
0,5921
0,6020
0,6118
0,6217
0,6316
0,6415
0,6513
0,6612
0,6711
0,6810
0,6908
0,7007
0,7106
0,7204
0,7303
0,7402
Рг
0,1144
0,1274
0,1427
0,1586
0,1755
0,1941
0,2143
0,2361
0,2589
0,2831
0,3088
0,3374
0,3683
0,4000
0,4338
0,4705
0,5089
0,5497
0,5937
0,6394
0,6896
0,7415
0,7967
0,8539
0,9144
0,9786
1,0000
ДЯи,
кал/моль
6248
6149
6049
5947
5844
5739
5632
5523
5411
5295
5174
5047
4914
4774
4627
4472
4308
4133
3944
3736
3502
3232
2911
2515
2001
1275
0
Тг
0,7501
0,7599
0,7698
0,7797
0,7896
0,7994
0,8093
0,8192
0,8291
0,8389
0,8488
0,8587
0,8686
0,8784
0,8883
0,8982
0,9081
0,9179
0,9278
0,9377
0,9475
0,9574
0,9673
0,9772
0,9870
0,9969
1,0000
//. Теплоемкость и энтальпия
фазовых
переходов
73
са
будет
равно энтальпии сублимации AHs. В первом приближении
при
постоянной температуре
AHs=AHm+AHv.
(11.23)
При
низких давлениях можно пренебречь объемом конденсированной
фазы
по сравнению с объемом пара и использовать закон идеальных
Газов. После подстановки величины V =
RTIP
в уравнение
(11.22)
й
соответствующих преобразований получим уравнение Клаузиу-
са — Клапейрона
PdT
Это уравнение можно представить в виде
При
небольших изменениях температуры и давления отношение
dPldT можно заменить на АР/А Т; в этом
случае
значения Р и Т
будут
соответствовать некоторым средним значениям давления
и
температуры в интервале АР и АГ. Сделав такую замену в уравне-
нии
(11.24), получим
(IJ.zb)
=
= AHv.
T
PAT
Тиммерманс
[1501]
приводит значение Тт для фенола, равное-
313,90°
К; Бидискомб и Мартин [129] измерили давление пара
жидкого и твердого фенола. Поскольку давление пара жидкого фено-
ла определяли в интервале температур
394—455
°К, экстраполяция
полученного авторами [129] уравнения Антуана
(1.12)
к температуре
плавления
фенола приводит к занижению экстраполированных вели-
чин
по сравнению с давлением пара, измеренным над твердым фено-
лом,
на величину около 0,06 мм рт. ст. Введение небольшой поправ-
ки
в коэффициент уравнения Антуана приводит к совпадению давле-
ний
паров твердого и жидкого фенола в тройной точке. Полученные
в
работе Бидискомба и Мартина [129] величины давлений пара
твердого и жидкого фенола с соответствующей поправкой приведены
в
табл. И.9. Подстановка этих величин в уравнение
(11.26)
позволяет
Таблица II.9
Т, °К
311,15
313,15
314,15
316,15
Р, мм
ртп.
ст.
1,0907
1 _ .
1,2920
/
ТвердаЯ фа3а
1,4146
1 _. _
1,6320
/
ЖиДКаЯ фа3а

74
Часть
1.
Основы
термодинамики
рассчитать энтальпии сублимации
и
испарения фенола при соответ.
ствующих средних температурах
312,15
и
315,15°
К:
.„
1,9872
X
0,2013
X
(312,15)2
Л#*=
1,1913X2,00
=
16 379 кал/моль,
.„
1,9872
х
0,2174
х
(315,15)2 „
/лоо
AHv=
1,5233X2,00
= 14Ш ка
Подставляя найденные величины
AHs и AHv в
выражение (11.23),
получим энтальпию плавления фенола
АНт
=
16379
—14083
=
2296
кал,молъ.
Эту величину можно сравнить
со
значением
2530
кал/молъ.
полученным Тиммермансом
[1503]
криоскопическим методом,
а
также
с величиной
2752
кал/молъ,
определенной калориметрически Андо-
ном,
Коунселом, Херингтоном
и
Мартином
[19].
Трутон
[1518]
предложил грубое эмпирическое соотношение
между нормальными температурами кипения жидкостей
и их
энталь-
пиями
испарения
"•
=
21 кал/(моль-°К).
Это соотношение применимо
к
неполярным жидкостям,
не
образую-
щим ассоциированных молекул
в
газовой фазе. Общий метод расчета
энтальпий испарения, основанный
на
предположении
о том, что
молекулы вещества, находящиеся
в
некотором одинаковом приве-
денном состоянии, обладают одинаковыми свойствами, был разрабо-
тан Отмером [1093]. Согласно этому методу, выбирается некоторое
стандартное вещество (обозначенное звездочкой),
для
которого изве-
стны энтальпия испарения
как
функция температуры, критическая
температура
(Тс) и
критическое давление
(Рс). Из
соотношения
(11.27)
Тс*
вычисляется энтальпия испарения
другого
вещества
для
приведен-
ной
температуры
Тг =
Т/Тс. Например, если выбрать бензол
в
каче-
стве стандартного вещества, нетрудно рассчитать энтальпию испаре-
ния
фтористого бензола при
357,89°
К
(нормальная точка
кипения).
Доуслин, Мур, Доусон
и
Уаддингтон [343] приводят для фтористого
бензола следующие критические константы:
Тс =
560,07°
К и Рс =
=
44,91
атм,
откуда
Тг =
0,6390
и Рг =
0,02227.
Для
бензола:
Тс*
=
562,65°
К,
Рс* =
48,7 атм
и Тг* =
0,6390,
откуда
AHv*
=
=
7253
кал/молъ
и Рг* =
0,02432.
Подставляя приведенные величи-
ны
в
уравнение (11.27), получим
7253
X
560,07
X
log 0,02227
562,65
X
log 0,02432
=
7391 кал/молъ.
II.
Теплоемкость
и
энтальпия
фазовых
перехооов
75
считанное значение
AHv
примерно
на
1 % меньше величины
кал/молъ,
определенной Скоттом, Мак-Каллохом, Гудом, Мес-
I,
Пеннингтоном, Кинхелоу, Хоссенлоппом, Доуслином
и Уад-
4ЩНГТОНОМ [1318]. Применение правила Трутона дает
AHv =
2*21
X
357,89
=
7515
кал/молъ,
величину, менее чем
на
1 % превы-
шающую расчетную.
Скотт
и
сотр.
[1318]
приводят для фтористого бензола следующее
уравнение Антуана:
12ЛЯ 084
lgf(**)
=
6,95208- ,4-221,827
"
Из
этого уравнения получаем
Т, °К
356,82
357,89
358,95
Р,
мм 735 760 785
Подстановка этих значений
в
уравнение Клаузиуса — Клапепрона
4Н.26) дает
50
х
(357,89)2x7,9872
AHv=
760
X
(358,95- 356,82)
=7860 кал
'
молъ
-
i
Жто значение более
чем на 5%
превышает измеренную величину
^внтальпии испарения. Расхождение объясняется приближениями,
.^'Которые используются
при
выводе уравнения Клаузиуса
—
Кла-
пейрона.
Более точное значение энтальпии испарения можно найти
из
гуравнения
RT2
I dP \
Г
„
Тс
3
Р
1
1
/г
/тт ооч
впервые полученного Хаггенмахером
[560] из
уравнения
(11.24)
с учетом фактора сжимаемости
(в
скобках). Дифференцирование
уравнения Антуана
(1.12)
приводит
к
следующему выражению:
dP 2,303ЯР
If
(Г+С—273,15)2
'
где температура
Т
выражена
в
градусах
Кельвина.
Комбинируя выражения
(11.28)
и
(11.29), получим
4,5757Г
2
Д
г
Тсзр
ji/2
(Т+С—273,15)2
[
Т»Рс
J "
(11.29)
(11.30)
Подставляя
в это
уравнение данные
для
фтористого бензола
при
357,89°
К, находим
4,5757
X
(357,89)2
х
1248,083
[
л
(560,07)з
Х
1,00
I
*
"
[
л
(560,
I
*~
(357,8
(357,89+221,83-273,15)2
I *
(357,89)з
х
44,91
J ~
ШЪ
кал
'
молъ
-
Таким образом, вычисленное значение
AHv
находится
в
хорошем
соответствии
с
измеренной величиной.

76
Часть
1.
Основы
термодинамики
Методы экспериментального определения энтальпии испарения
были описаны в этой главе ранее. В табл. 11.10 приведены значения
Таблица
11.10
Энтальпия
испарения
гептана
а
)
р,
мм
рт
597,
391,
195,
cm
1
2
2
363
350
331
,63
,48
,21
Номер
опыта
3
3
4
AHv,
кал/моль
опыт
7715+2
7938±5
8244±2
расчет
по
уравне-
нию
Кла-
пейрона
7734
7945
8245
а
) Данные Уаддингтона,
Тодда
и
Хаффмана
[1552]
энтальпии
испарения гептана, полученные Уаддингтоном, Тоддом
и
Хаффманом
[1552]
в проточном калориметре. Там же для сравнения
приведены величины AHv, рассчитанные по уравнению Клапейро-
на
(11.22)
с
учетом
объемов газовой фазы, найденных из уравнения
состояния,
и объемов жидкости, полученных из измерения плотно-
стей жидкой фазы.
Для идеальных газов общая производная энтальпии испарения
по
температуре вдоль кривой насыщения в
результате
исчезновения
ряда членов уравнения близка к величине
AHv
=
ACvp.
Соответствующая производная для реального газа была получена
Глесстоном [492].
Глава
III
ТЕРМОХИМИЯ
Тепло,
выделяющееся или поглощающееся при образовании
соединения
из элементов в
результате
различных химических
реакций,
называется энтальпией (теплотой) образования и обозна-
чается символом Д#/. Данные по теплотам образования необходимы
при
проектировании новых и совершенствовании уже действую-
щих химических производств, а также для оценки теплотворной
способности различных видов ракетных топлив и топлив для
двигателей внутреннего сгорания. В современной химической тех-
нологии
точные значения энтальпии образования важны для
решения
вопроса о возможности самопроизвольного протекания
той или иной реакции в заданных условиях и определения числен-
ных значений констант равновесия. Знание энтальпий образования
важно для решения ряда теоретических проблем, связанных с опре-
делением энергии связи, резонансной энергии и природы химической
связи.
Поэтому не удивительно, что в этом столетии определению
теплот образования химических соединений уделялось значительное
внимание
*.
Следует,
однако, отметить, что многие из имеющихся в настоящее
время данных часто недостаточно надежны для точных термохимиче-
ских расчетов.
Авторы
первых термохимических работ, как правило,
не
указывали чистоту используемых в опытах веществ, а неполное
описание
калориметрических методик в значительной степени
затруд-
няет
введение в полученные результаты соответствующих поправок,
которые весьма существенны.
Следует
также отметить, что
отсут-
ствие общепринятых стандартных веществ затрудняло сравнение
точности результатов, полученных в разных лабораториях. В каче-
стве примера можно привести положение, сложившееся в термохи-
мии
галоген- и серусодержагцих соединений, которое только отчасти
было улучшено за последнее время. Таким образом, сейчас весьма
сложно провести обработку полученных ранее значений энтальпии
образования,
которые часто
могут
быть использованы только как
г
Рубые оценочные величины. В качестве примера интересно сравнить
^^ * В советской литературе вопросы термохимии различных классов орга-
нических соединений подробно рассмотрены в книге: С. М.
Скуратов,
В. П.
Коле-
ео
«. Л. ф.
Воробьев,
Термохимия, ч. II, Изд-во МГУ, М.,
1966.—
Прим.
перев.
78
Часть
1.
Основы
термодинамики
значения
энтальпий образования, предложенные Парксом
и
Хафф,
маном
в
1932
г.
[1105],
с
современными величинами [1248]. Для газо-
образного этана Парке и Хаффман
[1105]
приводят величину
&Hf =-.
=
— 23 460
кал/молъ;
в
настоящее время принята
&Hfl
ta
=
=
—20 236
кал/молъ.
Для
газообразного пропилена
эти
авторы
[1105]
приводят значение
ДЯ/°
98
=
4550
кал/молъ;
современное зна-
чение равно
4879
кал/молъ.
В
первом
случае
имеется серьезное рас-
хождение
в
энтальпии образования, равное около
3000
кал/моль,
во втором
случае
совпадение значительно лучше.
Следует
отметить'
что
в
обоих случаях
в
качестве исходных данных были использованы
теплоты сгорания, полученные экспериментально Томсеном [1495].
С
развитием химии переработки нефти потребовались более
точные
и
надежные данные
о
термодинамических свойствах
угле-
водородов.
За
последние годы были сделаны большие успехи
в
опре-
делении термодинамических свойств этих соединений
*.
Точно опре-
деленные энтальпии образования углеводородов оказались весьма
ценной
основой для рассмотрения термохимических величин
других
классов органических соединений. Некоторые термохимические зако-
номерности, обнаруженные
в
рядах углеводородов,
могут
быть
использованы
для
оценки термодинамических величин сходных
по
составу
и
строению кислород-, азот-, галоген-
и
серусодержащих
органических соединений,
а
также
для
анализа несогласованности
и
ошибок
в
экспериментальных данных, опубликованных разными
авторами.
Энтальпия реакции
Если реакция образования соединения
из
элементов сопровож-
дается выделением тепла из системы
в
окружающую
среду,
то энталь-
пии
образования этого соединения
AHf,
согласно принятому согла-
шению,
приписывают отрицательный знак.
И
наоборот, если система
поглощает тепло
из
окружающей среды, энтальпии образования
соединения
из
элементов обычно приписывают положительный знак.
Для полного энергетического описания реакции необходимо
учи-
тывать температуру
и
агрегатное состояние исходных
и
конечны^
веществ. Согласно международному соглашению, энтальпии
эле-
ментов
в их
стандартном состоянии
(AHf)
при
всех
температурах
приняты
равными нулю.
В
табл. III.1 приведены энтальпии обра-
зования
из
элементов некоторых важных соединений.
В 1840
г. Г. И.
Гесс [592] показал,
что
энтальпия реакции —
аддитивная величина
и не
зависит
от
промежуточных стадий реак-
*
В
СССР
систематические исследования
по
термодинамике различны^
типов углеводородов (парафинов, олефинов, ароматических
и
нафтеновых угле-
водородов) были начаты
в
40-х
годах
в
Государственном институте высоких
давлений
под
руководством
А. В.
Фроста
и
А.
А.
Введенского.
См.,
например:
А.
В.
Фрост,
Избранные труды,
т. I,
Изд-во
МГУ, М, 1960;
А. А.
Введенский,
Термодинамические расчеты нефтехимических процессов, Гостехиздат, I960.-"
Прим.
перев.
III.
Термохимия
79
Таблица
III.1
Энтальпии
образования
Реакции
C{graphite)+
у
O
2
(g)
=
CO(g)
C(graphite)
+
O
2
(g)
=
CO
2
(g)
•jH
2
(g)+
y
Cl
2
(g)=HCl(g)
HCl(g)+600H
2
O(/)
=
HC1
•
600H
2
O(0
1
1
HBr(g)
+
600H
2
O(0
=
HBT-
600H
2
O(0
1
1
HF(g)
+
50H
2
O(0
=
HF-
50H
2
O(0
S
(rhombic)
+lo
2
(g)
=
SO
3
(g)
so
3
(g)+H
2
(g)+
-i
o
2
(
g
)+И5н
2
о(г)
=
=
H
2
SO
4
.115H
2
O(0
-26,416
-94,052
-68,317
-22,063
-17,822
-8,66
-20,115
-64,92
-12,11
-94,45
-117,75
,
ккал/моль
1
-39,885
i
-28,775
[ -77,03
!- -212,20
Литера-
тура
[1249]
[1249]
[1249]
[1249]
[1249]
[1249]
[1249]
[833]
[833]
[1249]
[926]
ции,
а
зависит лишь
от
начального
и
конечного состояния системы.
Этот закон позволяет определить изменение энтальпии реакции
АНг, так как по определению
где
Vi —
число молей каждого вещества, участвующего
в
химической
реакции
(т.
е.
стехиометрический коэффициент
в
уравнении
дан-
ной
реакции). Важно подчеркнуть,
что
число
v^
положительно
для
продуктов реакции
и
отрицательно
для
исходных веществ
*.
Вводя
Если
бы
форму записи химических уравнений определяли математики,
"
не
химики,
то
реакцию
С+2Н
2
=
СН
4
'
ве
Роятно, записали
бы в
виде
СН
4
—С
—2Н
2
=0,
^
m
B
более общем виде
а
а>
1
_у
сте
хиометрический коэффициент, смысл которого определен выше,.
•
i
некоторая величина, соответствующая молю
г'-го
вещества.
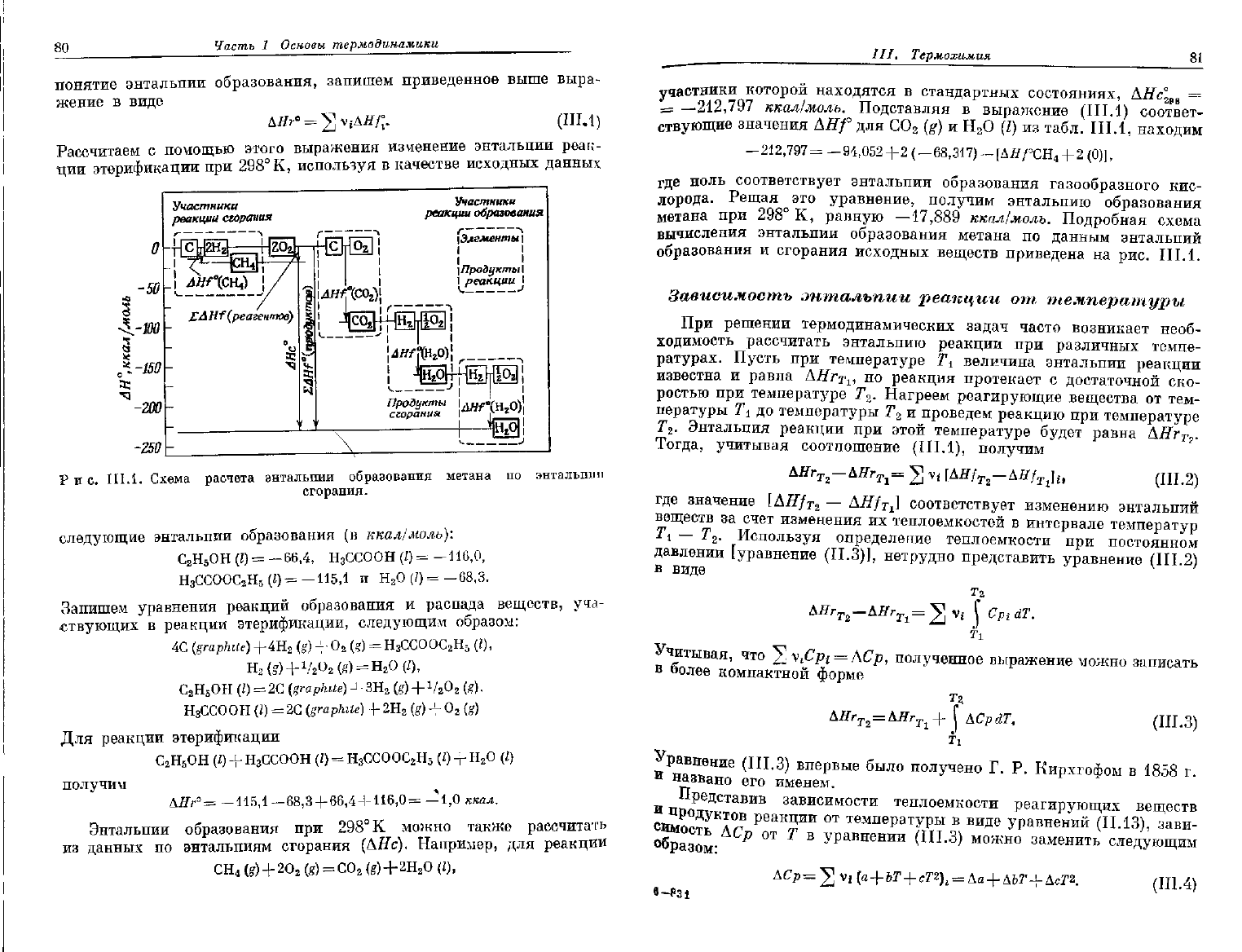
80
Часть
1
Основы
термодинамики
понятие
энтальпии образования, запишем приведенное выше выра-
жение
в
виде
Рассчитаем
с
помощью этого выражения изменение энтальпии реак-
ции
этерификации при
298°
К, используя
в
качестве исходных данных
oY
-200
-250
Участники
реакции
сгорания
Участники
реакции
образования
\Элементы\
\
\
\ПроЪукты\
I
реакции
I
Продукты
*
сгорания
I
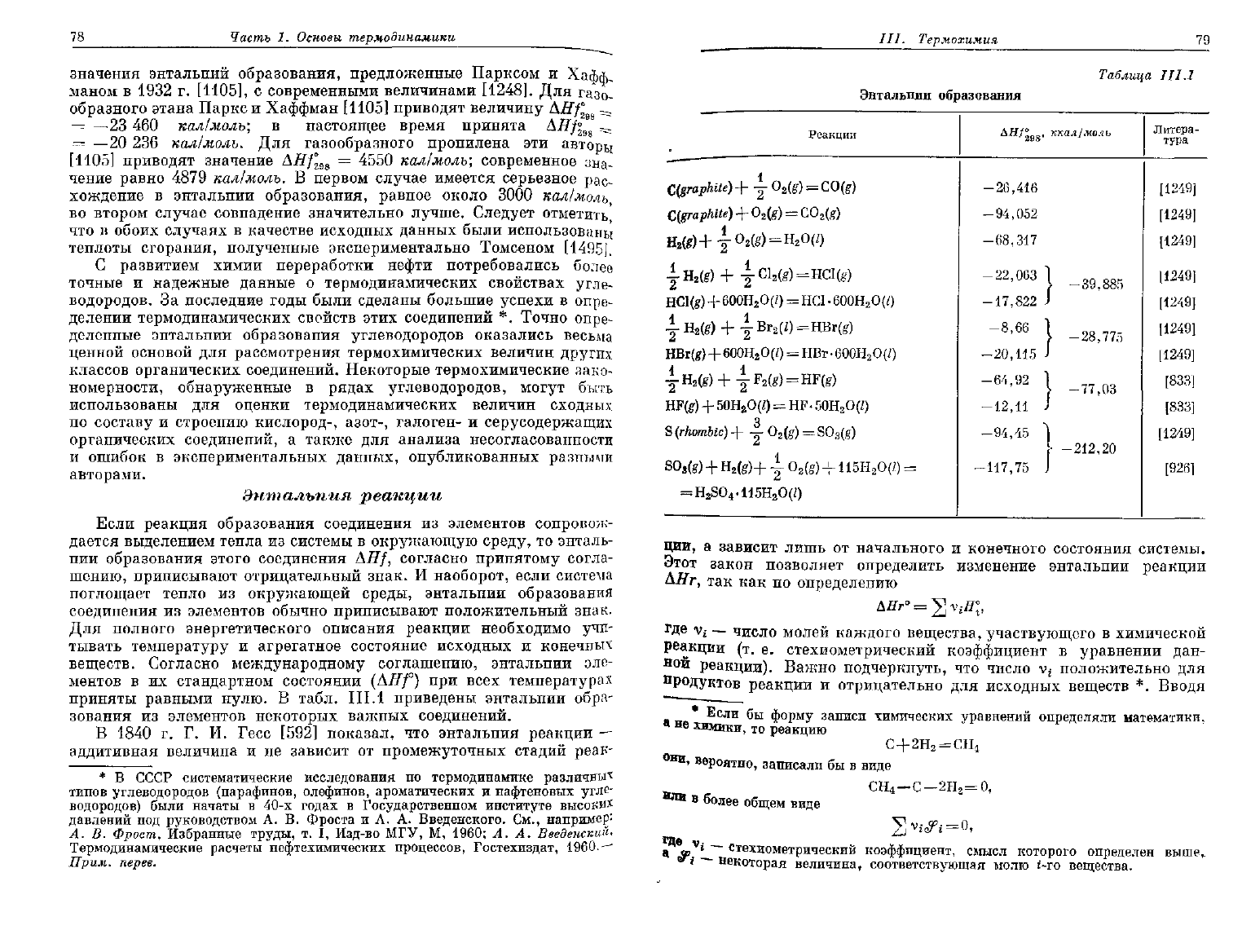
Рис.
III.1.
Схема расчета энтальпии образования метана
по
энтальпии
сгорания.
следующие энтальпии образования
(в
ккал/молъ):
С
2
Н
5
ОН
(I)
=
—66,4,
Н
3
ССООН
(I)
=
—116,0,
Н
3
ССООС
2
Н
5
(0 =
—115,1
и
Н
2
О(/)=—68,3.
Запишем уравнения реакций образования
и
распада веществ,
уча-
ствующих
в
реакции этерификации, следующим образом:
4С
(graphite)
+
4Н
2
(g)
+ О
2
(?) =
Н
3
ССООС
2
Н
5
(I),
С
2
Н
5
ОН
(l)
=
2C
(graphite)
^Ш
2
(g)
+
V
2
O
2
(g),
Н3ССООН
(I)
=
2C
(graphite)
+
2H
2
(g)
+
O
2
(g)
Для реакции этерификации
C
2
H
5
OH
(I)
+
Н3ССООН
(I)
=
Н
3
ССООС
2
Н
3
(I)
+
Н
2
О (I)
получим
ДЯг
о
=
-115,1—68,3
+
66,4+116,0=
—1,0
ккал.
Энтальпии образования
при
298° К
можно также рассчитать
из
данных
по
энтальпиям сгорания (АЯс). Например,
для
реакции
СН
4
Gr)+2O
2
(g)
=
CO
2
(g)+2H
2
O (I),
///.
Термохимия
81
I
участники которой находятся
в
стандартных состояниях,
АНс°
29В
=
__
212,797
ккал/молъ. Подставляя
в
выражение (III.1) соответ-
ствующие значения
AHf°
для СО
2
(g)
и
Н
2
О (I) из табл.
III.
1, находим
—212,797=— 94,052+2 ( —
68,317)
—
[Д#/°СН
4
+
2 (0)],
'•
где
ноль соответствует энтальпии образования газообразного кис-
' лорода. Решая
это
уравнение, получим энтальпию образования
метана при
298°
К, равную
—17,889
ккал/молъ. Подробная схема
вычисления
энтальпии образования метана
по
данным энтальпий
образования
и
сгорания исходных веществ приведена
на
рис.
III.1.
Зависимость энтальпии реакции от температуры
При
решении термодинамических задач часто возникает необ-
ходимость рассчитать энтальпию реакции
при
различных темпе-
ратурах. Пусть при температуре Т± величина энтальпии реакции
известна
и
равна
AHr
Tl
,
но
реакция протекает
с
достаточной ско-
ростью при температуре
Т
2
.
Нагреем реагирующие вещества
от
тем-
пературы
Ti
до температуры
Т
2
и
проведем реакцию при температуре
Т
2
- Энтальпия реакции при этой температуре
будет
равна
АНг
Т;
.
Тогда, учитывая соотношение
(III.1),
получим
ДЯг
Г2
-ДЯг
Т1
=
2
v* [ДЯ/
Г2
-ДЯ/
Г1
]
г
,
(Ш.2)
где значение
[AHf
T2
—
AHf
Tl
]
соответствует изменению энтальпий
веществ
за
счет изменения
их
теплоемкостеи
в
интервале температур
Т\
— T
z
.
Используя определение теплоемкости
при
постоянном
давлении [уравнение
(II.3)],
нетрудно представить уравнение (Ш.2)
в
виде
h
Учитывая, что
2
v
t
Cpi
=
ACp, полученное выражение можно записать
в
более компактной форме
ДЯг
Г2
=ДЯг
Т1
+
\
ACpdT.
T
(Ш.З)
Ti
Уравнение (Ш.З) впервые было получено
Г. Р.
Кирхгофом
в
1858
г.
и
названо
его
именем.
Представив зависимости теплоемкости реагирующих веществ
и
продуктов реакции
от
температуры
в
виде уравнений (11.13), зави-
симость
АСр от Т в
уравнении (Ш.З) можно заменить следующим
образом:
«-Р31
=2
v
i
{а
(Ш.4)
