Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

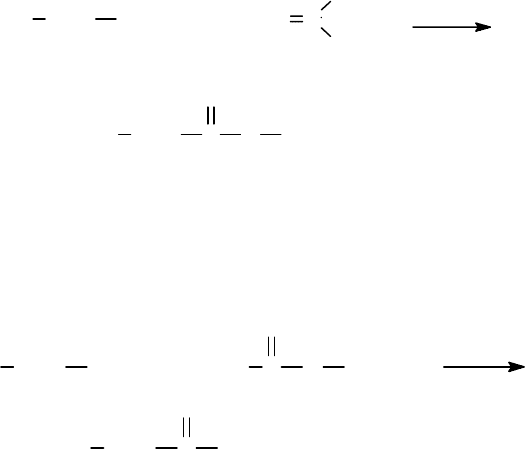
322
Метиловые и этиловые эфиры N-защищенных аминокислот получают
введением N-защитной группы в эфир, а не наоборот.
По завершению пептидного синтеза эфирные группировки расщепляют
щелочным гидролизом. По мере удлинения пептидной цепи гидролиз эфиров
затрудняется и требует более жестких условий проведения реакции. Это, в
свою очередь, повышает вероятность рацемизации. Поэтому, в таких случаях,
щелочной гидролиз заменяют кислотным.
Трет-бутиловые эфиры аминокислот и пептидов исключительно легко
расщепляются кислотами, что делает их более предпочтительными перед мети-
ловыми и этиловыми эфирами. Известно несколько способов получения трет-
бутиловых эфиров аминокислот.
¾ В реакции этерификации свободных аминокислот с изобутиленом. Ката-
лизатор - серная кислота; растворитель - диоксан:
NH
2
CHR COOH CH
2
C
CH
3
CH
3
H
2
SO
4
NH
2
CHR C
O
OC(CH
3
)
3
¾ В реакции переэтерификации свободных аминокислот трет-
бутилацетатом. Катализатор - хлорная кислота:
NH
2
CHR COOH CH
3
C
O
OC(CH
3
)
+
HClO
4
HClO
4
NH
2
CHR C
O
OC(CH
3
)
2
CH
3
COOH
+
.
¾ В реакции N-защищенных ааминокислот с трет-бутанолом и хлорокисью
фосфора в присутствии избытка пиридина.
Трет-бутиловые эфиры большинства аминокислот - устойчивые жидко-
сти. Перегоняются без разложения. Не вступают в реакцию самоконденсации
при хранении. Очень устойчивы к гидразинолизу и аминолизу.
323
Расщепляют трет-бутиловые эфиры хлористым водородом в этилацетате
или хлористом метилене; толуолсульфокислотой в бензоле; трифторуксусной
кислотой. Последнюю особенно часто используют при синтезе фрагментов
биологически активных пептидов.
Бензиловые эфиры аминокислот получают по реакции хлоргидратов хло-
рангидридов аминокислот с бензиловым спиртом:
HCl NH
2
CH
2
C
O
Cl
CH
2
OH
+
-HCl
NH
2
CH
2
C
O
OCH
2
C
6
H
5
HCl
.
.
Выходы реакции, как правило, невелики.
При использовании в реакции незамещенных аминокислот процессу спо-
собствует бензилборат, связывая образующуюся воду.
Бензиловые эфиры можно получить также по реакции аминокислот с 5-10
кратным избытком дибензилсульфита в присутствии п-толуолсульфокислоты.
Этот метод неприменим к аланину, лизину и пролину.
Расщепляют бензиловые эфиры ааминокислот и пептидов каталитиче-
ским гидрогенолизом в присутствии Pd. Избирательный гидрогенолиз бензило-
вых эфиров в присутствии карбобензоксигруппы невозможен. Бензиловые эфи-
ры можно расщепить также действием натрия в жидком аммиаке. Крайне редко
используется щелочной гидролиз бензиловых эфиров.
Модифицированные бензиловые эфиры
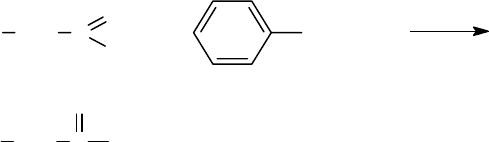
п-Нитробензиловые эфиры аминокислот получают кипячением карбобен-
зоксиаминокислот с п-нитробензилбромидом или п-нитробензилхлоридом в
этилацетате. Катализатор - третичный амин (X - карбобензоксигруппа). Карбо-
бензоксигруппу отщепляют от продукта реакции бромистым водородом в ледя-
ной уксусной кислоте.

324
XNH CHR COOH Br CH
2
NO
2
XNH CHR COO CH
2
C
6
H
4
NO
2
-HBr
Второй метод получения п-нитробензиловых эфиров - этерификация сво-
бодных аминокислот п-нитробензиловым спиртом в присутствии толуолсуль-
фокислоты в четыреххлористом углероде.
Третий способ - взаимодействие натриевых или триалкиламмониевых со-
лей карбобензоксиаминокислот с п-нитробензиловым эфиром п-толуолсульфо-
кислоты.
Для расщепления п-нитробензиловых эфиров прибегают к щелочному
гидролизу или каталитическому гидрогенолизу.
5.2.2 Гидразидная группа
Гидразидная группа (-NH-NH
2
) как таковая для защиты карбоксильной
функции непринима. В ее присутствии невозможно провести селективное аци-
лирование аминогруппы. Поэтому, для получения гидразидов используют про-
изводные гидразина (например, бензил- или третбутилоксигидразид), а амино-
группу в аминокислоте блокируют предварительно подходящей N - защитной
группой (Х):
XNHCHRC
O
Cl
NH
2
NH C
O
OCH
2
XNHCHRC
O
NH NH C
O
OCH
2
NH
2
NH C
O
OC(CH
3
)
3
()
или
+
Удаляют гидразидную защиту гидрогенолизом.
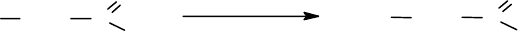
325
5.2.3 Защита карбоксильной группы путем солеобразования
Защита карбоксильной группы путем солеобразования - наиболее про-
стой метод. Такая защита легко достигается и дает почти количественный вы-
ход. Соли аминокислот растворяются только в воде. Это затрудняет дальней-
шее использование этих солей в пептидном синтезе. Поэтому, солеобразование
редко используется как метод защиты карбоксильной группы. Во всяком случае
его нельзя рекомендовать в качестве общего метода С-защиты.
5.3 Методы синтеза пептидов
5.3.1 Метод смешанных ангидридов
В методе смешанных ангидридов используются хлорангидриды N-
защищенных ааминокислот, смешанные ангидриды с моноэфирами угольной
кислоты, эфирами фосфорной и серной кислот, смешанные ангидриды с орга-
ническими кислотами (карбоновыми, трифторуксусной, сульфокислотами).
5.3.1.1 Хлорангидридный метод
В этом методе используются хлорангидриды N-защищенных аминокис-
лот. Стадии.
1.
Получают хлорангидрид N-защищенной аминокислоты обработкой ами-
нокислоты большим избытком тионилхлорида в инертном растворителе (на-
пример, бензоле) или без растворителя, либо реакцией с пятихлористым фос-
фором в бензоле или хлороформе.:
XNH CHR C
O
OH
SO
2
Cl, PCl
5
XNH CHR C
O
Cl
2.
Проводят реакцию образования пептидной связи с аминокомпонентой
(NH
2
-a/k) в присутствии сильного основания для связывания образующегося
хлористого водорода:
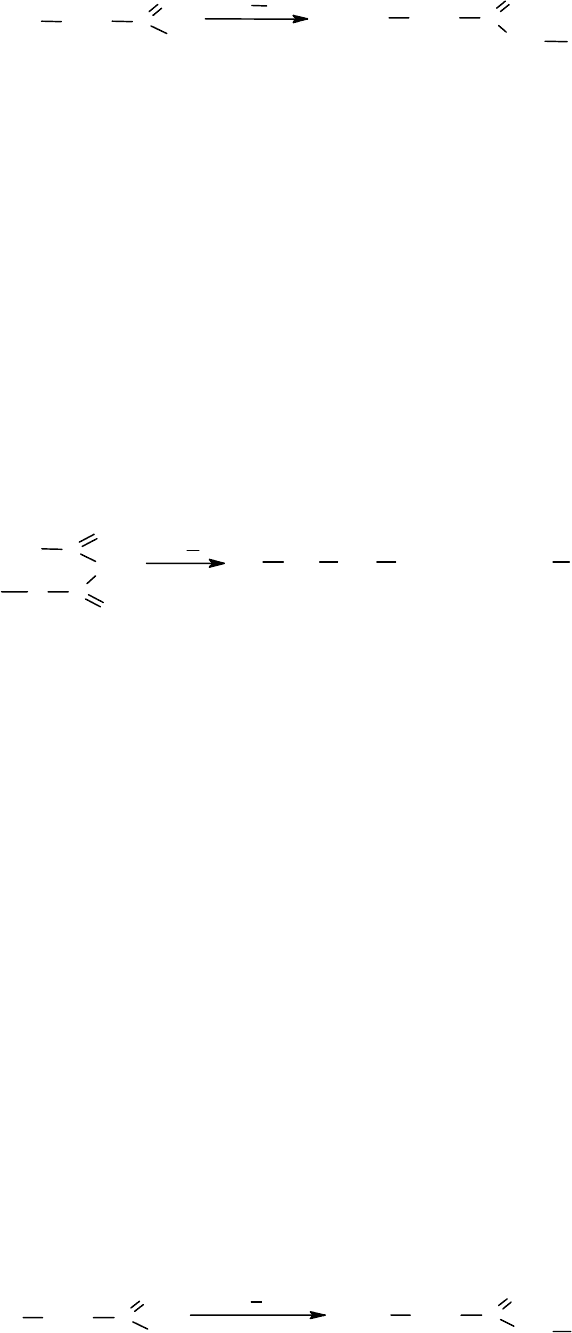
326
XNH CHR C
O
Cl
HCl
NH
2
a/k
-
XNH CHR C
O
NH
a/k
5.3.1.2 Смешанные ангидриды с моноэфирами угольной кислоты
Ангидриды с моноэфирами угольной кислоты играют в пептидном синте-
зе исключительную роль по сравнению со смешанными ангидридами других
типов. Этот метод предложен одновременно Виландом, Бернхардом и Буассо-
ном. Основное достоинство и преимущество этого метода - отсутствие побоч-
ных реакций в стадии образования пептидной связи. При аминолизе (в реакции
с аминокомпонентой) смешанного ангидрида образуется помимо соответст-
вующего пептида только двуокись углерода и спирт:
RC
O
O
C
O
OR'
NH
2
R''
RCONHR''
CO
2
R' OH
+
+
Смешанные ангидриды с моноэфирами угольной кислоты получают
обычно при пониженной температуре (0
0
С и меньше). Реакция образования
пептидной связи протекает быстро уже при комнатной температуре. Для за-
вершения реакции требуется в некоторых случаях кипячение. Процесс протека-
ет удовлетворительно с большинством аминокислот.
5.3.2 Азидный метод
Азидный метод является наиболее универсальным методом синтеза пеп-
тидов. Его основное достоинство - отсутствие рацемизации. Реакцию синтеза
пептида проводят в несколько стадий.
1.
Получают гидразид аминокислоты из эфиров N-защищенных аминокис-
лот
XNH CHR C
O
OR
NH
2
NH
2
XNH CHR C
O
NH NH
2
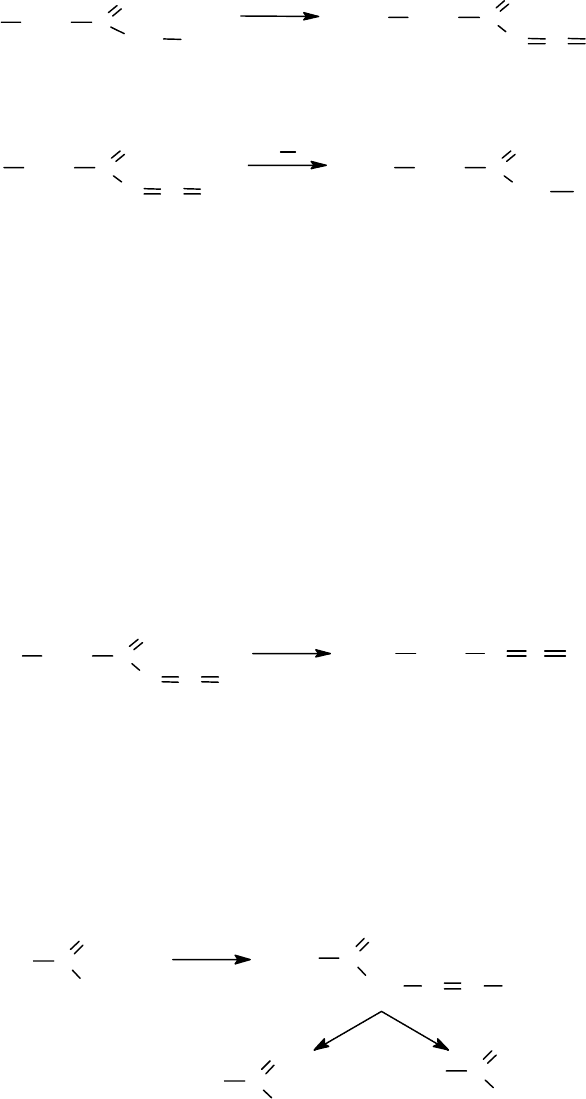
327
2.
Обработкой гидразида N-защищенной аминокислоты азотистой кислотой
получают гидразид:
XNH CHR C
O
NH NH
2
HNO
2
XNH CHR C
O
NNN
3.
Гидразид вводят в реакцию с аминокомпонентой:
XNH CHR C
O
NNN
NH
2
a/k
XNH CHR C
O
NH
a/k
NH
3
-
Образование азидов происходит только в сильнокислых растворах - смесь
уксусной и соляной кислот, или только соляная кислота. После добавления
нитрита натрия азид осаждается из раствора в виде масла, или в кристалличе-
ском состоянии. Азиды легко разлагаются водой. Поэтому их сразу после полу-
чения экстрагируют органическим растворителем (этилацетатом или эфиром).
Основные побочные реакции азидного метода синтеза пептидов обуслов-
лены:
¾ Перегруппировкой азида в изоцианат:
XNH CHR C
O
NNN
N
2
-
XNH CHR N C O
Изоцианат
¾ Образованием в ходе азидного синтеза амидов. Образовние амида не свя-
зано с перегруппировкой азида. Предполагается, что это побочная реакция гед-
разида с азотистой кислотой, которая протекает по следующему механизму:
RC
O
NHNH
2
HNO
2
RC
O
NHNNOH
RC
O
N
3
RC
O
NH
2
Acea
Aiea
328
5.3.3 Пептидный синтез с использованием
активированных эфиров
Синтез пептидов путем аминолиза сложных эфиров N-защищенных ами-
нокислот известен давно. Систематический поиск наиболее склонных к амино-
лизу «активированных эфиров» начат, однако, только после 1950г.
В ряду изученных ариловых, алкиловых, тиоариловых, тиоалкиловых, ок-
сисукцинимидных и цианметиловых эфиров для синтеза пептидов наиболее
приемлемыми оказались п-нитрофениловые эфиры.
По активности в реакциях аминолиза сложные эфиры располагаются
примерно в такой последовательности:
-O-C
2
H
5
< -O-CH
2
-C
6
H
5
< -O-CH
3
< -O-CH=CH
2
< -O-C
6
H
5
< -S-C
2
H
5
<
-S-C
6
H
5
< -O-CH
2
CN
< -O-C
6
H
5
-NO
2
< -S-C
6
H
5
-NO
2
Ариловые эфиры. Богдански с сотр. исследовали процесс аминолиза фе-
ниловых и нитрофениловых эфиров фталилглицина и в идентичных условиях
получили следующие выходы реакции для:
-O-C
6
H
5
(3%); -S-C
6
H
5
(31%); p-O-C
6
H
5
-NO
2
(75%); m-O-C
6
H
5
-NO
2
(83%);
o-O-C
6
H
5
-NO
2
(76%).
Как видно наибольшие выходы наблюдаются для нитрофениловых эфи-
ров. Предпочтительное использование пара-изомера обусловлено тем, что он
легче остальных кристаллизуется.
Метод п-нитрофениловых эфиров. Пептидный синтез с использованием
п-нитрофениловых эфиров проводят обычно в этилацетате или тетрагидрофу-
ране (в зависимости от растворимости эфира) при комнатной температуре или
слабом нагревании. Иногда рекомендуется добавлять диметилформамид. Этим
путем удалось синтезировать ряд природных полипептидов.
Скорость аминолиза зависит от длины цепи карбоксильной и аминоком-
понент. Большее влияние оказывает длина цепи карбоксикомпоненты. Амино-
лиз хорошо катализируется добавками имидазола. Реакция образования пеп
329
тидной связи протекает в оптимальных условиях, как правило, без рацемиза-
ции. Однако, для растворов карбобензоксиаминокислот величина удельного
вращения в присутствии даже 1% триэтиламина изменяется уже при 20
0
. В этих
условиях устойчивы только соответствующие производные глутамина и аспа-
рагина.
Оптически чистые п-нитрофениловые эфиры можно синтезировать по
одному из обычных методов, если С-концевая аминокислота не способна раце-
мизоваться (глицин или пролин).
п-Нитрофениловые эфиры обладают характеристическим поглощением в
УФ-области (λ
мах
= 268-270 нм.), что позволяет следить за кинетикой процесса
спектрофотометрически. Нитрофеннол в этой области не поглощает.
Алкиловые эфиры. Метиловые и этиловые эфиры обладают малой реак-
ционной способностью в пепетидном синтезе. Тем не менее, их используют для
получения циклических и линейных пептидов. Скорость аминолиза метиловых
эфиров можно увеличить добавками имидазола.
Наиболее активными в ряду алкиловых эфиров являются цианметиловые
эфиры. Они легко получаются реакцией N-защищенных аминокислот с хлор-
ацетонитрилом в присутствии триэтиламина. Аминолиз цианэтиловых эфиров
проводят обычно при комнатной температуре. Рацемизации, как правило, не
наблюдается. Процесс, так же как и в случае п-нитрофениловых эфиров, ката-
лизируют добавками имидазола, пиразола, триазолов и др.
Тиоэфиры. В целом тиоалкиловые эфиры малоактивны в реакциях пеп-
тидного синтеза и требуют весьма жестких условий проведения процесса. По-
этому они находят весьма ограниченное применение.
По наблюдениям Фаррингтона с сотр. в ряду ариловых эфиров наиболее
реакционноспособными являются п-нитротиофениловые эфиры. Тиоалкиловые
эфиры по своей активности располагаются в следующий ряд:
-S-CH
2
-CH
3
< -S-CH
2
-CH
2
-NH-COCH
3
< -S-CH
2
-CH
2
-COOH < -S-CH
2
COOH.
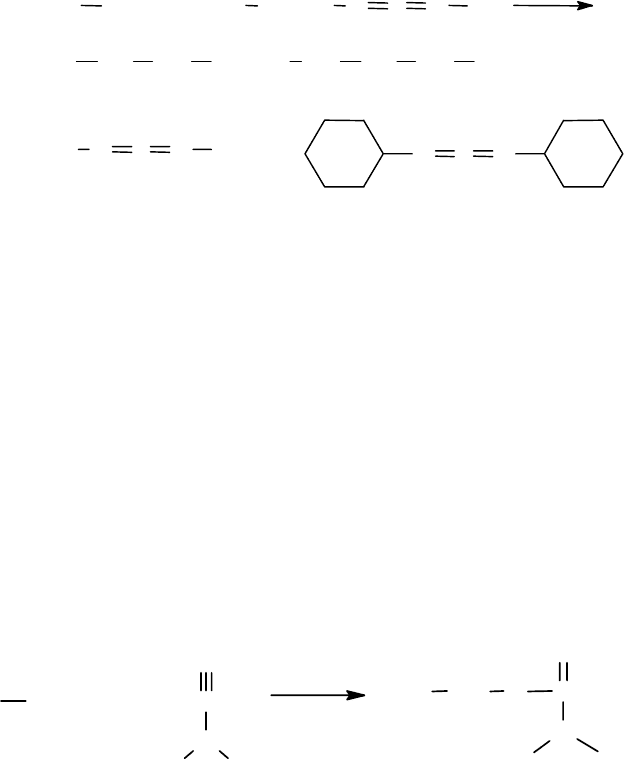
330
5.3.4 Пептидный синтез с использованием соединений
с кратными С-N и C-C связями.
5.3.4.1 Карбодиимиды
В 1955г Шиэн и Хесс предложили новый метод образования пептидной
связи путем использования N,N’-диалкилпроизводных карбодиимида. Этот
карбодиимидный метод стал одним из основных и широко применяемых спо-
собов образования пептидной связи. Достоинство этого метода - простота и не-
значительная тенденция к рацемизации. Схема реакции образования пептидной
связи выглядит следующим образом:
RCOOH NH
2
R' R'' N C N R''
+
+
RCONHR' R''NHCONHR''
+
R'' N C N R''
=
NCN
N
,N'-
дициклогексилка
р
бодиимид
При синтезе пептидов карбодиимидным методом N-защищенный карбок-
сильный компонент и аминокомпонент вводят в реакционную смесь одновре-
менно. Поскольку такая процедура не исключает образование соли, рекомен-
дуют карбодиимид вводить в несколько приемов.
5.3.4.2 Цианамиды
Лоссе и Веддиге в 1960г. разработали метод активирования карбоксиль-
ной группы N-защищенных аминокислот реакцией с N,N-диалкилцианамидами:
RCOOH C
N
N
RR'
C
NH
OCOR
N
R
R'
(
I
)
Аддукт N-защищенной а/к
с диациламидом
N
-
защищ. а/к
N
,N-
диалкил-
цианамид
+
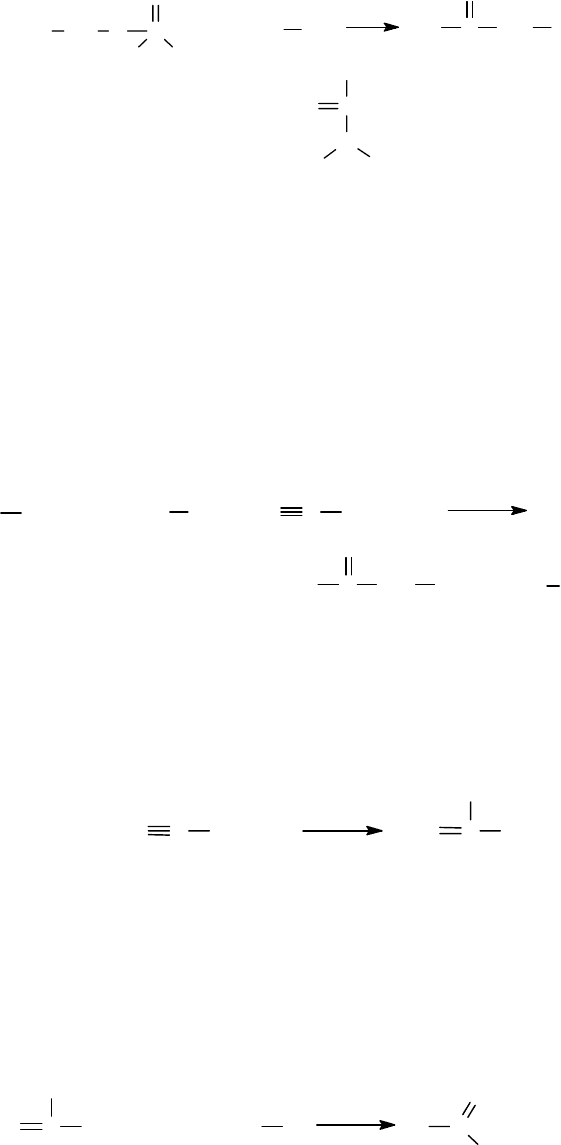
331
Образовавшийся активный аддукт (I) реагирует далее с аминокомпонен-
том с образованием пептидной связи:
C
RR'
NH
OCOR
H
2
NR''
+
RCNH
O
R''
C
NH
2
O
N
R
R'
(
R=
C
6
H
5
CH
2
,
C
6
H
5
C
2
H
5
)
+
5.3.4.3 Этоксиацетилен
Этоксиацетилен, в качестве конденсирующего средства при пептидном
синтезе, предложили Аренсон (1955) и Паннеманн (1959).
Реакция конденсации описывается в этом случае следующим суммарным
уравнением:
R COOH
H
2
NR' HC C OC
2
H
5
+
+
RC
O
NH R'
CH
3
COOC
2
H
5
+
Если аминокомпонента вводит в реакцию в форме хлоргидрата, то первой ста-
дией процесса является присоединение хлористого водорода к тройной связи
этоксиацетилена с образованием этилхлорвинилового эфира (II):
HC C OC
2
H
5
HCl
+
H
2
CC
Cl
OC
2
H
5
(II)
Этот эфир реагирует затем с карбоксильной компонентой, с образованием хло-
рангидрида:
(II)
H
2
CC
Cl
OC
2
H
5
HOOC R
+
RC
O
Cl
CH
3
COOC
2
H
5
+
