Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.


302
Рис. 4.23
Маска, моделирующая одну (А) и две (Б) и четыре молекулы гексаметилбензола (левая
часть рисунка). Те же маски с одним дополнительным отверстием в центре (правая часть
рисунка)
303
Расположение дырочек соответствует расположению атомов в изучаемой
молекуле. Например, на рис.4.23 изображена маска, передающая строение гек-
саметилбензола (напоминаем, что атомы водорода в РСА могут не приниматься
во внимание). После второй линзы лучи фокусируются в плоскости F, в кото-
рой и образуется дифракционная картина. Она рассматривается через микро-
скоп малого увеличения. Вот и весь прибор для визуального наблюдения ди-
фракции света.
На рис. 4.23 (левая часть) изображены дифракционные картины, полу-
ченная от масок моделирующих одну, две и четыре правильно расположенные
на плоскости молекулы гексаметилбензола. Видно, что уже одна молекула дает
систему дифракционных пятен, общее расположение которых сохраняется и
для решетки из нескольких молекул. Но каждое пятно дробится на несколько и
получается в конечном счете сложная картина, в которой межмолекулярные и
внутримолекулярные интерференции перемешаны.
Спрашивается, можно ли, зная дифракционную картину, получить расче-
том или измерением породившую ее картину дырочек или освещенных точек.
Оказывается, это было бы возможно и легко, если бы мы знали не только ам-
плитуды (их квадрат - интенсивность пятна), но и фазы колебаний в дифракци-
онных пятнах. В данном случае мы имеем дело с картиной в прямом простран-
стве гораздо более элементарной, чем белковый кристалл. Эта картина плоская,
с центром симметрии. При этом все фазы интерференции имеют только два
значения: 0 и π. Иначе говоря, неопределенность фазы пятен сводится к неоп-
ределенности знаков амплитудных коэффициентов, т.е "+" или "-". Если бы мы
знали знаки, соответствующие каждому из пятен, т. е. каждой точке в обратном
пространстве, не представляло бы труда реконструировать (рассчитать через
ряды Фурье) структуру «кристаллической ячейки гексаметилбензола», исходя
из дифракционной картины. Поскольку знаки амплитудных коэффициентов
неизвестны - вычислить ряды Фурье нельзя. Существенно, однако, то, что
можно обойтись без расчетов, а пойти путем аналогового решения задачи, т.е.
304
применить тот же прием дифракции видимого света для преобразования карти-
ны пятен из обратного пространства в прямое. Для этого нужно изготовить
маску с дырочками, соответствующими дифракционной картине (рис. 4.23 ле-
вая часть). Но этого недостаточно. Часть дырочек должна давать пучок света с
обратной фазой колебаний по отношению к остальным и расположение этих
дырочек надо знать. Зная эти отверстия, мы заклеиваем их прозрачной слюдя-
ной пластинкой, дающей запаздывание по фазе точно на π (толщина пластинки
подбирается равной половине длины волны света в данной среде). Тогда мы
получаем в фокусной плоскости нашей оптической системы картину располо-
жения атомов в «молекулах» гексаметилбензола.
Таким образом, обратная задача перехода от дифракционной картины к
«структуре решетки» решается аналоговым путем только в том случае, если из-
вестны фазы (в данном случае знаки) интерференционных максимумов. Фазы
заранее неизвестны (мы видим и измеряем на практике только интенсивность
пятен), поэтому необходимо прибегнуть к методу изоморфного замещения. Для
этого вводим в структуру «молекулы» лишнюю освещенную точку в опреде-
ленном месте. Для простоты в нашем примере лишняя дырочка в маске сделана
в самом центре (рис. 4.23, правая часть). Получаем дифракционные картины от
измененных «молекул» и сравниваем их с дифракционными картинами от пер-
воначальных «молекул». Поскольку здесь дело гораздо проще и необходимо
выбрать только между двумя фазами - 0 и π, качественное сравнение двух кар-
тин вполне достаточно и дает сразу же полный ответ на поставленный вопрос.
Действительно, дополнительная дырочка находится в центре симметрии «моле-
кулы». Анализ показывает, что все амплитудные коэффициенты, создаваемые
этими центральными дырочками, будут иметь знак плюс. Значит, если дифрак-
ционное пятно увеличило свою интенсивность после добавления центрального
«атома» в «молекуле» гексаметилбензола, то его амплитудный коэффициент
положителен, если же уменьшило, то отрицателен.
305
Сравнивая левые и правые стороны рис. 4.23, мы легко находим пятна с
положительными и отрицательными знаками амплитудных коэффициентов. В
этом и заключена, правда с большими упрощениями, основная физическая идея
метода изоморфного замещения. При анализе белковых кристаллов дело обсто-
ит несравненно сложнее и вот по каким причинам.
Во-первых, решетка пространственная; во-вторых, центр симметрии от-
сутствует (в белках не может быть центра симметрии хотя бы уже потому, что
они содержат асимметрические атомы углерода). Но в принципе брэгговская
иллюстрация помогает понять саму идею метода.
Возвращаясь к рентгеноструктурному анализу белков, рассмотрим,
имеющий теперь уже только исторический интерес, путь пройденный при РСА
исследовании миоглобина. Характерными являются несколько последователь-
ных этапов, проделанных в этой работе. Разрешающая способность метода
рентгеноструктурного анализа находится в известной мере во власти исследо-
вателя. В начале было решено ограничиться более грубой картиной, пренебре-
гая мелкими деталями. Было принято, что анализ ведется с разрешением в 6 Å.
Это означало, что интерференции, соответствующие расстояниям в прямой ре-
шетке меньше 6 Å, во внимание не принимались. В этом случае, в обратном
пространстве выбрасываются все пятна, расстояния которых от центра больше
определенного. Иначе говоря, выбор разрешающей силы приводит к тому, что
мы отбираем дифракционные максимумы, достаточно близкие к центральному
пятну, и тем ограничиваем используемый экспериментальный материал. Так,
для получения пространственной модели миоглобина с разрешением в 6 Å ока-
залось необходимым использовать 400 дифракционных пятен. При переходе к
разрешению в 2 Å объем обратного пространства, который приходится исполь-
зовать для анализа, возрастает в 3
3
= 27 раз. Отсюда число дифракционных пя-
тен, использованных для расчетов, составило 10 000. При повышении разреше-
ния до 1,5 Å объем обратного пространства и, соответственно, число дифрак
306
ционных максимумов возросло еще вдвое, т. е. для анализа служили 20000 ин-
терференционных пятен.
Картина, полученная при разрешении в 6 Å, не позволила выявить поло-
жение отдельных атомов, но положение спиралей Полинга - Кори, образован-
ных полипептидной цепью, было установлено четко, так как диаметр спирали
10,1 Å. Боковые цепи аминокислотных звеньев здесь получились как бесструк-
турная аморфная масса, заполняющая промежутки между стержнеобразной
спиралью. По причине того, что отдельные белковые группы идентифициро-
вать не удалось, о чередовании аминокислот в цепи ничего сказать было нельзя.
Следующим шагом было повышение разрешающей способности до 2 Å путем
анализа 9600 интерференций. Такую титаническую работу можно было осуще-
ствить только путем значительной механизации, в особенности всех численных
расчетов. Кристаллики миоглобина (из мышц кашалота) снимались для получе-
ния так называемых диаграмм колебаний из 22 различных положений. Затем
после фотометрирования всех пятен проводилась нормировка интенсивностей
всех отдельных рентгенограмм c тем, чтобы получить вполне сравнимую серию
из 9600 коэффициентов. Затем вся та же измерительная работа была проделана
нa четырех изоморфных дериватах белка, содержащих тяжелые атомы метал-
лов.
К счастью, оказалось, что подобные дериваты образуются довольно легко
и в значительном разнообразии. В состав белковой молекулы входят многие ак-
тивные функциональные группы, способные связывать атомы или ионы метал-
лов как ковалентно, так и путем комплексообразования. Для надежности следу-
ет выбирать такие соединения, для которых число связанных атомов металлов
на одну молекулу белка невелико (лучше всего 1 - 2). Необходимо, чтобы по-
ложение тяжелых атомов было строго фиксировано в определенных точках
макромолекулы, но знать заранее координаты этих точек нет необходимости.
Наконец, обязательным является изоморфизм белкового деривата с исходным
белком. Это требование, как правило, нетрудно выполнить: введение одной или
307
двух групп с тяжелым металлом в макромолекулу белка зачастую почти не из-
меняет упаковку макромолекул в элементарной ячейке (решетке). Во всяком
случае, возникающие деформации решетки оказываются пренебрежимо малы.
Все эти обстоятельства помогают решить химическую часть задачи - получение
дериватов белков с атомами тяжелых элементов, причем критерием образова-
ния нужных соединений служат обычно сами рентгенограммы соответствую-
щих кристаллов.
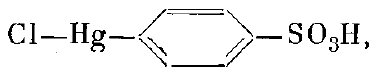
Применительно к миоглобину лучшими реагентами оказались следую-
щие. Первый - это парахлормеркурибензосульфонат.
Это вещество присоединяется в одном единственном месте, даже если задать
его в кристаллизационную жидкость в 20-кратном ибытке.
Второй реагент - комплексные ртутно-аммиачные ионы, образующиеся
при нагревании окиси ртути с водным аммонийсульфатом. Эти ионы присоеди-
няются к молекуле миоглобина также в одном единственном месте и притом в
совершенно другом, чем первое, ртутно-органическое соединение. Третий, при-
годный для рентгеноструктурного анализа, дериват содержал комплексный ион
золота AuCl
4
-
(добавлялась при кристаллизации миоглобина соль KAuCl
4
). Зо-
лото прикрепляется также в одной определенной точке макромолекулы миог-
лобина. Реакция идет очень медленно и требует нескольких месяцев. Четвертое
соединение содержало в комбинации ртуть в виде хлормеркурибензосульфона-
та и ртутно-аммиачного комплекса.
Для всех четырех дериватов были получены рентгенограммы также из 22
положений и точно измерены около 10000 дифракционных максимумов. Затем
были получены разностные картины, относящиеся к атому тяжелого металла,
вычислены координаты атома металла, получены для него амплитудные коэф
фициенты как по величине, так и по фазе. Наконец, решением векторных урав
308
нений получены фазы всех 9600 интерференции миоглобина, и в итоге прове-
дено суммирование рядов Фурье для 96 слоев, на основании чего построены
поверхности равной электронной плотности. Степень выразительности этой
картины такова, что вторичная и третичная структура белка получилась во всех
деталях, структура спиральных участков Полинга - Кори подтвердилась в пол-
ной мере. Степень спиральности миоглобина оказалась близкой к 77%, что хо-
рошо совпадало с оценкой, сделанной Бенсоном и Линдерштрём - Лангом на
основании изотопного обмена водорода пептидных связей. Природа боковых
радикалов аминокислот в этом приближении установлена в большинстве слу-
чаев, но не во всех. Только в следующем окончательном расчете с разрешением
в 1,5 Å, когда приходится иметь дело с 20000 дифракционных пятен, степень
детальности анализа оказалась такой, что удалось идентифицировать все ами-
нокислотные остатки.

309
ГЛАВА 5
СИНТЕЗ ПЕПТИДОВ
В настоящей главе изложены основы пептидного синтеза, которые на се-
годняшний день можно отнести к хрестоматийным. Реальной практической
значимости они уже не имеют в силу появление и стремительного развития в
последние 10-15 лет способов получения пептидов и белков методами генной
инженерии.
Пептидный синтез сводится к образованию амидной связи между α-
карбоксильной и α-аминогруппами двух аминокислот. В реакции отщепляется
молекула воды и для ее осуществления необходимо активировать карбоксиль-
ную или аминогруппу. К настоящему моменту предложено много различных
способов активации, однако лишь немногие из них нашли широкое практиче-
ское применение.
Для однозначного проведения пептидного синтеза в смеси аминоксилот
одного активирования их функциональных групп недостаточно. Причина в том,
что активированная молекула ааминокислоты может реагировать как с себе по-
добной, так и с отличной по строению молекулой иной аминокислот:
NH
2
CHR COOH
NH
2
CHR COOH
NH
2
CHR' COOH
NH
2
CHRCONHCHRCOOH
NH
2
CHRCONHCHR'COOH
Или
+
В силу этого, синтез пептидов требует защиты всех функциональных групп,
участие которых в реакции нежелательно. Применяемые в пептидном синтезе

310
защитные группы подразделяются на амино-(или N)-защитные (Х) и карбоксил-
(или С)-защитные (Y).
Помимо α-амино- и α-карбоксильных групп блокируют также и функ-
циональные группы в R-остатке (все они объединены общим названием - ω-
группы), если последние могут привести к побочным реакциям.
Защитные группы в пептидном синтезе, независимо от того блокируют ли
они Х-, Y- или ω-группы, должны удовлетворять таким требованиям.
¾ Они должны быть доступными или легко синтезироваться с хорошими
количественными выходами.
¾ Они должны быть применимы для возможно большего числа методов
синтеза пептидов.
¾ Они не должны вступать в побочные реакции или способствовать проте-
канию таковых.
¾ Они должны легко и селективно удаляться.
На практике все эти условия одновременно почти никогда не выполняют-
ся. Поэтому приходится останавливаться на некотором компромиссном реше-
нии.
В самом общем виде процесс пептидного синтеза можно выразить сле-
дующей схемой:
В целом, пептидный синтез включает следующие стадии:
¾ защита карбоксигруппы аминокомпоненты;
Y
N
HCHRC
O
Z*
N
H
2
CHR' COX
Y
N
HCHRC
O
N
N
CHR' COX
X - защита аминогруппы
Y - защита карбоксильной группы
Z* - ативированная карбоксигруппа

311
¾ защита аминогруппы карбоксикомпоненты;
¾ защита карбокси- и аминогрупп боковых цепей;
¾ активация карбоксигрупппы карбоксикомпоненты;
¾ синтез, образование пептидной связи;
¾ удаление (снятие) защитных групп;
¾ выделение пептида.
5.1 Методы защиты аминогруппы
Ацильные защитные группы
Простые ацильные группы малопригодны для защиты аминогруппы. Они
образуют новую амидную связь, которую трудно расщепить селективно в при-
сутствии других пептидных связей. Поэтому, в качестве ацильных защитных
групп применяют: формильный остаток; трифторацетильную, фталильную
группу; остаток сульфокислот. Эти группы можно селективно удалить соответ-
ственно: гидролизом в кислой среде; обработкой щелочью; гидразинолизом;
восстановлением с образованием меркаптанов.
Формильная группа
Формиламинокислоты впервые были получены Фишером и Вабургом в
1905г. И только спустя 50 лет Хильман обнаружил, что они очень легко гидро-
лизуются кислотами. Это открыло путь к использованию формиламинокислот в
пептидном синтезе. Удалить формильную группу можно не только кислотным
гидролизом, но и окислением трехкратным избытком 15% Н
2
О
2
:
HCNHCH
OR
COOH NH
2
CH
R
COOH CO
2
H
2
O
2
+
