Сергеев О.С., Уксусова Л.И. и др. Типовые патологические процессы. Воспаление. Лихорадка. Повреждение клетки
Подождите немного. Документ загружается.


МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
САМАРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
О.С. СЕРГЕЕВ, Л.И. УКСУСОВА,
В. В. САПРЫКИН, Е.А. ДЕНИСОВА, И.О. ПРОХОРЕНКО
ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
ВОСПАЛЕНИЕ. ЛИХОРАДКА. ПОВРЕЖДЕНИЕ КЛЕТКИ
УЧЕБНОЕ ПОСОБИЕ ДЛЯ СТУДЕНТОВ
ВЫСШИХ МЕДИЦИНСКИХ УЧЕБНЫХ ЗАВЕДЕНИЙ
САМАРА 2004
УДК 612.02
О.С. Сергеев, Л.И. Уксусова, В.В. Сапрыкин, Е.А. Денисова, И.О. Прохоренко. Типовые
патологические процессы. Воспаление. Учебное пособие для студентов медицинских
институтов. Самара, 2004, 68 с., Библ. 12, Табл. 10.
В «Учебном пособии» подробно представлены теоретический блок информации, где
изложен систематический курс лекций по патофизиологии типовых патологических процессов
«Воспаления», «Лихорадки», «Повреждения клетки» и основанные на нем тестовые задания с
эталонными ответами на них. Материалы предназначены для студентов медицинского
института и университетов медико-биологического профиля, могут быть использованы
ординаторами, аспирантами, субординаторами и врачами широкого профиля, в том числе для
самоконтроля.
Рецензенты: доктор медицинских наук профессор Т.А. Федорина, доктор медицинских
наук профессор А.А. Суздальцев.
Рекомендовано к изданию Учебно-методическим отделом СамГМУ
@ Самарский государственный медицинский университет
2
Содержание
Стр.
Введение…………………………………………………………………………………..
Определение понятия «Воспаление»………………………………………………………
Этиология…………………………………………………………………………………
Патогенез альтерации…………………………………………………………………….
Медиаторы воспаления…………………………………………………………………..
Биогенные амины…………………………………………………………………
Полипептидные медиаторы………………………………………………………
Система комплемента…………………………………………………………….
Кининовая система и нейропептиды……………………………………………
Липидные медиторы……………………………………………………………..
Сосудистая реакция при воспалении……………………………………………………
Патогенез экссудации и виды экссудатов……………………………………………….
Проницаемость сосудов при воспалении……………………………………………….
Краевое стояние и эмиграция лейкоцитов………………………………………………
Механизмы маргинации и диапедеза. Взаимодействие
лейкоцитов и эндотелия. Молекулы клеточной адгезии…..…………………………..
Фагоцитоз: его участники и неоднозначные последствия……………………………..
Стадии фагоцитоза, их механизмы и расстройства…………………………….
Патогенез пролиферации: противовоспалительные механизмы………………………
Регуляторы регенерации и фиброплазии………………………………………..
Воссоздание ткани при регенерации и фиброплазии…………………………..
Особенности хронического воспаления…………………………………………………
Изменения в целостном организме……………………………………………………...
Ответ острой фазы………………………………………………………………..
Главные медиаторы острой фазы………………………………………………..
Воспаление и реактивность……………………………………………………………..
Тестовые задания……………………………..…………………………………………..
Эталонные ответы на тестовые задания…… …………………………………………
Литература………………………………………………………………………………..
ПРЕДИСЛОВИЕ
Учебно-методическое пособие «Воспаление» предназначено главным образом студентам
второго и третьего курсов медицинского и медико-биологического факультетов, но может
оказаться полезным врачам, ординаторам, субординаторам и аспирантам, так как охватывают
материал не только теоретического, но и клинического характера.
Основное назначение материалов «Учебного пособия» – помочь студентам, обучающимся,
экзаменующимся и занимающимся самостоятельно объективно оценить уровень собственных
знаний по наиболее распространенному типовому патологическому процессу как
«Воспаление». В теоретическом блоке можно найти эталоны ответов на 67 тестовых заданий.
Среди предложенных в каждом тестовом задании эталонных ответов даются не только
положительные и отрицательные, но и ложноотрицательные сведения. Тем не менее,
значительная их часть несет правильную информацию, однако, поскольку она
запрограммирована в форме вопроса, у читателя всегда возникает некоторая доля сомнения в
правильности выбранного им ответа.
3
Для корректного ответа на поставленные вопросы требуется настойчивая и кропотливая
работа, ибо при кажущейся простоте выбрать среди однотипных именно «тот самый ответ»
представляется не легкой задачей. Механически же заучить ответы на все тестовые задания в
виде буквенных и цифровых выражений практически невозможно. Однако определенный запас
теоретических знаний по общим типовым патологическим процессам заметно облегчает поиск
правильного ответа и успешное завершение задачи в целом.
Составляя «Учебное пособие», мы исходили из того, что при освоении значительных
объемов информации студент или слушатель не всегда может отделить «зерна от плевел»,
главное от второстепенного. Поэтому методические разработки должны обеспечить глубокое
осмысливание знаний, почерпнутых из лекционного курса, учебников и учебных пособий, в том
числе из теоретического блока настоящей книги. С этой целью ответы на многие вопросы
патофизиологии «Воспаления» даны в форме положений, охватывающих различные стороны
этиологии, патогенеза и сути воспалительного процесса в целом и отдельных его этапов.
Итоговая оценка по тестовому контролю определяется по общепринятым в педагогике
критериям. «Удовлетворительно» ставится в том случае, если экзаменуемый, отвечая на по-
ставленные вопросы, «набрал» из предложенного стандартного объема ответов более 66%
(практически 70%) всей заложенной в них информации. Если этот объем составил менее 66%
(практически менее 60%) – «неудовлетворительно», а более 80% – «хорошо» и «отлично» (более
90%).
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «ВОСПАЛЕНИЕ»
Острое воспаление (inflammatio, phlogosis) – это типовой патологический процесс,
который возникает в васкуляризованных тканях на действие повреждающего
(флогогенного) агента и проявляется местно альтерацией (деструкцией клеток и тканей),
изменениями микроциркуляции, проницаемости сосудов (экссудацией) и эмиграцией
лейкоцитов в сочетании с пролиферацией тканей. Таким образом, внутренними
компонентами воспаления являются альтерация, экссудация и пролиферация. Выше
описанные внутренние компоненты сопровождают любую воспалительную реакцию, но в
зависимости от преобладания того или иного из них можно выделить альтеративное,
экссудативное и пролиферативное воспаление. C точки зрения эволюции, воспаление
формируется как защитно-приспособительная реакция организма на действие патогенных
факторов, направленная на локализацию, уничтожение и удаление флогогенного агента, а также
на устранение последствий его действия.
Изучая латинский язык, первокурсник-медик навсегда усваивает знаменитое латинское
«-itis,-itidis». Однако не только процессы с типичным грамматическим окончанием в названии
(панкреатит, дерматит, ринит, гломерулонефрит...) являются, по сути, воспалением.
Разнообразие воспалений значительно шире. Воспаление составляет суть таких разных
процессов, как ушиб, ожог, обморожение, абсцесс, бронхиальный астматический приступ и
многих других болезней.
ЭТИОЛОГИЯ
Причинами воспаления являются многочисленные флогогенные факторы, которые при
своем действии на организм превосходят адаптивные возможности тканей. По происхождению
все флогогенные раздражители объединяют в две большие группы – экзогенные и эндогенные.
К экзогенным относят инфекционные и неинфекционные агенты. К инфекционным
биологическим факторам мы будем относить действие бактерий, вирусов, грибов, паразитов и
их токсинов; к неинфекционным биологическим агентам – животных и насекомых, действие
чужеродных белков и т.п. Среди других экзогенных факторов выделяют (1) физические
(электрический ток, лучистая энергия, ультразвук, тепло-холод и др.); (2) механические
(давление, разрыв, инородное тело и др.); (3) химические (кислоты, щелочи и др.); (4)
4
психогенные факторы (известны случаи возникновения и развития отдельных признаков
воспаления под гипнозом).
К эндогенным флогогенным агентам относят камни и отложение солей (при уремии,
желчно-каменной болезни, камнях почек, подагре и т.п.), продукты тканевого распада,
злокачественные опухоли, тромбы и эмболы, иммунные комплексы антиген-антитело при их
фиксации в органах, некоторые физиологические раздражители, а также сапрофитную
микрофлору.
Общая картина событий при остром воспалении может быть представлена в виде
последовательности:
1. АЛЬТЕРАЦИЯ:
а) Первичное повреждение;
б) Вторичное самоповреждение;
2. ЭКССУДАЦИЯ:
а) Сосудистые реакции:
1. Ишемия;
2. Артериальная гиперемия;
3. Смешанная гиперемия;
4. Венозная гиперемия;
5. Смешанный стаз.
6) Экстравазация жидкости:
в) Маргинация лейкоцитов;
г) Эмиграция лейкоцитов;
д) Внесосудистые процессы;
1. Хемотаксис;
2. Фагоцитоз;
3. ПРОЛИФЕРАЦИЯ:
1. Действие противовоспалительных механизмов;
2. Активация фибробластов;
3. Фиброплазия и ангиогенез репарация.
ПАТОГЕНЕЗ АЛЬТЕРАЦИИ
Альтерация – необходимый для уничтожения флогогенного агента компонент процесса.
Комплекс изменений, вызванных непосредственным действием повреждающего агента,
называют первичной альтерацией. Она является результатом разрушения ткани флогогенным
агентом и тем самым пролонгирует последствия воздействия причины воспаления, когда та уже
не действует на организм. В результате прямого повреждения тканей нарушаются транспортные
и биоэнергетические систем клетки, которые локализованы в мембранах. Альтеративные
изменения особенно выражены в высокодифференцированных тканях, выполняющих сложные
функции (нейроны, мышцы, паренхиматозные органы). Расстройства биоэнергетики клеток и
тканей, повреждение мембран приводит к повышению их проницаемости: из клеток выходит их
содержимое, а в цитоплазму поступают вещества околоклеточной среды – натрий и вода.
При первичной альтерации имеют место все закономерности, представленные ниже,
включая дистрофические процессы, некробиоз, некроз и апоптоз клеток. Повреждение прямо
провоцирует ацидоз, накопление калия в очаге воспаления, нарастание числа внеклеточных
молекул и повышение осмотического давления.
Результатом повреждения нервных окончаний могут быть боль, спазм сосудов,
гиперемии и стаз.
5
Вторичная альтерация. Продукты первичной альтерации и клетки-участники воспаления
вызвают вторичное самоповреждение тканей. Существуют гуморальные и клеточные агенты вторичной
альтерации. Важнейшими гуморальными агентами вторичной альтерации являются следующие
аутокоиды:
1. Активные кислородные и кислород-галогеновые радикалы;
2. Оксид азота;
3. Конечный продукт активации комплемента;
4. Гидролитические ферменты лизосом;
5. Фактор некроза опухолей (ФНО);
6. Катионные антибиотические белки;
7. Эозинофильные цитотоксические белки;
8. Лактоферрин.
1. Активные кислородные и кислород-галогеновые радикалы освобождаются при гибели
клеток в результате первичного повреждения и при экзоцитозе.
2. Оксид азота, который, в принципе, также является активным кислородсодержащим
радикалом, выделяется активированными макрофагами и эндотелиальными клетками в
результате метаболизма аргинина и оказывает мощный неселективный цитотоксический эффект
как на клетки паразитов и бактерий, так и на собственные клетки.
3. Конечный продукт активации комплемента – мембрано-атакующий комплекс С
5
-С
9
,
способный нарушать целостность мембран клеток. Избирательность этой эффекторной системы
обеспечивается иммуноглобулинами, так как комплемент активируется на клетках, помеченных
антителами или иммунными комплексами. Полимеризация факторов мембранной атаки ведет к
формированию порообразных структур, являющихся своего рода порами, через которые внутрь
клетки проходит кальций, запускающий процессы альтерации и гибели клетки.
4. Гидролитические ферменты лизосом (нейтральные и кислые протеазы, липазы,
гликозидазы, фосфатазы), освобождаются при некробиотической гибели клеток и при
экзоцитозе и далее способные разрушать компоненты межклеточного вещества, мертвые клетки
и компоненты их поверхностного аппарата. Видоизмененные лизосомы гранулоцитов
формируют так называемые гранулы. Большая часть лизосомальных гидролаз освобождается из
крупных азурофильных гранул, а некоторые (коллагеназа, щелочная фосфатаза) – из мелких
специфических (вторичных) гранул. Нейтральные протеазы (коллагеназа, эластаза, катепсины,
желатиназа) могут разрушать коллаген, эластин, базальные мембраны, фибрин межклеточного
вещества, а также активировать полипептидные каскадные медиаторные системы, например,
сторожевую полисистему плазмы. Кислые протеазы способны разрушать гликопротеиды и
протеогликаны, а гликозидазы – гликозаминогликаны основного вещества соединительной
ткани и компоненты бактериальных клеточных стенок. Относящийся к последней группе
фермент мураминидаза имеется в обоих типах гранул. Он известен также под названием
лизоцим. Особую роль играют маркерные гидролазы тучных клеток и базофилов – триптаза и
химаза, разрушающие хондроитинсульфаты сосудистой стенки, а, возможно, также
устраняющие хондроитинсульфат А, ослабляющий действие перфорина при киллинг-эффекте
клеточной цитотоксичности.
Показано, что лизосомальные ферменты не способны сами разрушать интактную
клеточную стенку бактерий, что заставило переоценить их роль в бактерицидных событиях, где
они скорее потенцируют действие более мощных агентов альтерации — активных кислородных
радикалов (АКР). Действие большинства лизосомальных ферментов (например, гликозидаз и
некоторых протеаз) требует кислой среды, что повышает их роль в разгар воспаления при
ацидозе.
5. Фактор некроза опухолей (ФНО) – продукт активированных макрофагов и Т-
лимфоцитов способен вызывать апоптоз и некроз опухолевых, а в высоких концентрациях и
некоторых собственных клеток, например, гепатоцитов. Вместе с интерлейкином-1 (ИН-1) и γ-
6
интерфероном ФНО усиливает генерацию в очаге воспаления оксида азота и других активных
кислородсодержащих радикалов. ФНО имеет две разновидности -, известную как кахексин, и
-, ранее называвшуюся лимфотоксин.
6. Катионные антибиотические белки представляют собой группу протеинов, богатых
аргинином и цистеином. Они обладают наибольшей активностью при нейтральных значениях
рН. Эти агенты представлены в макрофагах и, особенно, в азурофильных гранулах
нейтрофилов. Катионные белки встраиваются в мембраны клеток-мишеней и повышают их
ионную проницаемость, формируя ионный канал.
7. Эозинофильные цитотоксические белки (катионный белок эозинофилов и главный
основной белок эозинофилов). Эти агенты при относительно низкой бактерицидной
активности, обладают способностью повреждать и убивать паразитов, в частности, гельминтов
и их личинок.
8. Лактоферрин – бактерицидный белок нейтрофилов, действие которого основывается
на связывании в нейтральной и кислой среде железа. При этом бактериальные клетки теряют
способность размножаться и испытывают блокаду железо-зависимых ферментов, в том числе,
окислительных.
Гуморальные механизмы вторичной альтерации могут быть связаны и с действием
аутоантител. При этом аутоантитела могут опосредоватъ свое разрушающее действие через
другой гуморальный агент – комплемент, индуцируя в качестве опсонинов аутофагоцитоз, но
могут провоцировать и антителозависимые механизмы клеточной цитотоксичности. Защищаясь
от экзогенных агентов первичной альтерации – микроорганизмов, иммунная система выбирает в
качестве мишеней такие важные компоненты бактерий, как белки теплового шока (БТШ).
Теоретически, это должно эффективно ослаблять резистентность бактериальных клеток к
повреждению.
Наряду с гуморальными механизмами вторичной альтерации, исключительную роль,
особенно, при гиперергических реакциях замедленного типа, то есть при продуктивном
хроническом гранулёматозном воспалении, играют клеточные механизмы самоповреждения.
Среди клеточных механизмов выделяют:
1. Нейтрофильный и макрофагальный фагоцитоз;
2. Клеточно-опосредованную цитотоксичность;
3. Антителозависимую клеточную цитотоксичность.
> Нейтрофильный и макрофагальный фагоцитоз, при котором фаголизосома использует
для цитотоксического или бактерицидного эффекта многие из гуморальных агентов,
перечисленных выше, находящихся в ней в высоких концентрациях (кислородные и
галогеновые радикалы, гидролазы, дефензины, лактоферрин, азуроцидин).
> Клеточно-опосредованная цитотоксичность. Кроме внутриклеточного фагоцитарного
механизма вторичной альтерации, существуют и такие клеточные альтеративные механизмы,
которые не требуют поглощения клетки-мишени. Они известны под собирательным названием
«клеточно-опосредованная цитотоксичность» и могут быть условно разделены на
антителозависимую и не антителозависимую разновидность. Жертвами клеточной
цитотоксичности при воспалении могут быть не только опухолевые клетки и клетки
трансплантатов, но и бактериальные клетки, клетки, зараженные вирусами и иными
внутриклеточными паразитами, а также собственные интактные клетки организма (при
аутоиммунном воспалении, например, тироидите Хашимото).
В осуществлении этого механизма альтерации могут участвовать цитотоксические Т-
лимфоциты (Т-киллеры), нормальные киллеры (NK-клетки) и лимфоидные К-клетки, а также
макрофаги. При этом, по крайней мере, некоторые клетки, например, натуральные киллеры,
способны к обоим типам цитотоксичности.
> Антителозависимая клеточная цитотоксичность осуществляется профессиональной
группой К-клеток. К-клетки – условное название клеточных элементов любого происхождения
7
(Т-лимфоцитов, естественных киллеров, макрофагов и даже эозинофилов), имеющих Fc-
рецептор к иммуноглобулинам любого класса (чаще к G и Е) и способных реализовать
альтерацию путем антитело опосредованного прикрепления к клетке-мишени и фокального
цитотоксического удара. Поверхностный Fc-рецептор клетки распознает антитело,
прикрепленное к клетке-мишени, и обеспечивает контакт, необходимый для убийства. Способ
убийства зависит от гистологической принадлежности К-клетки.
При антителозависимой разновидности клеточной цитотоксичности клетка-мишень или
вирусные антигены на ней опознаются различными киллерами.
Т-киллеры дают избирательную альтерацию, так как опознают мишени клеточным
антигенным рецептором в контексте соответствующего белка главного комплекса
гистосовместимости (ГКГС).
Естественные киллеры (NK-клетки или нуль-клетки) – это клеточные элементы с
морфологией больших гранулярных лимфоцитов, которые, однако, лишены как поверхностных
иммуноглобулинов, так и Т-клеточных ангигенных рецепторов (антигенов СD
3
).
Способы убийства при цитотоксических клеточных взаимодействиях варьируют и
считается даже, что один клеточный тип может использовать несколько механизмов киллинга.
Наиболее хорошо изучен перфориновый механизм киллерного эффекта, представленный
в классическом виде при не антителозависимой цитотоксичности. Гранулы естественных
киллеров и многих Т-киллеров содержат мономерную форму белка перфорина, который
напоминает по структуре С
9
-фрагмент комплемента и его активатор серинэстеразу. После
контакта с клеткой-мишенью альтерации содержимое гранул освобождается, и перфорин
формирует пороподобные структуры в мембране мишени. Через образованные поры кальций
проникает в клетку-мишень и запускает процесс апоптоза. Киллер выживает при летальном
контакте, так как имеет в мембране антиперфориновый фактор («протектин»), оказавшийся, по
некоторым сведениям, противовоспалительным медиатором хондроитинсульфатом А.
Другой предполагаемый механизм киллинга заключается в инъекции цитотоксической
клеткой содержимого своих лизосом и пероксисом в клетку-мишень через каналы или
цитоплазматические мостики. Он, возможно, представлен и у лимфоидных, и у миелоидных
агентов вторичной альтерации. При этом мишень подвергается атаке практически всех
гуморальных агентов альтерации, вплоть до комплемента, активатор которого С
За
может
выделять макрофаг.
Наконец, цитотоксические макрофаги, нуль-клетки и Т-киллеры способны обрабатывать
клетки-мишени лимфотоксином, кахексином и цитотоксическим НК-фактором, которые
осуществляют отсроченный киллерный эффект с участием кальция, но без перфорина, и
опосредуют его через рецепторную индукцию апоптоза. Мощным синергистом этих агентов
является γ-интерферон, действующий как блокатор нуклеинового синтеза в клетке-мишени.
Существуют и иные способы клеточного киллинга, не зависящие ни от перфорина, ни от
кальция.
При альтерации повреждаются не только клетки. Характерная реакция межклеточного
матрикса на повреждение заключается в дезорганизации основного вещества соединительной
ткани (лизисе протеогликанов и гиалуроновой кислоты). Ослабляются цементирующие
свойства этих компонентов, повышается дисперсность межклеточных коллоидов и их
гидрофильность. Увеличивается проницаемость основного вещества.
Важным результатом первичной альтерации является синтез и активация ряда
медиаторов воспаления, в частности, арахидоновых производных, компонентов сторожевой
полисистемы плазмы крови, биогенных аминов, а также освобождение продуктов повреждения
и метаболитов, которые в совокупности ответственны за сосудистую реакций при воспалении и
начало экссудации. Таким образом, выход в ткани многочисленных лизосомальных
гидролитических ферментов знаменует собой наступление вторичной альтерации. Именно
поэтому Фриммер называл лизосомы стартовыми площадками воспаления. В связи с
8
дезорганизацией ферментных систем клетки нарастает (1) метаболический ацидоз – это сдвиг
реакции среды в очаге воспаления в кислую сторону со значений рН 7,25 до 5,3 ед. Нарушение
окисления жиров приводит к (2) кетозу, что дополняет явления метаболического ацидоза.
Нарушение упорядоченного движения ионов через мембрану приводит к (3) гиперионии. Так,
концентрация калия в очаге воспаления может увеличиваться в 5-10 раз (гиперкалийиония), что
ведет к (4) гиперосмии – повышению осмотического давления в очаге воспаления с 7,6 до 8-11
атмосфер). Гиперосмия ведет к образованию из крупных белковых молекул более мелких,
которые, в свою очередь, способствуют удержанию воды и развитию высокого давления за счет
белка – (5) гиперонкии. Образование мелких белковых молекул облегчается наличием ацидоза,
или (6) гиперН
+
ионии.
Преобладание интенсивности катаболических процессов в очаге воспаления при общей
интенсификации метаболических реакций получило образное выражение «пожар обмена»,
который длится до 2-3 часов. В этом случае потребление тканями воспалительного участка
кислорода возрастает на 35%. Дальнейшее течение воспаления определяется медиаторами
воспаления.
МЕДИАТОРЫ ВОСПАЛЕНИЯ
Вся вышеописанная динамика воспаления связана с сигнальным действием его
медиаторов. Медиаторы воспаления – это местные химические сигналы, образующиеся,
освобождаемые либо активируемые в очаге воспаления, действующие и разрушаемые также в
пределах очага.
Источники медиаторов – плазма крови (тканевая жидкость), либо клетки-участники
воспаления. Гуморальные медиаторы пептидной природы при воспалении активируются путем
ограниченного протеолиза.
Клеточные медиаторы могут синтезироваться заново (простагландины, ИЛ-1, ИЛ-2), а
также освобождаться в готовом виде из депо чаще всего путем дегрануляции или экзоцитоза из
структур, гомологичных фаголизосомам. Наиболее богатым спектром медиаторов,
освобождаемых и синтезируемых заново, обладает макрофаг. Кон образно называет эту клетку
«циркулирующим гепатоцитом» за ее необычайные биосинтетические возможности. Кроме
того, важными источниками клеточных медиаторов служат гранулоциты, тучные клетки,
эндотелиоциты и тромбоциты.
Поскольку большинство медиаторов многофункционально, вряд ли плодотворны
попытки классифицировать их по эффектам. Наиболее не противоречивой представляется
химическая классификация медиаторов по их строению (низкомолекулярные
кислородсодержащие радикалы, пептидные, липидные, полисахаридные медиаторы и
биогенные амины).
Биогенные амины
К данной группе относятся гистамин, серотонин, а также полиамины (спермин,
спермидин, путресцин, кадаверин). Гистамин поступает в очаг воспаления при дегрануляции
мастоцитов (с их рекордным содержанием этого медиатора – до 3,5 пг на клетку), а также из
базофилов (содержащих до 1 пг на клетку), тромбоцитов, эозинофилов и, в гораздо меньшей
степени, гладкомышечных клеток и эндотелия. Он образуется при посредстве
гистидиндекарбоксилазы из гистидина во всех клетках, но только тучные клетки накапливают
его в значительных количествах в гранулах. Отметим, что дегрануляция возможна в ответ на
различные стимулы:
> Связывание антигенов через гомоцитотропные иммуноглобулины и реагиновые
рецепторы (при анафилактическом воспалении).
> Связывание фрагментов комплемента – анафилотоксинов С
5a
и С
3а
, в меньшей мере С
4a
(при обычном и анафилактическом воспалении).
9
> Нейропептиды диффузной эндокринной системы, например, вещество Р (при астме,
вызванной физическими усилиями).
> Цитокины (ИЛ-1 и ИЛ-8) при гиперчувствительности замедленного типа (ГЗТ).
> Физические повреждения клеток (при механической или температурной травме).
> Агонисты простагландиновых рецепторов (изоцианаты синтетических красок и
герметиков при аллергоидной «астме новостроек»).
> Никотиновую кислоту (при аллергоидной крапивнице в ответ на витамин РР).
При воспалении гистамин вызывает расширение артериол и повышение проницаемости
венул. Он усиливает секрецию слизи, вызывает зуд и боль, способствует освобождению
кининов и липидных медиаторов. Другие его эффекты перечислены в таблице 1. Следует
отметить, что гистамин сужает крупные сосуды (что делает его участником анафилактического
коронароспазма) и, подавляя функцию номотопного водителя сердечного ритма (через H
1
-
рецепторы), способен вызвать аритмии, вплоть до фибрилляции (с участием Н
2
-рецепторов).
Эти эффекты смертельно опасны при аллергическом и аллергоидном шоке.
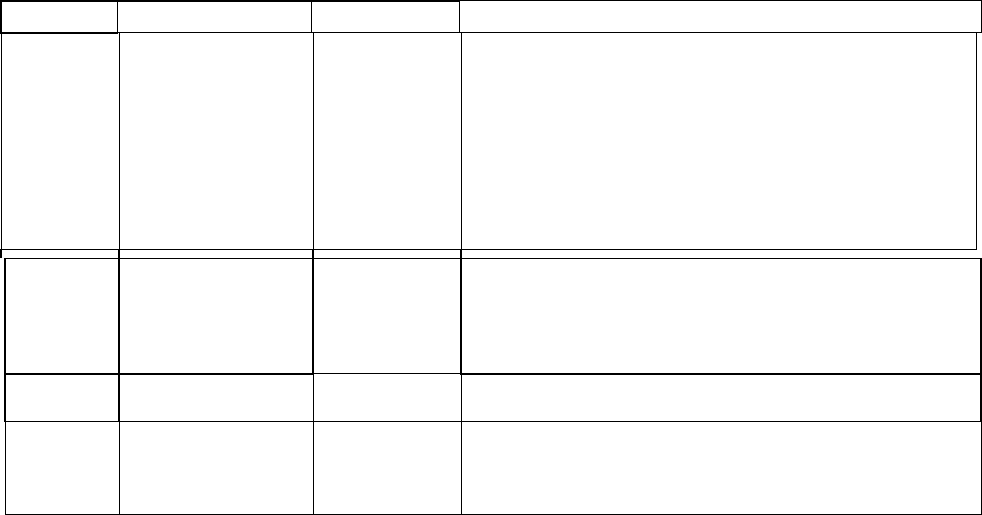
Таблица 1
Биогенные амины при воспалении
Медиатор Источники Способ
активации
Основные эффекты
Гистамин Мастоциты.
Тромбоциты,
базофилы,
эдотелиоциты,
гладкомышечные
клетки,
эозинофилы.
Преформиро
вание и
освобождени
е от гранул.
Н
1
- + Н
2
-рецепторы: боль, зуд, фибрилляция,
гиперсекреция слизи. Н
1
-рецепторы: активация
хемокинеза, бронхоспазма, и
лимфоцитотоксичности, генерация липидных
медиаторов, подавление номотопного водителя
сердечного ритма, повышение проницаемости.
Н
2
-репепторы: бронходилатация, расширение
артериол, аритмогенный эффект, торможение
Серотони
н
Энтерохромаффи
нные клетки,
тромбоциты,
эозинофилы, у
грызунов
Тот же. Агрегация тромбоцитов, бронхоспазм,
повышение проницаемости. Расширение
артериол, спазм поврежденных сосудов, мигрень,
стимуляция стероидогенеза.
Полиамин
ы
Все клетки. Синтез
заново.
Торможение экссудации, стимуляция
регенерации.
Адренали
н,
Норадрен
алин
Тромбоциты.
Преформиро
ваны,
дегрануляция
.
Снижение проницаемости, спазм сосудов,
агрегация тромбоцитов.
Действие гистамина не продолжительно из-за его инактивации.
Серотонин у человека в тучных клетках отсутствует. В связи с этим считается, что его
роль в воспалении у человека менее важна. Его источником могут быть тромбоциты,
эозинофилы, а в кишечнике – энтерохромаффинные клетки. Медиатор образуется из
триптофана и представляет собой 5-гидрокситриптамин.
В очагах воспаления освобождению серотонина способствуют агреганты и активаторы
тромбоцитов, в частности, фактор активации тромбоцитов и тромбин, а также иммунные
комплексы.
Серотонин имеет 4 типа рецепторов, действуя через которые он повышает
проницаемость венул, способствует агрегации тромбоцитов, активирует моноциты. В то же
время, он вызывает спазм гладких мышц в бронхах и неоднозначно влияет на сосуды.
Серотонин способен оказать прямой вазоконстрикторный эффект, особенно на венулы, внося
вклад в формирование стаза. На мозговые сосуды серотонин действует как вазоконстриктор
(возможно, его эффект опосредован нервами) и участвует в патогенезе мигрени. Серотонин как
10
