Сергеев О.С., Уксусова Л.И. и др. Типовые патологические процессы. Воспаление. Лихорадка. Повреждение клетки
Подождите немного. Документ загружается.


Миелоперокс
идазная
активность
Дефицит миелопероксидазы
(дефект миелопероксидазы).
Острый миелоидный лейкоз. Колхицин,
циклофосфан,
глюкокортикоид
ы, дапсон,
сульфоны.
Синдром Иова (по имени библейского страдальца) характеризуется гиперпродукцией IgЕ
и нехваткой IgA против различных микробов, протекает с проявлениями атонического
дерматита, которые сочетаются с холодными абсцессами, кандидомикозом, рецидивирующими
гнойными пневмониями. Отмечаются эозинофильный лейкоците и сниженные хемотаксис и
супрессорная активность лимфоцитов. Столь парадоксальный «аллергический
иммунодефицит», возможно, связан с дефектом рецепции какого-то из цитокинов. Маркером
синдрома служат сколиоз и аномалии лицевого скелета.
При дефекте белков гранул страдают не только специфические гранулы нейтрофилов, но
и отсутствует эозинофильное окрашивание гранулоцитов, а также функция α-гранул
тромбоцитов. Поэтому расстраивается не только фагоцитоз, но и образование белого тромба,
что выражается в рецидивирующих инфекциях кожи и ЛОР-органов, гипоергическом течении
воспаления, замедлении заживления ран и геморрагическом синдроме.
Комплексное расстройство фагоцитоза наступает при сахарном диабете, голодании,
гиперкортицизме, иммунодефицитах и сепсисе. При диабете это приводит порой к тому, что не
леченный больной первоначально обращается не к эндокринологу, а к дерматологу или хирургу
по поводу поражений кожи и слизистых, вызванного гноеродной флорой или грибками.
Так как тимические гормоны α-протимозин, тимопоэтин, спленопоэтин, тимусный
гуморальный фактор и тимулин стимулируют фагоцитоз, состояния с нарушением функций
тимуса, например, синдромы Ди-Джорджи и Незелова, сопровождаются ослаблением
фагоцитоза. Дефицит цинка в диете способен нарушить производство цинк-содержащего
тимулина, что отрицательно сказывается на иммунитете и фагоцитозе, в частности. У
новорожденных также имеется снижение нескольких функций фагоцитов, вследствие чего для
них характерен не завершенный фагоцитоз и персистирование возбудителей в фагоцитах.
ПАТОГЕНЕЗ ПРОЛИФЕРАЦИИ: ПРОТИВОВОСПАЛИТЕЛЬНЫЕ МЕХАНИЗМЫ
Пролиферация происходит в очаге воспаления все время. Примером служит
размножение местных тканевых макрофагов, которое особенно значительно в гранулёмах и
атеромах. Но главным условием успешного хода репаративного процесса при воспалении
служит затухание острых, альтеративных и экссудативных изменений. Это достижимо лишь
при условии полной деструкции или устранения флогогенного агента. Если флогогенный агент
полностью не устранен, воспаление может стать хроническим и не приведет к полной
реституции.
Второе условие перехода к репаративным процессам требует действия
противовоспалительных медиаторов. К противовоспалительным медиаторам относятся
ингибиторы экссудации и литических ферментов, инактиваторы провоспалительных
сигнальных молекул, антиагреганты, антикоагулянты и фибринолитики.
Наиболее важные из них следующие:
> Гепарин – медиатор из группы протеогликанов. Гепарин освобождается из гранул
мастоцитов, эозинофилов и базофилов, а также синтезируется макрофагами и фибробластами
заново. Гепарин связывает биогенные амины, ингибирует комплемент, коагуляцию, адгезию и
агрегацию, снижает активность кининовой системы. Вместе с тем, он служит структурным
компонентом межклеточного вещества соединительной ткани и участвует в процессах
регенерации в качестве строительного блока.
31
> Хондроитин-сульфаты – медиаторы той же группы. Их источники и эффекты близки к
гепариновым. Хондроитин-сульфаты входят в состав сосудистых стенок и значительно снижают
проницаемость гистогематических барьеров.
> Апопротеин Е – медиатор макрофагального происхождения. Противовоспалительное
действие данного медиатора связано с его иммуносупрессивной активностью. Кроме того,
апопротеин Е способствует транспорту стероидов, противовоспалительные эффекты которых
обсуждаются ниже.
> Ингибиторы протеаз – разнообразные белки макрофагального происхождения,
включая α
1
-антитрипсин, α
2
-микроглобулин, ингибиторы комплемента и плазмина,
трансформирующий фактор роста β. Данные медиаторы подавляют активность лизосомальных
гидролаз и сторожевой полисистемы плазмы крови, уменьшая альтерацию и ликвидируя
последствия экзоцитоза. Наиболее известен первый из перечисленных белков, так как его
наследственный дефицит ведет к усиленной альтерации бронхолегочного аппарата при
респираторных заболеваниях, что не позволяет закончить бронхит и пневмонию полной
реституцией и постепенно приводит к развитию генуинной эмфиземы легких, сопровождаемой
у ряда больных циррозом печени. α
1
-антитрипсин способен подавлять активность тромбина и
других протеаз системы коагуляции.
> Антиоксиданты – сульфгидрильные и металлосодержащие белки, инактивирующие
активные кислородные радикалы и липоперекиси или прерывающие разветвленные цепные
реакции в связи с хелатированием железа. В основном, антиоксиданты поставляются в очаг
воспаления макрофагами и плазмой крови, поскольку последняя в ходе преиммунного ответа
насыщается положительными глобулинами острой фазы, многие из которых проявляют
антиокислительные свойства. К данной группе относятся церулоплазмин, гаптоглобин,
гемопексин, транскобаламин, пероксидаза, супероксиддисмутаза, β
2
-микроглобулин, амилоид А
и С-реактивный белок.
> Инактиваторы воспалительных медиаторов разрушают сигнальные молекулы,
поддерживающие ход острого воспаления. Примером служит арилсульфатаза IIВ – фермент
эозинофильного происхождения, инактивирующий лейкотриены. По содержанию
арилсульфатазы эозинофилы превосходят другие гранулоциты в 8 раз. Кристаллы Шарко-
Лейдена, появляющиеся в мокроте при астматическом бронхите, содержат именно этот
фермент, а эозинопения, свойственная послеприступному периоду при бронхиальной астме,
возможно, связана с расходованием эозинофилов при попытке подавить гиперергическое
воспаление. Другие ферменты этой группы – гистаминаза и кининаза, также имеются у
эозинофилов и нейтрофилов. Гистаминаза способствует окислительному дезаминированию
гистамина в имидазолуксусную кислоту. В связи с высоким содержанием
противовоспалительных регуляторов некоторые авторы рассматривали эозинофилы, или, по
крайней мере, их специализированные популяции как понижающие регуляторы воспаления и
аллергии. Другие лейкоциты также содержат инактиваторы воспалительных медиаторов,
например, гистаминметилтрансферазу, деактивирующую гистамин.
> Действие гистамина на Н
2
-рецепторы вызывает противовоспалительные эффекты, а
именно бронходилатацию, ослабление хемокинеза и хемотаксиса нейтрофилов и эозинофилов,
генерацию цАМФ в лимфоцитах и иммуносупрессию. Возможно, изменение экспрессии
рецепторов гистамина в ходе воспалительных и аллергических заболеваний модулирует
продолжительность и исход этих процессов.
> Фрагменты реагиновых рецепторов отщепляются в ходе атопического воспаления от
поверхности клеток и оказывают ингибирующее действие на развитие анафилаксии.
> Полиамины (кадаверин, путресцин, спермин и спермидин), вырабатываемые
различными клетками при участии орнитиндекарбоксилазы, подавляют экссудацию и
оказывают стимулирующий эффект на клеточную пролиферацию. Первые два медиатора, ранее
32
мрачно именовавшиеся биохимиками «трупные яды», были впервые обнаружены в
некротических тканях.
Полиамины, возможно, служат универсальными внутриядерными посредниками
действия соматомединов, а через них – и соматотропина на процессы пролиферации. Среди
моноаминов выраженным стимулирующим действием на фиброгенез и синтез коллагена
обладает серотонин.
> Интерлейкин-10, выделяемый Т-лимфоцитами, служит ингибитором продукции
прочих цитокинов, блокирует функции Т-хелперов первого типа и может рассматриваться в
роли понижающего регулятора воспалительных, а в частном случае, аллергических процессов
различного типа.
> Липоксины, вырабатываемые нейтрофилами из арахидоновой кислоты, представляют
группу липидных противовоспалительных медиаторов. Некоторые простагландины и
лейкотриены также проявляют отдельные противовоспалительные эффекты, в частности,
иммуносупрессорные.
Среди системных регуляторов известное значение для затухания воспаления, особенно в
условиях противовоспалительной терапии, имеют глюкокортикоидные гормоны. Их
противовоспалительное действие связано со стимуляцией продукции макрофагальных
антифосфолипаз, тормозящих арахидоновый каскад, а также с подавлением экспрессии генов
интерлейкинов и индукцией апоптоза лимфоцитов и эозинофилов. Глюкокортикоиды снижают
интенсивность трансцитоза и блокируют в клетках-участниках воспаления некоторые
локомоторные функции, зависящие от цитоскелета. Они тормозят активность и экзоцитоз
коллагеназ и других протеаз. Большое значение для разрешения острой фазы воспаления имеет
функция лимфатической системы.
Воспалительный экссудат, содержащий медиаторы и клетки-участники воспаления, а
также причинные агенты процесса, дренируется лимфатическими сосудами в региональные
лимфатические узлы, представляющие собой фильтры в системе лимфообращения. За счет
функции обитающих в них иммунокомпетентных клеток лимфоузлы реализуют представление
антигенов и иммунный ответ. В лимфоузлах продолжается фагоцитоз и идет инактивация
медиаторов воспаления. Все эти процессы препятствуют системному распространению
медиаторов и возбудителей и представляют механизмы барьерности воспаления. Определенная
доза медиаторов проникает через лимфоидные фильтры в системный кровоток, запуская
преиммунный ответ (или ответ острой фазы), сопровождающий воспаление. Воспалительный
экссудат вовлекает в воспаление лимфатические сосуды, (лимфангиит) и лимфоузлы
(лимфаденит). При реактивном лимфадените увеличение лимфоузла обусловлено гиперплазией
его лимфоидных фолликулов и макрофагальных элементов под влиянием цитокинов. Если
инфекция персистирует в лимфоузле, то его увеличение сопровождается отеком окружающих
тканей, гибелью фагоцитов и образованием гноя (гнойный лимфаденит). Массированный
прорыв инфекционных агентов и медиаторов воспаления в системный кровоток ведет к
септицемии, пиемии и сопровождается гематогенной диссеминацией с образованием артритов,
гломерулонефритов, эндокардитов, а также системными эффектами, описанными выше,
тяжелейшей формой которых является септический шок. На пути патогенных агентов и
сигналов, проникших в системный кровоток, стоят в качестве последних барьеров макрофаги
селезенки, печени, костного мозга.
При успешном развитии воспаления действие противовоспалительных агентов приводит
к понижению интенсивности альтерации и экссудации.
РЕГУЛЯТОРЫ РЕГЕНЕРАЦИИ И ФИБРОПЛАЗИИ
Репаративные процессы, разворачивающиеся по мере затухания острой фазы
воспаления, сводятся к регенерации и фиброплазии.
Регенерация – это замена утраченных клеток клетками того же типа. Если полное
количественное восстановление паренхиматозных клеток невозможно, например, при потере
33
клеточных элементов, неспособных к делению, или при недостаточной регенерации паренхимы,
то происходит восполнение дефекта паренхимы соединительной тканью, или фиброплазия.
Формируется молодая, богатая регенерирующими высокопроницаемыми сосудами
грануляционная ткань, переходящая затем в соединительную ткань, оставляющую рубец.
Примером служит формирование очага кардиосклероза после инфаркта миокарда, плевральные
шварты при туберкулёзе, клапанные пороки сердца после эндокардитов, глиоз после
энцефалитов.
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия
достигаются как через усиление пролиферации, так и путем ограничения апоптоза клеток.
Роль макрофагов в репарации столь значительна, что многие старые авторы отстаивали
положение об их прямой трансформации в фибробласты (метаплазии). В настоящее время
считается, что фибробласты, как и другие новообразованные соединительно-тканные клетки,
происходят из полибластов, привлеченных и стимулированных макрофагальными медиаторами.
Классические представления отводили лимфоциту роль «трофоцита» в процессах
тканевого роста. Ранние представления о лимфоцитах как транспортерах нуклеопротеидов,
используемых тканью в качестве сырья для синтеза ДНК при пролиферации, сменились
концепцией «трефонов» – гуморальных усилителей пролиферации, выделяемых лейкоцитами в
культурах клеток. Хэберленду принадлежит мысль о «некрогормонах», то есть трефонах,
выделяемых in vivo при воспалении и некрозе ткани и контролирующих репаративный процесс.
Широко известны представления о «десмонах» – растворимых факторах, выделяемых в кровь и
культуральную среду регенерирующей тканью или лимфоцитами и переносящих
тканеспецифический митогенный стимул клеткам. Современная концепция репарации
преобразовала эти идеи следующим образом;
> Стимуляторами пролиферации и ограничителями апоптоза выступают, главным
образом, медиаторы воспаления, которые объединяют в сборную функциональную группу
факторов роста, происходящих из макрофагов, лимфоцитов, тромбоцитов, фибробластов и
других клеток (Таблица 10).
> Для самосборки тканей и их роста существенное значение имеют также распознающие
адгезивные гликопротеиды межклеточного вещества. В отличие от факторов роста они
фиксированы в тканях. Эти компоненты производятся макрофагами и фибробластами.
> Кроме этих регуляторов, известное участие в регуляции репаративных процессов
принимают гликопротеидные тканеспецифические ингибиторы роста, получившие название
кейлоны (от греческого «халао» – тормозить ход корабля), вырабатываемые эпидермисом,
нейтрофилами и некоторыми другими клетками (эндотелий, эритроциты, гепатоциты,
мезенхимальные клетки, в частности фибробласты). Наряду с кейлонами существуют сигналы
обратного действия – антикейлоны (мезенхимальный, фибробластный, гранулоцитарный).
Антикейлоны, впервые открытые в 1968 г. у гранулоцитов, рассматриваются как вытеснители
или блокаторы кейлонов, а их баланс, нарушаемый в пользу антикейлонов при гибели клеток,
как один из возможных регуляторов пролиферации в очагах воспаления. Однотипные клетки
при пролиферации производят нарастающие количества водо-растворимого кейлона,
действующего как аутокринный и паракринный тканеспецифический, кратковременный,
обратимый ингибитор роста, влияющий на G
1
, и G
2
фазы клеточного цикла. Вероятно, многие
антикейлоны идентичны факторам роста, молекулярно идентифицированным в более поздних
работах.
> Контактное ингибирование роста клеток достигается при распознавании некоторых
компонентов межклеточного вещества. Спермин и спермидин способствуют разрыву
заякоривающих клетки соединительной ткани связей между фибронектином и волокнистыми
белками и активации роста фибробластов.
> Ингибиторами роста для некоторых клеток служат те же цитокины, которые
стимулируют рост других: кахексин, трансформирующий фактор роста β и β-интерферон.
34

> Есть веские основания полагать, что стимулировать и ингибировать процессы роста
способны и тканеспецифические иммуноглобулины против определенных клеточных
рецепторов. По крайней мере, это совершенно твердо установлено для регуляции роста
щитовидной железы и, весьма вероятно, для печени.
Современная концепция гормональной регуляции репаративных процессов признает, что
системные эндокринные регуляторы, по-видимому, могут оказывать ограниченное как
тканеспецифическое, так и универсальное влияние на процессы роста и анаболизма, вообще, и
на регенерацию в очагах воспаления, в частности. Не подлежит сомнению трофическая роль
тропных гормонов гипофиза для клеток, регулируемых им периферических эндокринных желез
(например, ТТГ для тироцитов). Аденогипофиз выделяет в системный кровоток фактор роста
фибробластов. Выделяется гипофизом и эритропоэтин. В 1983 г. обнаружено, что ангиотензин-
2, в том числе и происходящий из гипоталамо-гипофизарной системы, стимулирует
пролиферацию клеток клубочковой зоны коры надпочечников. Тимус является важным
источником ростовых и дифференцированных гормонов для лимфоидных клеток. Среди них α-
протимозин (16 kD), стимулирующий созревание Т-лимфоцитов-предшественников и
усиливающий их ответ на митогены, тимопоэтин (5,562 kD) и спленопоэтин (5,6 kD),
стимулирующие дифференцировку Т-клеток, цинк-содержащий гормон тимулин [он же
сывороточный тимический фактор (876 D)], стимулирующий пролиферацию и
дифференцировку Т-лимфоцитов-предшественников и не идентифицированный в чистом виде
гипотетический стероидный гормон тимуса – тимостерин, способный восстанавливать до
нормы количество лимфоцитов в крови безтимусных мышей. Химические ростовые гормоны
вырабатываются, в основном, эпителием субкапсулярной и медуллярной зоны тимуса,
спленопоэтин, как указывалось выше, производится также селезенкой.
Таблица 10
Характеристика ростовых факторов
Наименовани
е
Источники Характеристики Мишени
Фактор роста
эпидермиса
Эпителиальные
клетки и железы
эпителиального
происхождения,
петля Генле,
макрофаги,
Полипептидный стимулятор
пролиферации и созревания
эпителиев и их производных,
стимулирует ангиогенез.
Различные
эпителиальные
клетки, гепатоциты,
фибробласты,
производные кожи.
Трансформир
ующий
фактор роста
α
Макрофаги,
фибробласты,
эпителий, клетки
саркомы.
50 аминокислот, гомологичен ЭФР,
инициирует ангиогенез.
Те же.
Тромбоцитар
ный фактор
роста
α-гранулы
тромбоцитов,
активированные
макрофаги,
фибробласты,
гладкомышечные
клетки, эндотелий.
Термостабильный катионный
гетеродимерный гликопротеид с
высоким содержанием цистеина и
м.м. 30 kD
. Стимулирует миграцию,
пролиферацию и синтез белка в
клетках-мишенях и обладает
провоспалительным эффектом.
Гладкомышечные
клетки,
фибробласты,
макрофаги,
синовиоциты,
стимулирует синтез
коллагена.
35
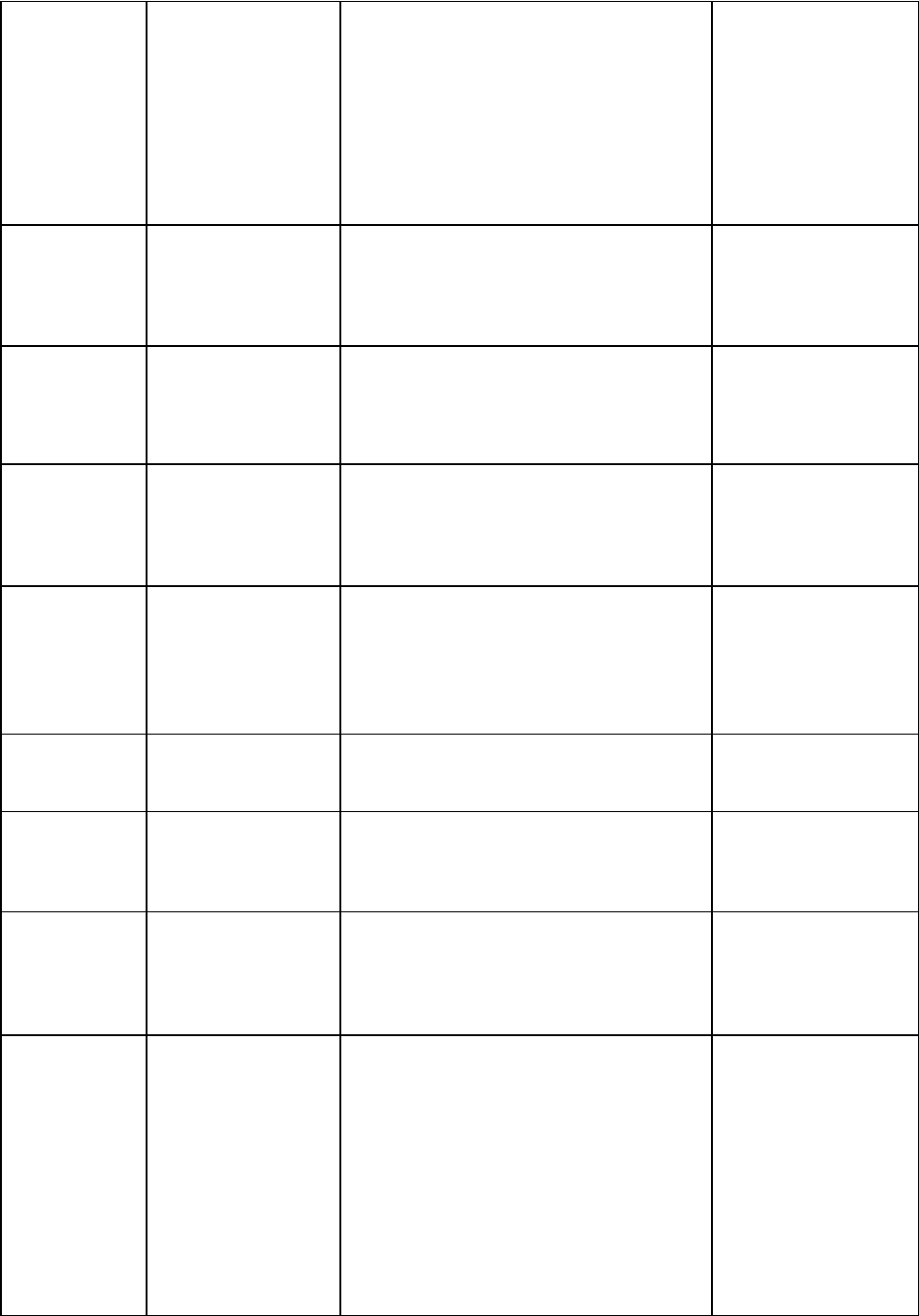
Трансформир
ующий
фактор роста
β
Макрофаги, Т-
лимфоциты,
эндотелиоциты,
тромбоциты,
эпителий тимуса.
Стимулирует фиброгенез
(стимуляция синтеза коллагена
фибробластами, стимуляция синтеза
фибронектина, ангиогенеза,
хемоаттрактант фибробластов),
ингибитор протеолиза. В малых
концентрациях стимулирует
пролиферацию через индукцию
тромбоцитарного фактора роста, в
Фибробласты,
лимфоциты,
эпителий тимуса.
Инсулинопод
обный фактор
роста 1
(соматомедин
С)
Печень,
хондроциты,
гипофиз, почки,
желудочно-
кишечный тракт,
Основной белок с м.м. 7, 6 kD, на
50% гомологичен проинсулину,
секреция стимулируется СТГ и
хорионическим пролактином,
стимулирует рост тела в
Хондроциты,
остеобласты,
мышцы,
паренхиматозные
органы и др.
Инсулинопод
обный фактор
роста 2
(соматомедин
А)
Те же, что для
инсулиноподобног
о фактора роста 1.
На 70% гомологичен ИПФР-1 ,
стимулирует рост тела в
эмбриональном периоде, действует и
на первом году внеутробной жизни.
После первого года
внеутробной жизни
активен только в
отношении зубных
зачатков.
Фактор роста
эндотелиоцит
ов (фактор
сосудистой
проницаемост
Эндотелиоциты,
макрофаги,
тромбоциты,
опухолевые
клетки.
М.м. 46 kD, стимуляция
пролиферации и повышение
проницаемости.
Эндотелиоциты.
Фактор роста
фибробластов
(ФРФ)
(кислый)
Активированные
макрофаги, Т-
лимфоциты
(вырабатывают
специализированн
ый дермальный
Гепаринсвязывающий полипептид.
фиксируется к базальным
мембранам, стимулирует
пролиферацию всех клеток
сосудистой стенки, фактор
ангиогенеза.
Эндотелий,
фибробласты,
гладкомышечные
клетки, макрофаги.
Фактор роста
фибробластов
(основной)
Нервная ткань,
гипофиз.
Близка к кислому фактору, менее
значительная активность в
ангиогенезе.
Микроглия,
эндотелий,
гладкомышечные
Фактор роста
печени
Макрофаги,
тромбоциты,
мезенхимальные
клетки.
Гликопротеид, м.м. 35-70 kD,
рецептор для которого является
продуктом онкогена met
. Необходим
для морфогенеза биполярного
Гепатоциты,
эпителий почки.
Эритропоэти
н
Перитубулярные
интерстициальные
клетки почек.
Макрофаги
печени,
Гликопротеид с м.м. 30 kD,
образуется в ответ на гипоксию и
продукты гемолиза; стимулирует
пролиферацию и ингибирует
апоптоз.
Эритроидные
клетки-
предшественники,
начиная с
колониеобразующи
Гранулоцитар
но-
моноцитарны
й
колониестиму
лирующий
фактор
Активированные
макрофаги,
лимфоциты,
фибробласты и
эндотелиоциты в
очагах воспаления
и костном мозге.
Гликополипептид с м.м. 25-30 kD,
127 аминокислот, освобождается в
ответ на стимуляцию лейкоцитов
цитокинами, антигенами и
эндотоксинами, а также из эндотелия
и фибробластов. Стимулирует рост
эритроидных, мегакариоцитарных
клеток-предшественников 2 и 3
классов, эозинофильных - 2, 3 и 4;
рост и дифференцировку
миелоидных и моноцитарных
Гемопоэтические
клетки-
предшественники,
лейкоциты в очагах
воспаления.
36

Гранулоцитар
ный
колониестиму
лирующий
фактор
Активированные
макрофаги,
фибробласты в
очагах воспаления
и стромальные
клетки в костном
Среднемолекулярный гликопротеид.
Стимулятор пролиферации и
дифференцировки и ингибитор
апоптоза нейтрофилов, активатор их
функций в очагах воспаления.
Гемопоэтические
клетки-
предшественники,
лейкоциты в очагах
воспаления.
Макрофагаль
ный
колониестиму
лируюший
фактор
Активированные
макрофаги,
фибробласты,
эндотелиоциты в
очагах воспаления,
стромальные
клетки тимуса и
костного мозга.
Среднемолекулярный гликопротеид.
Стимулятор пролиферации и
дифференцировки и ингибитор
апоптоза моноцитов, активатор их
функций и пролиферации в очагах
воспаления.
Гемопоэтические
клетки-
предшественники,
лейкоциты в очагах
воспаления.
Интерлейкин-
1
Макрофаги,
фибробласты,
дендритические
клетки, тимоциты,
эндотелиоциты,
астроциты.
Гликопротеид с м.м. 17 kD. 152
аминокислотных остатка,
стимулятор размножения
мультипотентных стволовых клеток
и лимфопоэза. Стимулятор
фиброгенеза.
Мультипотентные
стволовые клетки,
миелоидные
полустволовые,
лимфоидные
клетки-
предшественники 2-
Интерлейкин-
2
Т-лимфоциты. Стимулятор пролиферации. Стимулированные
Т-лимфоциты.
Интерлейкин-
3
Тучные клетки, Т-
лимфоциты,
микроглия.
Гликопротеид с м.м. 28-31 kD, 152
аминокислотных остатка,
стимулирующий фактор для всех
нелимфоидных клеток-
предшественников, стимулятор
пролиферации и дифференцировки.
Базофильные
предшественники 2-
5 классов, тучные
клетки, остальные
миелоидные
предшественники 2-
Интерлейкин-
4
Т-лимфоциты,
особенно хелперы
2-го типа.
Гликопротеид с м.м. 17-20 kD. 112
аминокислотных остатков,
стимулятор роста и изотипической
селекции в пользу В-клеток,
вырабатывающих гомоцитотропные
Пре- В-лимфоциты,
протимоциты,
тучные клетки,
клетки
базофильного ряда
Интерлейкин-
5
Т-клетки,
особенно, хелперы
1-го типа.
Протеид с м.м. 45 kD 112
аминокислотных остатков,
стимулятор роста и изотипической
селекции в пользу В-клеток,
Пре-В-лимфоциты,
колониеобразующи
е предшественники
эозинофилов.
Интерлейкин-
6
Макрофаги,
лимфоциты.
Эндотелий.
Фибробласты,
эпителий тимуса.
Протеид с м.м. 26 kD, 184
аминокислотных остатка.
Стимулятор роста и
днфференцировки В- и Т-
лимфоцитов, полустволовых
миелоидных клеток. Стимулирует
В- и Т-лимфоциты
(по 3 класс
включительно),
полу стволовые
миелоидные
предшественники,
Интерлейкин-
7
Стромальные
клетки костного
мозга.
Полипептид – стимулятор
пролиферации лимфоидных клеток.
В- и Т-лимфоидные
стволовые клетки.
Кахектин (он
же фактор
некроза
опухолей)
Макрофаги,
активированные Т-
и В-лимфоциты,
эндотелий,
микроглия,
адипоциты,
тимоциты.
Полипептид с м.м. 17 (α) 20-25 kD
(β). Хемоаттрактант и стимулятор
роста и белкового синтеза
фибробластов.
Стимуляция
ангиогенеза, роста
синовиоцитов,
слияния макрофагов
гранулём в
гигантские
многоядерные
клетки. Стимулятор
37

Фактор роста
нервов
Нейроны, глия. Пролиферация, рост, морфогенез,
стимуляция миграции.
Симпатические
нейроны, эпителий
почки,
хемоаттрактант
Широко известно ростостимулирующее действие гипофизарного соматотропина, в
частности, на фибробласты, остеобласты, хондроциты, мышечную ткань и паренхиматозные
клетки внутренних органов. Эти эффекты особенно значительны в первые два десятилетия
внеутробной жизни. Секреция соматотропина аденогипофизом стимулируется соматокринином
гипоталамуса и тормозится гипоталамическим соматостатином. Уровень гормона роста и
зависимых от него соматомединов в крови служит фактором обратной связи для
гипоталамической секреции соматокринина и соматостатина. Гормон роста выделяется
импульсно, периодами по 10-15 мин, в основном ночью. Помимо прямого стимулирующего
эффекта на пролиферацию клеток и анаболизм аминокислот, соматотропин опосредует свое
действие через систему синтезируемых под его влиянием инсулиноподобных факторов роста –
соматомединов и инсулина.
Соматомедины – инсулиноподобный фактор роста 1 (он же соматомедин С, или ИРФ-1)
и инсулиноподобный фактор роста 2 (или ИРФ-2, близкий к охарактеризованному некоторыми
авторами соматомедину А), опосредуют стимулирующий эффект гормона роста на
орнитиндекарбоксилазу различных тканей, вырабатывающую непосредственные митогенные
агенты полиамины. ИРФ-1 активен после первого года внеутробной жизни с максимумом в
период пубертатного ростового скачка и некоторым снижением после 50 лет. ИРФ-2 действует
только внутриутробно и на первом году жизни, сохраняя некоторое влияние в последующем
онтогенезе лишь в отношении роста зубов. Как соматомедины, так и сам гормон роста
связываются и инактивируются плазменными транспортными белками, которых существует не
менее семи. Инсулин, для которого соматотропин служит тропным гормоном, а соматостатин –
ингибитором секреции, оказывает отсроченные морфогенетические эффекты на фибробласты и
другие клетки, причем, частично, через рецепторы ИФР. Показано, что и гормон роста, и
инсулин способствуют образованию грануляционной ткани при воспалении.
Рост и заживление ран не тканеспецифически стимулируется и тироидными гормонами,
которые контролируют работу аминоацил-т-РНК-синтетаз, стимулируют секрецию
соматотропина и опосредуют эффекты ИФР-1 на хондроциты. При отсутствии тироидных
гормонов торможение ростовых процессов выражено сильнее, чем при дефиците
соматотропина.
Многие процессы регенерации при повреждении, например, сращение переломов,
стимулируются половыми стероидами. Андрогены сильно способствуют росту костей, хрящей
и мышц, а эстрогены обладают стимулирующим эффектом при малых и тормозящим – при
больших концентрациях.
Стероидные гормоны, вообще, могут оказывать как пролиферативные, так и
апоптогенные эффекты во многих тканях, действуя на цис-регуляторные элементы хроматина
клеток-мишеней после проникновения в комплексе с цитоплазматическими рецепторами в их
ядра. Классическими экспериментами Г. Селье была установлена стимуляция репаративных
процессов при повреждении минералокортикоидами и гормоном роста и их торможение под
действием глюкокортикоидов.
В отношении нервного контроля регенерации можно отметить, что подобные влияния
наиболее значимы, когда они опосредованы через местные факторы роста либо через
гипоталамо-гипофизарную систему. Поражение вентромедиального гипоталамуса и гипофиза
ослабляет интенсивность роста и ухудшает регенерацию. Показано, что высшие нервные
структуры оказывают действие на секрецию соматокринина и соматостатина, а последний даже
38
вырабатывается в коре больших полушарий (как, впрочем, и в островках Лангерганса,
дуоденальных апудоцитах и многих других органах).
Хотя достоверно показано, что денервация ран и очагов воспаления радикально не
отражается на процессах репарации, а десимпатизация даже ускоряет заживление ран, нельзя
отрицать, что некоторые факторы роста могут транспортироваться по нервам путем
аксонального тока и оказывать влияние на пролиферативные процессы в нервной ткани (фактор
роста нервов). Существует концепция взаимных трофических влияний иннервируемого органа
и нервной системы посредством пептидных трофогенов, распространяющихся по аксонам
ортоградно и ретроградно. Денервация органа способствует растормаживанию в нем
эмбриональных генетических программ, включая активацию пролиферации. Еще хирург
наполеоновской армии Ляррей отметил, что «...раны победителей заживают быстрее». С
развитием учения о стрессе стало ясно, что этот эффект во многом определяется продукцией
эндогенных опиатов и их иммуномодулирующим и регенераторным действием.
Регенеративный потенциал при воспалении сильно зависит от возраста. По
классическим данным, кожная травматическая рана площадью 20 см
2
заживает в 5 раз быстрее у
десятилетнего пациента, чем у шестидесятилетнего. Уровень обеспеченности организма
незаменимыми компонентами диеты, особенно, витаминами А, С, белком, в частности,
аргинином, стимулирующим продукцию ряда трофических факторов, и метионином,
инициирующим трансляцию, а для ряда тканей – витамином В и кальцием, заметно отражается
на ходе репарации при воспалении.
Не исключено, что определенную роль при стимуляции регенерации могут иметь чисто
физические сигналы – от передачи механического напряжения при контакте клеток, что
неоднократно демонстрировалось на примере зависимости регенерации костей от действия
физиологических нагрузок, и вплоть до влияния митогенного ультрафиолетового клеточного
излучения диапазона 190-320 нм.
Итак, хотя некоторые ростовые сигналы универсально производятся различными
клетками, а другие имеют центральное нейроэндокринное происхождение, следует еще раз
подчеркнуть, что главным источником факторов роста и других регуляторов пролиферации
выступают местные макрофаги. Именно эти долгоживущие участники воспаления, фагоцитируя
и синтезируя противовоспалительные медиаторы, способствуют расчистке строительной
площадки для капитального ремонта повреждений. Они выделяют активаторы и
хемоаттрактанты для главных эффекторов фиброплазии и восстановителей соединительно-
тканной стромы органа – фибробластов. Многие эффекты макрофагов на процессы
пролиферации увязаны с лимфокин-продуцирующей активностью Т-лимфоцитов. Спектр
цитокинов, выделяемых при воспалении, способен определять тип и интенсивность системных
пролиферативных реакций в костном мозге при воспалениях, отчего, в частности, зависит
характер сопровождающего воспаление лейкоцитоза. В-лимфоциты могут участвовать в
регуляции роста через росторегулирующие аутоантитела.
Под действием ростовых факторов происходят вовлечение стабильных находящихся в
G
0
-фазе клеток в митотический цикл или реже – укорочение цикла лабильных клеток.
Часть ростовых факторов непосредственно стимулирует синтез ДНК в клетках-мишенях
(факторы прогрессии), другие необходимы для подготовки в клетке рецепторов и ферментов,
отвечающих на факторы прогрессии (факторы компетентности). Ростовой эффект
обеспечивается сочетанным действием факторов обеих групп. Важно отметить, что
внутриядерные программы, активируемые ростовыми факторами, могут срабатывать и
неспецифически – при некробиозе клеток, гибнущих от ишемии, излучения и других
повреждении.
Общий механизм действия ростовых факторов изучен подробно. Ростовые факторы
взаимодействуют с цитоплазматическими рецепторами клеток-мишеней. После связывания
происходит димеризация и стимулируется тирозинкиназная активность этих рецепторов. Если
39
даже сам рецептор не является тирозинкиназой, он мобилизует тирозинкиназы внутри клетки.
Тирозинкиназы фосфорилируют и, таким образом, «включают» целый ряд внутриклеточных
белков, ответственных за пролиферацию клетки. Эти белки содержат пептид-гомолог онкобелка
SRC, позволяющий им взаимодействовать с фосфотирозином активированных рецепторов.
В результате происходит активация каскада, состоящего из нескольких групп белков.
Среди них:
1. Фосфолипаза Сγ, запускающая продукцию инозит-фосфатидов и диацилглицерина с
последующим освобождением из депо в цитозоль кальция и активацией серин-треониновой
протеинкиназы С. Протеинкиназа, в свою очередь, активирует другие внутриклеточные
мишени.
2. ГТФ-связывающие белки, в том числе, G-белки и RAS-белки. Последние под влиянием
активных рецепторов факторов роста переходят из ГДФ-связывающей в ГТФ-связывающую
форму и стимулируют фосфорилирование митоген-активируемых протеинкиназ (МАПК).
Каскад RAS-зависимого фосфорилирования может обрываться под влиянием белка-активатора
ГТФ-азы, зависящего от некоторых ингибиторов пролиферации, в частности, антионкогенов.
3. Белок Raf-1 – серин-треониновая протеинкиназа, включаемая как непосредственно
активными рецепторами факторов роста, так и белками семейства RAS. Этот фермент
дополняет и расширяет спектр активируемых МАПК.
4. Семейство энзимов МАПК продолжает каскад фосфорилирования, вовлекая в него
ядерные факторы транскрипции, белки-продукты клеточных протоонкогенов myc, fos и jun.
Последние известны как «немедленные гены предранней реакции». Данные гены срабатывают в
самом начале G
1
-фазы, и их активация не требует синтеза белка de novo. Позже, в середине G
1
и
при переходе к S-фазе, сигналы МАПК и кальмодулин-кальциевых посредников из цитоплазмы
активируют поздние гены регуляции роста. Для их активации требуется синтез белка de novo.
5. Белки-циклины представляют собой те члены каскада фосфорилирования, которые
контролируют финальные стадии процесса. В фазе G
1
значительно увеличивается концентрация
циклинов Е и D. Они формируют комплекс с протеинкиназой СDС2, запускающей репликацию
ДНК. В фазе G
2
индуцируется синтез циклинов В, которые связывают СDС2, активируют ее и
запускают митоз. После завершения митоза циклины разрушаются, и дочерние клетки должны
вновь накопить их в достаточном количестве, чтобы повторить митоз. СDС2 имеет в клетке
множественные мишени – белки, вовлекаемые в митоз, в частности, компоненты митотического
веретена. Работа циклинов нарушается под воздействием антионкогена р53, а также
антициклиновых антител и стимулируется онкогеном bcl-1.
Наиболее значимые факторы роста представлены в таблице 10. Для цитокинов из всего
разнообразия подконтрольных им реакций обозначены только эффекты, связанные с
пролиферацией и дифференцировкой.
Пролиферативные процессы при воспалении нацелены на воссоздание определенной
архитектуры ткани. Эта технологическая задача требует тонких молекулярных взаимодействий
размножающихся клеток с белками и полисахаридами межклеточного вещества. Некоторые из
подобных взаимодействий выяснены и обсуждаются в разделе «Воссоздание ткани при
регенерации и фиброплазии».
ВОССОЗДАНИЕ ТКАНИ ПРИ
РЕГЕНЕРАЦИИ И ФИБРОПЛАЗИИ
Самосборка тканей – одно из самых изумительных свойств живого организма. Его
проявления столь поразили выдающегося немецкого эмбриолога Г. Дриша (1911), что он
истолковал результаты своих экспериментов как доказательство справедливости витализма.
Дриш обработал суправитальным красителем бластулу зародыша тритона. Затем он подверг
действию пищеварительных ферментов in vitro окрашенную и не окрашенную бластулу другого
зародыша. Обе бластулы распались на бластомеры. Дриш смешал взвеси бластомеров двух
разных тритоновых зародышей в одном флаконе. Каково же было его удивление, когда
40
