Сергеев О.С., Уксусова Л.И. и др. Типовые патологические процессы. Воспаление. Лихорадка. Повреждение клетки
Подождите немного. Документ загружается.

сопровождается существенной экстравазацией жидкости, но требует от клетки больших
энергозатрат. При преодолении базальной мембраны могут иметь значение лизосомальные
коллагеназа и эластаза. Лимфоциты, помимо вышеописанного пути эмиграции, обладают
способностью проникать прямо через цитоплазму живых клеток сосудистой стенки, не
повреждая их. Это любопытное явление называется эмпериполез.
> Движение лейкоцитов к центру воспалительного очага, имеющее скорость порядка 20
мкм/мин. Оно носит характер хемотаксиса и рассматривается как первая фаза фагоцитоза.
Маргинация начинается со стадии артериальной гиперемии и продолжается вместе с
выселением лейкоцитов при венозной гиперемии и стазе. Полный стаз приводит к уменьшению
эмиграции и переносит центр событий во внесосудистое пространство, так как там активно
продолжаются хемотаксис и фагоцитоз.
МЕХАНИЗМЫ МАРГИНАЦИИ И ДИАПЕДЕЗА. ВЗАИМОДЕЙСТВИЕ
ЛЕЙКОЦИТОВ И ЭНДОТЕЛИЯ. МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ
По современным представлениям, основной механизм эмиграции лейкоцитов состоит в
комплементарных лиганд-рецепторных взаимодействиях между лейкоцитом и сосудистой
стенкой, причем появление рецепторов индуцируется медиаторами воспаления.
Группа молекул-регуляторов минимально представлена в покоящихся лейкоцитах и
эндотелиоцитах или, вообще, не экспрессирована на них (как ELAM-1). Кроме того, до
активации молекулы адгезии секвестрированы во внутриклеточных гранулах и не
функционируют. Часть из них распознает свои лиганды только после того, как первичная
альтерация и/или медиаторы воспаления вызовут в последних конформационные изменения.
При воспалении ряд медиаторов (фрагменты комплемента, лейкотриен В
4
, фактор активации
тромбоцитов, трансферрин, цитокины: ИЛ-1, ИЛ-8, -интерферон, ФНО и ФНО, пептидные
хемотаксические факторы: мастоцитарные факторы хемотаксиса нейтрофилов, эозинофилов и
базофилов, а также сами липополисахариды бактерий) вызывает освобождение молекул адгезии
и их лигандов из гранул, конформационные изменения, благоприятствующие их
комплементарным взаимодействиям и позже синтез молекул адгезии de novo. При этом часть
медиаторов индуцирует повышение клейкости только у лейкоцитов (лейкотриен В – на
нейтрофилах, факторы комплемента – на полиморфонуклеарах и моноцитах), часть действует
только на эндотелий (ИЛ-1, эндотоксины бактерий), а большинство стимулирует и адгезивность
лейкоцитов, и клейкость эндотелия (ФНО). Большинство медиаторов-усилителей адгезивных
свойств синтезируется лимфоцитами и макрофагами, но и сам эндотелий под влиянием
липополисахаридов бактерий, тромбина и ФНО способен вырабатывать, например, ИЛ-1.
Молекулы клеточной адгезии подразделяются на несколько семейств:
> Селектины – лектиновые молекулы клеточной адгезии (LECCFMs). Селектины
опосредуют самую раннюю стадию маргинации лейкоцитов – обратимую адгезию. Благодаря
взаимодействиям с их участием лейкоциты покидают осевой кровоток, претерпевают краевое
движение и краевое стояние. Таблица 6 содержит общую характеристику селектинов.
Взаимодействие селектинов с участием олигосахаридных остатков позволяет лейкоцитам
задержаться у эндотелиальных клеток. Селектины экспрессируются рано: пик эксрессии Р-
селектина, например, приходится на 7-8 мин после стимуляции эндотелия пупочной вены
кахексином.
Первым экспрессируется Е-селектин для нейтрофилов (поэтому именно эти лейкоциты
во многих случаях эмигрируют раньше других). Наиболее массированная экспрессия этого
селектина наступает уже через 20 мин после стимуляции эндотелия пупочной вены кахексином.
> Интегрины – димерные трансмембранные белки, экспрессируемые лейкоцитами и
другими клетками гемопоэтического ряда, фибробластами и клетками ряда внутренних органов.
Эндотелий экспрессирует лишь некоторые интегрины. Они ответственны за поздние стадии
адгезии активированных лейкоцитов и тромбоцитов к эндотелию и, частично, диапедез белых
21
клеток крови через стенку сосуда. Интегрины распознают трипептид арг-гли-асп (RGD) и,
возможно, другие, конформационно близкие детерминанты (Таблица 7).
При маргинации и диапедезе основными участниками являются
2
-интегрины LEA-1,
p150 CR3 (МАС-1) миелоидных и лимфоидных клеток. Они взаимодействуют с появляющимися
под воздействием цитокинов на эндотелиоцитах молекулами ICAM из числа членов
суперсемейства иммуноглобулинов. В то же время,
1
-интегрин VLA-4 взаимодействует с
экспрессируемым под влиянием цитокинов на эндотелиальных и некоторых
антигенпредставляющих клетках белком VCAM из того же суперсемейства. При
наследственном дефиците
2
-интегринов развивается синдром дефектной адгезии лейкоцитов,
приводящий к нарушению аккумуляции фагоцитов в очагах воспаления и затяжным инфекциям.
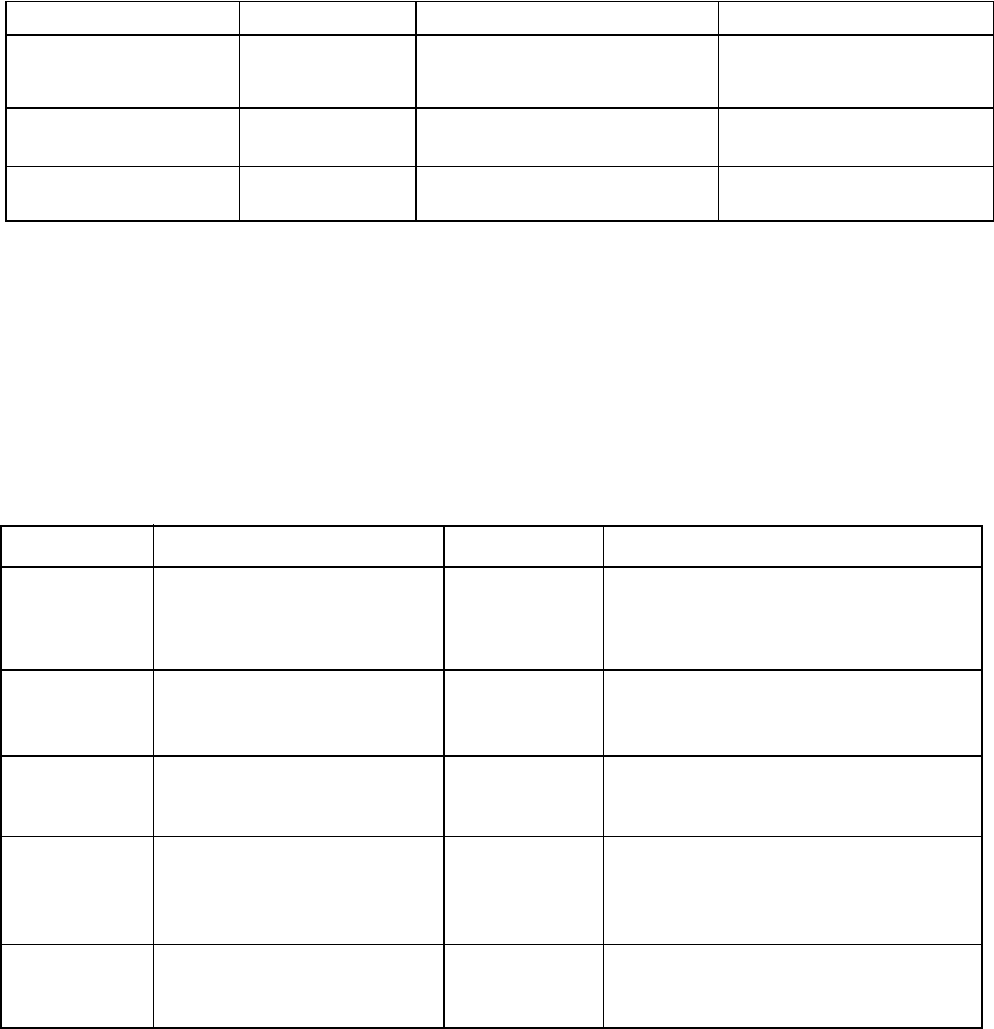
Таблица 6
Селектины и их функции
Селектин Источник Лиганды Функции
L-селектин (LAM-1) Все лейкоциты. Адресин лимфоузлов,
сиалированные
олигосахариды сосудистой
Маргинация, хоуминг
лимфоцитов.
Р-селектин (GMP-
140)
Эндотелий,
тромбоциты.
Сиалированные Льюис-Х
олигосахариды лейкоцитов.
Маргинация лейкоцитов,
адгезия тромбоцитов.
Е-селектин (ELAM-1) Эндотелий. Асиало-Льюис-Х антиген
нейтрофилов.
Маргинация
нейтрофилов.
> Белки суперсемейства иммуноглобулинов, участвующие в адгезии и экспрессируемые.
преимущественно, эндотелием, именуются ICAM. Это трансмембранные протеины с пятью
внеклеточными доменами, их экспрессия усиливается ИЛ-1, ФНО и -интерфероном (Таблица
8).
> Адресины – белки клеток внутренней выстилки высокоэндотелиальных венул. Эти
сосуды лимфоидных органов – место физиологической адресной миграции лимфоцитов и
других лейкоцитов, которое и опосредуется рецепцией адресинов.
Таблица 7
Интегрины и их роль
Интегрин Источник Лиганды Функции
VLA-1
(CD
49а
)
Эндотелий, моноциты,
фибробласты,
активированные Т-
лимфоциты, маркер Т-
Ламинин,
коллаген.
Рецептор адгезии активированных
лейкоцитов.
VLA-1
(CD
49b
)
Лимфоциты, моноциты,
макрофаги, тромбоциты,
гранулоциты.
Ламинин,
коллаген.
Рецептор адгезии активированных
лейкоцитов, тромбоцитов.
VLA-1
(CD
49c
)
Эндотелий, лимфоциты,
тироциты, почки, другие
внутренние органы.
Фибронектин,
ламинин,
коллаген.
Рецептор адгезии активированных
лейкоцитов.
VLA-1
(CD
49d
)
Т- и В-лимфоциты,
моноциты, тромбоциты.
Фибронектин,
VCAM-1,
сосудистый
адресин.
Рецептор внутриорганного
хоуминга Т-клеток памяти,
хоуминга лимфоцитов в пейеровы
бляшки, усилитель маргинации,
VLA-1
(CD
49e
)
Активированный
эндотелий, некоторые
лейкоциты, тромбоциты.
Фибронектин. Рецептор адгезии активированных
лейкоцитов, тромбоцитов, хоуминга
Т-клеток.
22

VLA-1 (CD
49f
) Активированные Т-
лимфоциты, тромбоциты,
внутренние органы.
Ламинин. Рецептор адгезии активированных
лейкоцитов.
LFA-1 (CD
11a
) Лимфоциты, моноциты,
макрофаги, гранулоциты.
ICAM-1, 2, 3. Рецептор адгезии лейкоцитов.
CR3 MO-1,
(CD
11b
)
НК-клетки, моноциты,
нейтрофилы.
ICAM-1, С
Зb.
Рецептор продуктов протеолиза 3
фактора комплемента, адгезии
активированных лейкоцитов.
CR4 (p150
(CD
11c
)
В-лимфоциты, макрофаг,
моноциты, НК, и
гранулоциты.
С
4b.
Рецептор продуктов протеолиза 4
фактора комплемента, адгезии
активированных лейкоцитов.
В очаге острого воспаления эмиграция лейкоцитов характеризуется очередностью. Хотя
для форсирования стенки сосуда отдельному нейтрофилу достаточно 3-12 мин, максимальная
скорость выхода нейтрофилов приходится на первые 2 часа, а максимальное накопление этих
клеток в очаге наступает к 4-6 часам.
Моноциты начинают эмиграцию вместе с нейтрофилами, но наращивают ее до 16-24 ч и
после этого срока преобладают в инфильтрате. Считается, что лимфоциты начинают
эмигрировать позже других лейкоцитов. Асинхронность эмиграции связана с неодновременным
появлением молекул клеточной адгезии и хемотаксических факторов, специфичных для разных
лейкоцитов.
Выходя из сосудов, лейкоциты проявляют положительный хемотаксис и приближаются к
носителям хемоаттрактивных детерминант, что составляет уже первую стадию фагоцитоза.
ФАГОЦИТОЗ: ЕГО УЧАСТНИКИ И НЕОДНОЗНАЧНЫЕ ПОСЛЕДСТВИЯ
Фагоцитоз – одно из самых блестящих открытий патофизиологии XIX века. И. И.
Мечников описал фагоцитоз в 1883 г. как общебиологическое явление в жизнедеятельности
одноклеточных и многоклеточных организмов, состоящее в поглощении клетками других
клеток и твердых частиц. В настоящее время под фагоцитозом понимают захват клеткой путем
рецепторного эндоцитоза при участии микрофиламентов объектов с диаметром более 1 мкм.
Таким образом, фагоцитоз – частный случай рецепторного эндоцитоза. Последний может
проявляться и в иных формах – трансцитоза, адсорбтивного и жидкофазного пиноцитоза.
Пиноцитоз не требует участия микрофиламентов, менее энергоемок и пригоден лишь для
захвата меньших по размеру объектов.
Таблица 8
Иммуноглобулиноподобные молекулы клеточной адгезии
Ig-
подобный
Источник Лиганды Функции
ICAM-1 Активированные
эндотелий, лейкоциты,
тромбоциты, эпителий
тимуса.
LFA-1,
CR3,
риновирус
ы,
Опосредует адгезию активированных
лейкоцитов, тромбоцитов и эндотелия.
ICAM-2 Эндотелий. LFA-1. Опосредует физиологическую эмиграцию
лейкоцитов.
ICAM-3 Все лейкоциты в покое. LFA-1. Межлейкоцитарная кооперация.
VCAM Активированный
эндотелий и
дендритические клетки.
VLA-4.
Хоуминг в пейеровых бляшках и фиксация
В-лимфоцитов в герминативных центрах,
транспорт лимфоцитов за
CD
2
Т-лимфоциты и НК-
клетки.
CD
58.
Кооперация клеток при презентации
антигенов, передает митогенный сигнал.
23

CD
58
(LFA-
3)
Большинство клеток, в
том числе все клетки
гемопоэтического ряда,
иммунокомпетентные и
антигенпредставляющие.
CD
2.
Кооперация клеток при презентации
антигенов, прикрепление киллеров к
мишеням.
У одноклеточных и низших многоклеточных фагоцитоз служит способом питания и
защиты. С появлением в филогенезе мезодермы функции защиты переходят к ее производным.
У высших животных фагоцитоз – не только способ защиты против экзогенных агрессоров, но и
один из механизмов устранения собственных состарившихся клеток и апоптотических телец в
ходе запрограммированной клеточной гибели на протяжении морфогенеза. Фагоцитоз
обеспечивает развитие преиммунного и иммунного ответов, устраняет из кровотока иммунные
комплексы, предупреждая иммунокомплексные болезни, утилизирует материал тромбов при
тромболизисе и участвует в рассасывании рубцов, устранении микроэмболов и патологических
продуктов обмена при тезаурисмозах. В ходе фагоцитоза его исполнителями реализуется
сложный комплекс защитно-приспособительных механизмов, которые включают не только
цитотоксическое или бактерицидное действие на объект фагоцитоза, но и секрецию медиаторов
воспаления (экзоцитоз), активацию энергетического метаболизма фагоцита (дыхательная
вспышка), процессинг антигенов и их представление лимфоцитам.
Подчеркивая важную роль фагоцитов при воспалении, Мечников говорил: «Нет
воспаления без фагоцитоза». Патофизиология оценивает справедливость мечниковских слов, но
это отнюдь не значит, что фагоцитоз не оказывает, наряду с саногенным, и патогенного
действия.
Участники фагоцитоза – фагоциты. Мечников выделял макрофаги и микрофаги,
впоследствии было установлено, что первые – это моноциты и их потомки. К последним
Мечников причислил гранулоциты.
Сейчас говорят о системе мононуклеарных фагоцитов (состав которой приведен выше) и
о полиморфонуклеарных фагоцитах, представленных, в основном, нейтрофилами. Способность
к фагоцитозу присуща также эозинофилам и базофилам, но для них этот вид деятельности не
является основным. В фагоцитозе, определенно, могут участвовать и тромбоциты, причем эта
их функция сильно стимулируется -фетопротеином. По некоторым данным, фагоцитировать
способны и некоторые пролимфоциты, но зрелые лимфоидные клетки фагоцитами не являются.
Эпизодически фагоцитируют даже клетки, не относящиеся к системе крови, например, нервные
и эпителиальные, не являющиеся профессиональными фагоцитами.
Нейтрофил – короткоживущая клетка. В крови он находится, в среднем, 12-14 ч, а в
тканях – не более 2-4 суток. При воспалениях нейтрофилы играют ту же роль, что ручные
гранаты при боевых действиях: это фагоциты одноразового использования, которые обязательно
гибнут при фагоцитозе, «разбрасывая» вокруг своего рода осколки – бактерицидные и
цитотоксические факторы и медиаторы воспаления, в том числе и нейтрофильный
хемотаксический фактор, привлекающий макрофаги, гранулоцитарный колониестимулирующий
фактор, способствующий восполнению их пула и нейтрофильный пироген, вносящий
некоторый вклад в стимуляцию преиммунного ответа организма.
Гибель нейтрофилов при воспалении связана не столько с кознями микробов, сколько с
тем, что они не выдерживают собственного мощного окислительного удара, наносимого по
флогогенным агентам системой продукции активных кислородных радикалов.
Не участвующие в воспалении нейтрофилы претерпевают апоптоз или экспрессируют
антиген стареющих клеток и фагоцитируются макрофагами («экспроприация
экспроприаторов»!). Остатки нейтрофилов и макрофагов, а также поврежденные клетки и
микроорганизмы формируют гной. При нейтрофильном экссудате гной особенно богат
миелопероксидазой, придающей ему зеленоватый цвет. Макрофаги лишены миелопероксидазы
и формируют гной иного оттенка. Компоненты бактерий, например, синегнойной палочки,
24
могут придавать гною особые, специфические цвет и другие свойства. Гной всегда проявляет
гидролитическую активность и может участвовать в распространении воспаления и инфекции,
что привело медицину к постулату «Ubi pus – ibi evacua».
Нейтрофилы отличаются менее широким репертуаром фагоцитируемых объектов, чем
макрофаги. Последние принципиально способны фагоцитировать практически все объекты,
доступные нейтрофилам (например, кокки и грибки), а также многие другие, не
фагоцитируемые гранулоцитами. Так, фагоцитоз опухолевых клеток, а также клеток,
зараженных вирусами и персистирующими интрацеллюлярными патогенами, является
исключительно макрофагальным.
В то же время, в фагоцитозе стафилококков, стрептококков, включая пневмококки,
диплококков и многих других возбудителей, условно обозначаемых как «гноеродная флора»,
роль нейтрофилов является решающей. Отчасти, именно поэтому скарлатина, гоноррея и
менингококковая инфекция, например, сопровождаются нейтрофильным, а коклюш, паротит и
мононуклеоз – моноцитарно-лимфоцитарным лейкоцитозом в крови и соответствующим
составом экссудатов.
Система мононуклеарных фагоцитов представлена как профессиональными фагоцитами,
так и антиген-представляющими клетками различной локализации. Это, прежде всего,
монобласты и промоноциты, моноциты и макрофаги костного мозга, пролиферация и
дифференцировка которых находятся под влиянием ряда последовательно действующих
цитокинов (плюрипотентного ростового фактора, ИЛ-6, ИЛ-1, ИЛ-3, GM-CSM), моноциты
периферической крови, проводящие в ней, в среднем, 1-2 дня и покидающие кровеносное русло
через высокоэндотелиальные венулы и синусоиды. В тканях моноциты превращаются в
альвеолярные макрофаги легких, плевральные, перикардиальные, суставные и перитонеальные
макрофаги серозных полостей, селезеночные макрофаги, клетки Купфера в печени, макрофаги
лимфоузлов, микроглию головного мозга, остеокласты костей, гистиоциты соединительной
ткани, мезангиальные макрофаги клубочков почек, эпителиоидные клетки. Фагоцитирующие
макрофаги особенно активны при метаболическом взрыве и экзоцитозе медиаторов воспаления.
Близкие к ним, но обособленные в функциональном и антигенном отношении антиген-
представляющие макрофагальные клетки – это клетки Лангерганса в коже, интердигитирующие
клетки тимуса и лимфоузлов, фолликулярные дендритические клетки герминативных центров.
Помимо фагоцитоза, они специализированы на взаимодействии с лимфоцитами, обладают
экспрессией белков ГКГС не только первого, но и второго класса, осуществляют процессинг
антигенов и их презентацию и выделяют клеточно-специфические хемоаттрактивные пептиды.
В тканях как при воспалении, так и в норме, макрофаги представляют собой
долгоживущие элементы и их участие в фагоцитозе и воспалении многократно. Более того, на
протяжении воспаления макрофаг, по-видимому, в пределах своей специализации может менять
спектр вырабатываемых медиаторов воспаления и влиять на его ход, не только управляя
процессами альтерации и экссудации, но и оперируя противовоспалительными сигналами,
участвуя в контроле и исполнении пролиферации и репаративного процесса в целом. Репертуар
объектов фагоцитоза у макрофагов очень широк. Уже отмечалось, что такие объекты, как
клетки, пораженные микобактериями, бруцеллами, риккетсиями, сальмонеллами,
токсоплазмами и листериями, иммунные комплексы, стареющие и снабженные неоантигенами
собственные клетки, мишени аутоиммунных процессов, практически подлежат только
макрофагальному фагоцитозу. Макрофаги не только выделяют, но и синтезируют заново
медиаторы воспаления, принадлежащие ко всем химическим группам.
Это важные источники арахидоновых производных и АКР, причем они обладают
значительным антиоксидантным потенциалом и, как правило, выживают при нанесении
окислительного удара по микробам и другим мишеням фагоцитоза. В отличие от нейтрофилов и
моноцитов крови, обладающих миелопероксидазой и генерирующих гипохлорит, зрелые
тканевые макрофаги не содержат данного фермента, поэтому спектр вырабатываемых ими АКР
25
богат перекисью водорода и гидроксильными радикалами, но не включает этот «естественный
отбеливатель». Это может способствовать их выживанию при фагоцитозе. Мононуклеары
способны вырабатывать биогенные амины и многие медиаторы, присущие нейтрофилам
(гидролазы, лизоцим). Макрофаги синтезируют компоненты сторожевой полисистемы плазмы
крови (включая факторы комплемента, факторы свертывания, предшественники кининов и
активатор фибринолиза плазминоген). В отличие от нейтрофилов, они выделяют транспортные
белки (трансферрин, транскобаламин, апопротеины липопротеидов), фибронектин,
противовоспалительные антиоксиданты и ингибиторы протеаз (
2
-макроглобулин, С-
реактивный белок,
1
-антитрипсин и другие положительные глобулины острой фазы плазмин).
ИЛ-1, кахексин и -интерферон также являются макрофагальными продуктами. Это делает
исключительной роль макрофагального фагоцитоза как процесса, обеспечивающего с помощью
этих цитокинов стартовые сигналы для преиммунного ответа – системного коррелята
воспаления. Продромальный синдром, включая лихорадку, распространенное повышение
адгезивных свойств эндотелия, гипоферремию, ускорение СОЭ и типовой сдвиг белковых
фракций в плазме крови, обеспечивается, в основном, макрофагальными цитокинами.
Истощение при хронических воспалениях и опухолевых процессах опосредуется действием
кахексина, значительная часть которого производится тоже активированными макрофагами.
Лейкоцитоз при воспалениях стимулируется не только нейтрофилами, но и
макрофагальными колониестимулирующими факторами. Макрофаги и, в еще большей степени,
близкие к ним антигенпредставляющие клетки, выделяют хемоаттрактанты и ингибиторы
миграции для лимфоцитов и гранулоцитов, участвующих в рекрутировании клеток в состав
экссудатов и гранулём. Мононуклеарные фагоциты – мощный источник стимуляторов
пролиферации и биосинтетической деятельности фибробластов (фактор роста, фактор
ангиогенеза). Они могут и тормозить размножение клеток (опухолевых, некоторых
бактериальных, например, туберкулезных и листериозных; а также лимфоидных). Доказано, что
макрофаги, в отличие от гранулоцитов, сами могут пролиферировать в очагах воспаления, хотя
их тканевой пул пополняется, по большей части, иммиграцией. Таким образом, роль
макрофагов, по сравнению с другими фагоцитами, становится особенно важной при
хроническом воспалении.
Наследственные и приобретенные нарушения в работе фагоцитов тяжело отражаются на
ходе воспаления и снижают его защитную эффективность.
СТАДИИ ФАГОЦИТОЗА, ИХ МЕХАНИЗМЫ И РАССТРОЙСТВА
Процесс фагоцитоза подразделяется на 4 стадии:
1. Приближение к объекту фагоцитоза;
2. Прилипание фагоцита к поверхности объекта (распознавание рецепторами
фагоцита опсонических детерминант объекта);
3. Погружение объекта в цитоплазму фагоцита;
4. Переваривание (или шире – киллинг-эффект, деградация объекта).
Приближение может быть и случайным, особенно, у фиксированных фагоцитов. Однако
главным его механизмом служит хемотаксис.
Хемотаксисом называется направленное движение живых клеток по градиенту
концентрации какого-либо распознаваемого ими вещества. Вещества, привлекающие клетки,
называются хемоаттрактантами. По сути дела, хемоаттрактивная чувствительность, присущая
всем лейкоцитам, включая не фагоцитирующие клетки – это прообраз обоняния на
одноклеточном уровне.
Хемоаттрактанты, если они имеются на поверхности выделяющего их объекта, являются
в то же самое время, и опсонинами, поскольку прямая ассоциация фагоцитарного рецептора
хемоаттрактанта с его лигандом обеспечивает опсонизацию, то есть способствует прилипанию
и дополнению клеточного «обоняния» своего рода осязанием. Например, и хемоаттрактантами,
и опсонинами служат специфические иммуноглобулины и факторы комплемента. Часть
26
хемоаттрактантов не является опсонинами, поскольку не присутствует на поверхности мишени
фагоцитоза, а лишь выделяется клетками-участниками воспаления. Таковы интерлейкины и
пептидные хемотаксические факторы.
Наряду с хемотаксисом различают хемокинез – явление не направленного увеличения
локомоторной активности клеток под влиянием медиаторов воспаления. Например, гистамин,
действуя на Н
1
-рецепторы нейтрофилов и эозинофилов, активирует их подвижность, но не
обязательно в направлении нарастающего градиента своей концентрации.
Фагоцитирующие клетки имеют поверхностные рецепторы хемоаттрактантов.
Хемоаттрактанты могут быть экзогенными и эндогенными, специфическими для определенного
вида лейкоцитов или же универсальными.
Основные группы хемоаттрактантов следующие:
> Микроорганизмы и их продукты, в частности, пентоды, содержащие М-формил-
метионин – аминокислоту, инициирующую синтез любого из прокариотических белков, но не
используемую трансляционной системой эукариот. Благодаря наличию у лейкоцитов рецептора
к трипептиду с этой аминокислотой, они обладают аттракцией к «прокариотам вообще», то есть
к той категории возбудителей, которая вызывает широчайший круг инфекционных воспалений.
Некоторые липидные компоненты микробных оболочек из состава их липополисахаридов
напоминают по строению арахидоновые производные и также оказывают универсальный
хемоаттрактивный эффект на лейкоциты. Например, полисахариды из состава таких
микроорганизмов привлекают нейтрофилы и макрофаги и напрямую связывают лейкоцитарный
рецептор комплемента CR
3
. Это делает их продукт зимозан и препараты из данных микробов, в
частности, пронермил. стимуляторами фагоцитоза и активаторами фагоцитов.
> Компоненты системы комплемента распознаются лейкоцитарными рецепторами и
оказывают хемоаттрактивный и опсонизирующий эффект. На лейкоцитах – лимфоцитах,
нейтрофилах, эозинофилах и макрофагах имеются несколько типов комплемент-
чувствительных рецепторов. Например, рецептор CR
1
-типа служит для фагоцитоза иммунных
комплексов. CR
2
является воротами для проникновения в лимфоциты, антиген-представляющие
клетки и эпителий носоглотки и шейки матки вируса Эпштейна-Барр. Таким образом, он
участвует в патогенезе инфекционного мононуклеоза.
> Продукты повреждения и метаболизма клеток являются хемоаттрактантами для
лейкоцитов. Клетки не обмениваются готовыми макроэргическими фосфатами и не передают
друг другу свои программы. Поэтому, значительные количества ДНК и АТФ попадают в
межклеточное пространство только при разрушении клеток. Следовательно, привлеченные ими
лейкоциты оказываются в эпицентре альтерации. Пуриновые рецепторы на поверхности
фагоцитов позволяют им двигаться в сторону нарастания концентрации этих метаболитов.
Данный эффект известен под названием некротаксиса. Хемоаттрактивными для макрофагов (и
фибробластов) являются и продукты деградации внеклеточных белков: фибрина (фибрин-
пептид В), коллагена, а также фибронектин и тромбин. Повреждение клеточных мембран ведет
к продукции арахидоновых метаболитов, многие из которых, особенно, лейкотриен В
4
, а также
гидроксиэйкозатетраеновые кислоты и тромбоксан А
2
, служат хемоаттрактантами для
нейтрофилов, макрофагов и эозинофилов.
> Некоторые другие медиаторы воспаления могут быть хемоаттрактантами, в том числе,
избирательными для тех или иных клеток. К ним относятся пептиды, привлекающие моноциты:
нейтрофильные катионные белки, С-реактивный белок, цитокины ИЛ-1 и кахексин,
тромбоцитарный фактор роста, трансформирующий фактор роста . Мастоциты выделяют
хемотаксические факторы для эозинофилов (содержит лейкотриен В
4
), нейтрофилов и
лимфоцитов. Макрофаги способны генерировать хемотаксические пептиды для нейтрофилов и
базофилов, в частности, именно так действует ИЛ-8. Макрофагальные продукты (фибронектин)
могут привлекать фибробласты. Фактор активации тромбоцитов (ацетилглицериновый эфир
27
фосфохолина), выделяемый макрофагами, гранулоцитами и эндотелием, оказывает мощное
хемоаттрактивное действие на все лейкоциты.
> Иммунные комплексы и иммуноглобулины, особенно классов М и G, распознаются Fc-
рецепторами лейкоцитов и оказывают хемоаттрактивный и опсонический эффект как через
факторы комплемента, так и непосредственно.
Перемещение лейкоцита обеспечивается структурами цитоскелета: микрофиламентами и
микротрубочками. Сопряжение функций цитоскелета и рецепции хемоаттрактанта достигается
с участием ионов кальция, проникающих в эктоплазму фагоцита через каналы, которые
открывают, занимая рецепторы, молекулы лиганда, а также выходящих из кальцисом.
Пострецепторное сопряжение внутри фагоцита осуществляется по типичному механизму,
вовлекающему систему G-белков.
Прилипание лейкоцитов к объектам фагоцитоза связано с распознаванием
поверхностных детерминант мишеней рецепторами фагоцитов.
Некоторые объекты, например, многие бактерии или грибки-сахаромицеты,
распознаются рецепторами экзогенных хемоаттрактантов напрямую. Определенную роль при
этом могут играть рецепторы формил-метионина и таких сахаров, как манноза и фруктоза.
Рецептор комплемента CR
1
связывает липополисахариды бактериальных клеточных стенок
напрямую. Но большинство объектов фагоцитоза нуждается в опсонизации, то есть
распознается только после прикрепления сывороточных факторов, к которым рецепторы
фагоцитов обладают значительным аффинитетом. Сывороточные факторы, играющие при этом
роль «адаптеров», называют опсонинами. Выше уже говорилось, что не все хемоаттрактанты
являются опсонинами.
Наиболее активны как опсонины иммуноглобулины (G
1
и G
2
, в меньшей степени М и Е).
Они распознаются Fс- или иными Fc-рецепторами. Фактор комплемента С
3b
и его
нестабильная форма iС
3b
(как при прямой активации объектами фагоцитоза, так и при активации
иммуноглобулинами и иммунными комплексами) также оказывают опсониновый эффект через
рецепторы CR
1
-CR
3
.
Опсонизация в несколько раз увеличивает активность прилипания, причем эффект
иммуноглобулинов и комплемента аддитивен. Опсонизация – мощный усилитель фагоцитарной
активности. Однако иногда и опсониновый эффект дает осечки или даже оборачивается против
организма.
Термин «опсонизация» может трактоваться расширительно. Фагоцитоз фибрина,
деградирующих белков соединительной ткани, нуклеопротеидов усиливается после
присоединения к ним фибронектина, что, по существу, делает этот макрофагальный продукт
опсонином при рассасывании тромбов, рубцов и клеточного детрита.
С-реактивный белок фактически также является ко-опсонином, так как связывает С-
белок пневмококков и других микробов и опосредует прикрепление к ним факторов
комплемента и фагоцитов. Сходным действием в отношении некоторых бактерий обладает
лизоцим.
Активацию фагоцитов подавляют некоторые продукты бактерий («агрессины»). Так,
микобактерии выделяют липоарабиноманнан, блокирующий ответ макрофагов на γ-интерферон.
При активации в фагоците происходит метаболический взрыв. При этом клетка
увеличивается, в ней резко усиливается интенсивность реакций пентозного пути и гликолиза,
распадается гликоген. Происходит накопление НАДФН и ГТФ, которые затем будут
обеспечивать энергетически синтез АКР и работу элементов цитоскелета. Удельная
теплопродукция лейкоцитов возрастает в 4-5 раз. Хотя общее потребление кислорода фагоцитом
увеличивается, аэробное окисление не вносит в этот процесс решающего вклада, судя по тому,
что цианиды не ингибируют метаболический взрыв и последующие события при фагоцитозе.
При активации на поверхности фагоцита появляются дополнительные молекулы
клеточной адгезии и белки первого и второго классов главного комплекса гистосовместимости.
28
Происходит экзоцитоз, в ходе которого гранулоциты подвергаются дегрануляции и
освобождают медиаторы воспаления, кумулированные в гранулах. Макрофаги выделяют ИЛ-1,
ИЛ-6 и кахексин, а также активаторы фибринолиза. Все фагоциты при активации синтезируют
арахидоновые медиаторы воспаления. Активированные фагоциты увеличивают свою
цитотоксическую, фагоцитарную и бактерицидную активность. В них начинается выработка
активных кислородных радикалов.
Погружение внешне выглядит как охват объекта фагоцитоза псевдоподиями или накат
фагоцита на объект. Это наводит на мысль об общности механизмов хемотаксиса и погружения.
Некоторые авторы, особенно изучавшие фагоцитоз крупных частиц и клеток, уподобляют
механизм погружения застегиванию молнии. При этом предполагается, что происходит
последовательная ассоциация опсонических детерминант объекта с опсониновыми рецепторами
фагоцита, таким образом, объект вдвигается в цитоплазму клетки. Поглощение объекта,
покрытого иммуноглобулинами, происходит без дополнительных условий. При опсонизации
С
3b
-фрагментом комплемента требуется одновременная активация фибронектинового и
ламининового рецептора фагоцита внеклеточными лигандами, как если бы клетка «опиралась»
на межклеточное вещество. Активация цитокиновых рецепторов фагоцита также может
способствовать погружению объекта, опсонизированного С
3b
-фрагментом комплемента.
В результате погружения, объект оказывается в цитоплазме фагоцита, полностью
окруженный фагосомой, созданной путем инвагинации и замыкания участка клеточной
мембраны. Процесс создания фагосомы, видимо, имеет много общего с образованием
рецептосом при рецепторном эндоцитозе, когда окаймленные ямки плазматической мембраны,
содержащие белок цитоскелета клатрин, замыкаются в опушенные везикулы. При участии
микрофиламентов цитоскелета и особых белков-фъюзогенов, фагосома сливается с лизосомами
и специфическими гранулами фагоцита (внутренняя дегрануляция), формируя фаголизосому,
где и происходит завершающая стадия фагоцитоза. Все эти процессы, как и хемотаксис, зависят
от кальция, протеинкиназы С и липидных внутриклеточных посредников.
Деградация объекта фагоцитоза (по классической терминологии – переваривание)
служит заключительной стадией фагоцитоза. Главную роль здесь играют частично
охарактеризованные выше кислород-зависимые цитотоксические механизмы фагоцитов
(галогенизация и перекисное окисление компонентов захваченных объектов с участием
гипохлорита, перекиси водорода, синглетного кислорода, гидроксильных радикалов,
супероксидного аниона, оксийодидов и оксида азота). Вспомогательную роль выполняют
бескислородные механизмы: катионные антибиотические белки, лактоферрин, лизоцим и,
возможно, мочевина.
При наследственном дефекте кодируемого Х-хромосомой мембранного компонента
НАДФ-зависимой оксидазы (гетеродимера цитохрома b-558), равно как и при аутосомно-
рецессивном дефекте цитозольного гетеродимерного компонента этой ферментативной
системы, образование супероксида нарушается, и у детей развивается хронический
гранулематоз (ХГ) – заболевание, характеризующееся иммунодефицитом, незавершенным
фагоцитозом и персистированием бактериальных возбудителей в лейкоцитах. Особенно опасны
для таких больных вышеупомянутые каталаза-положительные микробы, провоцирующие у них
лимфадениты, гранулёмы, себоррейный дерматит, афтозный стоматит и гингивиты.
Гранулематозная болезнь, как и большинство дефектов фагоцитоза, вызвана сочетанным
поражением макрофагов и гранулоцитов. Реже подобные дефекты бывают клеточно-
избирательными. Например, дефект макрофагального фагоцитоза иммунных комплексов и
опсонизированных ими объектов присутствует при коллагенозах, рассеянном склерозе,
герпетиформном дерматите и у родственников больных этими иммунокомплексными
заболеваниями. Помимо ХГ, наиболее важными в клинике являются расстройства фагоцитоза,
описанные в таблице 9:
29
Легко заметить, что нарушения функции фагоцитов очень распространены и
ответственны за многие случаи снижения иммунологической резистентности у длительно и
часто болеющих пациентов, хотя каждая отдельная наследственная аномалия фагоцитов не
является частым заболеванием (Таблица 9). Наследственные дефекты фагоцитоза, как правило,
аутосомно-рецессивны за исключением вышеописанного варианта ХГ и дефекта глюкоза-6-
фосфатдегидрогеназы, сцепленных с Х-хромосомой.
Наиболее часто (1:2000) обнаруживается миелопероксидазный дефицит нейтрофилов.
Сам по себе, он не приводит к значительному иммунодефициту, но в сочетании с другими
приобретенными расстройствами остальных звеньев функции фагоцитов, например, диабетом,
может стать клинически значимым, в основном, из-за развития микозов.
Дефицит лейкоцитарных адгезирующих молекул вызывается дефектами,
локализованными в длинном плече хромосомы 21. В нейтрофилах, лимфоцитах и макрофагах
нарушается адгезия, агрегация, хемотаксис и активация лейкоцитов лимфокинами, а также
снижается опсонизация фактором комплемента С
3b
. Грибковые и бактериальные поражения
кожи, а также слизистых оболочек половых, пищеварительных и дыхательных органов
сочетаются с парадоксальным лейкоцитозом, вызванным отсутствием краевого стояния. У
новорожденных с этим синдромом плохо заживает пупочная ранка.
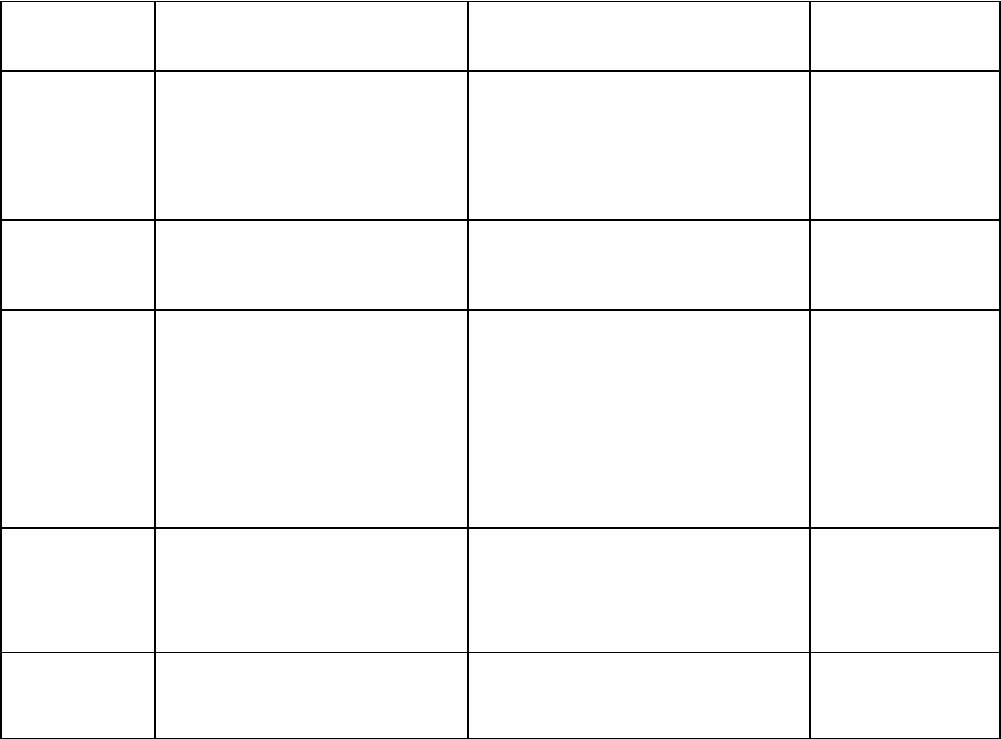
Таблица 9
Нарушение фагоцитоза
Нарушенная
функция
Наследственные дефекты Приобретенные дефекты Лекарственная
патология
Адгезия.
Агрегация
Недостаточность
лейкоцитарной адгезии 1
типа (дефект β-цепи
интегринов).
Недостаточность
лейкоцитарной адгезии 2
Новорожденность, сахарный
диабет, последствия
гемодиализа.
Глюкокортикоид
ы, алкоголь,
аспирин,
ибупрофен,
пироксикам,
колхицин.
Пластичность Новорожденность, сахарный
диабет, гиперрегенераторные
сдвиги влево, лейкозы.
Локомоция Синдром Чедиака-Хигаши
(дефект микрофиламентов,
дефект антигенсвязывающего
белка), синдром Иова,
дефицит специфических
нейтрофильных гранул.
Новорожденность, сахарный
диабет, онкологические
заболевания. СПИД, тяжелый
комбинированный
иммунодефицит, коллагенозы,
голодание, грипп, герпес,
синдромы Дауна и Вискотта-
Олдрича, парадонтоз, дефицит
Фенилбутазон,
напроксен,
колхицин.
Глюкокортикоид
ы, индометацин,
интерлсйкин-2.
Деградация
объекта
Синдром Чедиака-Хигаши
хронический гранулёматоз
(дефекты НАДФ-оксидазы)
дефицит специфических
нейтрофильных гранул.
Новорожденность, сахарный
диабет, сепсис, ожоги, СПИД,
спленэктомия, гемоцитопении,
лейкоз, голодание.
Колхицин,
циклофосфан,
глюкокортикоид
ы.
Метаболичес
кий взрыв
Хронический гранулёматоз,
дефицит пируваткиназы
дефицит глюкоза-6-
фосфатдегидрогеназы.
Пеллагра. Колхицин,
циклофосфан,
глюкокортикоид
ы.
30
