Реймерс Н.Ф. Экология - теории, законы, правила принципы и гипотезы
Подождите немного. Документ загружается.

воды пройдет раньше выше лежащей, так и в процессах развития преды-
дущие стадии не могут идти позже за ними следующих. Такова логическая
модель действия системогенетического закона. Принципы управления
остаются все теми же — целое ограничивает число степеней свободы
своих частей, то же делают части по отношению друг к другу и к це-
лому.
Системогенетический закон в отличие от биогенетического своего
предшественника позволяет прогнозировать будущее развитие. Вернее,
не сам закон, а одно из его следствий. Если развитие относительно детер-
минировано воздействием иерархии надсистем, а отчасти и подсистем в
прошлом (подсистемы, изменяясь, не могут не влиять на целое, пример
тому мутации), то характер процессов не изменится и в будущем, во всяком
случае ближайшем (в масштабе характерного времени систем). И хотя
принцип «развитие есть движение движений во всей иерархии значимых
систем» не позволяет создать одной безальтернативной модели, все же
можно прогнозировать вероятный ход событий. Если же рассматривает-
ся процесс, описываемый системогенетическим законом, в начальных (не
в конечных) фазах развития, точность прогноза резко возрастает: ни-
когда бабочка не вылетит из яйца или из гусеницы, только из ку-
колки.
Отсечение надсистемой и межсистемными отношениями многих вероят-
ных путей развития подсистем, детерминированность их развития пред-
полагает наличие единого русла изменений, их одновременности и сопря-
женности. На это обратили внимание еще биологи первой трети прошлого
века. В 1830 г. Ж. Кювье сформулировал закон анатомической (или
структурной) корреляции. Его современное звучание: в организме, как
в целостной системе, все его части соответствуют друг другу как по строе-
нию (закон соподчинения органов), так и по функциям (закон соподчи- i
нения функций). Изменение одной части организма или отдельной функ-
ции неизбежно влечет за собой изменение других частей и функций. Рогам
соответствуют копыта, а не хищные зубы, травоядность, а не плотояд- I
ность. Но и в любой системе имеется согласование частей, иначе она бы
шла вразнос, не было бы никакого единства. Очевидно, действует закон
согласования строения и ритмики (функций) частей (подсистем), или
закон синхронизации и гармонизации системных составляющих: в системе \
как самоорганизующемся единстве индивидуальные характеристики \
подсистем согласованы между собой. Одно из важнейших следствий этого
закона в том, что выпадение одного из звеньев системы меняет структуру
и функции других, сопряженных с этим законом, или полностью изменя-
ет целое. Выпадение атома из молекулы делает молекулу совсем иной;
эволюционное изменение одного из функциональных органов меняет весь
строй организма и т. д.
Поскольку имеется корреляция между органами и фуйкциями, а раз-
витие есть движение многих движений, в системе одновременно должны
присутствовать подсистемы бурно прогрессирующие, стабильные и ре-
грессирующие. Система как правило, развивается неравномерно. Это так-
же подметили биологи, и Дж. Хаксли в 30-х гг. нашего столетия сформу-
лировал закон аллометрии — неравномерности роста частей тела в про-
цессе развития организма. Автор закона аллометрии считал такую нерав-
номерность развития аномалией, даже патологией. Однако неравномер-
ное развитие подсистем внутри одной системы весьма обычно. Так раз-]
виваются — сезонно и в многолетнем ряду — организмы в биоценозе,
так совершенствуются технические устройства, так идет развитие эконо-
мики стран и так далее, и тому подобное. Видимо, закон неравномерности
2

развития систем, или, лучше, закон разновременности развития (изме-
нения) подсистем в больших системах может быть сформулирован в таком
виде: системы одного уровня иерархии (как правило, подсистемы системы
более высокого уровня организации) развиваются не строго синхронно —
в то время, когда одни из них достигли более высокого уровня развития,
другие еще остаются в менее развитом состоянии. Связь обсуждаемого
закона с законом необходимого разнообразия (разд. 3.2.1) лежит на
поверхности и не требует комментариев.
Подосновой законов внутреннего строения и развития систем как ло-
гических гомологии должны быть какие-то относительно элементарные
физические явления, прежде всего энергетические. Обратимся к ним.
3.2.3. Термодинамика систем
Очевидно, в жизни экологических систем действуют общие термоди-
намические принципы и законы сохранения энергии, вещества, информа-
ции. Наиболее существенны из них, видимо, следующие, формулировки
которых приближены к экологическим нуждам.
Наиболее очевиден закон (принцип) энергетической проводимости:
поток энергии, вещества и информации в системе как целом должен быть
сквозным, охватывающим всю систему или косвенно отзывающимся в ней.
Иначе система не будет иметь свойства единства. Это закон (принцип)
не следует понимать слишком упрощенно и ограничиваться короткими
интервалами времени. Очевидно, для любой, в том числе и экологической,
системы определенного уровня иерархии длительность прохождения по-
тока энергии, вещества и информации будет специфичной. Больше всего
расчетов сделано для воды. Водообмен в биологической особи занимает
часы, влаги в атмосфере (следовательно, и в аэробиосфере) — 8 дней,
свободных континентальных поверхностных вод — от 16 дней в реках до
17 лет в озерах; подземные воды обновляются за 1400 лет, а воды океана за
2500 лет. Очевидно, существует характерное время транзита энергии и
обмена веществ во всех природных системах мира.
Ю. Н. Куражсковский (Введение в экологию и природопользование.
Ростов-на-Дону: Ростовское кн. изд-во, КПК «Кристалл», 1990. 157 с.)
на с. 25 назвал закон (принцип) энергетической проводимости законом
сохранения жизни: «Второй экологический закон — закон сохранения
жизни: жизнь может существовать только в процессе движения через
живое тело потока веществ, энергии и информации. Прекращение движе-
ния в этом потоке прекращает жизнь». Это верно. Однако движение
энергии, вещества и информации необходимо не только для живого и сис-
тем с его участием, но, видимо, и для более широкого класса систем, напри-
мер, многих абиотических, шире — космических, особенно на определен-
53
ных этапах их существования. Даже неэксплуатируемые здания скорее
приходят в негодность, чем заселенные. Видимо, это закон функциониро-
вания не только жизни, но и всех динамических систем. Само же движение
энергии, вещества и информации подчинено группе закономерностей,
часть которых упомянута ниже.
Закон сохранения массы: сумма массы вещества системы и массы
эквивалентной энергии, полученной или отданной той же системой, по-
стоянна. Первоначальная формулировка этого закона — масса (вес)
веществ до химической реакции равна массе (весу) веществ после хими-
ческой реакции, а более расширительно — масса поступающего в систему
вещества минус масса выходящего из системы вещества равна массе
накапливаемого в системе вещества. Если накопления или убывания
вещества в системе не наблюдается, она находится в устойчивом, гоме-
остатическом состоянии. Близкий к этому закон сохранения энергии, или
первый принцип (закон, начало) термодинамики, гласит: любые изменения
в изолированной системе оставляют ее общую энергию постоянной;
или: при всех макроскопических процессах энергия не создается и не
исчезает, а лишь переходит из одной формы в другую.
В экологии особенно значим второй принцип (начало, или закон)
термодинамики, имеющий множество формулировок и смысловых оттен-
ков. Три важнейших для экологии: 1) энергетические процессы могут
идти самопроизвольно только при условии перехода энергии из концентри-
рованной формы в рассеянную; 2) потери энергии в виде недоступного для
использования тепла всегда приводят к невозможности стопроцентного
перехода одного вида энергии (кинетической) в другую (потенциальную)
и наоборот; результат — невозможно создать вечный двигатель 2-го
рода; 3) закон возрастания энтропии: в замкнутой (изолированной в
тепловом и механическом отношении) системе энтропия либо остается
неизменной (если в системе протекают обратимые, равновесные процессы),
либо возрастает (при неравновесных процессах) и в состоянии равнове-
сия достигает максимума.
В открытых системах, согласно теореме сохранения упорядоченности
в них, сформулированной И. Р. Пригожиным (1955), энтропия не возрас-
тает — она в открытых системах падает до тех пор, пока не достигается
минимальная постоянная величина, всегда большая нуля. При этом в
системе вещество распределяется неравномерно и организуется таким
образом, что местами энтропия возрастает, а в других местах резко сни-
жается. В целом же, используя поток энергии, система не теряет упоря-
доченности. Деятельность же живых систем всегда негэнтропийна, пока
сохраняется их свойство системности: таково индивидуальное развитие
организмов, средообразующая их роль в биосфере и другие процессы в
открытых системах.
Все системы, с которыми приходится иметь дело экологии, негэнтро-
пийны, упорядочены таким образом, что, по известному меткому выра-
жению Ю. Одума, как бы «откачивают из сообщества неупорядочен-
ность».
Это происходит до тех пор и постольку, поскольку действует принцип
Ле Шателье — Брауна: при внешнем воздействии, выводящем систему из
состояния устойчивого равновесия, это равновесие смещается в том на-
правлении, при котором эффект внешнего воздействия ослабляется. По-
скольку в биосфере механизм осуществления принципа Ле Шателье —
Брауна основывается на функционировании систем живого, оно, это
функционирование, как постулировал В. И. Вернадский, служит основным
регулятором общеземных процессов. Как показано в ряде работ, и прежде .
54
всего В. 1 . 1 оршкова , действие принципа Ле Шателье — Брауна в рам-
ках биосферы в наши дни глубоко нарушено. Если в конце прошлого века
еще происходило увеличение биологической продуктивности и биомассы
в ответ на возрастание концентрации углекислого газа в атмосфере, то с
начала нашего века это явление не обнаруживается. Наоборот, биота
выбрасывает углекислый газ, а биомасса ее автоматически снижается.
Поскольку биосфера имеет лишь одно устойчивое состояние, единствен-
ным способом восстановить действие принципа Ле Шателье — Брауна
будет сокращение площадей антропогенно измененных земель
2
.
Важное значение для экологических и биолого-эволюционных процес-
сов имеет общефизический закон минимума диссипации (рассеивания)
энергии Л. Онсагера, или принцип экономии энергии: при вероятности
развития процесса в некотором множестве направлений, допускаемых
началами термодинамики, реализуется то, которое обеспечивает минимум
диссипации энергии (или минимум роста энтропии). Очевидна прямая
связь обсуждаемого закона и закона оптимальности (разд. 3.2.1).
Не менее тесно связан с другими энергетическими постулатами закон
максимизации энергии и информации: наилучшими шансами на само-
'Серия работ этого и других авторов обобщена в книге: В. Г. Горшков Энергетика
биосферы и устойчивость состояния окружающей среды//Итоги науки и техники Теорети-
ческие и общие вопросы географии. 1990. Т. 7. 238 с.
2
Теоретические основы поддержания экологического равновесия см. в книге- Рей-
мерс Н. Ф., Штильмарк Ф. Р. Особо охраняемые природные территории. М: Мысль, 1978.
/Уэ С,
55
сохранение обладает система, в наибольшей степени способствующая
поступлению, выработке и эффектному использованию энергии и инфор-
мации; максимальное поступление вещества как такового не гарантирует
система успеха в конкурентной группе других аналогичных систем. Перво-
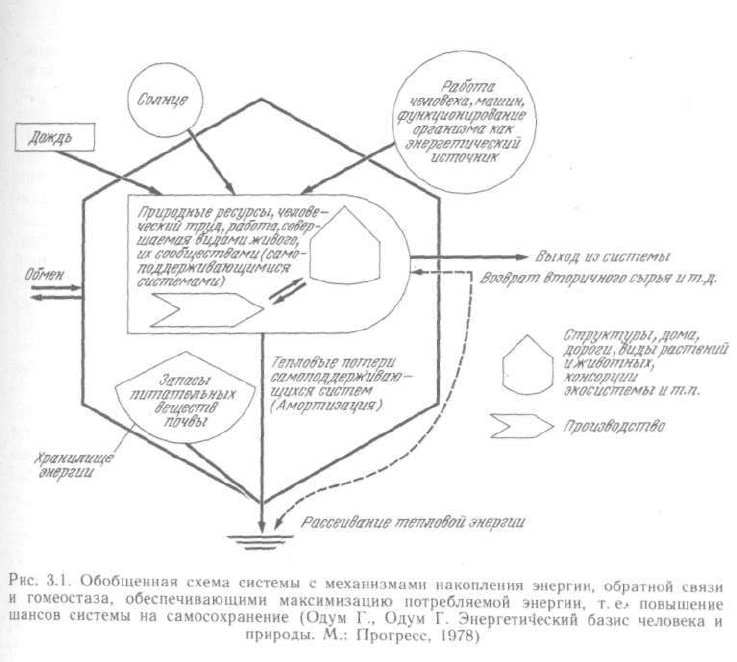
начально закон энергии и информации был сформулирован (Г. и Э. Одумы)
как закон максимизации только энергии: в соперничестве с другими
системами выживает (сохраняется) та из них, которая наилучшим образом
способствует поступлению энергии и использует максимальное ее коли-
чество наиболее эффективным способом (рис. 3.1). «С этой целью система:
1) создает накопители (хранилища) высококачественной энергии;
2) затрачивает накопленную энергию на обеспечение поступления новой
энергии; 3) обеспечивает кругооборот различных веществ; 4) создает
механизмы регулирования, поддерживающие устойчивость системы и ее
способность приспособления к изменяющимся условиям; 5) налаживает
с другими системами обмен, необходимый для обеспечения потребности
в энергии специальных видов »(Г. Одум, Э. Одум. Энергетический базис
человека и природы. М.: Прогресс, 1978. С. 72—73).
Закон максимизации энергии и информации имеет более обобщенную
и краткую формулировку в виде принципа максимизации мощи: системы
с мощной энергетикой вытесняют системы с более низкой энергетической
«мощью». Вероятно, следует добавить «как правило», так как иногда
низкоэнергетические системы имеют преимущества в силу меньшего воз-
действия на среду и лучшего соответствия столь же низкому энергети-
ческому потенциалу этой среды. Видимо, следует более точно учитывать
закон оптимальности (разд. 3.2.1). Например, многие примитивные и низ-
коэнергетические виды живого в относительно стабильной среде остаются
неизменными и вполне конкурентоспособными на протяжении миллионов
лет, хотя вокруг имеются так или иначе конкурирующие более, казалось
бы, энергетически совершенные и более высоко организованные виды.
Обобщающим выводом из серии закономерностей энергетического ряда
может служить правило основного обмена: любая большая динамическая
система в стационарном состоянии использует приход энергии, вещества и
информации главным образом для своего самоподдержания и саморазви-
тия. Таково соотношение основного метаболизма и производимой организ-
мом работы, таково положение в экосистемах и хозяйстве. Это правило
нередко не учитывают и сетуют, что де государственный аппарат работает
лишь на себя, промышленность делает то же и т. д. Иной ситуации при
системном застое и быть не может...
В главе 2 приведена таблица «системы систем» и разобрана иерархия
экосистем. Очевидно, законы сложения систем, их внутреннего развития
и энергетики должны подводить к формированию закономерностей по-
строения иерархии системного мира — взаимоотношений прежде всего
на одном иерархическом уровне, так сказать, в третьем измерении таблицы
(см. табл. 2.1). Если каждый новый уровень организации, отраженный
этой таблицей, возникает как дупликация целостных подсистем, то более
элементарный процесс можно ожидать и в рамках одного уровня иерархии
системных образований, и тут имеется уже достаточное число системных
законов, некоторые из которых в приложении к конкретным структурам
оказались полу- или полностью забытыми. В канве науки сохранились
лишь основные.
56
3.2.4. Иерархия систем
• Принцип иерархической организации, или интегративных уровней
• Периодический закон химических элементов Д. И. Менделеева
• Закон гомологических рядов и наследственной изменчивости Н. И. Вавилова
• Периодический закон географической зональности А. А. Григорьева—М. И. Будыко
• Закон периодичности строения системных совокупностей, или системопериодический
закон
Глава 2 была фактически целиком посвящена иерархии систем, прежде
всего биосферы и входящего в нее живого. Общие принципы формирова-
ния иерархии: 1) дублирование относительно разнокачественных струк-
тур, составляющих в своей организованной совокупности нечто новое,
т. е. наличие свойства эмерджентности (древние говорили: целое больше
суммы его частей) и 2) определенность функциональной цели организа-
ции в рамках связей со средой и внутренних возможностей системы. Сам
принцип иерархической организации, или принцип интегративных уровней,
в биологии и экологии принимается как аксиома или эмпирически наблю-
даемый факт (разд. 3.10). Столь же аксиоматически утверждается и
проявление эмерджентности с переходом от одного уровня иерархии к дру-
гому. Эмерджентность — наличие у системного целого особых свойств, не
присущих его подсистемам, элементам и (несистемным) блокам, а также
сумме элементов и блоков, не объединенных системообразующими свя-
зями. Свойство цели как функциональное состояние и закономерность
построения системы, достигаемая путем возникновения обратных связей,
создает некое поле взаимодействий. Это поле не может быть бесконечным
по способу организации, так как любая система существует в рамках ее
характерного времени и пространства (размера).
Размер системы, или характерный размер системы,— это простран-
ственная ее протяженность (объем, площадь) или масса, а также мини-
мальное (максимальное) число подсистем, позволяющее системе сущест-
вовать и функционировать с осуществлением саморегуляции и самовосста-
новления в рамках своего характерного времени. Системное время (харак-
терное, или собственное, время системы) — это время, рассматриваемое
в рамках периода существования данной системы и/или происходящих
в ней процессов. Эти процессы ограничены термодинамикой системы, ее
функциональными особенностями. Сочетание цели системы, ее характер-,
ного времени и пространства создает предпосылки для действия закона
оптимальности, разобранного в разд. 3.2.1. В то же самое время, поскольку
системы с одной и той же функциональной целью, формируемой обрат-
ными связями, располагаются на одном уровне иерархии и поэтому огра-
ничены однотипным характерным временем и пространством, их постро-
ение подчинено одному ряду внутренних закономерностей. Это — смысло-
вое «третье измерение» табл. 2.1, упомянутое в главе 2.
Ограничение числа и форм взаимодействия подсистем одного систем-
ного уровня ограничивает «фантазию природы», укладывает ее в строго
лимитированный закономерный ряд образований. Периодический закон
химических элементов Д. И. Менделеева (свойства химических элемен-
тов, проявляющиеся в простых веществах и соединениях, находятся в
периодической зависимости от заряда ядер их атомов) был первой форма-
лизацией «третьего измерения» таблицы «системы систем» (см. табл. 2.1).
Тот же характер имеет закон гомологических рядов и наследственной
изменчивости Н. И. Вавилова. (Родственные виды, роды, семейства и др.
57
систематические категории обладают закономерно возникающими гомоло-
гичными генами и порядками генов в хромосомах, сходство которых тем
полнее, чем эволюционно ближе сравниваемые таксоны. Гомология генов
у родственных форм проявляется в сходстве рядов их наследственной
изменчивости. Циклы изменчивости проходят через все роды и виды, со-
ставляющие семейство). Менее известен и признан периодический закон
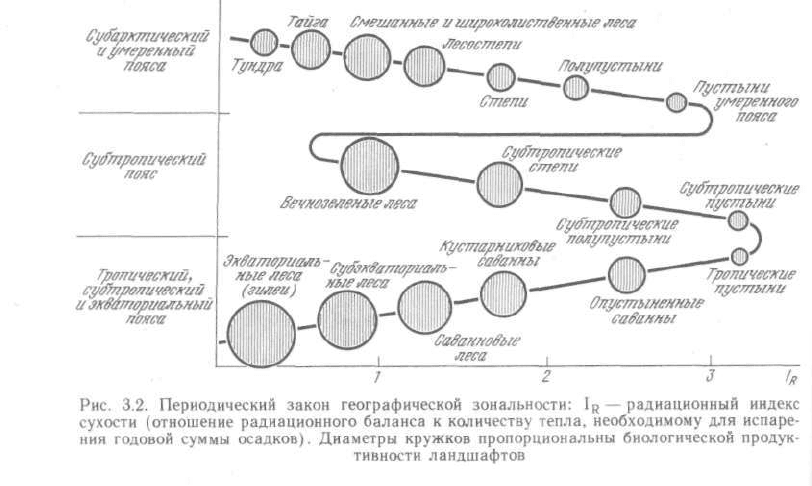
географической зональности А. А. Григорьева — М. И. Будыко: со сменой
физико-географических поясов Земли аналогичные ландшафтные зоны и
их некоторые общие свойства периодически повторяются (рис. 3.2).
Периодическое повторение свойств в рядах систем одного иерархичес-
кого уровня, видимо, общий закон мироздания. Он был сформулирован
как закон периодичности строения системных совокупностей, или системо-
периодический закон. Формулировка первого варианта: конкретные при-
родные системы одного подуровня (уровня) организации составляют
периодический или повторяющийся ряд морфологически аналогичных
структур в пределах верхних и нижних системных пространственно-вре-
менных границ, за которыми существование систем данного подуровня
делается невозможным (они переходят в неустойчивое состояние или пре-
вращаются в иную системную структуру, в том числе другого уровня орга-
низации)
1
. Более обобщающая формулировка дана мною в словаре-
справочнике «Природопользование»: принципы структурного построения
и управления однородных природных систем в иерархическом соподчи-
нении и особенно сложении таких же природных систем одного уровня
организации (иерархии) повторяются с некоторой правильностью в зави-
симости от действия единого (комплекса) системообразующего фактора
(факторов)
2
. Конкретные примеры иерархии экосистем приведены в
главе 2.
1
Реймерс Н. Ф. Системные основы природопользования//Философские проблемы
глобальной экологии. М.: Наука, 1983. С. 140.
N
2
Реймерс Н. Ф. Природопользование. М.: Мысль, 1990. С. 156.
58

Периодичность систем природы не исчерпывается приведенными выше
частными законами периодического строения элементов, гомологических
рядов и географической зональности. Она проявляется в строении косми-
ческих тел, прохождении геологических эпох, сукцессионных стадий раз-
вития экосистем и во многих других случаях.
Системопериодический закон можно считать всеобщей закономерно-
стью, действующей во всем системном мире, в том числе в системах с
участием живого — экосистемах. Поскольку они всегда составлены живым
и средой, окружающей это живое, очевидно, следует обратиться к группе
связей, определяющих основные принципы взаимоотношений системы с
окружающей ее средой.
Абсолютно изолированные системы вне связи с окружающей их средой
длительное время существовать не могут в силу действия второго начала
термодинамики (закона возрастания энтропии — разд. 3.2.3). Самые об-
щие закономерности взаимосвязи система — среда обобщены в философ-
ски расширенной формулировке принципа дополнительности Нильса
Бора.
Изначальный смысл этого принципа (при приборном исследовании фи-
зического микрообъекта могут быть получены точные данные либо о его
поведении в пространстве и во времени, либо о его энергиях и импуль-
сах как о двух взаимно исключающих картинах, «дополняющих» друг
друга) был расширен до: две взаимосвязанные, но различные материаль-
ные системы дополняют друг друга в своем единстве и противоположности.
Такой «общий принцип дополнительности» очень существенен для функ-
ционирования экологических систем (см. в разд. 9.1 принципы экологи-
ческой конгруэнтности и экологической комплементарности, а также закон
единства организм — среда в разд. 3.5.1).
Без относительного (динамического) равновесия в рамках «общего
принципа дополнительности» взаимодействие будет кратковременным:
система разрушится. Этого не происходит в силу действия принципа
Ле Шателье — Брауна, формулировку которого . мы повторим (разд.
3.2.3.): при внешнем воздействии, выводящем систему из состояния устой-
чивого равновесия, равновесие смещается в том направлении, при котором
эффект внешнего воздействия ослабляется. Следствием этого служит
принцип торможения развития: в период наибольших потенциальных
темпов развития системы возникают максимальные тормозящие эффекты.
В зависимости от силы процесса они могут быть заметны или скрыты хо-
дом этого процесса.
59
Вещество и энергия для функционирования и развития системы могут
поступать лишь из окружающей эту систему среды, и только за счет этой
среды может существовать и прогрессировать любая система. Этот оче-
видный факт отражает закон развития системы за счет окружающей ее
среды: любая система может развиваться только за счет использования
материально-энергетических и информационных возможностей окружаю-
щей ее среды; абсолютно изолированное саморазвитие невозможно. Этот
закон действует как в сфере природных, так и социальных (видимо, прин-
ципиально всех) систем природы и общества (кроме, быть может, меха-
нических) .
Энергия, вещество и информация, поступающие в систему извне и вы-
ступающие как факторы ее жизни, действуют не в «чистом» виде, а селек-
тируются и видоизменяются этой системой. Если они проходят предвари-
тельно через надсистемы рассматриваемой системы, то эти процессы
идут многократно и до нее доходят в трансформированном всеми над-
системами виде. Поиск прямых связей между очень далекими по иерархи-
ческому уровню системными образованиями (например, между активно-
стью Солнца и массовыми размножениями организмов), если эти связи
не настолько сильны, что проходят «транзитом» через промежуточный
ряд иерархии систем, как правило, бывает очень затруднителен. Дей-
ствует принцип преломления действующего фактора в иерархии систем.
При этом не следует сбрасывать со счета и саму рассматриваемую систе-
му как преобразующий фактор члена иерархии: фактор, действующий
на систему, преломляется через всю иерархию ее надсистем и через функ-
циональные особенности самой системы. В связи с этим, как правило,
воздействия надсистем не равны по силе и не совпадают по времени с
интенсивностью и моментом их возникновения.
Вероятно, лучше рассматривать отдельно принцип преломления дей-
ствующего фактора внутри системы (внешние для систем воздействия,
как правило, проявляются не прямо, а опосредованы механизмами функци-
онирования этой системы; они могут быть ослаблены ее буферными свой-
ствами или усилены возникающими цепными реакциями), справедливый
для не моментально гибельных для системы воздействий, и только что
сформулированный принцип преломления действующего фактора в иерар-
хии систем. В первом случае буфером оказываются механизмы самой
системы, а во втором — ее надсистем. В данной формулировке в иерар-
хию систем включена и сама система, на которую воздействует тот или
иной фактор, что равно можно принимать или оспаривать в зависимости
от подхода.
Упрощенное, механистическое представление о действующих факто-
рах очень распространено и приводит к многочисленным ошибкам.
В силу преломления действующего фактора в иерархии систем и нали-
чия многих «фильтров» этот фактор либо ослабляется, либо усиливается,
а чаще всего оказывается неравномерным по силе воздействия с ходом
времени. Система немедленно или с задержкой реагирует на возникаю-
щие флуктуации. Этот факт констатируется законом функционально-
системной неравномерности: темпы реакций и прохождения фаз разви-
тия системы (в ответ на действие внешних факторов) закономерно не-
равномерны — они то убыстряются (усиливаются), то замедляются (осла-
бевают).
Ритмика таких колебаний обычно кратна трем. Об этом говорят эмпи-
рические факты, прямые наблюдения в природе. Была выдвинута (совет-
скими учеными Г. Розенбергом и С. Рудерманом) гипотеза и сформули-
рован принцип скользящих среднемаксимальных случайного статистичес-
60
кого ряда: периоды между максимумами временного (или любого другого
случайного условно бесконечного статистического) ряда величин имеют
определенную цикличность вне зависимости от характера и происхожде-
ния самих наблюдаемых величин, т. е. математическое ожидание вели-
чины расстояния от максимума до максимума средних, равномерно рас-
положенных значений признака, не зависит от характера самого слу-
чайного ряда. Чаще всего наблюдаются периоды, близкие к п-3, 3", 4
и 5. Таковы циклы солнечной активности, колебания численности орга-
низмов. Весьма вероятно, что в основе упорядоченности циклов коле-
баний на Земле лежат космические процессы.
Если речь идет не об условно бесконечном ряде статистических вели-
чин, а о конечном явлении, то обычно в развитии систем действует пра-
вило затухания процессов: насыщающиеся системы с увеличением сте-
пени равновесности с окружающей их средой или внутреннего гомеостаза
(в случае изолированности системы) характеризуются затуханием в них
динамических процессов. Это затухание может быть постепенным при ли-
нейности процесса или идти скачкообразно по затухающей синусоиде,
лавинообразно (экспоненциально и сверхэкспоненциально). Такое явле-
ние характерно для насыщающихся растворов, термодинамических про-
цессов, темпов размножения акклиматизированных организмов, эконо-
мического развития стран и регионов и других природных и социальных
явлений.
Частным, но важным случаем правила затухания процессов и одно-
временно следствием закона оптимальности (разд. 3.2.1), перекликаю-
щегося в данном случае со вторым принципом термодинамики (разд.
3.2.3), служит закон растворения системы в чуждой среде, выведенный
советским геофизиком Г. Ф. Хильми. Он действует в любых системах, в том
числе социальных (при большой разнице «культурного острова» и среды,
в которой он находится, этот остров бывает уничтожен, что и было в ре-
зультате репрессий после 1917 г. в нашей стране). Особенностью социаль-
ных «островов» является то, что в них малые системные образования,
растворяясь, увлекают за собой окружающую их среду, что в совокуп-
ности приводит к явлению пассионарности, детально исследованному
Л. Н. Гумилевым в ряде работ, в том числе в нашумевшей книге «Этно-
генез и биосфера Земли» (Л.: Изд-во ЛГУ, 1989. 495 с). Формулировка
закона растворения системы в чуждой среде приведена в особой трак-
товке в разд. 3.7.3 при обсуждении биогеографических закономерно-
стей.
Общесистемные закономерности, изложенные выше, распространяются
на экологические системы и действуют либо сами по себе, либо в специ-
фическом для природных систем с участием живого виде. Нередко они
сформулированы как узкоэкологические законы, правила, принципы и так
далее. В дальнейшем изложении необходимо будет обратить внимание
на это.
Перейдем к общим физико-химическим и молекулярным закономерно-
стям возникновения, построения и фукнционирования живого.
