Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров
Подождите немного. Документ загружается.

581
Н
+
участвующие в процессе окисления. Повышение температуры окисления выше
363 К нецелесообразно из-за увеличения концентрации гидропероксида. По этой
же причине нежелательно возрастание рН выше 10, так как при рН 6-10 количест-
во гидропероксида в сыром гидропероксиде составляет ~ 12%, а при рН 11-12
достигает 20-25%.
Концентрирование гидропероксидов. Разложение гидропероксида в прин-
ципе можно проводить без концентрирования – в этом случае фенолы можно вы-
делить ректификацией или экстракцией щелочью непосредственно из реакцион-
ной массы. Однако разложение гидропероксида в присутствии большого избытка
непрореагировавшего углеводорода неизбежно приведет к образованию продук-
тов взаимодействия с углеводородом и, в конечном счете, к большим потерям
гидропероксида
и увеличению выхода побочных продуктов.
Концентрирование гидропероксида осуществляют либо удалением непро-
реагировавшего углеводорода дистилляцией в вакууме, либо путем химических
превращений гидропероксида. Дистилляция в вакууме – наиболее простой способ
концентрирования, который находит наиболее широкое применение в производст-
ве фенола. Обычно используются двух- или трехступенчатые схемы дистилляции.
В первом случае отгон углеводорода производится в системе последовательно
расположенных колонн, причем
последняя из них работает при остаточном давле-
нии ~49 Па. При дистилляции главная задача – поддерживать в системе темпера-
туру не выше 373 К, чтобы уменьшить разложение гидропероксида.
При работе с гидропероксидом как в лаборатории, так и на производстве сле-
дует учитывать высокую взрывоопасность пероксидных соединений, которая воз-
никает в связи с возможностью
автоускоряющегося разложения в результате на-
грева, механических воздействий, детонации. Ряд пероксидов образуют взрыво-
опасные смеси. Например, пероксид бензола может взорваться при перекристал-
лизации из хлороформа. Известны примеры аварий, вызванные образованием пе-
роксидных соединений в простых эфирах. Низшие представители гомологических
рядов органических пероксидных соединений каждого типа наиболее взрывоопас-
ны.
Кислотное разложение гидропероксидов. Кислотное разложение гидропе-
роксидов протекает по следующей схеме:
В зависимости от природы гидропероксида получают фенол и различные ок-
сосоединения. Так, арилизопропилгидропероксиды образуют при разложении фе-
нолы и ацетон, фенил-
втор-бутилгидропероксид – фенол и метилэтилкетон; толи-
лэтилгидропероксид – крезолы и ацетальдегид.
-Н
2
О
OOH
C(CH
3
)
2
C(CH
3
)
2
O
O
C(CH
3
)
2
582
Выход фенолов в расчете на превращенный гидропероксид зависит от чис-
тоты гидропероксида. При разложении гидропероксида 98-99%-й степени чистоты
количественно образуются фенол и оксопроизводное. При концентрации гидропе-
роксида 90-92% выход уменьшается до 94-97%, 87-88%-й гидропероксид дает 88-
90%-й выход фенола. При разложении технического гидропероксида, содержаще-
го побочные продукты окисления, протекают побочные реакции, снижающие вы-
ход целевого продукта. Например, при взаимодействии фенола и диметилфенил-
карбинола образуется кумилфенол:
+
-Н
2
О
Диметилфенилкарбинол отщепляет воду с образованием
-метилстирола,
который, в свою очередь, может алкилировать фенол, а также полимеризоваться, и
особенно димеризоваться, с образованием линейного димера
Кроме этого, протекают реакции конденсации ацетона с образованием окси-
да мезитила, конденсации фенола и ацетона с образованием гидроксидифенило-
пропана, образование смолообразных продуктов.
Для разложения гидропероксидов применяют сильные кислоты. Слабые ки-
слоты
вызывают разложение гидропероксида только при длительном пребывании
при 373-393 К и значительном расходе кислоты. В промышленности чаще приме-
няют серную кислоту, но могут быть использованы также фенолдисульфокислота,
алкилфенолсульфокислота и др.
При рассмотрении возможных вариантов технологической схемы разложе-
ния следует учитывать высокую экзотермичность этого процесса (
Н=309,6
кДж/моль гидропероксида).
Как правило, разложение гидропероксидов проводят в среде ацетона, при
этом за счет его испарения отводится тепло реакции. Кислота в этом случае пода-
ется в виде раствора в ацетоне. Количество кислоты составляет 0,05-0,1% от реак-
ционной массы, т. разл. ~ 348 К.
Общим недостатком всех технологических вариантов кислотного разложе-
ния гидропероксидов
является необходимость нейтрализации реакционной массы
и выведения из нее солей, чтобы исключить коррозию и выпадение осадков в рек-
тификационной аппаратуре. При нейтрализации и промывке образуются сточные
воды, содержащие фенол и соли.
Эти обстоятельства делают перспективным каталитическое разложение гид-
ропероксида на твердых кислотах органического и неорганического происхожде-
HO
CH
3
CH
3
CHO
CH
3
CH
3
C
HO
(CH
3
)
2
-C-CH=C-CH
583
ния. В качестве твердых катализаторов могут использоваться сильные катиониты
(смолы типа КУ-2), которые разлагают гидропероксиды при 323-333 К. Однако их
недостатком является быстрое уменьшение каталитической активности при отно-
сительно длительной эксплуатации в результате окислительной деструкции.
Значительно более перспективно применение в качестве катализаторов
твердых неорганических кислот. Они обладают высокой устойчивостью к дейст-
вию окислителей. В качестве катализаторов могут быть использованы кислые
природные глины (каолин, бентонит, мориллонит и др.), алюмосиликаты, кремне-
цирконевые катализаторы, цирконийфосфат.
Выделение фенола из продуктов разложения гидропероксида. Реакционная
масса после разложения гидропероксида представляет сложную смесь фенола,
ацетона, побочных продуктов превращения гидропероксида, смолистых веществ.
Ректификация продуктов кислотного разложения кумилгидропероксида проводит-
ся в системе ректификационных колонн. Кроме ацетона и фенола выделяют
-
метилстирол, а фенольную смолу направляют на сжигание или переработку. Такая
система очистки позволяет получить фенол высокой степени чистоты с выходом
97% от ресурсов в сырье.
Недостатки кумольного метода. Несмотря на прекрасно отлаженную тех-
нологию, кумольный метод имеет ряд недостатков. Прежде всего, это наличие
взрывоопасного промежуточного соединения – гидропероксида кумила, а также
многостадийность процесса. Так, при выходе целевого продукта 95% на каждой из
трех стадий итоговый выход составляет лишь 86%.
Однако основным и принципиально неустранимым недостатком кумольного
метода является образование в качестве
побочного продукта ацетона. Это обстоя-
тельство становится все более серьезной проблемой, поскольку ацетон не находит
эквивалентного рынка сбыта. В 1990-х годах это стало особенно ощутимым после
создания новых способов синтеза метилметакрилата путем окисления углеводоро-
дов С
4
, что резко сократило потребность в ацетоне.
В связи с проблемой утилизации ацетона в Японии разработана технология,
предусматривающая его рецикл. С этой целью к традиционной кумольной схеме
добавляют еще две стадии: гидрирование ацетона в изопропиловый спирт и де-
гидратация последнего в пропилена
O OH
CH
3
—C—CH
3
+ H
2
CH
3
—C—CH
3
OH
CH
3
—C—CH
3
CH
3
—C=CH
2
+ H
2
O.
Образующийся пропилен снова возвращают на стадию алкилирования бен-
зола. В 1992 г. фирма "Мицуи" осуществила промышленную реализацию процесса
Al
2
O
3
593K, 1,0 Па
350K, 1,8 Па
Ni
584
мощностью 200 тыс. т/год по этой пятистадийной кумольной технологии. В на-
стоящее время ведутся интенсивные исследования, ориентированные на поиск но-
вых путей синтеза фенола, которые основывались бы на прямом окислении бензо-
ла. Работы проводятся главным образом в следующих направлениях: окисление
молекулярным кислородом, окисление моноатомными донорами кислорода и со-
пряженное окисление.
Окисление бензола
Окисление бензола молекулярным кислородом.
Прямое окисление бен-
зола кислородом представляется наиболее привлекательным способом получения
фенола:
+ 0,5O
2
Работы по окислению бензола кислородом начались еще до того, как в 1865
г. Кекуле предложил структурную формулу бензольного цикла. С тех пор много-
численные попытки найти эффективный путь для проведения этой реакции не
прекращаются.
Наиболее успешные результаты получены при применении в качестве окис-
лителей так называемых моноатомных доноров кислорода в виде
различных ки-
слородсодержащих молекул. Из таких молекул наибольшего внимания заслужива-
ет пероксид водорода:
+ H
2
O
2
+ Н
2
О.
Однако этот путь является мало перспективным из-за высокой стоимости пе-
роксида водорода по сравнению со стоимостью фенола.
Более перспективным окислителем для бензола с практической точки зрения
представляется азотная кислота, которая впервые была использована для этой це-
ли в 1925 г. Эффективными катализаторами этой реакции являются оксидные сис-
темы на
основе V
2
O
5
и MoO
3
:
+ 2HNO
3
+ 2NO
2
+ H
2
O.
Окисление протекает в газовой фазе в присутствии паров воды в при 600-
700 К. Степень конверсии бензола достигает 52% при селективности по фенолу
303-343 К
Комплексы металлов,
Ti-силикаты
OH
OH
OH
585
более 90%. Образующийся оксид азота (IV) может быть окислен до HNO
3
и вновь
применен для окисления бензола.
Представляет интерес способ окисления бензола сульфатом двухвалентной
меди в качестве окислителя:
+ 2CuSO
4
+ H
2
O + Cu
2
SO
4
+ H
2
SO
4
.
Реакция протекает за счет восстановления Сu
2+
в Cu
+
или даже в Cu
0
.
Интересным способом окисления бензола и других углеводородов является
использование пероксида водорода, образующегося в реакционной системе in situ.
Применение пероксида по мере его образования из Н
2
и О
2
позволяет значительно
увеличить селективность его использования. Это типичный пример сопряженного
процесса:
H
2
+ O
2
[H
2
O
2
] H
2
O
В данном случае первичной реакцией является окисление водорода в Н
2
О
через промежуточное образование Н
2
О
2
, а вторичной – окисление бензола в фе-
нол.
Помимо окисления водорода в качестве первичной реакции может высту-
пать процесс окисления других молекул, например монооксида углерода:
CO + O
2
[CO
3
] CO
2
Сопряженный процесс может проводиться в сочетании с окислением вос-
становленной формы металла в растворах:
M
n
+ O
2
[M
n+
O
2
] M
m+
Реакция окисления бензола в фенол, вероятно, является рекордсменом по
разнообразию подходов, количеству испытанных каталитических систем, а также
по объему усилий, предпринимаемых исследователями для осуществления этой
реакции.
573 K
OH
OH
OH
OH
586
Окисление бензола оксидом азота (I) в присутствии цеолитных катали-
затолров.
В 1983 г. Ивамото с сотр. впервые использовал оксид азота (I) для
окисления бензола в фенол:
+ N
2
O + N
2
.
При температуре 850 К и добавлении в реакционную смесь 30% воды селек-
тивность по фенолу на нанесенных ванадиевых катализаторах достигала 71% при
конверсии бензола 10%. Наилучшими катализаторами этой реакции являются цео-
литы ZSM-5, на которых реакция протекает при значительно более низкой темпе-
ратуре и при селективности по фенолу приближающейся к 100%.
Высокая каталитическая активность цеолитов в
этой реакции объясняется
способностью протонировать молекулы оксида азота (
I) с образованием гидрокси-
атионов, которые далее атакуют молекулу бензола:
N
2
O + H
+
+
N=N—OH N
2
+ OH
+
,
C
6
H
6
+ OH
+
C
6
H
5
OH + H
+
.
Как показано в табл. 15.2, оксид азота (I) в случае первого катализатораяв-
ляется гораздо более эффективным окислителем, чем кислород. Столь сильное
влияние природы окислителя связано с существенным изменением в состоянии
поверхностного кислорода. Разложение N
2
О протекает на активных центрах цео-
лита с образованием новой формы поверхностного кислорода, условно названной
-кислородом.
Таблица 15.2
Параметры реакции окисления бензола оксидом азота (I)
и молекулярным кислородом на Fe-содержащих катализаторах
Катализатор Окислитель Т, К Степень
конверсии,%
Селективность
(в расчете на фе-
нол), %
N
2
O 623 27,0 99,0 FeZSM-5
O
2
773 0,3 0
N
2
O 623
5,5 0
Fe
2
O
3
O
2
623
24,5 0
В низкотемпературной области реакция образования -кислорода носит сте-
хиометрический характер:
N
2
О (О)
+ N
2
.
OH
587
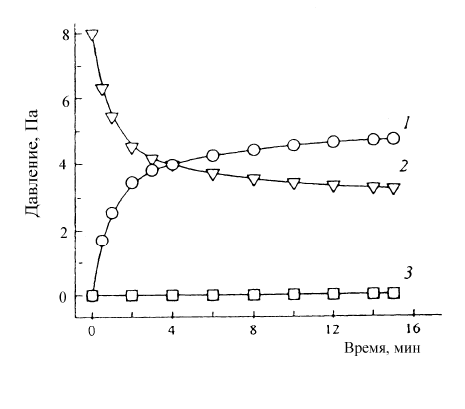
На рис. 15.4 приведена кинетическая кривая низкотемпературного разложе-
ния N
2
О в статической установке.
Рис. 15.4. Изменение парциального давления
N
2
(1), N
2
O (2) и O
2
(3) при разложении оксида
азота (I) на цеолите FeZSM-5 при 523 К
Видно, что протекание реакции сопровождается выделением в газовую фазу
только N
2
, тогда как образующийся кислород заполняет каталитические центры и
остается полностью связанным на поверхности. До температуры 600 К -кислород
термически устойчив. Выше этой температуры он необратимо десорбируется в га-
зовую фазу и реакция разложения N
2
О приобретает характер обычного каталити-
ческого процесса.
Процесс получения фенола окислением бензола закисью азота (
I) разработан
совместно Институтом катализа Сибирского отделения Российской Академии На-
ук совместно c американской фирмой "Монсанто", которая принадлежит к числу
крупнейших в мире производителей адипиновой кислоты (полупродукт для синте-
за полиамида-6,6), что в значительной мере и определило ее первоначальный ин-
терес к новому процессу получения фенола.
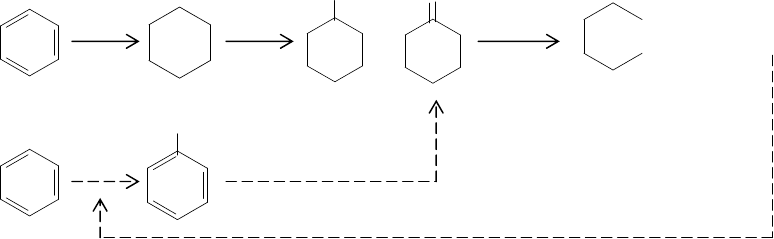
Схема получения адипиновой кислоты (cхема 15.3) включает
следующие
стадии: гидрирование бензола в циклогексан, окисление циклогексана кислородом
воздуха в смесь циклогексанола и циклогексанона и, наконец, дальнейшее окисле-
ние этой смеси в адипиновую кислоту с помощью азотной кислоты. На последней
стадии выделяется большое количество отходов оксида азота (
I), который образу-
ется (в мольном соотношении 1:1) одновременно с адипиновой кислотой. Поэтому
идея использования таких отходов для окисления бензола в фенол как стадии в
модифицированной схеме получения адипиновой кислоты является привлекатель-
ной.
Оксид азота (
I) уже не рассматривается как безобидный "веселящий газ". Он
обладает сильным парниковым эффектом, который (в расчете на г/моль) в 160 раз
превосходит эффект СО
2
, главного "парникового газа". Кроме того, имея большое
588
время жизни, N
2
О достигает верхних слоев атмосферы, где способствует разруше-
нию озонового слоя Земли.
Схема 15.3
+ + N
2
O
П р и м е ч а н и е. Обычная схема – сплошные стрелки, модифицированная – штриховые.
В процессе получения фенола окислением бензола оксидом азота (I) исполь-
зуют железосодержащие цеолиты ZSM-5. Ниже приведены типичные технологи-
ческие показатели процесса на пилотном заводе, построенном в г. Пенсакола
(США).
Т, К ………………………………………..
673-723
Время контакта, с …………………………………….. 1-2
Степень превращения, % (мол.):
бензола в фенол …………………………………... 97-98
бензола в СО ……………………………………… 0,2-0,3
бензола в двухатомные фенолы …………………. 1
N
2
O в фенол ………………………………………. 85
Производительность катализатора в расчете на фенол,
кг/кг(кат.)
ч ……….
0,4
Таким образом, вместо расходования средств на нейтрализацию окси-
да азота (
I) в новом процессе его используют как ценное химическое сырье. По ре-
зультатам пилотных испытаний фирмой принято решение о строительстве круп-
ного промышленного завода мощностью 140 тыс. т фенола/год.
15.1.2. Получение бромфенолов и их производных – антипиренов
Несмотря на успехи, достигнутые в создании трудносгораемых пластиков,
проблема пожароопасности полимерных материалов остается актуальной. Удель-
ный вес галогенсодержащих соединений в общем объеме потребляемых в мире
антипиренов довольно высок и непрерывно возрастает. Около трети производимо-
го брома используется для производства огнестойких материалов и антипиренов.
Практическое значение нашли одно- и двухатомные фенолы
с различной степенью
2H
2
N
2
O
HNO
O
2
3H
2
OH
O
COOH
COOH
OH
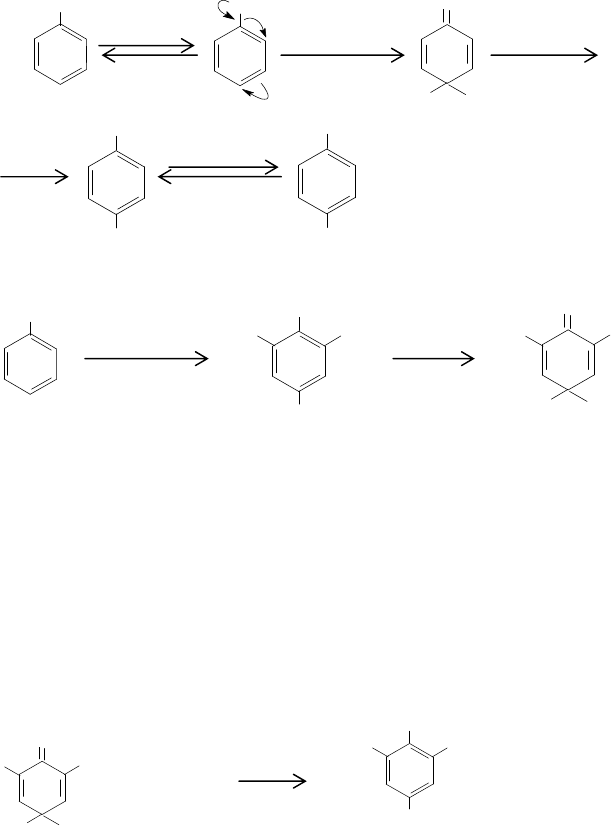
589
бромирования. К числу самых многотоннажных продуктов относятся бромиро-
ванный бисфенол А, а также 2,4,6-трибром- и пентабромфенолы.
Фенолы являются довольно рекционноспособными соединениями и в боль-
шинстве случаев их бромирование не вызывает затруднений. Бромирование фено-
лов в воде протекает через арилоксидный анион, который протонируется и броми-
руется. Медленной стадией процесса является конечная стадия
отщепления про-
тона. Промежуточный аддукт образуется быстро и обратимо, как только в раство-
ре появляется бромирующий агент:
-Н
+
Н
+
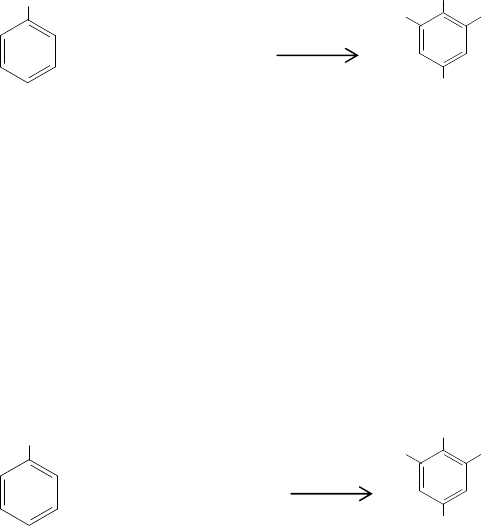
Бромирование избытком брома проходит по схеме
Естественно, что при получении 2,4,6-трибромфенола как конечного про-
дукта в водной среде большой избыток брома недопустим. Тетрабромфенол явля-
ется бромирующим агентом ароматических соединений. Он может также восста-
навливаться 1%-ным раствором КI в присутствии 20%-го НСl до 2,4,6-
трибромфенола. В связи с этим
сначала ведут бромирование избытком брома, за-
тем добавляют иодид калия и оттитровывают выделившийся иод.
Тетрабромфенол (в хиноидной форме) отдает при этом четвертый атом бро-
ма и переходит в 2,4,6-трибромфенол:
+ 2I
-
+ H
2
O + Br
-
+ I
2
+ OH
-
Промышленный метод получения 2,4,6-триброфенола и дибромрезорцина осно-
вывается на окислительном бромировании фенола в присутствии хлора:
B
r
2
-HB
r
3Br
2
Быст
р
о
Медленно
Br
+
илиB
r
2
Быст
р
о
OH
O
-
Быст
р
о
O
H
Br
O
-
Br
Br
OH
OH
OH
Br
Br
Br
Br
O
Br
Br
B
r
Br
O
Br
Br
B
r
OH
Br
Br
Br
590
+ 1,5Br
2
+ 1,5Cl
2
+ 3HCl .
Основным бромирующим средством в промышленности является молеку-
лярный бром или молекулярный бром в смеси с молекулярным хлором. Хлор вво-
дят потому, что бром - дефицитное сырье. В отсутствие хлора улавливание выде-
ляющегося HBr и его утилизация в виде бромоводородной кислоты не решают
проблемы, так как потребность в этой кислоте не велика
. Эффективным решением
данной задачи является применение окислителей для перевода бромида водорода
в бром. В качестве окислителя в процессах бромирования фенолов обычно ис-
пользуют пероксид водорода.
2,4,6–Трибромфенол может быть получен таким образом:
+ 1,5Br
2
+ 1,5H
2
O
2
+ 3H
2
O .
Выход целевого продукта достигает 85% при селективности ~ 90%.
15.2. МОНОМЕРЫ ДЛЯ КАРБАМИДО-АЛЬДЕГИДНЫХ
ПОЛИМЕРОВ
Карбамидо-альдегидные полимеры (мочевино-формальдегидные олигоме-
ры, смолы) - синтетические термореактивные продукты поликонденсации карба-
мида с формальдегидом. Эти полимеры бразуются в результате поликонденсации
первичных продуктов присоединения карбамида и формальдегида – метилкарба-
мидов Н
2
NCОNНСН
2
ОН и СО(NНСН
2
ОН)
2
-
друг с другом, карбамидом и фор-
мальдегидом и содержат повторяющуюся группу —NH—С(О)—NH—.
Карбамидо-формальдегидные полимеры - смесь олигомеров различ-
ной молекулярной массы линейного, разветвленного или циклоцепного строения,
содержащих реакционноспособные NH
2
-
и ОН-группы. Получают и применяют
карбамидо-формальдегидные олигомеры в виде водных растворов (преимущест-
венно 40-70%-х) и порошков. Твердые сетчатые олигомеры бесцветны, светостой-
ки, устойчивы в органических растворителях и маслах, легко окрашиваются. Од-
нако они характеризуются пониженной водостойкостью, хрупкостью, низкой ус-
тойчивостью к деструктивным воздействиям, выделением свободного формальде-
OH
OH
Br
Br
Br
OH
OH
Br
Br
Br
