Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров
Подождите немного. Документ загружается.

311
ние к хлориду палладия таких компонентов, как хлорид лития, катализирует
процесс пиролиза этилидендиацетата до винилацетата и уксусной кислоты.
В начале ХХI столетия ~ 66% производимого в мире винилацетата–
мономера - вырабатывают из этилена, 33% - из ацетилена и 1% - из ацетальде-
гида и уксусного ангидрида. Имеется также устойчивый интерес к процессу по-
лучения винилацетата через
этилидендиацетат.
8.5. ПРОИЗВОДНЫЕ ПОЛИВИЛОВОГО СПИРТА –
ПОЛИВИНИЛАЦЕТАЛИ
Поливинилацетали сами по себе или в виде сополимеров
—CH—CH
2
—CH—CH
2
— —CH
2
—CH— —CH
2
—CH—
O— CHR—O x OH y OCOCH
3
z
где R = H, Alk, фурфурильная и другие группы, являются важнейшими произ-
водными поливинилового спирта, имеющими большое техническое значение.
Они получаются обычно конденсацией поливинилового спирта с различными
альдегидами или гидролизом поливинилацетата с последующим присоединени-
ем альдегида (или кетона) к образовавшемуся поливиниловому спирту.
Впервые поливинилацеталь был синтезирован В. Германом и В. Генелем
в 1927 г., а
первое промышленное производство поливинилацеталей было орга-
низовано в Канаде в 1932 г.
Наибольшее промышленное значение имеют поливинилформаль, поли-
винилбутираль, поливинилэтилаль, поливинилформальэтилаль и поливинилке-
таль.
Поливинилформаль содержит винилформальные звенья
—CH—CH
2
—CH—CH
2
—
O— CH
2
—O x
Его получают ацеталированием поливинилового спирта формальдегидом в
водной среде при 363-368 К в присутствии в качестве катализатора соляной или
какой-либо другой кислоты. Выход продукта составляет 68-72%. Поливинил-
формаль применяют главным образом для производства электроизоляционных
лаков, стойких к действию масел, жиров, как связующее при изготовлении маг-
нитных лент для звуко- и
видеозаписи. Из смесей поливинилформаля с синте-
тическими каучуками, имеющими повышенную ударную вязкость, формуют
изделия для машиностроения и электротехники.
312
Поливинилбутираль – аморфный бесцветный полимер, содержащий 65-
78% винилбутиральных звеньев
—CH—CH
2
—CH—CH
2
—
O—-CH-—O
CH
2
—CH
2
—CH
3
n
а также 32-19% винилспиртовых и до 3% винилацетатных звеньев. В промыш-
ленности поливинилбутираль получают обработкой масляным альдегидом по-
ливинилового спирта в водной среде, а также его суспензии в органических
растворителях, в которых поливинилбутираль растворяется. Пластифицирован-
ный поливинилбутираль применяют в производстве безосколочных стекол типа
триплекс, спиртовые растворы поливинилбутираля используют для изготовле-
ния некоторых
синтетических клеев (типа БФ), лаков, грунтовок, эмалей. Ме-
тодом газопламенного напыления поливинилбутираля на металлические изде-
лия получают антикоррозионные и декоративные покрытия.
Поливинилэтилаль содержит винилэтилальные, винилспиртовые и ви-
нилацетатные звенья. Его используют для производства лаков и политур, пла-
стифицированный полимер перерабатывают литьем под давлением, экструзией
и выдуванием.
Поливинилформальэтилаль содержит винилметилальные, винилэтилаль-
ные, винилспиртовые и винилацетатные звенья. Его применяют для производ-
ства электроизоляционных лаков.
Поливинилкеталь, получаемый взаимодействием поливинилового спирта
с циклогексаноном, содержит винилкетальные, винилспиртовые и винилаце-
татные звенья. Его используют в композициях с резольными и другими термо-
реактивными смолами для изготовления термостойких клеев и высокопрочных
термостойких эмалей, для изоляции проводов и деталей электротехнических
приборов.
313
Глава 9
МОНОМЕРЫ ДЛЯ ПРОСТЫХ ПОЛИЭФИРОВ
Простые алифатические или ароматические полиэфиры – гетероцепные
полимеры, содержащие в основной цепи регулярно повторяющиеся звенья
(—С—О—С—).
К простым алифатическим полиэфирам относятся:
полиацетали (—СНR—O—)
n
, где R=Н, Alk;
полиалкиленоксиды [(—СН
2
)
х
—О—)]
n
;
сополимеры алкиленоксидов друг с другом
[—(CH
2
)
x
—O—]
m
—[—(CH
2
)
y
—O—]
n
;
с другими ацеталями
[—(CH
2
)
x
—O—]
m
—[—CHR—O—]
n
или виниловыми мономерами
[—(CH
2
)
x
—O—]
m
—[—CH
2
—CHX—]
n
,
где Х = Н или какой-либо заместитель.
Простые полиэфиры включают также циклические полиалкиленоксиды и
полидиэпоксиды:
—(CH
2
)
x
— —(CH
2
)
x
—
—OCH
2
CH CH— ; —CH
2
CH CHO—
—(CH
2
)
y
— n O n
Простые ароматические полиэфиры – полиариленоксиды - содержат в
основной цепи один или два ароматических фрагмента (—ОАr—)
n
или
(—ОArОАr'—)
n
, где Аr и Аr' не равны:
или
(R
х
= Н, Alk, Alkenyl, Hal, С
6
Н
5;
Х - электроноакцепторная или электронодонор-
ная группа).
R
x
X
R
x
R
x
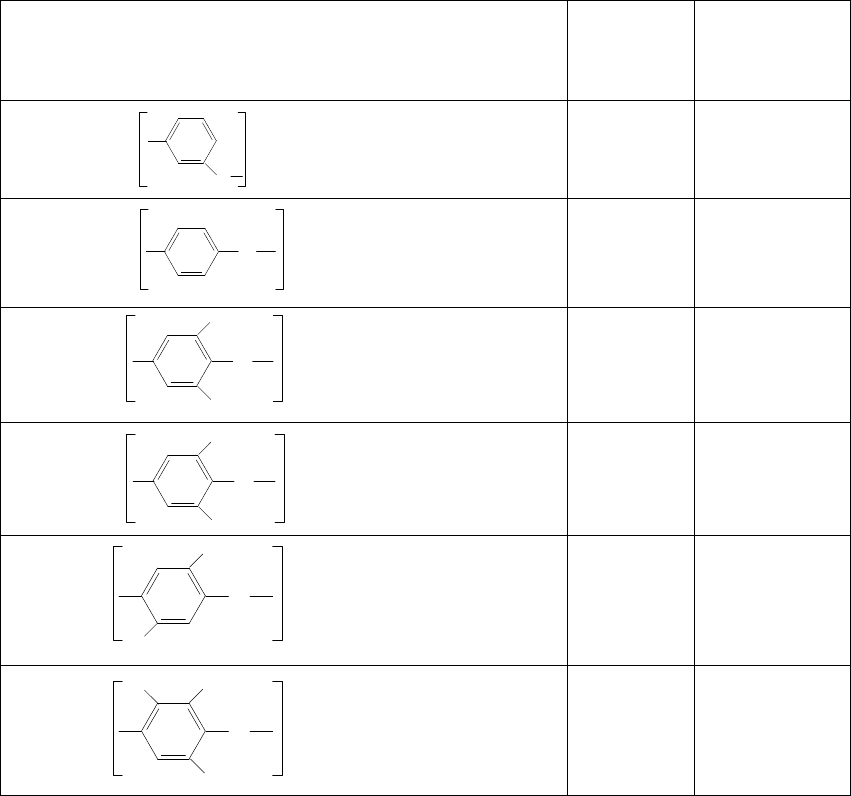
314
Для простых полиэфиров алифатического ряда благодаря высокой гиб-
кости макромолекул характерны низкие температуры стеклования и плавле-
ния – от 203 до 273 К и от 313 до 453 К соответственно. Свойства простых по-
лиэфиров зависят от строения элементарного звена в большей степени, чем
свойства полиолефинов. Например, полиформальдегид – твердый жесткий
кристаллический полимер (т. пл. 451-453 К). Введение
еще одной метиленовой
группы в элементарное звено приводит к снижению температуры плавления
до 339 К и возрастанию эластичности. С увеличением числа последовательно
соединенных метиленовых групп в звене полиэфира температура плавления
проходит через минимум 308 К (для политриметиленоксида) и затем повыша-
ется до 403 К (для полиэтилена высокой плотности). Все незамещенные поли-
меры этого
ряда – кристаллические вещества (табл. 9.1).
Таблица 9.1
Температуры стеклования и плавления
некоторых простых ароматических полиэфиров
Полимер
Т. стекл.,
К
Т. пл.
кристал-
лической
фазы, К
393-403
-
356 565
478 540
463-468
-
543-546
-
458-461
-
O
n
n
O
O
n
CH
3
CH
3
n
O
Cl
Cl
Cl
Cl
O
n
n
O
Cl
Cl
Cl
315
433 623
478
-
428 521
423
-
453 523
Наличие полярных групп и высокая гибкость макромолекул обусловли-
вают относительно хорошую растворимость простых полиэфиров. Они, одна-
ко, характеризуются значительно меньшей термической стойкостью, чем по-
лиолефины.
Из простых полиэфиров наибольшее практическое применение нашли
полиформальдегид, полиметилен-, полиэтилен- и полипропиленоксиды, поли-
ацетальдегид, политетрагидрофуран, пентапласт, пропиленоксидный и эпи-
хлоргидриновые каучуки, полифениленоксиды, полиариленсульфоны, поли-
1,4-эпоксициклогексан,
поли-1,2,5,6-диэпоксигексан, поли-1,2-
поксициклогексан.
COO
n
O
O
n
O CO
SO
2
O
n
O CO
C(CH
3
)
2
O
n
O O
C(CH
3
)
2
NO
2
O
n
O
C(CH
3
)
2
N=N

316
9.1. ФОРМАЛЬДЕГИД
Формальдегид Н
2
С=О – мономер, широко применяемый для получения
полиформальдегида. Полиформальдегид (полиметиленоксид, полиоксимети-
лен) [—СН
2
—О—]
n
- полимер со степенью полимеризации выше 1000, т.
пл. 448-453 К, т. стекл. 213 К. Он растворяется только в моногидрате гексаф-
торацетона и гексафторацетоноксиме.
Полиформальдегид применяют, главным образом, как литьевой конструкци-
онный материал в машино-, автомобиле- и приборостроении, для выработки
полиформальдегидных волокон, которые используются для производства
фильтровальных тканей, рыболовных изделий, канатов и швейных ниток.
По
теплостойкости полиформальдегидные волокна уступают полиамидным, но
превосходят полипропиленовые. Они устойчивы в органических растворителях,
нефтепродуктах, щелочах, к действию микроорганизмов, но недостаточно ус-
тойчивы в минеральных кислотах.
В промышленности полиформальдегид получают анионной или катион-
ной гомополимеризацией формальдегида и катионной сополимеризацией фор-
мальдегида или триоксана.
9.1.1 Механизм и катализаторы
окислительного дегидрирования метанола
Основной
промышленный метод получения формальдегида - окислитель-
ное дегидрирование метанола кислородом воздуха:
CH
3
OH + 0,5O
2
CH
2
O + H
2
O Н = 147,4 кДж/моль.
Процесс осуществляют в присутствии твердых катализаторов, как прави-
ло, серебряных и в значительно меньших масштабах – оксидных.
Первая промышленная установка окислительного дегидрирования мета-
нола на медном катализаторе была построена в Германии в начале 90-х годов
XIX века. В качестве сырья использовали метанол лесохимического происхож-
дения. В 20-е годы
ХХ-ого столетия были разработаны серебряные катализато-
ры, существенно более эффективные, чем медные.
Механизм окислительного дегидрирования метанола
Окислительное дегидрирование метанола сопровождается реакцией про-
стого дегидрирования и рядом других побочных реакций:
CH
3
OH CH
2
O + H
2
Н = -93,4 кДж/моль,
CH
3
OH + 1,5O
2
CO
2
+ 2H
2
O Н = 575,1 кДж/моль,
CH
2
O + 0,5O
2
HCOOH Н = 270,4 кДж/моль,
HCOOH +0,5O
2
CO
2
+ H
2
O Н = 14,5 кДж/моль ,

317
HCOOH CO + H
2
O Н = -53,7 кДж/моль,
2CH
2
O + H
2
O CH
3
OH + HCOOH Н = 122,0 кДж/моль,
H
2
+ 0,5O
2
H
2
O Н = 241,8 кДж/моль,
2CH
3
OH + CH
2
O CH
2
(OCH
3
)
2
+ H
2
O Н = 131,0 кДж/моль,
Метилаль
2CH
2
O HCOOCH
3
Н = 132,6 кДж/моль,
HCOOH + (n-1)CH
2
O HCOO(CH
2
O)
n
CH
2
OH ,
CO + 0,5O
2
CO
2
Н = 283,0 кДж/моль,
2CO CO
2
+ C Н = 172,5кДж/моль,
Константа равновесия реакции окислительного дегидрирования значи-
тельно выше, чем реакции простого дегидрирования. Это означает, что реакция
может развиваться до практически полного исчерпания реагента - в данном
случае, кислорода, взятого в недостаточном количестве. Степень превращения
метанола по целевой реакции окислительного дегидрирования составляет
~60%, а по остальным реакциям - 10%. Подавляющее
большинство побочных
реакций экзотермичны
и поэтому суммарный тепловой эффект положителен.
Реально процесс осуществляется без отвода тепла, т.е. в условиях адиабатиче-
ского режима.
Рассмотрение приведенных выше реакций показывает, что ключевые
превращения протекают с увеличением объема, а побочные – как с увеличени-
ем объема, так и с уменьшением объема реакционной смеси. В связи с тем, что
реакционная
смесь разбавлена азотом, система мало чувствительна к измене-
нию давления (объема). Термодинамические расчеты показали, что изменение
общего давления от 0,01 до 1 МПа практически не влияет на состав продуктов.
Активными центрами катализатора дегидрирования являются поверхно-
стные оксиды серебра, на которых сорбируются метанол и кислород. В процес-
се хемосорбции кислорода осуществляется перенос заряда
с атомов серебра на
адсорбированный кислород, и поверхность заряжается отрицательно. При сте-
пени покрытия серебра кислородом до 0,10-0,12 см
3
О
2
/м
2
Ag, т.е. в пределах
покрытия поверхности монослоем кислорода, один атом кислорода связан с
двумя поверхностными атомами серебра (Ag
2
O). С увеличением степени окис-
ления
до 0,22-0,26 см
3
О
2
/м
2
Ag преобладают соединения, в которых атом ки-
слорода связан с одним атомом поверхностного серебра (Ag
s
или Ag
s
2
O
2
). При
дальнейшем возрастании степени окисления образуются структуры с большим
содержанием кислорода на один атом серебра. Структуры всех типов можно
представить в виде:
O O O— O O—O—O
Ag
s
Ag
s
; Ag
s
; Ag
s
Ag
s
; Ag
s
Ag
s
318
Каталитическая специфичность серебра объясняется особым состоянием
кислорода на серебре. В то время, как на других металлах при активированной
адсорбции кислорода возникают только атомные ионы О
-
(или О
2-
), вызываю-
щие окисление исходного продукта до диоксида углерода, на серебре возника-
ют поверхностные молекулярные ионы типа О
2
-
(или О
2
2-
). За мягкое окисление
метанола в формальдегид ответственен относительно прочно связанный с ката-
лизатором ион О
-
. Более прочно связанный с поверхностью ион О
2-
способству-
ет образованию формальдегида по реакции дегидрирования метанола. Исследо-
вания по окислению спиртов на серебре в условиях наложения на катализатор
электрического заряда показали, что отрицательный заряд увеличивает выход
формальдегида, а положительный - уменьшает. Наложение отрицательного за-
ряда, т.е. избыток электронов, увеличивает долю ионов О
2
-
и О
-
, наиболее
прочно связанных с поверхностью катализатора, и селективность процесса по-
вышается. Таким образом, превращение метанола в формальдегид на серебре -
окислительно-восстановительная реакция.
Под действием хемосорбированного на поверхности серебра кислорода
происходит ассоциативная адсорбция метанола, который, в отличие от кисло-
рода, распадается не на ионы, а на радикалы. Методами ЯМР-, ЭПР- и
масс-
спектроскопии было найдено, что при 653-903 К на поверхности серебра обра-
зуются свободные радикалы:
СН
3
,
ОН
-
, НО
2
. Некоторые из протекающих на
поверхности реакций можно представить схемой:
s
O
2
(г) 2O
s [О] (CH
3
O
) + (HO
)
CH
3
OH (CH
3
OH)адс.
(CH
3
) + (HO
2
)
(CH
2
O) + O
2
(HCO
) + (HO
2
)
[о] (HCO
) + (H
)
(CH
2
)O
CO + H
2
(H
) + O
2
(HO
2
)
(HCO
) + O
2
(HO
2
) + CO и т.д.

319
Как свободные радикалы, так и молекулы реагентов, могут диффундиро-
вать с поверхности в объем. Большинство побочных реакций развивается под
влиянием высокой температуры в свободном пространстве между зернами ка-
тализатора, а также в
объеме под слоем катализатора до зоны резкого охлажде-
ния (закалки) продуктов реакции. К числу этих превращений относятся реакции
полного окисления и распада, протекающие по свободнорадикальному цепному
механизму.
При температурах, применяемых обычно на практике, скорость превра-
щения метанола в формальдегид лимитируется подводом реагентов к поверх-
ности зерен катализатора, т.е. процесс протекает
во внешнедиффузионной об-
ласти. Кинетическая область протекания процесса реализуется при температуре
ниже 573 К. Выход формальдегида и степень конверсии метанола в этих усло-
виях не превышают соответственно 3,6 и 4,6% (мол.), рис. 9.1.
Рис. 9.1. Зависимость степени конверсии
кислорода от линейной скорости потока
реагентов и от температуры реакции
Циркуляционно-проточная установка, катали-
затор – нарезанная серебряная проволока 0,5-
1,0 мм)
При температурах выше 643-673 К процесс переходит в область внешней
диффузии. Протекание процесса в диффузионной области обусловливает зна-
чительную разность концентраций реагентов и продуктов реакции на поверх-
ности серебра и в потоке. Само химическое взаимодействие между реагентами
происходит очень быстро и разогрев катализатора настолько велик, что он ока-
зывается достаточным
для поддержания высокой температуры реакции.
Термодинамический расчет равновесия реакции дегидрирования (1) и
окислительного дегидрирования (2) метанола в формальдегид в интервале тем-
ператур 573-1073 К показывает, что равновесие существенно смещено в сторо-
ну образования продуктов реакции. При этом значения константы равновесия
реакции окислительного дегидрирования (2) метанола на 5-20 порядков выше
соответствующих значений для простого дегидрирования (1), рис. 9.2.
Рис. 9.2. Температурная зависимость константы
равновесия реакции дегидрирования (1) и окис-
лительного дегидрирования (2) метанола в фор-
мальдегид.
320
Итак, реакция (1) может протекать до практически полного исчерпания
компонента, взятого в недостаточном количестве. Поскольку таким компонен-
том является кислород, последний расходуется полностью, а метанол подверга-
ется лишь дегидрированию и распаду. Согласно расчетам мольная доля мета-
нола, израсходованного на окислительное дегидрирование в условиях техноло-
гического процесса, составляет 60%, а на дегидрирование
- 40%.
Если на входе в реактор метанольно-воздушная смесь нагрета до 413-433
К, то температура в слое катализатора за счет разогрева достигает 923-1023 К.
Основным параметром, позволяющим регулировать температуру процесса, яв-
ляется соотношение кислород:метанол. Чем больше кислорода подается в реак-
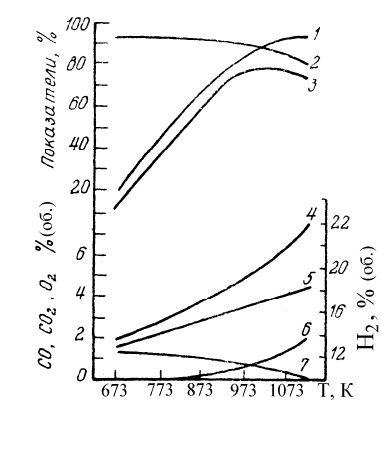
тор с сырьем, тем выше температура в реакторе. Зависимость показателей про
-
цесса от температуры представлена на рис. 9.3. Как видно из рисунка, с повы-
шением температуры степень конверсии (1) метанола возрастает.
Рис. 9.3. Зависимость параметров процесса и со-
става отходящих газов от температуры реакции
Катализатор - 20% серебра на алюмосиликате, на-
грузка по метанолу - 2500 кг/м
2
· ч; сырье - 90%-й
метанол.
1 – степень конверсии метанола; 2 -селективность
по формальдегиду; 3 - выход формальдегида; 4-7 -
содержание в отходящих газах H
2
, CO, CO
2
и O
2
соответственно.
Селективность процесса (2) практически постоянна при повышении тем-
пературы от 673 до 973 К, но с дальнейшим ростом температуры она снижает-
ся. Выход (содержание) водорода и оксидов углерода (4-6) с увеличением тем-
пературы возрастает.
Поскольку на выходе из слоя катализатора реакция образования фор-
мальдегида практически прекращается, а термический распад продолжается,
селективность процесса уменьшается. В связи
с этим продукты реакции под-
вергают закалке, т.е. резкому охлаждению на выходе из реактора путем смеше-
