Передерій В.Г., Ткач С.М. Клінічні лекції по внутрішнім хворобам (у 2-х томах)
Подождите немного. Документ загружается.

Травний канал: язик вологий, обкладений білим нальотом у кореня. При
поверхневій орієнтованій пальпації болю, напруги м'язів, пухлиноподібних
утворень, розходжень м'язів передньої черевної стінки немає. При глибокій
пальпації визначається невеликий біль у зоні проекції цибулини
дванадцятипалої кишки і жовчного міхура, а також сигмовидної кишки. Печінка
по краю реберної дуги. У
лівому підребер’'ї пальпується селезінка, що добре
визначається через свій фестончатий край, що виступає з-під реберної дуги на
5-7 см. Симптом Пастернацького по обидва боки негативний. Сечовипускання і
випорожнення в нормі.
Нами відразу ж був запідозрений хронічний мієлолейкоз, зроблений
загальний був аналіз крові, що підтвердив попередній діагноз і хворий був
переведений у гематологічну клініку.
Навіщо ми наводимо дану історію хвороби? Щоб проілюструвати Вам
ситуацію, коли хвороба крові може починатися непомітно, маніфестуючи навіть
не астенічним синдромом, а окремими дуже специфічними симптомами. Тому
обстеження любого хворого повинне бути дуже ретельним і уважним.
Картина крові в пізні періоди розгорнутої стадії ХМЛ при відсутності
цитостатичної терапії характеризується анемією нормо-макроцитарного
характеру, що розвивається швидко, із кольоровим показником, близьким до
одиниці. Анізоцитоз і пойкілоцитоз еритроцитів виражені нерізко. У більшості
хворих у цій стадії кількість лейкоцитів перевищує 150-200 х 10 9/л, хоч іноді
бувають й алейкемічні форми з лейкоцитозом 5-15 х 10 9/л. У периферичній
крові в значній кількості виявляють
мієлоцити, промієлоцити і навіть поодинокі
мієлобласти. Лейкемічні нейтрофільні гранулоцити характеризуються
зниженням активності лужної фосфатази і значним зниженням фагоцитарної
активності. При гіперлейкоцитозах /500 х 10 9/л і вище/ нерідко утворюються
лейкоцитарні тромби в судинах мозку, селезінці, легенях, що можуть
призводити до загибелі хворих ще до настання термінальної стадії. Лімфатичні
вузли при ХМЛ збільшуються рідко
і незначно.
Потрібно, проте, підкреслити, що перераховані вище зміни крові в цей час
мають місце вкрай рідко. Це пов'язано із широким застосуванням сучасної
цитостатичної терапії, що різко змінює картину крові. На фоні проведення
цитостатиків рівень лейкоцитів звичайно зберігається в межах 10-20 х10 9/л, а в
лейкограмі знаходиться велика кількість сегментоядерних
нейтрофілів.
В міру подальшого прогресування захворювання переходить у термінальну
стадію, що протікає гостро і злоякісно. Нерідко ця стадія називається бластною
фазою ХМЛ. Ця фаза приблизно у 25% хворих може наступати вже через 6-12
місяців і більше 85% хворих вмирає саме в цю стадію хвороби. Для картини
крові в цій стадії характерні анемія, лейкопенія, тромбоцитопенія
і мієлемія -
вихід у периферичну кров вмісту кісткового мозку. Внаслідок мієлемії в
периферичній крові з'являється велика кількість еритрокаріоцитів і бластних
клітини. Іноді в термінальній стадії виявляють швидке збільшення в крові
базофільних гранулоцитів, моноцитів або еозинофілів, що є провісником
бластного кризу.
На початкових стадіях бластного кризу бластні клітини ще зберігають
риси того або іншого паростка кровотворення /мієлобласти, монобласти,
еритробласти, мегакаріобласти/. У останній стадії бластного кризу в крові
виявляються недиференційовані пухлинні клітини, що по будові,
цитохімічним і цитогенетичним особливостям значно відрізняються від
таких же клітин у розгорнутій стадії ХМЛ.
Специфічного тесу, що дозволив би прогнозувати тривалість хронічного
перебігу ХМЛ і точний
час появи бластної фази, не існує. Вважається, що
несприятливими ознаками, при яких настає рання трансформація, є виражений
лейкоцитоз, значне збільшення печінки і селезінки, підвищення відсоткового
вмісту незрілих клітинних елементів у кістковому мозку, а також еозинофільно-

базофільна асоціація. Тривалість життя хворих на ХМЛ від моменту
постановки діагнозу складає в середньому 3,5 роки.
Діагностика лейкемічної форми ХМЛ не представляє великої складності.
Вона грунтується на значному підвищенні кількості лейкоцитів у крові, зниженні
активності їх лужної фосфатази і різкому омолодженні складу периферичної
крові /поява незрелих форм гранулоцитарного ряду - метамієлоцитів,
мієлоцитів, промієлоцитів
і мієлобластів/ у поєднанні з значно збільшеною
селезінкою й іншою клінічною ознакою, не говорячи вже про філадельфійску
хромосому, яку у нас, як ми вже згадали, не визначають. У типових випадках
постановка діагнозу ХМЛ не виявляє труднощів.
У атипових випадках, а також у початкових стадіях ХМЛ, частіше усього
доводиться проводити диференціальну
діагностику з лейкемоїдними реакціями
мієлоїдного типу, що супроводжують інфекції і злоякісні новоутворення. На
відміну від лейкемоїдних реакцій, при ХМЛ відзначається бімодальний
розподіл нейтрофільних елементів у крові, тобто з двома піками, один із
яких зумовлений дозрілими поліморфно-ядерними нейтрофілами, а інший
- мієлоцитами і метамієлоцитами. Для лейкемоїдної реакції не властива
базофільно-еозинофільна асоціація, а картина кісткового мозку не має
патологічних змін. На відміну від ХМЛ, при злоякісних новоутвореннях лужна
фосфатаза лейкоцитів звичайно підвищена. Крім того, варто враховувати, що
лейкемоідні реакції завжди зумовлені визначеними причинами, котрі неважко
виявити за допомогою різноманітних інших діагностичних методів.
ЛІКУВАННЯ
Основні складові лікувальної програми при ХМЛ подані в таблиці 13.
Таблиця 13
ЛІКУВАЛЬНА ПРОГРАМА ПРИ ХМЛ
* Цитостатична терапія /монотерапія, поліхіміотерапія/
* Лікування альфа-інтерфероном
* Променева терапія
* Лейкоцитаферез
* Спленектомія
* Симптоматична терапія
* Трансплантація кісткового мозку
Лікування ХМЛ залежить від стадії захворювання і прогностичних критеріїв
тривалості життя на момент постановки діагнозу.
У хронічній фазі ХМЛ основним методом лікування є цитостатична терапія. У
якому вигляді її проводити - у вигляді моно- або поліхіміотерапії, залежить від
прогностичних факторів на момент встановлення діагнозу. Розподіл хворих по
групах ризику і вибір
методу цитостатичної терапії при ХМЛ подані в таблиці 14.
Таблиця 14
ПРОГНОЗ І ВИБІР МЕТОДУ ЦИТОСТАТИЧЕСКОЙ ТЕРАПІЇ ПРИ ХМЛ
1.Несприятливі ознаки:
* Лейкоцитоз понад 200 х 10 9/л, бластемія понад 3%, сума бластів і
промієлоцитів у крові понад 20%, кількість базофілів у крові понад 10%
* Зниження рівня гемоглобіну менше 90 г/л
* Тромбоцитоз більш 500 х 10 9/л або тромбоцитопенія менше 100 х 10 9/л
* Виражена спленомегалія /нижній полюс селезінки пальпується на 10 см
нижче реберної дуги/
* Гепатомегалія /нижній край печінки пальпується більш, ніж на 5 см нижче
реберної дуги
2.Групи ризику:
* Низький ризик /середня тривалість життя біля 5 років/ - навність одного з
несприятливих чинників
* Проміжний ризик /середня тривалість життя - 3-5 років/ - навність 2-3
несприятливих прогностичних чинників
* Високий ризик /середня тривалість життя біля 2,5 років/ - навність 4-х і
більше несприятливих прогностичних факторів
3.Вибір виду цитостатичної терапії:
* Монотерапія - при низькому і проміжному ризику
* Поліхіміотерапія - при високому ризику
Монотерапія ХМЛ. Препаратом вибору в лікуванні ХМЛ є
гідроксисечовина /гідреа, літамир/. Цей препарат інгибує один із ключових
ферментів біосинтезу ДНК - рибонуклеозидифосфатредуктазу і переважно діє
на пул лейкозних клітин, що швидко ростуть, блокуючи S- і G1-стадії
мітотичного циклу. Препарат випускається в капсулах по 0,5 г і призначається в
початківій дозі 20-40 мг/кг
в добу, підтримуюча доза складає 15-30 мг/кг, а при
прогресуванні збільшується до 40-60 мг/кг на добу. Ефект лікування звичайно
оцінюється після 6 тижнів лікування, хоча тривалість лікування не обмежується.
Як правило, гідроксисечовина добре переноситься, проте можлива поява
диспептичних явищ, стоматиту, шкірних алергічних реакцій, неврологічних
порушень /головний біль, запаморочення/. Найбільше серйозним побічним
ефектом
є пригнічення функції кісткового мозку. Тому при лікуванні
гідроксисечовиною склад периферичної крові треба контролювати не рідше 1
разу на тиждень, а якщо кількість лейкоцитів знижується менше 2,5 х 10 9/л, а
тромбоцитів - менше 100 х 10 9/л, терапія припиняється до відновлення цих
показників.
При відсутності ефекту від гідроксисечовини хворому призначається
мієлосан /бусульфан, мілеран/, що діє
на родоначальную стовбурну клітину і
призупинює продукцію лейкозних клітин. Випускається в таблетках по 0,002 г,
застосовується в залежності від рівня лейкоцитів в добовій дозі 2-8 мг. Ефект
мієлосану звичайно починає виявлятися не раніше ніж на 10-й день від початку
прийому, а нормалізація гемограми і зменшення розмірів селезінки звичайно
настають на 3-6 тиждень лікування після
досягнення загальної дози в 250-300
мг. При досягненні ремісії і зниженні рівня лейкоцитів менше 18 х 10 9/л,
переходять на підтримуючі дози - по 2 мг 1-2 рази на тиждень. До основних
побічних ефектів мієлосану при тривалому застосуванні належать виникнення
фіброзу легеневої тканини, пігментація шкіри, пригнічення статевої функції в
чоловіків. Так само як і при лікуванні
гідроксисечовиною, показники гемограми
контролюються 1 раз на тиждень.
Мієлобромол /таб.0,25 г/ цитостатично діє переважно не на стовбурні, а на
лейкозні клітини, що проліферують, і тому більш швидко діє. Звичайно
призначається при недостатньому ефекті від мієлосану в добовому дозуванні
125-250 мг протягом 2-3 тижнів під суворим контролем показників аналізу крові.
Поліхіміотерапія ХМЛ. Поліхіміотерапія проводиться
в розгорнутій стадії
ХМЛ при наявності критеріїв високого ризику. Частіше усього застосовуються
схеми АВАМП і ЦВАМП:
Програма АВАМП: цитозар, метотрексат, вінкристин, 6-меркаптопурин,
преднізолон.
Програма ЦВАМП: циклофосфамід, метотрексат, вінкристин, 6-
меркаптопурин, преднізолон.
Курси поліхіміотерапії проводяться 3-4 рази на рік, кожний із яких займє 10
днів.
Лікування альфа-2-інтерфероном. У лікуванні ХМЛ з успіхом
використовується рекомбінантний альфа-2-інтерферон /інтрон, реаферон/, хоча
механізм його антипроліферативної дії остаточно не відомий. У деяких
дослідженнях було показано, що 5-літнє виживання хворих на ХМЛ при
монотерапії альфа-2-інтерфероном була вірогідно вище, ніж при при
монотерапії гідроксисечовиною /52% проти 34%/. Лікування може проводитись
як у вигляді монотерапії / при низькому ризику/, так і у вигляді поєднання з
гідроксисечовиною /при високому ризику
/. У перші 10 днів альфа-2-інтерферон
вводиться щодня підшкірно в дозі 4 млн ОД/м2, потім по 3 млн. ОД 2 рази на
тиждень протягом 6 місяців.
В усіх випадках лікування повинно проводитися під каріологічним контролем
і вважається успішним, якщо в лейкоцитах зникає філадельфійска хромосома.
Променева терапія застосовується тільки в розгорнутій стадії ХМЛ при
наявності
екстрамедулярних пухлиних утворень, що загрожують життю хворого
/наприклад, різкому збільшенні мигдаликів, що закривають просвіт гортані/, а
також при різко вираженій спленомегалії.
Лейкоцитоферез в основному застосовується з метою зменшення маси
лейкозних клітин, для відновлення чутливістості до проведеної цитостатичної
терапії у випадках виникнення резистентності, а також при клінічних ознаках
стазу в судинах
головного мозку, зумовлених гіперлейкоцитозом і
гіпертромбоцитозом /поява головного бою, приливів до голови, зниження слуху/.
Спленектомія, за допомогою якої видаляться осередок найінтенсивнішого
патологічного кровотворення і зменшується маса пухлинних клітин, уповільнює
розвиток термінальної стадії ХМЛ у більшості хворих, хоча тепер і не
розглядається як обов'язковий метод лікування. Основними показаннями для
спленектомії є
погрожуючий розрив селезінки, важкий абдомінальний
дискомфорт, пов'язаний із її великими розмірами, глибока тромбоцитопенія
внаслідок гіперспленізму, гемолитичні кризи, повторні інфаркти селезінки.
Симптоматичне лікування хворих на ХМЛ полягає в проведенні
дезінтоксикаційних заходів, лікуванні анемії, тромбоцитопеніі й інфекційних
ускладнень.
Трансплантація кісткового мозку є єдиним реальним способом
вилікування захворювання. Вона переслідує мету — повну
деструкцію популяції
лейкозних клітин, а водночас і здорових кістномозкових клітин при проведенні
інтенсивної хіміо- і радіотерапії з наступним заміщенням здоровим кістковим
мозком. Види трансплантантів можуть бути різноманітними. Сингенний
трансплантант означає, що донор і реципієнт генетично ідентичні /однояйцеві
близнюки/, алогенний трансплантант - що донор і реципієнт мають різне
генетичне походження. Химерою називають індивідумів
, чий організм містить
живі проліферуючі клітини різноманітного генетичного походження.
Аутологічний трансплантант являють собою попередньо заготовлені клітини
кісткового мозку самого хворого, що йому реімплантують після хіміо- і/або
радіотерапії.
Якщо трансплантація кісткового мозку при ХМЛ проводиться протягом
першого року хвороби, вона дозволяє домогтися повної клінико-гематологічної
ремісії на протязі 5 і більше
років приблизно у 60-70% хворих, хоча є дані і про
пізні рецидиви. У бластній фазі трансплантація менш ефективна через більш
високу частоту рецидивів.

ЗАХВОРЮВАННЯ НИРОК
Нефрологія є одним із важливих розділів внутрішніх хвороб, який
практичні лікарі-терапевти знають гірше інших розділів внутрішніх
хвороб. На нашу думку це пов'язано з тим, що так звані
“терапевтичні захворювання нирок” дуже часто перебігають
латентно, нерідко “первинно хронічно”, аж до розвитку хронічної
ниркової недостатності, у зв'язку з чим
вони випадають із поля зору
дільничних терапевтів /у відсутність сімейних лікарів/. Хоча
поширеність терапевтичних нефрологічних захворювань не така
висока, як, наприклад, серцево-судинних, бронхолегеневих або
гастроентерологічних захворювань, проте ця проблема надзвичайно
актуальна. Це обумовлюється тим, що в більшості випадків
терапевтичні захворювання нирок /гломерулонефрити,
необструктивні пієлонефрити/ вражають людей молодого віку, у
більшості випадків призводячи до інвалідізації і нерідко - до
передчасної смерті, труднощам діагностики і диференціальної
діагностики, а також тривалістю і високою вартістю лікування.
Незважаючи на те, що за останні 5 років діагностика захворювань
нирок зросла в 2,5 рази, смертність залишається високою.
Наприклад, смертність від гострого гломерулонефриту в різних
країнах коливається від 2 до 10 на 100000 населення
, причому 60%
померлих - це люди у віці до 40 років. Існує і географічна
варіабельність захворюваності на гломерулонефрит. Наприклад, у
нашій країні вона найбільш висока в Івано-Франківській області.
Зважаючи на те, що навіть при завзятому лікуванні / при
відповідному комплайенсі/ позитивний результат досягається тільки
в 25% випадків, то стає зрозумілим, наскільки важку проблему ми
сьогодні з Вами розбираємо.
Систематизація усієї різноманітності захворювань нирок має
велику історію. Вперше докладно описав захворювання нирок
Ричард Брайт, чия монографія “Доповіді медичної казуїстики,
підібрані для ілюстрації симптомів і лікування хвороб у зіставленні з
патологічною анатомією”, виглядана в 1827 році, по праву є першим
класичним керівництвом по нефрології. Майже 100 років уся
різноманітність захворювань нирок називалася брайтовою хворобою
нирок. Але, природно, у міру поліпшення наших знань, особливо
морфологічних, із появою нових методів діагностики, стала
виявлятися і велика кількість інших захворювань нирок, таких як
сечокам’яна хвороба, пухлини, туберкульоз і багато інші.
Перед тим, як докладно роздивитися одну з найбільших груп
захворювань нирок, що
зустрічаються часто - гломерулонефрити,
нагадаємо Вам основні дані про структуру і функції нирок, а також
основні нефрологігічні синдроми.
Нирки - парний орган, розташованно зачеревиної з обох сторін
від хребта. Поверх нирка вистелена щільною сполучнотканинною
капсулою. Поверхня нирки рівна, гладка, коричнвого кольору. На
розтині виглядно два прошарки - зовнішній коркова і внутрішній-
мозкова речовина. У тканині коркової речовини
при ретельному
огляді за допомогою лупи виглядні численні краплинні утворення
червоного кольору - ниркові /мальпігієві/ тільця. В більшості місць
коркова речовина глибоко проникає в товщу мозкової речовини у
вигляді радіарно розташованих ниркових стовпів, що, у свою чергу,
розділяють його на ниркові піраміди, звернені вершинами
усередину. Таких пірамід від 8 до 12-18. Вершини пірамід
закінчуються малими нирковими чашечками. При цьому одна
чашечка охоплює вершини двух-трьох пірамід, створюючи так
званий сосочок, тому по кількості чашечок менше, ніж пірамід. На
поверхні кожного сосочка знаходиться 13-15 отворів збірних
трубочок /канальці Белліні/, по яких витікає сеча, попадаючи в малі
чашечки, що об'єднуються в одну велику чашку - ниркову лоханку
,
що переходить у сечовід, який впадає в сечовий пухирь.
Основною структурною-функціональною одиницею нирки є
нефрон, що складається з ниркового /мальпігієва/ тільця і канальця.
У обох нирках здорової людини нараховується 2,5-4 мільйони
нефронів.
Ниркове тільце складається з клубочка і його капсули
/Шумлянського-Боумена/. Клубочок /гломерула/ являє собою
судинне утворення, що
має біля 50 капілярних петель, які
починаються від приновідної клубочкової артеріоли і збираються у
відвідну клубочкову артеріолу. Підраховано, що загальна довжина
клубочкових капілярів усіх нефронів обох нирок складає біля 25 км,
а їх фільтруюча поверхня - біля 1,5 кв.м.
Це багато в чому обумовлено тим, що нирки належать до одних із
найбільш складних за
структурою і функцією органів людини. Їх
роль і значення в зберіганні нормальної життєдіяльності організму
незамінні. Порушення макро- і мікроструктури нирок під впливом
різноманітних ендогенних або екзогенних чинників призводить до
зниження або різкого падіння їх функціональної здатності і важких
розладів гомеостазу, які нерідко несумісні з життям.
Вивчення морфології і гістології, сумарної
і парціальних функцій
нирок дотепер залишається предметом пильної уваги анатомів,
патологоанатомів, фізіологів, патофізіологів і клініцистів.
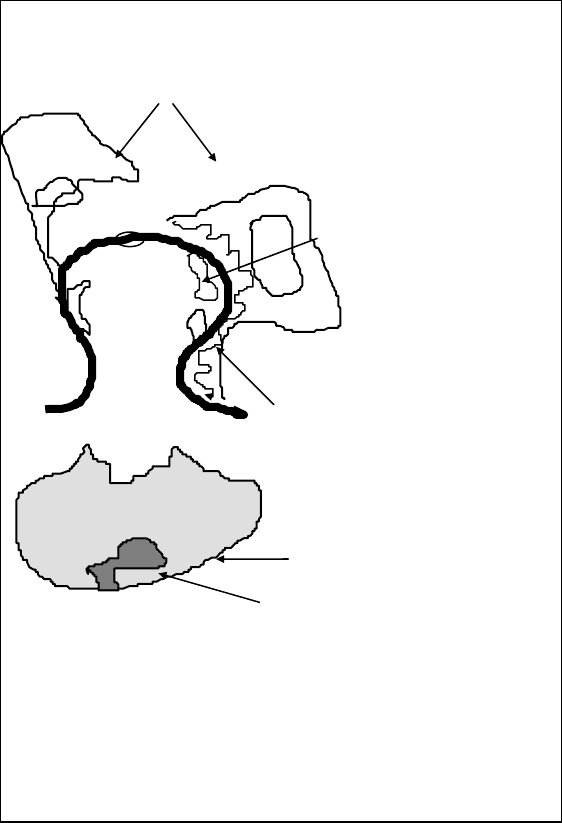
Стінка клубочкових капілярів складається з трьох прошарків.
Внутрішній
ендотеліальний
прошарок
представлений
клітинами ендотелію,
які не прилягають
близько один до одного
і між ними
утворюються
мікроскопічні отвори
до 100-150 нм. У
цілому ендотеліальна
пластинка має вигляд
своєрідного сита й
одержала назву lamina
fenestrata. Зовнішній
прошарок стінки
клубочкового капіляра
складається з клітин
епітелію, названих
подоцитами.
Клітини
подоцитів мають довгі
протоплазматичні
відростки - трабекули,
від котрих майже
перпендикулярно
відходять малі, або підошвові, відростки - педикули. У результаті
сама клітина подоцита і її трабекули не прилягають безпосередньо
до базальної мембрани клубочкового апарата, а спирається на неї
педикулами. Між базальною мембраною і подоцитами, трабекулами,
а також педикулами, що щільно переплітаються, утворюється
ультрамікроскопічний “простір". Його порівнюють із
субмікроскопігічною губкою, що сприяє процесу клубочкової
фільтрації і “відсмоктуванню” рідкої частини плазми крові з
просвіту клубочкових капілярів у порожнину капсули ниркового
клубочка. Середній прошарок стінки клубочкового капіляра складає
базальна мембрана товщиною 250-400 нм. З усіх трьох прошарків
лише вона одна являє собою безупинний бар'єр
між кров'ю, що
циркулює в капілярах, і порожниною капсули ниркового клубочка.
Проте, при електронній мікроскопії у ній визначаються
ультрамікроскопігічні пори /філаменти/, середній діаметр яких
Епітеліальні клітини /подоцити /
Ендотеліальні
клітини
Базальна
мембрана
Мезангіальний
матрикс
Мезангіальна
клітина
Мал. 1. Схема просвітку клубочкового
капіляра в
нормі
дорівнює приблизно 3 нм. Антигенна структура базальної мембрани
в 30-50 разів вища, ніж в інших органів і тканин, у зв'язку з чим тут
частіше усього і виникає ушкодження. Крім клітин ендотелію
/інтракапілярних/ і подоцитів /екстракапілярних/, між петлями
клубочкових капілярів розташовані мезангіальні клітини, оточені
аморфною речовиною - мезангіальним матриксом, що безпосередньо
сполучений із
базальною мембраною і має здатність продукувати її
складові. Схематично нирковий клубочок поданий на малюнку 1.
Нирковий каналець нефрону умовно ділиться на 3 основних
відділи: проксимальний /каналець 1 порядку/, петля Генле /петля
нефрона/ і дистальний /каналец 2-го порядку. Довжина канальця
складає 35-50 мм. Найбільше складну будову має епітелій
проксимального канальця. Для його клітин характерна навність
щіточкової
облямівки у вигляді великої кількості мікроворсинок, що
збільшують робочу поверхню кожної клітини приблизно в 40 разів.
Між клубочковими артеріолами, що приносять і відносять кров
розташований юкстагломерулярний апарат, у якому виробляється
ренін.
Основна функція нирок - екскреторна, що полягає у виведенні з
організму чужорідних речовин і шкідливих кінцевих продуктів
обміну, насамперед азотистих, а
також речовин, необхідних для
нормальної життєдіяльності організму, але які утворилися в
підвищених кількостях. Кінцевим результатом діяльності нирок є
сеча, що представляє собою складну біологічну рідину.
Протягом доби в дорослої здорової людини в середньому
утворюється 1,0-1,5 л сечі /у чоловіків на 300-400 мл більше, ніж у
жінок/, хоча її кількість,беобумовно, залежить від
питного режиму.
Вдень у нормі сечі утворюється більше /приблизно 75-80%/, ніж
уночі. Значне зменшення утворення сечі /менше 300 мл на добу/
зветься олігурія, повне припинення сечовигляділення - анурія, а
збільшення сечовигляділення вище 1,5 л на добу - поліурія.
У механізмі утворення сечі беруть участь 3 механізми:
клубочкова фільтрація, канальцева реабсорбція і секреція. Процес
сечеутворення починається з клубочкової
фільтрації, при якій
утворюється так звана первинна сеча, що містить усі елементи
плазми крові в тій же концентрації, за винятком білків /його
концентрація не перевищує 30 мг%/. Первинна сеча , що утворилася
, надходить у просвіт ниркових канальців, де піддається реабсорбції.
При цьому в проксимальних канальцях поряд із реабсорбцією води /
до 60-80%/ повністю
реабсорбується глюкоза і білок, до 70-80%
натрію, 90-95% калію, до 60-65% сечовини, у значній кількості іони
хлору, фосфати, велика кількість амінокислот і інші речовини.
Реабсорбція води і натрію продовжується й у дистальних канальцях,
проте інтенсивність всмоктування тут води залежить від потреби в
ній організму. Ще один механізм - канальцева секреція, призначена
для виведення з організму деяких чужерідних речовин, іонів водню і
калію, а також речовин, утворених у клітинах канальцевого епітелію
/наприклад, аміак/.
Крім екскреторної, нирки
мають інкреторну функцію, завдяки
якій в них утворюються такі біологічно активні речовини, як ренін,
ниркові кініни /брадикінін, брадикініноген/ і калікреїн,
простагландини, урокіназа, еритропоетин і ін.
У діагностиці захворювань нирок, визначенні ступеня їх
активності, стадії хвороби і функціонального стану нирок
надзвичайно велике значення, поряд із даними анамнезу і клінічної
картини, належить лабораторним
методам дослідження.
Найпростішим методом, правильна інтепретація результатів якого
несе велику діагнстичну інформацію, є загальний аналіз сечі. Варто
пам'ятати, що для дослідження необхідно брати тільки
свіжовипущену сечу з ранкової порції, зібрану в старанно вимитий
посуд після ретельного туалету зовнішніх статевих органів.
Свіжовигляділена сеча здорової людини звичайно прозора і має
солом’
яно- або оранжево-жовте забарвлення. Колір сечі змінюється
при гематурії, вживанні деяких продуктів /буряк, ревінь/ і
медикаментів /5-НОК, нітрофурани й ін./,зниженні концентраційної
здатності нирок / слабозафарбована, майже безбарвна/. Прозорість
сечі зменшується при домішках великої кількості слизу, лейкоцитів,
еритроцитів, епітеліальних клітин, бактерій, капель жиру, солей
/особливо фосфатів і уратів/.
Реакція сечі
залежить від концентрації вільних іонів водню й у
нормі коливається від 4,5 до 8,0. При звичному харчуванні реакція
сечі, як правило, кисла, при переважно рослинному харчуванні вона
може бути лужна. Нерідко лужна реакція сечі спостерігається також
при запальних процесах і рясному розмноженні бактерій у сечі.
Визначення відносної густини сечі, особливо в динаміці, а
також
у пробі по Зимницькому, дозволяє судити про здатність нирок до
осмотигічного розведення і концентрації сечі. У нормі протягом
доби вона може коливатися в широких межах - від 1004-1010 до
1020-1030 і залежить від кількості випитої рідини і діурезу. Прийом
значної кількості рідини призводить до вигляділення великої
кількості сечі з низькою відносною густиною
. Навпаки, обмежений
вжиток рідини або її позаниркові втрати супроводжуються
зменшенням кількості сечі і високою відносною густиною. Низька
відносна густина, виявлена при повторних дослідженнях, свідчить
про зниження концентраційної здатності нирок і може бути ознакою
хронічної ниркової недостатності. Підвищення відносної густини
сечі має місце при нефротичному синдромі, у хворих на цукровий
діабет.
Одним із найважливіших показників загального аналізу сечі є
вміст в ній білка. Здорова людина на добу може вигляділяти до 50
мг білка, проте тими методами, що
використовуються в кліничній
практиці, такі кількості виявити не можна. Якщо в сечі виявляються
сліди білка або його концентрації складає 0,033 г/л, аналіз
повторюють, а в сумнівних випадках визначають добову кількість
білка, екскретується із сечею. Поява білка в сечі - протеїнурія - є
одним із головних ознак більшості первинних і вторинних
захворювань нирок.
Динаміка протеїнурії дозволяє судити про
перебіг захворювання. Як уже було сказано, у час коли тільки
з'явиться білок в сечі, обов'язково визначають добову протеїнурію.
Нормальна екскреція білка на добу складає не більш 0,05 г/доб.
Велика добова протеїнурія /більш 3,5 г/доб/ характерна для
нефротичного синдрому різної етіології.
Цукор у сечі здорової
людину відсутній. Наявність глюкозурії
при нормальному рівні цукру в крові може бути наслідком
ниркового діабету /первинне або вторинне ураження ферментних
систем канальцевого епітелію/, цукрового діабету, важкого
нефротичного синдрому, а також ускладненням глюкокортикоїдної
терапії.
При мікроскопії осаду сечі підраховують насамперед еритроцити,
лейкоцити, циліндри, епітеліальні клітини, а також кількість
бактерій і солі.
У сечі здорової людини, взятої після ретельного туалету
зовнішніх статевих органів, у нормі повинно бути не більш 3-4
лейкоцитів у полі зору в чоловіків і 4-6 - у жінок. Еритроцити в
нормі відсутні або бувають поодинокі в препараті. Якщо в сечі
виявляється понад 5-6 лейкоцитів або 1-2 еритроцити у полі зору,
проводять кількісне визначення формених елементів
в осаду за
визначений час - за 1 хвилину /метод Амбурже/, за добу /метод
Каковського-Аддіса/ або в 1 мл сечі /метод Нечипоренко/.
Нормальними показниками в пробі по Нечипоренко, що тепер
застосовується частіше усього, є до 1000 еритроцитів, до 2000
лейкоцитів. Раніш методом Штернгеймера-Мальбіна виявляли так
звані “активні” лейкоцити, збільшення кількості котрих понад 25%
стосовно
усіх лейкоцитів, що екскретуються із сечею, вважалося
специфічним для пієлонефриту, проте тепер діагностичне значення
цього методу невелике.
