Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ
Подождите немного. Документ загружается.


Если присоединение одной молекулы субстрата не влияет на
сродство к другой, то К
&
= К$
г
, и выражение (39) переходит в
уравнение
«•"*МЕ.]{
Т
[
^' }
2
(40)
где
к
т
= K
s
.
Это выражение отличается от выражения (5) тем, что один из
сомножителей его стоит в квадрате.
Присоединение первой молекулы субстрата к ферменту может
сильно понизить его сродство ко второй молекуле субстрата.
В этом
случае
константа диссоциации К$
2
будет
больше, чем кон-
станта Ks- При этом в области начальной концентрации субстрата
может оказаться, что
Ks,Ks
> Ks
3
[S]
o
и
тогда
уравнение (39)
приобретает вид
w
Q
=>
k' [E]
o
[Slj3/(A"
s
/C
S2
+
[S]Q)
(41)
Как
видно из уравнения (41), порядок реакции по
субстрату
изменяется от нулевого до второго. Если же
KsKs
2
< As
2
[S]
0
, то
пренебрегая малой величиной в знаменателе, получим уравнение,
аналогичное уравнению (5):
»
0
= k' [EJ
0
fSJ
0
/(2/C
Sa
-f [S]
o
) (42)
Интересно
отметить, что уравнение (42) описывает кинетику мно-
гих
двухсубстратных
реакций.
Зависимости
скорости
ферментативных
реакций
от
температуры
Кривая
зависимости
скорости
ферментативных
реакций
от тем-
пературы
обычно
проходит
через
максимум.
Температура,
при ко-
торой
скорость
реакции
становится
максимальной,
называется
оптимальной
температурой.
При
температурах
35°С
и
выше
наблю-
дается
дезактивация
ферментов.
Из
уравнения
(5)
видно,
что за-
висимость
скорости
реакции
от
температуры
имеет
сложный
харак-
тер.
Если
скорость
реакции
подчиняется
уравнению
(7),
зависи-
мость
скорости
реакции
от
температуры
подчиняется
уравнению
Аррсниуса.
При
низких
концентрациях
субстрата,
если
k
3
> k
2
,
уравне-
ние (5)
переходит
в
уравнение
««-MEMS]
(43)
и,
следовательно,
зависимость
скорости
реакции
от
температуры
также
будет
подчиняться
уравнению
Аррениуса,
а
энергия
акти-
вации
будет
относиться
к k\.
Если
при
малой
концентрации
субстрата
k
2
> k
3
, то из
урав-
нения
(5)
получаем
w
-^^o[S)
(44)
и
энергия активации
Е,
полученная
из
зависимости
\gw от \/Т
будет
равна
£
= £i + Е
А
— Е
2
(45)
где Е\, Е
3
и Е
2
— энергия активации соответствующих элементарных реакций.
618
Величина &
3
характеризует
активность
фермента
как катали-
|i затора. За условную единицу количества фермента Е
(фермент-
ную
единицу)
принимают такое количество, которое необходимо
для превращения одного микромоля субстрата в 1 мин при стан-
дартных условиях, температуре 25 °С, оптимумо рН и при субстрат-
ном
насыщении. Согласно этому определению количество Е на-
ходят
пи пр*_
Д
с1инои начальной скорости превращения «опклрага.
Концентрацию
фермента выражают в числе ферментных единиц
на
1 мл раствора, а
удельную
активность
— в числе ферментных
единиц на 1 мл белка. Удельная активность для недостаточно очи-
щенных препаратов
дает
нижний предел активности. Сравнение
удельных активностей
двух
произвольных ферментов с различной
молекулярной массой не отражает их истинных каталитических
свойств.
Молекулярной
активностью
фермента называют величину, по-
казывающую число молей субстрата, превращаемых за одну ми-
нуту
одной молекулой фермента в условиях субстратного насы-
щения.
Она равна числу ферментных единиц в одном микромоле
фермента. Молекулярную активность можно определить только
для достаточно чистых ферментов. Когда субстрат является поли-
мером или веществом со многими превращаемыми связями, вме-
сто числа молекул субстрата учитывают число связей, превращае-
мых ферментом.
Как
видно из рассмотренных уравнений кинетики, предельная
скорость ферментативной реакции часто имеет смысл эффектив-
ной.
В выражение этой величины входят сложные соотношения
констант скоростей отдельных процессов, поэтому эксперименталь-
ные значения предельной скорости не позволяют судить о скоро-
сти элементарного процесса, а характеризуют некоторый сложный
процесс.
В заключение надо отмстить, что рассмотренные в этом пара-
графе уравнения кинетики ферментативных реакций (а также
уравнения кинетики ингибировапия ферментативных реакций, при-
веденные в § 3),
дают
упрощенную картину явлений, так как опи-
сывают протекание процесса в модельных кинетических установ-
ках (in
vitro).
Ферментативные реакции в живых системах (in
vivo)
протекают в потоке (в открытых системах), поэтому описы-
ваются другими уравнениями (см. описание кинетики химических
реакций
в потоке).
§
3. Ингибирование ферментативных реакций
Вещества, понижающие активность фермента, называются
инги-
биторами.
В тех случаях, когда строение молекулы ингибитора
близко к строению молекулы субстрата, понижение активности
фермента может происходить за счет того, что молекулы ингиби-
тора присоединяются к каталитическому или к адсорбционному
центру. Поэтому иногда в качестве ингибитора выступает конеч-
ный
продукт реакции. Существуют ингибиторы, имеющие совсем
619

отличное строение от строения субстрата. Присоединение их к мо-
лекуле фермента происходит вне активного центра, но тоже при-
водит к уменьшению активности фермента. Такое присоединение
вещества носит название
аллостерического
(от греческого слова
«аллос»
—
иной).
Иногда ингибирование ферментов наблюдается при адсорбции
на
мембранах или при контакте с другими белками. Например,
соединения ртути(II) образуют очень прочные комплексы с суль-
фогидрильными группами, и поэтому необратимо ингибируют
многие ферменты, в которых сульфогидрильные группы важны
для катализа.
Некоторые ниэкомолекулярные вещества, проникая к катали-
тическому центру, образуют с ним прочные комплексы (как, на-
пример, цианиды или сероводород с медью или железом) или из-
меняют природу активных групп (восстанавливают сульфогид-
рильные группы). Таких примеров можно привести много. Соли
тяжелых металлов (Ag, Cu, Pb, Hg) необратимо ингибируют фер-
менты, благодаря способности образовывать прочные комплексы
с основаниями или нуклеофилами.
Специфичность фермента к ингибированию менее выражена,
чем его субстратная специфичность. Исследование ингибирующего
действия различных веществ позволяет в ряде случаев разобрать-
ся
в природе и строении каталитических и адсорбционных центров
ферментов.
Общую
схему
протекания ферментативной реакции с участием
одного субстрата S в присутствии ингибитора I можно записать
я
следующем виде:
EI+S
*=* EIS
HS
+ I *=fe ESI
Каждое равновесие характеризуется соответствующими кон-
стантами равновесия Ки Ks, Kis и Ksi- Образование комплекса
EIS
связано в присоединением ингибитора и субстрата к разным
частям молекулы белка, поэтому двойные комплексы EIS и ESI
одинаковы. Константы диссоциации Kis и Ksi численно различа-
ются, так как при диссоциации образуются разные продукты EI
и
I в первом
случае
и ES и I во втором. Коэффициент р харак-
теризует изменение константы скорости распада комплекса ES в
присутствии ингибитора.
Допустим, что начальные концентрации субстрата [S]
o
и ин-
гибитора [1]о много больше, чем концентрация фермента [Е]
о
-
Будем рассматривать процесс, предполагая, что скорости реакций
образования конечных продуктов малы, т. е. концентрации
всех
промежуточных продуктов равны равновесным. Тогда [S]»[S]o,
Рассматриваемая схема в плане образования разных комплек-
сов совпадает со схемой реакции с участием
двух
субстратов, рас-
смотренной в § 2. Поэтому, если принять, что Si = S,
S
2
=»l,
ESIS
B
= ESI, то концентрации комплексов ES и EIS легко найти
по
аналогии с выражениями (25) и (32).
Согласно рассматриваемой
схеме
скорость реакции
Подставляя в (46) концентрации промежуточных продуктов,
найденных из выражений (25) и (32) после соответствующей за-
мены в них символов, а также замены символов констант диссо-
циации
Ksi, Kis комплекса ESI обозначением a/Cs и a/Сь получим
PIII
0
}
IS],
(47)
где
4.
Я..ФФ
(49)
Константа а характеризует изменение сродства фермента к
одному из компонентов под влиянием
другого.
Если сродство не
изменяется, то сс = 1, если комплекс EIS не образуется, то а—оо.
Относительное торможение реакции при данной концентрации
ингибитора равно
W
n
-r- W,
(W)
где
WQ
— скорость реакции в отсутствие ингибитора.
Уравнение (47) похоже на уравнение Михаэлиса — Ментена
(б).
Если комплексы ES и EI образуются, а комплекс EIS не
образуется совсем (полная диссоциация EIS,
a-=>oo),
то, как
видно из выражений (48) и (49), в этом случав
Ш>эфф
= hi [Е]
о
= И>пред
m, эфф
(61)
(52)
ПО
Этот случай реализуется
тогда,
когда ингибитор является
хи-
мическим аналогом
субстрата
S, не
способным претерпевать ката-
литическое превращение,
но
занимающим активное место
в
моле-
куле
фермента. Такое торможение ферментативной реакции назы-
вается
конкурентным
ингибированием.
Как
видно
из
выражений
(51)
и (52), при
конкурентном ингибировании предельная
ско-
рость реакции оказывается постоянной величиной, равной ш
првд
,
а константа
k
m< 9
фф
зависит
от
концентрации ингибитора. Констан-
ту ингибирования
&
можно найти, пользуясь уравнением
(52)
«21
Эфф
ж
~Щ1ч]
'[lJo-0
М,*РФТ%'
[&
7ЗД
Эфф
to
-к
=-ь
Ш -
mi
ШР'О
bga-i/w
0
-*W//«
S
[SJ
0
Ж
W
n
"Эфф
f
tge—л
8
wj
1 /и,
Щ,
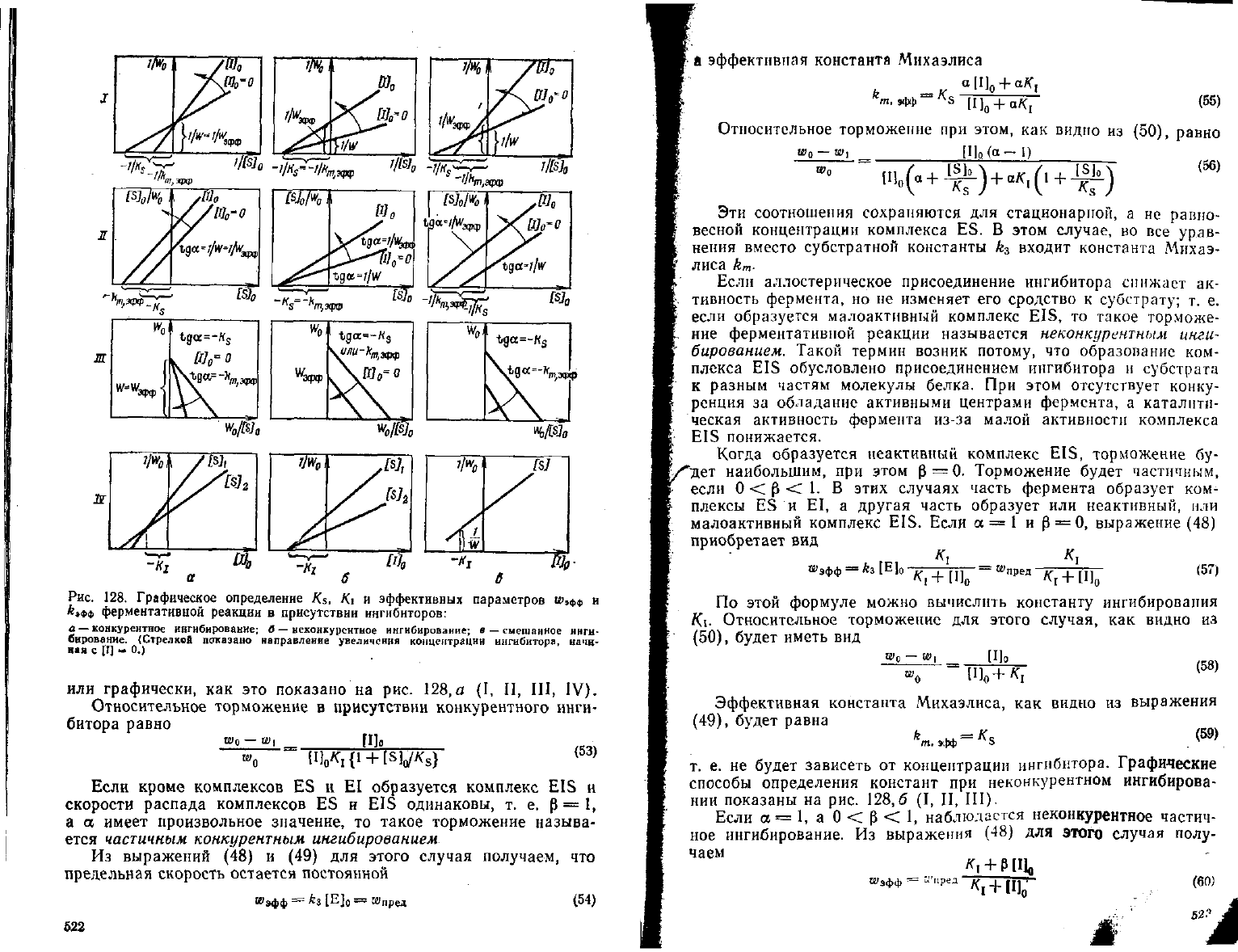
Рис.
128. Графическое определение Ks, Ki и эффективных параметров
и>»фф
и
*»ФФ
ферментативной реакции в присутствии ингибнторов:
а — конкурентное ингибирование; в — неконкурентное имгнбирование; в —смешанное инги-
бнрование. (Стрелков показано направление увеличения концентрации ингибитора, начи-
ная
с Ш - 0-)
или графически, как это показано на рис. 128,а (I, II, III, IV).
Относительное торможение в присутствии конкурентного инги-
битора равно
Если кроме комплексов ES и EI образуется комплекс EIS и
скорости распада комплексов ES и EIS одинаковы, т. е. р=1,
а а имеет произвольное значение, то такое торможение называ-
ется
частичным
конкурентным
ингибированием
Из
выражений (48) и (49) для этого случая получаем, что
предельная скорость остается постоянной
=
h [Е]
о
(54)
522
а
эффективная
константа Михаэлиса
Й
т
,эфф-
Д
5
[i^'+a/C,' (55)
Относительное торможение при этом, как видно из (50), равно
WQ
— WI [I]
0
(a— i)
(56)
Эти соотношения сохраняются для стационарной, а не равно-
весной концентрации комплекса ES. В этом случае, во все урав-
нения
вместо субстратной константы А
3
входит
константа /Михаэ-
лиса k
m
.
Если аллостернческое присоединение ингибитора снижает ак-
тивность фермента, но не изменяет его сродство к
субстрату;
т. е.
если образуется малоактивный комплекс EIS, то такое торможе-
ние
ферментативной реакции называется
неконкурентным
инги-
бированием.
Такой термин возник потому, что образопанис ком-
плекса EIS обусловлено присоединением ингибитора и
субстрата
к
разным частям молекулы белка. При этом
отсутствует
конку-
ренция
за обладание активными центрами фермента, а каталити-
ческая активность фермента из-за малой активности комплекса
EIS
понижается.
Когда образуется неактивный комплекс EIS, торможение бу-
*дет
наибольшим, при этом р—0. Торможение
будет
частичным,
если 0< р < 1. В этих
случаях
часть фермента образует ком-
плексы ES и EI, а
другая
часть образует или неактивный, или
малоактивный комплекс EIS. Если а — 1 и р = 0, выражение (48)
приобретает вид
(57
>
По
этой формуле можно вычислить константу ингибирования
Ки Относительное торможение
для
этого случая,
как
видно
из
(50),
будет
иметь
вид
Эффективная
константа Михаэлиса,
как
видно
из
выражения
(49),
будет
равна
k
,. = К* (69)
т.
е. не будет
зависеть
от
концентрации ингибитора. Графические
способы определения констант
при
неконкурентном ингибирова-
нии
показаны
на рис. 128,6 (I, II, III).
Если
а= 1, a 0 < р < 1,
наблюдается неконкурентное частич-
ное ингибирование.
Из
выражения
(-48) для этого
случая полу-
чаем
Ш
3
фф
=
"'пред
(
60)

а из выражения (49)
(61)
Относительное торможение при этом, как видно из выражения
(50), равно
— W\
Юг,
(1-р)
т
Графическое определение константы ингибирования приведено на
рис.
128,6 (IV).
Если а ф 1 и р Ф 1, то эффективная предельная скорость ш
Э
фф
и
константа Михаэлиса определяются уравнениями (48) и (49).
Процесс ингибирования фермента при этих условиях называется
смешанным
ингибированием.
Смешанным ингибированием назы-
вается и процесс, в котором р = 0, а а > 1. В
ходе
такого про-
цесса возникает неактивный комплекс EIS и, кроме того, ингиби-
тор понижает сродство катализатора к
субстрату.
Для этого слу-
чая выражения (48) и (49) приобретают вид
w,
'пред
(63)
Графические способы нахождения констант для процессов со сме-
шенным ингибированием приведены на рис. 128, в (I, II, III, IV).
Отличие смешанного ингибирования от неконкурентного за-
ключается только в изменении сродства к одному из компонентов,
т. е. все отличие заключается в числовом значении а. При некон-
курентном ингибировании, как мы видели, а=1, а при смешан-
ном аф\.
Иногда в односубстратной реакции наблюдается прохождение
скорости реакции через максимум. Это явление может быть объ-
яснено
как
самоингибирование
(ингибитором является субстрат).
Этот процесс можно описать, если в уравнении (47) для односуб-
стратной реакции положить Kss = Ks и, следовательно, а=1,
р = 0. Так как w\ при этом равно ю
0
, уравнение (47) переходит
в уравнение
6з[Е]
0
ks
[E]Q
isi к. (М)
..
[SJ
r
Таким образом, прохождение кривой зависимости скорости од-
носубстратной реакции от концентрации субстрата через макси-
мум указывает на неконкурентное самоингибирование.
При
рассмотрении кинетики ферментативных реакций и
кине-
тики
этих реакций в присутствии ингибиторов предполагалось, что
активные центры ферментов
ведут
себя независимо
друг
от
друга.
Это справедливо в тех
случаях,
когда молекула фермента имеет
4дин активный центр. Если у фермента несколько активных цент-
ров, присутствие в одном центре связанной молекулы субстрата
624
[•или
ингибитора (или активатора) может изменить способность к
f связыванию и, следовательно, каталитическую активность
другого
центра и в этой молекуле
(кооперативный
эффект).
Описание
кинетики
процессов, Происходящих в многоцентровых молекулах
ферментов, в которых наблюдаются «кооперативные» взаимодей-
ствия центров, очень сложная задача. Такие ферменты иногда на-
зывают
аллоетерическими
ферментами.
К
многоцентровым белкам относится гемоглобин. Его молекула
состоит из четырех полипептидных цепей
двух
типов и четырех
функционально активных остатков гема, содержащих железо.
В глицеральдегидфосфатдегидрогеназе на активную нативную мо-
лекулу
фермента приходится четыре идентичные полипептидные
цепи
и четыре центра для связывания субстрата и фермента. Для
таких регуляторных многоцентровых ферментов зависимости ско-
рости реакции от концентрации субстрата, ингибитора или акти-
ватора не совпадают с зависимостями, рассмотренными выше.
Скорость реакции в этих
елучаях
сильнее зависит от концентра-
ции
субстрата, ингибитора или активатора. Зависимость скорости
реакции от концентрации субстрата для такого типа ферментов
часто выражается s-образной кривой. Молекулы, стехиометрически
несходные с субстратом,
могут
выступать не только в роли инги-
биторов ферментативного катализа, но и в роли активаторов, по-
этому их часто называют
эффекторами.
ГЛАВА
XVI
КИНЕТИКА
РЕАКЦИЙ
ОБРАЗОВАНИЯ
ВЫСОКОМОЛЕКУЛЯРНЫХ
СОЕДИНЕНИИ
Реакция
соединения одинаковых молекул (мономеров) с образо-
ванием соединения большой молекулярной массы, протекающая
без изменения элементного состава реагирующих веществ, назы-
вается
полимеризацией
(или
гомопояимеризацией).
Аналогичная
реакция
соединения разных молекул называется
сополимеризацией.
Реакция
соединения нескольких молекул, сопровождающаяся
отщеплением простейших низкомолекулярных соединений (воды,
аммиака, хлористого водорода и др.) и приводящая к образованию
высокомолекулярного соединения, называется
поликонденеацией.
При
этом реагирующие молекулы должны содержать не меньше
двух
функциональных групп (ОН, СООИ, Cl, NHa и т.п.). Эле-
ментный состав конденсационного полимера отличается от эле-
ментного состава мономера.
Как
и всякая химическая реакция, реакция образования поли-
меров идет в
результате
разрыва одних связей и образования
других.
Разрыв связей, как мы уже видели, может быть гетероли-
тическим (образуются ионы) или гомолитическим (образуются
525

свободные радикалы). Реакции полимеризации классифицируют
на
радикальные, ионные, ионно-координационные, ступенчатые,
с раскрытием циклов, реакции поликонденсации.
§
1. Радикальная полимеризация
Примерами реакций радикальной полимеризации являются реак-
ции
полимеризации этилена под высоким давлением и полимери-
зации
стирола.
Исходные молекулы являются валентно-насыщенными соедине-
ниями.
Для того чтобы молекулы стали реакционноспособиыми,
необходимо возникновение свободных валентностей. Разрыв связей
под действием тепла возможен только при высоких температурах,
но
при этом вследствие термической нестабильности полимер часто
существовать не может. Поэтому обычно реакцию образования
радикалов осуществляют, применяя фотохимическое, радиационно-
химическое, электрохимическое воздействие на систему или вводя
в систему малоустойчивые вещества (инициаторы), образующие
свободные радикалы. В качестве инициаторов часто используют
пероксиды и азосоединения, например, бензоилпероксид, азоизо-
бутиронитрил.
Процесс инициированной полимеризации начинается с при-
соединения к молекуле мономера свободного радикала, возникаю-
щего в
результате
распада инициатора. Растущая полимерная
цепочка на одном конце все время содержит этот радикал.
Реакцию радикальной полимеризации можно изобразить сле-
дующей схемой:
Инициатор
—>• Rj (а) |
тт
>
Инициирование
R,+M
—• Пз (б) )
Rn
+ Rm
Пп+Rn
М
л
+В
(в)
К
Реакция
роста цепи
Реакция
обрыва цепи
где М — молекула мономера; R
n
—радикал, состоящий из радикала R[ с при-
соединенной
к нему цепочкой п — 1 мономерных молекул.
Скорость реакции инициирования (а) (образования радикала
Ri*) обозначим w
H
. Константы скоростей
всех
реакций роста цепи
будем
для простоты считать одинаковыми и равными k
p
. Так как
процесс радикальной полимеризации обычно протекает в газе под
давлением или в жидкой фазе, преобладающим является квадра-
тичный обрыв цепей. Обрыв цепей, как показано на схеме, может
осуществляться двумя способами: путем рекомбинации (г) и путем
диспропорционирования свободных радикалов (д), когда проис-
ходит
передача атома от одного свободного радикала к
другому,
626
1риводящая к образованию
двух
валентно-насыщенных молекул.
1ри этом у частицы, отдающей атом, возникает двойная связь.
J
реакции обрыва
могут
участвовать любые радикалы (которые
шогут
быть и одинаковой длины). Константу скорости обрыва обо-
значим k
o
.
Применяя
метод стационарных концентраций к скоростям во-
•
зникновения и гибели первого радикала, получим уравнение
Принимая
во внимание, что w» = k
№
[l] ([I] —концентрация ини-
циатора), находим
*и
Ш — ftp
IRil
{Ml — ft
0
IRi
1
2 [R"]
= o
0)
n
= l
Аналогично для R
2
получим выражение
A
P
[Ril [Ml - ftp [R,l (Ml - ft
0
[R
2
] £ [R
n
] = 0
и
для радикала R
n
оо
ftp
[R
n
_!l
[M] - ftp [R
n
l [MJ - k
Q
[R«l ^ [R
n
l =
n-i
Складывая все эти уравнения, получим
(2)
-ч
Z
п-1
Из
этого уравнения находим
(4)
(5)
га—1
Скорость
расходования мономера,
как
видно
из
схемы, равна
ft
p
lM]£
[Кп\
(6)
Подставляя в (6) выражение (5), получим
-d[Ml/d/-ft
p
(ft
H
[l]/*o)'
A
[Ml
(7)
Это уравнение описывает кинетику процесса газофазной полимери-
зации
стирола.
Если
инициирование осуществляется
по
реакции второго
по-
рядка,
то
ю« =
МП[М1
(8)
Легко
увидеть,
что
скорость полимеризации
-
a (M)/dt = ftp <ft
H
[I]/fto)
v
MM]
Vl
(9)
Этому уравнению подчиняется кинетика реакции полимеризации
стирола, инициируемая пероксидом бснзоила.
627

При
фотохимическом инициировании
где
/ —
интенсивность
поглощенного
света
[в
квант/(моль-с),|.
Тогда
скорость полимеризации равна
(10)
1MJ
(ID
Фотохимическое инициирование часто используют для нахож-
дения величины k
0
, применяя
метод
прерывистого освещения. Об-
рыв цепи можно вызвать, если вводить в систему некоторые ва-
лентно-насыщенные соединения. Они
реагируют
с активными сво-
бодными радикалами, ведущими процесс, и
образуют
радикалы,
не способные продолжать реакционную полимерную цепь. Такие
соединения называются
ингибиторами
цепных реакций. Определяя
скорость расходования ингибитора, можно найти константу ско-
рости реакции инициирования полимеризации. Располагая значе-
ниями
констант k
B
и Ао, по уравнениям (7), (9) и (11) можно
найти константу скорости роста цепи А
р
.
Процесс полимеризации осложняется
реакциями
передачи
цепи.
Реакция
передачи цепи состоит и передаче свободной валентности
от растущей полимерной цепи молекулам мономера, растворителя
или какой-либо примеси. Если реакционная способность возникаю-
щих таким образом радикалов мало отличается от реакционной
способности первоначальных радикалов, то скорость процесса
,почти не изменяется, но происходит снижение молекулярной мас-
,сы образовавшегося полимера.
Реакции
обрыва и передачи цепи широко используются для
предотвращения полимеризации мономеров при их хранении. Для
этого к мономерам добавляют ингибиторы. Ими
служат
хиноны,
ароматические амины, фенолы, органические соли меди, железа,
цинка,
свинца и т. д. Кроме того, реакции переноса цепи исполь-
зуют
для регулирования молекулярной массы получаемого поли-
мера. Вещества, добавляемые с этой целью, называют
регулято-
рами.
При полимеризации диенов регуляторы не только способст-
вуют
получению полимеров заданной молекулярной массы, но и
препятствуют возникновению разветвлений и трехмерных
структур,
ухудшающих
эластичность и пластичность каучуков. Одним из
таких регуляторов является додецилмеркаптан.
Радикальную полимеризацию можно характеризовать опреде-
ленной
длиной цепи, показывающей сколько молекул мономера
вступило в реакцию полимеризации на один свободный радикал.
Эту величину и называют
кинетической
длиной
цепи,
чтобы не
Путать с понятием длины цепи образовавшегося полимера.
Число мономерных молекул, входящих в состав полимерной
молекулы, называется
степенью
полимеризации.
Если гибель ра-
дикалов происходит в
результате
их диспропорционирования и
свободнорадикальная полимеризация не осложнена дополнитель-
дшми элементарными стадиями, то степень полимеризации равна
кинетической длине цепи v. Если же гибель радикалов происходит
в
результате
рекомбинации, то степень полимеризации равна уд-
военной кинетической длине цепи 2v. Длина кинетической цепи
может быть выражена и как отношение скорости роста цепи w
P
к
скорости обрыва w
o
, т. е.
\ =
w
p
/w
0
(12)
Для стационарного режима
*
н
[1]
(13)
Подставляя (7) и (13) в (12) и считая, что средняя степень
полимеризации
j>
«=*
v, получим
(14)
где
При
наличии процесса передачи цепи материальная цепь пре-
кращает свой рост не только за
счет
реакций обрыва, но и за
счет
передачи цепи; число свободных валентностей в системе не изме-
няется.
Длина кинетической цепи в этом
случае
будет
больше
длины материальной цепи, и средняя скорость полимеризации Р
будет
обратно пропорциональна
сумме
скоростей обрыва и пере-
дачи цепи:
Р=.
Шр
/К
+ Е
ш
п
еР
) (15)
где
Sieinep
—
сумма
скоростей
всех
процессов
передачи
цепи.
Предполагается, что обрыв цепи происходит
путем
диспропор-
ционирования.
Если проводить полимеризацию чистого мономера
до небольших значений F, то можно ограничиться
учетом
передачи
цепи
на мономер,
тогда
выражение (15) приобретет вид
(16)
Учитывая, что
/1-1 П-1
(где Ы — константа скорости передачи цепи на мономер) выраже-
ние
(16) можно переписать
/1=1
Из
формулы (6) вытекает
Д-1
(17)
(18)
629

Подставляя (18)
в
(17), найдем
или
[М]'
(19)
(20)
Отсюда видно, что величина 1/Р линейно зависит
от
ш
р
/[М]*.
Отрезок, который прямая отсекает
на оси
ординат, равен
kt\/kp,
а
тангенс
угла
наклона прямой равен kjk
2
p
. Уравнение (20)
справедливо
для
реакции полимеризации метилметакрилата при
50°С;
степень полимеризации растет
с
увеличением концентрации
мономера
и
падает
с
увеличением скорости полимеризации
н,
следовательно,
с
увеличением скорости инициирования.
Вязкость среды сильно влияет на скорость процесса рекомбина-
ции
радикалов при полимеризации. При больших глубинах поли-
меризации (больших значениях
Р)
время жизни макрорадикалов
сильно возрастает, т. е. возрастает
и их
концентрация. Это при-
водит
к
тому,
что число мономерных молекул, присоединяющихся
к
радикалам
в
единицу времени
на
более поздних стадиях поли-
меризации, возрастает. Таким образом,
на
поздних стадиях поли-
меризации наблюдается самоускорение, приводящее
к
так назы-
ваемому
гель-эффекту.
Реакционная масса после достижения
очень большой скорости полимеризации превращается
в
гель,
и
скорость полимеризации резко падает.
На
основании этого рас-
смотренные нами уравнения
к
поздним стадиям полимеризации
неприменимы.
В
результате
полимеризации обычно получается смесь поли-
мерных молекул разной длины. Важной характеристикой полимера
является распределение полимерных молекул
по
молекулярным
массам.
Распределение молекул по молекулярным массам определяется
функцией
Wx=
,c
x
/c =
f
l
(х)
(21)
где
w
x
и
с
х
—
соответственно мольная доля
и
молярная концентрация молекул
полимера
с
числом звеньев
х
(молекулярная масса звена равна молекулярной
массе мономера);
с —
общая молярная концентрация полимера.
Молекулярно-массовым распределением
по
молекулярной мас-
се называется функция
h(*)8
(22)
где
у*
и g
x
—
соответственно массовая доля
и
массовая концентрация молекул
полимера
с
числом звеньев
х;
#—общая концентрация полимера.
Рассмотрим расчет функции распределения полимера по моле-
кулярным массам
для
начальной стадии полимеризации, когда
скорость инициирования
и
концентрацию мономера,
а
следователь-
но,
и
стационарную концентрацию свободных радикалов можно
630
^читать постоянными. Реакциями передачи цепи пренебрегаем,
ртрогое
и
общее решение этой задачи очень сложно.
Для определения концентрации радикалов, содержащих
х
зеньев мономера, можно воспользоваться выражением (3),
за-
гнив
в
нем индекс
п
на
х.
Тогда
*
Р
1М]
>бозначим
ftp
[Ml
(23)
(24)
:
;
Тогда выражение
(23)
после последовательной подстановки кон-
центраций радикалов
с
длиной цепи
х—
1,
х
— 2
и
т.д. до 1 может
быть
записано
в
виде
[Rxl-o'(l-o)
(25)
л-1
Полимерные молекулы образуются
в
результате
обрыва цепи.
Если обрыв цепи происходит путем диспропорционирования,
то
молекулы, содержащие
х
звеньев мономера, образуются
со
ско-
ростью
ш
х
щ=коШ
£
[R«]
(26)
л-1
Подставляя
в
(26) выражение (25), получаем
я-1
(27)
Если обрыв цепи происходит
в
результате
рекомбинации сво-
бодных радикалов, один
из
которых состоит из
/, а
другой
из
х
—
— / звеньев мономера,
и
при этом образуется молекула полимера,
содержащая
х
звеньев мономера,
то
скорость образования таких
молекул равна
X
JRiHR«_il
(28)
Г-о
Подставляя
в
(28) выражение (25)
и
заменяя индекс
х
сначала
на
I,
а
затем на
х
— /, получим
.2
(29)
Множитель
!
/
2
введен потому, что без этого множителя рекомби-
нация
каждой пары свободных радикалов учитывалась
бы
дваж-
631
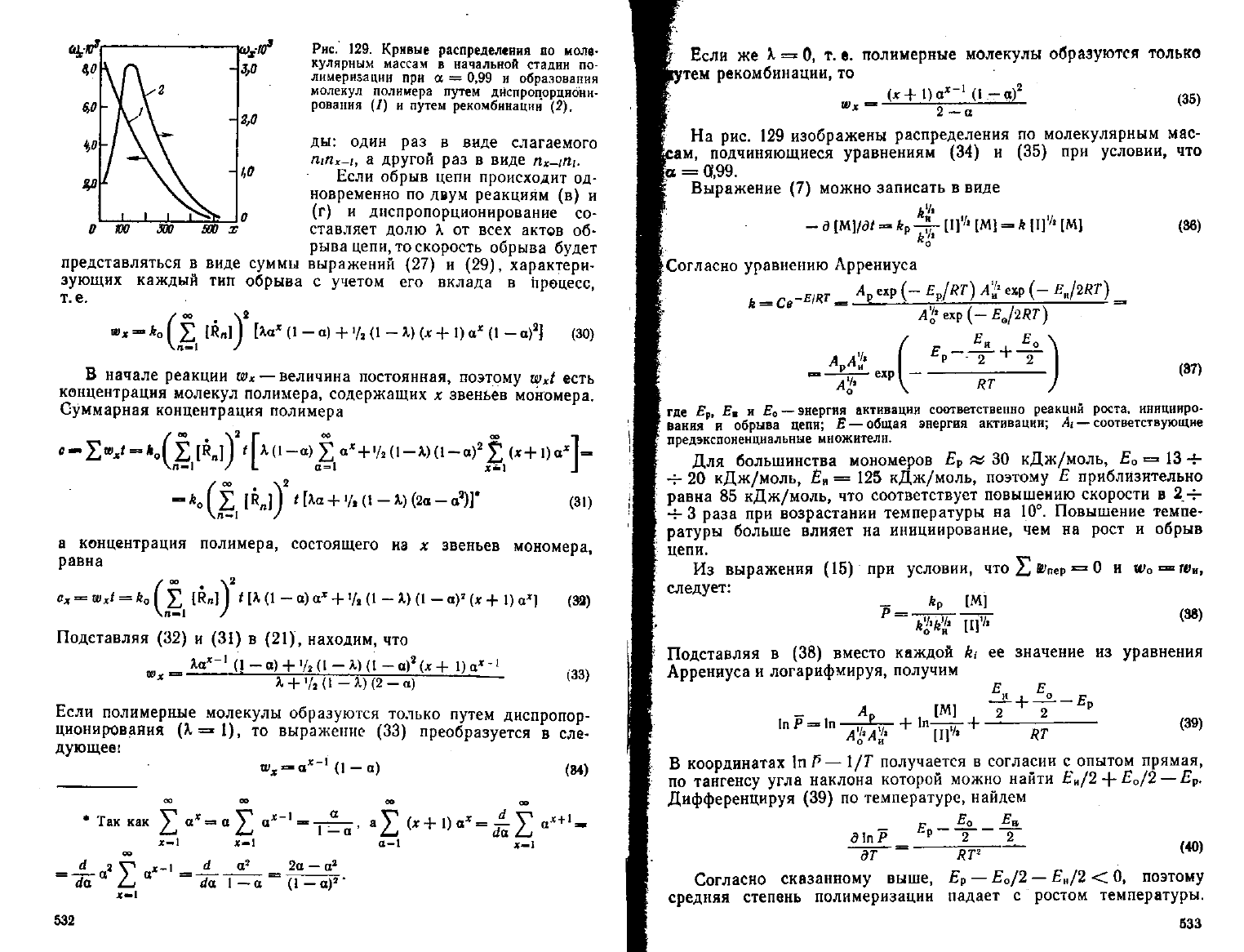
•яг
8,0
6,0
¥
в
\г\
V
V
)vA
/
t
I
юо
-
^
-
1
Г^Ь
300
500
х
3,0
-2,0
-1,0
Рис.
129.
Кривые распределения
оо
моле-
кулярным массам
в
начальной стадии
по-
лимеризации
при
а =
0,99
и
образования
молекул полимера путем днепропорцнонн-
рования
(/) и
путем рекомбинации
(2).
ды: один
раз
в
виде слагаемого
tiiiix-i,
а
другой
раз
в
виде n
x
-tn
{
.
Если
обрыв цепи происходит
од-
новременно
по
двум
реакциям
(в)
и
(г)
и
диспропорционирование
со-
ставляет долю
X от
всех
актов
об-
рыва цепи,
то
скорость обрыва
будет
представляться
в
виде суммы выражений
(27)
и
(29),
характери-
зующих каждый
тип
обрыва
с
учетом
его
вклада
в
процесс,
т.е.
л=1
-X)(x+l)a
x
(\
-af]
(30)
В начале реакции
w
x
—
величина постоянная, поэтому
w
x
t
есть
концентрация
молекул полимера, содержащих
х
звеньев мономера.
Суммарная концентрация полимера
f£
lK
\л-1
«
+ViO
-Л-) (2а -а
2
)]
2
)]*
(31)
а концентрация полимера, состоящего
из
х
звеньев мономера,
равна
(
°°
• \
2
У
[Rn}\ i[^{\~a)a*+4
1
(\-X)(l-ay(x+l)a
x
]
(33)
1
/
Подставляя
(32)
и
(31)
в
(21),
находим,
что
Ло*"
1
(l-ol
+
'/id-Wd-al
1
'/«(1-Я)
(2-а)
(33)
Если
полимерные молекулы образуются только путем диспропор-
ционирования
(А,=*1),
то
выражение
(33)
преобразуется
в
сле-
дующее:
п^
— а*"
1
(1-а)
(34)
da
L
х-1
x+
i
а-1
JC-I
JC—1
1
—
о
(1
-a)
2а-а
а
-я!»
1
532
Если
же
Л.
=« 0, т. в.
полимерные молекулы образуются только
рекомбинации,
то
(•-«)'
2~а
(35)
На
рис. 129
изображены распределения
по
молекулярным
мас-
:ам,
подчиняющиеся уравнениям
(34)
и
(35)
при
условии,
что
[о
=
01,99.
Выражение
(7)
можно записать
в
виде
-d[M]/d/-ft
p
-5-[I]'
^Согласно уравнению Аррениуса
ll]
Vl
[Ml
(Зв)
Е
—
expl
—
(37)
где
£
р
,
Яж
и
Ео
—
энергия активации соответственно реакций роста, иннцииро-
вания
и
обрыва цепи;
В —
общая энергия активации;
At —
соответствующие
предэкспоненцнальные
множители.
Для большинства мономеров
Е
р
»
30
кДж/моль,
Е
о
=
13 -*-
-г-
20
кДж/моль,
£
и
=
125
кДж/моль, поэтому
Е
приблизительно
равна
85
кДж/моль,
что
соответствует повышению скорости
в
2-г-
4-3 раза
при
возрастании температуры
на
10°.
Повышение темпе-
ратуры больше влияет
на
инициирование,
чем
на
рост
и
обрыв
цепи.
Из
выражения
(15) при
условии,
что
£
uW ==
0
и
W
O
™WH,
следует:
Р
=
[М]
(Зв)
Подставляя
в
(38)
вместо каждой
ki
ее
значение
из
уравнения
Аррениуса
и
логарифмируя, получим
Е
Е
In
Р
+
Ы
[М]
(39)
В координатах
In Я— \/Т
получается
в
согласии
с
опытом прямая,
по
тангенсу
угла
наклона которой можно найти Е
и
/2-\-
Е
о
/2 — Е
р
.
Дифференцируя
(39) по
температуре, найдем
dlnP
p
2 2
дТ
RT
2 (40J
Согласно сказанному выше,
Я
р
— £
о
/2 —
Е„/2
<
0,
поэтому
средняя
степень полимеризации падает
с
ростом температуры.
533

Например,
метилметакрилат
при
100 ^С
образует
полимер
со
сред-
ней
молекулярной массой
10500,
при
13СГС
—
7150,
а при
150°С
—5100.
При
фотополимеризации
Е
н
zz 0,
значение
Е
р
— Е
о
/2 >0 и по-
этому молекулярная масса полимера растет
с
повышением темпе-
ратуры.
§
2.
Сополимеризация
Методом сополимернзации различного типа мономеров
получают
полимеры
с
практически интересными физико-химическими свойст-
вами. Специфику процесса соиолимерпзации
при
свободнорадп-
кальной
полимеризации определяет реакция роста цепи.
Она
пол-
ностью определяет состав полимера. Реакции инициирования
и
обрыва цепи имеют много общего
с
аналогичными реакциями
при
гомоиолимернзацпн.
Скорость присоединения мопомсра
к
реагирующему свободному
радикалу зависит только
от
природы концевой группы полимер-
ного радикала. Будем рассматривать сополимеризацию
двух
видов
мономеров
М] и М
2
, из
которых образуются радикалы типа
Mi
и
М
2
.
Протекание реакции роста цепи возможно
по
четырем путям:
(а)
(б)
(г)
В правых частях этих уравнений записаны только концевые
группы радикалов,
а не
схематические формулы всего возникшего
радикала.
Это
сделано
в
соответствии
с том, что
скорость присо-
единения
мономера
к
растущему
свободному радикалу,
как
было
принято,
зависит только
от
природы концевой группы полимер-
ного радикала. Количеством радикалов, израсходованных
на ини-
циирование
и
обрыв цепи, пренебрегаем
как
малой величиной
но
сравнению
с
количеством радикалов, израсходованных
на
рост
цепи.
Скорость расходования мономера
М,, как
видно
из
возмож-
ной
схемы протекания реакций, определяется скоростями реак-
ций
(а) и (г):
-aiM.i/^^^uiM^fM.n-*;, [м,][м,]
(4i)
Аналогично скорость расходования мономера
М
а
определяется
скоростями реакций
(б) и (в):
-
д [Щ/dt -
k
2
» [М,] [М,]
Поделив
(41)
на
(42),
получим
i:
[M,l [М
2
]
[М.ПМ,]
(42)
(43)
Применяя
принцип стационарности, можно считать,
что кон-
центрации радикалов
-Mi и
-М
2
остаются постоянными,
т.е. ско-
.рость превращения
-Mi и
-М
2
должна быть равна скорости
пре-
'вращения
«М
2
в
-М;.
Другими словами:
откуда
[М
2
(44)
(45)
Подставляя
в (43)
вместо &
2
i[M2][Mi]
его
значения
из
фор-
мулы
(44) и
значение
[-М
2
] из
выражения
(45) и
умножая
чис-
литель
и
знаменатель правой части
на
[MJ/A^, получим
(46)
где
r
l
=k
ll
/k
l2
,
534
Уравнение
(46)
было получено рядом авторов (Алфреем, Гольд-
фингером,
Мейло, Льюисом, Уоллом, Сакурада) независимо
друг
от
друга.
Это уравнение показывает отношение изменения содержания
мономера
в
данный момент времени
в
зависимости
от
соотношения
мономеров
в
данный момент полимеризации. Константы сополиме-
ризации
п и г
2
представляют собой отношения констант скоростей
присоединения
к
данному радикалу своего
и
«чужого»
мономеров.
Если
Г[
> 1, это
значит,
что
радикал
-М]
присоединяет преиму-
щественно мономер
Mj,
если
г\
<С
1, это
указывает
на
большую
скорость присоединения
к
этому радикалу мономера
М
2
. На-
пример,
в
системе стирол
(Mi)
—
метилметакрилат
(М
2
)
Г\
=
0,52,
г
2
=
0,46,
т.е.
каждый радикал присоединяет
«чужой»
мономер
со скоростью приблизительно вдвое большей,
чем
скорость
при-
соединения своего собственного. Зависимость состава сополимера
от соотношения мономеров
в
исходной смеси показана
на
рис.
130.
Если
Г|Г
2
—
1,
система называется идеальной.
В
этом
случае
мономерные единицы обоих типов располагаются
в
цепи случайно,
соотношение количеств этих единиц
в
цепи определяется составом
мономерной смеси
и
относительной реакционной способностью
мономеров. Когда
г\г
2
—
1,
уравнение
(46)
переходит
в
уравнение
aMlAMMal^Ml/lMal
(47)
и
носит название
уравнения Уолла.
Если
Г]
= г
2
=0,
радикал
реагирует
исключительно
с
«чужим»
мономером. Мономерные единицы строго
чередуются
в
цепи
не-
зависимо
от
состава мономерной смеси.
Если
г\ = г
2
=
оо,
образуются только гомополимеры,
а не со-
полимеры. Большая часть известных систем характеризуются
тем,
что
0<
r\f2
< J, т.е. они
являются промежуточными
между
идеальными
и
регулярными системами. Если отношение
М
2
и Mi
535

О 0,2 0,4 0,8 0,8' w
Mf 0
CM9CL
М0Н0М8рОб,*0лЗШ
Рис.
130. Зависимость
состава
сополимера от соотношения мономеров в
исход-
ной
смеси при разных константах сополимеризации:
i
—П — 0.1;
Г,—10;
2 —
Г,=Г,—0,135;
3 — Г,-=10; г,=-0,1.
Рис.
131. Нахождение г, и г
а
по
методу
пересечения прямых.
в
полимере такое же, как и в исходной смеси мономеров, такие
сополимеры называются
аэеотропными.
Они образуются при
условии
(rx [Mi] + [M
2
] )/(r
3
[M,I + IMil) - 1 (48)
Тогда из выражения (46) вытекает
Из
выражения (47) получаем
1) (49)
При
этом условии мономерный состав сополимера не
будет
изме-
няться
в
ходе
сополимеризации и
будет
совпадать с составом ис-
ходной смеси. Если исходное соотношение мономеров отлично от
(г
2
— l)/(/"i — 1), то мономерный состав сополимера
будет
не-
прерывно
изменяться в
ходе
полимеризации.
Как
видно из приведенных примеров, константы сополимериза-
ции
имеют большое значение не только для понимания протекания
процесса сополимеризации, но и для уяснения состава получаемых
полимеров.
Константы сополимеризации чаще всего определяют
двумя методами: методом пересечения прямых и интегральным
методом, который также сводится к пересечению прямых. Метод
пересечения прямых заключается в следующем.
Уравнение (46) легко решить относительно г
2
:
/"я
[М,]Г<ИМ
[Mi
.1
J
(50)
Как
видно из выражения (50), связь констант Г] и г
2
при по-
стоянных отношениях [Mi]/[ЛЬ] и d[M
2
]/d[Mi] линейная. Для
каждого заданного на основании экспериментальных данных от-
ношения
<Э[М
г
]/<5[М1] и [Mi]/[M
2
] строится прямая, дающая
«ависимость г\ от Гг. Вследствие неточности экспериментальных
данных »ти прямые пересекаются в некоторой ограниченной об-
536
!асти. По среднему значению координат точек пересечения опре-
1еляют значения г\ и г
2
. Результаты
трех
опытов представлены
ia рис. 131.
Второй метод заключается в следующем. Интегрируя уравне-
ние
(46), получим
,_ [М
а
] _ гг ... [МдЫМ,]
8
[М
3
]
0
— Г\Г
2
1-г
2
(1 - г,) (1 -
(г, - I) ( [М,у[М
г
]
0
) - г, + 1
(51)
где [М]]о и [MJo — первоначальные концентрации монимеров М] и М
2
; [М[]
к IMJ
•*-
концентрации непрореагнровавшнх к
моменту
времени / мономеров.
Уравнение (51), если ввести величину
?-(1
преобразуется к виду
(62)
1
.
Я
g
(53)
[М,
Константы
г\ и г% определяют графически. Для этого проводят
процесс полимеризации и определяют молярные концентрации
обоих мономеров в начале реакции и в момент времени /. Эти зна-
чения
подставляют в уравнение (53). Положительные или от-
рицательные значения ц выбирают произвольно методом подбора.
Для того чтобы получить точки г
а
в соответствующей области,
значение
п рассчитывается для каждого из значений q с помощью
уравнения (53). Затем строят график r
2
—
f{r\).
При таком по-
строении
получается практически прямая
линия;
результаты опыта
с
другой смесью мономеров
дают
другую
прямую линию. По пере-
сечению прямых находят значения г\ и г
2
- Обычно проводят три
опыта и получают вместо точки пересечения — треугольник.
Для определения г\ и г
2
существует
и еще ряд методов, на
которых мы останавливаться не
будем.
Если известна k\\ — кон-
станта роста при гомополимеризации и г\ = k\\/k\
2
, то можно рас-
считать абсолютное значение k
l2
, характеризующее реакционно-
способность одного и того же мономера М
2
к различным радика-
лам -Mi. To же можно сказать и относительно константы kzi.
Способ
определения констант гомополимеризации был указан в
§
1 этой главы.
Рассмотренные уравнения сополимеризации хорошо оправды-
ваются во многих случаях. Однако иногда они оказываются плохо
применимыми.
Это наблюдается в тех случаях, когда: а) реак-
ционное
п
особ ноет
ь
мономеров зависит от природы мономерных
звеньев, предшествующих концевому звену; б) система — гетеро-
генная
или гомогенность системы нарушается в
ходе
процесса;
в) процесс образования полимера обратим; г) мономеры содержат
Бв7
