Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ
Подождите немного. Документ загружается.

Зона проводимости
\
.
i
i
£_
ft
V_
Валентная
зона
Рис.
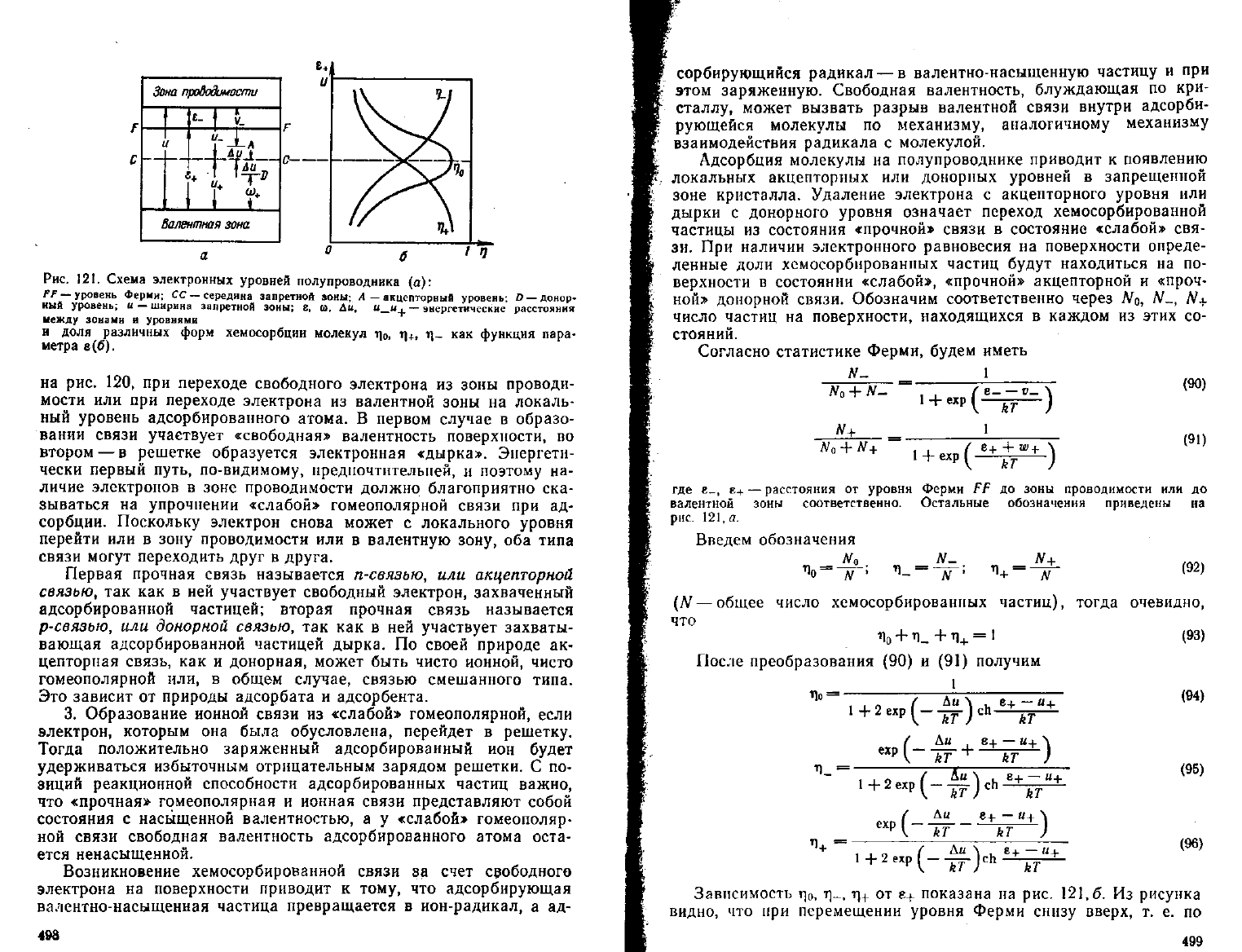
121. Схема электронных уровней полупроводника {а):
PF — уровень
Ферми;
СС — середина запретной
зоны;
А — акцепторный уровень; D — донор-
ный
уровень; и —ширина запретной
зоны;
8. и. Ди, и_и
+
— энергетические расстояния
между зонами я уровнями
и
доля различных форм хемосорбции молекул т|
0
, ц+, ц~ как
функция
пара-
метра
а(6).
на
рис. 120, при переходе свободного электрона из зоны проводи-
мости или при переходе электрона из валентной зоны на локаль-
ный
уровень адсорбированного атома. В первом
случае
в образо-
вании
связи
участвует
«свободная» валентность поверхности, по
втором — в решетке образуется электронная
«дырка».
Энергети-
чески первый путь, по-видимому, предпочтительней, и поэтому на-
личие электронов в зоне проводимости должно благоприятно ска-
зываться на упрочнении
«слабой»
гомеополярной связи при ад-
сорбции.
Поскольку электрон снова может с локального уровня
перейти или в зону проводимости или в валентную зону, оба типа
связи
могут
переходить
друг
в
друга.
Первая
прочная связь называется
п-связью,
или
акцепторной
связью,
так как в ней
участвует
свободный электрон, захваченный
адсорбированной частицей; вторая прочная связь называется
р-связью,
или
донорной
связью,
так как в ней
участвует
захваты-
вающая адсорбированной частицей дырка. По своей природе ак-
цепторная
связь, как и донорная, может быть чисто ионной, чисто
гомеополярной или, в общем случае, связью смешанного типа.
Это зависит от природы адсорбата и адсорбента.
3. Образование ионной связи из
«слабой»
гомеополярной, если
электрон,
которым она была обусловлена, перейдет в решетку.
Тогда положительно заряженный адсорбированный ион
будет
удерживаться избыточным отрицательным зарядом решетки. С по-
зиций
реакционной способности адсорбированных частиц важно,
что «прочная» гомеополярная и ионная связи представляют собой
состояния
с насыщенной валентностью, а у
«слабой»
гомеополяр-
ной
связи свободная валентность адсорбированного атома оста-
ется ненасыщенной.
Возникновение
хемосорбированной связи за счет свободного
электрона
на поверхности приводит к
тому,
что адсорбирующая
валентно-насыщенная
частица превращается в ион-радикал, а ад-
498
сорбирующийся радикал — в валентно-насыщенную частицу и при
этом заряженную. Свободная валентность, блуждающая по кри-
сталлу,
может вызвать разрыв валентной связи внутри адсорби-
рующейся молекулы по механизму, аналогичному механизму
взаимодействия радикала с молекулой.
Адсорбция молекулы на полупроводнике приводит к появлению
локальных акцепторных или донориых уровней в запрещенной
зоне
кристалла. Удаление электрона с акцепторного уровня или
дырки с донорного уровня означает переход хемосорбированной
частицы из состояния «прочной» связи в состояние
«слабой»
свя-
зи.
При наличии электронного равновесия на поверхности опреде-
ленные доли хсмосорбированиых частиц
будут
находиться на по-
верхности в состоянии
«слабой»,
«прочной» акцепторной и «проч-
ной» донорной связи. Обозначим соответственно через Л^, AL, N+
число частиц на поверхности, находящихся в каждом из этих со-
стояний.
Согласно статистике Ферми,
будем
иметь
(00,
N+
(91)
где е_,
е,+
— расстояния от уровня Ферми FF до зоны проводимости или до
валентной
зоны соответственно. Остальные обозначения приведены на
рис.
121, а.
Введем обозначения
^0
=
(92)
(N
— общее число хемосорбированных частиц),
тогда
очевидно,
что
% + л_ +
т]
+
=
1
(93)
После преобразования
(90)
и
(91)
получим
(94)
ехр
4,=
I
Аи
1гГ
т
. 8+ —
Ы
+
Ch
^kf—
kT )
£+
—
U
+
«pi-isr-
kT
ch
(95)
(96)
kT
Зависимость
х\§,
т]_,
TJ+
ОТ е+ показана на рис.
121,6.
Из рисунка
видно,
что при перемещении уровня Ферми снизу вверх, т. е. по
499
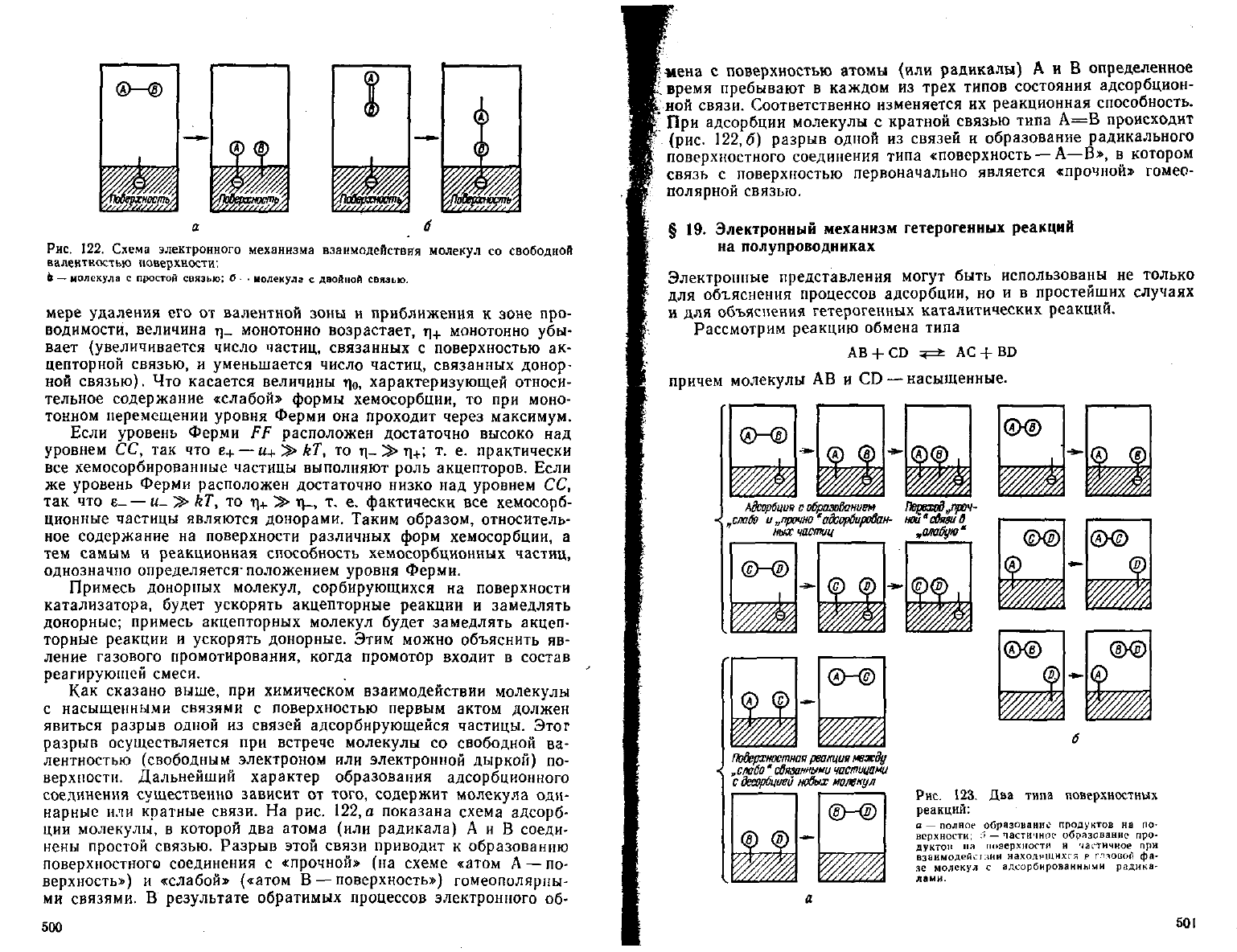
Рис.
122.
Схема
электронного
механизма
взаимодействия
молекул
со
свободной
валентностью
поверхности:
6
— молекула с
простой
связью; б
•
молекула с двойной связью,
мере удаления его от валентной зоны и приближения к зоне про-
водимости, величина т)_ монотонно возрастает, г\+ монотонно убы-
вает (увеличивается число частиц, связанных с поверхностью ак-
цепторной связью, и уменьшается число частиц, связанных донор-
ной
связью). Что касается величины tio, характеризующей относи-
тельное содержание
«слабой»
формы хемосорбции, то при моно-
тонном перемещении уровня Ферми она проходит через максимум.
Если уровень Ферми FF расположен достаточно высоко над
уровнем СС, так что е+ — u+^kT, то ri_ ^> rj+; т. е. практически
все хемосорбированные частицы выполняют роль акцепторов. Если
же уровень Ферми расположен достаточно низко над уровнем СС,
так что е- — и- ^> kT, то i}
+
>
TJ_,
т. е. фактически все хемосорб-
ционные
частицы являются донорами. Таким образом, относитель-
ное содержание на поверхности различных форм хемосорбции, а
тем самым и реакционная способность хемосорбционных частиц,
однозначно определяется-положением уровня Ферми.
Примесь донорных молекул, сорбирующихся на поверхности
катализатора,
будет
ускорять акцепторные реакции и замедлять
донорныс; примесь акцепторных молекул
будет
замедлять акцеп-
торные реакции и ускорять донорные. Этим можно объяснить яв-
ление газового промотирования, когда промотор
входит
в состав
реагирующей смеси.
Как
сказано выше, при химическом взаимодействии молекулы
с насыщенными связями с поверхностью первым актом должен
явиться разрыв одной из связей адсорбирующейся частицы. Этот
разрыв осуществляется при встрече молекулы со свободной ва-
лентностью (свободным электроном или электронной дыркой) по-
верхности. Дальнейший характер образования адсорбционного
соединения существенно зависит от того, содержит молекула оди-
нарные или кратные связи. На рис. 122, а показана схема адсорб-
ции
молекулы, в которой два атома (или радикала) А и В соеди-
нены
простой связью. Разрыв этой связи приводит к образованию
поверхностного соединения с «прочной» (на
схеме
«атом
Л — по-
верхность»)
и
«слабой»
(«атом В — поверхность») гомеополярпы-
ми
связями. В
результате
обратимых процессов электронного об-
500
1-мена
с поверхностью атомы (или радикалы) А и В определенное
. время пребывают в каждом из
трех
типов состояния адсорбцион-
ной
связи. Соответственно изменяется их реакционная способность.
При
адсорбции молекулы с кратной связью типа А=В происходит
(рис.
122,5)
разрыв одной из связей и образование радикального
поверхностного соединения типа «поверхность
—А—В»,
в котором
связь с поверхностью первоначально является «прочной» гомео-
полярной
связью.
§
19. Электронный механизм гетерогенных реакций
на
полупроводниках
Электронные представления
могут
быть использованы не только
для объяснения процессов адсорбции, но и в простейших случаях
и
для объяснения гетерогенных каталитических реакций.
Рассмотрим реакцию обмена типа
АВ + CD =F^ AC + BD
причем молекулы АВ и CD — насыщенные.
Адсорбция
с
образованием
Переход
„р
слабо
и
„прочно'адсорбирован- нои'ебявид
ных
частиц „слабую
*
Поверхностная
реакция между
„
слабо * ебшнными
чпе/ттами
с
десорбцией
новых
тлену
л
Рис.
123. Два
типа
поверхностных
реакций:
а — полное образование продуктов на по-
верхности; 0—частичное образование про-
дукгои на поверхности я частичное при
взанмодейепши находящихся р глювоЛ фа-
зе молекул с адсорбированными радика-
лами.
501
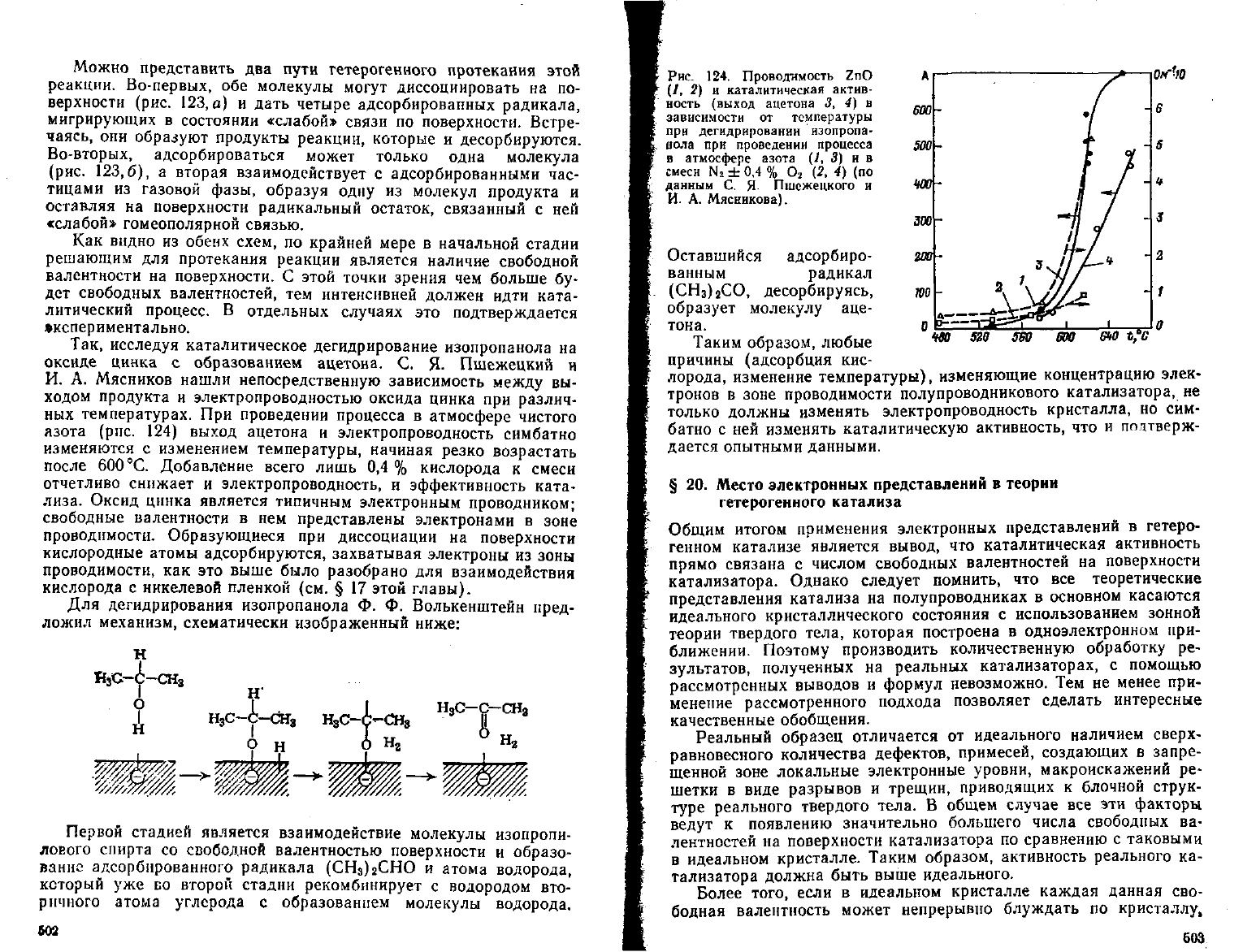
Можно
представить два пути гетерогенного протекания этой
реакции.
Во-первых, обе молекулы
могут
диссоциировать
на
по-
верхности (рис. 123, а)
и
дать четыре адсорбированных радикала,
мигрирующих
в
состоянии
«слабой»
связи по поверхности. Встре-
чаясь,
они образуют продукты реакции, которые
и
десорбируются.
Во-вторых, адсорбироваться может только одна молекула
(рис.
123,6),
а
вторая взаимодействует
с
адсорбированными час-
тицами
из
газовой фазы, образуя одну
из
молекул продукта
и
оставляя
на
поверхности радикальный остаток, связанный
с
ней
«слабой»
гомеополярной связью.
Как
видно из обеих схем, по крайней мере
в
начальной стадии
решающим для протекания реакции является наличие свободной
валентности на поверхности. С этой точки зрения чем больше бу-
дет свободных валентностей, тем интенсивней должен идти ката-
литический процесс.
В
отдельных случаях это подтверждается
•кспериментально.
Так,
исследуя каталитическое дегидрирование изопропанола на
оксиде цинка
с
образованием ацетона.
С. Я-
Пшежецкий
и
И.
А. Мясников нашли непосредственную зависимость
между
вы-
ходом продукта
и
электропроводностью оксида цинка при различ-
ных температурах. При проведении процесса
в
атмосфере чистого
азота (рис. 124)
выход
ацетона
и
электропроводность симбатно
изменяются
с
изменением температуры, начиная резко возрастать
после 600 °С. Добавление всего лишь 0,4 % кислорода
к
смеси
отчетливо снижает
и
электропроводность,
и
эффективность ката-
лиза. Оксид цинка является типичным электронным проводником;
свободные валентности
в
нем представлены электронами
в
зоне
проводимости. Образующиеся при диссоциации
на
поверхности
кислородные атомы адсорбируются, захватывая электроны из зоны
проводимости, как это выше было разобрано для взаимодействия
кислорода
с
никелевой пленкой (см.
§
17 этой главы).
Для дегидрирования изопропанола Ф. Ф. Волькенштейн пред-
ложил механизм, схематически изображенный ниже:
н
ЙзС-С-СНа
О
И"
:4-с
'S////A2.V/
/
//,
••*-
'•'///A'VS/SA
НзС-С-СНз
HsC-'
О
н
М
"2
Первой
стадией является взаимодействие молекулы изопропи-
лового спирта со свободной валентностью поверхности
и
образо-
вание адсорбированного радикала
(СНзЬСНО
и
атома водорода,
который
уже
во
второй стадии рекомбннирует
с
водородом вто-
ричного атома
углерода
с
образованием молекулы водорода.
603
At
600 6kO
t,C
Рис.
124. Проводимость ZnO
(/,
2) и
каталитическая актив-
ность
(выход ацетона
3, 4) в
зависимости
от
температуры
при
дегидрировании изопропа-
нола
при проведении процесса
в
атмосфере азота (1, 3)
и в
смеси
N
s
±0,4%
О
г
(2,
4)
(по
данным
С. Я
Пшсжецкого
и
И.
А. Мясннкова).
Оставшийся адсорбиро-
ванным
радикал
(СН
3
)
2СО, десорбируясь,
образует
молекулу
аце-
тона.
Таким
образом, любые
причины
(адсорбция
кис-
лорода, изменение температуры), изменяющие концентрацию элек-
тронов
в
зоне проводимости полупроводникового катализатора,
не
только должны изменять электропроводность кристалла,
но сим-
батно
с
ней
изменять каталитическую активность,
что
и
подтверж-
дается опытными данными.
§
20.
Место электронных представлений
в
теории
гетерогенного катализа
Общим итогом применения электронных представлений
в
гетеро-
генном
катализе является вывод,
что
каталитическая активность
прямо
связана
с
числом свободных валентностей
на
поверхности
катализатора. Однако
следует
помнить,
что все
теоретические
представления катализа
на
полупроводниках
в
основном касаются
идеального кристаллического состояния
с
использованием зонной
теории
твердого
тела,
которая построена
в
одноэлектронном
при-
ближении.
Поэтому производить количественную обработку
ре-
зультатов, полученных
на
реальных катализаторах,
с
помощью
рассмотренных выводов
и
формул невозможно.
Тем не
менее
при-
менение
рассмотренного
подхода
позволяет сделать интересные
качественные обобщения.
Реальный
образец отличается
от
идеального наличием
сверх-
равновесного количества дефектов, примесей, создающих
в
запре-
щенной
зоне локальные электронные уровни, макроискажений
ре-
шетки
в
виде разрывов
и
трещин, приводящих
к
блочной струк-
туре
реального
твердого
тела.
В
общем
случае
все эти
факторы
ведут
к
появлению значительно большего числа свободных
ва-
лентностей
на
поверхности катализатора
по
сравнению
с
таковыми
в
идеальном кристалле. Таким образом, активность реального
ка-
тализатора должна быть выше идеального.
Более того, если
в
идеальном кристалле каждая данная
сво-
бодная валентность может непрерывно
блуждать
по
кристаллу»
603

переходя от одного участка поверхности к
другому,
уходя
с по-
верхности в
глубь
решетки и обратно, в реальном кристалле на
поверхности неизбежно
будут
существовать ловушки, в которых
свободная валентность локализуется и значительно большее вре-
мя
существует
в фиксированном состоянии. Такими ловушками
могут
быть любые поверхностные нарушения решетки и в первую
очередь атомы катализатора, в той или иной степени утратившие
свои связи с решеткой. Следовательно, в реальном кристалле не
только значительная доля свободных валентностей локализована,
но
и распределение свободных валентностей
между
поверхностью
и
объемом по сравнению с распределением в идеальном
случае
сдвинуты «в
пользу»
поверхности.
Основная
идея большинства теорий активных центров сводится
к
тому,
что активный центр,
будь
то
«пик»
Тейлора,
«мультиплет»
Баландина
или
«ансамбль»
Кобозева, является образованием, в
той или иной мере разорвавшим свои связи с кристаллом. Это
подтверждается и с позиций электронных представлений.
Не
следует
думать,
что электронные теории в гетерогенном ка-
тализе призваны заменить уже существующие теоретические кон-
цепции.
Рассматривая каталитический акт в новом аспекте, эти
теории
дают
новое истолкование уже сложившимся и апробиро-
ванным
понятиям, открывают путь к более глубокому познанию
установленных фактов, например, особому по сравнению с нор-
мальной решеткой состоянию активного центра, составу центра,
избирательности и специфичности действия катализатора и т. п.
ГЛАВА
XV
КИНЕТИКА
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
§
1.
Ферменты
Ферменты,
или
энзимы
— это белки, играющие роль катализато-
ров в живых системах. Молекулярная масса этих белковых моле-
кул составляет Ш
4
~- 10
7
.
Первоначальная
структура
ферментов состоит из аминокислот-
ных остатков, соединенных линейными ковалентными (пептидны-
ми) связями. Макромолекула белка состоит из закономерно рас-
положенных аминокислотных остатков, т. е. построена по опреде-
ленному коду. Подавляющее большинство известных белков мо-
жет быть построено всего только из 20 аминокислот.
Свойства каждого белка зависят от характерной для него по-
следовательности аминокислотных остатков. Ферментные белки
могут
быть получены в кристаллических состояниях.
Известно
около 200 кристаллических ферментов. Всякие воз-
действия, нарушающие упорядоченную
структуру
белка, такие,
604
как
повышение температуры, действие некоторых растворителей,
приводят к его денатурации. Денатурированные белки не способ-
. ны кристаллизоваться и теряют свойства катализаторов.
Ферменты относятся к глобулярным белкам, поэтому кроме
первичной,
вторичной и третичной
структур
имеют так называе-
мую четвертичную
структуру.
Глобула
строится таким образом,
что некоторые полипетидные цепи или части этих цепей скручи-
ваются в спираль, а затем такие сложные структуры, содержащие
скрученные цепи, определенным образом укладываются в про-
странстве.
Характер спирализации цепи называют
вторичной
структурой.
Третичная
структура
характеризует пространственную укладку
частично или полностью скрученной полипептидной цепи. Образо-
вание спиралей, если не учитывать действия боковых цепей, мож-
но
объяснить наличием межвитковых водородных связей, соеди-
няющих группы
—NH—
и —СО— удаленных аминокислотных
остатков. Образование таких связей сопровождается выигрышем
энергии
5,8 кДж на моль связей. Характер объединения струк-
турно независимых единиц в одну
глобулу
называется
четвертич-
ной
структурой
белка.
Каталитическое действие ферментов связано с наличием в бел-
ковых макромолекулах некоторых участков, играющих роль ак-
тивных центров. Для того чтобы центр имел высокую каталитиче-
скую активность, он должен быть определенным образом располо-
жен в макромолекуле.
В состав активного центра ферментов
входят
кислотные или
основные
группы, находящиеся в необходимом для данного типа
реакции
состоянии ионизации. В состав каталитических центров
большинства изученных ферментов в различном сочетании
входят
имидазол гистиднна, флавины, тиоловая группа цистеина, карб-
оксильные группы аспарагиновой и глутаминовой кислот, спирто-
вая
группа серина, пиродоксалевая группа и некоторые другие.
Кислотно-основные
группы
входят
в состав молекул
всех
бел-
ков,
однако не все белки являются катализаторами. Это объясня-
ется тем, что только при вполне определенном расположении этих
групп
друг
относительно
друга,
т. е. только при строго определен-
ной
вторичной, третичной, а иногда и четвертичной
структуре
белка, эти кислотно-основные группы становятся активными ка-
талитическими центрами. Поэтому функциональные группы, вхо-
дящие в состав ферментов, проявляют свойства, не характерные
для них в низкомолекулярных соединениях.
Ферменты высокоспецифичны по отношению к субстратам.
Между реагирующими молекулами или их превращающимися
группами и активными центрами ферментов должно быть струк-
турное соответствие. Этим объясняется не только высокая специ-
фичность,
но и стереоспецифичность ферментов. Субстрат компле-
ментарно присоединяется к ферменту. Стереоспецифичность ярко
проявляется в способности некоторых ферментов превращать либо
только
£.-форму, либо
только
D-форму
субстрата.
806

На
участке фермента, в котором находится активный центр,
всегда имеется строго определенная последовательность аминокис-
лотных остатков. Например, глицеральдегидфосфатдегидрогеназы,
выделенные из дрожжей и из мышц кролика, имеют в целом раз-
ный
аминокислотный состав, но последовательность аминокислот
в
области активного центра на протяжении 18 остатков у них
одинакова. Это явление характерно для высокоспецифичных
ферментов.
У менее специфичных ферментов в последователь-
ности
аминокислот активного центра наблюдаются небольшие
вариации.
Активность фермента определяется не только химическим
строением активного центра, но и конформацией фермента.
Инак-
тивация
фермента может происходить или в
результате
изменения
химического состава активного центра, или вследствие изменения
конформации.
Последнее в ряде случаев приводит к
тому,
что
активный
центр становится недоступным. Возможности небольших
изменений
конформации в области активного центра позволяют
наилучшим способом объединить молекулы субстрата с активным
центром при образовании активного промежуточного продукта.
Лучшему
взаимодействию субстрата с ферментом способствует
также и то, что в макромолекуле фермента имеются области, на
которых происходит адсорбция молекулы субстрата на необходи-
мых расстояниях от активного каталитического центра, что спо-
собствует
протеканию химического процесса. Адсорбционные цент-
ры обеспечивают доступ к каталитическому центру только вполне
определенным молекулам. Это обстоятельство приводит к
тому,
что многие ферменты, в отличие от известных гомогенных и гете-
рогенных катализаторов, проявляют абсолютную субстратную спе-
цифичность,
т. е. каждый фермент способен осуществлять обра-
тимое или необратимое превращение только одного субстрата или
одной
пары (для бимолекулярных процессов) субстратов в соот-
ветствующие продукты, проявляя инертность к гомологам суб-
стратов. Есть ферменты, называемые малоспецнфичными, которые
ускоряют несколько разных типов реакций, но и они часто оказы-
ваются абсолютно специфичными по отношению к одной опреде-
ленной
реакции.
Структурные данные, указывающие способ пространственной
укладки полипептидной цепи, т. е. раскрывающие третичную струк-
туру
белковых
глобул,
подтверждают наличие адсорбционных
центров,
построенных в виде
«щели»
и расположенных недалеко
от каталитических центров. Так, активный центр карбоангидразы
представляет собой некоторую
«щель»,
на дне которой и распола-
гается каталитический участок. Эти
«щели»
имеют вполне опре-
деленные геометрические размеры и такое распределение поляр-
ных и неполярных групп, которое позволяет пропускать к ката-
литическим центрам и придавать необходимую ориентацию
молекулам со строго определенным строением и химическими
свойствами. Этим самым обусловливается специфичный отбор суб-
стратов.
506
Из-за
возможности небольших изменений конформации макро-
f молекул ферментов адсорбционный центр в виде
«щели»
в
глобуле
является в некоторой мере подвижной структурой. На рис. 125
приведена грубая схема строения
глобул
фермента, на которой
показаны
каталитические и адсорбционные центры.
Как
уже сказано, высокая специфичность ферментов проявля-
ется не только по отношению к химическому составу реагентов,
но
и к их пространственному строению. Например, если молекула
продукта реакции содержит асимметрический атом, а молекула
исходного субстрата симметрична, значит фермент осуществляет
асимметрический синтез одного изомера. Если же исходное веще-
ство представляет собой рацемическую смесь, фермент ускоряет
превращение только одного изомера. Если в качестве исходных
веществ
берут
цис- и гране-изомеры, высокоспецифичный фермент
изменяет скорость реакции только одного стереоизомера.
Специфичность
ферментов можно подразделить на следующие:
1) абсолютную специфичность, например, уреаза, ускоряющая ги-
дролиз мочевины, не оказывает никакого действия на ее произ-
водные; 2) абсолютную групповую специфичность, когда фермент
катализирует превращение определенных категорий соединений,
например,
алкогольдегидрогеназа катализирует окисление в при-
сутствии специфического субстрата (см. ниже) этилового спирта
в
альдегид, но она способствует, хотя и в меньшей степени, и
окислению
неразветвленных спиртов нормального строения; 3) от-
носительную групповую специфичность, которой обладает трипсин,
способный
гидролизовать пептидную связь и действовать как экс-
траза при условии, что карбонильная группа пептидной или
эфир-
ной
связи принадлежит лизину или аргинину — аминокислоте, бо-
ковая
цепь которой имеет положительный заряд; 4) стереохимиче*
скую специфичность (ферменты способны отличать свой
субстрат
от его оптического изомера, например, окендаза L-аминокислот не
действует
на D-аминокислоты). Стереоспецифичность указывает;
что во взаимодействии субстрата с ферментом должно участвовать
по
крайней мере три из четырех заместителей у оптически актив-
ного атома
углерода.
Экспериментальные данные показывают, что кислотно-основ-
ные
группы фермента должны находиться в определенном состоя-
нии
ионизации. Поэтому актив-
ность ферментов сильно зави-
сит от рН среды, в которой
протекает биохимическая реак-
ция.
Для каждого фермента
существует
такая область зна-
чений
рН, в которой актив-
ность фермента наибольшая.
Рис.
125. Схема адсорбции субстра-
та в
глобулах
фермента.
Каталитические
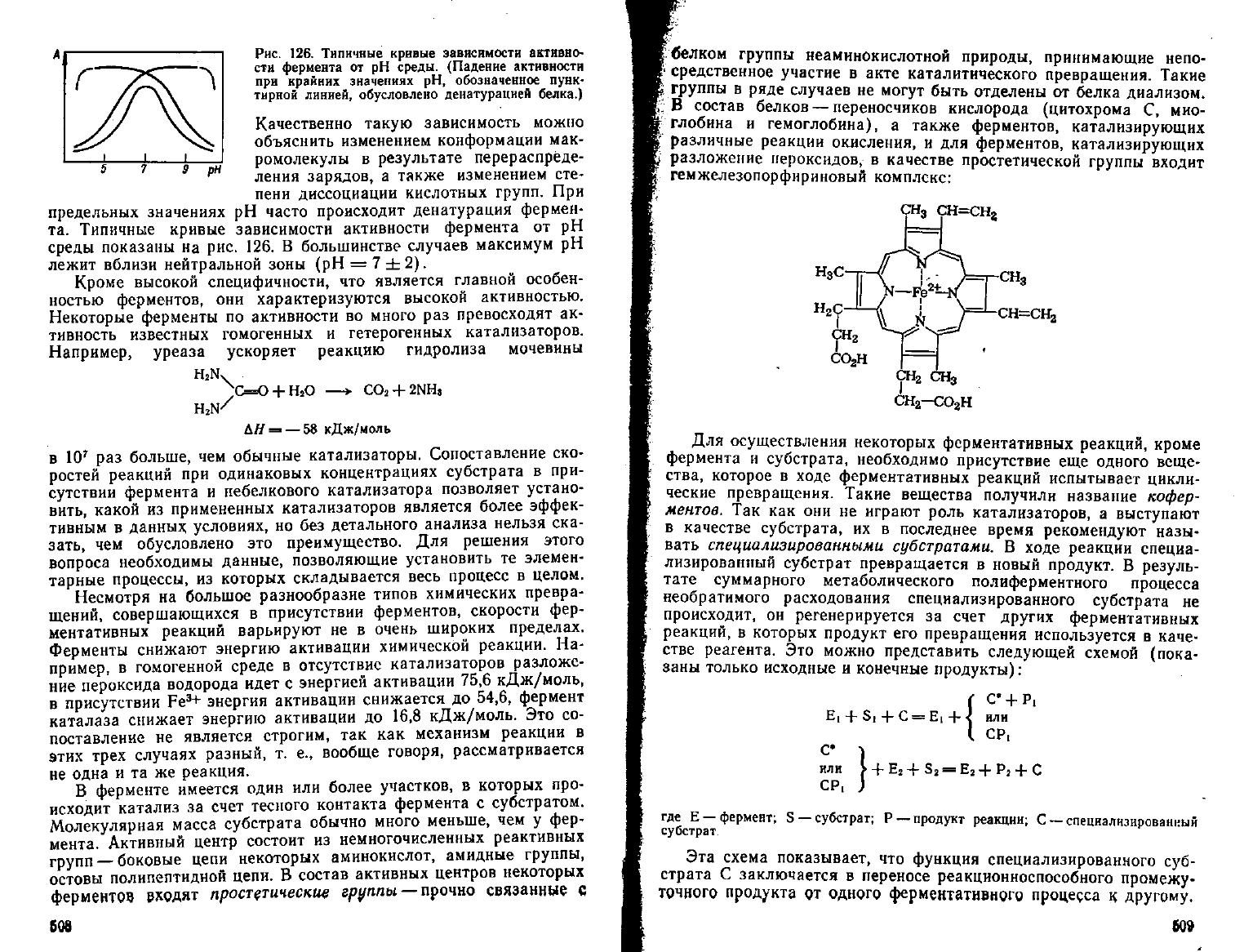
Рис.
126. Типичные кривые зависимости активно-
сти фермента от рН среды. (Падение активности
при
крайних значениях рН, обозначенное пунк-
тирной
линией, обусловлено денатурацией белка.)
Качественно такую зависимость можно
объяснить изменением конформации мак-
ромолекулы в
результате
перераспреде-
ления
зарядов, а также изменением сте-
пени
диссоциации кислотных групп. При
предельных значениях рН часто происходит денатурация фермен-
та. Типичные кривые зависимости активности фермента от рН
среды показаны на рис. 126. В большинстве случаев максимум рН
лежит вблизи нейтральной зоны (рН = 7 ±2).
Кроме
высокой специфичности, что является главной особен-
ностью ферментов, они характеризуются высокой активностью.
Некоторые ферменты по активности во много раз превосходят ак-
тивность известных гомогенных и гетерогенных катализаторов.
Например,
уреаза ускоряет реакцию гидролиза мочевины
v
:с=о
+ н
2
о
СО
2
+ 2NH,
ДЯ = — 58 кДж/моль
в
10
г
раз больше, чем обычные катализаторы. Сопоставление ско-
ростей реакций при одинаковых концентрациях субстрата в при-
сутствии фермента и небелкового катализатора позволяет устано-
вить, какой из примененных катализаторов является более
эффек-
тивным в данных условиях, но без детального анализа нельзя ска-
зать, чем обусловлено это преимущество. Для решения этого
вопроса необходимы данные, позволяющие установить те элемен-
тарные процессы, из которых складывается весь процесс в целом.
Несмотря
на большое разнообразие типов химических превра-
щений,
совершающихся в присутствии ферментов, скорости фер-
ментативных реакций варьируют не в очень широких пределах.
Ферменты снижают энергию активации химической реакции. На-
пример,
в гомогенной среде в отсутствие катализаторов разложе-
ние
пероксида водорода идет с энергией активации 75,6 кДж/моль,
в
присутствии
Fe
3
+
энергия активации снижается до 54,6, фермент
каталаза снижает энергию активации до 16,8 кДж/моль. Это со-
поставление не является строгим, так как механизм реакции в
этих
трех
случаях разный, т. е., вообще говоря, рассматривается
не
одна и та же реакция.
В ферменте имеется один или более участков, в которых про-
исходит катализ за счет тесного контакта фермента с субстратом.
Молекулярная масса субстрата обычно много меньше, чем у фер-
мента. Активный центр состоит из немногочисленных реактивных
групп — боковые цепи некоторых аминокислот, амидные группы,
остовы полипептидной цепи. В состав активных центров некоторых
ферментов
входят
простатические
группы
— прочно связанные С
Е белком группы неаминокислотной природы, принимающие непо-
I
средственное участие в акте каталитического превращения. Такие
| группы в ряде случаев не
могут
быть отделены от белка диализом.
f;• В состав белков — переносчиков кислорода (цитохрома С, MHO-
S' глобина и гемоглобина), а также ферментов, катализирующих
I
различные реакции окисления, и для ферментов, катализирующих
" разложение иероксидов, в качестве простетической группы
входит
гемжелезопорфириновый комплекс:
сн
3
сн=сн
г
н
3
с
н
2
с
сн
3
СН
2
-СО
2
Н
Для осуществления некоторых ферментативных реакций, кроме
фермента и субстрата, необходимо присутствие еще одного веще-
ства, которое в
ходе
ферментативных реакций испытывает цикли-
ческие превращения. Такие вещества получили название
кофер-
ментов.
Так как они не играют роль катализаторов, а выступают
в
качестве субстрата, их в последнее время рекомендуют назы-
вать
специализированными
субстратами.
В
ходе
реакции специа-
лизированный
субстрат
превращается в новый продукт. В резуль-
тате
суммарного метаболического пол
и
ферментного процесса
необратимого расходования специализированного субстрата не
происходит, он регенерируется за счет
других
ферментативных
реакций,
в которых продукт его превращения используется в каче-
стве реагента. Это можно представить следующей схемой (пока-
заны
только исходные и конечные продукты):
Е,
С
или
чи >
p.
J
где Е — фермент; S —
субстрат;
Р
субстрат.
С'+Р,
или
СР,
продукт реакции; С —специализированный
Эта схема показывает, что функция специализированного суб-
страта С заключается в переносе реакционноспособного промежу-
точного продукта от одного ферментативного процесса к
другому.
Ш

В каталитических свойствах ферментов определенную роль иг-
рают ионы металлов. Они
могут
быть; 1) ингибиторами (напри-
мер,
ионы Ag+, Hg+,
Pb
2+
);
2) активаторами, не участвующими
непосредственно в акте катализа, но способствующими сорбции
субстрата или взаимодействию субстрата с активным центром,
или
образованию четвертичной структуры фермента (четыре иона
цинка
стабилизируют
структуру
алкогольдегидрогеназы, состоя-
щей
из четырех субединиц); 3) активаторами, входящими в состав
активных центров ферментов или в простетические группы и по-
этому непосредственно участвующими в каталитических реакциях
(например,
в состав активного центра карбоксипептидазы А вхо-
дит
Zn
2+
,
лейцинаминопептидазы —
Мп
2+
,
или
Mg
2
+,
аскорбатокси-
дазы —
Си
2+
,
гидрогеназ —
Fe
2+
).
Вся система реактивных групп фермента имеет строго опреде-
ленную конформацию. Небольшие изменения конформации актив-
ного центра объясняют возможность регулирования активности
фермента. Субстрат может вызвать конформационные изменения,
которые активируют фермент.
Опыт показывает, что механизм ферментативного катализа
сводится к процессам нуклеофильного и электрофильного или об-
щего кислотно-основного катализа. Трансферазы, гидролазы, нзо-
меразы, лиазы и большая часть оксиредуктаз оказались кислотно-
основными
катализаторами.
Реакции,
катализируемые ферментами, можно разделить на
два класса: реакции, сводящиеся к переносу электронов; реакции,
сопровождающиеся переносом и электронов, и протонов. Фермент
обычно содержит кислотный и основной остатки. Высокая
эффек-
тивность действия фермента часто объясняется одновременным
действием этих групп. Например, можно предположить, что при
ферментативном гидролизе эфиров происходит одновременно нук-
леофильная
атака на карбонильный атом
углерода
основной груп-
пой
и передача протона к активному атому кислорода от кислот-
ной
группы. Такой «пуш-пульный» механизм является очень эф-
фективным.
В гл. XIII, § 5 показано, что в реакции мутаротации глюкозы
катализаторами являются фенол (а), пиридин (б) и 2-гидрокси-
пиридин
(в):
ОН
N
N
ОН
2-Оксипиридин более слабая кислота, чем фенол, и более сла-
бое основание, чем пиридин. Однако 2-гидроксипиридин более
активный
катализатор, чем фенол и пиридин, так как
действует
по
«пуш-пульному»
механизму.
Тесный
контакт активного центра фермента с субстратом при-
водит к образованию промежуточного соединеия, которое претер-
«10
зевает дальнейшие изменения с образованием конечного продукта
о
механизму внутримолекулярной реакции. В стерически выгод-
ных условиях внутримолекулярные реакции протекают быстрее,
чем соответствующие межмолекулярные превращения. Это может
быть еще одной причиной высокой скорости ферментативных ре-
акций.
Обычно продукт ферментативной реакции имеет иную струк-
туру
и меньшее сродство к активному центру, чем
субстрат,
по-
этому фермент легко освобождается от конечных продуктов реак-
ции.
Однако в некоторых случаях продукты реакции
ведут
себя
как
конкурентные ингибиторы (см. гл. XV, § 3).
§
2. Кинетика ферментативных реакций
Реакции
с
одним
субстратом
Скорость ферментативных реакций обычно прямо пропорциональ-
на
концентрации фермента в первой степени. Характерно, что при
заданной
концентрации введенного фермента скорость реакции
вначале линейно изменяется с концентрацией субстрата, а затем
становится независимой от концентрации субстрата. Зависимость
скорости реакции от концентрации субстрата показана на
рис.
127, а.
Наблюдающуюся зависимость можно объяснить, если предпо-
ложить, что процесс протекает в две стадии:
Е+
S
Е + Р
где ES--комплекс; Р — конечный продукт.
(а)
(б)
Рис.
127. Кривая зависимости скорости ферментативной реакции от концентра-
ции
субстрата
(а), соответствующая уравнению (Ь), н графические методы опре-
деления
ш
оР
«
д
и А« (6, в, г).
611

Пользуясь принципом стационарности, можно записать
*i [EJ [S] - fe
2
[ES] - ft
3
[ES] = 0
(I)
Общая начальная концентрация фермента
[Е]
о
равна концентра-
ции свободного фермента
[Е]
плюс концентрация комплекса
[ES],T.
е.
l] tES] (2)
Подставляя значение [Е], найденное из выражения (2), в вы-
ражение (1) и решая полученное уравнение относительно [ESj,
получим
[ES]
= ft,
[Е]
о
l$]/(k
2
+ k
3
+ ft, [S]) (3)
Скорость образования конечного продукта Р согласно принятой
схеме
(4)
(5)
Подставляя в (4) выражение (3), находим
ft
2
+
ft
a
+
ft,[S]
ft
m
+[S]
Это уравнение было получено другими способами в 1903 г. Анри
и
в 1913 г. Михаэлисом и Ментен. Константу
k
m
~(k2
+
£з)/&1
на-
зывают
константой
Михаэлиса.
Из
выражения (5) видно, что если [S] < k
m
, то
т. е.
будет
наблюдаться первый порядок реакции по
субстрату.
Если
[S] > k
m
, то
w = «з [Ejo (7)
Порядок
реакции по
субстрату
в этом
случае
нулевой, а скорость
реакции
соответствует предельной (см. рис. 127,а).
Скорости
различных ферментативных реакций удобно сравни-
вать при насыщении субстратом, т. е. при таких концентрациях
субстрата, когда скорость реакции перестает зависеть от концен-
трации последнего.
Величина k$ в выражении (7) имеет размерность t~
x
. Эту ве-
личину часто называют числом оборотов, так как она показывает
число молекул субстрата, превращаемых в продукт одним актив-
ным
центром фермента в единицу времени. Однако примени-
мость уравнения (5) для описания кинетики ферментативной ре-
акции
вовсе не означает, что справедлива рассмотренная схема.
Легко можно показать, что и более сложные схемы протекания
ферментативных реакций приводят к уравнению (5). В этих слу-
чаях константа k
3
не имеет того смысла, который ей придает реак-
ция
(б). В эту константу может входить ряд констант скоростей
реакции
более сложных схем, и
тогда
константа &
3
не сможет слу-
жить мерой числа оборотов.
612
К
уравнению (5), как
будет
показано ниже, можно прийти Й
в
случае
реакций, которые протекают через два промежуточных
комплекса
по
схеме
E + S ч=* ES ^=fc ES' —• Е+Р
а также
(при
некоторых упрощениях)
и в
случае
реакций,
в ко-
торых
участвуют
два
субстрата.
Выражение
(5) для
начальной скорости
w
0
,
когда
[S] = [S]
o
,
можно переписать
в
виде
Если
то
(ft
m
/[SlobFT
(8)
»о-*>[ЕЬ/2
(В)
т.
е.
константа Михаэлиса
k
m
численно равна
той
концентрации
субстрата,
при
которой начальная скорость реакции равна поло-
вине
предельной скорости,
так как
согласно
(7)
величина
й
э
[Е]
0
соответствует предельной скорости.
Значения
k
m
и
предельной скорости реакции, равной Аз[Е]
0
,
находят обычно одним
нз
трех
способов, основанных
на
преобра-
зовании
выражения
(8) к
виду линейного уравнения. Обозначим
для
удобства
величину £
3
[Е]
0
через ш„ред. Тогда
из
уравнения
(8)
получим
1
1 k
m
I
а*о "'пред ©пред
~Що
Отсюда видно, что в координатах \/w
0
—
1/[S]
O
получитс-я
прямая
(см. рис. 127). Отрезок, отсекаемый этой прямой на оси
ординат,
будет
равен
1/ш
П
ре
Д
,
а тангенс
угла
наклона прямой ра-
вен
ftm/йУпред-
Таким образом легко и достаточно точно определяют
две важные константы, характеризующие кинетику ферментатив-
ной
реакции, Шпред и k
m
- Как видпо из рис.
127,6,
константу km
можно определить и по отрицательному отрезку, отсекаемому на
оси
абсцисс, так как при 1/ш
о
= О, l/w =
k
m
/w
npea
[S]o
Кроме
того, выражение (8) можно переписать в виде
откуда
В координатах w
0
— Wo/[S]
0
получится прямая, с помощью ко-
торой легко определить
пу
пР
ед
и k
m
(рис. 127,в).
Умножая (10) на [S]
o
, получим
1S1
°- *- • ' г.»
Отсюда видно, что зависимость [S]
0
/a>o от [S]
o
является ли-
нейной
(рис. 127, г).
Зная
предельную скорость, по уравнению (9) можно рассчи-
тать значение А
3
—константы скорости
распада
комилекса
ES, a
17
80$
513

зная
km, рассчитать по выражению (3) стационарную концентра-
цию комплекса [ES]. Труднее найти константы k\ и k%. Для их
определения необходимо экспериментально изучить кинетику про-
цесса в широком интервале концентраций.
Применение метода стационарных концентраций для реакции,
протекающей по
схеме
E+S
*==*
ES 4=t ES' ^ Е + Р
приводит к уравнению
где
| эфф
+ [S]
o
)
(13)
'эфф
[Е]
с
Уравнение (13) формально аналогично уравнению (5), но
смысл констант, входящих в него, иной. Поэтому, пользуясь урав-
нением (5), нельзя сказать, как же в действительности протекает
процесс — образуется конечный продукт из первого возникшего
промежуточного соединения или реакция протекает с образова-
нием ряда промежуточных продуктов. Примером реакции, проте-
кающей через два промежуточных комплекса, является реакция,
катализируемая пероксидазой. Бурый фермент сначала приобре-
тает
зеленую окраску (образуется ES), а затем становится крас-
ным (образуется ES').
Реакции
с
двумя
субстратами
Многие ферментативные реакции протекают с участием
двух
суб-
стратов. В простейшем
случае
катализатор, образуя с
субстра-
том Si промежуточный комплекс, активирует только
субстрат
Si
E + S,
Продукт же реакции возникает в
результате
взаимодействия ком-
плекса со вторым субстратом
ES,
+ S; —*-*• Е + Р
Для этой кинетической схемы характерно, что процесс распада
комплекса является бимолекулярным. Применяя условия стацио-
нарности, для стационарной начальной концентрации получим вы-
ражение, отличающееся от ранее найденного (3) тем, что в него
входит
начальная концентрация
субстрата
[S]o и вместо кон-
станты k
3
— величина Д'зЕЗзЬ т. е.
[ES[]3
M^UEb
(Н)
Начальная скорость реакции
будет
равна
Обычно изучают зависимость начальных скоростей от исход-
ных концентраций каждого из компонентов при постоянной кон-
центрации
другого
участника реакции. Если постоянной поддер-
живается концентрация [Бг] = с
2
, то уравнение (15) легко преоб-
разуется к виду
ю
эфф[
5
1]о
. эфф
где
да.
. эфф
(16)
(IT)
(18)
Константа
As,—субстратная
константа.
Задавая несколько значений концентраций с
2
, легко найти гра-
фическим методом, рассмотренным ранее, эффективные значения
константы Михаэлиса и величину ш
эфф
.
Подставляя значение константы Аз согласно (17) в выраже-
ние
(18), получим
'т. эфф
*s,+
W
эфф
(19)
Графическим путем, строя прямую k'
m
^ = f (c
2
), согласно
уравнению (18) по отрезку, отсекаемому на оси ординат, находят
значение ks
v
а по тангенсу
угла
наклона прямой —k
u
зная кото-
рую можно найти Дг
—&s,Ai>
Таким образом, кинетический ана-
лиз
двухсубстратных
реакций оказывается более полным, чем од-
носубстратных, где определение k
2
и k\ методом стационарного
приближения невозможно.
Если постоянная концентрация первого компонента [Si]
0
—с
ь
то уравнение начальной скорости реакции имеет вид
где
'"эфф
==
"1
l^lo^l
(21)
И
"т, эфф
=3
\ 2
"1
с
1//*з
(22)
В этом случае, определив k"
m эфф
для разных концентраций С\,
можно найти все константы, характеризующие
двухсубстратную
реакцию, протекающую по приведенной выше схеме.
Если £з[5
2
]
0
"^ *2»
т
-
е
- концентрация комплекса близка к
равновесной, то, пренебрегая малой величиной в знаменателе вы-
ражения (15), получим
[Si
(28)
614
516

Реакция
в
этом
случае
имеет первый порядок
по
субстрату
S
2
и
переменный порядок
по
субстрату
Si.
Фермент может образовывать комплексы
с
обоими субстра-
тами. Наиболее интересным является случай, когда фермент
об-
разует
комплексы
ESi, ES
2
и
комплекс ESiS
2
,
в
котором
и
проис-
ходит
каталитическое превращение субстратов
с
образованием
конечных продуктов. Применение метода стационарных концен-
траций
в
этом
случае
приводит
к
очень громоздкому уравнению,
мало удобному
для
выявления общих закономерностей. Более
про-
стые выражения получаются, когда скорости распада промежуточ-
ных соединений настолько малы,
что
концентрации промежуточ-
ных соединений оказываются близкими
к
равновесным, получа-
ющимся
в
отсутствие реакции распада промежуточных соединений.
В этом
случае
при
условии,
что [Е}
0
< [Si]
0
и [Е]
о
<
[S
2
]o,
уравнения материальных балансов запишутся следующим
об-
разом:
[S.J
«
[S,]
o
;
[S,] « [S
a
W
[Е]
-
[Е]
о
-
[ES,]
-
[ES
2
]
-
[ES,S
2
]
(24)
(26)
(W)
(27)
(28)
Константы равновесия нижеследующих реакций имеют
вид
E
+ S,
E
+ S,
ES,;
ES
o
t
IES,]
[E1[S
2
]
O
IES
a
]
К
s
a
s,
[ES.Sj]
Множители
oci и a
2
отражают изменение сродства
к
отмеченному
индексом
субстрату
под
влиянием присоединения
другого
суб-
страта
к
ферменту
Е.
Из
четырех напиеанных констант равновесия независимы толь-
ко
три, так как
легко показать,
что
/CsiKsiSj
—tfsjKsiSi-
Прини-
мая
для
простоты,
что a
2
= cei
"*=
ос,
из
выражения
(28) и (27)
находим
IBS,].
[ES
2
]
ISab
Из
выражений
(25) и (29)
получаем
[EJ
*
s,
(29)
(30)
(31)
Подставляя
в
выражение
(24)
выражения
(29), (30), (31) и
решая полученное уравнение относительно [ES]S
2
], находим
•
•
;E]oIS,1,[S,lo
FES
1
l
[S
l]o[
S
2
]
o
010
При
сделанном выше предположении,
что
устанавливается
рав-
новесие
между
исходными веществами
и
комплексами, концентра-
ции
которых близки
к
равновесным, получающимся
в
отсутствие
реакции распада промежуточных соединений, скорость реакции
лимитируется необратимой стадией распада комплекса ESiS
2
с
образованием конечных продуктов,
т. е.
где k—константа скорости распада комплекса ESiS
a
.
Подставляя
в (33)
выражение
(32), а
также учитывая,
что
aK
s
= K
ss
и
<xK
s
= K
SiSJ
получим
Разделив чиелитель
и
знаменатель уравнения
(34) на
+
[S2]o. находим
где
и
К.
»фф
(86)
(88)
(37)
Как
видно
из
выражений
(36) и (87),
ьу
9
фф
И
А
т
-»фф зависят
от концентрации второго субстрата. Если принять,
что (S
3
] = c
a
(где
с
а
—
постоянная величина),
то
выражение
(35)
становится
аналогичным выражению
(5):
если [Sa]
0
>
foiSj»
то
ш»фф
=
ft'[E]
o
=«
«*=а>пред, km,
Э
фф
«»
Ks
2
Si,
а
если [S2j<KsiS
1
,
то
ш
9
фф
=
Л
/
[Е1]
0
[5^]
0
/
/JCsiSj
И k
m
,
Э
фф «s /Csr
Следовательно, подбирая соответствующие постоянные концен-
трации [S
2
]o, можно ранее описанными методами найти
ft',
^C
Sa
si
и
ASI»
а при
постоянных концентрациях [Si]
о
и
переменных
($в]о можно определить
/Csis
a
и
/Cs
a
»
т. е.
найти
все
константы,
входящие
в
уравнение
(34).
Если присоединение одного субстрата
к
катализатору
не
влия-
ет
на
сродство
к
другому,
т. е.
если
A"
Sl
=
/C
Sa
s
1
и
Kst^Ks^,
уравнение
(34)
может быть записано
в
виде
[S,
K
$i
+ [
s
Ao
K
s, +
[S
2
]
0
В
случае
превращения
двух
молекул одного субстрата
(38)
S;
К
К<
и
уравнение (34)
переходит
в
уравнение
Ш>0 (39)
617
