Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ
Подождите немного. Документ загружается.


ГМ.Панченков,
ВЛЛебеЬев
Химическая
кинетика
и
катализ
для
высшей
школы
ИЗДАНИЕ
3-е, ИСПРАВЛЕННОЕ
И
ДОПОЛНЕННОЕ
Допущено
Министерством
высшего и среднего
специального образования
СССР
в
качестве учебного пособия для
студентов
химических
и химико-технологических специальностей
высших учебных заведений
Москва
«ХИМИЯ»

MI
nies
УДК
541.124(075.8)
I
Г. М. Панченков |. | В. П.
Лебедев
Химическая кинетика и катализ.
Учебное
пособив
для вузов. — 3-е изд. испр. и доп. — М., Химия, 1985.
592 с, ил.
$ннга является третьим изданием учебного пособия (2-е изд.— 1974 г.)
по
химической кинетике и катализу.
3 книге рассмотрены формальная кинетика химических реакций, общие
iaконокерности
распада н образования молекул, основы теорий столк-
новений
и переходного состояния, теор*Ня моно- и тримолекулйриых реак-
ций,
кинетика реакций в растворах, теория цепных, фотохимических и
гетерогенных реакций, элементы макрокинетакн. кинетика Химических
реакций
под действием излучений высокой энергии, современные теория
гомогенных и гетерогенных каталитических реакций, кинетика фермента*
пшных реакций, реакций образования высокомолекулярных соединений,
ллкэмохимических реакций.
Учебное пособие предназначено для студентов химических факультетов
университетов и хнмико-технологкчеекмх вузов;
будет
полезно также для
аепи
рантов,
инженеров-химиков и мучных работников, осваивающих ме-
тоды химической кинетики н катализа.
В92 с, 45 табл., 196 рнс, 100 литературных ссылок.
Рецензент:
акад. Я. М.
Эмануэль.
|
П
180&000000—023
050(01.)-83
23,86
Ф
Издательство
сХнмия»,
1965 п,
СОДЕРЖАНИЕ
Предисловие
к 3-му
изданию
в
Глава I. Формальная кинетика 9
Общие понятия 9
§
1. Скорость химической реакции 9
§
2. Обратимые и необратимые реакции И
| 3. Порядок реакции И
Киветнка
реакций в статических условиях 13
§
4. Необратимая реакция первого порядка 13
§
5. Необратимая реакция второго порядка 17
§
6. Необратимая реакция л-го порядка 20
§
7. Обратимая реакция первого порядка 22
§
8. Обратимая реакция второго порядка . 24
§
9. Параллельные реакции 26
§
10. Последовательные реакции 27
§
11 Сложные химические реакции . 31
§
12. Методы определения порядка реакции 34
§
13 Влияние температуры на скорость реакция 37
§
14 Тепловой взрыв . . . . . . 41
Кинетика
гомогенных химических реакций, протекающих в потоке .... 44
§
15 Режимы вытеснения и перемешивания 44
§
16. Общее уравнение динамики и скорости химической реакции, про
текаюшей в потоке в режиме идеального вытеснения 45
§
17. Необратимая реакция первого порядка 50
§
18. Необратимая реакция второго порядка 52
§
19. Обратимая реакция первого порядка А, з=* Аз 52
§
20. Обратимая реакция второго порядка А + В
4=
fc
С + D . . 53
§
21. Последовательная реакция в потоке 53
§
22 Расчет энергии активации химической реакции, протекающей в по
токе в режиме идеального вытеснения 56
§
23 Время установления стационарного состояния в реакторе идеаль-
ного вытеснения 58
$ 24. Кинетика гомогенных химических реакций в режиме идеального
перемешивания . ... 59
Глава
II. Общие закономерности распада и образования молекул ... 63
Некоторые вопросы теории 63
§
1. Элементарные химические процессы 63
§
2. Спектры молекул 64
$ 3. Потенциальные кривые 66
§
4. Уравнение Шредингера для
двухатомных
молекул в его решение
для ангармонических колебаний 70
Диссоциация
молекул под действием света (фотодиссоциация) .... 75
§
5. Принцип Франка —
Кон
дона. Типы потенциальных кривых. Струк-
тура
полосатых спектров
$ 6 Определение энергии диссоциации из спектроскопических данных
§
7. Явление «предиссоциации»
Обмен энергией при соударениях. Диссоциация и образование молекул .
§
8. Обмен кинетической энергией при
упругом
ударе
§
9 Переход кинетической энергии поступательного движения в энер-
гию электронного возбуждения .
§
10 Ионизация молекул атомным н ионным ударом
§11.
Термическая диссоциация
1*

I
12.
Диссоциация молекул
на
поверхностях
98
§
13-
Свободные атомы
н
радикалы
99
§
14.
Образование молекул
из
атомов
или
радикалов
101
Глава
III.
Основы теории столкновений
и
бимолекулярные процессы
.
•
106
§
1.
Понятие
об
активных столкновениях
IC6
§
2.
Расчет константы скорости химической реакции
по
числу столкно-
вений
• • 109
§
3.
Энергия активации бимолекулярных реакций
111
§
4.
Стерический множитель
111
§
5.
Осложняющее действие гетерогенных процессов
113
§
6.
Реакции свободных атомов
и
радикалов
118
§
7.
Реакции
в
разреженных пламенах
129
§
8.
Реакции
в
диффузных пламенах
132
§
9. О
реакционной способности радикалов
133
Глава
IV.
Теория активированного комплекса (переходного состояния)
. . 134
§
1.
Поверхность потенциальной энергии. Переходное состояние, путь
и
координата реакции
134
§
2.
Вывод основного уравнения теории активированного комплекса
L38
§
3.
Свободная энергия (энергия Гельмгольца) активации
. . • . 142
§
4.
Экспериментальная энергия активации
143
§
б.
Взаимодействие
двух
атомов. Сравнение теория столкновений
с тео-
рией
активированного комплекса
145
$
б.
Неадиабатические процессы. Трансмиссионный коэффициент
, , . 147
Глава
V,
Мономолекулярные
и
тримоленулярные реакции
149
§
1,
Мономолекулярные реакции
в
газовой фазе
149
|
2.
Ранние теории мономолекулярных реакций
,152
§
3.
Истолкование мономолекулярных реакций
на
основании теории
столкновений
. . • 152
§
4.
Энергия активации мономолекулярной реакции
155
§
5.
Теории Гиншельвуда, Касселя, Слетера
15S
§
6.
Мономолекулярные реакции
в
теории активированного комплекс?
15Э
§
7.
Тримолекулярные реакции
в
газовой фазе
Ill
$
8.
Тринолекулярные реакции
в
теории активированного комплекса
165
Глава
VI.
Реакции
в
растворах
170
5
1. О
применимости теории столкновений
к
реакциям
в
растворах
170
§
2.
Скорости химических реакций
в
растворах .........
172
§
3.
Применение теории активированного комплекса к,реакциям
в рас-
творах. Уравнение Бренсте.да
—
Бьеррума
177
§
4.
Влияние ионной силы раствора
на
скорость реакции. Солевые
эф-
фекты
. 1W)
§
5.
Реакция
между
ионами
н
между
днполямн
. . . , 182
§
6.
Влияние давления
на
скорость реакции
в
растворе
.186
§
7.
Эффекты заместителей
в
органических молекулах
188
§
8.
Гемолитические
н
гетеролитические реакции
193
§
9.
Нуклеофильные реакции
194
§
10.
Электрофнльиые реакции
197
§
11.
Радикальные реакции
199
§
12.
Реакции передачи электрона
201
§
13.
Сопряженные реакции
. . - 204
Глава
VII.
Цепные реакции
208
§
1.
Основные понятия
и
примеры цепных реакций ........
208
§
2,
Длина
у$ди
и
ветви
217
4
\
3.
Обрыв цепи
219
I
4.
Кинетика неразветвленных цепных реакций
221
§
б.
Термический крекинг углеводородов •
224
§
6.
Разветвленные цепные реакции
230
§
7.
Кинетика разветвленных цепных реакций
235
§
8.
Теория
трех
пределов самовоспламенения
246
Глава VIII. Гетерогенные реакции
А Я.
Розовский
253
§
1.
Основные понятия
и
определения
253
§
2.
Особенности гетерогенных реакций
256
Реакции
в
системе
газ —
жидкость
258
§
3.
Растворение газа
в
жидкости
258
§
4.
Реакция газа
с
жидкостью
в
открытой
(по
газу)
системе
. . . 261
§
5.
Кинетика реакции
газ —
жидкость
в
барботажном реакторе
с уче-
том распределения времен пребывания пузырьков
в
барботажном
слое
263
Реакции
с
участием
твердых
веществ
267
§
6.
Кинетика образования ядер фазы твердого продукта
..... 269
§
7.
Основное уравнение кинетики реакции
на
поверхности раздела
твердых
фаз
....................
271
§
8.
Интегрирование основного уравнения кинетики реакции
на
поверх-
ности раздела
фав
........
273
§
9.
Приближенные уравнения кинетики реакций
с
участием
твердых
веществ
276
$
10.
Определение
удельных
скоростей реакции
на
поверхности разде-
ла
фаз 278
§
11.
Учет
перекрывания ядер
в
процессе роста
281
Реакция
газа
с
поверхностью твердого тела
284
§
12.
Общие закономерности
284
§
13.
Кинетика реакций газа
с
поверхностью
286
Глава
IX
Элементы диффузионной кинетики химических реакций
А
Я-
Розовский
289
1. Внешняя задача диффузионной кинетики
290
2. Внутренняя задача диффузионной кинетики
293
3. Макрокинетическне области гетерогенно-каталитической реакции
297
4. Диффузионное торможение
в
реакциях газа
с
твердым телом
. . 301
б. Подходы
к
решению более сложных задач диффузионной кинетики
304
Глава
X.
Фотохимия
306
§•1.
Основные фотохимические законы
306
|
2.
Квантовый
выход
и
классификация фотохимических процессов
. . 307
|
3.1
Различие кинетики фотохимических
и
темновых реакций
.... 313
§
4.
Процессы, протекающие
при
фотовозбужден ил молекул
.... 316
(
б.
Полные
н
локальные скорости фотохимических реакций
. . . .321
§
6.
Кинетика флуоресценции, фосфоресценции
и
иктеркомбннаплюкной
конверсии
323
§
7.
Зависимость скорости фотохимических регкций
от
температуры
324
Глава
XI.
Химическое действие юлучення большой энергии
325
§
1.
Общие понятия
325
$
2.
Источники излучения
. . . 326
§
3.
Отличне радиолиза
от
фотохимического процесса
327
ji
4.
Первичные процессы
328
5. Раднационно-хнмическвй
и
ионный выходы
330
6. Количественные характеристики радиационно-хпмнческлх превра-
щений
• 333
f
7.
Вторичные процессы
338

§
12.
Диссоциация молекул
на
поверхностях
98
§
13.
Свободные атомы
и
радикалы
99
§
14.
Образование молекул
из
атомов
или
радикалов
101
Глава
III.
Основы теории столкновений
н
бимолекулярные процессы
. . 108
§
1.
Понятие
об
активных столкновениях
1С6
§
2.
Расчет константы скорости химической реакции
по
числу столкно-
вений
109
§
3.
Энергия активации бимолекулярных реакций
111
§
4.
Стерический множитель
Ill
§
5.
Осложняющее действие гетерогенных процессов
113
§
6.
Реакции свободных атомов
и
радикалов
118
§
7.
Реакции
в
разреженных пламенах
129
§
8.
Реакции
в
диффузных пламенах
. • . . 132
§
9. О
реакционной способности радикалов
133
Глава
IV.
Теория активированного комплекса (переходного состояния)
. . 184
§
1.
Поверхность потенциальной энергии. Переходное состояние, путь
я
координата реакции
134
§
2.
Вывод основного уравнения теории активированного комплекса
138
§
3.
Свободная энергия (энергия Гельмгольца) активации
. . - . 142
§
4.
Экспериментальная энергия активации
143
§
б.
Взаимодействие
двух
атомов. Сравнение теории столкновений
с тео-
рией
активированного комплекса
146
§
6.
Неадиабатические процессы. Трансмиссионный коэффициент
, , .147
Глава V.
Мономолекулярные
н
трнмолекулярные реакции
149
§
1.
Мономолекулярные реакции
в
газовой фазе
1*9
|
2.
Ранние теории мономолекулярных реакции
.152
§
3.
Истолкование мономолекулярных реакций
на
основании теории
столкновений
..... 152
§
4.
Энергия активации ыономвлекулярной реакции
165
§
5.
Теории Гиншельвуда, Касселя, Слетера
155
§
6.
Мономолекулярные реакции
в
теории активированного комплекс?
15Э
§
7.
Тримолекуляриые реакции
в
газовой фазе
Ill
§
8.
Тримолекулярные реакции
в
теории активированного комплекса
166
Глава
VI.
Реакции
в
растворах
170
§
1. О
применимости теории столкновений
к
реакциям
в
растворах
170
§
2.
Скорости химических реакций
в
растворах .........
172
§
3.
Применение теории активированного комплекса
к
.реакциям
в рас-
творах. Уравнение Бренстеда
—
Бьеррума
177
§
4.
Влияние ионной силы раствора
на
скорость реакции. Солевые
эф-
фекты
. • №
§
5.
Реакция
между
ионами
и
между
диполями
.........
182
§
6.
Влияние давления
на
скорость реакции
в
растворе
186
§
7.
Эффекты заместителей
в
органических молекулах
......
188
§
8.
Гемолитические
и
гетеролитическне реакции
193
§
9.
Нуклеофильные реакции
194
§
10.
Электрофильные реакции
197
§
11.
Радикальные реакции
199
§
12.
Реакции передачи электрона
201
§
13.
Сопряженные реакции
204
Глава
VIL
Цепные реакции
208
§
1.
Основные понятия
и
примеры цепных реакций
208
|
2.
Длина £Ь$ДН
и
ветви
217
4
I
3. Обрыв цепи 219
§
4.
Кинетика неразветвленных цепных реакций
221
§
5.
Термический крекинг углеводородов •
224
§
6.
Разветвленные цепные реакции
230
§
7.
Кинетика разветвленных цепных реакций
285
§
8.
Теория
трех
пределов самовоспламенения
246
Глава VIII. Гетерогенные реакции
А Я-
Розовский
253
§
1.
Основные понятия
и
определения
253
§
2.
Особенности гетерогенных реакций
256
Реакции
в
системе
газ —
жидкость
258
§
3
Растворение газа
в
жидкости
258
§
4.
Реакция газа
с
жидкостью
в
открытой
{по
газу)
системе
. . . 261
|
5.
Кинетика реакции
газ —
жидкость
в
барботажном реакторе
с уче-
том распределения времен пребывания пузырьков
в
барботажном
слое
263
Реакции
с
участием
твердых
веществ
267
§
6.
Кинетика образования ядер фазы твердого продукта
. . . . - 269
§
7.
Основное уравнение кинетики реакции
на
поверхности раздела
твердых
фаз
...................
271
§
8.
Интегрирование основного уравнения кинетики реакции
на
поверх-
ности
раздела
фав
........
273
§
9.
Приближенные уравнения кинетики реакций
с
участием
твердых
веществ
276
$
10.
Определение
удельных
скоростей реакции
на
поверхности разде-
ла
фаз 278
$
11.
Учет
перекрывания ядер
в
процессе роста
281
Реакция
газа
с
Поверхностью твердого тела
284
§
12.
Общие закономерности
284
§
13.
Кинетика реакций газа
с
поверхностью
286
Глава
IX
Элементы диффузионной кинетики химических реакций
А
Я.
Розовский
289
1. Внешняя задача диффузионной кинетики
290
2. Внутренняя задача диффузионной кинетики
293
3- Макрокинетическне области гетерогенно-каталитической реакции
297
4. Диффузионное торможение
в
реакциях газа
с
твердым телом
. . 301
5. Подходы
к
решению более сложных задач диффузионной кинетики
304
Глава
X.
Фотохимия
зов
§•1.
Основные фотохимические законы
306
§
2.
Квантовый
выход
и
классификация фотохимических процессов
. . 307
$
3->
Различие кинетики фотохимических
и
темповых реакций
.... 313
§
4.
Процессы, протекающие
при
фотовозбуждении молекул
.... 316
|
5.
Полные
н
локальные скорости фотохимических реакций
.... 321
§
6.
Кинетика флуоресценции, фосфоресценции
н
интеркомбннацион.чой
конверсии
.......
323
§
7.
Зависимость скорости фотохимических реакций
от
температуры
324
Глава
XI.
Химическое действие юлученнй большой энергии
.
325
§
1.
Общвд понятия
325
§
2.
Источники излучения
. , . 326
§
3.
Отличие радиолиза
от
фотохимического процесса
327
\\
4.
Первичные процессы
.... - ...
328
\\
5.
Раднацнонно-хнмнческнй
и
ионный выходы
330
$
6.
Количественные характеристики радиаиионно-хпмнческлх превра-
щений
.........
333
I
7.
Вторичные процессы
, 388

§
8. Поведение веществ в разных агрегатных состояниях под дей-
ствием излучений 340
§
9. Сольватироаанный электрон 343
§
10. Радиолнз воды . . . 342
§
11. Раднолнз водных растворов 346
§
12. Кинетика радиолиза растворов 347
§
13. Химические реакции атомов, получающихся при ядерных превра-
щениях
. 349
Глава XII. Плазмохимия А И.
Максимов
353
§
1. Основные понятия 353
§
2. Особенности плазмохимическнх реакций 353
§
3. Уравнение Паули . 355
§
4. Константа скорости суммарного процесса и уровпевые константы
скорости .-.. 356
§
5. Два тина плазмохимическнх реакций 358
§
6, Образование химически активных частиц в плазме ...... 358
§
7. Некоторые реакции химически активных частиц 365
§
8. О механизме и кинетике плазмохимических процессов 369
§
9. Методы получения и исследования неравновесной плазмы .... 371
Глава XIII, Каталитические реакции 372
§
1. Общие сведения о катализе 377
Гомогенные каталитические реакции 374
§
2. Промежуточные стадии в гомогенном катализе 374
§
3. Общая
схема
расчета кинетики гомогенных каталитических реакций 377
§
4. Распад перокенда водорода 378
§
5. Катализ кислотами и основаниями 387
§
6. Электрофнльный и нуклеофнльный катализы 407
§
7. Катализ комплексными соединениями переходных металлов , . 410
Гетерогенные каталитические реакции 415
§
8. Оснопные характерные черты гетерогенных каталитических про
иессов . .... • 415
§
9. Лктпвационный процесс в гетерогенных реакциях 418
§
10. Активированная адсорбция 421
Кинетика
гетерогенных каталитических реакций в статических условиях и
логоке • . 422
§
П. Кинетика процессов, в которых
реагирует
одно вещество и про-
дукты
реакции не тормозят процесс 422
§
12. Кинетика процессов, в которых
реагирует
одно вещество и про-
дукты
реакции тормозят процесс -526
§
13, Истинная и кажущаяся энергии активации гетерогенных химиче-
ских реакций 429
§
14. Кинетика гетерогенных каталитических реакций в потоке . . . 431
Глава XIV. Теория активных центров в гетерогенном катализе . 441
§
1. Отравление катализатора 441
§
2. Роль поверхности и пористость катализатора 444
§
3. Теория активных центров Тейлора 448
§
4. Связь
между
энергией активации и предэкспоненциальным мно-
жителем .... . . .... . . 449
Адсорбшюнно-каталитнческне явления на неоднородных поверхностях 451
§
5. Недостаточность модели однородной поверхности а катализе и ад-
сорбции
..... 451
§
С. Адсорбция и катализ на неоднородных поверхностях ..... 452
§
7. Взаимодействие молекул в адсорбционном слое 460
§
8. Роль дефектпп кристаллов в катализе 465
Мультиплстная теория катализа ... . 470
§
9.
Принцип
геометрического соответствия 470
§
10. Энергетический фактор в гетерогенном катализе 475
Теория
активных ансамблей ... ... ..... 478
§
1 i. Физические огнопм теория актпнных ансамблей 478
§
12. Основное уравнение теории активных ансамблей 481
§
13- Активные центры каталитических процессов 487
Электронные
представления в терогенном катализе 488
§
14. Строение электронных оболочек и каталитические свойства пере
ходных
металлов .... . . 48У
§
15. Магнитные и каталитические- свойства переходных металлов . -191
§
16. Работа
выхода
электрона и каталитические снонетпа переходных
металлов и полупроводников 491
§
17. Образование промежуточных соединении адсорбционного типа на
поверхности переходных металлов 492
§
18. Электронный механизм хемосорбцин на полупроводниках . . . 496
§
19. Электронный механизм гетерогенных реакции на полупроводниках 501
§
20. Место электронных представлений в теории гетерогенного катализа 503
Глава XV. Кинетика ферментативного катализа 504
§
1. Ферменты . 504
§
2. Кинетика ферментативных реакций 51!
§
3. Ингнбнрование ферментативных реакций 519
Глава XVI. Кинетика реакций образования высокомолекулярных соединений 525
§
1. Радикальная полимеризация 526
§
2. Сополимернзацня . 53 i
§
3.
Ионная
полимеризация б4<")
§
4. Ионио-координационная полимеризация 546
§
5. Ступенчатая полимеризация 549
§
б. Полимеризация с раскрытием циклов 550
§
7. Поликонденсация , 563
Глава
XVII.
Применение меченых атомов в химической кинетике .... 557
§
1. Установление места разрыва связей в молекуле 558
§
2. Реакции изотопного обмена ...... 560
§
3. Исследование кинетики химических процессов с помощью меченых
атомов . . • - . . 564
§
4. Изотопные кинетические эффекты 568
§
5, Исследование поверхностен
твердых
тел и гетерогенных реакций 576
Литература
578
Предметный указатель 58i

ПРЕДИСЛОВИЕ
К 3-МУ ИЗДАНИЮ
Оба предыдущих издания этой книги (первое вышло в 1961 г.,
второе — в 1974 г.) давно уже разошлись и стали библиографиче-
ской
редкостью. Однако решение о новом, 3-ем издании учебника
оказалось нелегким, потому что материал книги требовал пере-
смотра и дополнений в соответствии с современным состоянием
химической кинетики и катализа, а вся работа по переизданию
должна была осуществляться, к сожалению, уже после смерти
авторов книги.
Выполняя
завещание отца,
труд
по подготовке третьего изда-
ния
книги взял на себя сын покойного профессора Г. М. Панчен-
кова,
канд. хим. наук И. Г. Панченков.
В связи с тем, что со времени последнего издания учебника
прошло более десяти лет, было признано целесообразным допол-
нить
его тремя новыми главами, специально написанными для 3-го
издания
доктором хим. наук А. Я. Розовским (глава VIII
«Гетеро-
генные реакции» и глава IX «Элементы диффузионной кинетики
химических реакций») и доктором хим. наук А. И. Максимовым
(глава XII «Плазмохимия»).
Как
и в предыдущих изданиях, основной задачей учебного посо-
бия
осталась выработка у читателя стремления к самостоятель-
ному дальнейшему изучению одной из важнейших областей со-
временного естествознания.
Пользуюсь случаем выразить признательность авторам новых
глав, рецензентам и сотрудникам издательства за бережное и
внимательное отношение к
труду
моего покойного отца и ту по-
стоянную помощь, которую я непрерывно ощущал и которой ши-
роко
пользовался при подготовке к печати этого издания книги.
Канд.
хим. наук И. Г.
Панченков
ГЛАВА
I
ФОРМАЛЬНАЯ
КИНЕТИКА
ОБЩИЕ
ПОНЯТИЯ
Химическая
кинетика — раздел физической химии, посвященный
закономерностям
протекания процессов во времени.
Раздел химической кинетики, в котором рассматривается метод
нахождения на основании основного постулата химической
кине-
тики
зависимости скорости химических реакций от концентраций
реагирующих веществ, получил название
формальной
кинетики.
§
1. Скорость химической реакции
Пусть протекает химическая реакция, уравнение которой в общем
виде можно записать следующим образом:
... +v
fe
A
fe
—* ч[А\ +
ч'
2
А2+
...VX (I)
где v
i
и V( — стехиометрические коэффициенты исходных и конечных веществ;
А, и Aj — исходные и конечные вещества.
Скоростью
химической
реакции
называется количество молекул
данного вида, реагирующих в единицу времени.
Скорости
различных реакций можно сравнить, если относить
скорость реакции к единице объема. Поэтому скорость реакции
определяют числом молекул или молей данного вещества, реаги-
рующих в единицу времени в единице объема.
Для определения скорости химической реакции достаточно
знать изменение во времени количества только одного из веществ —
участников реакции (исходного или конечного), так как измене-
ния
количества
всех
остальных веществ можно найти па основа-
нии
стехиометрии из уравнения реакции (1).
Еще в самом начале исследований по химической кинетике
было сделано физически очевидное предположение, что реагируют
только те молекулы, которые сталкиваются. Как известно, число
столкновений
прямо пропорционально числу молекул, поэтому ско-
рость реакции должна быть пропорциональна концентрации реаги-
рующих веществ, т. е. в общем
случае
W
= K,f
д
'Cj
1
Л! л
2
(2)
Где w — скорость химической реакции; k\ — константа скорости химической ре-
акции;
с
А
—концентрации реагирующих веществ; п. — порядок реакции по ве-
ществу А, (см. § 3).
Полученное выражение иногда называют
основным
постулатом
химической
кинетики.

Физический
смысл
k\
можно
найти,
если
принять,
что все
кон-
центрации
равны
единице,
т. е.
СА,
=
Сд
2
= ... —
c
Ajt
=з
1.
При
этом
условии
ю-А,
(3)
Таким
образом,
константа
скорости
химической реакции есть
скорость этой реакции при условии, что концентрации реагирую-
щих веществ постоянны
и
равны единице.
Из
выражения
(2)
следует,
что
скорость реакции является
функцией
времени, так как
с
течением времени изменяются кон-
центрации
реагирующих веществ. Поэтому можно ввести понятие
средней скорости
w,
которая рассчитывается как средняя величина
для заданного интервала времени:
- =
(%-Ч)/^"-<') (4)
где
п, и н,
—число молей одного
из
исходных
веществ
А<
в
начальный
V и
конечны»
I"
моменты времени; V —
объем
рассматриваемой системы.
Если
t"
—
i'
будет
стремиться
к
нулю, получим истинную ско-
рость
w,
которая является скоростью химической реакции
в
дан-
ный
момент времени
V
dt
(5)
Если
рассматриваемый объем постоянен,
то
его можно ввести
под знак дифференциала,
тогда*
)
Уравнением
(6)
удобно пользоваться, когда рассматривают
реакции
в
растворах, так как изменением объема раствора
в
ре-)
зультате
реакции можно пренебречь.
Из
уравнения (1) ш:дио, что
dn
'/Л'1'1
"'"
или
dn,
/v,
=
dn.
(7)
Поэтому, если правую
и
левую
части уравнения
(5)
поделить
на
v
;
,
то получится, что скорость реакции, рассчитанная на едини-
цу стехиометрического коэффициента,
не
зависит
от
того, по ка-
кому веществу ее определяют:
dn
dn
dt
dt
dt
v
2
V
dt
(8)
* Согласно определению мольно-объемная концентрация
с =
n/v, поэтому
dc/dt
=
{\lv)dn!dt
—
(nfv
2
)dvfdt
(a),
а
так
как
c
—
f{n,y),
то
tlc/dt =(dcfdt)
v
+
+
{dc/d-t}
n
(б). Сопоставляя
(а) с
(б), находим, что
{dc;di)
v
=(]/v)dn/dl
(в).
Сравнивая выражение (п)
с
определением скорости химической реакции (5), по-
лучаем,
что
w
—
—<dc'f?t)
L
.
Как видно
из
(а), только при
v =
const
(де/dt),,
=
=
defdt.
В
oi'iUL-м
случае
к
1
Ф
defdt,
поэтому
в
книге
везде,
где
при опреде-
лении скорости
[ftaKUiiii
используется молто-объемная концентрация, скорость
записывается
я
нн.че 'мпной производной
от
концентрации
по
времени
при
[юешмшюм
'_-0f-fvt;
сил обозначена
or/Of,
'
10
В общем виде (если
о
скорости реакции судить по количеству
одного из исчезающих веществ) можно записать:
<%=="
dt
где
§
2.
Обратимые и необратимые реакции
Обратимыми
в
химической кинетике называют такие реакции, ко-
торые одновременно
и
независимо протекают
в
двух
направле-
ниях—
прямом
и
обратном, но
с
различными скоростями. Для об-
ратимых реакций характерно, что через некоторое время после их
начала скорости прямой
и
обратной реакций становятся равными
и
наступает состояние химического равновесия.
Все химические реакции обратимы, но при определенных усло-
виях некоторые из них
могут
протекать только
в
одном паправлс
нии
практически
до
полного исчезновения исходных продуктов.
Такие
реакции называют
необратимыми.
Обычно необратимыми
бывают реакции,
в
которых хотя бы один продукт реакции выво-
дится из сферы реакции
(в
случае
реакции
в
растворах — выпа
дает
в
осадок или выделяется
в
виде газа), пли реакции, которые
сопровождаются большим положительным тепловым эффектом.
В
случае
ионных процессов реакция является практически
не-
обратимой, если
в
результате
нее образуется очень малораствори-
мое или малодиссоциированное вещество.
Рассмотренное здесь понятие обратимости реакции
не
совпа-
дает
с
понятием термодинамической обратимости. Обратимая
в
кинетическом
смысле реакция
в
термодинамическом смысле может
протекать необратимо. Для того чтобы реакцию можно было на-
звать обратимой
в
термодинамическом смысле, скорость прямого
процесса должна бесконечно мало отличаться
от
скорости обрат-
ного процесса
и,
следовательно, процесс
в
целом должен проте-
кать бесконечно медленно.
§
3.
Порядок реакции
Химические реакции редко протекают
в
одну стадию, как
их
при-
нято
записывать
в
учебниках химии.
В
обычной одностадийной
записи
уравнении химических реакций указывается только началь-
ное
и
конечное состояния системы, что является по
существу
сим-
волическим выражением материального баланса (закона сохране-
ния
вещества).
В
действительности реакция обычно идет через ряд
промежуточных стадий, причем скорость реакции определяется
скоростью наиболее медленной стадии.
В тех
случаях,
когда реакция протекает
в
одну стадию (та"ая
реакция
называется
элементарным
химическим
процессом),
по-
рядок
реакции
n
t
по данному веществу
i
[степень,
в
которой кон-
11

центрация
данного вещества
входит
в выражение основного по-
стулата
химической кинетики (2)] совпадает со стехиометрическим
коэффициентом
данного вещества в химическом уравнении, т. е.
П, = V/.
Общий
порядок
элементарной
реакции
равен сумме стехиоме-
трических коэффициентов веществ, вступающих в реакцию, или,
другими словами, числу молекул,
участвующих
в реакции, и назы-
вается
молекулярностью.
Если превращение испытывает одна мо-
лекула, то реакция называется мономолекулярной, если в элемен-
тарном процессе
участвуют
две молекулы — бимолекулярной и т. д.
Так
как вероятность одновременного столкновения большого числа
частиц мала, молекулярность одностадийного процесса не пре-
вышает
трех.
Порядок
реакции щ = V; для
всех
реакций, которые протекают
бесконечно медленно, т. е.
тогда,
когда система из начального со-
стояния
переходит в конечное квазистатическим процессом * или
когда она находится в состоянии, бесконечно близком к состоянию
химического равновесия.
Вдали от равновесия химическая реакция идет через набор
промежуточных элементарных реакций, который в заданных усло-
виях обеспечивает наибольшую скорость протекания реакции или,
иначе говоря, наибольшую вероятность достижения конечного со-
стояния.
Для таких реакций обычно tit Ф v, и, следовательно,
общий
порядок п Ф £ v,-. Например, распад пероксида водорода
согласно уравнению
2Н
2
О
2
—* 2Н
г
О + О
2
должен был бы протекать как реакция второго порядка, на самом
же
деле
порядок этой реакции изменяется в зависимости от усло-
вий
ее проведения и может быть первым или дробным. Последнее,
таким
образом, указывает па то, что реакция протекает через раз-
личные промежуточные стадии. Только в том случае, когда реак-
ция
протекает бесконечно медленно, т.е. как термодинамический
квазиравновесный
процесс, она может идти и по маловероятному
пути, т. е. непосредственному превращению в одну стадию.
Как
мы уже видели, сумма показателей степеней, в которых
входят
концентрации
всех
реагирующих веществ в выражение (2),
определяет общий порядок реакции. Однако, если химический про-
цесс протекает через ряд промежуточных стадий, выражение (2)
является удобной, но формальной записью уравнения скорости
химического процесса. При этом порядок реакции может быть как
целым, так и дробным. К дробным порядкам при расчете скорости
приводит, как мы увидим ниже, применение принципа стационар-
ности
Боденштейнэ.
Уравнение (2) отражает существо протекающих процессов
только в
случае
одностадийных реакций. Совпадение порядков
сложной реакции по каждому веществу со стехиометрическими
* Это понятие используют в химической термодинамике при выводе изо-
термы химической реакции.
13
коэффициентами
возможно, но не
вв«гда
отвечает истинному
меха-
низму ее протекания.
Несмотря
на сказанное, выражение (2) позволяет найти уравне-
ния,
определяющие скорости расходования исходных веществ или
накопления
конечных продуктов для многих реакций (не только
одностадийных, но и сложных) и находящиеся в хорошем согласии
с опытом.
Так
как стадии, через которые протекают реакции, в боль-
шинстве случаев неизвестны, предвидеть порядки реакции по каж-
дому веществу невозможно; их
следует
определять специальными
методами, которые
будут
рассмотрены ниже.
КИНЕТИКА
РЕАКЦИИ В СТАТИЧЕСКИХ УСЛОВИЯХ*
§
4. Необратимая реакция первого порядка
Примером
необратимых реакций первого порядка
могут
являться
реакции
разложения азометана
CHaNjCIb
—* C
2
H
e
+ N
2
разложения оксида азота (V)
разложения диметилового эфира
СН
3
ОСНз
—> СН
4
+ Н
3
+ СО
и
другие.
В общем виде уравнение моно моле кул яр ней необратимой реак-
ции
можно записать следующим образом:
А — •
V|
B + v
2
C-f-v
3
D+ ...
При
мономолекулярных процессах исходные молекулы превра-
щаются независимо от остальных, т. е. превращение молекул А
зависит только от их внутреннего состояния. Такой процесс пре-
вращения
называется
спонтанным.
Число молей, превращающихся
в
промежуток времени
между
t и / -f dt, должно быть пропорцио-
нально
промежутку времени dt и числу молей а—х, оставшихся
непревращенными
к моменту /, независимо от объеме, в котором
они
находятся (а — число исходных молей; х — число молей ис-
ходного вещества А, превратившихся к моменту времени г):
или
d (а — х) = k {а — х) dx
dx/dt
« k (a - х)
(10)
Уравнение (10) и
будет
дифференциальным уравнением ско-
рости необратимой реакции первого порядка.
• Статическими условиями проведения реакции
будем
называть такие, при
которых
отсутствует
принудительный поток реагирующих веществ в заданных
Направлениях.
13
С
формальной точки зрения выражение (10)" может быть по-
лучено и непосредственно из основного постулата химической
Кинетики
(2), так как можно написать, что
dia-x)
Vdt
= k
а — х
Легко увидеть, что после сокращения V и дифференцирования по-
лучается выражение (10).
Уравнение (10) относится к разряду обыкновенных дифферен-
циальных уравнений, которые решаются путем разделения пере-
менных. Умножая правую и
левую
части на dt/(a—х), получаем
dxf(a
~ х) = k dt
После интегрирования выражение приводится к виду
-\п(а-х) =
1Ы
+ С (И)
Константу интегрирования С можно найти из начальных усло-
вий:
когда t = 0, то л: = 0. Подставляя эти значения в равенст-
во (11), находим:
- In a = C (12)
Подставляя (12) в (11) и решая относительно к, получаем
t a — x
(13)
Из
выражения (13) вытекает, что k имеет размерность Г"
1
.
Следовательно, константа скорости мономолекулярной реакции
будет
выражаться в с~'
(мин-
1
или ч-').
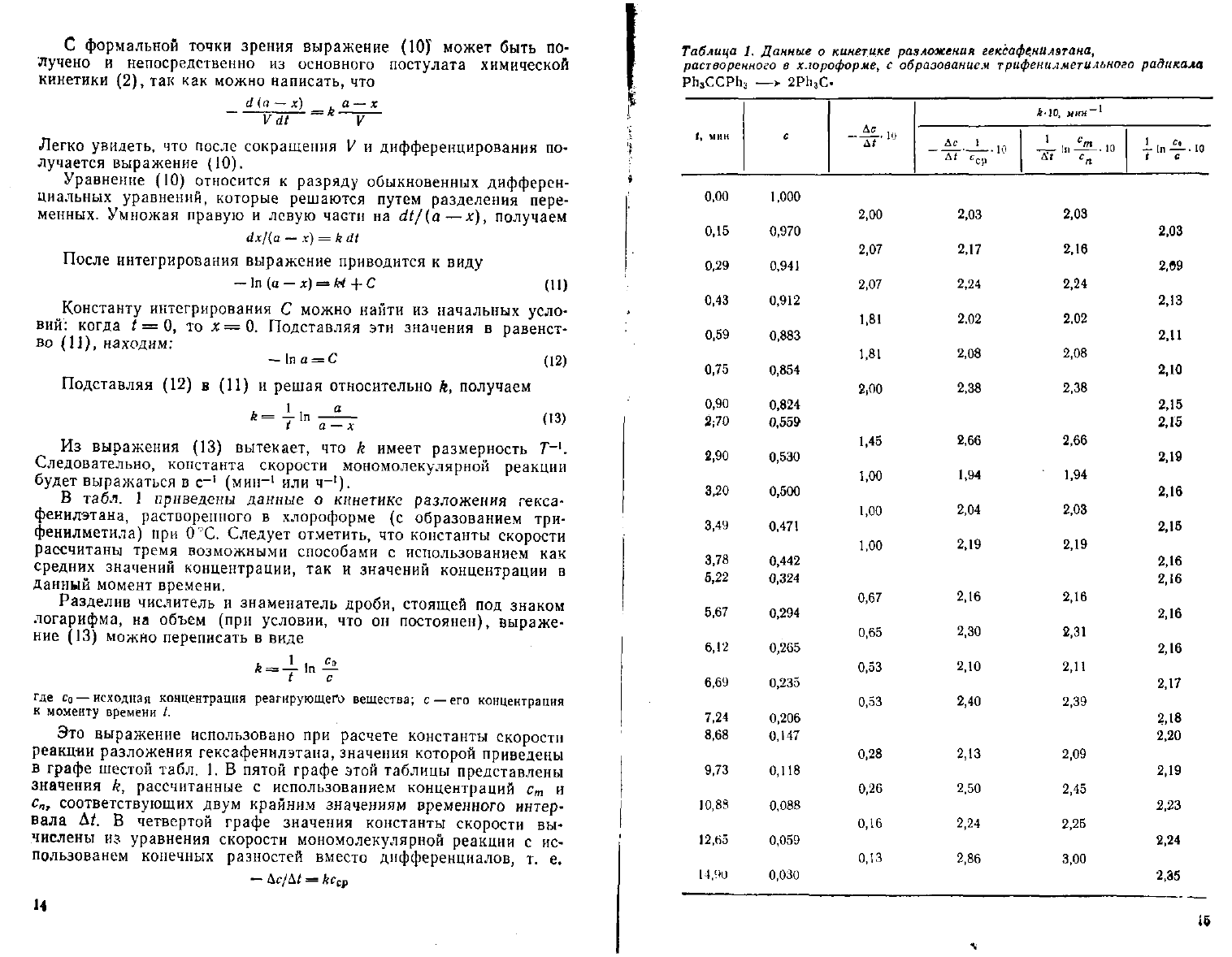
В табл. 1 приведены данные о кинетике разложения гекса-
фенилэтана, растворенного в хлороформе (с образованием три-
фенилметила) при ОХ.
Следует
отметить, что константы скорости
рассчитаны тремя возможными способами с использованием как
средних значений концентрации, так и значений концентрации в
Данный момент времени.
Разделив числитель и знаменатель дроби, стоящей под знаком
логарифма, на объем (при условии, что он постоянен), выраже-
ние
(13) можно переписать в виде
где со —исходная концентрация реагирующего вещества; с —его концентрация
к
моменту времени /.
Это выражение использовано при расчете константы скорости
реакции разложения гексафеннлэтана, значения которой приведены
в графе шестой табл. 1. В пятой графе этой таблицы представлены
значения
к, рассчитанные с использованием концентраций с
т
и
с
п
, соответствующих
двум
крайним значениям временного интер-
вала Д*. В четвертой графе значения константы скорости вы-
числены из уравнения скорости мономолекулярной реакции с ис-
пользованем конечных разностей вместо дифференциалов, т. е.
— Дс/Д* =
&г
ср
14
Таблица
1.
Данные
о
кинетике
разложения
гексафе,нил$тана,
растворенного
в
хлороформе,
с
образованием
трифенилметильного
радикала
Ph
3
CCPh
3
—
>
2Ph
3
C.
I, мин
-10, мки
-1
Ас
•
•
10
"Ср
-. ш
i-.nii-.io
( с
0,00
0,15
0,29
0,43
0,59
0,75
0,90
2;70
2,90
3,20
3,49
3,78
5,22
5,67
6,12
6,69
7,24
8,68
9,73
10,88
12.65
14'Ю
1,000
0,970
0,941
0,912
0,883
0,854
0,824
0,559
0,530
0,500
0,471
0,442
0,324
0,294
0,265
0,235
0,206
0,147
0,118
0,088
0,059
0.030
2,00
2,07
2,07
1.81
1,81
2,00
1,45
1,00
1,00
1,00
0,67
0,65
0,53
0,53
0,28
0.26
0,16
0,13
2,03
2,17
2,24
2.02
2,08
2,38
2,66
1,94
2,04
2,19
2.16
2,30
2,10
2,40
2,13
2,50
2,24
2,86
2,03
2,16
2,24
2,02
2,08
2,38
2,66
1,94
2,03
2,19
2,16
2,31
2,11
2,39
2,09
2,45
2,25
3,00
2,03
2,09
2,13
2,11
2,10
2,15
2,15
2,19
2,16
2,15
2,16
2,16
2,16
2,16
2,17
2,18
2,20
2,19
2,23
2,24
2,35

Потенцируя
выражение (13), получаем
а/{а-х)
=e
kt
(14)
откуда находим
a~x
=
ae-
kt
(15)
и
х
=
а{1
~e~
kt
)
(16)
Выражение
(15)
дает
возможность определить количество
вещества А, оставшееся неизменным
к
моменту времени
/, а
(16)
—
количество вещества
В,
образовавшееся
к
моменту времени
/.
Из
этих уравнений видно, что как убыль вещества
А,
так
и
увели-
чение вещества
В
протекают
по
экспоненциальному закону.
При
этом
из
уравнения
(15J
вытекает, что когда
/ =
0,
а
—
х = а,
а когда
/ =
оо,
а
—
х =
0;
из
уравнения (16)
следует,
что при
t =
=
0 х ~
0,
а
при
/ =
со
х = а.
На
рис.
J
УТИ зависимости изображены графически. Полное ис-
чезновение исходного вещества
будет
наблюдаться только через
бесконечно большой промежуток времени. Практически реакцию
считают закончившейся, когда аналитическим путем нельзя обна-
ружить исходных веществ. Очевидно, что
результат
будет
зависеть
от чувствительности применяемого аналитического метода.
На
рис.
2
приведены экспериментальные данные
по
термиче-
скому разложение оксида азота (V):
2\',О
Б
—>
4NO
2
+ O
2
Количество нераспавшегося пентаоксида азота рассчитано
по
уравнению
а
—
х = a
exp(-kt);
к =
0,0310
мин-
1
. Количество
образовавшегося вещества получено
по
уравнению
*
—а[1
—
- ехр(—£/)]; Р
о
-=46 кПа,
Г =
45 "С.
Как
видно, зависимости аналогичны изображенным
на
рис.
1.
На
обоих рисунках
т
обозначает время, соответствующее точке
Рис.
1.
Теоретическая зависимость количества оставшегося вещества
А и
обра-
зовавшегося
вещества
В от
времени для
реакции
первого
порядка.
Рис.
2.
Кинетические
кривые термического разложения лента
оксида
азога (точ-
кп
—
экспериментальные,
по
данным Даниальса
и
Джонсона;
pj = 46
Kllaj.
пересечения кривых.
В
точке пересечения корни уравнений
(15) и
(16)
будут
равны, следовательно:
Отсюда
х =
а/2, т.е.
к
моменту
т.
прореагирует половина
ис-
ходного вещества, поэтому время
т
называется
временем
полурас-
пада.
На
основании равенства
(17) из
выражений
(15) и (16)
вытекает, что
или
откуда
=
2
и т =
(18)
Таким
образом, время полураспада
не
зависит
от
количества
ис-
ходного вещества. Это понятно,
так
как
в
случае
мономолекуляр-
ных процессов превращение молекул является спонтанным
(не
зависящим
от
присутствии остальных).
Обратная величина константы скорости мономолекулярной
ре-
акции
имеет физический смысл
средней
продолжительности
жизни
отдельной молекулы. Действительно, среднюю продолжительность
жизни
отдельной молекулы можно найти, пользуясь определением
средней величины:
=
f t
dN/N
a
(19)
где
(—
время
жизни
отдельной молекулы,
т. е.
время,
протекающее
от
началь-
ного
момента, произвольно взятого для всей массы,
до
распада
выбранной
мо-
лекулы;
N
o
—
общее число молекул.
Но
dN
=
kN
dt (20)
И
N
=
N
Q
e~
kl
(21)
Подставляя (22)
в
(19)
и
интегрируя
по
частям,
а
также при-
нимая
/ =
и
и
e~
kt
dt
=
dv, получим
поэтому
-e-
kt
dt
=
kt
что
и
требовалось доказать.
§
5.
Необратимая реакция второго порядка
Примером
реакции второго порядка
в
растворе может служить
омыление эфира щелочью
6
+
NaOH
—>
CH
s
COOXa + QH
6
OH
