Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ
Подождите немного. Документ загружается.


После интегрирования выражение (127) примет вид
(128)
где у— средний
температурный
коэффициент в
температурном
интервале
Т
э
— 7"|.
Строго обоснованную зависимость константы скорости хими-
ческой реакции от температуры можно найти, пользуясь уравне-
нием
изохоры или изобары реакции. Без индексов, характеризую-
щих условия протекания процесса, уравнения изохоры и изобары
запишутся одинаково
(129)
где К— константа химического равновесия; Q —
теплота
химической реакции;
R — универсальная газовая постоянная; Т — абсолютная
температура.
Подставляя вместо константы равновесия отношение констант
скоростей, получим
dinki/k,
Q
(130)
dt RT
1
ИЛИ
(d In *, - d In
k
3
)fdT
=
QfR-n
Запишем теплоту реакции как разность
двух
величин
Q = A,-A
2
Тогда выражение (131) можно переписать в виде
d
In ft, d In
k-i
A) At
(131)
d\nk
dT
d\n
dT
_j4,
RT
1
RT
7
(132)
С
точностью до постоянной величины В можно считать, что
слагаемые правой и левой части уравнения (132) равны попарно:
d
in k
2
А%
IT
dlnki
RT
3
A
x
(133)
(134)
dT RT
3
^
Опыт показал, что 5 = 0. Поэтому, отбрасывая индексы, урав-
нения
(133) и (134) можно записать
d In k/dT =
A/RT
3
(135)
Это уравнение, получившее название
уравнения
Аррениуса,
показывает зависимость константы скорости реакции от темпера-
туры Т. Величина Л по размерности должна быть энергией; она
называется
энергией
активации. Ее можно определить как избыток
энергии по сравнению со средней энергией молекул при данной тем-
пературе, которым должны обладать молекулы, чтобы вступать
в химическую реакцию. Точнее физический смысл этой величины
будет
раскрыт ниже.
Уравнение (135) можно легко проинтегрировать. Взяв не-
определенный интеграл и принимая, что А есть величина постоян-
ная,
получим
In
ft —
|-4/(W)]
+ lnC (136)
где In С — константа интегрирования.
Если в качестве переменных выбрать
lgft
и \/Т и значения их
#гложить на координатных осях (рис. 6), то графически уравне-
(136) выразится прямой линией. Отрезок, который отсекает
прямая
на оси ординат, соответствует \gC, а тангенс
угла
на-
г
«лона кривой
:-
Г
tg<p = -AIR (137)
Равенство (137) позволяет определить энергию активации хими-*
ческой реакции.
..,, Потенцируя уравнение (136), получаем
k=~Ce-
AlRT
(138)
;;
f
. Из этого уравнения видно, что константами, характеризующими
•-/реакцию,
являются предэкспоненциальный множитель С и энергия
активации А. Чем больше А, тем меньше при данном С скорость
.'химической реакции.
У". ' На рис. 7 показана зависимость логарифма константы скорости
- от обратной температуры для реакции дециклизации циклопропана
СНг—СН
г
—• СНя—СН=СН
?
сн
2
t
'r Эта реакция протекает по уравнению первого порядка; энергия
«ктивации, найденная по тангенсу
угла
наклона прямой, равна*
272,14 кДж/моль. Зависимость константы скорости этой реакции от
Температуры может быть выражена уравнением
Если выражение (135) проинтегрировать в пределах от Л
, получим
№ А, и *а —константы скорости химической реакции при
температурах
7\ и
Соответственно.
ХвС
Рве. 6. Зависимость логарифма кон-
ставты
скорости химической реакции
от обратной
температуры.
1,23
Рис. 7. Зависимость логарифма константы скорости от обратной
температурЧ
*и реакции двцнклязацня циклопропана по данным Корнера я Пиза [А -*
-—
272,14
кДж/моль; k «= 2- 1Q-
|S
ехр(-272,14/ЯГ)].
88

Н'О
Рис.
Ъ Схема энергетических переходов при
химической реакции.
Таким
образом, зная константу
скорости k\ при какой-нибудь тем-
пературе 7"|, по уравнению (139)
можно рассчитать константу скоро-
сти k
2
для температуры Т
2
.
Энергию активации можно опре-
делить и не зная констант скоро-
стей. Отношение скоростей реакции
при
двух
температурах можно в общем виде записать следующим
образом:
k
7
f (с)
(НО)
Если
реакцию проводят так, что концентрации участников при
двух
температура:; одинаковы, то
wi/w
2
=
k\lki
(HI)
Из
формулы (139)
, *МЛ
Я
/*.)
поэтому
J i_
Tx
T
2
R
In
(wjw
2
)
L
1
т,
(142)
Экспериментально определяя скорости реакции W\ и Шг для
двух
температур Т\ и Т
2
при условии, что концентрации реагирую-
щих веществ при этих
двух
температурах одинаковы, по фор-
муле
(142) можно определить энергию активации. Такой расчет
представляет большой интерес, так как может явиться одним из
методов проверки справедливости предлагаемого кинетического
уравнения.
Если значение энергии активации, найденное из за-
висимости lg k от 1/7', совпадает со значением энергии активации,
найденной
по уравнению (142), это свидетельствует о справедли-
вости предлагаемого кинетического уравнения.
Интересно
рассмотреть связь энергии активации с тепловым
эффектом
реакции. Химическую реакцию, протекающую при р =
«= const, можно представить как переход системы из энергети-
ческого состояния I в состояние II с теплотой Л#. На рис. 8
видно,
что переход из состояния I в состояние II возможен при
затрате энергии Л
и
а обратный переход — при затрате энергииЛ
2
.
При
осуществлении реакции в прямом направлении выделяется
энергия
— Д// = Л
2
— А\. Величина —Д# рарча разности энталь-
пий
исходных и конечных продуктов реакции: — АН = Н\ — Я
2
,
отсчитываемых от некоторого уровня, принятого за нулевой
40
14. Тепловой взрыв
ЪАЯИ экзотермическая реакция (например, горение) протекает
в
замкнутом объеме, выделяющаяся в окружающую
среду
теплота
может оказаться меньше теплоты реакции. Это приведет к само-
разогреву реагирующей смеси, а следовательно, к возрастанию
скорости реакции. Явление перехода реакции к нестационарному,
Прогрессивно
ускоряющемуся выгоранию смеси, получило назва-
ние
теплового
взрыва.
Представим себе замкнутый сосуд, заполненный горючей сме-
сью. Пусть температура смеси
будет
7"о, а концентрация горю-
чего с. Выделяющееся при реакции тепло передается стенкам
сосуда
и через последние попадает в окружающую
среду,
темпе-
ратура которой в начале процесса также равна Т
о
. Характер про-
цессов,
сопровождающих горение смеси,
легче
всего представить
с помощью показанной на рис. 9 диаграммы. По оси абсцисс от-
ложены значения температуры, а по оси ординат — теплоты, вы-
деляющейся или отводимой в единицу времени от
сосуда.
Кривая
/ показывает зависимость от температуры теплоты,
выделяющейся за счет химической реакции при адиабатическом
процессе.
Эта кривая должна быть похожа на кривую зависимости
скорости химической реакции от температуры; кривая 2 отражает
зависимость количества отводимого тепла от температуры при
начальной температуре Т
о
. Кривая теплоотдачи всегда имеет мень»
шую кривизну, чем кривая тепловыделения за счет химического
процесса, и поэтому с достаточной степенью точности в небольшом
интервале температур может быть изображена в виде прямой
Если
начальную температуру повышать, то путем параллельного
переноса можно перевести кривую 2 в положение 2' и 2".
В стационарном состоянии количество выделяющегося и от-
водимого тепла в единицу времени должно быть равно. Как видно
из
рис. 9, таких стационарных состояний может быть или два
(точки
I и II пересечения кривых / и 2), или одно (точка В), или
ни
одного (кривая 2), т.е. число наблюдающихся стационарных
состояний
зависит от начальной температуры Т
о
. В случае, если
для системы возможны два стационарных состояния, только одно
из
них, (а именно I), как легко увидеть из рисунка, соответствует
устойчивому равновесию.
Действительно, в области ниже точ-
ки
I количество тепла, выделяющего-
ся
в единицу времени в
результате
реакции,
больше, чем количество от-
водимого тепла, следовательно, систе-
ма в таком состоянии через некоторое
время за счет саморазогрева вновь
Рис
9. Зависимость от температуры количе-
ства тепла, выделяющегося или отводимого в
единицу времени от
сосуда,
в котором проис-
ходит
химическая реакция.
41

попадет в точку I. Если система находится в состояниях, располо-
женных выше точки I, то выделение тепла в
сосуде
в единицу
времени при этом
будет
меньше, чем теплоотдача в единицу вре-
мени
в окружающую
среду,
и, следовательно, система начнет
охлаждаться и вернется в состояние, характеризуемое точкой I.
Необходимо заметить, что система, выведенная из состоя-
ния
II, не вернется в него, т. е. состояние II является состоянием
неустойчивого равновесия. Действительно, если состояние системы
описывается точками, расположенными ниже точки И, то тепло-
выделение меньше, чем теплоотдача, реакционная система
охлаж-
аается и, следовательно, состояние системы удаляется от точки II;
если же состояние системы описывается точками, расположен-
ными
выше точки II, тепловыделение в
сосуде
больше, чем его
теплоотдача, поэтому система
будет
разогреваться, т. е. ее со-
стояние
будет
все больше удаляться от точки II. Если постепенно
довышать начальную температуру Та, то при Т
в
для системы воз-
можно только одно стационарное состояние, отвечающее точке В.
,':сли начальная температура больше Т
в
, то стационарный процесс
Остановится невозможным. Количество выделяющегося в единицу
времени тепла
будет
больше количества тепла, отдаваемого окру-
жающей среде, и процесс
будет
протекать только как нестационар-
ный
с саморазогревом и увеличением скорости течения процесса,
Условие, отвечающее точке В, обычно называют
критическим
условием
воспламенения.
Условия воспламенения (в частности,
температура воспламенения) зависят от природы горючей смеси,
ее концентрации, материала стенок и формы
сосуда,
природы
внешней
среды, так как от
всех
этих условий в свою очередь за-
висит тепловой режим процесса.
Количество тепла Q, выделяющегося в единицу времени в со
суде,
где протекает экзотермический процесс, равно
Q
= wQV (143)
где
w —
скорость химического процесса;
Q —
тепловой эффект химической
ре-
акции
(термохимическая теплота);
V —
объем сосуда.
Скорость
химической реакции можно записать как функцию
температуры и концентраций реагирующих веществ:
w
=
ke~
ElRT
w
c
(c)
(144)
где
w
c
(c) —
некоторая функция концентрации реагирующих веществ.
Рассмотрим кинетику процесса при сравнительно низкил тем-
пературах, когда выгорание смеси незначительно. Тогда величину
kw
c
(c)VQ
= B (145)
можно считать постоянной. Следовательно, выражение (143)
можно записать
43
(146J
Количество тепла, отдаваемого сосудом окружающей среде,
удет
равно
QaS<r7-
o)
(147)
'где
СЕ
—
суммарный коэффициент теплоотдачи;
S —
поверхность сосуда.
При
достижении стационарного состояния
Qi=Q
a
(148)
|
На основании равенств (146) и (147)
Be-
EfRT
=
L(T-T
0
)
(149)
где
L = aS —
постоянная величина.
В точке В касания кривых выделения и отвода тепла должны
выполняться
равенства:
или,
что то же самое:
(BE/RT
2
B
)txp(-ElRT
B
)
Подставляя (151) в (152), получим
Е
Т=2
К1
или
(150)
(151)
(152)
(163)
(164)
Из
уравнения
(154)
находим значение температуры воспла-
менения
Корень
со знаком плюс у радикала отбрасываем, поскольку
он
соответствует
области высоких температур, которую, как не-
достижимую в обычных процессах, нет смысла рассматривать.
Из
формулы видно, что воспламенение может происходить в
определенном интервале температур окружающей среды
(166)
Температура воспламенения
тогда
будет
иметь максимальное
значение,
когда радикал в формуле (155) станет равным нулю,
т. е. когда Т
о
= E/AR. Из формулы (155) получаем
E/2R
(157)
При
температурах окружающей среды выше Го = E/4R рас-
положена область «теплового взрыва», в которой стационарное
течение реакции невозможно.
44

Как
видно из системы уравнений (151), (152), при заданных
величинах В, L и Е возможно только одно значение критической
температуры воспламенения Т
в
при вполне определенном значе-
нии
Т
о
. Пользуясь этой системой уравнений, можно выразить
значение
критической температуры воспламенения через В, L и Е.
Значение
Т
в
можно найти графическим решением. Тогда величина
Т
о
однозначно определяется первым из этих уравнений
КИНЕТИКА
ГОМОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЯ,
ПРОТЕКАЮЩИХ
В ПОТОКЕ
§
15. Режимы вытеснения и перемешивания
Крупнотоннажные
химические процессы обычно осуществляют в
потоке,
т. е. в
струе
газа, проходящей через реактор с заданной
температурой. Последний может быть пустым или со слоем зерне-
ного катализатора. Примерами реакций, осуществляемых в потоке
в
широких технических масштабах, являются крекинг нефтепро-
дуктов, гидрокрекинг, каталитическое алкилирование, полимериза-
ция,
гидро- и дегидрогенизация углеводородов, дегидратация
спиртов,
гидратация олефинов, галогенирование, нитрование окси-
дами азота, синтез аммиака, контактный способ получения серной
кислоты,
каталитический риформинг и т. п.
Проведение реакций в потоке обеспечивает непрерывность про-
цесса, высокую эффективность использования реакторов, создает
большие возможности для регулирования и автоматизации про-
цесса. Многие технически важные реакции при изучении их
кине-
тики
в лабораторных условиях проводят также в потоке.
Малотоннажные процессы, а также некоторые процессы, про-
ходящие опытную проверку, чаще проводят в реакторах периоди-
ческого действия с однократной загрузкой исходных веществ. Ре-
акции
в потоке можно классифицировать по режимам проведения.
Предельными режимами являются: режим идеального вытеснения
и
режим идеального перемешивания. На практике
могут
реализо-
ваться и промежуточные режимы.
Режим
идеального
вытеснения,
осуществляемый в
трубчатых
реакторах, характеризуется тем, что в потоке реагирующего газа
отсутствует
продольное и поперечное перемешивание.
Режим
идеального
перемешивания
характеризуется тем, что в
результате
интенсивного перемешивания концентрации
всех
реа-
гирующих веществ в любой точке реактора равны их концентра-
циям
на
выходе
из реактора.
Очевидно, что строгая реализация идеальных режимов очень
затруднительна, и поэтому химические процессы в потоке в дей-
ствительности протекают или по режимам, близким к идеальным,
или
по смешанным. Изменение концентрации одного из реагирую-
щих веществ вдоль потока в реакторе при
двух
идеальных режи-
мах ведения процесса показано на рис. 10.
Реакторы,
в которых происходят химические реакции в потоке,
являются частным случаем открытых систем.
44
>нс.
10. Изменение числа молей n
t
,
l
реаги-
рующего вещества вдоль реактора длины /:
/ —
режим идеального вытеснения;
2 —
режим
иде-
%
ального перемешивания
( 0А
(
—
число молей
ве-
',Щества
А»,
подаваемых
в
начало реакционной зоны
единицу времени).
Кинетические
уравнения процессов в потоке вследствие того,
что их обычно проводят при постоянном давлении и они сопро-
вождаются в большинстве случаев изменением объема
участвую-
щих в реакции веществ, должны отличаться от обычных кинети-
ческих уравнений, приведенных выше и выведенных для условия
• постоянного объема. Кроме того, метод расчета констант скоро-
стей реакций, идущих в потоке, должен быть иным из-за
труд-
ности
определения времени пребывания реагирующих веществ в
зоне
реакции (так называемого
времени
контакта).
Общие уравнения кинетики химических процессов в потоке
можно получить, как это было показано Г. М. Панченковым, поль-
зуясь методами гидродинамики. Этот прием интересен и важен
в
том отношении, что позволяет рассчитывать динамику как ста-
ционарных,
так и нестационарных процессов. Полученные общие
, уравнения позволяют рассчитывать скорости как гомогенных реак-
ций
любых порядков и любой сложности (необратимых, обрати-
мых, параллельных, последовательных, автокаталитических, цеп-
ных и др.), так и гетерогенных (см. гл. X, § 16).
," § 16. Общее уравнение динамики
и
скорости химической реакции, протекающей в потоке
в
режиме идеального вытеснения
; Общим уравнением динамики химической реакции *, протекающей
в
потоке в режиме идеального вытеснения, является уравнение,
выражающее закон сохранения вещества. Это уравнение в теоре-
тической физике называют
уравнением
неразрывности,
а в тех-
нике
—
уравнением
материального
баланса.
Будем рассматривать поток химически реагирующих веществ,
, проходящий через сечение 1\ и /
2
, находящиеся на расстоянии Д/
(рис.
И). В потоке происходит химическая реакция
v^t +
v
2
A
2
+ • • • +
v
k
A
k
=-
vjAj
+
V2A2
+ - • • +
v'
ft
A'
ft
(a)
Для простоты расчетов
будем
считать температуру в реакторе
- постоянной. Переносом вещества за счет диффузии и действием
* При описании химических процессов в потоке в режиме вытеснения не-
обходимо учитывать не только протекание реакции во времени, но и переме-
щение
веществ вдоль координат пространства реактора. Поэтому уравнения,
описывающие химические процессы в потоке в нестационарных условиях, со-
держат
не менее
двух
переменных (для одномерного потока) — время и коор-
динату. Эти уравнения косят название
уравнений
химической
динамики.
45

Рис.
11.
Поток
вещества в трубке.
диссипативных сил, т. е. вязкости и теплопроводности, пренебре-
жем. Зададим площадь сечения потока, равной р. Сначала за-
пишем
уравнение материального баланса словами:
Количество
вещества А[, Количество вещества А/,
входящего в сечение /, — выходящего из сечения t
3
=
за
время At за время At
(158)
Количество
вещества А/, Количество вещества А/,
«=>
прореагировавшего за + оставшегося за время Дг
время
At в объеме р Д/ в объеме р Д/
Пусть линейная скорость потока в любом сечении
будет
и,
а концентрация вещества А,- в любом сечении с
А{
. Эти величины
в
общем
случае
являются переменными, т. е. в каждом заданном
сечении
имеют разное числовое значение. Тогда за единицу вре-
мени
через сечение U пройдет объем, равный ир|/ь а через сече-
ние
/
2
соответственно up
\
h. Если это величины умножить на
мольно-объемную концентрацию * вещества А; в каждом данном
сечении,
то мы найдем число молей вещества А/, проходящего
за единицу времени сечения
1\
и /
2
.
Умножив эти величины на At, получим величины, стоящие
в
левой части уравнения материального баланса, т. е. количество
вещества А/, проходящего сечение 1
г
и h за время At.
Обозначим УА. количество вещества А/, реагирующего к мо-
менту времени t в любом заданном объеме V. Тогда количество
вещества А/, реагирующего к моменту времени t в объеме рД/
будет
равно
(yxJVjp&l.
Количества вещества А/, прореагировав-
шего к моментам времени U и t
s
в объеме рД/,
будут
равны
УА, УА,
-f-pM\
tl
я -рг-рД/1,,
а количество вещества, прореагировавшего за время At в объеме
рД/,
будет
равно
УА,
Количества вещества А/, оставшегося (непрореагировавшего)
в
объеме рД/ к моментам времени U и U,
будут
равны соответст-
венно
CKpAl\t
v
и
c
Al
pAl\t
a
.
Тогда количество вещества А
1(
остав-
шегося в объеме рД/за время А/,
будет
равно сд рД/|* — сд.рД/|/
(
.
*
Концентрация
может быть выражена в любых единицах массы на еди-
ницу
объема, но при рассмотрении
кинетики
химических реакций ее удобнее
выражать
числом молей а единице объема,
46
Подставляя найденные таким образом величины в уравнение
материального баланса (158), получим
У
А УА
(159)
Деля правую и
левую
части равенства (159) на ДШ и сокра-
щая
р (считая его для простоты постоянным), находим
—
ис,
A/
Переходя к пределу при Л/
VAt """ М
О и At
-*•
0, получим
(
uc
A
t
)
dl
Vdt
dt
(160)
(161)
Первое слагаемое в правой части равенства по физическому
смыслу является истинной скоростью химической реакции да, по-
этому уравнение (161) может быть записано в виде
ис
<
162
>
Это выражение и есть общее уравнение динамики гомогенного
химического процесса, происходящего в потоке в режиме идеаль-
ного вытеснения.
Пользуясь векторным обозначением, выражение (162) можно
записать
-
div (с
А
и\ — w + дс
А
/dt (163)
Уравнения (162) и (163)
могут
быть использованы для расчета
нестационарных процессов.
Если
количество исходных веществ, подаваемых в реакцион-
ную
трубку,
постоянно, в трубке к моменту, когда реагирующие
вещества достигают конца реакционной зоны, устанавливается
стационарное
состояние.
В стационарном состоянии концентрации
в
каждом данном сечении со временем не изменяются, т. е.
dc
K
jdt*=Q
(164)
Когда установится стационарное состояние, концентрации С
х[
и
линейная скорость вещества и в заданном сечении трубки
будут
однозначно
определяться только расстоянием / этого сечения от
начала реакционной зоны:
%
=
Ф(<>
н=Ц>(/)
(165)
Поэтому уравнения (162) и (163) для стационарного состоя-
ния
запишутся следующим образом:
—
d (c
A
u\/di = w
di()
l 6)
47

Определим концентрацию /-го компонента так
(167)
где я
д
—
число
молей
вещества
А/,
проходящего
через
заданное
сечение
в еди-
ницу
времени;
V —
объем
вещества,
проходящего
в
единицу
времени
через
это
сечение.
Линейную скорость можно выразить
и=И/р
(168)
Подставляя (167) и (168) в первое уравнение (166), находим
Р dl
W
(169)
Но
n
Al
= noA
t
(l —х) (где
ПОА.
{
— число молей вещества А;,
поступающего в единицу времени в начало реакционной зоны;
х
— количество вещества А*, прореагировавшего на расстоянии /
от начала реакционной зоны, выраженное в долях от исходного
количества), поэтому
Подставляя (170) в (169), получим
л
0А,
(171)
Это — уравнение кинетики любой химической реакции, проис-
ходящей в потоке в режиме идеального вытеснения в общем виде.
Пользуясь основным постулатом химической кинетики, выраже-
ние
(171) для необратимых реакций можно записать в виде
rtn. —тг =
kc
K
l
C
A
2
... c
A
* (172)
а для обратимых реакций оно запишется следующим образом:
*,£r-*№...#
k
-*Z4-%
(i73>
где А] и kj —
константы
скоростей
прямой и
обратной
реакций.
Для интегрирования уравнений (172) и (173) необходимо вы-
разить концентрации как функции /. Это особенно легко сделать
для идеальных газов. В этом случае
и,следовательно
(174)
(175)
где 2п —
общее
число
молей
всех
участников
реакции (как
исходных,
так и
конечных
продуктов),
проходящих
в
единицу
времени
через
заданное
сечение*;
р —
общее
давление
смеси
всех
газов.
Давление р в общем случае
будет
функцией расстояния / от
начала реакционной зоны, т. е.
Р-/СО (176)
Для интегрирования уравнений (172) и (173) эта функция
должна быть задана. Найти вид этой функции легко, так как
давление в начале и в конце реакционной зоны в лабораторных
и
технических реакционных аппаратах известно. Чаще всего пере-
пад давления Др от начала реакционной зоны к ее концу невелик,
и,
следовательно, в этом случае значением Ар можно пренебречь,
а величину р рассматривать как постоянную.
Если
реагирующий газ сильно разбавлен инертным газом, так
что изменением объема, происходящим вследствие химической
реакции,
можно пренебречь, или химическая реакция протекает
без изменения объема, или реакция протекает в потоке жидкости,
то (так как объемная скорость
будет
постоянной величиной) при
постоянном
р
d 0 (177)
Поэтому
уравнение (166) запишется в виде
-u(dc
K
Jdr) = w (178)
Подставляя в (178) значение производной
dcta/dl
с учетом
(177), находим
— dn
A
ff>dt = w (179;
Как
видно, уравнение (179) по форме похоже на уравнение
(169): при выводе уравнения (169) объем газа V, протекающего
в
единицу времени через заданное сечение, принимался завися-
щим
от расстояния / от начала реакционной зоны, а при выводе
уравнения (179) этот объем принимался постоянным.
• Для реакции (а) при
условии,
что концентрации
конечных
продуктов
в
начальный
момент
времени
равны
нулю
причем
n
0A,
•-.+
(
0А,
*0
AJ
n
t
п
(
n
f
"к
п,
где п
0А
—
число
молей
вещества
Ai,
поступающего
в
единицу
времени
в на-
чало
реакционной зоны; n
L
и n
i
—
стехиометрические
коэффициенты
исходных
А/ н
конечных
А^
продуктов
реакции.
49

В выражениях (172),
(173) и (179)
величину
pdl
можно заме-
нить
на
элемент объема
dV
пространства,
где
протекает реакция,
т.
е.
можно записать
pdt=*dV
(180)
Указанная
замена позволяет использовать уравнения (172),
(173)
и (179) для
расчета объема реактора, необходимого
для
осуществления заданной степени превращения
х.
Очевидно,
что
для такого расчета необходимо заранее определить константы
скоростей данной реакции.
Для неизотермического процесса
(что
часто наблюдается
в
промышленных реакторах) необходимо выразить
с
помощью урав-
нения
Аррениуса константу скорости
как
функцию температуры
и
задать
на
основании экспериментальных данных зависимость
температуры
от
расстояния вдоль трубки
с
начала реакционной
зоны.
Ниже
будет
рассмотрено несколько примеров гомогенных газо-
вых необратимых реакций.
§
17.
Необратимая реакция первого порядка
В общем виде такую реакцию можно записать
А
—*• V|A,
+v
2
A
2
+
...
В этом
случае
уравнение
(172) с
учетом
равенства
(175) при-
обретает
вид
dx
. (1 — х) р
°
0А
pdl (1 + рх) RT
Разделяя
переменные,
получаем:
вли
dx
.
а
xdx kftp
(182)
(183)
Прибавляя
и
вычитая единицу
в
числителе второго слагаемого
левой части, имеем:
dx
1-х
г
\-х
ИЛИ
или
50
4AW
(184)
(185)
(186)
-[n
oA
ln(t-Aj]-t0
Рис.
12.
Зависимость п
ол
х
от
—гео
А
1п(1
— х) для
реакции первого порядка,
про-
текающей
в
потоке.
Рис.
13.
Кинетика термического крекинга к-гексадекана
в
потоке
(по
данным
Г.
М.
Панченкова
и В. Р.
Баранова).
Интегрируя
это
выражение
в
пределах
от 0 до х и
соответст-
венно
от 0 до t,
получим
откуда
—
(1 + Р) In (1 —
др)
—
"0А*
7
"
(187)
(188)
где
V = р/ —
объем реакционного пространства.
Для реакции
А^Аа, так как р = 0,
уравнение
(188) за-
пишется
RT
PV
In
1
Из
сопоставления уравнений
(189) и (13)
вытекает
(189)
т.
е.
время пребывания вещества
в
реакционной зоне,
или
время
контакта,
для
данного случая
V
A*
7
' (190)
Проверить применимость уравнения
(188) к
опытным данным
и
определить значение констант удобнее всего следующим обра-
зом.
Запишем уравнение
(188) в
виде
п
о\
х
= — л
10А
l
+
P
вя;
(191)
Тогда, если выбрать в качестве переменных г = п
0А
х н
У
= — «од1п(1 — х), уравнению (191)
будет
соответствовать пря-
мая
на рис. 12.
51

Этому уравнению подчиняется кинетика реакции термического
крекинга
н-гексадекана, если о ней судить по количестеу непре-
вращенного н-гексадекана при различных скоростях его подачи
в
реакционную зону (рис. 13).
Прямая
отсекает по оси ординат отрезок, равный —kpV/$RT
тангенс
угла
наклона прямой lg<p= (1 + Р)/Р
Отсюда легко определяется р.
Зная
р, нетрудно рассчитать к.
§
18. Необратимая реакция второго порядка
Допустим, что в потоке протекает реакция А + В -^ С -f D.
Если
число молей веществ А и В, подаваемых в единицу времени
в
начало реакционной зоны, составляет соответственно л
О
д и «ов,
уравнение (172) с
учетом
равенства (175) приобретает вид
dx
t
р (1-х) (п
ов
-
np
A
x)
(193)
После
разделения переменных и интегрирования получим
•In
п
0А
(
П
0В
-
П
0
Если
исходные концентрации обоих веществ одинаковы, урав-
нение
(172) с
учетом
равенства (175) после интегрирования
дает
1
0А
7р
2
1-х
(194)
§
19. Обратимая реакция первого порядка А| ** Аг
Обратимую реакцию формально можно рассматривать так же,
как
и необратимую, считая, что реагирует не все исходное число
молей
ПОА,
а разность
между
исходным числом и тем, которое
остается непрореагировавшим к моменту равновесия. В этом слу-
чае уравнение (173) с
учетом
равенства (175) приобретает вид
dx
(195)
Здесь
rt
«.A,
"•
Л
°°А,/
Я
ОА,
где я' . — число молей вещества А
|ф
образующегося к моменту равновесия.
После
интегрирования получим
RT
1 -я
'ОА,
pV
In
~ «-д. -
Х
(196)
В этом равенстве k — k\ + k
2
(k
x
и k
2
— константы скоростей
прямой
и обратной реакции).
§
20. Обратимая реакция второго порядка А + В
D
В
случае
обратимой реакции второго порядка уравнение (173)',
если в начальный момент времени имеются налицо только ве-
щества А и В, с
учетом
равенства (175) приобретает вид
dx
~pdf
р
2
(1 — х) (п
Ой
—
п
0А
х)
л
0А*
(197)
где пол И лов — число молей веществ А и В, поступающих в начало реакционной
гоны в единицу времени.
После интегрирования находим
(т,
-
х)
где
*1
""
i, 2
fe
2
=
(
Л
0А -
Л
'
"ОА —
л
0В =Ь V("0A ~
п
0в)
pW
(ш,
—
т
2
) т\ (т
2
—
х)
(198)
§
21. Последовательная реакция в потоке
Задача расчета констант скоростей гомогенной последовательной
необратимой реакции, проводимой в потоке, решается легко. Рас-
смотрим последовательную необратимую реакцию
*• к,
А —• viB —*• v
a
C
где А] ,и ^2 — константы скоростей
соответствующих
реакций.
Допустим, что в начальный момент времени имеется только
вещество А. На некотором расстоянии / от начала реакционной
зоны
число молей вещества А составит
ЛОА(1
— х), где n
Q
\ —
число молей этого вещества, поступающего в единицу времени
в
начало реакционной зоны. Как легко увидеть из химического
уравнения,
должно возникнуть VI^OAJC молей вещества В, из кото-
рых П
О
АУ молей превращается в вещество С, т. е. число молей
вещества В, проходящего в единицу времени сечение, которое
находится на расстоянии / от начала реакционной зоны,
будет
«OA(VIX
— у). Кроме того, образуется, согласно химическому урав-
нению,
v
2
rt
0
A(//vi
молей вещества С. Суммируя эти величины,
получаем
2][ (^)] (199)
Пользуясь выражением (175), найдем
62
(201)
53
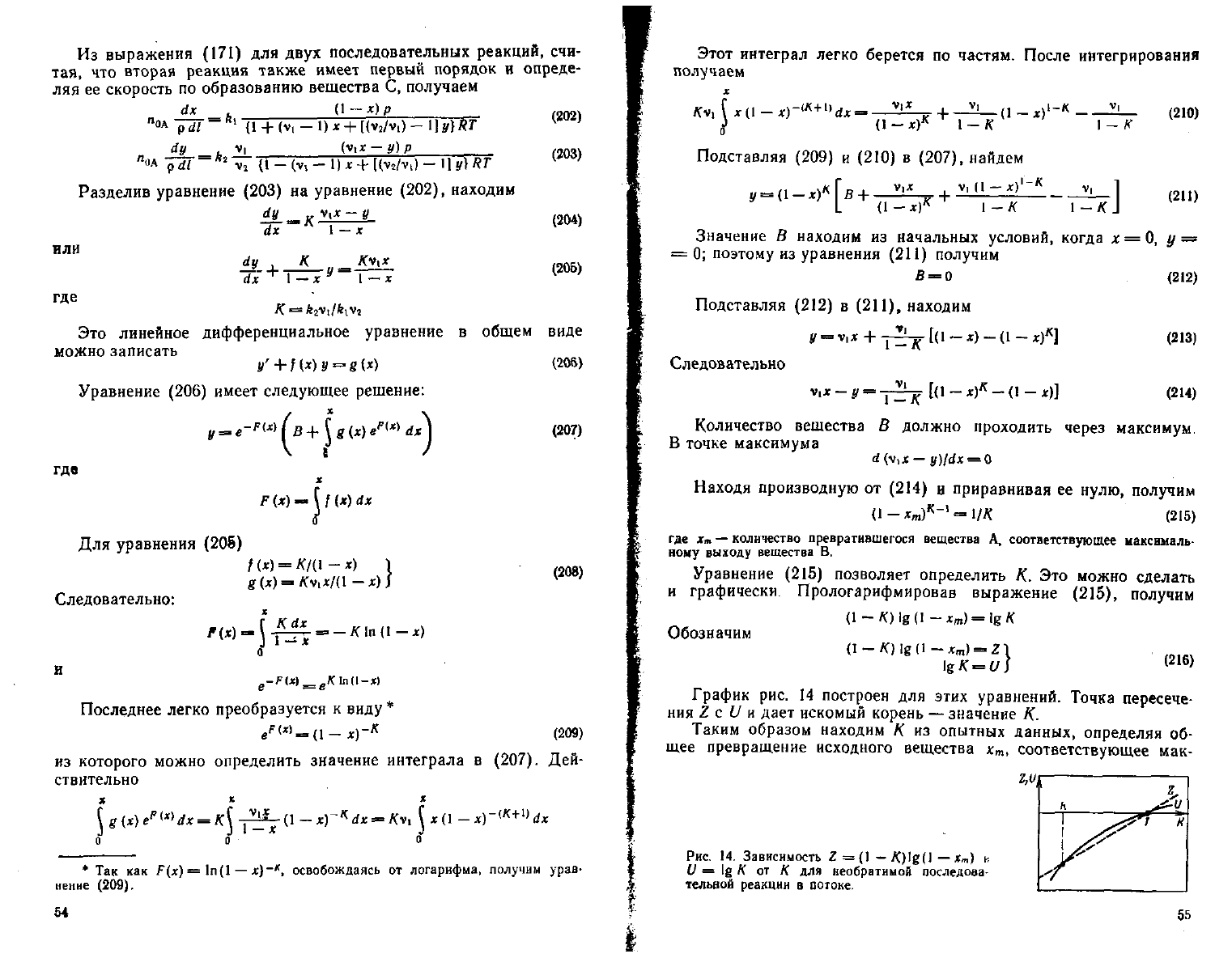
Из
выражения
(171) для
двух
последовательных реакций,
счи-
тая,
что
вторая реакция также имеет первый порядок
и
опреде-
ляя
ее
скорость
по
образованию вещества
С,
получаем
n
^JdJ-
Ri
{l +
(v,-l>
п
ы
9
dt-
ki
v
a
{l-(v,-
Разделив уравнение
(203) на
уравнение (202), находим
dy
y
dx
™
Л
1-х
ИЛИ
где
-К
_
/СУ,*
dx "•" 1
- х
у =
1
- х
(202)
(203)
(204)
(205)
Это линейное дифференциальное уравнение
в
общем виде
можно записать
y'
+ f(x)y =
z{x)
(206)
Уравнение
(206)
имеет
следующее
решение:
в
(х)
e
Fix)
dx
•)
где
F(x)-*\f(x)dx
Для уравнения
(205)
/W-/C/0-X)
Следовательно:
)
1
-x)J
(207)
(208)
Последнее легко преобразуется
к
виду
.(i
—
Х
)"
Л
(209)
из
которого можно определить значение интеграла
в
(207).
Дей-
ствительно
XX X
xr
K
dx
=
Kvi
\x(\-x)-
(K+l)
dx
* Так как F(x)
=
1п(1 — х)-*, освобождаясь
от
логарифма, получим урав-
нение
(209).
54
Этот интеграл легко берется
по
частям. После интегрирования
получаем
v
t
*
V|
(1-
V|
(1
- х)
к
^
1
-
Подставляя
(209) и (210)
в
(207), найдем
V,JC
, V,
(1-ДГ)'"
Л
- К
0 —(1 —•
(1-х)
I
-К
(210)
(211)
Значение
В
находим
из
начальных условий, когда
* =
0,
у
—
=
0;
поэтому
из
уравнения
(211)
получим
В
=
0
(212)
Подставляя
(212)
в
(211), находим
y*=ViX
+
j^
T
hl-x
Следовательно
—
у
1-К
1(1-*)*-(!_
(213)
(214)
Количество вещества
В
должно проходить через максимум.
В точке максимума
Находя производную
от (214)
и
приравнивая
ее
нулю, получим
(1-**.)*-'
=
1/*
(215)
где хт — количество превратившегося вещества
А,
соответствующее ыаксемаль
вому
выходу
вешества
В.
Уравнение
(215)
позволяет определить
К. Это
можно сделать
и
графически. Прологарифмировав выражение (215), получим
Обозначим
(2I6
>
График
рис. 14
построен
для
этих уравнений. Точка пересече-
ния
Z с
U и
дает
искомый корень
—
значение
К.
Таким
образом находим
К
из
опытных данных, определяя
об-
щее превращение исходного вещества
х
т>
соответствующее
мак-
Рис.
14. Зависимость Z=(l — K)lg(l — х
т
)
и
U
= lg
К
от К для
необратимой последоаа
тельвоЙ реакции
в
потоке.
55

симальному
выходу
продукта
В.
Зная
y
t
можно решать уравне-
ние
(202). Подставляя
у из
уравнения
(213) в
уравнение (202),
получим
п
0
dx
=
ft,
(217)
Это обыкновенное дифференциальное уравнение, которое
ре-
шается
путем
разделения переменных. Интегрирование уравне-
ния
(217)
дает
к
\
="ОА
pV
Т (
_
К)
{ ~ vj (I - К) In {1 - х) - [v, -
1
+ К (1 - v,)J х +
(218)
Уравнение
(218)
позволяет вычислить константу скорости
пер-
вой реакции.
Так как нам
известна
К,
которую находят
с по-
мощью графика
рис. 14,
следовательно,
из
соотношения
К —
—
k2V\/kiV
2
легко определить
и
константу скорости второй
ре-
акции:
Vi
§
22.
Расчет
энергии активации химической реакции,
протекающей в потоке в режиме идеального вытеснения
Энергию активации реакции, протекающей
в
потоке
в
режиме
идеального вытеснения, можно определить, пользуясь графиком
зависимости
\gk от 1/Г, так, как уже
рассмотрено выше.
Для
этого
нужно установить, какому кинетическому уравнению подчиняется
реакция,
и,
пользуясь
им и
экспериментальными данными,
рас-
считать
для
разных температур константы скоростей.
Однако энергию активации реакции можно рассчитать
и не
зная
кинетического уравнения. Экспериментальные данные
о
кинетике
реакции
в
потоке обычно графически изображают
в
виде зависи-
мости количества непрореагировавшего вещества
А, или
количе-
ства образовавшегося продукта реакции
от
числа молей
/год. ве-
щества
А/,
подаваемого
в
начало реакционной зоны. Поэтому
общее уравнение кинетики химической реакции
в
потоке
в
режиме
идеального вытеснения удобно преобразовать
так,
чтобы вместо
переменной
I
входила
переменная
под .
Интегрируя выражение (174)
в
пределах
от 0 до / и от 0 до х,
получим
п
0А,
)
W
Продифференцировав
(219) по
ЯОА
£
, применяя теорему
о диф-
ференцировании
определенного интеграла
по
параметру, найдем
р/
dx
а
"
(220)
<>А.
Если
в
реакции
(а) (см. § 16)
участвуют
газы,
то
согласно
законам идеальных газов
C\
l
=
PAJRT
где
х —
доля
превратившегося
вещества
Aj; Av =
(221)
v
2
+
• • •
+ v
K
—
v
(
—
Таким
образом,
в
общем
случае,
поскольку^
= f
(сд,
...
сд
£
...
•
• -
СА
П
), скорость реакции
будет
зависеть
от
ЛОА,
И Х. Как
видно
из
выражения (221),
в
двух
случаях,
когда
реагирует
одно
ве-
щество
и
когда
в
реактор подается смесь веществ,
но на
протяже-
нии
всего опыта состав смеси
не
изменяется,
а
изменяется лишь
скорость подачи
в
реактор реакционной смеси неизменного
со-
става, скорость реакции является функцией только
х. Для
этих
случаев
и выражение
(220)
преобразуется к-виду
rt
0A
J
dx
pi dn,
0A,
(222)
Легко показать,
что
формула
(222)
применима
и к
реакциям
в жидкой фазе
при
соблюдении указанных выше условий.
Пользуясь кривыми
* =
f(/ioA,),
полученными
на
основании
опытных данных
при
различных
температурах,
можно найти
dx/
jdnox
для
одного
и
того
же
значения
х,
после
чего
вычислить
скорости реакции
при
различных
температурах.
Подставляя
най-
денные таким образом значения скоростей
в
выражение (142),
находим энергию активации. Сопоставляя найденную этим спосо-
бом энергию активации
с
вычисленной
из
функциональной
за-
висимости
In k от 1/7",
можно
судить
о
справедливости выбран-
ного кинетического уравнения
для
описания данной реакции.
Рассмотренный прием преобразования уравнения скорости
ре-
акции
в
режиме идеального вытеснения
в
форму,
удобную
для
использования экспериментальных кривых
х= f
(noA
t
)
при рас-
чете
скоростей реакции, может быть применен
для
реакции любой
сложности.
