Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ
Подождите немного. Документ загружается.


/
Возникший отрицательный ион реагирует с галогеном /
I
СН,—С=СН
2
+1,
О"
I
СН
а
—С—CH
S
I
+ НА —
J
-
_*
СН
3
—С—СИ,1
А-
СНзСОСНЛ
+ HI + А"
Реакция
галогена с отрицательно заряженным ионом более ве-
роятна, чем реакция с незаряженным енолом.
Кроме рассмотренного прототропного механизма кислотно-
основного катализа возможен и
другой
механизм, называемый
протолитическим. Возникший в первой стадии
s
+ вн*
*==*=
SH
+
+
B
«а
протонизнрованный
субстрат
SH+ может передавать протон моле-
кулам воды, являющейся растворителем
SH
+
+
H
2
O
—*-*-
Р+НаО*
Эта вторая стадия и характеризует протолитический механизм
процесса.
Скорость образования конечного продукта при достаточно
большой концентрации воды
будет
w — Аз [SH
+
]
Пользуясь принципом стационарности, найдем
*i [S] [ВН*] - к, [SH
+
] [В] - кг [SH
+
] = О
откуда
[SH
+
]
~
MS][BH
+
J/(*
S
[В] + *а)
Подставляя
(55) в (54),
получим
[S]
[BH
+
]/(Aj
[В] + кг)
(54)
(55)
(66)
(67)
Если А
2
[В] 3> Аз, т.е. вещество SH+ является промежуточным
веществом Аррениуса, то уравнение (57) переходит в уравнение
Для реакции
ВН+4-
Н
2
О +* В -f- H
3
O+ константа равновесия
равна
/С
= [В][н
3
о
+
]/[вн
+
] (59)
Подставляя в (58) значение
[ВН+],
найденное из уравнения
(59), получим
w =
^[S\[H
a
O+]
(60)
398
т. е. скорость реакции оказывается прямо пропорциональной кон-
центрации
[Н
3
О+]
и, следовательно, реакция протекает по
меха-
низму специфического кислотного катализа, несмотря на то что
присоединяющийся в первой стадии протон появляется из вещест-
ва ВН+. Если &з^Аг[В], т.е. образующийся комплекс SH+ яв-
ляется промежуточным веществом Вант-Гоффа, уравнение (57)
превращается в уравнение
(61)
Следовательно, процесс протекает по механизму общего основного
катализа.
В неводных растворителях, содержащих водород, возможна
диссоциация по типу 2НВ ч=ь Н
2
В+ + В- с образованием ионов
лиония
и лиата, аналогичным ионам гидроксония и гидроксила.
В таких растворителях возможны как специфический катализ
ионами
лиония и лиата, так и общий кислотно-основной катализ,
причем относительная сила кислот и оснований во многих раство-
рителях (вода, спирты, амины, уксусная кислота, л-крезол, хлоро-
форм,
бензол) приблизительно одинакова.
В растворителях, не содержащих водорода (апротонные рас-
творители), может осуществляться лишь общий кислотный или
основной катализ, так как ионы, аналогичные ионам гидроксония
и
гидроксила, при этом
отсутствуют.
При
реакции S[ +
S
2
-*Pi
+ Р2, протекающей в апротонном
растворителе, в присутствии кислоты НА может осуществляться
каталитический процесс по
схеме
S. + HA
*==*
S,H* + A- (a)
SiH*
+ Si *- РН
+
Р,Н*
+ А~ *• Р
2
Н
АН
(б)
(в)
Если медленной стадией является реакция (б), то скорость реак-
ции
равна
dlP,l/d/-fts[s,H*][S,l
Для реакции (а) можно написать
(62)
l
(63)
откуда, принимая во внимание, что [SH+] = [А~], найдем
[SH
+
]
=
V/C[S
!
][HA]
(64)
Подставляя
(64) в (62),
получим
d[P
t
]fdt~k
s
VK VfsTlS»] V[HA[ (65)
т.
е.
скорость
реакции
прямо
пропорциональна
квадратному
корню
из
концентрации
катализатора.
399

Вследствие малой диэлектрической проницаемости многих ап-
ротонных растворителей возможны процессы ассоциации ионов и
полярных молекул. Это приводит к более сложным зависимостям
скорости реакции от концентрации кислоты.
Уравнения
Гаммета
и
Бренстеда
Для реакций, катализируемых кислотами одного гомологического
ряда, можно ожидать справедливость уравнения Гаммета (см.
гл. VI, § 7) для константы скорости k
a
1 1
p
a
p
и
константы диссоциации
(66)
(67)
где р и р'— константы,
характеризующие
природу
реакции; А
о
и Ко— постоян-
ные для рассматриваемой
группы
веществ
и реакций; а — константа, завися-
щая от природы заместителя в
реагирующем
веществе.
Вычитая из (66) выражение (67) и умножая па р, получим
или
или
(68)
(69)
(70)
где
а =
р/р'; константы
Она
обычно меньше единицы.
Уравнение (70) было независимо от Гаммета и даже несколько
ранее предложено Бренстедом и Педерсоном.
Для основного катализа Бренстед и Педерсон предложили
уравнение
Ьь =
а
ъ4 (71)
где kb — константа скорости основного катализа; Gb и 0 — константы, обычно
меньшие единицы, для
гомологических
серий оснований; Кь — константа диссо-
циации основания.
Для процесса В + Н
2
О ч* ВН+ -f ОН- константа диссоциации
основания
составляет
=
[вн
+
][ОгГ]/[В]
(72)
Если рассмотреть реакцию диссоциации сопряженной кислоты
ВН+
+ Н
2
О *£ В -f-
H
3
O+,
то для нее константа диссоциации
будет
равна
[1/[
+
J (73)
400
Из
выражений (72) и (73) видно, что
где /С
н
о= [Н
3
О*] fOH'J — ионное произведение воды.
Подставляя (74) в (71), получим
ГДв
(74)
(75)
Если в кислоте имеется р протонов, одинаково сильно связан-
ных с анионом кислоты, a q — число положений в сопряженном
основании,
которые
могут
присоединять протоны, то для кислот-
ного катализа уравнение Бренстеда записывается в виде
—— = G
a
{qKalp)
(76)
Для основного катализа уравнение Бренстеда (если q — число
положений в катализирующем основании, способных присоединять
протон, а р — число протонов, способных отщепляться в сопряжен-
ной
основанию кислоте) записывается в виде
(77)
Для реакции иодирования ацетона в присутствии кислот, у ко-
торых р = <7=1, оказалось, что уравнение Бренстеда имеет вид
К =
(78)
Числовые значения констант подобраны на основании опыта.
В табл, 39 приведены значения констант диссоциации Ка и катали-
тических констант скоростей k
a
, найденных экспериментально и
рассчитанных по уравнению (78).
Кислотные
функции
Для оценки относительной кислотности сред разного состава и для
корреляции скоростей реакции в различных растворителях полез-
ной
оказалась функция кислотности Гаммета.
Силу слабых кислот и оснований в разбавленных водных рас-
творах можно сравнивать, используя величины констант дис-
социации.
Гамметом был разработан способ сравнения силы сильных про-
тонных кислот (полностью распадающихся в воде на ионы) не
только в водных, но и в неводных
средах.
В основу этого метода
была положена индикаторная шкала кислотности и введена
удоб-
ная
величина, характеризующая силу кислоты, — функция кислот-
ности Яд.
401

Таблица
39.
Кинетически»
данные
для
реакции
иодирования
ацетона
Кислота
—
катализатор
k
a
,
л/(моль-с)
опытвая
рассчитанная
по (78)
Дихлоруксусная
а,р-Дибромпропноновая
Монохлоруксусная
Глнколевая
Р-Хлорпропионовая
Уксусная
Пропионопая
Триметилуксусная
5,7
6,7
1,41
1,54
1,01
1,75
1,34
9,1
10"
10"
10"
10"
10"
10"
10"
10"
220
63
34
8,4
5,9
2,4
1,7
1,9
270
54
32
7,9
6,2
2,2
1,8
1,5
Если электронейтральное основание В растворено в кислоте
НА, то ионизация основания
В + ЫА
=«=*
ВН* + А~
протекает тем полнее, чем сильнее кислота и основание. Об от-
носительной кислотности растворителей можно
судить,
сравнивая
степень ионизации основания в нескольких растворителях. Степень
ионизации,
являющуюся отношением [ВН+]/[В] легко определить
с помощью индикатора — основания, неодинаково окрашенного в
неионизированном и ионизированном состояниях.
Для
того
чтобы
охватить
широкую область кислотности, Гам-
мет воспользовался серией индикаторов — оснований различной
силы. Большинство подобранных индикаторов были производными
нитроанилинов.
Реакция
ионизации индикатора —основания В состоит в при-
соединении протона
В + Н* 4=i BH
+
(а)
Например,
если индикатор — анилин, эта реакция имеет вид
C
e
H
s
NH
2
+ H
+
+=± C
6
H
5
NH
3
*
Константа
равновесия
реакции
(а)
[BHi
Y
BH+
К
а,
ннд
(79)
где у — коэффициент активности.
Величину
[ВН
+
]/[В] можно определить спектрофотометриче-
ски.
Если
раствор разбавлен, то у „
+
= Y
=^
Y,.+
==
1» и, следова-
тельно,
легко определить К
а
,
ИН
д*
Выражение
(79) можно переписать в виде
[ВН*]
Ун
— -"В-та -Ъ^^~ (80)
где и + — [Н*] у
н+
— активность иона
водорода.
402
V
Значение
левой части выражения (80) определяют
эксперимен-
тально
с помощью подходящего индикатора. Величину
YB
— lga
V
BH
+
(81)
jf Гаммет назвал кислотной функцией. Эта
функция
удобна для опи-
сания
скоростей
реакций
кислотного катализа при условии, что
механизм
каталитической
реакции
включает стадию типа (а). На-
пример,
если механизм
реакции
может быть
описан
равнениями
+
Н
(ХН
+
)
+
(б)
(в)
причем
стадия (б) протекает быстро, а стадия (в) медленно, ско-
рость
реакции
будет определяться скоростью распада
активиро-
ванного
комплекса
(ХН+)*
по
реакции
(в):
ш=»А
+
[ХН
+
]
ф
(82)
Можно
считать (см. гл. IV, § 2), что
активированный
комплекс
находится
в равновесии с веществом ХН
+
, поэтому
К* (83)
Подставляя в (82) выражение для [XH+J+, найденное из урав-
нения
(83), получим
[XH+j
хн
* (84)
Y
Для реакции (б) константа равновесия
Л
а, инд
[XH1Y
XH+
(85)
Подставляя
в (84) выражение для [XH
+
JY
VU+
.
найденное
из
хн
(85),
получим
Г Обозначим
•vw
Yx
а,
ннд'
(86)
(87)
Считая,
что
отношение
¥„/У„
ы
* —
V
v
/V
VU
f
(экспериментально
В* ВН X' ХН
это приближенно оправдывается), логарифмируя (87) и учитывая
| (81), получаем
ннл-Яо (88)
403

Таким
образом, находим,
что
между
Ig
А
и Я
о
существует
кор-
реляция.
Опыт показывает,
что эта
зависимость линейная. Тангенс
угла
ваклона прямой, получающейся
в
координатах
Ig k —
f(H
0
),
равен '—1.
Для разбавленных водных растворов шкала кислотности,
вы-
раженная
при
помощи #о, совпадает
с
рН.
Это
видно
из
следую-
щих преобразовании. Правую часть выражения
(80) с
учетом
(79)
it
К
6\у
можно записать
в
виде
.
[Н
+
][В]
У
н
+У
в
, , [В1
—
Ig
\-
ig
WlQ~*M0J!b/0r
-HUH)
[вн1
или
DH
+
(89)
разбавленных
растворах
(Y
H
+
Y
B)/
V
BH
+==::
К
и
»
следовательно:
Я
9
=—
1g[H
+
]
=
pH
(90)
Обозначим
—
А.
(91)
г
вн<
Тогда,
как
видно
из
выражения
(89), для
любых
растворов
#„
= — Ig
Ао
(92)
Поскольку
для
разбавленных растворов справедливо выраже-
ние
(90), функция
Ао
=
[Н
+
]
(93)
Справедливость соотношения
(88)
можно видеть
на
примере
реакции
инверсии сахарозы
(рис. 84). На
одну
и ту же
прямую
легли результаты четырех независимых работ
по
исследованию
инверсии
сахарозы, катализируемой
пятью кислотами
НСЮ
4
,
H
2
SO
4
,
НС1,
HNO
3
,
ССЬСООН, концентра-
ции
которых изменялись
в
широких
пределах, причем некоторые
рас-
творы содержали
еще
нейтральные
соли [НСЮ
4
0,5-4 М;
H
2
SO
4
0,25—
3,77
М; HCI
0,5—4
М;
HNO
3
0,5-
6,95 М; ССЬСООН
0,5—4
М
(по дан-
ным
Ганна
и
Вейсбергера);
НС1
0,28-3,08
М;
HNO
3
0,19-3,18
М
(по
данным Армстронга
и
Вилера,
Рис.
84.
Зависимость логарифма константы
скорости гидролиза сахарозы
от
функции
кислотности
Нц
концентрированных раство-
ров кислот.
404
р|*ис.
85.
Зависимость скорости иодирования
'ацетона
в
присутствии уксусной кислоты
от
концентрации
ацетата натрия
(по
данным
Даусона
и
Картера).
а также Уорлей);
0,1 и.
HCI
+
KCI
0,3
М; 0,1 н.
НС1
+
КС1
0—1,3 М (по
данным
Каутца
и
Робинсона)].
На
этом рисунке крестиками отме-
чены данные
по
катализу инверсии
са-
харозы трихлоруксусной кислотой.
Видно,
что эти
данные ложатся
на
прямую. Гаммет предположил,
что в
[СНвСоеЖа],н.
этом
случае
наряду
с
ионами Н
3
О
+
катализируют
и
молекулы
кис-
лоты. Рассматривая равновесие
можно аналогичным способом ввести
еще
одну кислотную
функцию
Л
04)
Функцию
Нц
можно связать
с
константой скорости кислотного
катализа. Однако число реакций,
для
которых выполняется
кор-
реляция
Ig
А
и
#R пока очень невелико.
Солевые
эффекты
Согласно классической теории электролитической диссоциации,
если катализатором является слабая кислота, диссоциирующая
по
уравнению
прибавление соли, содержащей одноименный
с
кислотой анион
А~,
должно смещать равновесие
д,
[HA
J
в
сторону образования недиссоциированной кислоты
и,
следо-
вательно, подавлять каталитическое действие. Однако Аррениус
(1893)
показал,
что это
замещающее действие заметно меньше
того, которое должно было
бы
ожидаться
по
закону действия масс.
Последующими работами было установлено,
что
прибавление соли
с одноименным
с
кислотой анионом способно
при
некоторых усло-
виях
даже
ускорять каталитический процесс
(вторичный
солевой
эффект).
На рис. 85
приведены данные Даусона
и
Картера
по
иодированию ацетона
в
присутствии уксусной кислоты.
По оси
абсцисс отложены количества добавляемого ацетата натрия.
Вна-
чале действительно наблюдается снижение скорости реакции,
за-
тем после характерного минимума скорость линейно растет
с
увеличением концентрации добавляемой соли.
405

Аррениус также нашел, что прибавление к реагирующей сис-
теме нейтральной соли с чуждыми ионами способно резко уско-
рять каталитический процесс
(первичный
солевой
эффект).
Ниже приведены данные о влиянии добавок хлорида и нитрата
натрия на реакцию иодирования ацетона, катализируемую соля-
ной
кислотой (первичный и вторичный солевые эффекты):
Нормальность
добав-
ленной
соли 0,0 0,1 0,5 1,0 2,0 4,0
ft*lO
4
при
добавлении
fJaCl 4,65 4,78 5,30 5,95 7,26 11,10
NaNO
3
4,65 4,74 6,11 5,57 6,48 8,30
Из
этих данных видно,
что при
концентрации NaCl
1,0 н. ско-
рость возрастает
в 1,3
раза,
а при
концентрации
4,0 н. — в 2,4
раза.
Константа ионизации
К
а
кислоты
в
водном растворе
выраженная через коэффициенты активности, равна
«AH
Из
выражения (95) получаем
(НзО
+
]
YAH
YAH
(96)
Логарифмируя выражение (96), подставляя значения логариф-
мов коэффициентов активностей согласно формуле (19) гл. VI,
§
4 и пренебрегая как малым слагаемым (6 — р„
п4
— В Лщ
\
АН Н3О A /
получим
"•*.-
Так
как
Z
HO
+
= 1, Z
AH
всегда
на единицу больше заряда
-{- 1 выра-
сопряженного кислоте основания
А"
,
т. е. Z
HA
=
жение (97) приобретает вид
In
К
с
— In K
a
- 2Л2
А
+
(98)
В большинстве случаев заряд сопряженного основания отри-
цателен, поэтому Кс растет с увеличением ионной силы раство-
ра ц, а следовательно, растет и концентрация
[Н
3
О
+
].
Поскольку
в выражение константы скорости кислотного или кислотно-основ-
ного катализа
входит
концентрация иона гндроксония, с увели-
чением ионной силы раствора
будет
расти константа скорости
каталитической реакции.
Как
известно, ионная сила ц раствора электролита равна по-
лусумме
произведений моляльности каждого из присутствующих
406
щ растворе ионов
на
квадрат
его
заряда. Прибавление нейтраль-
ных солей
к
кислоте увеличивает ионную силу раствора
и по-
этому увеличивает концентрацию ионов гидроксония.
Так
объяс-
няется
первичный солевой эффект.
В редких
случаях
сопряженное основание может иметь
и
поло-
жительный заряд.
Из
формулы
(98)
видно,
что
вторичный солевой
эффект
при
этом оказывает противоположное действие. Константа
скорости реакции кислотного катализа
будет
уменьшаться
от при-
бавления нейтральной соли.
Разложение диазоуксусного эфира CHN
2
COOC
2
H
5
в
присут-
ствии гидратированных ионов трехвалентного хрома, обладающих
кислотными свойствами
и
реагирующих
с
водой
по
реакции
з+
[Сг<Н
г
О)
6
Г
+ Н
2
О
2+
1Сг<Н
2
О)
5
ОН1*
+
+
Н
3
О
+
замедляется
при
добавлении
к
раствору
КС!, т. е.
согласно
(98)
константа ионизации
будет
уменьшаться.
В
случае
более концентрированных растворов
или
растворов
многовалентных ионов пренебрегать слагаемым
р,ц, уже
нельзя,
поэтому получаются более сложные зависимости
К
с
от ц.
Введение одноименного иона
в
разбавленные растворы слабых
кислот также приводит
к
увеличению ионной силы раствора
и,
следовательно,
к
росту константы скорости кислотного катализа.
Этим объясняется вторичный солевой эффект.
Таким
образом,
как
первичный,
так и
вторичный солевые
эф-
фекты
в
кислотном катализе объясняются изменением ионной
си-
лы раствора, которая приводит
к
изменению концентрации
гид-
роксониевых ионов.
§
6. Электрофильный и нуклеофильный катализы
Соединения,
способные присоединяться к свободной электронной
паре — электронные акцепторы или кислоты Льюиса, играют роль
катализаторов в тех
случаях,
когда возникающий комплекс обла-
дает
повышенной реакционной способностью. Опыт показывает,
что апротонные кислоты катализируют те же реакции, что и про-
тонные кислоты, причем активность апротонных кислот иногда
выше, чем протонных. Возникающие комплексы имеют ионный
характер и
даже
иногда диссоциированы с образованием проме-
жуточного активного продукта катионного типа.
Типичными
апротонными кислотами являются галогенидные
соединения алюминия, бора, хлорид цинка, тетрахлорид олова.
Аналогично апротонным кислотам
ведут
себя иногда ионы
металлов (железа, меди,
никеля).
Активный промежуточный про-
дукт
образуется при этом в
результате
двухцептрового взаимо-
действия иона с субстратом и является хелатом. Субстратами мо-
гут быть эфиры и амиды дикарбоновых кислот, аминокислоты, не-
которые кетокислоты. Процесс во второй стадии, как и во всяком
кислотном катализе, протекает с участием основания.
407
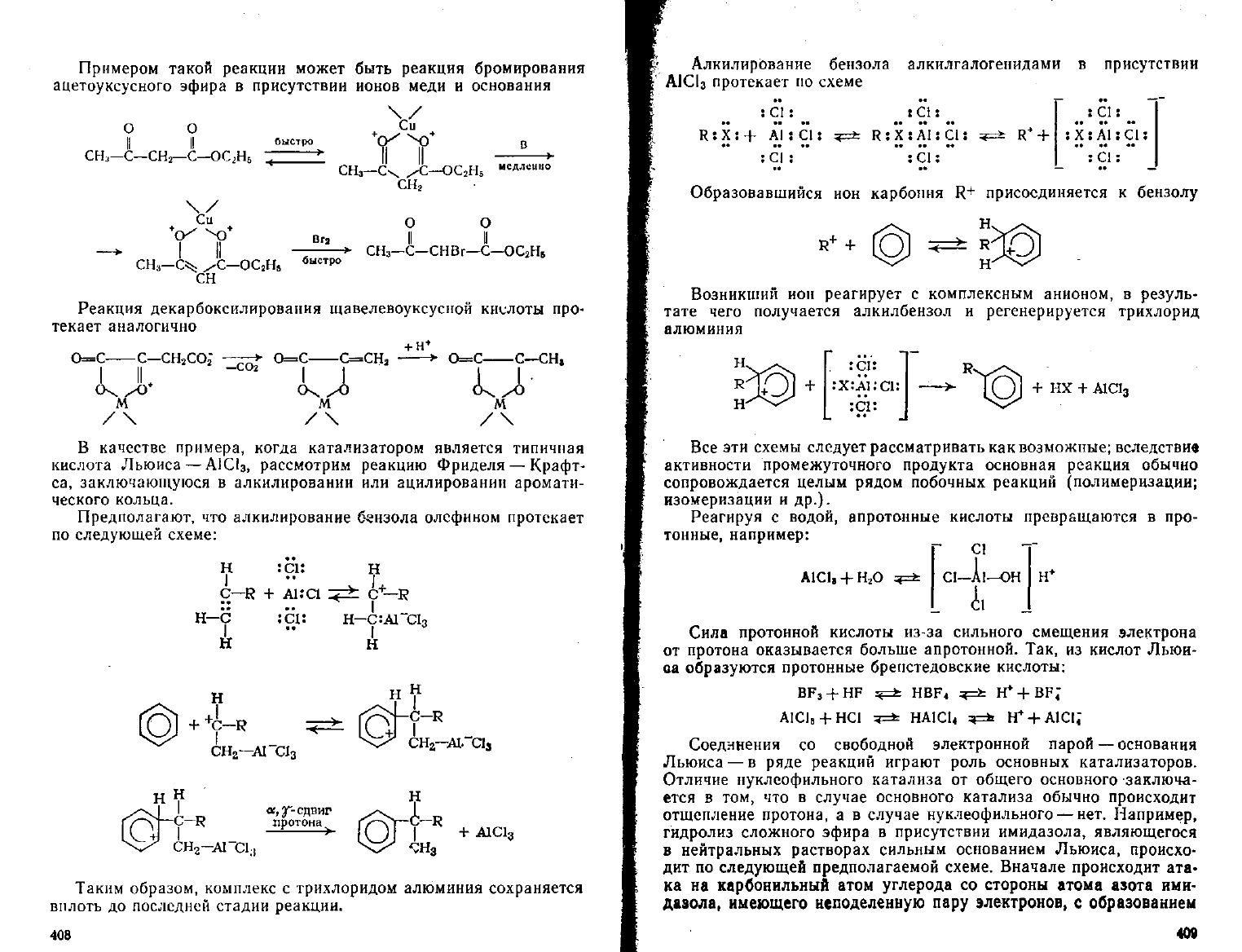
Примером
такой реакции может быть реакция бромирования
ацетоуксусного эфира
в
присутствии ионов меди
и
основания
о о
I!
I!
СН
а
—С—
СН
2
—С—ОС
2
Н
5
Си
быстро
V
СН
3
—С-ч
/С—ОС
2
Н
5
СН
Я
О О
В
г
а
СНз—С^
/С—OC
2
H
S
быстро
СН
*•
СНз—С—СНВг—С—ОС
2
Н
В
Реакция
декарбоксилирования щавелевоуксусной кислоты про-
текает аналогично
;
>
—СО2
Оч/О*
М
X
м
О=С
С—СН,
А
I
•
м
/\
В качестве примера, когда катализатором является типичная
кислота Льюиса
—
А1С!
3)
рассмотрим реакцию Фриделя
—
Крафт-
са, заключающуюся
в
алкилировании
или
ацилировании аромати-
ческого кольца.
Предполагают,
что
алкилирование бензола олсфином протекает
по
следующей схеме:
н
:ск
с—R
+
AIICL
:
н—с
:
ci:
н—с:
AI "CI
3
н
н
C+
Таким
образом, комплекс
с
трихлоридом алюминия сохраняется
вплоть
до
последней стадии реакции.
408
Алкилирование бензола алкилгалогенидами
в
присутствии
А1С1
3
протекает по
схеме
R:
X: +
А1: С1:
:
CI
: "
:
С1:
м
R:X:AI:C1:
"
:
С1:
"
R
+
-f
:
CI:
^
г
X:
А1: С1:
"
:
С1:
"
Образовавшийся
ион
карбония
R+
присоединяется
к
бензолу
Возникший
ион
реагирует
с
комплексным анионом,
в
резуль-
тате
чего получается алкилбензол
и
регенерируется трихлорид
алюминия
ГСП
:X:AI:CI:
:ci:
Q]
+
HX + A1CI
3
Все эти схемы
следует
рассматривать как возможные; вследствие
активности промежуточного продукта основная реакция обычно
сопровождается целым рядом побочных реакций (полимеризации;
изомеризации
и
др.).
Реагируя
с
водой, апротонные кислоты превращаются
в
про-
тонные,
например:
С!
А1С1,
+
Н
а
О
^=±
CI—A1—ОН
Сила
протонной кислоты из-за сильного смещения электрона
от протона оказывается больше апротонной.
Так,
из
кислот Льюи-
оа образуются протонные брепстедовские кислоты:
BF
3
+
HF
^=fc
HBF
4
4=*:
H*+BF;
A1CI
B
+
HC1
4=*=
HAICU
4=*=
H
+
+
AlCi;
Соединения
со
свободной электронной парой
—
основания
Льюиса
— в
ряде реакций играют роль основных катализаторов.
Отличие нуклеофильного катализа
от
общего основного заключа-
ется
в
том,
что в
случае
основного катализа обычно происходит
отщепление протона,
а в
случае
нуклеофильного
—
нет.
Например,
гидролиз сложного эфира
в
присутствии имидазола, являющегося
в
нейтральных растворах сильным основанием Льюиса, происхо-
дит
по
следующей предполагаемой схеме. Вначале происходит
ата-
ка
на
карбонильный атом
углерода
со
стороны атома азота
ими-
дазола, имеющего неподеленную пару электронов,
с
образованием
409

цвиттер-иона,
который, распадаясь, образует устойчивый
конеч-
ный
продукт — спирт и промежуточное вещество. Последнее в ре-
зультате взаимодействия с водой переходит в состояние неустой-
чивого цвиттвр-иона, распад которого приводит к образованию
кислоты
и регенерации имидазола. Указанные реакции могут быть
записаны
в виде
Т
^Ч
NH
+
ROH
OR
•О—
i—N
H
3
C
I W
H
a°
OH
o—C-N^
^
H
3
C
OR
о=с
+
н«с
6=C—
H
8
C
§
7. Катализ комплексными соединениями
переходных металлов
Комплексные соединения переходных металлов в последнее время
находят все большее практическое применение. Механизм их ка-
талитического действия представляет интерес для понимания не
только гомогенного, но, как
будет
показано ниже, и гетерогенного
катализа. Большое значение комплексы переходных металлов иг-
рают в биологических системах. Ограничимся рассмотрением лишь
небольшого числа гомогенных каталитических реакций, в которых
комплексные соединения металлов являются катализаторами или
образуются как промежуточные продукты в
ходе
химического пре-
вращения.
Как
известно, к переходным металлам относятся элементы
дополнительных подгрупп периодической системы. Эти элементы
обладают свойствами, характерными для металлов. Они занимают
средние части длинных периодов периодической системы от Se
до Ni, от Y до Pd, от La до Pt. К ним же относятся все актиноиды.
В свободных атомах этих элементов происходит заполнение
(п—1)4-уровней (где л —номер периода). Для этих элементов
характерна незавершенность d-оболочки и наличие нескольких
валентных состояний.
Все переходные элементы образуют устойчивые комплексные
соединения, являясь комплексообразователями. Лиганд выступает
в роли донора электронов, а комплексообразователь — в роли их
акцептора. Акцепторные свойства особенно сильно выражены у
Ad- и б^-элементов.
Если 34-элементы образуют в водных растворах простые гн-
дратированныв ионы, то Ad- и 54-элементы —комплексы своих
410
формально простых солей. Как мы увидим ниже, эти элементы
склонны
образовывать и мало устойчивые комплексные соедине-
ния
за счет взаимодействия rf-электронов с я-электронами органи-
ческих молекул. Эти неустойчивые реакционноспособные комплек-
сы играют большую роль в катализе.
Интересными катализаторами гомогенных реакций в растворах
являются карбонилы металлов. Они представляют собой комплекс-
ные соединения, образованные из электронодонорных групп СО
и
переходных металлов.
Атомы
металлов — комплексообразовате-
лей способны присоединить такое число электронов, какое недо-
стает до построения атома инертного газа, находящегося в конце
периода, в котором стоит данный металл. Примером технически
важной реакции, катализируемой карбонилами металлов, служит
оксосинтез, или процесс гидроформилирования, — метод получе-
ния
альдегидов из олефинов при взаимодействии жидкого суб-
страта, соли кобальта, СО и водорода
[90—200°С,
(1 ~А) -10
7
Па].
При
этом протекают несколько реакций:
б) гидрирование
\ / I
в) образование гомологов —СНдОН + СО -f 2Н
г
-*• —
СН
г
СН
а
ОН
+ Н
а
О
Г)
гидрогенолиз RCH
2
OH -f Н
г
-»-
RCH
3
+ HjO
В
ходе
реакции из соли кобальта и СО образуются дикобальт-^
октакарбонил [Со (СО)
4
]
2
и карбонилгидрид кобальта
НСо(СО)
4
.
Карбонилгидрид кобальта с олефином при комнатной температуре
и
атмосферном давлении
дает
те же продукты, которые образу-
ются при оксосинтезе. В водном растворе
НСо(СО)
4
полностью
ионизирован
и в насыщенном растворе
(0,056
моль/л) является
сильной кислотой.
Если сравнивать кислотные свойства гидрокарбонилов метал-,
лов, то оказывается, что гидрокарбонил железа близок по силе.
к
уксусной кислоте, гидрокарбонил никеля не обладает кислыми
свойствами, а гидрокарбонил кобальта, как уже указано, является
сильной кислотой. В реакции оксосинтеза гидрокарбоиил кобальта
в 10
6
раз активнее гидрокарбоинла железа, а гидрокарбоннл ни-
келя совсем неактивен. Олсфины, благодаря наличию я-электро-
нов,
являются электронодонорными веществами, или основаниями
Льюиса.
Реакция
гидроформилирования протекает как реакция первого
порядка по олефииу и почти первого порядка по кобальту. Ско-
рость реакции растет с повышением давления водорода и снижа-
ется с ростом давления СО независимо от природы растворителя.
Кроме того, она для а-олефинов выше, чем для олефинов с внут-
ренней двойной связью, так как в последнем
случае
возникают,
стерические затруднения. Карбонилы металлов способствуют изо-
меризации а-олефинов в олефины с внутренней двойной связью.
41)

Предполагают, что после того, как в
ходе
реакции образуется
НСо(СО)4,
устанавливаются вледующие равновесия:
НСо(СО),
+RCH=CHR
НСо(СО)
э
< '
R
\/
H
—RCH=CHR
С
СоН(СО)
а
И
RH
2
C-CH<R)-Co(CO)
4
RH
2
C—CH(R)—Со(СО)з
Диссоциация НСо(СО)
4
на СО и НСо(СО)
3
подавляется окси-
дом
углерода;
этим объясняется торможение реакции при высоких
давлениях СО. С
учетом
указанных равновесий уравнение реак-
ции
гидроформилирования этилена формально может быть запи-
сано следующим образом:
НСо(СО)
4
+
С
2
Н
5
СоСО(СО)
3
С
2
Н
6
Со(СО)4
Н
а
или
НСо(СО)4
C
2
H
S
CHO
гидрирование
[Со(СО)
4
]
2
Необходимо отметить, что механизм реакции гидроформилиро-
вания
очень сложен и не все детали его еще установлены. С выс-
шими
олефинами образуются два изомерных альдегида, за счет
реакции гидрирования альдегидов получают спирты,
идут
про-
цессы кротонизации, образования ацеталей и сложных эфиров,
простых эфиров, эфироальдегидов и эфироспиртов.
Образование я-комплексов карбонилов металлов с олефина-
ми—
дикобальтоктакарбонила и пентакарбонила Fe является пер-
вой стадией реакции изомеризации олефинов. Наибольшей актив-
ностью в процессе изомеризации олефинов обладают карбонилы
железа, кобальта, менее активны карбонилы осмия и малоактивны
или совсем не обладают изомеризующим действием карбонилы
марганца, вольфрама, хрома, молибдена.
Другой интересной и практически важной реакцией, в которой
также существенную роль играют л-комплексы, является реакция
окисления
этилена до ацетальдегида в водном растворе палладия,
так называемый вакер-процесс:
Рс1С1Г
+
С
г
Н
4
+ Н
г
О
СНэСНО
+ Pd + 4СГ + 2Н*
Металлический палладий легко окисляется до Pd
11
двухвалент-
ной
медью, а возникающая одновалентная медь легко окисляется
воздухом
до двухвалентного состояния:
Таким образом, в
ходе
реакции расходуются только этилен и
кислород. .--••--.
4U
Предполагают, что процесс протекает через образование комп-
лекса с олефинами
[C
2
H«PdCl
3
]"
<C
2
H
4
PdCl
2
-HjO)
(C
2
H
4
PdCl
2
0H)'
(а)
(б)
(в)
Затем происходит внутренняя перегруппировка этого комплекса
(медленная стадия):
к
(C
2
H
4
PdCl
a
0H)"
—+
ClPdCHjCHjOH+CP
ClPdCH
2
CH
a
OH
—* ' НС1 + Pd +
СНзСНО
(г)
Для такой схемы легко получить уравнение скорости реакции,
находящейся в хорошем согласии с опытом:
w
[C
2
H
4
j jPdCU]
[СГ]
а
[НзО1
(99)
где Ки Кя, Кл — константы равновесий реакции (а), (б) и (в) соответственно.
Как
видно из схемы реакции, связи С=О возникают путем
перегруппировки в комплексе, содержащем ОН и С
2
Н
4
в качестве
лигандов [реакция (г)].
Хлорид палладия катализирует окисление пропилена до аце-
тона, окисление цис- и гранс-бутенов до метилэтилкетона, реакцию
винилироваиия при взаимодействии этилена и уксусной кислоты
в присутствии PdCl
2
и
Na
2
HPO
4
.
Комплексные соединения некото-
рых переходных металлов катализируют также реакции связы-
вания
азота.
В гомогенной среде в присутствии комплексного соединения
родия (PPh
3
)
3
RhCI, находящегося в форме сольватированных мо-
лекул, образуются в присутствии водорода и олефина дигидрид-
ный
комплекс и п-комплекс с олефинами. Эти комплексы способ-
ствуют
процессу присоединения водорода по месту двойной связи.
Комплекс родия в бензоле, вследствие диссоциации с отщеплением
одного фосфинового лиганда, представляет собой либо
(PPh
3
)
2
RhCl,
либо сольватированные молекулы (PPh
3
)
2
RhCl-
•(Растворитель)*. Кинетические исследования показывают, что в
условиях реакции устанавливаются равновесия
н
2
<PPh
3
)
2
RhCl
•
(Растворитель)*
*==*
(PPh
a
)
2
Rh(Hj)Cl
Олефин I
;i —• (PPh
3
)jRhCI+Парафин
I
Олефии
Характерной реакцией ацетиленов является гидратация, кото-
рая катализируется солями Hg" в кислых растворах (реакция
Кучерова):
Hg"
Н—СшО-Н
+ Н
а
О *-
СН,СНО
ИЗ

Подобно
олефинам ацетилены образуют я-комплексы со многими
ионами
переходных металлов, такими, как Ag
1
, Hg
11
Возникающий
л-комплекс является активным промежуточным
продуктом реакции. Медленной стадией реакции является внедре-
ние
воды в комплексный ацетилен.
Важным примером гомогенных каталитических реакций, в ко-
торых катализаторами являются комплексные соединения переход-
ных металлов и в
ходе
которых образуются я-комплексы с олефи-
нами,
являются реакции полимеризации олефинов. Катализаторы
для полимеризации были предложены Циглером и Натта. Их
получают из металлорганических соединений элементов II и
III
групп (чаще всего используют триалкилалюминий), гидридов
щелочных металлов или смешанных алкилгидридов металлов и
соединений
переходного металла (например, галогенидов титана).
Большинство
катализаторов Циглера — Натта — гетерогенные, од-
нако
известен и ряд гомогенных. Растворимые катализаторы Ци-
глера— Натта получают из А1Рп
3
и VCU или
А1Вг
3
в циклогек-
сане.
Эти катализаторы эффективны при полимеризации этилена,
но
непригодны при стереоспецифической полимеризации а-оле-
финов.
Для описания связи в комплексах переходных металлов, что
существенно для понимания свойств соединений и количествен-
ного описания химических процессов катализа, в настоящее время
пытаются применить теорию поля лигандов. Такое название по-
лучил метод молекулярных орбиталей (МО) в применении к спе-
цифическим
свойствам комплексов переходных металлов. Обычно
применяют полуэмпирический метод МО с использованием линей-
ной
комбинации атомных орбнталей (метод МО ЛКАО). Необхо-
димо заметить, что квантовохимические расчеты из-за их прибли-
женности и ряда допущений хороши только в том случае, если
они
сочетаются с экспериментальными методами исследования
строения
молекул и кинетики химических превращений.
Как
видно из изложенного, в гомогенных системах возможны
каталитические реакции гидрирования, изомеризации и полимери-
зации
олефинов. Такие реакции характерны, как
будет
показано
ниже,
и для гетерогенных каталитических реакций. Поэтому мож-
но
предполагать, что механизм гетерогенных каталитических реак-
ций
в общем аналогичен механизму гомогенных каталитических
реакций.
Во многих случаях активные участки гетерогенных ката-
лизаторов в присутствии реагирующих веществ
ведут
себя ана-
логично комплексам, возникающим в гомогенных системах. Тео-
рию поля лигандов, по-видимому, можно применить и для объяс-
нения
комплексов, возникающих на поверхности твердых катали-
заторов в гетерогенных каталитических реакциях.
Гомогенные системы представляют большой интерес для рас-
крытия
детального механизма каталитических реакций.
Удобства
гетерогенных каталитических реакций, обусловленные легкостью
отделения катализатора от реагирующих и получающихся ве-
ществ, заменяются в гомогенном катализе высокой селективностью
414
протекающих процессов. Поэтому перспективными являются ка-
тализаторы гомогенных систем, закрепленные на твердых
телах.
ГЕТЕРОГЕННЫЕ
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
§
8. Основные характерные черты гетерогенных
каталитических процессов
Для объяснения действия гетерогенного катализатора Д. И. Мен-
делеев предложил теорию промежуточных соединений. В 1886 г.
в
статье «Заметки о влиянии прикосновения на ход химических
превращений» он высказал ряд интересных мыслей о природе гете-
рогенного катализа. Он указал, что свойства молекул на поверх-
ности
раздела фаз в энергетическом отношении отличаются от
свойств молекул в объеме; процесс удерживания молекул на по-
верхности связан с выделением тепла, которое может идти на ак-
тивирование молекул; молекулы на поверхности переходят в более
реакционноспособное
состояние, поэтому для химических процес-
сов большое значение имеет контакт молекул на границе раздела
фаз;
реакции на границе раздела фаз
идут
с большими скоро-
стями
при невысоких температурах.
Идея
образования промежуточных соединений развивалась да-
лее Сабатье и рядом
других
исследователей, особенно школой
Н.
Д. Зелинского.
Согласно этой идее, катализатор образует с одним из реаген-
тов промежуточное соединение, активируя данный реагент и об-
легчая реакцию. Типичными промежуточными соединениями явля-
ются сорбционные соединения
Pt
О
Pt—H,
Ni—H,
Pd—H и т. д.
Отсюда
следует
и один из основных принципов гетерогенного
катализа: катализатор обладает физическим или химическим
сродством к одному или нескольким реагентам. Например, гидро-
генизационные
и дегидрогенизационные катализаторы Pt, Pd, Ni,
Си
и др. легко сорбируют водород, образуя с ним промежуточные
соединения
(палладий
даже
способен растворять газообразный
водород).
Гидратирующие и дегидратирующие катализаторы, например
А1
2
О
3
или
Al
2
(S0
4
b,
обладают способностью образовывать гидрат-
ного типа соединения с водой; их действие в реакции дегидрата-
ции
спиртов, таким образом, подобно действию серной кислоты.
Аналогичные явления имеют место и на окислительных ката-
лизаторах: платина и палладий легко образуют с кислородом
сорбционные
поверхностные соединения; оксид меди (СиО) легко
восстанавливается до металлической меди и снова окисляется до
415
CuO.
Ванадий образует ряд оксидов разных степеней окисления,
легко переходящих
друг
в
друга.
Тетраоксид осьмия, уже при
комнатной
температуре окисляющий мышьяк
_5_
„ ОзО
4
легко восстанавливается до OsO
z
и снова окисляется кислородом
до OsO
4
.
Таким
образом, важно не только одно сродство катализатора
к
реагирующему веществу, но и лабильность, неустойчивость по-
лучающегося промежуточного соединения, легко вновь распада-
ющегося при взаимодействии со вторым реагирующим компонен-
том на продукты реакции и вновь готовый к действию катализатор.
Интересным
примером подобной регенерации катализатора явля-
ется получение водяного газа на Fe
3
O4, которое может быть изо-
бражено следующим стехиометрическим уравнением:
Fe
8
O
4
СО + Н
2
О •
СО
г
+ Н
2
Первой
стадией этого процесса является восстановление
Fe
3
O
4
оксидом
углерода:
4СО + Fe
3
O«
Затем железо, взаимодействуя с водой,
дает
водород н регенери-
руется в
Fe
3
O
4
:
4H
2
O+3Fe
—• Fe
3
O
4
+ 4H
2
Оба эти процесса и
дают
в сумме приведенное выше стехиомет-
рическое уравнение.
Практически
важным свойством гетерогенного катализатора,
как
и всякого катализатора, является специфичность его действия.
Различные катализаторы
могут
направлять процесс по совершен-
но
разным путям. Так, из этанола
могут
быть получены семь раз-
личных продуктов в зависимости от выбора катализатора или
условий его применения:
СН
г
=СНСН=СН
а
+ Н
2
+ 2Н
а
О
fzno,
I
сг
2
о
8
A!
S
O
3
Л1
2
О
3
Си
С
2
Н<
+ Н
2
О -*
(С
2
Н
5
ЬО
+ Н
2
О -«
С
2
Н
Б
ОН
»
СН
3
СНО
+ Н
2
I
Н
а
О
активированная Си Na
г
|
СН
3
СООС
2
Н
5
+ 2Н
г
С«Н
В
О
I
активированная Си
Y
СНзСОСНз
+ ЗН
2
+ СО
Специфичность
действия катализатора, позволяющая вести
процесс в желательном направлении,
является
одним из основных
свойств
используемых
при
практическом
применении
катализатора
416
в
промышленности. Избирательное каталитическое действие по
теории промежуточных продуктов связано с образованием проме-
жуточных соединений разной химической природы на разных ка-
тализаторах.
Уже давно установлено, что присутствие в реагирующей смеси
некоторых веществ, часто в совершенно ничтожном количестве,
способно понижать или полностью подавлять активность катализа-
тора. Такие вещества получили название каталитических
ядов,
а само явление назвали
отравлением
катализаторов.
Типичными
каталитическими ядами являются соединения серы (H
2
S, CS
2
,
тиофеи,
меркаптаны и др.), синильная кислота, оксид
углерода,
свободные галогены (I
2
, C1», Вг
2
),
ртуть
и соли
ртути
[HgCh,
Hg(CN)
2
],
соединения фосфора, мышьяка, свинца и др. Отравле-
ние
катализатора происходит вследствие сорбции яда на поверх-
ности
катализатора, в
результате
чего затрудняется доступ к ней
реагирующих веществ. Поскольку сорбция может быть обратимой
и
необратимой, различают
обратимое
и
необратимое
отравление.
Например,
платиновый катализатор отравляется в присутствии
СО
и CS
2
, однако при внесении его в чистую исходную смесь га-
зов активность катализатора быстро восстанавливается. При от-
равления
же H
2
S и РН
3
платина необратимо и полностью дезак-
тивируется.
Иногда
действие яда
удается
использовать для направления
процесса в желательном направлении (благоприятствующее отрав-
ление).
Так, гидрирование бензоилхлорида в бензольном растворе
над платипой приводит через ряд последовательных стадий к об-
разованию толуола
+
На + Н
а
+ Hj
С
6
Н
6
СОС1
*•
C
fl
H
s
CHO
ь
С
6
Н
5
СН
2
ОН
»-
С
в
Н
5
СНз
Между тем отравление платины небольшим количеством со-
единений
серы (например, путем подмешивания их к исходной
смеси или употребления в качестве растворителя неочищенного
бензола) позволяет с хорошими выходами остановить реакцию на
стадии получения ценного продукта — бензальдегида.
Прибавление
к катализатору вещества, которое само по себе
является каталитически недеятельным, вызывает иногда весьма
значительное повышение эффективности процесса. Такие вещества
получили название
промоторов.
Как правило, эффективность дей-
ствия промотора зависит от его количества: наблюдаются макси-
мумы активности при определенном составе смешанного катализа-
тора. На рис. 86 показан интересный случай промотирования мед-
ного катализатора, используемого при разложении метанола раз-
личными
промоторами: Mn, Zn, AI, Се, Be, Zr. Церий, марганец
и
цирконий
дают
отчетливый максимум промотирующего эффекта,
алюминий
дает
сложную экстремальную зависимость, а
цинк
и
бериллий показывают кривую с насыщением.
Явление промотирования находит большое применение на прак-
тике,
позволяя повышать активность, срок действия и избиратель-
ность катализатора,
14
Зак
417
