Молявко М.А.,Чалова О.Б. Коррозия металлов
Подождите немного. Документ загружается.


81
сколько понизится, затем останется без изменения. Убедившись в герметич-
ности прибора, вернуть бюретку 2 в прежнее положение, чтобы вода в обеих
бюретках была на одном уровне.
Рис. 34. Диаграмма Пурбэ (Е-рН) для системы Al - H
2
O
г) В колбу 5 при помощи длинной воронки налить 25-40 мл водного
раствора электролита так, чтобы не смочить стенки горла колбы и закрепить
колбу в горизонтальном положении. Варианты заданий (состав электролита)
получить у преподавателя (табл. 18.).
Таблица18
Варианты заданий
Варианты Металл Состав электролита
I Fe 2н HCl
II Zn 2н HCl
III Zn 2н NaOH
IV Al 2н HCl
V Al 2н NaOH
д) Металл поместить в сухое горло колбы. Закрыть колбу резиновой пробкой,
слегка смоченной водой, и снова проверить герметичность прибора, как ука-
зано выше. Закрепить бюретки 1 и 2 так, чтобы положение воды в них было
точно на одном уровне. При этом уровень воды в бюретке 1 должен быть
около нулевого деления. Отметить этот уровень V
1
и записать числовое зна-
чение. Чтобы правильно замерить уровень воды в бюретке, глаз наблюдателя
должен находиться на одном уровне с нижним мениском воды (см. рис. 35);
е) Наклонить колбу 5 так, чтобы металл упал в раствор, и отметить вре-
мя начала взаимодействия металла c раствором (τ
o
). Через каждые 2-5 минут,
в зависимости от природы металла, бюреткой 2 определять смещение уровня
жидкости в бюретке (объем выделяющегося водорода) с точностью до 0,05
см
3
. Опыт продолжать от 30 до 60 минут по указанию преподавателя.
ж) По истечении указанного преподавателем времени дать колбе охла-

82
диться до комнатной температуры.
Рис.35. Установка для изучения скорости коррозии:
1 - бюретка; 2- бюретка;
3,4 - резиновые трубки; 5 - колба Вюрца
з) Затем привести уровень воды в обеих бюретках к одному уровню,
отметить уровень воды (V
2
) в бюретке 1 и записать его значение;
и) затем в сливную банку вылить раствор и достать металл с помощью
пинцета, промыть водой и обработать спиртом или ацетоном, подсушить на
воздухе и взвесить на аналитических весах.
к) Результаты опыта оформить по следующей форме:
1. Корродирующий металл.
2. Площадь поверхности металла (S, см
2
);.
3. масса металла до опыта (m
0
, г).
4. Масса металла после коррозии (m
a
, г).
5. Масса прокорродировавшего металла (∆m=m
0
- m
1
, г).
6. Состав и концентрация раствора электролита (N, моль-экв./л).
7. Температура, К.
8. Время от начала коррозии (τ)
9. Давление атмосферное (Р, мм.рт.ст.)
9. Парциальное давление водорода (Р
H2
= Р – Р
H2O
); Р
H2O
- см.табл.17.
10. Расчет объемного водородного показателя скорости коррозии.
11.Начертить график зависимости скорости коррозии металла (К
обН2
) от
продолжительности опыта (τ). Объяснить полученную зависимость скорости
коррозии от времени.
12. По объему выделившегося водорода ( Vo ) при н.у. вычислить массу
прокорродировавшего металла (∆m
выч
) (см.с.86). по суммарному уравнению
исследуемого процесса коррозии:
2Me + 2nНСl = 2МеСl
n
+ nH
2
или
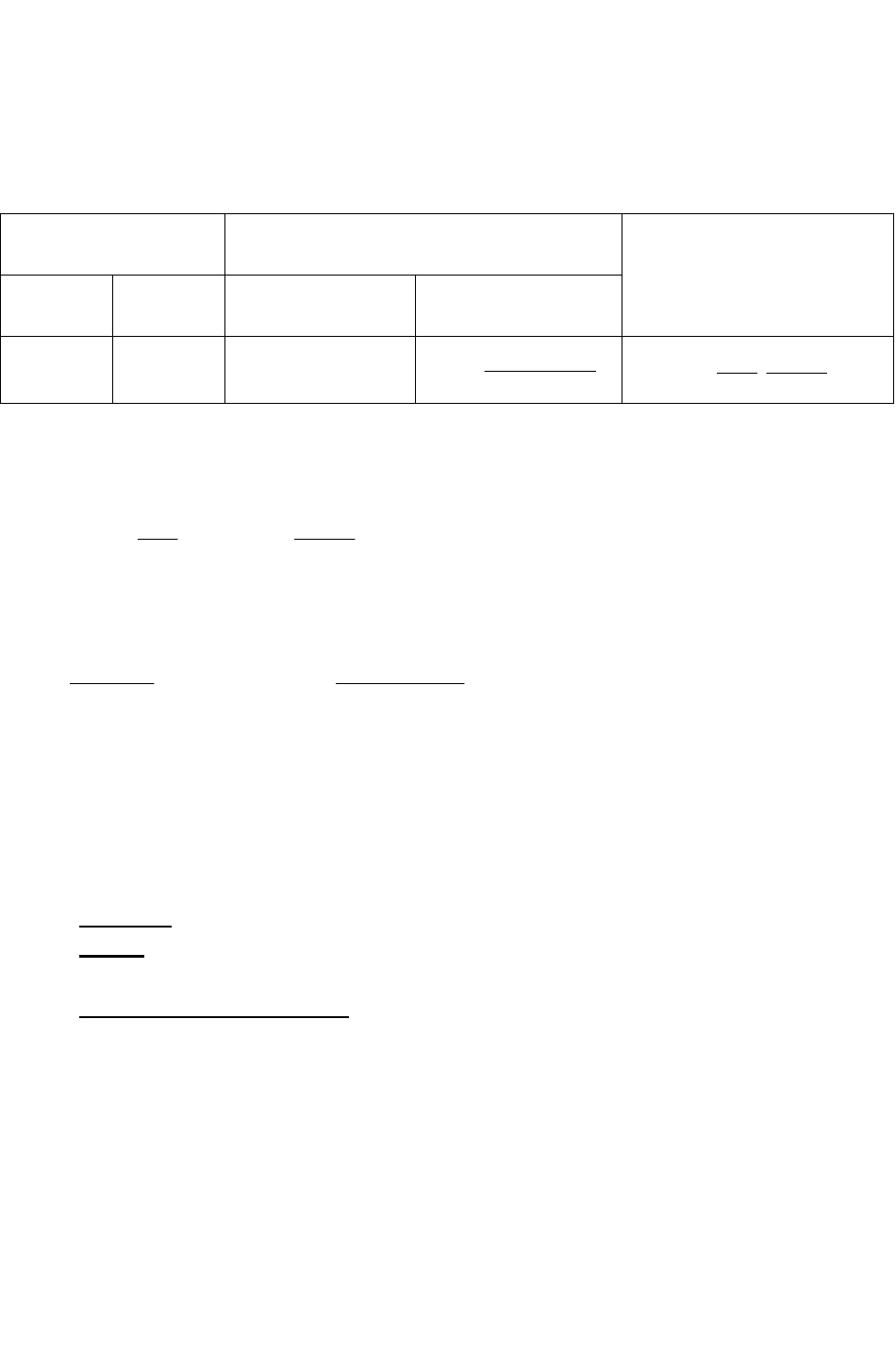
83
Zn + 2NaOH + 2Н
2
О = Na
2
[Zn(OH)
4
)] + Н
2
или
2Al + 2NaOH + 6H
2
O = 2Na[Al(OH)
4
] + 3Н
2
Сравнить изменение массы (∆m
выч
) с определенным опытным путем
изменением массы образца (∆m). Дать объяснение.
Таблица 19
Расчет объемного водородного показателя скорости коррозии.
Время от начала
коррозии, τ
Объем выделившегося водорода,
см
3
мин час в условиях
эксперимента
при н.у.
Объемный водород-
ный показатель ско-
рости коррозии
V=V
2
-V
1
V
0
=
T
PPV
OH
78,2
)(
2
К
об(Н2)
= ]
4
[
2
3
0
см
см
S
V
13. По значениям ∆m и ∆m
выч
, найти массовый показатель скорости
коррозии
К
m
и К
.выч
m
по формулам:
S
m
K
m
и
S
m
K
выч
выч
m
.
.
Сравнить значения: K
m
и K
.
выч
m
14. Рассчитать глубинный показатель скорости коррозии по формулам:
m
Г
K
K
76,8
и
.
.
)(76,8
вычm
выч
Г
K
K
.
Сравнить К
г
и K
гвыч.
. По величине К
г
определить балл коррозионной
стойкости изучаемого металла (табл.16).
15. Составить схему коррозионного гальванического элемента. Напи-
сать уравнения электродных, (катодного и анодного) и суммарное уравнение
коррозионного процесса.
Опыт 5. Коррозия стали в солевом растворе
Цель: Изучить теоретически и экспериментально коррозию металла
под действием кислорода, растворенного в нейтральной водной среде.
Теоретическая часть. По диаграмме Пурбэ (Е-рН) электрохимиче-
ских равновесий в системе Fe -∙Н
2
О при 298К: (рис.33 ) теоретически обосно-
вать термодинамическую вероятность коррозионного взаимодействия железа
с чистой водой при рН=7. Написать уравнения электрохимических процессов
окисления железа и восстановления молекул воды. Написать суммарное
уравнение реакции окисления железа водой в стандартных условиях. Вычис-
лить ∆G
0
химической реакции. О чем свидетельствует значение? По диа-
грамме Е - рН (рис.33) для системы Fe - H
2
O установить термодинамическую
вероятность окисления железа кислородом, растворенным в воде при стан-
дартных условиях при рH=7. Составить схему гальванического элемента.
Написать уравнения электрохимических процессов окисления железа и вос-
становления кислорода в нейтральной среде. Написать суммарную реакцию

84
коррозии с кислородной деполяризацией.
Реактивы и приборы. Скрепки из стали, обезжиренные в спирте или
ацетоне, просушенные фильтровальной бумагой; медная проволока, гранула
цинка, дистиллированная вода, растворы солей Na
2
SO
4
или K
2
SO
4
,
K
3
[Fe(CN)
6
], раствор фенолфталеина, пять пробирок.
Выполнение опыта:
а) пять пробирок пронумеровать карандашом по стеклу;
б) в первую пробирку до половины налить дистиллированную воду, в
остальные - раствор соли (Na
2
SO
4
или K
2
SO
4
);
в) раствор в пробирке 4 прокипятить 2-3 мин для удаления кислорода и
охладить до комнатной температуры;
г) во вторую пробирку добавить 2 -3 капли фенолфталеина, в осталь-
ные - K
3
[Fe(CN)
6
], который является индикатором на ионы Fe
2+
и реагирует с
ними по уравнению:
Fe
2+
+ К
+
+ [Fe(CN
6
)]
3-
КFe[Fe(CN)
6
]
FeSO
4
+ К
3
[Fe(CN)
6
]
КFe[Fe(CN)
6
] + K
2
SO
4
турнбулева синь
По интенсивности синей окраски можно судить о концентрации ионов
Fe
2+
: чем интенсивнее синяя окраска раствора, тем выше концентрация ионов
Fe
2+
и интенсивнее протекает коррозия;
д) четыре скрепки из стали очистить наждачной бумагой, промыть во-
дой, просушить, соединить с медной проволокой и опустить в пробирки (1-
4); пятую скрепку соединить с цинковой гранулой и опустить в 5 пробирку;
е) установить пробирки в штативе и наблюдать за ними в течение 30-40
мин.
Обратить внимание, вблизи какой части металла, погруженного в рас-
твор, появляется заметное окрашивание раствора. Появляется ли окрашива-
ние в 1 и 4 пробирке? Если нет, то почему? По окрашиванию раствора в ма-
линовый и синий цвета установить на корродирующем металле катодные и
анодные участки. Восстановление кислорода происходит - у катодного или
анодного участка? Почему малиновое окрашивание появляется вблизи по-
верхности раствора? В отчете отразить: выводы по теоретической части,
опытные наблюдения.
Опыт 6. Влияние ингибиторов на скорость коррозии
Цель работы. Освоить методику определения эффективности ингиби-
тора коррозии, изучить влияние ингибитора на скорость коррозии металла с
водородной деполяризацией,
Теоретическая часть. Пользуясь диаграммой Пурбэ (Е-рН), для сис-
темы Me - Н
2
O (рис.4, рис.33, рис.34) написать уравнение реакций электрод-
ных процессов окисления металла (Fe,Zn,Al) и восстановления деполяриза-
тора при коррозии металла в 2н растворе электролита, а также схему корро-
зионного гальванического элемента.
Реактивы и приборы: Коррозиометр (рис.35, оп.4), пластинки из ме-
талла (Fe, Zn, Al) размером 1x1,5 см
2
, наждачная бумага, ацетон или спирт,

85
пинцет, весы аналитические, 2н растворы Н
2
SО
4
или NaОН, ингибиторы:
(0,1%-й раствор К
2
Сг
2
O
7
); (0,1%-й раствор Bi(NO
3
)
3
); 0,5%-й раствор уротро-
пина или другие ингибиторы, предложенные преподавателем.
Выполнение опыта. Опыт проводится на установке (см. рис.35) по ме-
тодике опыта 4. Изучить коррозию для одинаковых образцов стали сначала в
растворе электролита в отсутствие ингибитора, затем на той же установке в
присутствии одного из вышеназванных ингибиторов, заданных преподавате-
лем. По результатам эксперимента вычислить величину эффективности ин-
гибитора по формуле
[%],100
.)(
m
инг
mm
k
KK
где К
m
- массовый показатель коррозии в данной в среде в отсутствие
ингибитора;
).(инг
m
K
то же в присутствии ингибитора.
По методике опыта 4 рассчитать объемный водородный показатель
(K
oб(H2)инг.
) для процесса коррозии, протекающего в присутствии ингибитора.
Построить график зависимости (K
oб(H2)инг.
) от времени.
Сравнить с данными опыта 4.
9. КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое коррозия металлов? Причины ее возникновения.
2. По каким признакам классифицируют коррозионные процессы?
3. Каковы условия возникновения сплошной и локальной коррозии?
4. Назовите разновидности локальной коррозии.
5. Какие виды коррозии возникают при одновременном действии кор-
розионной среды и механических нагрузок на металл?
6. Что такое химическая коррозия металлов?
7. Приведите примеры коррозии металлов в растворах неэлектролитов.
8. Сформулируйте условия возможности окисления металла кислоро-
дом.
9. Какими свойствами должна обладать защитная пленка?
10. Приведите законы роста сплошных и пористых оксидных пленок.
11. Чем контролируется скорость газовой коррозии металлов в усло-
виях образования несплошных пленок продуктов коррозии?
12. По какому закону изменяется толщина пленки во времени, когда
скорость окисления металла контролируется диффузией окислителя через
сплошную пленку?
13. Как изменяется скорость газовой коррозии металлов с повышени-
ем температуры?
14. Что такое обезуглероживание стали?
15. В каких условиях возникает водородная хрупкость стали и меди?
16. Что такое электрохимическая коррозия?
17. При каких условиях электрохимическая коррозия термодинамиче-
ски возможна?

86
18. Поясните, что такое равновесный и неравновесный окислительно-
восстановительный потенциалы?
19. Запишите катодные реакции коррозионного процесса в водных
растворах и уравнения для расчета их равновесных потенциалов.
20. В чем заключаются особенности анодных реакций в процессе
электрохимической коррозии?
21. Что понимают под пассивным состоянием металлов?
22. Назовите факторы, способствующие переходу металла в пассив-
ное состояние и наоборот, нарушающие пассивное состояние.
23. Что такое перепассивация металлов?
24. Какая информация представлена на диаграмме Пурбэ?
25. Что такое ток коррозии, потенциал коррозии?
26. Что такое поляризация электродов?
27. Каковы причины поляризации электродов?
28. Каковы причины анодной поляризации электродов?
29. Каковы причины катодной поляризации электродов?
30. Какие факторы влияют на величину необратимого электродного
потенциала металла?
31. Что такое потенциал нулевого заряда?
32. Что такое перенапряжение ионизации металла, перенапряжение
водорода, перенапряжение ионизации кислорода?
33. Что такое концентрационная поляризация?
34. Приведите схему электрохимического коррозионного потенциала.
35. В чем особенности электрохимического коррозионного процесса?
36. Что такое поляризационная кривая?
37. Каково влияние вторичных продуктов на электрохимическую кор-
розию металлов?
38. Какие факторы способствуют протеканию коррозии металла с во-
дородной деполяризацией?
39. В воду опущена металлическая пластинка (медь, цинк). В раствор
с поверхности металла переходят ионы. До какого предела будет проходить
этот процесс (сравните медь и цинк)? Какими приемами можно повысить или
понизить заряд пластинок? Можно ли его сделать нулевым? Можно ли из-
менить знак заряда пластинки на противоположный?
40. Какие из перечисленных факторов способствуют понижению зна-
чения электродного потенциала металла: а) разбавление раствора; б) введе-
ние в раствор веществ, способных образовывать комплексные соединения с
ионами, содержащимися в растворе; в) удаление электронов с поверхности
электрода; г) повышение температуры раствора?
41. Какие факторы способствуют протеканию коррозии металла с ки-
слородной деполяризацией?
42. Что означает термин "сплошная кислородно-водородная деполя-
ризация"?
43. Какой вид имеет общая кривая катодной поляризации?
44. Какими показателями можно охарактеризовать скорость корро-

87
зии?
45. Какие методы изучения коррозионных процессов Вам известны?
46. Какая взаимосвязь существует между: а) К
m
. и К
г
; б) К
m
и К
об
; в)
К
m
и i ; г) К
об
и i?
47. Как по объему выделившегося H
2
рассчитать массу прокорродиро-
вавшего металла?
48. Какие факторы влияют на электрохимическую коррозию?
49. Перечислите методы защиты от коррозии.
50. Что такое ингибиторы коррозии?
51. Что такое протекторная защита?
52. Какие факторы, внешние и внутренние, влияют на механизм дей-
ствия углекислого газа на коррозию металлического оборудования?
53. Какими путями осуществляются процессы электрохимической
коррозии в углекислых средах?
54. В какую сторону и почему в углекислотной среде смещается рав-
новесие реакции: СO
2
+ H
2
O → H
2
CO
3
→ HCO
3
-
+ H
+
→ CO
3
2-
+ 2Н
+
при
водородной деполяризации?
55. Откуда берутся катионы водорода при катодной реакции в раство-
рах других минеральных кислот?
56. Во что превращается СО
2
при высоких давлениях в катодном про-
цессе?
57. Что влияет на толщину и плотность карбонатных пленок?
58. Объясните, почему наряду с образованием карбонатной пленки
происходит ее непрерывное растворение?
59. По какому закону с повышением давления углекислого газа уве-
личивается скорость равномерной углекислотной коррозии? Приведите при-
меры.
60. Как происходит коррозионное растрескивание металла катодно-
защищенных трубопроводов в карбонат-бикарбонатных средах?
61. Что является причиной карбонатного растрескивания катодно-
защищенного трубопровода?
62 астворимость сероводорода в воде достигает 3500 мг/л. Объясните,
почему происходит смещение рН среды в сторону его уменьшения?
Приведите уравнение реакции растворения сероводорода в воде.
63 Как влияет на ускорение катодного процесса выделения водорода
избыток (0,1 моль/л) недиссоциированного растворенного серово-
дорода?
64. Напишите уравнения реакций выделения водорода на катоде по
механизму Фольмера-Гейровского.
65. Напишите уравнения реакций выделения водорода на катоде по
механизму Фольмера-Тафеля.
66. Напишите уравнения реакций, происходящих на аноде при серо-
водородной коррозии, согласно механизму, предложенному Иофе З.И.
67. Чем является хемосорбированный комплекс [Fe(HS
-
)]
адc
., обра-

88
зующийся на поверхности металла, и к чему он приводит?
68. Объясните, почему ионы (HS
-
) называют промоторами наводора-
живания или электродными ядами?
69. Объясните, как происходит водородное охрупчивание металла?
70. Объясните процесс сероводородной коррозии, включающий суль-
фидное растрескивание по Тодту.
71. Объясните, чем является пленка сульфида железа на металле по
отношению к оголенным участкам металла
72. Объясните влияние микроорганизмов и продуктов их жизнедея-
тельности на коррозионные процессы (катодные и анодные) в присутствии
сероводорода.
73. Объясните, что способствует протеканию следующей реакции:
2Н
+
+ SO
4
2-
+ 4Н
2
→ Н
2
S + 4Н
2
О?
74. В каких условиях возникает биокоррозия?
75. Как защитить металлическое оборудование от сульфидного рас-
трескивания?
76. Как происходит коррозия в пластовых водах?
77. Объясните, как протекают коррозионные процессы в многофазных
расслаивающихся системах?
78. Объясните, какие покрытия возможны для защиты металла от кор-
розии?
79. Объясните, как защитить металл с помощью анодного покрытия?
Приведите примеры.
80. Объясните, что такое катодное покрытие защищаемого металла?
Приведите примеры.
81. Приведите примеры неметаллических покрытий для защиты ме-
таллического оборудования.
82. Как влияет природа анионов соли на скорость коррозии металла в
растворе?
83. Объясните принцип протекторной защиты металлического обору-
дования, находящегося в агрессивной среде.
84. Объясните катодную защиту металла.
85. Объясните, как протекает коррозия трубопроводов блуждающими
токами. Назовите источники блуждающих токов.
86. Какой состав имеют пластовые воды?
87. Как снижается агрессивность технологических сред нефтепромы-
слов?
88. Объясните уменьшение агрессивности среды с помощью деаэра-
ции.
89. Объясните механизм защитного действия ингибиторов образова-
нием на поверхности металла трехслойной пленки.
90. Объясните, как защищают металл углеводородорастворимые ин-
гибиторы.
91. Объясните, как защищают нефтегазопромысловое оборудование
водорастворимые ингибиторы:

89
92. Приведите примеры катионных ингибиторов.
93. Приведите примеры анионных ингибиторов.
94. Как осуществляется подача ингибитора при защите нефтегазо-
промыслового оборудования? Приведите примеры.
95. Приведите примеры парофазных ингибиторов.
96. Как осуществляется ингибиторная защита от коррозии нефтепро-
мыслового оборудования при применении диоксида углерода с целью повы-
шения нефтеотдачи.
97. Приведите примеры смешанных экранирующих ингибиторов.
10. ЗАДАЧИ И УПРАЖНЕНИЯ
1. Охарактеризовать химическую активность кислорода и металла.
Указать возможные степени окисления атома металла и формулы соответст-
вующих оксидов. Написать уравнения реакций взаимодействия металла с ки-
слородом с образованием оксидов. Пользуясь величиной давления диссоциа-
ции оксидов (табл. 2),оценить вероятность коррозии металла на воздухе при
стандартных условиях. При какой температуре коррозия вероятна? Вычис-
лить фактор Пиллинга-Бэдвордса, дать заключение о вероятных защитных
свойствах возникающего в результате газовой коррозии слоя оксидной, плен-
ки на изучаемом металле.
Указаны электронные конфигурации металлов:
a) Co 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
7
;
б) Pb 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
2
;
в) Cu 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
10
г) Fe 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
6
д) Zn 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
е) Al 1s
2
2s
2
2p
6
3s
2
3p
1
;
2. Указать, какой тип коррозионных процессов (химический или элек-
трохимический) возможен при контакте указанных фаз. Ответ теоретически
обосновать: 1) Zn - сухой воздух; 2) Zn, - соляная кислота; 3) золото - влаж-
ный воздух; 4). железо –сухие пары иода; 5) серебро - сероводород; б) титан -
серная кислота; 7).Са - плавиковая кислота (HF); 8). ртуть - разбавленная
HNO
3
; 9) натрий - влажный воздух; 10) натрий - сухой воздух; 11) железо -
концентрированная H
2
SO
4
; 12). железо - разбавленная H
2
SO
4
; 13). железо -
раствор хлорной меди; 14) железо - раствор хлорного железа.
3. Исходя из величины ∆G
0
298
, определить, какие из приведенных ниже
металлов будут корродировать во влажном воздухе по уравнению:
4Ме + n2Н
2
О + nO
2
→ 4Me(OH)
n
a)Мg; б) Сu; в)Аu; г)Ni.
4. Какие металлы (Fe, Ag, Ca) будут разрушаться в атмосфере влажного
воздуха? Ответ дать на основании вычисления ∆G
0
298
соответствующих про-
цессов. Какого типа коррозия возникает?
5. Возможна ли коррозия серебра кислородом воздуха в среде серово-
дорода? Ответ дать на основании вычисления ∆G
0
298
этого процесса.

90
6. Медь во влажном воздухе покрывается зеленым налетом "патины",
в состав которой в основном входит карбонат гидроксомеди (II). Составить
уравнение реакции, рассчитать ∆G
0
298
для этой реакции.
7. Возможно ли окисление титана хлором? Ответ дать на основании-
расчета ∆G
0
298
8. Устойчив ли титан в среде: а) брома при t = 100°С; б) кислорода при
25°С; в) серы при 300°С? Написать уравнения реакций, рассчитать ∆G
T
.
9. По диаграмме Пурбэ (Е-рН) (рис.4;32-34;36) системы Ме - Н
2
О найти
области наиболее вероятной коррозии металла с водородной деполяризацией
в водных растворах. Указать, в каких пределах рН скорость окисления ме-
талла в воде минимальна. Представить условный график зависимости скоро-
сти коррозии от рН. Составить схему микрогальванического элемента и урав-
нения предполагаемых анодного и катодного процессов коррозии Me с водо-
родной деполяризацией при рН=0. По стандартным потенциалам вычислить
∆Е° коррозионной пары Ме-водород в растворе кислоты при рН=0. Оценить
термодинамическую вероятность коррозии металла с кислородной деполяри-
зацией. Рассчитать ∆Е° коррозионной пары Ме-кислород.
1) Zn; 2) Al; 3) Сu; 4) Ni; 5) Sn; 6) Аg; 7) Ti; 8) Мg, 9) Рb.
10. По диаграмме Пурбэ системы Fe - H
2
O описать коррозионное по-
ведение железа в чистой воде и в растворах кислот и оснований. Написать
уравнения электродных процессов окисления железа и восстановления депо-
ляризатора в сильно кислой среде (рН=0) и в жесткой воде (рН=7). Составить
суммарные уравнения коррозии металла в обоих случаях и изобразить схемы
коррозионных гальванических элементов.
11. По диаграмме Пурбэ для системы Fe - H
2
O оценить термодинами-
ческую вероятность окисления железа кислородом, растворенным в воде в
стандартных условиях при рН=7. Написать уравнения реакций предполагае-
мых электродных процессов окисления железа и восстановления кислорода в
нейтральной водной среде, а также уравнение суммарной реакции коррозии.
Составить схему предполагаемого коррозионного микрогальванического эле-
мента. Вычислить изменение стандартной энергии Гиббса системы (∆G
0
298
)
12. Какова термодинамическая вероятность взаимодействия меди с
водным раствором соляной кислоты: а) концентрация кислоты = 1моль/л;
б) концентрация кислоты = 2моль/л? Каково значение перенапряжения вос-
становления ионов водорода на меди? Как будет влиять контакт меди с цин-
ком в условиях коррозии с водородной деполяризацией?
13. Обосновать раcчетом, какой из видов деполяризации (водородная
или кислородная) определяет процесс электрохимической коррозии во влаж-
ном воздухе следующих металлов: I) Аg; 2) Сu; 3). Рb; 4) Hg; 5) Zn; 6) Mg;
7) Са; 8) Со?
14. Почему цинк, железо и некоторые другие металлы, расположен-
ные в ряду стандартных окислительно-восстановительных потенциалов ме-
таллов левее водорода, не растворимы в воде?
15. Почему алюминий не растворим в воде, но корродирует в щелоч-
