Молявко М.А.,Чалова О.Б. Коррозия металлов
Подождите немного. Документ загружается.

21
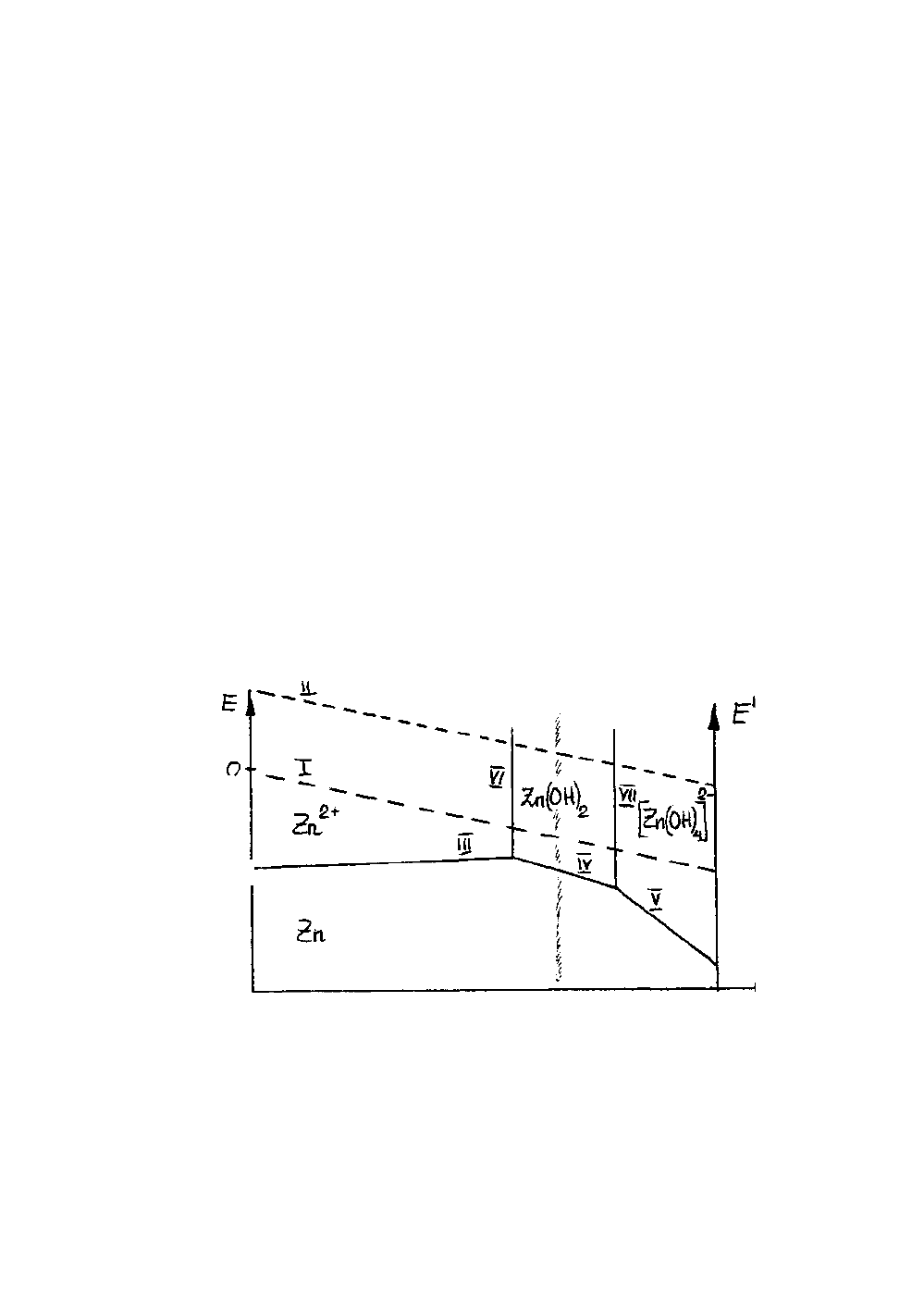
На рис.4 изображена диаграмма Пурбэ (Е - рН) системы Zn - H
2
O с учетом
образования Zn
2+
-ионов в кислой, [Zn(OH)
4
]
2-
- ионов в щелочной и твердого
Zn(OH)
2
в нейтральной средах.
Приведенные на диаграмме горизонтальные и наклонные прямые линии
отображают равновесные потенциалы электрохимических систем как функцию от
рН:
Zn → Zn
2+
+ 2ē (линия III)
Zn + 2OH
-
→ Zn(OH)
2
+2ē (линия IV)
Zn + 4OH
-
→ [Zn(OH)
4
]
2-
+2ē (линия V)
Равновесный потенциал E
Zn(OH)2
/
Zn
меняется с изменением рН так же, как
равновесный потенциал водородного и кислородного электродов. В общем, для
всех оксидных и гидроксидных электродов, независимо от валентности металла,
справедливы соотношения: E
MenOm//Me
= Е°
MenОm//Ме
- 0,059 рH.
Вертикальные линии соответствуют значениям рН, при которых устанавли-
ваются равновесия:
Zn
2+
+ 2OH
-
→ Zn(OH)
2
(линия VI)
Zn(OH)
2
+ 2H
2
O → [Zn(OH)
4
]
2-
+2H
+
(линия VII)
Заштрихованная полоса разделяет области рН, при которых в растворе пре-
обладают ионы Zn
2+
или [Zn(OH)
4
]
2-
. На диаграмме нанесены также прямые, пока-
зывающие влияние рН на потенциалы «водородного» (линия 1) и «кислородного»
(линия II) электродов соответственно
pH
2 12
Рис. 4. Диаграмма Пурбэ (Е-рН) для системы Zn- Н
2
О.
Диаграммы Пурбэ могут быть использованы для установления термодина-
мической возможности электрохимической коррозии. Термодинамическая дви-
жущая сила коррозии с водородной деполяризацией для раствора, свободного от
кислорода, пропорциональна разности потенциалов:
∆Е= (E
H
+
/H2
- Е
ме
).
-0,76
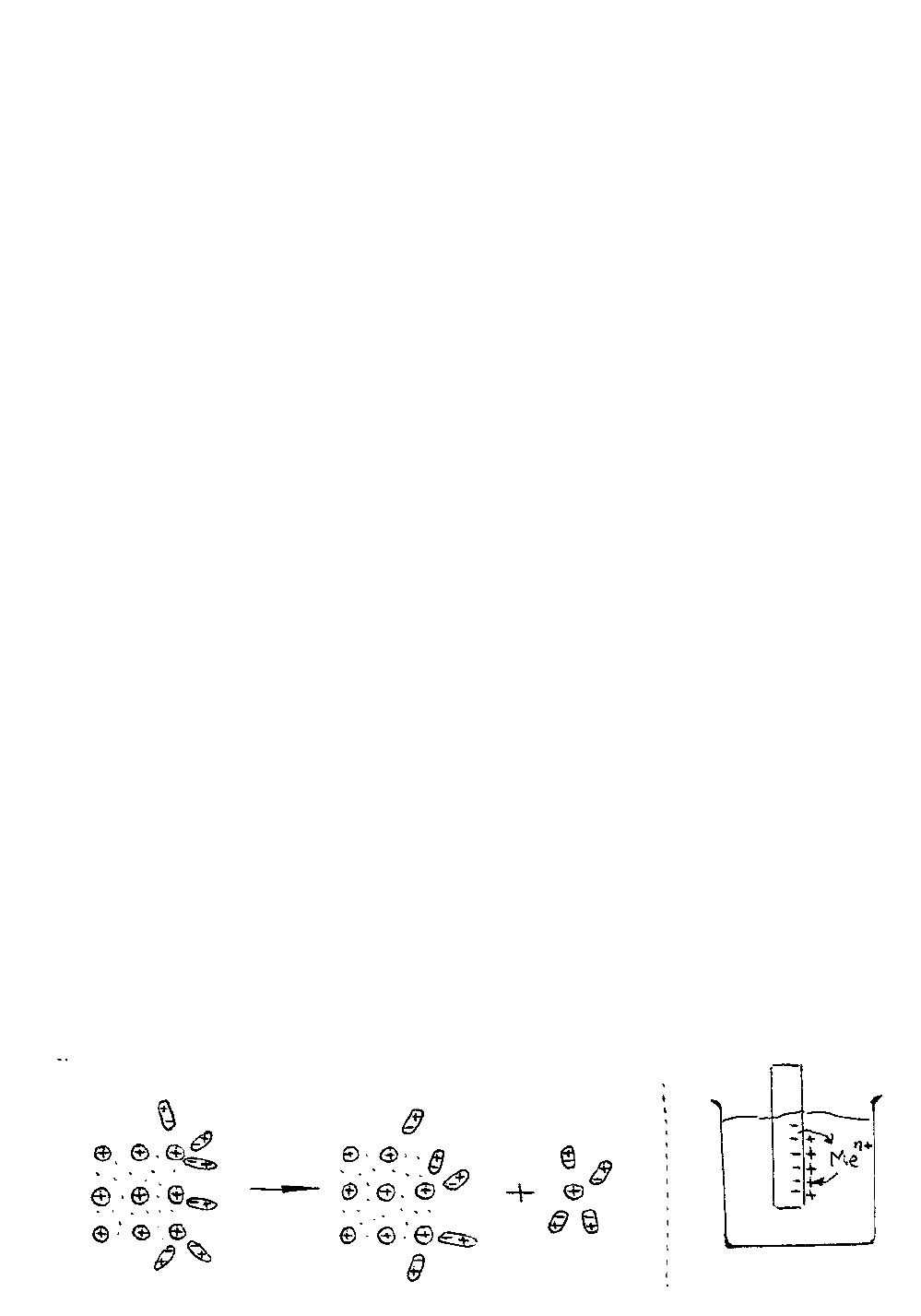
22
Термодинамическая движущая сила коррозии с кислородной деполяризаци-
ей для раствора, насыщенного кислородом, пропорциональна разности потенциа-
лов:
∆Е = (Е
о2/он
- -
Е
ме
).
Каждой области диаграммы соответствует одно термодинамически устой-
чивое состояние:
а) в области ниже линий (III-IV-V) устойчив металл Zn и коррозии он не
подвергается;
б) в области, ограниченной линиями (ось Е- III -VI), термодинамически ус-
тойчивы гидратированные катионы Zn
2+
. Металлический цинк, находящийся в ус-
ловиях, отвечающих какой-либо точке этой области, (рН < 6), термодинамически
не устойчив и будет корродировать с образованием ионов Zn
2+
;
в) в области, oграниченной линиями_.(VII-V-ось E΄), устойчивы анионы
[Zn(OH)
4
]
2-
.
В этих условиях цинк корродирует с образованием гидроксианионов;
г) в области, ограниченной линиями (VI-IV-VII), устойчивым является гид-
роксид Zn(OH)
2
. Термодинамически металлический цинк в условиях, отвечающих
этой области, может корродировать, однако пленка плохо растворимого гидро-
ксида пассивирует металл и предохраняет его от коррозии.
Таким образом, металлический цинк подвергается коррозии под действием
Н
+
- ионов или растворенного О
2
в кислых (рН < 6) и щелочных (рН > 11) средах.
В нейтральной слабокислой и слабощелочной средах (6 < рН < 11) металлический
цинк пассивируется пленкой гидроксида Zn(OH)
2
и не корродирует.
3.3. Двойной электрический слой
При соприкосновении металла и электролита на границе раздела фаз возни-
кает разность электрических потенциалов. Наибольшее значение имеют обрати-
мые равновесные электродные и адсорбционные потенциалы.
3.3.1. Обратимый равновесный электродный потенциал
На поверхности металлического кристалла атомы металла валентно нена-
сыщены. Они взаимодействуют с полярными молекулами, присутствующими в
электролите, в результате этого взаимодействия осуществляется переход катионов
металла в раствор:
Ме
(тв)
→ Ме
n+
(р-р)
+ nē
(мет)
.
Металл приобретает отрицательный заряд, а раствор - положительный.
Образуется двойной электрический слой на границе раздела фаз: (рис.5)
Рис. 5. Схема образования двойного электрического слоя

23
Между металлом и раствором устанавливается равновесный обмен ионами
металлов, при котором скорость восстановления ионов металла равна скорости
окисления металла. Переход катионов металла через границу раздела фаз соответ-
ствует переносу электрических зарядов, т.е. - через границу раздела фаз: металл -
электролит протекает электрический ток (рис. 5). Скорость обмена ионами метал-
ла между металлом и раствором при равновесном потенциале называют током
обмена, который равен:
← →
i
0
= i
k
= i
a
,
← ← ← где
i
k
= i
Me
i
k
- плотность тока катодного процесса,
то есть восстановления катионов металла
→ → →
i
a
= i
Me
i
a
- плотность тока анодного процесса,
то есть окисления атомов металла
Таким образом, при установлении равновесного потенциала границу разде-
ла фаз (металл – раствор) пересекает только один из видов ионов - катионы ме-
талла. При этом наблюдается баланс по зарядам и баланс по веществу, то есть
коррозия отсутствует.
3.3.2. Обратимый равновесный адсорбционный потенциал
Адсорбционный потенциал возникает в результате либо избирательной ад-
сорбции катионов или анионов электролита поверхностью металла (рис.6,а,б), ли-
бо ориентированной адсорбции полярных или поляризуемых молекул (рис.6,в).
Образуется двойной электрический слой в пределах одной фазы - раствора.
Рис. 6. Строение двойного электрического слоя
Возможно образование двойного электрического слоя, обусловленного од-
новременно несколькими причинами. Например, при адсорбции поляризуемых
молекул кислорода на поверхности металла и одновременном переходе катионов
из металла в электролит образуется ионно-адсорбционный слой (рис. 6, г).
3.4. Потенциал коррозии и ток коррозии
В реальных условиях значение потенциала на границе металл - электролит
отличается от равновесного, так как в катодном процессе участвуют не только ка-
тионы металла, но и другие ионы или молекулы, присутствующие в электролите
(рис. 7,б). Это значение потенциала называется неравновесным или необратимым
24
потенциалом металла. Он не подчиняется термодинамическому уравнению Нерн-
ста и не может быть по нему рассчитан. Его определяют экспериментально. Уста-
новившееся во времени значение необратимого потенциала называется стацио-
нарным потенциалом или потенциалом коррозии (Е
кор
.).
Величина необратимых электродных потенциалов зависит от очень многих
внутренних и внешних факторов. К внутренним факторам относятся: природа ме-
талла, его структура; состояние поверхности; присутствие на поверхности метал-
ла защитных пленок (например, оксидных) и адсорбированных веществ; механи-
ческих деформаций и напряжений в металле.
К внешним факторам относятся: химическая природа растворителя; приро-
да и концентрация ионов в растворе; природа и концентрация растворенных газов
и других не ионизирующихся веществ; температура; давление; движение раствора
и др.
Влияние различных факторов на величину необратимых электродных
потенциалов металлов:
№
п.п.
Фактор Изменение потенциала кор-
розии, Вольт
1 Химическая природа металла до 4 В
2 Состояние поверхности металла десятые доли В
3 Адсорбция атомов и молекул на поверхности
металла (особенно О
2
и Н
2
)
от сотых до десятых долей В
4 Механические деформации и напряжения от тысячных до сотых долей
В
5 Химическая природа и концентрация раство-
ра
от десятых.до.целых единиц
В
6 Температура (каждые 10
0
С) сотые доли В
При установлении стационарного электродного потенциала на границе раз-
дела фаз (металл – раствор) осуществляются одновременно процессы (2.1) и (2.2).
Количество атомов металла, окисляющихся и переходящих в раствор, и ка-
тионов металла, восстанавливающихся из раствора, не совпадают, так как в про-
цессе участвуют молекулы окислителя. Происходит изменение массы металла в
результате его электрохимического растворения, то есть протекает коррозионный
процесс. При потенциале коррозии соблюдается баланс электрических зарядов.
Количество электричества, проходящее через границу раздела фаз (металл – элек-
тролит), в суммарном катодном (восстановительном) и суммарном анодном
(окислительном) процессах должно быть одинаковым, то есть должно соблюдать-
ся равенство:
→ → ← ←
i
Me
+ i
ox
= i
Me
+ i
ox ,
→
где i
Me
- плотность тока обусловленная окислением атомов металла;

25
→
i
ox
- плотность тока обусловленная окислением восстановленной
формы ( Red ) окислителя;
→
i
Me
- плотность тока, обусловленная восстановлением катионов металла;
→
i
ox
- плотность тока, обусловленная восстановлением окислителя (ОХ).
Преобразуем равенство: → ← ← →
i
Me
- i
Me
= i
ox
- i
ox
; i
кор
= i
a
= i
k
i
кор
- плотность тока коррозии;
→ ←
i
a
= (i
Me
- i
Me
) - плотность анодного тока;
← →
i
k
= (i
ox
– i
ox
) - плотность катодного тока.
Рис. 7. Схема установления стационарного потенциала
Скорость растворения металла определяется числом ионов металла, перехо-
дящих в раствор через единицу поверхности раздела фаз в единицу времени, и
может быть выражена через плотность тока коррозии. Потенциал коррозии и ток
коррозии являются основными характеристиками коррозионного процесса.
3.5. Потенциал нулевого заряда
Если металл с катионным двойным электрическим слоем, соответствующим
отрицательному потенциалу металла относительно раствора, подвергнуть поляри-
зации, то есть отнять у него с помощью внешнего источника постоянного элек-
трического тока отрицательные заряды, то можно достичь исчезновения на его
поверхности отрицательных зарядов, при этом исчезнет и ионный двойной элек-
трический слой. При дальнейшей анодной поляризации металла произойдет пере-
зарядка его поверхности с образованием соответствующего анионного двойного
электрического слоя. Аналогичные эффекты будут наблюдаться при катодной по-
ляризации металла с анионным двойным электрическим слоем, то есть при подве-
дении к нему отрицательного заряда. Потенциал, при котором поверхность ме-
талла не заряжена и, соответственно, отсутствует двойной электрический слой,
называют потенциалом нулевого заряда.

26
При отсутствии заряда на поверхности металла, многие поверхностные
свойства металла проходят через экстремальные точки. Максимальных значений
достигают поверхностное натяжение, адсорбция молекулярных органических ве-
ществ, а минимальных - смачиваемость, емкость двойного электрического слоя и
др. Потенциалы нулевых зарядов находят экспериментально по этим экстремаль-
ным точкам поверхностных свойств металлов с помощью электрокапиллярных,
адсорбционных и др. измерений. Характеристику заряду поверхности металла да-
ет потенциал (φ
0
) металла в шкале нулевых точек (по Антропову Л.И.):
φ
0
= E
Me
– E
(0)
где Е
Me
- равновесный электродный потенциал металла в данных условиях
Е(о)- потенциал нулевого заряда.
Таблица 8
Стандартные потенциалы металлов в водных растворах при 25
0
С
в шкале нулевых точек (по Антропову Л.И.)
Металл Ni Fe Cr Zn Ga Sn Cu
φ
0
, B -0,11 -0,44 -0,31 -0,12 +0,08 +0,2 +0,29
Металл Cd Bi Tl Pb Ag Hg
φ
0
, B +0,34 +0,34 +0,42 +0,54 +0,79 +1,00
Заряд поверхности существен для процессов адсорбции на поверхности ме-
талла: при φ >0 на поверхности металла преобладает адсорбция анионов;
при φ < 0 - адсорбция катионов; при φ ≈ 0(±0,5В)- адсорбция молекулярных
частиц.
Адсорбция различных веществ на поверхности металла может очень сильно
изменять скорость его коррозии. Потенциал нулевого заряда металла зависит не
только от природы металлов, но и от адсорбции поверхностно-активных веществ,
которые могут изменять потенциал нулевого заряда.
3.6. Коррозионный гальванический элемент
Различные участки поверхности корродирующего металла характеризуются
различными значениями электродных потенциалов. Участки поверхности с более
отрицательными значениями электродных потенциалов (Еа) называют анодными;
участки с более положительными электродными потенциалами (Eк) - катодными.
Чем больше разность потенциалов катодных и анодных участков, тем больше
движущая сила коррозионного процесса.
Причины возникновения анодных и катодных участков на поверхно-
сти корродирующег о металла:
1. Неоднородность ме-
таллической фазы
а) контакт двух металлов
б) макро- и микровклю-
чения
в) неоднородность спла-
ва
Участки, обогащенные
металлом с более поло-
жительными электрод-
ными потенциалами,
являются катодными
2. Неоднородность по-
верхности металла
а) границы зерен кри-
сталлитов
Могут быть анодными
и катодными.

27
б) дефекты кристалличе-
ской решетки металла
в) анизотропность ме-
таллического кристалла
Обычно анодные участ-
ки.
Различные грани моно-
кристалла могут быть
анодными или катод-
ными.
3. Неоднородность за-
щитных пленок
а) макро- и микропоры в
оксидной пленке
б) неравномерность рас-
пределения на поверхно-
сти вторичных продук-
тов коррозии
Анодные участки.
Участки металла под
продуктами коррозии -
анодные.
4. Неоднородность
внутренних напряжений
в металле
а) неравномерная де-
формация
б) неравномерность при-
ложенных внешних на-
грузок
Более деформирован-
ные участки - аноды.
Более напряженные
участки - аноды.
5. Неоднородность жид-
кой фазы
а) различие в концентра-
ции собственных ионов
в электролите
б) различие в концен-
трации солей
в) различие в рН
г) различие в концентра-
ции кислорода или дру-
гих окислителей
Участки металла со-
прикасаются с разбав-
ленными растворами -
аноды.
Участки, соприка-
сающиеся_с раствором
с меньшим рН, - катоды
Участки, соприкасаю-
щиеся с раствором с
большей концентрацией
окислителя, - катоды.
6. Неоднородность фи-
зических условий
а) различие температуры
б)неравномерное нало-
жение внешнего элек-
трического поля.
Более нагретые участки
- аноды.
Протекание анодной реакции энергетически более выгодно на анодных уча-
стках, катодной - на катодных участках. При электрохимической коррозии участ-
ки, на которых протекают анодные и катодные реакции пространственно разделе-
ны, и для протекания коррозии необходим переток электронов в металле и ионов
в электролите. То есть при электрохимической коррозии в системе металл - рас-
твор возникает электрический ток, а поверхность корродирующего металла пред-
ставляет собой многоэлектродный гальванический коррозионный элемент. Схема
коррозионного электрохимического процесса представлена на рис. 8. Процесс
коррозии железа иллюстрируется рис.9.

28
Рис. 8. Схема электрохимического коррозионного процесса
а б
Рис. 9. Коррозия железа:
a - с водородной деполяризацией; б- с кислородной деполяризацией
3.7. Поляризация электродов
Измерения показывают, что протекание электрического тока в гальваниче-
ском элементе приводит к изменению электродных потенциалов катода и анода.
Относительно соответствующих обратимых равновесных значений потенциалов
потенциал анода при прохождении через него тока становится положительнее, а
потенциал катода - отрицательнее: разность потенциалов уменьшается:
Е
а
΄ = Е
а
+ ∆Е
а
, Е
к
΄ = Е
к
- ∆Е
к
где Е
а
΄ и Е
к
΄ - эффективные потенциалы анода и катода, устанавливающиеся
при данном значении тока. Изменение потенциала электрода, связанное с про-
хождением через него тока, относительно равновесного значения окисли-
тельно-восстановительного потенциала электрохимической системы в дан-
ных условиях называют поляризацией электрода (∆Е
а
или ∆Е
к
).
- Е
I
Рис.10. Изменение потенциалов анода и катода гальванического элемента с
увеличением силы протекающего через них тока

29
Явление поляризации электродов имеет общий характер и возникает как
при электролизе, при работе в гальванических элементах, так и в процессах элек-
трохимической коррозии при работе коротко замкнутых коррозионных гальвани-
ческих элементов. Уменьшение разности потенциалов анодных и катодных участ-
ков поверхности металла приводит к уменьшению скорости электрохимической
коррозии. Вещества, уменьшающие поляризацию электродов, называют деполя-
ризаторами.
Поляризация является следствием более низких скоростей протекания
электродных реакций, чем скорость передвижения электронов Анодный про-
цесс перехода катионов в электролит отстает от перехода освобожденных элек-
тронов от анода к катоду, что приводит к уменьшению отрицательного заряда на
аноде. Катодный процесс "присоединения" электронов к молекуле окислителя от-
стает от поступления на катод электронов, что приводит к увеличению отрица-
тельного заряда на катоде.
3.8. Причины анодной поляризации
1) Низкая скорость ионизации металла и перехода катионов металла в
раствор приводит к возникновению электрохимической поляризации (перенапря-
жение ионизации металла). Определяется природой металла, состоянием его по-
верхности, температурой и др. Наибольших значений перенапряжение ионизации
металла достигает у пассивирующихся металлов группы Fe;
2) Замедленность диффузии ионов металла от поверхности в объем рас-
твора приводит к возникновению концентрационной поляризации.
Значение концентрационной поляризации можно представить уравнением.
∆Е
а конц.. =
n
n
Me
Mt
a
a
nF
RT
lg
3,2
,
где a′
Me
n+
- активность катионов металла у поверхности металла;
а
Ме
n+
- активность катионов металла в объеме раствора;
3) Анодная пассивность металла возникает в определенных условиях в
результате образования на поверхности первичных фазовых или адсорбционных
защитных пленок. Переход металла в пассивное состояние сопровождается рез-
ким увеличением потенциалов до значений, достаточных для протекания иного
анодного процесса,- обычно выделение кислорода.
При электрохимической коррозии металлов наряду с первичной анодной
реакцией возможно протекание вторичных процессов: взаимодействие первич-
ных продуктов коррозии друг с другом или с электролитом и растворенными в
нем газами с образованием вторичных труднорастворимых продуктов коррозии.
Они оказывают влияние на анодную поляризацию.
Так, ионы многих металлов (Al
3+
, Fe
2+
, Мg
2+
, Ni
2+
и т.д.) при определенных
значениях рН среды образуют труднорастворимые гидроксиды:
[Me(H
2
O)
m
]+nOН
-
Me (OН)
n
+ mH
2
O
В табл.9 приведены значения рН начала осаждения гидроксидов металлов.

30
Та б л и ц а 9
рН начала осаждения гидрокидов металлов (по Бриттону)
Me(OH)n рН Me(OH)n рН Me(OH)n рН Me(OH)n л
рН
Fe (ОН)з
Zr(OH)2
Sn(OH)2
А1(ОН)з
2
2
3,41
4,1
РЬ(ОН)2
Zn(OH)2
Сг(ОН)3
Си(ОН)2
5,0
5,2
5,3
5,3
Fe(OH)2
Ве(ОН)2
Cd(OH)2
Со(ОН)2
5,5
5,7
6,7
7,5-8,0
Ni(OH)2
Мп(ОН)2
AgOH
Mg(OH)2
8,0
8,5-8,7
9,0
10,5
В фосфорнокислых средах железо образует труднорастворимый фосфат:
3 Fe
2+
+ 2PO
4
3-
Fe
3
(PO
4
)
2
В растворе концентрированной (70%-ной) серной кислоты -нерастворимый
в ней сульфат.
В концентрированных растворах плавиковой кислоты образуются нераство-
римые в HF фториды: Fe
2+
+2F
-
FeF
2
.
Mg
2+
+2F
-
MgF
2
.
Вторичные продукты коррозии могут подвергаться дальнейшим изменени-
ям. Например, гидроксид железа (II) окисляется кислородом до гидроксида желе-
за (III):
4Fe(OH)
2
+O
2
+2H
2
O
4Fе(OН)
3
Гидроксиды металлов претерпевают дегидратацию с образованием гидра-
тированных оксидов переменного состава:
FeO∙Fe
2
O
3
∙nН
2
O или например, Al
2
O
3
∙xH
2
O.
Пленки вторичных труднорастворимых продуктов коррозии металлов обла-
дают большими или меньшими защитными свойствами. Они заметно затрудняют
диффузионные процессы и в результате тормозят коррозию. Вещества, умень-
шающие анодную поляризацию, называют анодными деполяризаторами. К ним,
например, могут быть отнесены анионы или полярные молекулы (NH
3
, Cl
-
, OH
-
и
др.) - лиганды, способные связывать катион металла в устойчивый комплекс:
Сu
2+
+ 4NH
3
→ [Сu(NH
3
)
4
]
2+
Al
3+
+ 6(OH)
-
→ [Al(OH)
6
]
3-
Al
3+
+ 6F
-
→ [AlF
6
]
3-
).
Присутствие в растворе некоторых анионов (например, Cl
-
) предотвращает
или затрудняет наступление анодной пассивности металлов. Влияние природы
анионов, присутствующих в растворе, на скорость коррозии металла объясняется
их участием в многостадийном процессе анодного растворения. Схематически
можно выделить следующие стадии:
1). адсорбция аниона с образованием комплекса на поверхности;
Me + m
pp
L → [MeL
m
]
m
адс
.
;
2). электрохимическая реакция, определяющая скорость всего процесса:
[MeL
m
]
m
адс
.
→ [MeL
m
]
mn
pp
+ nē
(металл)
,
.
причем электроны могут отщепляться в несколько стадий, например, после-
