Молявко М.А.,Чалова О.Б. Коррозия металлов
Подождите немного. Документ загружается.


31
довательно по одному электрону в каждой из стадий;
3). распад комплекса на простые ионы:
[MeL
m
]
mn
pp
→ Me
n+
+ m
pp
L
3.9. Причины катодной поляризации
1). Замедленность катодной реакции разряда ионов водорода или иони-
зации кислорода в результате высокой энергии активации приводит к возникно-
вению электрохимической поляризации, называемой перенапряжением реакции
катодной деполяризации.
Как перенапряжение ионизации кислорода, так и перенапряжение водорода
зависит от материала катода (табл. 10 ), от катодной плотности тока, состояния
поверхности катода (включая адсорбцию на катодной поверхности различных
веществ), температуры и т.д. Перенапряжение водорода уменьшается с уменьше-
нием рН среды и зависит от строения двойного электрического слоя. Зависимость
перенапряжения водорода от материала катода сложная. Перенапряжение тем
ниже, чем больше склонность металла к взаимодействию с атомами водорода: вы-
сокая энергия адсорбции, образование твердых растворов, способность металла
катализировать рекомбинацию водородных атомов: (Н
0
+ Н
0
=H
2
). Так, в ряду: Pt,
Pd, W, Ni, Fe, Ag , Cu, Zn, Sn, Pb возрастает перенапряжение водорода;
Таблица 10
Перенапряжение водорода и кислорода на металлах, В.
Электрод Водород Кислород
Аg 0,3 0,4
Au 0,06 0,5
Cd 0,6 0,4
Fe 0,1 0,3
Сu 0,5 -
Ni 0,3 0,05
Pt (гладкая) 0,3 0,5
Pt (черненая) 0,03 0,3
Zn 0,7 -
С (графит) 0,65
Al 0,70
Рb 1,16
W 0,22
Sn 0,75
Sb 0,60
Hg 1,1
Вi 0,4

32
2). Замедленность диффузии окислителя (деполяризатора) из объема
электролита к поверхности металла или продукта восстановления окислителя от
поверхности металла в объем приводит к возникновению концентрационной по-
ляризации катода.
Поляризацию вследствие замедленного переноса ионов Н
+
к катодной по-
верхности называют ионной концентрационной поляризацией, а значение ее
рассчитывают по уравнению
∆Е
к(ион конц..) =
H
H
a
a
F
RT
lg
3,2
,
где a′
H+
- активность (или концентрация) водородных ионов у поверхности
катода;
а
H+
- то же в объеме раствора.
Поляризацию вследствие замедленной диффузии молекулярного водорода
от катодных участков вглубь раствора называют газовой концентрационной по-
ляризацией. Ее значение рассчитывают по уравнению
∆E
к(H2 газ.конц.)
=
2
2
2
2
'
lg
2
3,2
][
][
lg
2
3,2
H
H
H
H
P
P
F
RT
C
C
F
RT
где С′
H2
- концентрация молекулярного водорода у катодной поверхности;
С
H2
- концентрация молекулярного водорода в объеме раствора;
P′
H2
- парциальное давление водорода у катодной поверхности;
P
H2
- парциальное давление водорода в атмосфере.
В отличие от ионной концентрационной поляризации газовая концентраци-
онная поляризация постоянно сопровождает процесс водородной деполяризации.
К моменту начала выделения водорода в виде пузырьков (Рн
2
= Р = 1 атм.) в атмо-
сферу воздуха (Рн
2
= 5 10
-7
атм.) ее значение составляет 0,186В и дальше не изме-
няется.
Для процессов коррозии металлов с кислородной деполяризацией в отсут-
ствие перемешивания электролитов характерна замедленность переноса кислоро-
да к катодным участкам. Это обусловлено низкой растворимостью кислорода в
воде и в водных растворах, медленной диффузией кислорода через слой электро-
лита, дополнительными затруднениями диффузии кислорода через пленку вто-
ричных труднорастворимых продуктов коррозии. Значение концентрационной
поляризации кислорода можно вычислить по уравнению
∆E
к(О2 газ.конц.)
=
][
][
lg
4
3,2
2
2
Co
oC
F
RT
где С′о
2
- концентрация кислорода у поверхности катода;
Со
2
- концентрация кислорода в объеме раствора.
3.10.Поляризационные кривые
Поляризация электродов зависит от силы тока, протекающего в системе.
Графическая зависимость потенциала электрода от плотности тока (силы тока)
называется поляризационной кривой. Рассмотрим катодные поляризационные
кривые (рис.11).

33
Катодные поляризационные кривые в координатах Ек-iк
Кривая АВ - перенапряжение ионизации кислорода.
Кривая GН - перенапряжение водорода.
Кривая СДЕК - общая кривая катодной поляризации.
При очень малых плотностях катодного тока перенапряжение ионизации
кислорода линейно зависит от плотности тока (уч.А), при достаточно больших
плотностях тока перенапряжение ионизации кислорода имеет логарифмическую
зависимость от плотности тока (уч.АВ). Если скорость ионизации кислорода и
диффузии кислорода к катоду соизмеримы, то суммарная скорость катодного
процесса будет зависеть от обоих этих процессов. Возникает смешанная поляри-
зация, и катодная поляризационная кривая идет вверх более круто (уч.АС), чем
при наличии только перенапряжения ионизации кислорода (уч.АВ): концентраци-
онная поляризация увеличивает суммарную поляризацию катодного процесса.
При приближении к предельной диффузинной; плотности тока (i
Д
) по (О
2
)
наблюдается резкое изменение потенциала (уч.ДЕ) и при определенном его зна-
чении на катоде может начаться какой-либо новый процесс. В водных растворах
таким процессом обычно является разряд водородных ионов, обратимый потен-
циал которого более чем на 1B отрицательнее обратимого потенциала процесса
ионизации кислорода. При достижении обратимого потенциала водородного
электрода в данном растворе на процесс кислородной деполяризации начинает
накладываться процесс водородной деполяризации (уч.GН) и общий процесс ка-
тодной деполяризации будет соответствовать кривой АСДЕК, которую называют
общей кривой катодной поляризации. Кислородная и водородная деполяриза-
ции протекают параллельно и независимо друг от друга. Однако, возможно кос-
венное влияние водородной деполяризации на кислородную деполяризацию:
1) за счет перемешивания электролита пузырьками выделяющегося водоро-
да толщина диффузионного слоя электролита уменьшается, что должно привести
к увеличению диффузионного тока;
2) одновременно с выделением пузырьков водорода происходит десорбция
(унос) кислорода с поверхности металла.

34
3.11. Пассивное состояние металлов
Ряд металлов: железо, хром, никель, титан, алюминий и др. в концентриро-
ванных растворах окислителей разрушаются значительно меньше, чем в более
разбавленных растворах. Пассивное состояние металла характеризуется отно-
сительно высокой коррозионной стойкостью, обусловленной торможением
анодной реакции ионизации металла в определенной области потенциала
(рис 12, уч.З). Снижение скорости коррозии происходит в результате образования
на поверхности металла фазовых или адсорбционных слоев, тормозящих анодный
процесс.
1.- область активного растворения металла:
2.- активно-пассивное состояние металла;
3.- пассивное состояние металла;
4- нарушение пассивного состояния металла
4а - питтингобразование;
4б – перепассивация.
Рис. 12. Потенциостатическая анодная поляризационная кривая
В процессе пассивации происходит изменение электродного потенциала ме-
талла в положительную сторону. Например, железо в активном состоянии имеет
потенциал около (- 0,4 В), а в пассивном - (+ 1,0 В). Пассивность зависит от соста-
ва, структуры и состояния поверхности металла или сплава, состава агрессивной
среды, температуры, наложения постоянного тока, движения раствора и др. Соз-
дать пассивное состояние возможно изменением состава сплава, внешних условий
и состава агрессивной среды.
Способность к пассивации зависит от свойств металла. Так, никель легко
переходит в пассивное состояние под действием некоторых органических (уксус-
ной, лимонной, щавелевой) и минеральных (борной, ортофосфорной) кислот и в
растворах ряда нейтральных солей. Алюминий пассивируется в концентрирован-
ных растворах азотной и хромовой кислот; хром - в разбавленной азотной кисло-
те. Все указанные металлы пассивируются значительно легче, чем железо, поэто-
му при введении в состав железоуглеродистых сплавов легко пассивирующихся
металлов (Сг, Al, Ni) получают сплавы, коррозионная стойкость которых близка к
стойкости легирующего элемента, хотя его содержание в сплаве невелико.
В качестве окислителей - пасcиваторов могут быть использованы: НNО
3
,
КМnО
4
, K
2
Cr
2
O
7
,Н
2
O
2
, аэрированные растворы электролитов и др. Пассивирован-
ный металл или сплав при изменении внешних Факторов, связанных со свойства-
ми электролита, может вновь становиться активным. Вещества или процессы, вы-

35
зывающие этот переход, называются активаторами. Активацию могут вызвать
восстановители (H
2
, Na
2
SO
3
, Na
2
S
2
O
3
) некоторые ионы (Н
+
, Сl
-
, Br
-
, I
-
,SO
2
4
), ка-
тодная поляризация, повышение температуры, нарушение целостности пассивной
пленки на поверхности металла. В зависимости от свойств и концентрации пасси-
ватора и активатора в растворе возможны периодические переходы поверхности
металла из активного состояния в пассивное и наоборот.
3.12.Факторы, влияющие на электрохимическую коррозию металлов
Скорость и характер электрохимической коррозии металла зависят от мно-
гих факторов, перечисленных ниже
3.12.1. Химическая активность металла
В водных средах химическая активность металлов характеризуется значе-
нием обратимого равновесного окислительно-восстановительного потенциала:
чем меньше его значение, тем активнее металл. По химической активности метал-
лы подразделяют на четыре группы:
группа А - металлы, находящиеся в ряду стандартных окислительно-
восстановительных потенциалов от щелочных до Cd (Е
0
Me
< - 0,4В), корродируют
даже в нейтральных водных средах в отсутствие кислорода и других окислителей;
группа Б - металлы средней активности, находящиеся в ряду стандартных
окислительно-восстановительных потенциалов (-0,4 < Е
0
Me
<0,0В) от Cd до водоро-
да устойчивы в нейтральных средах при отсутствии кислорода и не устойчивы в
кислых растворах;
группа В - металлы малой активности, находящиеся в ряду стандартных
окислительно-восстановительных потенциалов от водорода до Ag (0 < Е
0
Me
<0,8 В),
устойчивы в нейтральных и кислых растворах при отсутствии кислорода;
группа Г - благородные металлы, находящиеся в ряду стандартных окисли-
тельно-восстановительных потенциалов правее серебра, (Е
0
Me
> 0,08 В), устойчивы
во всех средах, кроме кислых в присутствии сильных окислителей.
Положение металла в периодической системе Д. И.Менделеева не ха-
рактеризует однозначно его коррозионную стойкость. Однако, ряд закономерно-
стей и периодически повторяющихся свойств можно проследить в этой системе и
в отношении коррозионной характеристики металлов (табл.11). Наиболее неус-
тойчивые металлы находятся в подгруппах IА и IIА: щелочные и щелочноземель-
ные металлы. Металлы главных подгрупп, начиная со II (Be, Mg), склонны к об-
разованию пассивных оксидных пленок или пленок труднорастворимых вторич-
ных продуктов коррозии. Способность пассивироваться у этих металлов в каждой
подгруппе растет снизу вверх. Коррозионная стойкость металлов побочных под-
групп в значительной мере определяется их термодинамической устойчивостью,
которая растет в каждой подгруппе сверху вниз. Наиболее коррозионностойкие
металлы находятся в VI периоде в группе VIIIB(Оs, Ir, Рt: ) и в группе IВ (Аu).

36
Таблица 11 Периодическая система элементов Д. И. Менделеева
3.12.2. Состояние поверхности металла. Кристаллографический фак-
тор.
Структурная гетерогенность сплавов
Тонкая обработка (тонкая шлифовка, полировка), как правило, повышает
коррозионную стойкость металлов, облегчая образование более совершенных и
однородных пассивных защитных пленок, а также повышает предел коррозион-
ной усталости. Кристаллическая структура металлов и наличие различных струк-
турных дефектов сказывается на процессах коррозии металлов. При коррозии ме-
таллов в первую очередь растворяются неупорядоченные, неполные ряды кри-
сталлической решетки. С увеличением плотности упаковки атомов в кристалли-
ческой решетке скорость коррозии уменьшается. Дефекты структуры, выходящие
на поверхность металла, обладают повышенной реакционной способностью, и по
ним идет в первую очередь растворение металла.
Гетерогенность сложно влияет на коррозионную стойкость сплавов. Следу-
ет отметить следующие случаи. Если анодная фаза распределена так, что непре-
рывно пронизывает весь сплав, коррозия сплава ускоряется. Причем коррозия
проникает вглубь металла, частицы катодной составляющей при этом выпадают,
обнажая новые участки анодной составляющей. Возникает избирательная корро-
зия. Коррозионная стойкость гомогенных твердых растворов скачкообразно воз-
растает, когда концентрация легирующего элемента достигает 1/8 атомной доли
или величины, кратной этому числу, то есть n/8.

37
Объясняется это возникновением "сверхструктур" в твердом растворе, при
котором возможно появление защитных плоскостей в решетке сплава, обогащен-
ных или сплошь занятых атомами устойчивого элемента. Например, атомами Аu в
твердом растворе (Сu + Аu). При действии агрессивной среды на сплав разруша-
ется несколько атомных слоев сплава, до тех пор, пока не будут достигнуты за-
щитные плоскости из коррозионно устойчивых элементов, после чего скорость
коррозии резко снижается.
3.12.3. Влияние кислотности раствора
Кислотность раствора влияет на скорость электрохимической коррозии, из-
меняя потенциал катодных реакций, в которых участвуют H
+
или ОН
-
- ионы, а
также влияя на растворимость продуктов коррозии и возможность образования
защитных пленок на поверхности корродирующего металла. Все металлы по ха-
рактеру зависимости электрохимической коррозии от рН раствора можно разде-
лить на пять групп (рис. 13).
1). Металлы, устойчивые как в кислых, так и в щелочных раствоpax (Аu, Pt,
Ag.), скорость коррозии которых не зависит от рH (рис.13,а).
2). Металлы, малостойкие в кислых, недостаточно стойкие в нейтральных и
коррозионно стойкие в щелочных средах (Мg, Мn) (рис.13,б). Эти металлы по-
крыты защитными гидроксидными пленками, растворимыми в кислотах и нерас-
творимыми в щелочах (р
ИС
.13,б).
3). Металлы, неустойчивые в кислых, но коррозионно стойкие в щелочных
растворах (Ni, Co, Cd…), благодаря защитным свойствам оксидных и гидроксид
ных пленок (рис13,в).
Рис.13. Основные типы кривых зависимости скорости коррозии (K
m
, от рН
среды (добавки HCI или NaOН)
a-Au, Pt, Ag; б-Mg, Mn; в-Ni, Ca, Cd;
г-Ta, W, Mo; д-Zn, Al, Pb, Sn, Be, Cu
4). Металлы коррозионно стойкие в кислых, но неустойчивые в щелочных
растворах (Ta, W, Mo…). Это обусловлено кислотным характером оксидных за-

38
щитных пленок (рис.13,г).
5) Металлы, коррозионно стойкие в нейтральных растворах, но неустойчи-
вые как в кислых, так и в щелочных растворах (Zn, Аl, Рb, Сu, Sn, Be…). Это объ-
ясняется амфотерными свойствами оксидных и гидроксидных пленок. Значения
рН, соответствующие минимальной скорости коррозии этих металлов, являются
характерной величиной для каждого из них: например, для Аl рН=7; для Рb рH=8
(рис. 13,д).
Скорость коррозии металла зависит от природы кислоты. Например, обра-
зование плохорастворимого PbSO
4
на свинце в растворе серной кислоты корро-
зию замедляет. Возможность растворения оксидной пленки в результате комплек-
сообразования скорость коррозии увеличивает
3.12.4. Влияние природы соли
Cкорость электрохимической коррозии металлов в растворах солей зависит
от природы соли и ее концентрации, причем зависимость может быть различной.
1).Водные растворы гидролизующихся солей влияют на скорость коррози-
онного процесса в зависимости от того, уменьшают они рН раствора (например,
ZnCl
2
) или увеличивают его (например, Na
2
СО
3
). С изменением концентрации та-
ких солей растет кислотность или щелочность раствора и. соответственно изменя-
ется скорость коррозии.
2).Если соль, растворенная в воде, может взаимодействовать с первичными
продуктами коррозии с образованием плохорастворимого продукта, скорость
коррозии уменьшается. Например, пленки карбонатов или фосфатов железа на
железе в растворах солей угольной или фосфорной кислот.
3).Соли, образующие с ионом корродирующего металла комплексное со-
единение, скорость коррозии металла значительно увеличивают. Например, при-
сутствие фторид-иона в растворе увеличивает скорость коррозии железа в резуль-
тате реакции: Fe
3+
+ 6F
-
[FeF
6
]
3- .
Скорость коррозии металлов, об-
разующих устойчивые аммиакатные комплексы, увеличивается в присутствии со-
лей аммония.
4).Растворы солей, обладающих окислительными свойствами, повышают
скорость электрохимической коррозии металлов. Например, коррозия железа в
растворах персульфатов или железа в растворе медного купороса. С увеличением
концентрации cоли-окислителя скорость коррозии увеличивается. Однако некото-
рые соли-окислители пассивируют металл. Например, скорость коррозии железа в
растворах нитратов и нитритовуменьшается.
5) в растворах солей, не вступающих в химическое взаимодействие с метал-
лом или его первичными продуктами коррозии, скорость коррозии металла с уве-
личением концентрации соли увеличивается, достигает некоторого максимально-
го значения, после чего снижается (рис. 14)

39
1 2. 3 4
Рис.14. Влияние концентрации соли на скорость коррозии (K
m
)
стали при 20
0
C
Это объясняется двумя факторами: увеличением электропроводности рас-
твора с увеличением концентрации соли, но уменьшением, одновременно, рас-
творимости кислорода в концентрированных растворах солей. В каком-то интер-
вале концентраций сильнее сказывается первый фактор, а затем преобладает вто-
рой.
3.12.5. Влияние температуры
Температура оказывает в большинстве случаев значительное влияние на
скорость электрохимической коррозии металлов, так как изменяет скорость диф-
фузии, перенапряжение электродных процессов, растворимость кислорода, ок-
сидных пленок и вторичных продуктов коррозии. При электрохимической корро-
зии металлов, протекающей с водородной деполяризацией, повышение темпера-
туры электролита снижает перенапряжение водорода и наблюдается экспоненци-
альная зависимость скорости коррозии от температуры (рис. 15,а).
Рис.15.
Влияние температуры на скорость коррозии (К
г
)
стали
При электрохимической коррозии металлов в нейтральных раствоpax, про-
текающей с кислородной деполяризацией, повышение температуры снижает пе-
ренапряжение ионизации кислорода и ускоряет диффузию кислорода к поверхно-
сти металла, но уменьшает растворимость кислорода. Если кислород не может
выделяться из раствора при повышении температуры, (замкнутая система, напри-
мер, паровой котел), то скорость коррозии железа непрерывно возрастает (рис.
15,б). Если кислород может выделяться из раствора с повышением температуры,
(открытая система, например, водонапорный бак), зависимость скорости коррозии
металла от температуры имеет вид кривой с максимумом (рие.15,в). В ряде случа-
ев влияние температуры на скорость электрохимической коррозии металла обу-
40
словлено изменением свойств защитной пленки. Так, например, при температуре
50-95°С на цинке образуется зернистая, плохо сцепленная с поверхностью метал-
ла пленка вторичных продуктов коррозии со слабыми защитными свойствами. В
этой области температур электрохимическая коррозия цинка идет с наибольшей
скоростью. Следует помнить, что разная температура различных участков конст-
рукции приводит к возникновению термогальванических коррозионных пар.
Повышение температуры влияет не только на скорость коррозии, но и на
полярность электродов. Например, при высоких температурах в гальванической
паре Fe-Zn, потенциал цинка увеличивается, и цинк становится катодом по отно-
шению к железу.
3.12.6. Влияние давления
С увеличением давления скорость электрохимической коррозии может уве-
личиваться в результате нескольких факторов.
1) Изменение растворимости газов, участвующих в коррозионном про-
цессе. Например, ускорение коррозии стали в водных растворах при повышении
давления воздуха, кислорода или углекислого газа;
2) Появление механических напряжений в металле.
3.12.7. Влияние контакта, с другими металлами
Два металла, находящиеся в контакте друг с другом и имеющие разные
электродные потенциалы, образуют в электролите гальванический элемент, рабо-
та которого влияет на скорость коррозии каждого из этих металлов: коррозия бо-
лее электроотрицательного металла обычно увеличивается, а коррозия более
электроположительного металла, ослабляется или иногда полностью прекращает-
ся.
3.12.8. Влияние внешнего тока.
Электрический ток, протекающий через электролит, в котором находится
металлическая конструкция, влияет на скорость и характер распределения корро-
зионного разрушения. Если электрический ток постоянный, то участки металла,
где положительные заряды (катионы) выходят в электролит, являются анодами и
подвергаются электрокоррозии - дополнительному растворению, пропорциональ-
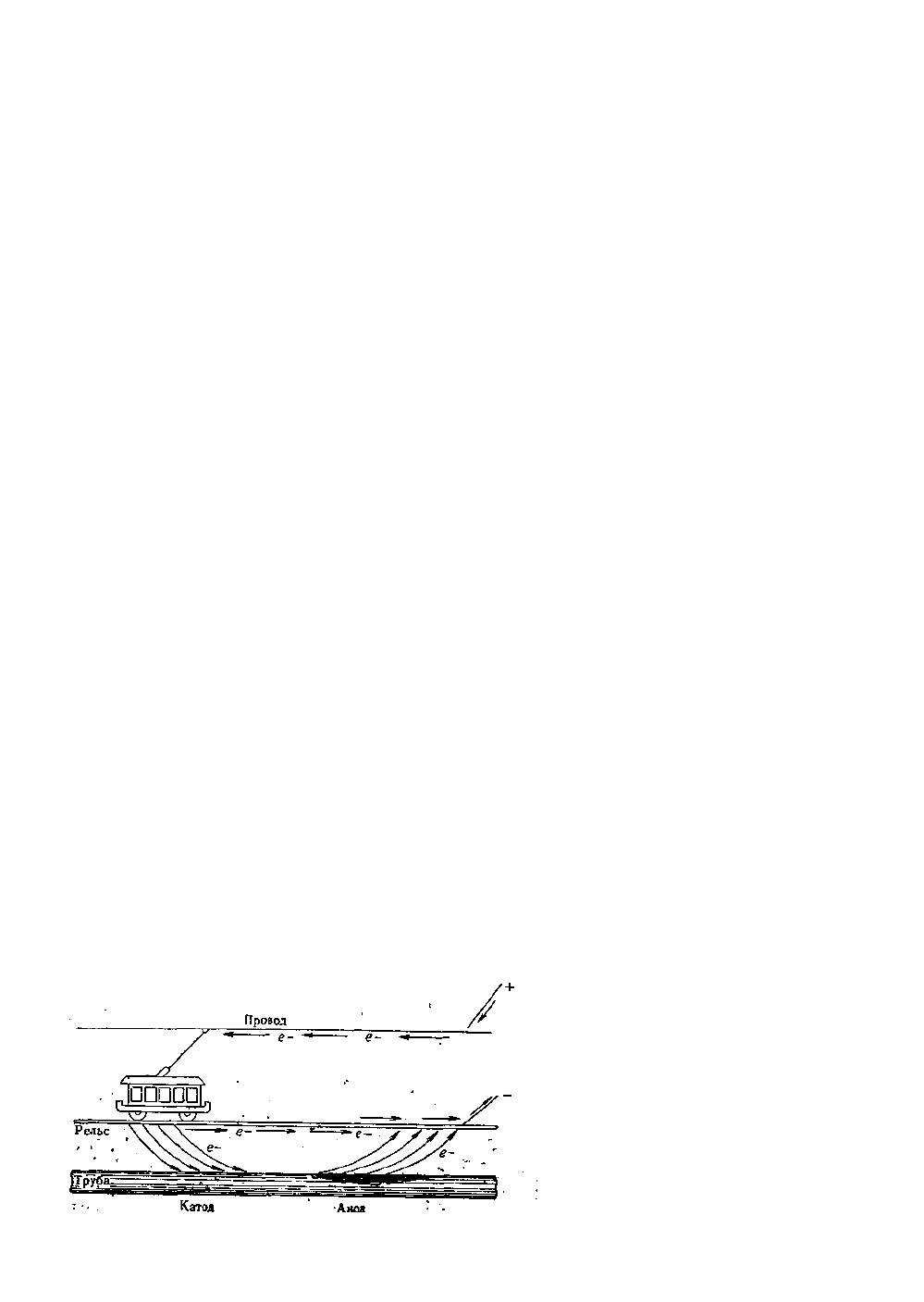
ному этому току (рис .16).
Рис.16. Коррозия под действием блуждающих токов
