Молявко М.А.,Чалова О.Б. Коррозия металлов
Подождите немного. Документ загружается.


11
Таблица 3
Значения фактора Пиллинга-Бэдвордса для некоторых металлов
α =
Me
okc
V
V
Металл
Оксид
α
М
е
талл
Оксид
α
М
е
талл
Оксид
α
Li
Li
2
O
0,57
Co
CoO
1,27
Mo
Mo
О
2
2,18
Nа
Na
2
О
0,59
U
UO
2
1,96
Mo
MoO
3
3,45
К
К
2
O
0,48
U
U
3
O
8
3,12
W
W
O
2
1,86
Mg MgO 0,79 AI AI
2
O
3
1,31 W WO
3
3,36
Са
CaO
0,63
Ti
T
I
O
2
1,76
Fe
FeO
1,77
Sr SrO 0,66 Zr ZrO
2
1,60 Fe Fe
3
O
4
2,09
Ва
BaO
0,73
Sn
Sn
O
2
1,33
Fe
Fe
2
O
3
2,14
С
u
С
u
2
О
1,67
Pb
Pb
O
1
,15
Co
CoO
1,75
Ag Ag
2
O 1,58 Nb NbO 1,57 Co Co
3
O
4
2,00
Be
BeO
1,67
Ta
Ta
2
O
5
2,32
Ni
NiO
1,52
С
u
С
u
О
1,74
Nb
N
b
2
O
5
2,81
Co
Co
2
O
3
2,42
Zn
ZnO
1,58
Cr
Cr
2
O
3
2,02
Pt
PtO
1,56
мере утолщения пленки. Следовательно, скорость роста пленки продуктов обрат-
но пропорциональна ее толщине, а зависимость толщины пленки от времени кор-
розии описывается параболической зависимостью:
y
2
= кτ + const.
Большинство применяемых в технике металлов окисляются по параболиче-
скому закону; к ним относятся: Сu, Ni (t>500°C), Zn, Cd, Sn и дp.
Для некоторых металлов: [Сu (t< 100
0
C), Та (t > 150
0
C) Ni (t<650°C), Fe (t <
400°C), Al, Cr] наблюдается более медленный рост пленки, чем это следует из па-
раболического закона. Для этих металлов характерна логарифмическая зависи-
мость между толщиной пленки и временем ее роста: y = ln(kτ). Такие пленки об-
ладают высокими защитными свойствами.
Пленки подразделяют на тонкие (до 40 нм), средние (от 40 до 500 нм.) и
толстые (более 500 нм). Пленки толщиной 40-50нм, соизмеримой с длиной волны
видимых световых лучей, окрашены в цвета "побежалости". Пленка должна иметь
некоторую оптимальную толщину, чтобы тормозить встречную диффузию моле-
кул окислителя и ионов металла. Наибольшим защитным эффектом обладают
сплошные тонкие пленки, для них α=1,2…1,6.
Состав оксидных пленок по толщине не однороден. Например, на железе
состав пленки изменяется от FeO через Fe
3
O
4
до Fe
2
O
3
(рис. 2в).

12
Рис.2. Схема образования оксидной пленки: а - пористой;
б - сплошной защитной; в - на поверхности железа
Оксид железа (III) образуется до температуры 100°C, a Fe
3
О
4
, при 400-
575°С. Эти оксиды имеют кристаллическую решетку сложного строения и про-
цессы диффузии кислорода в них затруднены, тогда как FeО образуется при тем-
пературе выше 575°С и имеет простую решетку гранецентрированного куба, со-
держащую дефекты, в результате чего FeO не обладает свойствами защитной
пленки. Наилучшие по стойкости оксидные пленки обладают структурой шпине-
лей состава MeO∙Mе
2
O
3
. Образуясь на поверхности сплавов, они служат надеж-
ной защитой от коррозии, например, FeO∙Cr
2
O
3
, NiO∙Cr
2
O
3.
По достижении определенной толщины пленки на некоторых металлах на-
чинают растрескиваться, давая возможность химической коррозии развиваться
дальше. Разрушение пленки возможно по ряду причин. Если объем пленки боль-
ше объема металла, на месте которого она образовалась, то это приводит к появ-
лению внутренних напряжений, сжимающих пленку параллельно поверхности и
стремящихся оторвать ее от металла. При высоких внутренних напряжениях
пленки разрушаются. Очевидно, важны механические свойства пленок: проч-
ность, упругость, пластичность. Скорость коррозии возрастает с увеличением
температуры из-за повышения скорости диффузии и изменения защитных свойств
пленки. Резкие температурные изменения вызывают быстрое разрушение пленки,
что зависит от величины коэффициента термического расширения металла и
пленки. Зависимость скорости коррозии от температуры выражается приблизи-
тельно уравнением
RT
Еакт
еAK
, где
К - константа скорости коррозии;
А - постоянная величина;
R - газовая постоянная;
Е
акт
. - энергия активации;
Т - температура, К.
Следует иметь в виду, что это соотношение может нарушаться, если изме-
няются структура или свойства металла или пленки при изменении температуры.
2.3. Влияние состава газовой среды
Конструкции из железа, стали и чугуна очень часто подвергаются воздейст-
вию температуры и газов: кислорода, воздуха, водорода, соединений серы, уг-
лерода и др. При высокой температуре образование оксидного слоя на поверхно-
сти сопровождается диффузией газов вглубь металла. Это приводит к изменению

13
состава сплава за счет окисления легирующих компонентов. Например, при тем-
пературах выше 700°С протекает обезуглероживание стали и чугуна в соответст-
вии с реакциями:
Fe
3
C + O
2
3Fe + CO
2
Fe
3
C + H
2
O
3Fe + CO + H
2
Fe
3
C + CO
2
3Fe + 2CO
Снижение концентрации углерода в поверхностном слое стали, приводит к
изменению структуры сплава, и ухудшает механические свойства, особенно пре-
дел усталости и предел прочности при растяжении. При коррозии чугуна проис-
ходит увеличение его объема за счет окисления железа в результате проникнове-
ния агрессивных газов по границам зерен и включениям графита.
При высоких температурах возможно окисление железа диоксидом угле-
рода: Fe + CO
2
FeO + CO
или парами воды: Fe + H
2
O
FeO + H
2
Особенно опасна при повышенных температурах водородная коррозия.
Она обуславливается способностью водорода к адсорбции, диффузии и растворе-
нию в металле. Молекулярный водород, проникая в металл, распределяется в де-
фектах кристаллической решетки или по границам зерен. При повышенных тем-
пературах водород растворяется во многих металлах. Образовавшиеся соединения
-гидриды металлов - являются хрупкой фазой, резко снижают пластичность, при-
водят к возникновению больших растягивающих напряжений и внутрикристал-
литному растрескиванию.
С железом водород образует твердый раствор, который характеризуется вы-
сокой хрупкостью и малой прочностью. Растворенный водород обезуглероживает
сталь:
Fe
3
C + 2Н
2
3Fe + СН
4
,
Образовавшийся метан не выделяется из металла, а скапливается по грани-
цам зерен, и в результате возникающего высокого давления происходит внутри-
кристаллитное растрескивание. Растворенный в железе водород реагирует с окси-
дами, восстанавливая их:
FeO + Н
2
Fe + H
2
Q
(газ)
Образовавшиеся пары воды ослабляют связь между кристаллитами, что
приводит к хрупкости, созданию внутреннего давления и к дальнейшему растрес-
киванию металла.
Монооксид углерода СО при высокой температуре и давлениях разрушает
сталь, никель и другие металлы. Так, железо начинает реагировать с ним при тем-
пературе выше 120°С с образованием комплексного соединения - пентакарбонил
железа:
Fе + 5СО Fe(CО)
5
,
а никель - при 200°С:
Ni + 4CO Ni(CО)
4
При высоких температурах (табл.4) большинство металлов разрушается под
действием сухого хлора и хлороводорода. Наиболее стойкими в среде этих газов
являются никель и его сплавы, а также нержавеющая сталь. Продуктами коррозии
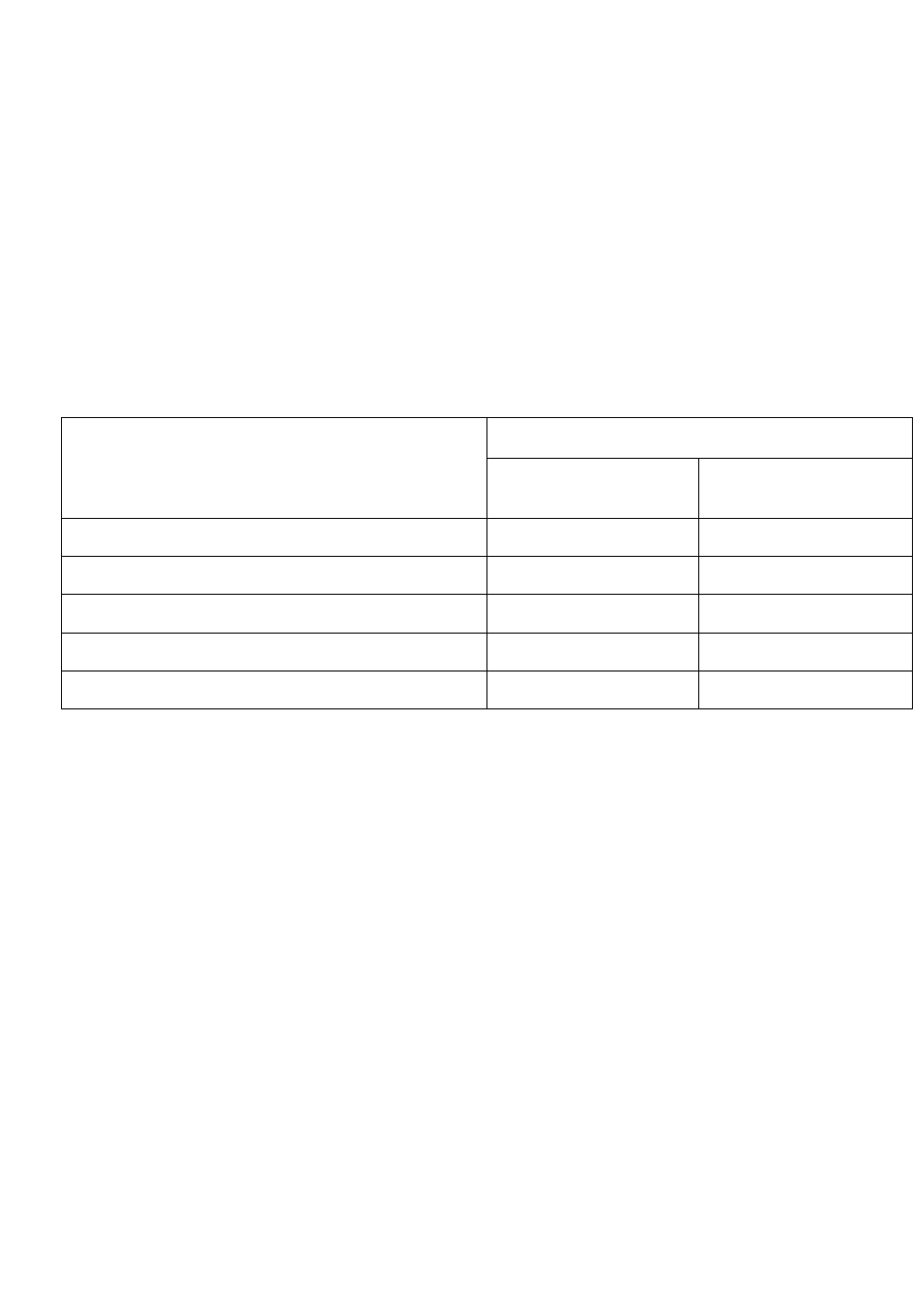
14
в среде Cl
2
и HCl являются хлориды металлов, которые, как правило, характери-
зуются меньшими температурами кипения и плавления, чем оксиды металлов или
металлы, и не обладают защитными свойствами.
Газовые смеси, содержащие соединения серы разрушают железо, сталь,
чугун и цветные металлы при нагревании, особенно в присутствии паров воды.
Газы, содержащие SO
2
и H
2
S интенсивно разрушают углеродистые стали при
300°С, а медь - при комнатной температуре. Никель подвергается коррозии в сре-
де этих газов при температуре 300
0
С. Хром устойчив к серосодержащим газам,
так как на его поверхности образуется сульфид хрома Cr
2
S
3
, обладающий защит-
ными свойствами в отсутствии воды.
Таблица 4
Верхние допустимые температуры применения металлов и сплавов в сухом
хлоре и хлороводороде
Температура, °С, Металл
в атмосфере
хлора
в атмосфере
хлороводорода
алюминий 100 150
медь 100 120
углеродистая сталь 150 350
нержавеющая сталь 300 600
никель 550 500
Аналогично алюминий устойчив к воздействию сероводорода до 500°С. По-
этому высокохромистые стали (20-30%Cr) с добавками алюминия (4-5%Al) ус-
тойчивы к воздействию этих газов при температурах до 1000°С.
2.4. Коррозия металлов в жидких неэлектролитах
Неэлектролиты - это растворы, не проводящие электрический ток. К ним
относятся:
неорганические вещества - жидкий бром, расплавленная сера и др.;
органические вещества: - бензол, четыреххлористый углерод, хлороформ,
смазочные масла; жидкое топливо: нефть, керосин, бензин и др.
Механизм химической коррозии металлов в жидкостях - неэлектролитах
включает ряд стадий:
1). диффузия реагента (окислителя) к поверхности металла;
2). хемосорбция реагирующих частиц на металле;
3). химическая реакция реагента с металлом;
4). десорбция продуктов реакции с поверхности металла;
5). диффузия продуктов реакции от металла в объем неэлектролита.

15
Если стадия 3 приводит к образованию пленки продуктов коррозии металла,
то последние стадии 4 и 5 могут отсутствовать и происходит самоторможение
процесса.
Жидкий бром при обычных условиях взаимодействует со многими метал-
лами. Заметно разрушает углеродистую сталь и титан, меньше - никель и незна-
чительно - железо, свинец, платину, золото.
Расплавленная сера реагирует почти со всеми металлами. Сильно разъеда-
ет медь, олово, свинец, меньше - углеродистую сталь и титан и незначительно раз-
рушает алюминий.
Химическая коррозия в неводных средах возникает при эксплуатации хи-
мико-технологического оборудования. Жидкое топливо, углеводороды и орга-
нические растворители без примесей и при отсутствии воды не активны по от-
ношению к металлам и не разрушают их. Примеси делают жидкое топливо корро-
зионно активной средой для металлов. Например, примесь йода, растворенного в
хлороформе, реагирует с серебром с образованием пленки нерастворимого в хло-
роформе иодида серебра по уравнению;
2Ag + I
2
(в хлороформе) = 2AgI .
Рост пленки иодида серебра подчиняется параболическому закону, т.е. кон-
тролируется диффузией реагента через нее.
Нефть - коррозионно не активный неэлектролит. Но если в нефти содер-
жатся примеси, такие как сульфиды, меркаптаны (RS R', RSH), то она
становится
коррозионно активной средой. Эти примеси разрушают кобальт, медь, серебро,
свинец с образованием соответствующих меркаптидов или сульфидов.
RSR' + Me
MeS + R - R'
RSH + Me
Me (SR)
2
+ H
2
,
где R, R' - органические радикалы.
Содержание сероводорода в нефти делает ее агрессивной средой для желе-
за, свинца, серебра, меди. В этой среде образуются пленки сульфидов металлов
(FeS, PbS, Ag
2
S, CuS):
2 Me + 2H
2
S + O
2
2MeS + 2H
2
O
Разрыв ковалентных связей в органических соединениях легче происходит
при высоких температурах. Особенно легко перестройка идет в присутствии
следов воды..
Бензин прямой гонки при отсутствии воды практически не действует на
технически важные металлы. Крекинг-бензины и сырые фенолы при взаимодей-
ствии с железом, медью, магнием, свинцом, цинком осмоляются, их кислотность
повышается и вызывает коррозию металла. Устойчивы в крекинг-бензинах алю-
миний и их сплавы, а также коррозионностоккие стали. Попадание в органиче-
ские неэлектролиты воды весьма значительно активирует действие примесей в
неэлектролитах и вызывает разрушение металлов, особенно в присутствии кислот
или солей. В присутствии воды изменяется механизм коррозионного процесса, и
коррозия протекает по электрохимическому механизму.

16
3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимической коррозией называется самопроизвольное разрушение
металла в результате химического взаимодействия с электролитически проводя-
щей средой. Этот тип коррозии широко распространен и может протекать во
влажной атмосфере, в растворах или расплавах электролитов: солей, кислот, ще-
лочей. По механизму электрохимической коррозии протекают атмосферная и
почвенная коррозии, коррозия грунтовыми, речными и морскими водами. Она со-
путствует многим разнообразным технологическим процессам: нефтегазопромы-
словым, транспортировки и переработки нефти, газа. При электрохимической
коррозии на металле одновременно протекают две реакции:
анодная: ионизация атомов металла (Me) с переходом в раствор электроли-
та катионов металла:
Me → Me
n+
+ ne (2.1)
и катодная: восстановление окислителя (Ох), присутствующего в среде
электролита:
Ох + nе → Red (2.2)
(Red - восстановленная форма окислителя).
Реакции (2.1) и (2.2) являются сопряженными, связанными между собой ба-
лансом электрических зарядов: число электронов, "отданных" восстановителем-
металлом равно числу электронов, принятых окислителем. Следует обратить
внимание, что при электрохимической коррозии катион металла связывается не
окислителем, а другим компонентом коррозионной среды, способным сольвати-
ровать катионы, например,
Me
n+
+ mH
2
O
[Me(H
2
O)
m
]
n+
Или образовывать комплексные соединения:
Me
n+
+ mL
[MeL
m
]
n+
,
где L - молекула или ион лиганда. Например, молекула аммиака (NH
3
) или
гидроксид-ион (OH
-
).
По этой причине состав коррозионной среды оказывает существенное влия-
ние на процессы коррозии.
К коррозии металла приводит протекание анодной реакции (2.1). Если по-
верхность металла и коррозионная среда однородны, реакция (2.1) протекает с
одинаковой скоростью в любой точке поверхности металла и металл растворяется
равномерно (равномерная сплошная коррозия). Поверхность реальных металлов и
сплавов обычно неоднородна. Различной по составу может быть и коррозионная
среда. Это приводит к тому, что анодная реакция ионизации атомов металла со-
средоточивается на отдельных небольших участках поверхности металла, т.е.
идет локальная коррозия.
Как равномерная, так и локальная коррозии протекают как электрохимиче-
ский процесс с осуществлением анодной и катодной реакции на различных участ-
ках металла и возникновением электрического тока в системе. Известны экспери-
ментальные факты, согласно которым, например, при коррозии железа, хрома,
сплавов Fe - Сг в горячей концентрированной серной кислоте наряду с электро-
химической протекает химическая коррозия, не зависящая от потенциала корро-

17
зии. Однако число подобных фактов незначительно. Наибольшее значение имеют
процессы, протекающие по электрохимическому механизму.
3.1. Термодинамические аспекты электрохимической коррозии
Для оценки термодинамической неустойчивости металла расчет изменения
энергии Гиббса можно осуществить по суммарному уравнению электрохимиче-
ской коррозии и табличным данным по стандартным термодинамическим функ-
циям (∆Н
298
, S
0
298,
∆G
0
298
) исходных веществ и продуктов. При электрохимической
коррозии металлов в водной среде для расчетов удобнее пользоваться электрохи-
мическими данными - электродными потенциалами. Термодинамически возможен
процесс электрохимической коррозии, для которого соблюдается условие
∆G
т
= - n F ∆E < 0,
где n - число электронов, участвующих в электрохимическом процессе;
F - число Фарадея. (F = 96486 кл/моль);
∆Е = (Е
к
. - Е
а
) - электродвижущая сила процесса, определяется как раз-
ность равновесных потенциалов катодной (Е
к
) и анодной (Е
а
) реакций.
Таким образом, электрохимическая коррозия металла в водной среде будет
происходить, если ∆Е>0, то есть в растворе присутствует окислитель, равновес-
ный потенциал которого больше равновесного потенциала металла:
E
а
=Е
Mе
< Е
к
= Е
ох
.
Равновесный (обратимый) окислительно-восстановительный потенциал (Е)
рассчитывают по уравнению Нернста
E = E
0
+
d
ox
a
a
nF
RT
Re
lg
3,2
Е° - стандартный окислительно-восстановительный потенциал электрохи-
мической системы (табл.5);
R = 8,31 Дж/моль, - газовая постоянная,
Т - температура, К;
а
ox
, a
Red
– активные концентрации окисленной и восстановленной форм
электрохимической системы,
Равновесный потенциал анодной реакции (2.1) равен
Еа = E
Me
= E
0
Me
+ lg
3,2
nF
RT
a
Me
n+
, где
Е°
Me
-стандартный окислительно-восстановительный потенциал системы
(2.1), (табл.5)
a
Me
n+
- активность ионов металла в растворе ;
a
Red
= a
Me
= 1 для индивидуального чистого металла.
Для расчета равновесного потенциала катодной реакции (Е
к
) нужно знать,
какой компонент коррозионной среды является окислителем. В водной среде, как
правило, им являются ионы водорода и растворенный кислород. Катодный про-
цесс с водородной деполяризацией осуществляется в соответствии с уравнением
2H
+
+ 2ē → Н
2
; (рН < 7, кислая среда) (2.3)
2Н
2
O + 2ē → Н
2
+ 2OН
-
; (рН ≥ 7, нейтральная или щелочная среда).

18
Таблица 5
Ряд стандартных окислительно-восстановительных
(электродных) потенциалов
Электро
д
ный про
-
E°,B
Электро
д
ный про
-
Б , В
цесс
цесс
Li=Li
+
+e
-
3,045
Cd=Cd
2+
+2e
-
0,403
Rb=Rb
+
+e
-
2,925
In
=
I
n
3+
+3e
-
0,340
К=К
+
+е
-
2,924
Tl=Tl
+
+e
-
0,336
Cs=Cs
+
+e
-
2,923
Co=Co
2+
+2e
-
0,277
Ва=Ва
2+
+
2е
-
2,905
Ni=Ni
2+
+2e
-
0,250
Sr=Sr
2+
+2e
-
2,888
Mo=Mo
3+
+3e
-
0,200
Ca
=
Ca
2
+2e
-
2,866
Sn=Sn
2+
+2e
-
0,136
Na=Na
+
+e
-
2,714
Pb=Pb
2+
+2e
-
0,126
Ac=A
c
3+
+3e
-
2,600
W=W
3+
+3e
-
0,050
La=La
3+
+3e
-
2,522
H
2
=2H
+
+2e
0,000
Y=Y
3+
+3e
-
-
2,372
Ge=Ge
2+
+2e
0,050
M
g=Mg
2+
+2e
-
2,363
Sb=Sb
3+
+3e
0,150
Sc=Sc
3+
+3e
-
2,077
Bi=Bi
3+
+3e
0,215
Be=Be
2+
+
2e
-
1,847
Re=Re
3+
+3e
0,300
H
f
=H
f
4+
+4e
-
1,700
Cu=Cu
2+
+2e
0,337
Al=A
l
3+
+3e
-
1,663
Tc=Tc
2+
+2e
0,400
Ti=Ti
2+
+2e
-
1
,603
Ru=Ru
2+
+2e
0,450
Zr=Zr
4+
+
4e
-
1,539
Rh=Rh
2+
+2e
0,600
Mn
=
Mn
2+
+
2e
-
1,179
Ag=Ag
+
+
e
0,799
V=V
2+
+2e
-
1,175
Hg=Hg
2+
+2e
0,850
Nb=Nb
3+
+3e
-
1
,100
Os=Os
2+
+2e
0,850
Zn=Zn
2+
+2e
-
0,763
Pd=Pd
2+
+2e
0,987
Cr=
Cr
3+
+3e
-
0,744
Ir=Ir
3+
+3e
1,150
Ga=Ga
3+
+3e
-
0,530
Pt=Pt
2+
+2e
1,188
Fe=Fe
2+
+2e -0,440 Au=Au
3+
+3e 1,498
Равновесный потенциал системы (2.3) рассчитывают по уравнению:
E
Н
+
/Н2
= E
Н
+
/Н2 +
2
2
lg
2
3,2
H
H
P
a
F
RT
E
Н
+
/Н2
- стандартный окислительно-восстановительный потенциал системы
(2.3), то есть «водородного электрода»;
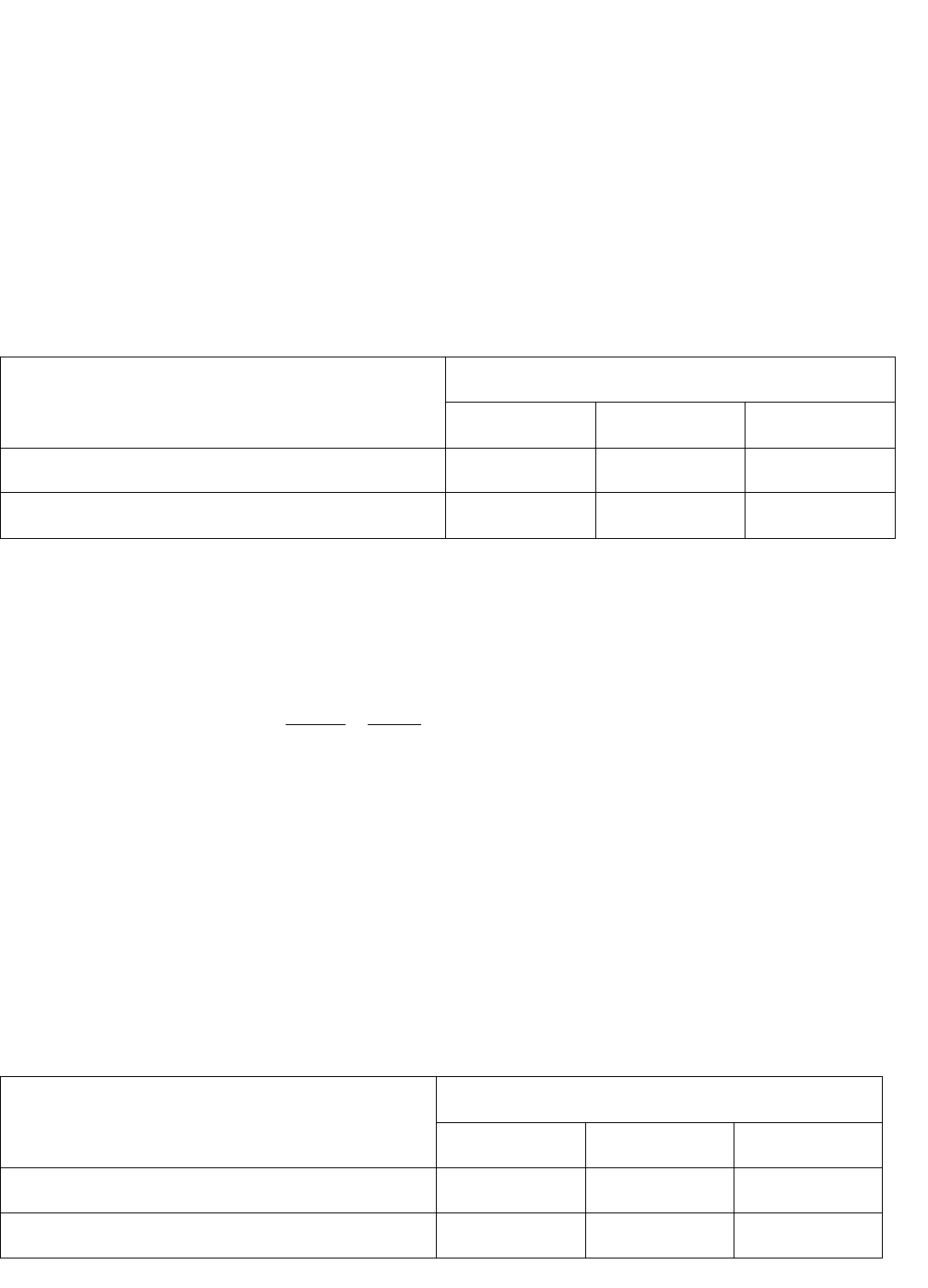
19
Р
H2
- парциальное давление водорода;
a
H
+
- активность ионов Н
+
в растворе.
Если Р
H2
= 1атм, для температуры 298 К, получим E
Н
+
/Н2
= 0,059 lg a
H
+
E
Н
+
/Н2
= - 0,059 рН (2.4)
где рН = - lg a
H
+
- водородный показатель.
Коррозия металлов с водородной деполяризацией в большинстве случаев
протекает в электролитах, соприкасающихся с атмосферой, парциальное давление
водорода в которой Р
Н2
= 5 10
-7
атм.= 0,057Па. Соответствующие значения потен-
циалов «водородного электрода» (Ен
+
/н
2
) приводятся в табл. 6.
Таблица 6
Обратимый окислительно-восстановительный потенциал «водородного элек-
трода» (Ен
+
/н
2
) при 298 К и различных значениях рН среды и Рн
2
Ен
+
/н
2
, В
Рн
2
, атм.
рН = 0 рН = 7 рН = 14
5 10
-7
+0,186 - 0,228 -0,641
1 0 - 0,414 - 0,828
Катодный процесс с кислородной деполяризацией протекает в соответ-
ствии с уравнением:
О
2
+ 4Н
+
+ 4ē → 2Н
2
О (рН < 7, кислая среда) или:
О
2
+2Н
2
О + 4ē → 4ОH
-
(рН > 7, нейтральная или щелочная среда) (2.5)
Равновесный потенциал электрохимической системы (2.5) равен
E
O2
/
OH
-
= E
0
O2/OH
-
+
OH
O
a
P
F
RT
4
2
lg
4
3,2
E
0
O2/OH
-
= 0,401В - стандартный окислительно-восстановительный потенциал
системы (2.5);
PQ
2
- парциальное давление кислорода;
a
OH
-
- активность ионов 0Н
-
в растворе.
Учитывая, что a
OH
-
= K
H2O
/ a
H
+
,
ионное произведение воды К
H2O
= 1,27 10
-14
при T = 298 К и при PQ
2
= 1атм,
получим
Ео
2
/он
-
= 1,23 - 0,059 рН . (2.6)
Таблица 7
Обратимый окислительно - восстановительный потенциал «кислородного
электрода» Ео
2
/он
-
при 298К и различных значениях рН среды и Po
2
Ео
2
/он
-
, В
Ро
2
, атм.
рН = 0 рН = 7 рН = 14
0,21 + 1,218 0,805 + 0,381
1 +1,229 0,815 +0,400
20
Коррозия металлов с кислородной деполяризацией в большинстве практи-
ческих случаев протекает в электролитах, соприкасающихся с атмосферой, парци-
альное давление кислорода в которой PQ
2
= 0,21 атм = 20,26 кПа. Соответствую-
щие значения потенциалов «кислородного электрода» EQ
2/OH-
приводятся в табл. 7
Для характеристики термодинамической устойчивости металлов - электро-
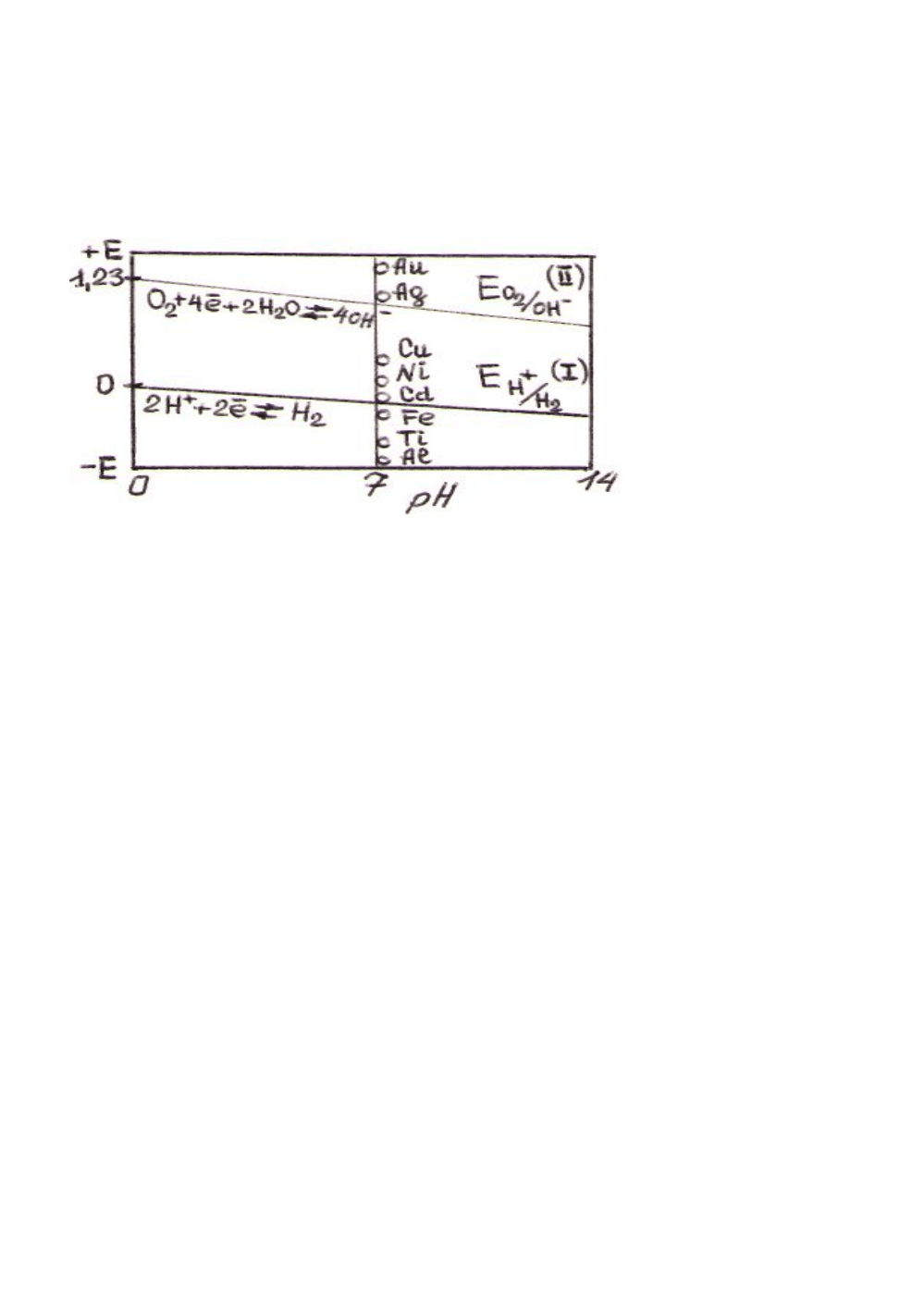
химических систем (2.1) - в водных растворах можно использовать диаграмму (Е–
рН) электрохимической устойчивости воды (рис.3).
Рис. 3. Диаграмма электрохимической устойчивости воды (Т = 298)
На диаграмме (рис.3) приведены графические зависимости равновесных по-
тенциалов «водородного» Ен
+
/н
2
(I) и «кислородного» Е
О2
/
ОН
-
(II) электродов от
рН, рассчитанные по вышеприведенным уравнениям (2.4) и (2.6) соответственно,
а также потенциалы для некоторых металлов. Металлы, потенциалы которых рас-
положены ниже линии (I), могут корродировать как под воздействием воды (ио-
нов Н
+
), так и растворенного О
2
, так как
Е
Ме
< E
H
+
/H2
и E
Me
< E
O2/OH
-
Если потенциал металла находится между линиями (I) и (II), то окислите-
лем, вызывающим коррозию металла, будет только растворенный кислород, так
как Е
Ме
> E
H
+
/H2
, но E
Me
< E
O2/OH
-
Коррозию благородных металлов, равновесный потенциал которых нахо-
дится выше линии (II), могут вызвать только более сильные окислители, чем H
+
или O
2
.
3.2. Диаграммы Пурбэ
Форма существования катионов металлов в водном растворе зависит от рН
и присутствия каких-либо компонентов коррозионной среды, способных связы-
вать катионы металлов. Гидратированные катионы металлов ( Ме
n+
) могут пре-
вращаться в оксокатионы МeО
+(n-2)
, гидроксокатионы (МеОН
+n-1
), гидроксиды
(Ме(OН)
n
), комплексные соединения, плохо растворимые соли.
Равновесие между металлoм, раствором, содержащим его ионы, и твердыми
кислородными соединениями этого металла удобно рассматривать на диаграмме
Пурбэ, по осям которой откладываются равновесный потенциал (Е) и значение
рН.
