Молочная промышленность март 2011 года
Подождите немного. Документ загружается.

N!!
3,
2011
М
О Л О
Ч
Н
А
Я
П
Р
О
М
Ы
W
Л
Е
Н
Н
О
С
Т Ь
1
69
Таблица2
Наименование
1
Содержание
1
заменителя
ПНЖК
,%
молочного
жира
1
Содержание
1
w
-б:
w
-3
транс-изомеров,
0
/о,
не
более
Tnn'
о
С
Использование
заменителей
мо
лочного
жира
Корпорации
<<
СОЮЗ
»
позволяет
:
СО
Ю
З
-
52
L
1
6-
18
11
- 13
СОЮЗ-53
20- 22 11- 13
СОЮЗ-60
21- 23 10- 12
СОЮЗ-7
1
20-
22
11
- 13
SOS
М
О
1
-16
23
- 25
11
- 13
SOS
М0
1
-17
23
- 25 11- 13
SDS
М01-20
16- 18
8- 10
SOS
МО
1
-21
15- 17 12- 14
SDS М
0
1
-22
15- 17
10- 12
SO
SM0
1-23 15- 17 10- 12
SD
SM0
1-24 15- 17 13- 15
SDS
МО
2-46
15- 17
12- 14
5
5
5
5
1
2
1
1
1
1
3
3
33-36
33-35
33-35
33-35
35-36
34-36
32-35
32- 35
33-36
28-32
30-34
33-36
•
получать
безопасную
и
качествен
ную
продукцию,
обладающую
повы
шенной
физиологической
ценностью
и
соответствующую
ГОСТу
;
•
формировать
желаемый
вкус
и
структурно-механические
свойства
продукта
;
ГОСТ
Р
53512-2009
<<
Продукты
сырные
.
Общие
технические
условия
• •
и
ГОСТ
Р
53502-2009
<<
Продукты
сырные
плав
леные
.
Общие
технические
условия
".
Использование
перечисленных
заменителей
молочного
жира
при
про
изводстве
спредов
и
смесей
топленых
дает
возможность
получать
вкусовой
профиль,
приближенный
к
сливочному
или
топленому
маслу
соответственно
,
а
также
получать
продукцию
,
соответ
ствующую
ГОСТ
Р
52100-2003
<<
Спре
ды
и
смеси
топленые
.
Общие
техниче
ские
условия
»
.
•
выпускать
продукцию
с
оптималь
ным
соотношением
цена-качество
,
но
с
более
высокими
сроками
год
ности;
•
добиться
высокой
технологичности
и
экономической
эффективности
процесса
.
новости
компаний
***
новости
компаний
***
новости
компаний
***
новости
компаний
***
новости
компаний
«
Сая
н.м.
о
л
око
»
выбирает
ин.н.о
в
ацион.н.оерешен.ие
Предприятие
осуществляет
запуск
производства
ультрапастеризованно
го
молока
на
новейшем
упаковочном
оборудовании
Tetra
Pak
AЗ/Fiex
iline
,
которое
качественно
меняет
процес
сы
интеграции
и
автоматизации
пред
приятия.
21
декабря
201
О
г.
здесь
тор
жественно
пущена
в
эксплуатацию
линия
<<
AЗ
/
Fiex
iline
»,
поставленная
компанией
«Тетра
Пак•
•
.
На
новом
обо
рудовании
будет
выпускаться
ультра
пастеризованное
молоко
в
упаковке
«
ТВА
1000
ml
Square»
с
крышкой
<<
StreamCap"
под
уже
хорошо
известным
потребителям
брендом
«Семёнишна
"
-
основной
маркой компании
<<
Саянмолоко
»
.
ОАО
«
Саян
молоко
»
является
одним
из
лидеров
молоч
ного
производства
не
только
Красноярского
края,
но
и
Сибирского
региона
.
Ежегодный
прирост
выпускаемой
про
дукции
составляет
15
%.
Новая
линия
позволит увеличить
объем
производимой
продукции
при
значительном
сниже
нии
эксплуатационных
расходов
и
повышении
надежности
работы
оборудования.
Упаковочное
оборудование
поколения
iline
-
одна
из
последних
разработок
<<
Тетра
Пак
"
,
в
основе
которой
лежит
принципиальный
технологический
прорыв
в
области
тех
нологий
автоматизации
.
<
<Tetra
Pak
AЗ
/
Fiex
iline"-
полно
стью
перенастраиваемая
линия
производства
семейных
упаковок
типов
<<
Tetra Brik Aseptic
",
«Tetra Prisma Aseptic»
и
<
<Tetra
Gemina Aseptic»
различного
объема
и
формы,
Комплексная
интеграция
на
линии
способствует
бесперебойной
и
эффективной
работе
оборудования
,
а
функции
Volume
Coпversioп
(пере
наладки
объема)
и
Quick Change
обесnечивают
быструю
адаnтацию
.
Линия
идеально
подходит
для
выпус
ка
до
35
млн
упаковок
в
год.
<<
Tetra Pak A3/Fiex
iline
"
увели
чивает
окупаемость
инвестиций
и
коэффициент
использования
обору
дования
,
а
также
обеспечивает
про
изводственную
платформу
для
прак
тически
бесконечных
инноваций
.
Это
оборудование
является
базой
для
дальнейшей
модернизации
предприятия
и
может
стать
цен
тральным
элементом
в
системе
его
автоматизации.
На
сегодняшний
день
в
России
установлены
три
такие
линии
.
ОАО
<<
Саян
молоко"
-одно
из
структурных
подразделе
ний
компании
«Агросибком",
в
которую
входят
12
пред
приятий.
«
Саянмолоко"-
крупнейший
производитель
молока
в
Сибири
.
90 %
перерабатываемого
молока
заготавлива
ется
на
дочерних
предприятиях
компании.
Производствен
ные
мощности
позволяют
перерабатывать до
350
т
моло
ка
в
сутки
,
сегодня
завод
перерабатывает
130
т
молока
.
Выпускаемые
молочные
продукты
традиционно
получают
высокие
оценки
на
престижных
конкурсах
регионального
и
всероссийского
значения.
ОАО
<<
Саянмолоко
»
является
уни
кальным
предприятием
молочной
промышленности
не
толь
ко
для
Хакасии
и
Красноярского
края
,
но
и
для
всей
Сиби
ри
и
Дальнего
Востока,
поскольку
на
нем
одинаково
сильно
развиты
оба
направления-
как
молочное,
так
и
сыродель-
позволяющая
оперативно
реагировать
на
изменения
спро-
ное
производство.
са.
Производительность
для
упаковок
«Tetra Brik Aseptic" 1
л
достигает
8000
единиц
в
час.
По
пресс
-
релизу
компании
"
Тетра
Пак
"

70
1
М
О
Л
О
Ч
Н А
Я
П
Р
О
М
Ы
W
Л
Е
Н Н
О
С
Т Ь
н~
з,
2
о
1 1
У
Д
К
637
.1
/3
Применеине
Фитостеринов
в
жировь1х
продуктах
Канд.
техн.
наук
Л.
Г.
ИПАТОВА
Московский
государственный
университет
пищевых
производста
Д
-
р
техн
.
наук
А.
А.
КОЧЕТКОВА
НИИ
питания
РАМН
ф
итостерины
представляют
собой
группу
вторичных
одно
атомных
циклических
спиртов
растительного
происхождения
и
имеют
ту
же
структурную
циклическую
осно
ву
,
что
и
присутствующий
в
организме
человека
холестерин
.
Различие
заклю
чается
в
строении
концевых
цепей
.
В
растениях
Фитостерины
участвуют
в
построении
и
стабилизации
клеточных
мембран.
Известно
более
40
типов
растительных
стеринов
,
самыми
рас
пространенными
являются
~-ситосте
рин,
стигмастерин
и
кампестерин
.
Еще
в
1980-х
годах
многочислен
ными
клиническими
испытаниями
за
рубежом
и
в
нашей
стране
достоверно
доказано
,
что
фитостерины
и
фитоста
нолы
способствуют
снижению
уровня
холестерина
в
крови
и
предотвращению
формирования
атеросклеротических
бляшек
.
Эффект
снижения
холестери
на
за счет
Фитостеринов
усиливается
на
фоне
уменьшения
потребления
насы
щенных
жиров
и
других
мер
профи
лактики
[2
,
8]
.
Хорошим
примером
слу
жит
опыт
Финляндии,
где
смертность
от
сердечно-сосудистых
заболеваний
среди
трудоспособных
мужчин
за
30-35
лет
снизилась
на
80 %
благода
ря
реализации
действующей
с
1970
г.
Национальной
программы
профилак
тики
сердечно-сосудистых
заболева
ний.
Эта
программа
предусматривает
регулярное
введение
Фитостеринов
и
фитестанолов
в
рационы
населения
как
одно
и з
профилактических
мероприя
тий
[3].
Фитостерины
содержатся
в
злаках
,
овоща
х,
фруктах
;
фитостанолы
-
в
куку
ру
з
ном
,
соевом
и
рапсовом
маслах
,
кун
ж
уте,
миндале
,
рисовых
отрубях
.
В
нашей
стране
с
2008
г.
методическими
рекомендациями
МР
2.
3.1.2432-08
<<
Нормы
физиологических
потребно
с
те
й в
энергии
и
пищевых
веществах
для
различных
групп
населения
РФ
>>
определена
норма
физиологической
Профилактика
сердеч1-lо
-
сосудистых
заболева1-lий
1-lаряду
с
исключе1-lием
факторов
риска
(малоподвиж1-lым
образом
жиз1-lи,
куреиием
и
др
.
)
предусматривает
с1-lиже1-lие
калорий1-lости
пита1-lия
и
потребле1-lия
живот1-lых
жиров,
увеличе1-lие
в
рац,ио1-lе
доли
зер1-lовых
продуктов,
овощей,
фруктов
.
Возмож1-lостъ
допол1-lителъ1-lых
профилактических
мер
со
сторо1-lы
производителей
пищевых
продуктов
связа1-lа
с
разработкой
продуктов
массовог
о
потреоле1-lия,
обогаще1-l1-lЫХ
фу1-lкц,ио1-lалъ1-lыми
и1-lгредие1-lтами,
которые
способствуют
С1-lиже1-lию
уров1-lЯ
холестери1-lа
в
крови.
К
таким
и1-lгредие1-lтам
от1-lосятся
растителъ1-lые
а?-lалоги
холестери1-lа
-
фитостери1-lы
(фитостеролъt)
и
их
1-lасыще1-l1-lые
формы-
фитоста1-lи1-lы
(фитоста1-lолы
).
потребности
в
фитостеринах,
равная
300
мг/сут.
Средний
уровень
потребле
ния
растительных
стеринов
в
западных
странах
составляет
150--450
мг/сут
,
ста
нслов-
25-50
мг/сут
[5
,
9].
По
результатам
мировых
исследо
ваний
за
последние
10-15
лет
была
дана
оценка
эффективности
различ
ных
видов
обогащенных
пищевых
про
дуктов.
Установлено
,
что
потребление
с
такими
продуктами
Фитостеринов
в
количестве
1-3
г/сут
снижает
уровень
общего
холестерина
на
1
0-20
%,
липо
протеинов
низкой
плотности
-
на
14-
16 %,
а
в
сочетании
с
низкожировой
и
низкохолестеринсвой
диетой-
на
24 %.
Достоверно
доказана
аналогичная
эффективность
эфиров
фитостеринов
.
На
этом
основании
Американской
национальной
образовательной
про
граммой
с
целью
снижения
уровня
в
плазме
крови
общего
холестерина
рекомендуется
ежедневное
потребле
ние
2
г
продуктов
,
обогащенных
расти
тельными
стеринами,
станолами
и
их
производными
[3
, 6,
7]
.
Выбор
пищевой
системы
для
обо
гащения
Фитостеринами
во
многом
определяется
их
растворимостью
или
диспергируемостью
.
Свободные
сте
риныплохо
растворяются
как
в
водной
,
так
и в
жировой
среде
.
Коммерческие
препараты
,
как
правило
,
представляют
собой
композицию
стеринов
с
другими
компонентами
,
повышающими
раство
римость
и
облегчающими
диспергиро
вание
в
пищевой
системе
,
например
,
они
могут
входить
в
состав
эмульсии
вместе
с
эмульгаторами
и
водной
фазой.
В
Финляндии
был
разработан
метод
их
этерификации
с
рапсовым
маслом
для
получения
жирорастворимой
формы
эфиров
стеринов
,
которые
хорошо
растворимы
в
маслах
,
поэтому
их
добавление
в
состав
жировой
фазы
не
вызывает
технологических
затрудне
ний
[11
].
Существует
способ
получения
жировых
гранул
,
содержащих
стерины,
станолы
,
сложные
эфиры
жирных
кислот
и
стеринов
/
станолов
и
их
любые
смеси
.
Гранулы
предназначены
для
введения
в
бульонные
кубики
,
пряности
и
подобные
продукты
[4].
Обоснованным
является
обогаще
ние
фитостеринами
,
особенно
их
эфи
рами,
эмульсионных
жировых
продук
тов,
в
частности
спредов
,
состав
которых
соответствует
формуле
оптимального
питания
,
т.е.
характери
з
уется
понижен
ной
калорийностью
,
отсутствием
в
жировой
фазе
источников
холестерина
и
транс-изомерных
кислот
,
сбаланси
рованным
содержанием
жирных
кислот
.
Многие
зарубежные
фирмы
произво
дят
функциональные
пищевые
проду
к
ты
,
обогащенные
фитостанолами
,
фито
стеринами
и
их
эфирами.
В
докладе
<<
Стратегический
анализ
европейског
о
рынка
фитостеринов
»
(подготовл
е
н
аналитическим
агентством
Frost and
Sullivan-
F&S)
общая
с
тоимость
евро
пейского
рынка
в
2005
г.
оценивалась
в
146
млн
евро
(184,6
млн
долл
.)
и
ее
рост
прогнозируется
до
312,5
млн
евр
о
(395,2
млн
долл.)
в
2012
г
.
Подавля
ющее
большинство
преп
а
ратов
фито
стеринов
и
фитастанолов
в
Европе
про
изводят
компании
Cognis, ADM
и
Raisio.

N!!
3,
2
О
1 1
П
о
д
а
нны
м
F&S, 82,2 %
преп
а
р а то
в
при
ме
няют
в с
о
с
тав
е
функциональны
х
п
и
щ
е
вы
х
проду
ктов
и
напитков
,
ассор
ти
ме
нт ко
т
о
ры
х в
ключает
йогурты
,
мо
ло
ко,
к
ол
б
а
с
ны
е
,
хле
б
обулочны
е
и з
дел
и я
,
м
арг
а
рины
и
спреды
[1
0].
В
от
еч
ес тв
е
нн
ой
пищево
й
про
м
ышленност
и
то
ж
е
ра
з
ра
б
отаны
о
бо
га
щ
е
нны
е
Фитостеринами
проду
к
ты
,
но
их
не
м
ног
о
.
Компания
«
Вимм-Билль
Данн
>>
выпускает
кисломолочный
про
дукт
«
Профилакт
120
/80>
>,
в
100
г
содер
жа
щи
й
80
м
г
ра
с
тит
е
льны
х
стеринов
.
В
сегменте
ж
ировы
х
продуктов
м
о
ж
но
от
мет
и
т ь
ра
з
ра
б
отку
Московского
госу
д
а
рственного
ун
и
верситета
пищевы
х
производств
по
исследованию
препара
то
в
Фитостеринов
и
и
х
эфиров
,
по
его
ре
з
ультатам
созданы
рецептуры
и
те
х
нологии
спредов
функционального
на
значения
с
фитостери
нами
[5].
Опубли
к
ованы
ре
з
ультаты
проведенного
компанией
«
ЭФКО
Пищевые
Ингреди
ентЫ
>>
исследования
влияния
фитосте
ринов
на
органолептические
и
физико
х
имические
свойства
заменителя
молочного
жира
группы
«
ЭколакТ
>>
с
ни
з
ки
м
содержанием
транс-изомеров
.
Разработанный
заменитель
с
фитосте
ри
нами
предполагается
использовать
для
производства
молокосодержащих
продуктов
и
с
предав
[1].
Некоторые
кисломолочные
продукты
и
спреды
,
присутствующие
на
отечественном
рын
к
е
,
приведены
в
таблице.
Анализ
опубликованных
результа
тов
дает
основание
рассматривать
фитостерины
и
фитастаналы
как
перс
пе
к
тивную
группу
фун
к
циональны
х
ингредиентов
с
достоверно
доказан
ными
физиологическими
эффе
к
тами
.
Включение
в
ежедневный
рацион
пита
ния
россиян
обогащенных
Фитостери
на
м
и
и
Фитостанолами
продуктов
,
в
ч
а
стности
ж
ировы
х
эмульсионных
,
будет
спосо
бс
твовать
снижению
развития
М
О Л О
Ч
Н А
Я
П
Р
О
М
Ы Ш
Л
Е
Н
Н
О
С
Т Ь
1
71
Пищ
е
вы
е
nро
дукт
ы
,
с
о
де
рж
а
щи
е
ста
н
олы
и э
фир
ы
стер
и
нов
«
Dan
aco
r
))
й
о
гур
т,
Фр
а
нция
1,1
г,
в
т
о
м
чи
с
ле
Эфиры
р
ас
тит
е
ль-
О
бо
г
а
щ
е
н
э
фирами
р ас
ти те
л
ь
ны
х
с
т
е р
и н
ов
«
Фи
т
он
атура
ли
с».
С
о
д
е р
жа
н и
е
м
о
л
о
чн
о
ки с
лы
х
бак
т
е
рий
н
а
к
он
е
ц
сро
к
а
годн
ост
и
н
е
м
е не
е
10
7
К
ОЕ
/
г
мол
о
чный
0,
05
г
ны
х
с т
е
рин
ое
2,7
г
(в
том
чи
с л е
рас
ти
т
е
л ь
ны
е
с т
е
рины
1,6
г)
К
и
сломо
л
очный
про
д
укт
«
П
роф
и
л а
кт
120/ 80
»,
Ро
сс ия
1,2
80мг(26
%
)
-
Обог
а
щ
е
н
комплексом
«
В
е
г
е
то
н и с+»,
включ
а
ющим
с т
е
ри
н
ы
,
вит
а
мины
Е
,
В
6
,
В
1
2
,
дигидрокв
е
рцитин
,
пр
о
би
о
ти
к
и
р
а
с т
ит
е л
ь
н
ы
е
с
те
р
и
ны
«Ben
eco
l"®,
Финлян
дия
32 -
р
ас
ти
те
ль-
8 -
ста
н
о
л
Н
етхо
л
естер
ин
а.
С
о
д
е
р
ж
и т
витамины
А
-
900
м
к
г
;
н
ы
е
м
а
сл
а
и
жиры
D - 7,5
м
кг
и
Е
-
6
м
г
«B
ece
l
))
™,
Ш
ве
ци
я
35
-
раст
и
те
л
ь-
13,8 -
эф
и
ры
с
те
-
Н
ет
хол
ес
т
е
рина.
Сод
е
ржит
витамины
А
-
900
м
кг
;
н
ые
масла
и
жир
ы
ри
н
ов
заболеваний
,
связанны
х с
повышен
ным
уровнем
холестерина
.
M
Гil
СПИСОК
ЛИТЕРАТУРЫ
1.
Алексеенко
А
.
В.
,
Рощупкина
Н
.
В
.
Разра
б
отка
н
ового
заменителя
м
о
л
о чного
ж
ира
с
Фитостеринами
11
М
ас
ло
ж
ировая
промышленность.
2010. N2 3.
2.
Все
о
холестерине
(н
а
цион
а
льный
доклад).
З
а
ключения
и
реком
е
нд
а
ции
/
под
ред. акад.
РАМН
Л.
А
.
Бокери
я
,
акад
.
РАМН
Р
.
Г
.
Ог
а
нов
а
11
Профилактическая
медицина
.
2010. N2 2.
3.
Драпкина
О.
М
.,
Клименков
А.
В.
,
Ивашкин
В.
Т.
Новые
методы
лечения
дислипидемии
11
Россий
с
кие
медицинские
ве
с ти
.
Т
.
12. 2007. N2 2.
4.
Жировые
гранулы
,
содержащие
сте
рин
,
и
способ
приготовпения
пищевой
дисперсии
с
их
участием
:
п
а
т
.
RU
2379905.
Оп
уб
л.
:
2
7.01
.2010.
5.
Карпухин
Д.
Е.
Разработк
а
те
х
нол
о гии
и
р
е
цептур
спред
ов
ф
у
нкцио
на
льног
о
н
аз
н
а
чения
:
ди
с
.
..
.
к
а
нд
.
т
ех
н
.
на
у
к
,
2
00
4
.
D - 7,5
мкг
и
Е -
10
мг
6.
Лещанекая
О.
А.
,
Бубнова
М.
Г
.,
Перава
Н.
В.
С
о
вр
еме
нные
п
о
д
ходы
к
пит
а
нию
б
ольных
с а
т
е
р
ог
енны
ми
ди
с
липидемиями
11
П
ро
ф
и
л
а кт
и
ч
еская
м
е
дицин
а
.2004
.
N
2
4.
7.
Погожева
А.
В
.,
Перава
Н.
В.
,
Дербе
нева
С
.
А.
Оценка
э
фф
е
кт
ивн
ос
т
и
п
ро
д
у
кт
а
,
обогащенн
о
г
о
фито
с
тер
и
н
ами
,
для
коррекции
гипер
хо
ле
с
тер
и
н
ем
ии
11
Coпsili
um Medicum,
Т
.
10
.
2008. N2
11
.
8.
Руженцова
Т
.
А.
Фитост
е
рины
в п
рофи
л
а
ктик
е
и
лечении
се
рдечн
о-со
с
удистых
з
а
б
олевани
й
11
Л
е
ч
а
щи
й
в
р
а
ч
.
2
01
0. N2 7.
9.
Шубина
О.
Г
.
,
Карпухин
Д.
Г.
,
Кочеткона
А
.
А
.
Фит
осте
рины
,
их
фи
з
иологически
е
преим
у
ществ
а
и
воз
мо
ж
но
с
ти
исп
о
ль
з
ов
а
ни
я
в
пищев ых
си
стемах!
/
Пищ
е
вы
е
и
нгр
е
диент
ы
:
сырье
и
до
ба
вки
.
2004
. N2 2.
10
.
Электронный
ресурс
:
www
.f
oodпavi
g
a
tor
.
c
om/
Fiп
a п
c
i
a
l
-
lпdus
try
/
Ph
ytosterols
m
a
rket
-
set
-
to
-c
oпtiпu
e-
g
rowt
h
.
11
. Hallikainen
М
.,
Sarkkinen
Е.
,
Wester /.
and
Uusitupa
М.
Sho
rt
- t
er
m LDL cholest
e-
ro
l-l
owering effic
acy
of
pl
ant stanol esters
ВМС
Cardiovasc
Di
sord. 2
:1
4 (200
2)
.
ВНИМАНИЕ!
ПОДПИСКА
НА
1
ПОЛУГОДИЕ
2011
r.
«Молочная
промышленность»
Индекс
70573
(в
каталоге
<<
Росnечать>
>
).
Н
а
1
полуг
о
дие
2011
г.
с
тои
м
о
с
ть
одного
но
м
ера
журнал
а
-
3
95
ру
б
.
«Сыроделие
и
маслоделие»
Индекс
47348
(в
каталоге
<<
Росnечать
>>
).
Н
а
1
полугодие
2011
г
.
сто
им
о
с
ть
одного
но
м
ера
журнала-
260
руб.
«Все
о
молоке,
сыре
и
мороженом»
Индекс
32961
(в
каталоге
«
Росnечать
>>
).
На
1
полугоди
е
2011
г.
с
тои
м
ость
одн
о
го
но
ме
р а
-
1
о ру
б
.
72
1
М
О
Л
О
Ч Н
А
Я П
Р
О
М
Ы Ш
Л
Е
Н
Н
О
С
Т Ь
N!!
3,
2
О
1 1
УДК
63
7.1
Стойкость
эмульсий
немоnочных
жиров
Канд.
техн.
наук
В.А.ГРУНСКАЯ
Волагодекая
государственная
молочно-хозяйственная
академия
им.
Н
.В
.Верещагина
Я.В.КОРЗЮК
Учебно-опытный
молочный
завод
им.
Н
.В
.Верещагина
о
дно
из
направлений
модификации
продуктов
с
целью
придания
им
функциональных
свойств
-
коррекция
липидного
состава.
Для
этого
используются
немолоч
ные
жиры
,
в
том
числе
растительные,
содержащие
незаме
нимые
полиненасыщенные
жирные
кислоты
и
применяемые
для частичной или
полной
замены
молочного
жира
.
При
этом
производители
сталкиваются
с
двумя
основными
проблема
ми
:
подбором
заменителя
молочного
жира,
характеризующе
гося
высоким
содержанием
полиненасыщенных
жирных
кислот,
соответствующими
физическими
(температуры
плав
ления
и
затвердевания)
и
органолептическими
свойствами,
а
также
получением
стойкой
эмульсии
заменителя
молочно
го
жира
в
среде
других
молочных
компонентов.
При
получе
нии
молокосодержащих
сквашенных
напитков
недостаточно
стабильная
эмульсия
в
результате
механического
воздей
ствия
(перемешивание,
перекачивание
,
фасование),
неизбеж-
0:
'-
§-L::
"'
-
а."'
о"'
""
"'"'
<(
:2
.!)fft
>-
-
" '
"'
о:;;:
""
'
"'
.D
о"'
>-
>-
u
:2
"'
2
б
2
в
3
3
•
WPN1
=6,2
мг/г
•
WPN1=5
мг
/
г
oWPNI
=3,7
мг
/г
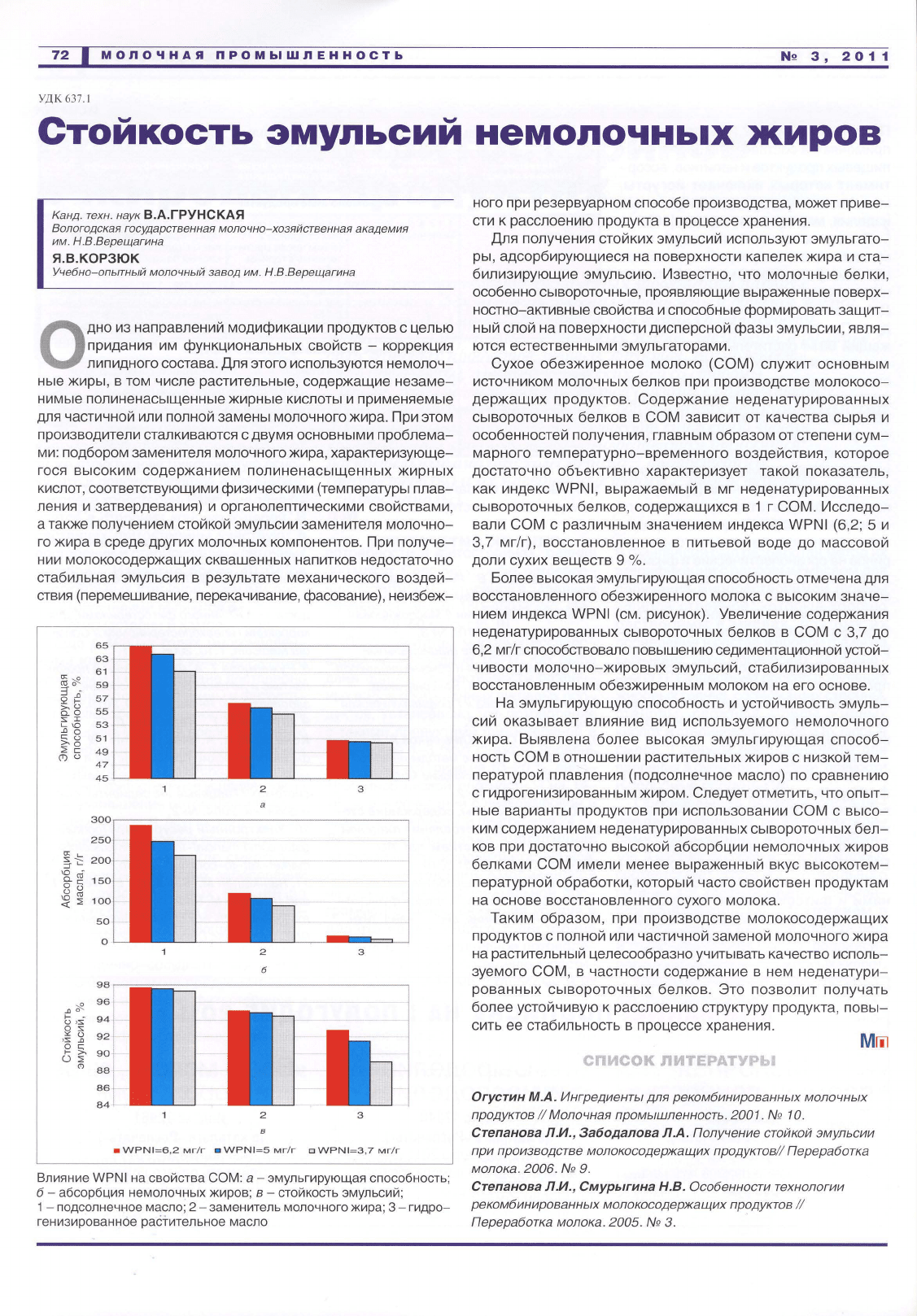
Влияние
WPNI
на
свойства
СОМ:
а-
эмульгирующая
способность;
б-
абсорбция
немелочных
жиров;
в-
стойкость
эмульсий;
1 -
подсолнечное
м~сло
;
2-
заменитель
молочного
жира;
3-
гидро
генизированное
растительное
масло
ногопри
резервуарном
способе
производства,
может
приве
сти
к
расслоению
продукта
в
процессе
хранения.
Для
получения
стойких
эмульсий используют
эмульгато
ры,
адсорбирующиеся
на
поверхности
капелек
жира
и
ста
билизирующие
эмульсию.
Известно,
что
молочные
белки
,
особенно
сывороточные,
проявляющие
выраженные
поверх
ностно-активные
свойства
и
способные
формировать
защит
ный
слой
на
поверхности
дисперсной
фазы
эмульсии,
явля
ются
естественными
эмульгаторами
.
Сухое
обезжиренное
молоко
(СОМ)
служит
основным
источником
молочных
белков
при
производстве
молокосо
держащих
продуктов.
Содержание
неденатурированных
сывороточных
белков
в
СОМ
зависит
от
качества
сырья
и
особенностей
получения,
главным образом
от
степени
сум
марного
температурно-временного
воздействия
,
которое
достаточно
объективно
характеризует
такой
показатель,
как
индекс
WPNI,
выражаемый
в
мг
неденатурированных
сывороточных
белков
,
содержащихся
в
1
г
СОМ.
Исследо
вали
СОМ
с
различным
значением
индекса
WPNI (6,2; 5
и
3,7
мг/г),
восстановленное
в
питьевой
воде
до
массовой
доли
сухих
веществ
9 %.
Более
высокая
эмульгирующая
способность
отмечена
для
восстановленного
обезжиренного
молока
с
высоким
значе
нием
индекса
WPNI
(см.
рисунок).
Увеличение
содержания
неденатурированных
сывороточных
белков
в
СОМ
с
3,7
до
6,2
м
г/г
способствовало
повышению
седиментационной
устой
чивости
молочно-жировых
эмульсий,
стабилизированных
восстановленным
обезжиренным
молоком
на
его
основе.
На
эмульгирующую
способность
и
устойчивость
эмуль
сий
оказывает
влияние
вид
используемого
немолочного
жира
.
Выявлена
более
высокая
эмульгирующая
способ
ность
СОМ
в
отношении
растительных
жиров
с
низкой
тем
пературой
плавления
(подсолнечное
масло)
по
сравнению
с
гидрогенизированным
жиром.
Следует
отметить
,
что
опыт
ные
варианты
продуктов
при
использовании
СОМ
с
высо
ким
содержаниемнеденатурированных
сывороточных
бел
ков
при
достаточно
высокой
абсорбции
немолочных
жиров
белками
СОМ
имели менее
выраженный
вкус
высокотем
пературной
обработки
,
который
часто
свойствен
продуктам
на
основе
восстановленного
сухого
молока.
Таким
образом,
при
производстве
молокосодержащих
продуктов
с
полной
или
частичной
заменой
молочного
жира
на
растительный
целесообразно
учитывать
качество
исполь
зуемого
СОМ,
в
частности
содержание
в
нем
неденатури
рованных
сывороточных
белков.
Это
позволит
получать
более
устойчивую
к
расслоению
структуру продукта,
повы
сить
ее
стабильность
в
процессе
хранения
.
M
lil
СПИСОК
ЛИТЕРАТУРЫ
Огустин
М.А.
Ингредиенты
для
рекомбинированных
молочных
продуктов
11
Молочная
промышленность.
2001.
NQ 10.
Степанова
Л.И.,
Забодалава
Л.А.
Получение
стойкой
эмульсии
при
производстае
молокосодержащих
продуктов
//
Переработка
молока.
2006.
NQ 9.
Степанова
Л.И.,
Смурыгина
Н.В.
Особенности
технологии
рекомбинированных
молокосодержащих
продуктов
11
Переработка
молока.
2005.
NQ 3.

N!!
3,
2
О
1 1
М
О Л О
Ч
Н А
Я
П
Р
О
М
Ы Ш
Л
Е
Н
Н
О
С
Т Ь
1
73
УДК
637
14
Обоrащеннь1й
твороr
Д-р
техн.
наук
д.Н.ПОНОМАРЁВ,
А.д.МЕРЗЛИКИНА
ОАО
«Молочный
комбинат
«Воронежский"
Д-р
техн.
наук
Л.В.ГОЛУБЕВА
Воронежская
государственная
технологическая
академия
н
а
состав
и
свойства
творога
основное
влияние
оказывают
способы
производства.
Пред
почтение
отдают
поточным
методам,
которые
в
значительной
степени
сокра
щают
произведетвенные
и
трудовые
расходы,
повышают
санитарное
состоя
ние
предприятия.
Современные
тенденции
совершен
ствования
ассортимента
творога
ориенти
рованы
на
создание
сбалансированной
по
пищевой
и
биологической
ценности
продукции
функциональной
направлен
ности
с
увеличенными
сроками
годно
сти.
Технологические
схемы
таких
про
дуктов
предусматривают
полное
и
комплексное
использование
сырья,
уве
личение
выхода
готового
продукта
,
сни
жение
энергозатрат
и
обеспечение
эко
логической
чистоты
как
продукта,
так
и
окружающей
среды.
Реализация
этих
Массовая
доля
,%:
жира
влаги
сухих
веществ
белка
небелкавага
азота
лактозы
Влагаудерживающая
способность,
%
Кислотность,
·
т
Содержание
аминокислот,
мг
/
100
г:
лизина
метиони
на
триптофана
тирозина
«
Вимм-Биллъ-Д
аю-t
»
выпустил
творог
«
ДомuJС
в
деревnе
»
в
ynuJCaлъnou
ynaJCoвJCe
Упаковка
уникальной
формы
была
разработана
специально
для
<<Домика
в
деревне>>.
Она
целиком
прозрачная,
что
позволяет
видеть
продукт.
Крыш
ку
благодаря
специальной
конструк-
принципов
достигается
в
результате
синтеза
оптимальной
структурной
схе
мы,
включающей
научное
обоснова
ние
последовательности
основных
тех
нологических
процессов
и
оптимальных
условий
их
проведения.
На
молочном
комбинате
«Воронеж
ский>>
разработана
технология
нового
вида
обогащенного
творога
на
линии
Tewes-Bis
с
использованием
комплек
са
пищевых
волокон
«Стейд
Милк
В-01
>>
(000
«Стейдтек>>)
и
антиокси
данта
Origanox
WS («Frutarom>>).
Комплекс
«Стейд
Мил
к
В-01
,,
обогаща
ет
молочную
смесь
белком
и
нераство
римыми
пищевыми
волокнами,
повы
шает
выход
продукта
и
придает
ему
более
выраженный
молочный
вкус.
Антиоксидант
на
основе
душицы
обык
новенной
Origanox
обладает
антибак
териальной
активностью,
устойчив
к
высоким
температурам,
экономичен
по
сравнению
с
существующими
анти
оксидантами.
Origanox
WS
характе
ризуется
многофункциональностью:
замедляет
и
предотвращает
развитие
окислительных
процессов,
поддержи
вает
и
проявляет
синергизм
с
антибак
териальными
агентами,
оказывает
бла-
9±0,15
73±0,2
27±0,2
17,16±0,06
0,
018
3,58±0,65
44
,84
156±1,2
1130
366
194
862
9±0,17
71
,8±0,2
28,2±0,2
16,38±0,06
0,
012
2,24±0,65
36,36
168±1 ,2
1096,6
354,9
190,5
841,3
готворное
воздействие
на
здоровье
за
счет
способности
к
связыванию
сво
бодных
радикалов.
Технология
производства
творога
включает
классические
операции:
•
подготовка
молочной
смеси
;
•
внесение
в
потоке
комплекса
пище
вых
волокон
«Стейд
Мил
к
В-01
>>
и
анти
окисиданта
Origanox WS;
•
кислотная
коагуляция
молочной
смеси;
•
обработка
сгустка;
•
обезвоживание
творога;
•
формование
и
прессование
;
•
охлаждение
и
упаковка
;
•
доохлаждение
в
холодильной
камере
до
4±2
°
С
.
Изучение
физико-химических
свойств
и
выхода
творога
позволило
определить
оптимальную
массовую
долю
комплек
са
пищевых
волокон
(0, 15 %
от
массы
смеси)
и
антиоксиданта
(0,03 %).
Актив
ная
кислотность
опытных
образцов
по
сравнению
с
творогом
,
полученным
без
использования
комплекса
пищевых
волокон
(контроль)
,
выше
на
О
,
1-0
,15,
а
титруемая
кислотность
-
ниже
на
10-15
о
т
(см
.
таблицу)
.
Расход
сырья
на
единицу
продукции
составил
4650-4700
и
5100-5150
кг/т
соответ
ственно.
Выход
творога
при
использо
вании
пищевых
волокон
увеличивается
за
счет
адсорбции
ими
жира
и
сыворо
точных
белков.
Результаты
оценки
орга
нолептических
показателей
обогащен
ного
творога
свидетельствуют
,
что
продукт
приобретает
приятный
цвет
и
аромат.
Таким
образом,
разработана
техно
логия
обогащенного
творога
,
который
удовлетворяет
требованиям
профилак
тического
питания
различных
возраст
ных
групп
населения
.
Mfil
(индивидуальной
-
на
170
г
и
семей
ной-
340
г)
с
разной
жирностью:
лег
кий
творог
(0,2 %)
и
творог
с
насыщен
ным
вкусом
(9
%).
ции
можно
открывать
и
закрывать
не
сколько
раз, и
творог
долго
будет
со
хранять
свежесть.
Продукт
выпускает
ся
в
двух
разных
по
размеру
упаковках
Творог
выпускается
на
специально
установленной
новой
линии
и
по
новой
технологии
на
Тимашевском
молоч
ном
комбинате.
Источник:
www.advis.ru

УДК
637
.1
Санитарно-rиrиеническая
обработка
при
производстве
копченых
сыров
ДМ
ФОМ
С
ЭКСТРА
и
БИО
СИД
С
с
ыр
-
готовый
к
употреблению
молочный
продукт
со
специфи
ческим
ароматом
и
вкусом
,
сфор
мированными
в
результате
деятельности
молочнокислой
микрофлоры.
Сыры
содержат
незаменимые
аминокислоты
,
витамины
,
минералы
,
необходимые
для
с
б
алансированного
питания.
Потребите
ли
в
зависимости
от
индивидуальных
осо
б
енностей
и
материальных
возможностей
предпочитают
различные
виды
сыров,
одним
из
которых
является
копченый
сыр
.
Неповторимый
вкус
и
изысканный
аромат
продукт
приобретает
именно
в
момент
копчения.
Вкус
,
аромат
и
цвет
готовой
продукции
напрямую
зависят
от
качества
дыма
,
получаемого
при
тлении
твердых
лиственных
пород
.
Дымовое
копчение
приводит
к
сложным
загрязнениям
поверхности
коптильных
камер
сажей,
смолой
и
дегтем.
Накопление
загрязне
ний
и
их
некачественное
удаление
могут
резко
ухудшать
органолептические
пока
затели
готовой
продукции
и,
как
след
ствие,
приводить
к
ухудшению
товарного
вида
и
сокращению
сроков
реализации.
Особенности
производства
копченых
сыров
и
свойства
используемого
сырья
определяют
структуру
и
состав
образу
ющихся
загрязнений.
На
первый
взгляд
те
х
нологический
процесс
кажется
про
стым,
но
он
требует
сочетания
многочис
ленны
х
факторов:
воздействия
центро
бежных
сил
,
седиментации,
броуновского
движения
,
конденсации
паров,
абсорб
ции
в
поверхностном
слое
влаги,
попада
ния
коптильных
компонентов
дыма
и
даль
нейшего
их
проникновения
в
толщу
сыра,
со
провождающегося
специфическими
реакциями
взаимодействия
с
химически
ми
составляющими
продукта.
При
нару
шении
хотя
бы
одного
из
перечисленных
факторов
может
ухудшаться
товарный
вид,
изменяться
органолептические
пока
зател
и
,
а
также
быстро
выходит
из
строя
технологическое
оборудование.
Для
решения
вопросов
санитарии
при
производстве
копченых
сыров
важно
гра
мотно
подобрать
моющие
средства.
Они
должны
не
только
действовать
эффек
тивно
,
но
и
облегчать
работу
персонала,
обеспечивать
качественный
результат
и
минимизировать
затраты.
Порой
даже
опытному
технологу
сложно
сделать
пра
вильный
выбор
средств
для
санитарно-ги
гиенической
обработки.
Зачастую
опре
деляющим
параметром
при
этом
является
ни
зка
я
себестоимость
моющих
препара
тов.
На
самом
деле
за
внешней
дешевиз
ной
почти
всегда
скрываются
простота
и
отсутствие
важных
компонентов,
что
впо
следствии
приводит
к
большому
расходу
,
низкой
эффективности,
недостаточному
дезинфицирующему
действию,
отсутствию
защитного
эффекта
,
в
результате
чего
возникает
предрасположенность
к
по
вреждению
очищаемых
поверхностей
.
Примененив
на
производстве
таких
деше
вых
средств
приводит
отнюдь
не
к
эконо
мии,
а
к
увеличению
финансовых
затрат
и
,
следовательно
,
к
снижению
прибыли.
Компания
«РАБОС
Интернешнл"
реко
мендует
использовать
высококачествен
ные
многокомпонентные
щелочные
мо
ющие
средства
ДМ
ФОМ
С
ЭКСТРА
и
БИО СИД
С
бельгийской
компании
CID
LINES,
предназначенные
для
удаления
стойких
отложений
дымовой
смолы,
копо
ти,
пригаров
жира
и
белка
в
коптильных
камерах,
плавителях
,
котлах
для
варки,
грилях.
Препараты
ДМ
ФОМ
С
ЭКСТРА
и
БИО
СИД
С
одинаковы
по
направлению
действия,
но
различаются
по
функциям
.
Основной
задачей
моющего
средства
БИО
СИД
С
является
предупреждение
образо
вания
остаточных
загрязнений
и
возмож
ность
применения
его
для
регулярной
мой
ки.
ДМ
ФОМ
С
ЭКСТРА
удаляет
самые
стойкие
загрязнения,
его
следует
исполь
зовать,
если
нет
возможности
проводить
регулярную
очистку
камер.
Моющие
сред
ства
ДМ
ФОМ
С
ЭКСТРА
и
БИО
СИД
С
можно
применять
для
разных
видов
мой
ки:
ручной
,
с
помощью
пенагенератора
(пенная
мойка)
,
встроенной
системы
ОЧИСТКИ
(ВСО).
Препараты
полностью
растворяются
в
воде
любой
жесткости
.
Так
как
в
состав
препаратов
входят
поверх
ностно
активные
вещества
(ПАВы),
рабо
чие
растворы
обладают
высоким
пена
образованием
,
создают
устойчивую
стабильную
пену
с
хорошими
адгезионны
ми
свойствами,
что
позволяет
качествен
но
отмыть
вертикальные
поверхности
и
труднодоступные
места.
ПАВы
увеличива
ют
проницаемость
моющих
растворов
в
загрязнения,
благодаря
чему
поверхность
смягчается
и
средство
проникает
в
копоть
и
грязь.
Диспергирующие
присадки
дро
бят
загрязнения
на
мелкие
частицы.
При
этом
эмульгирующие
свойства
удержива
ют
данную
грязь
в
растворе,
не
позволяя
оседать
повторно
на
очищенную
поверх
ность
оборудования.
Препараты
ДМ
ФОМ
С
ЭКСТРА
и
БИО
СИД
С
эффективно
удаляют
с
внешней
поверхности
технологического
оборудования
жировые
и
белковые
загрязнения
сложного
характера.
Благо
даря
входящим
в
состав
препаратов
инги-
биторам
коррозии
рабочие
растворы
обладают
щадящим
действием
на
поверх
ности,
изготовленные
из
стали
,
железа
,
стеклоэмали
,
резиновых
и
пластиковых
материалов.
Очистка
оборудования
дан
ными
средствами
оставляет
за
собой
совершенно
чистую
поверхность
,
поэто
му
позволяет
сократить
общее
время
мой
ки
и
расход
моющих
и
дезинфицирующих
средств.
Препараты
являются
безопас
ными
и
отвечают
европейским
экологи
ческим
требованиям
.
Другая
важная тема
,
о
которой
нельзя
забывать
при
очистке
коптильных
камер
,
минеральные
отложения
.
Ведь
наиболее
часто
в
образовании
нерастворимых
загрязнений
участвуют
соли жесткости
воды.
На
многих
молокоперерабатыва
ющих
предприятиях
используется
водо
проводная
или артезианская
вода
с
высо
кой
жесткостью.
Повышенное
содержание
катионов
кальция,
магния
и в
первую
оче
редь
железа
формирует
минеральные
отложения
на
поверхности
технологиче
ского
оборудования,
оказывая
негативное
действие
на
процессы
мойки
и
очистки
обо
рудования.
В
таких
случаях
моющие
сред
ства
ДМ
ФОМ
С
ЭКСТРА
и
БИО
СИД
С
могут
применяться
в
ротационных
про
граммах
с
препаратом
ТОРНАКС-С.
Кислотное
средство
ТОРНАКС-С
реко
мендовано
к
применению
с
профилакти
ческой
целью.
Прекрасно
удаляет
мине
ральный
налет
и
обладает
способностью
пассивировать
металл,
т.
е
.
образовывать
на
металле
защитную
пленку,
препят
ствующую
появлению
ржавчины.
Частота
применения
ТОРНАКС-С
зависит
от
жест
кости
используемой
воды
и
может
коле
баться
от
нескольких раз
в
месяц
до
одно
го
раза
в
год
.
Комплексное
удаление
всех
загрязне
ний
обеспечивает
возможность
производ
ства
качественной,
конкурентоспособной
и
безопасной
в
микробиологическом
отно
шении
продукции.
Специалисты
компании
«
РАБОС
Интернешнл
"
помогут
разрабо
тать
эффективную
санитарно-гигиениче
скую
программу
для
молокоперерабаты
вающих
предприятий.
Дополнительную
информацию
о
препаратах
вы
можете
получить
у
сотрудников
компании
«
РАБОС
Интернешнл".
О
.
МИГУНОВА,
специалист
отдела
гигиены
перерабатывающей
промышленности
«РАБОС
Интернешнл»
www.RABOS.ru
E-mail: inter.clean@rabos.ru

ДЛЯ
ОЧИСТКИ
ТЕРМИЧЕСКИХ,
ВАРОЧНЫХ
И
КОПТИЛЬНЫХ
КАМЕР
С
BIOCIO·S
";}
--·--·-
_
_,...
____
_
•
обладает
сильным
пенообразованием;
•
удаляет
жиры,
белки
и
пригоры
любого
состава;
•
предотвращает
отложение
солей
жесткости;
•
бережное
отношение
к
поверхностям
(сталь,
пластик,
резина);
•
быстро,
эффективно
и
экономически
выгодно
.
000
«РАБОС
Интл.»
142784
,
Московская
область,
Ленинский
р-н
,
пос
.
Московский
,
а
/
я
14
Тел.
+7
495
785
7121
,
факс
+7
495
785
7125
www.RABOS.
ru

Памяти
профессора
М.С.Уманскоrо
15
февраля
2011
г.
на
70-м
году
жизни
скоропостиж
но
скончался
главный
научный
сотрудник
Сибирского
научно-исследовательского
института
сыроделия
док
тор
технических
наук,
профессор
Марк
Соломонович
Уманский.
Марк
Соломонович
родился
4
июля
1941
г.
в
г.
Бобри
нец
Кировоградекой
обл.
Трудовую
биографию
начал
в
Сызрани
,
работал
токарем
на
комбайновом
заводе
.
В
1965
г
.
окончил
биологический
факультет
Московского
государственного
университета
им
.
М.В.Ломоносова
по
специальности
<<
Физиология
растений»
со
специализа
цией
<<
Микробиология
»
и
навсегда
связал
свою
жизнь
с
наукой
,
начав
с
должности
старшего
научного
сотруд
ника
,
а
затем
-
заведующего
отделом
биохимии
во
Всесоюзном
НИИ
маслоделия
и
сыроделия
в
Угличе
.
В
1968
г.
был
направлен
в
Алтайский
филиал
ВНИИМСа
в
Барнауле.
С
1974
по
1982
г.
возглавлял
отдел
биохи
мии
на
Алтае.
Специалист
высокой
квалификации,
он
приложил
много
сил
в
оснащение
лаборатории
современными
по
те
м
временам
оборудованием
и
приборами
,
боль
шое
внимание
уделял
освоению
и
разработке
новых
методов
биохимических
исследований
молока
и
сыра
,
воспитанию
молодых
ученых
и
специалистов
,
разви
тию
творческих
связей
с
другими
отраслевым
и
и
ака
демическими
НИИ
.
Им
впервые
предложен
новый
прин
цип
подбора
микроорганизмов
в
бактериальные
закваски
для
сыров-
принцип
ли
политической
актив
ност
и
.
Созданная
научно-экспериментальная
база
для
реализации
идеи
включала
17
оригинальных
аналити
ческих
методик
исследований
.
В
197 4
г
.
Марка
Соломоновича
переводят
на
рабо
ту
в
головной
институт
на
должность
заведующего
отделом
биохимии
ВНИИМСа
.
Здесь
продолжаются
и
сследования
по
изучению
процессалиполизав
нату
ральных
сыра
х,
которые
являются
основным
направле
н и
ем
его
научно
й
деятельности
.
В
1982
г
.
Марка
Соломоновича
как
специалиста
с
большим
опытом
научно-исследовательской
работы
назначают
заместителем
директора
по
научной
рабо
те
Алтайского
филиала
ВНИИМСа,
где
он
руководит
комплексными
научными
работами
по
программе
«
Ликвидация
последствий
Семипалатинского
ядер
ного
полигона
•
•.
В
2000
г.
М.С
.
Уманский
защитил
дис
сертацию
на
соискание
ученой
степени
доктора
тех
нических
наук.
Ему
присвоены
звания
старшего
научного
сотрудника,
а
затем
профессора.
С
2008
г.
занимал
должность
главного
научного
сотрудника
ГНУ
СибНИИС
Россельхозакадемии.
Основное
направление
его
научных
исследований
-биотехнология
селективного
липолиза
в
сыроделии.
Более
40
лет
трудовой
деятельности
ученый
высокой
эрудиции
М.С
.
Уманский
отдал
на благо
развития
молоч
ной
отрасли.
Прекрасно,
когда
жизненный
путь
человека
подтвер
ждается
его
предназначением,
его
миссией
на
этой
земле
.
Марк
Соломонович-
ученый
от
Бога
.
Светлая,
ясная
голова
,
постоянный
поиск
,
четкость
и
закончен
ность
мыслей,
неиссякаемое
новаторство,
искрометность
замыслов-
далеко
не
все
неотъемлемые
атрибуты
его
творческой
личности
.
Импульсивная
натура
ученого
по
стоянно
генерировала
идеи.
Он
находился
в
постоянном
движении
вперед,
обладал
редкими
качествами
зажи
гать
людей
своими
планами
и
вести
их
за
собой.
Большой
вклад
он
внес
в
дело
подготовки
специа
листов
высшей
квалификации
.
Под
его
научным
руко
водством
успешно
защитили
кандидатские
диссерта
ции
более
30
аспирантов.
Был
автором
36
изобретений
,
более
260
публикаций
,
среди
которых
4
монографии.
М
.
С
.
Уманский
известен
в
стране
и
за
ее
пределами
к
ак
эрудированный
специалист
,
крупный
ученый
,
глубо
к
о
понимающий
тенденции
мирового
опыта
развития
тех
ники
и
технологии
молочной
индустрии
.
За
многолетний
добросовестны
й
труд
Марк
Соло
монович
имел
многочисленные
поощрения
и
награды
,
среди
которых
почетный
знак
<<
Изобретатель
СССР
»,
а
также
медали
<
<За
доблестный
труд
"
и
<<
За
заслуги
во
имя
созидания
».
Марк
Соломонович
был
всеми
уважаемым
прекрас
ным
и
отзывчивым
человеком
,
готовым
всегда
прийти
на
помощь
делом
,
добрым
советом
или
просто
добрым
словом.
Таким
он
и
останется
в
наших
сердцах.
Друзья,
коллеги,
ученики
скорбят
о
тяжелой
утрате
и
выражают
соболезнование
родным
и
близ
ким
М.С.Уманского.

УД
К
637.325:543.54
Современнь1е
представnения
о
структуре
казеиновой
мицёnnь1
Канд.
техн.
наук
8.8.
ЕЛЬЧАНИНОВ
Сибирский
научно
-
исследовательский
институт
сыроделия
,
Барнаул
с
огласно
Vl
номенклатуре
белков
коровьего
молока
казеины
раз
деляют
на
четыре
основные
группы
(семейства):
а
51
-,
а
52
-,
~-
и
к-казеины
(1
].
В
молоке
взаимодей
ствие
всех
групп
казеинов
и
коллоидно
го
кальция
фосфата
(ККФ)
приводит
к
формированию
стабильных
агрегатов,
которые
называются
казеинаткальций
фосфатными
комплексами
(1-4-р.]
или
казеиновыми
мицеллами
[2,
9].
Основ
ная
биологическая
функция
казеиновых
мицелл
(КМ)
-
обеспечение
новорож
денных
млекопитающих
энергией
,
ионами
(прежде
всего
кальцием
и
фос
фатами)
и
аминокислотами
,
необходи
мыми
для
роста
и
развития
.
МОДЕЛИ
СТРОЕНИЯ
КАЗЕИНОВОЙ
МИЦЕЛЛЫ
Структура
и
свойства
мицеллы,
а
также
природа
движущих
сил,
обеспе
чивающих
ее
самоорганизацию
и
ста
билизацию,
являются
предметом
дис
куссий
и
многочисленных
исследований.
За
более
чем
50-летнюю
историю
науч
ных
поисков
в
этой
области
создано
несколько
десятков
моделей
структуры
КМ
(2-8, 10-15, 21, 38, 138].
Предла
гаемые модели
условно
можно
разде
лить
на
две
основные
группы.
К
первой,
исторически
ранней
груп
пе
относятся
различные
варианты
модели
пекрытого
ядра
[31-33].
Соглас
но
этим
моделям,
мицеллы
состоят
из
молекул
разных
групп
казеинов,
обра
зующих
преетранетвенную
сетку
(кар
кас)
.
Качественный
белковый
состав
ядерной
и
корковой
части
различен
.
Структура
мицеллы
формируется
за
счет
нелинейной
полимеризации
казеи
нов
,
при
этом
считается,
что
a
51
-CN
трифункционален,
~-CN
бифункцио
нален,
а
к-СN
монофункционален
и
терминирует
процесс
полимеризации
(32]
.
На
поверхности
мицеллы
адсорби
рованы
растворимые
казеины,
каль
цийфосфатные
и
кальцийцитратные
комплексы
.
Мицелла
имеет
губчатое
строение
со
множеством
полостей
и
каналов,
размеры
которых
позволяют
проникать
в
них
различным
реагентам,
в
том
числе
протеолитическим
фер
ментам
с
молекулярной
массой
около
36
кДа.
При
сычужном
свертывании
казеин
превращается
в
пара-к-казе
ин
и
казеинмакропептид
(гликомакро
пептид)
.
Сгусток
формируется
в
момент,
когда
основный
пара-к-казеин
и
отно
сительно
кислые
а
5
-
и
~-казеины
всту
пают
в
электростатические
или гидро
фобные
взаимодействия
[5-р
.
]
.
Более
поздний
вариант
первой
группы
-
модель
внутренней
субструктуры,
пред
ложенная
C.Holt
в
1992
г.,
в
которой
мицелла
рассматривается
как
минера
лизованная
сетчатая
глобула,
состоящая
из
поперечно-ешитых
нанокластера
ми
ККФ
полипептидных
цепей
казеи
нов
(2]
.
Вторая
группа
-
субмицеллярные
модели
(рис.
1
).
В
очень
упрощенной
форме
суть
этих
моделей
сводится
к
следующему.
Структурную
основу
казеиновой
мицеллы
составляют
субъ
единицы-
субмицеллы.
При
этом
пред
полагается,
что
субмицеллы,
форми
рующие
ядро,
отличаются
по
составу
и
физико-химическим
свойствам
от
суб
мицелл,
которые
образуют
внешний
(корковый)
слой
(7,
8,11-16,
18,
20].
100
нм
Q
Субмицелла
)-v
<<Волосковый"
участок
Коллоидный
фосфат
кальция
Рис
.
1.
Субмицеллярная
модель
казеино
вой
мицеллы
[8]
Диаметр
одной
субмицеллы
соста
вляет
1 Q-15
н
м,
в
ее
состав
входит
15--25
молекул
казеинов,
которые
связаны
друг
с
другом
гидрофобными
и
электроста
тическими
связями
[7,
8].
Основным
ста
билизирующим
фактором
<<большой>>
мицеллы
считаются
участки
ККФ,
кото
рые
жестко
связывают
субмицеллы
друг
с
другом.
Модель
предполагает
наличие
двух
типов
субмицелл
-
содержащих
и
не
содержащих
к-казеин
[15].
Субъеди
ницы
,
несущие
к-казеин
,
расположены
в
корковом
слое
мицеллы
.
Гидрофоб
ная
N-терминальная
последователь
ность
к-казеина
погружена
в
ядерный
слой
мицеллы
и
не
контактирует
с
вод
ной
фазой
.
Гидрофильные
гликомакро
пептидные
(С-терминальные)
участки
расположены
на
наружной
поверхно
сти
мицеллы
,
образуя
подвижный
«ВОЛОСКОВЫЙ>>
СЛОЙ
ВЫСОТОЙ
ОКОЛО
7
НМ
[19, 20].
Экспонированный
наружу
отрезок
молекулы
к-казеина
начинается
с
участка
последовательности
86-96
,
следовательно,
сайт
гидролитической
атаки
химозина,
Phe1
05-Met1 06,
также
находится
в
«волосковом>>
слое.
В
нативном
молоке
агрегационная
устой
чивость
мицелл
обеспечивается
сила
ми
электростатического
отталкивания
за
счет
значительного
отрицательного
заряда
экспонированных
гликомакро
пептидных
участков
к-казеина
.
Гидро
лизуя
пептидную
связь
Phe1
05-Met1 06
в
молекуле
к-казеина,
молокосвер
тывающие
ферменты
выступают
в
роли
«депилятора>>,
удаляя
с
поверхности
мицеллы
стабилизирующий
<<волоска
вый>>
слой.
Теряя
гидрофильный
<<волосковый>>
слой,
мицеллы
теряют
и
гидратную
оболочку.
С
потерей
глико
макропептидных
участков
уменьша
ются
поверхностный
отрицательный
заряд
мицелл
и
силы
кулонавекого
отталкивания
одноименных
зарядов.
В
результате
происходят
сближение
и
агрегация
мицелл
за
счет
гидрофоб
ных
взаимодействий
с
образованием
преетранетвенной
сетчатой
структуры
сгустка
[8, 64].
Одним
из
доказательств
субмицел
лярной
модели
долгое
время
считались
результаты
ранних
элекронно-микро
скопических
исследований
и
данные
рассеяния
нейтронов
и
рентгеновских
лучей
[35].
На
микрографиях
КМ
выгля
дели
как
глобулярные
структуры
с
элек
тронно-плотными
участками
(похожие
на
ягоды
малины),
что
интерпретирова
лось
в
пользу
субмицеллярной
структу
ры
(16, 28-30, 35].
Однако,
по
мнению
скептиков,
эти
данные
свидетельство
вали
лишь
о
том
,
что
внутренняя
струк
тура
мицелл
состоит
из
зон
с
различ
ной
рассеивающей
способностью
,
что
обусловлено
присутствием
нанокласте
ров
ККФ
(2,
36].
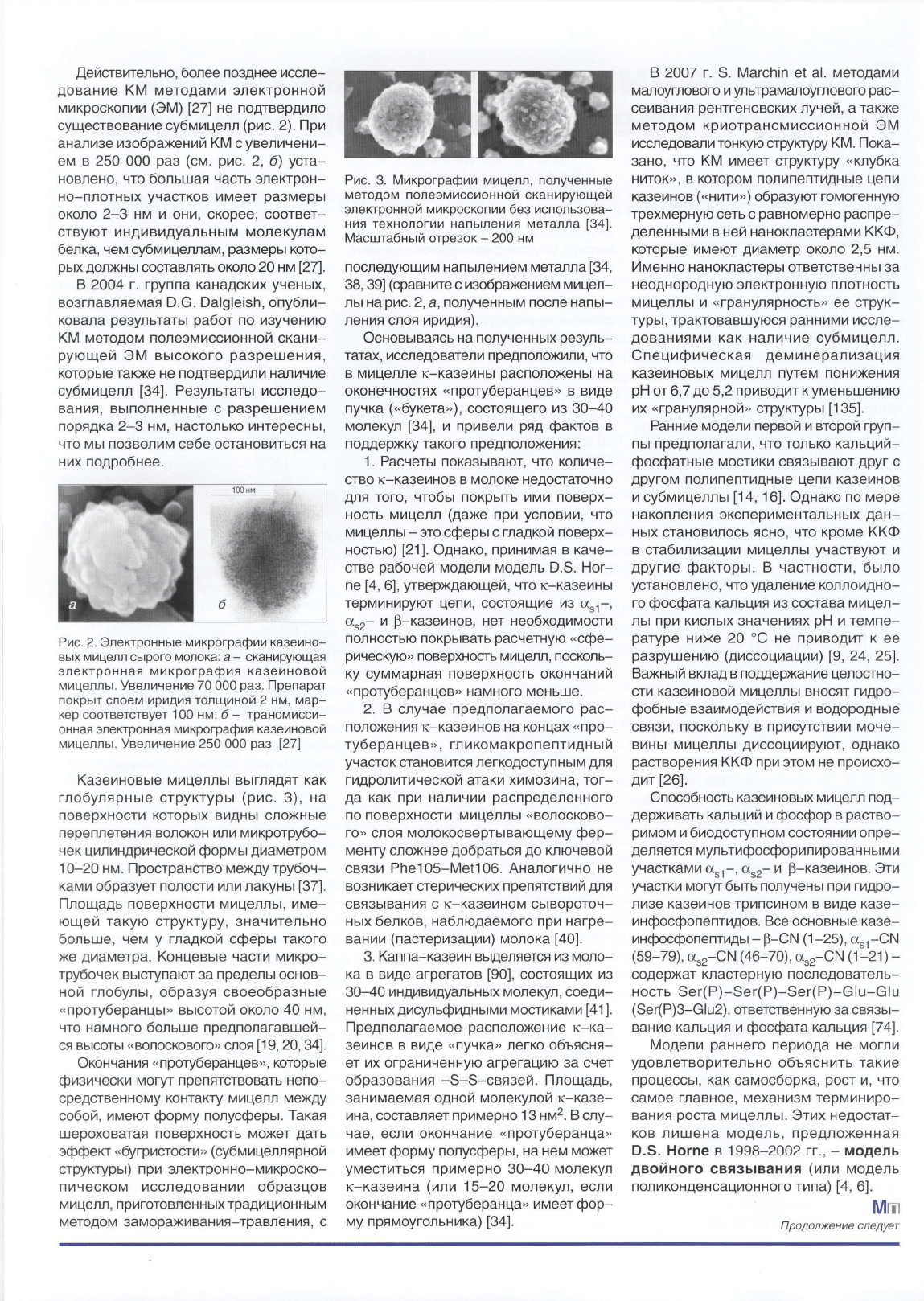
Действительно
,
более
позднее
иссле
дование
КМ
методами
электронной
микроскопии
(ЭМ)
[27]
не
подтвердило
существование
субмицелл
(рис.
2)
.
При
анализе
изображений
КМ
с
увеличени
ем
в
250 000
раз
(см.
рис.
2,
б)
уста
новлено
,
что
большая
часть
электрон
но-плотных
участков
имеет
размеры
около
2-3
нм
и
они
,
скорее
,
соответ
ствуют
индивидуальным
молекулам
белка,
чем
субмицеллам,
размеры
кото
рых
должны
составлять
около
20
н
м
[27].
В
2004
г
.
группа
канадских
ученых
,
возглавляемая
D.G. Dalgleish,
опубли
ковала
результаты
работ
по
изучению
КМ
методом
полеэмиссионной
скани
рующей
ЭМ
высокого
разрешения,
которые
также
не
подтвердили
наличие
субмицелл
[34].
Результаты
исследо
вания
,
выполненные
с
разрешением
порядка
2-3
нм,
настолько
интересны,
что
мы
позволим
себе
остановиться
на
них
подробнее
.
Рис
.
2.
Электронные микрографии
казеино
вых
мицелл
сырого
молока
:
а-
сканирующая
э
лектронная
микрография
казеиновой
мицеллы.
Увеличение
70 000
раз.
Препарат
по
к
рыт
слоем
иридия
толщиной
2
нм,
мар
к
ер
соответствует
100
н
м
;
б-
трансмисси
о
нная
э
лектронная
микрография
казеиновой
ми
целлы
.
Увеличение
250 000
раз
[27]
Казеиновые
мицеллы
выглядят
как
глобулярные
структуры
(рис.
3),
на
поверхности
которых
видны
сложные
переплетения
волокон
или
микротрубо
чек
цилиндрической
формы
диаметром
10-20
н
м.
Пространство
между
трубоч
ками
образует
полости
или
лакуны
[37].
Площадь
поверхности
мицеллы
,
име
ющей
такую
структуру,
значительно
больше
,
чем
у
гладкой
сферы
такого
же
диаметра
.
Концевые
части
микре
трубочек
выступают
за
пределы
основ
но
й
глобулы
,
образуя
своеобразные
<<
Протуберанцы
"
высотой
около
40
нм
,
что
намного
больше
предполагавшей
ся
ВЫСОТЫ
<<
ВОЛОСКОВОГО
>>
СЛОЯ
(19,
20,
34]
.
Окончания
<<
Протуберанцев
•
•,
которые
физически
могут препятствовать
непо
средственному
контакту
мицелл
между
собой
,
имеют
форму
полусферы.
Такая
шероховатая
поверхность
может
дать
эффект
<<
бугристости
••
(субмицеллярной
структуры)
при
электронна-микроско
пическом
исследовании
образцов
мицелл
,
приготовленных
традиционным
методом
замораживания-травления
,
с
Рис.
3.
Микрографии
мицелл,
полученные
методом
полеэмиссионной
сканирующей
электронной
микроскопии
без
использова
ния
технологии
напыления
металла
(34].
Масштабный
отрезок
- 200
н
м
последующим
напылением
металла
[34,
38,
39]
(сравните
с
изображением
мицел
лы
на
рис
.
2,
а,
полученным
после
напы
ления
слоя
иридия).
Основываясь
на
полученных
резуль
татах,
исследователи
предположили,
что
в
мицелле
к-казеины
расположены
на
оконечностях
<<Протуберанцев••
в
виде
пучка
(
<<букета
• •
),
состоящего
из
30-40
молекул
[34],
и
привели
ряд
фактов
в
поддержку
такого
предположения:
1.
Расчеты
показывают
,
что
количе
ство
к-казеинов
в
молоке
недостаточно
для
того,
чтобы
покрыть
ими
поверх
ность
мицелл
(даже
при
условии,
что
мицеллы-
это
сферы
с
гладкой
поверх
ностью)
[21
].
Однако,
принимая
в
каче
стве
рабочей
модели модель
D.S.
Ноr
пе
[4,
6],
утверждающей,
что
к-казеины
терминируют
цепи,
состоящие
из
а
8
г
,
а
8
2
-
и
~-казеинов,
нет
необходимости
полностью
покрывать
расчетную
< <
Сфе
рическую••
поверхность
мицелл,
посколь
ку
суммарная
поверхность
окончаний
<<
протуберанцев
••
намного
меньше
.
2.
В
случае
предполагаемого
рас
положения
к-казеинов
на
концах
<<
Про
туберанцев•
•,
гликомакропептидный
участок
становится
легкодоступным
для
гидролитической
атаки
химозина,
тог
да
как
при
наличии
распределенного
по
поверхности
мицеллы
<<
Волосково
го•
•
слоя
молокосвертывающему
фер
менту
сложнее
добраться
до
ключевой
связи
Phe1
05-Met1 06.
Аналогично
не
возникает
стерических
препятствий
для
связывания
с
к-казеином
сывороточ
ных
белков
,
наблюдаемого
при
нагре
вании
(пастеризации)
молока
[40].
3.
Каппа-казеин
выделяется
из
моло
ка
в
виде
агрегатов
[90],
состоящих
из
30-40
индивидуальных
молекул,
соеди
ненных
дисульфидными
мостиками
[41
].
Предполагаемое
расположение
к-ка
зеинов
в
виде
<<
пучка••
легко
объясня
ет
их
ограниченную
агрегацию
за
счет
образования
-S-S-связей.
Площадь
,
занимаемая
одной
молекулой
к-казе
ина
,
составляет
примерно
13
нм
2
.
В
слу
чае
,
если
окончание
<<
Протуберанца
••
имеет
форму
полусферы
,
на
нем
может
уместиться
примерно
30-40
молекул
к-казеина
(или
15-20
молекул
,
если
окончание
< <
протуберанца"
имеет
фор
му
прямоугольника)
[34].
В
2007
г
.
S.
Marchiп
et
al.
методами
малоуглового
и
ультрамалоуглового
рас
сеивания
рентгеновских
лучей,
а
также
методом
криотрансмиссионной
ЭМ
исследовали
тонкую
структуру
КМ.
Пока
зано
,
что
КМ
имеет
структуру
<<
клубка
ниток••,
в
котором
полипептидные
цепи
казеинов
(
< <
нити•
•
)
образуют
гомогенную
трехмерную
сеть
с
равномерно
распре
деленными
в
ней
нанокластерами
ККФ,
которые
имеют
диаметр
около
2,5
нм
.
Именно
нанокластеры
ответственны
за
несднородную
электронную
плотность
мицеллы
и
<
<
гранулярность
••
ее
струк
туры
,
трактовавшуюся
ранними
иссле
дованиями
как
наличие
субмицелл.
Специфическая
деминерализация
казеиновых
мицелл
путем
понижения
рН
от
6,7
до
5,2
приводит
к
уменьшению
их
<<гранулярной••
структуры
[1
35].
Ранние
модели
первой
и
второй
груп
пы
предполагали
,
что
только
кальций
фосфатные
мостики
связывают
друг
с
другом
полипептидные
цепи казеинов
и
субмицеллы
[14, 16].
Однако
по
мере
накопления
экспериментальных
дан
ных
становилось
ясно,
что
кроме
ККФ
в
стабилизации
мицеллы
участвуют
и
другие
факторы.
В
частности
,
было
установлено,
что
удаление
коллоидно
го
фосфата
кальция
из
состава
мицел
лы
при
кислых
значениях
рН
и
темпе
ратуре
ниже
20
о
с
не
приводит
к
ее
разрушению
(диссоциации)
[9,
24, 25].
Важный
вклад
в
поддержание
целостно
сти
казеиновой
мицеллы
вносят
гидро
фобные
взаимодействия
и
водородные
связи
,
поскольку
в
присутствии
моче
вины
мицеллы
диссоциируют
,
однако
растворения
ККФ
при
этом
не
происхо
дит
[26].
Способность
казеиновых
мицелл
под
держивать
кальций
и
фосфор
в
раство
римом
и
бисдоступном
состоянии
опре
деляется
муль
тифосфорилированными
участками
а
8
1
-,
а
82
-
и
~-казеинов
.
Эти
участки
могут
быть
получены
при
гидро
лизе
казеинов
трипсином
в
виде
казе
инфосфопептидов.
Все
основные
казе
инфосфопептиды-
~-CN
(1-25),
а
8
гСN
(59-79), a
82
-CN
(46-70), a
82
-CN
(1-21)-
содержат
кластерную
последователь
ность
Ser(P)-Ser(P)-Ser(P)-Giu-Giu
(Ser(P)3-Giu2),
ответственную
за
связы
вание
кальция
и
фосфата
кальция
[74].
Модели
раннего
периода
не
могли
удовлетворительно
объяснить
такие
процессы
,
как
самосборка
,
рост
и
,
что
самое
главное
,
механизм
терминиро
вания
роста
мицеллы
.
Этих
недостат
ков
лишена
модель,
предложенная
D.S. Horne
в
1998-2002
гг
.,
-модель
двойного
связывания
(или
модель
поликонденсационного
типа)
[4, 6].
M
fil
П
ро
должени
е с
л
едует
