Кубота Н. Твердые ракетные топлива и взрывчатые вещества
Подождите немного. Документ загружается.

61
нуля в дальней точке. Теплоперенос в газовую фазу прекращается на значитель-
ном расстоянии от поверхности горения, где температура достигает максимума и
образуются конечные продукты сгорания.
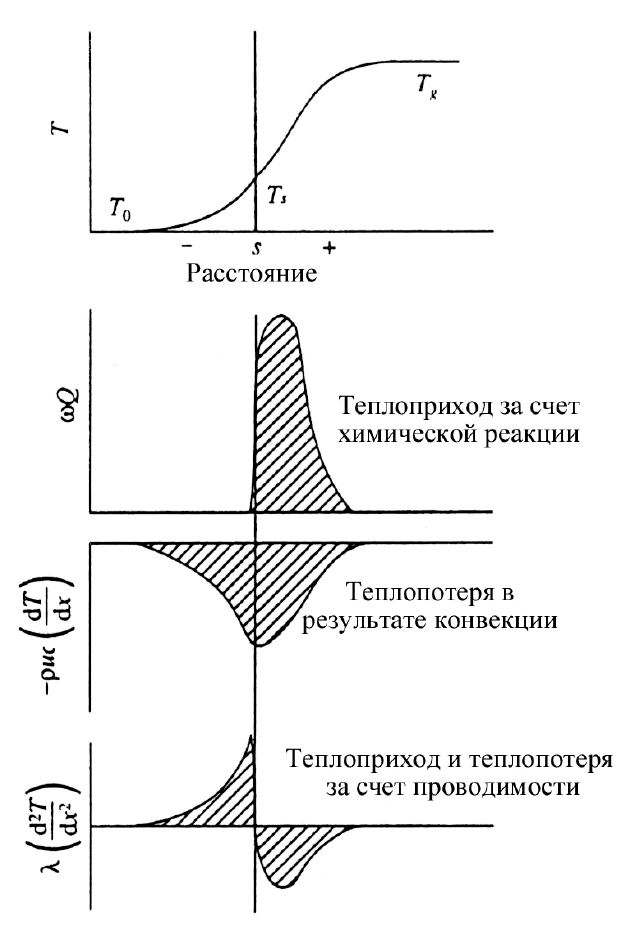
Рис. 3.11. Схематическое представление процессов оттока теплоты
в волну горения
3.5.1.2 Тепловая структура в конденсированной фазе
Для описания процесса энергопереноса в конденсированную фазу сделано
несколько дополнительных допущений в вышеприведенных уравнениях [9, 10]:
(1)
эндотермических или экзотермических реакций не происходит в кон-
денсированной фазе (ниже поверхности горения);
(2)
светящаяся зона пламени не делает вклада в обратную теплопровод-
ность от газовой фазы к поверхности горения;
(3)
не происходит диффузии компонентов в конденсированной или газовой
фазе.
62
Уравнения (3.39) и (3.40) можно упростить следующим образом:
0=−
⎟
⎠
⎞
⎜
⎝
⎛
dx
dT
rc
dx
dT
dx
d
ppp
ρλ , (3.43)
0
,
=−−
jp
j
p
dx
d
r ω
ε
ρ
(3.44)
Интегрирование уравнения (3.43) при граничных условиях:
Т = Т
0
при x = – ∞;
Т = Т
s
при x = 0
дает
Т(x) – Т
0
= (Т
s
– Т
0
) еxp (rx/α
р
), (3.45)
где α
р
– температуропроводность конденсированной фазы, определяемая как
α
р
= λ/ρ
р
с
р
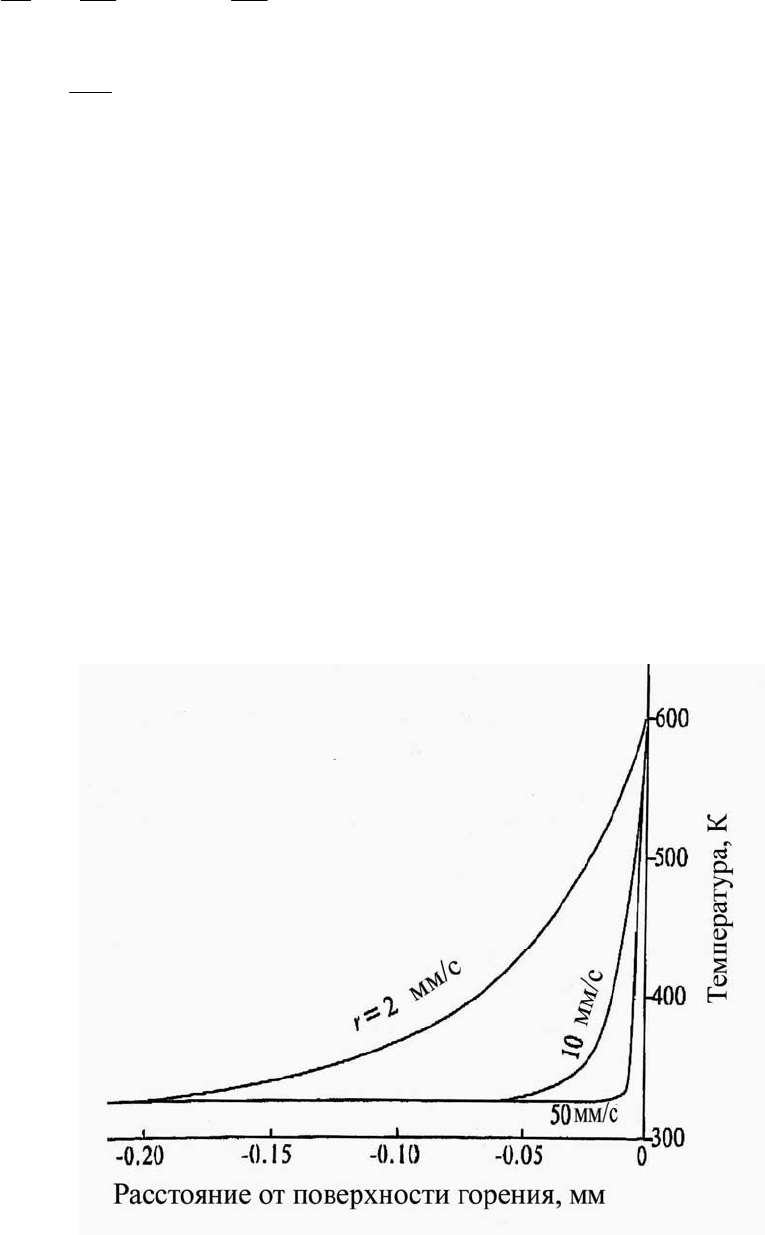
, то есть является независимой от температуры. На рис. 3.12 показаны
температурные профили в конденсированной фазе при r = 2 мм/с, 10 мм/с и
50 мм/с с допущениями, что T
0
= 325 К, T
s
= 600 К, λ
р
= 2,10 × 10
–4
кДж/с⋅м⋅К,
ρ
р
= 1600 кг/м
3
, с
р
= 1,47 кДж/кг К и α
р
= λ
р
/ρ
р
с
р
= 8,93 × 10
–8
м
2
/с. Толщина тепло-
вой волны в конденсированной фазе, определяемая как δ
р
= α
р
/r, составляет 45, 9
и 1,8 мк при r = 2, 10, 50 мм/с, соответственно. Температурный градиент в кон-
денсированной фазе увеличивается с увеличением скорости горения, то есть δ
р
уменьшается с увеличением скорости горения.
Рис. 3.12. Температурный профиль в конденсированной фазе
энергетического материала
63
3.5.1.3 Термическая структура в газовой фазе
Так как энергетические материалы состоят из нескольких химических ин-
гредиентов и каждая молекулярная структура является сложной, многочисленные
газообразные компоненты образуются на поверхности горения, и схемы их реак-
ций довольно сложны. Таким образом, определение скорости горения в газовой
фазе для каждого из компонентов j в процессе горения является довольно труд-
ным делом
. Трактовка реакции в газовой фазе, которая определяет температурный
градиент выше поверхности горения, Φ= (dТ/dx)
s,g
и обратный поток теплоты из
газовой в конденсированную фазу, Λ
g
= λ
g
Φ является отправной точкой, которая
приводит к уравнению скорости горения. Чтобы достичь фундаментального по-
нимания процесса обратного теплопотока в газовой фазе, допустим, что выделе-
ние тепла в газовой фазе задается ступенчатой функцией и имеет положительное
постоянное значение Q
g
ω
g
. Модель характеризует обратный тепловой поток из га-
зовой фазы в конденсированную фазу и при интегрировании уравнения (3.41)
принимается граничное условие, что тепловой поток в бесконечности равен нулю:
()
∫
∞
−=Λ
0
/exp dxxucQ
ggggggg
ωλρ
(3.46a)
По аналогии с конденсированной фазой температуропроводность в газовой
фазе задается как α
g
= λ
g
/ρ
g
с
g
, то есть допускается, что она не зависит от темпера-
туры. Толщина тепловой волны в газовой фазе δ
g
определяется как δ
g =
α
g
/и
g
. Далее
уравнение (3.46а) может быть представлено:
()
∫
∞
=−=Λ
0
/exp dxxuQ
ggggg
ωα
(3.46b)
=
()
∫
∞
−
0
/exp dxxQ
ggg
ωδ
(3.46с)
В общем, скорости реакций сильно зависят от температуры, когда энергия
активации высока. Таким образом, предполагается, что два важнейших фактора,
влияющих на скорость реакции – температура и концентрация реагирующего ве-
щества имеют тенденцию взаимоисключать друг друга, так как реакция протекает
таким образом, что при повышении температуры концентрация реагирующих ве-
ществ уменьшается.
Кроме того, предполагается, что результирующая постоянная
скорость реакции выявлена только в ограниченной зоне, то есть между x = x
i
и
x = x
g
.(рис. 3.13) и что скорость реакции в газовой фазе можно выразить через
ступенчатую функцию. Таким образом, интегрируя уравнение (3.46с), получаем
уравнение
[]
()()
(
)
{
}
gggigggg
xxQ
δδωδ
/exp/exp −−−=Λ , (3.46d)
где [ω
g
] – константа, имеющая положительное значение для x
i
< x ≤ x
g
, а равная
в другом месте равна нулю; [ω
g
] необходимо рассматривать как среднее значение
в случае реальной скорости реакции, возникающей в газовой фазе.
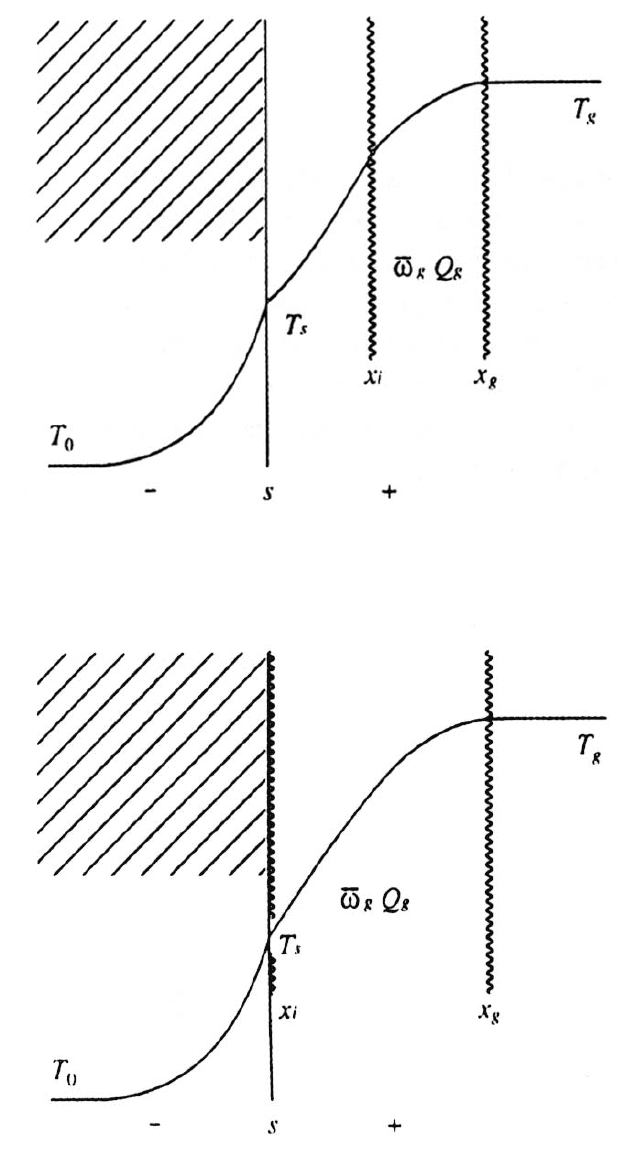
64
Рис. 3.13. Модель ступенчатой функции для реакции в газовой фазе,
которая начинается при x = x
i
и заканчивается при x = x
g
Рис. 3.14. Модель ступенчатой функции для реакции в газовой фазе,
которая начинается при x
i
= 0 и заканчивается при х = x
g
Если предположить, что химическая реакция, представленная как ступенча-
тая функция, начиная при x
i
= 0, то есть на поверхности горения, и заканчивается
при x = x
g
в газовой фазе, как показано на рис. 3.14, то уравнение (3.46d) можно
переписать следующим образом:
[]
()(){}
gggggg
xQ
δωδ
/exp1 −−=Λ (3.47)

65
Если член в экспоненциальном выражении x
g
/
δ
g
>> 1, то упрощенное выра-
жение для теплового потока в обратном направлении от газовой в твердую фазу
получается [8]:
Λ
g
=
δ
g
[ω
g
]Q
g
(3.48)
Эта асимптота имеет место всякий раз, когда тепло, передаваемое в обрат-
ном направлении к поверхности горения, является небольшим по сравнению с те-
плом, высвобождаемым в газовой фазе, из чего следует, что значение x
g
/δ
g
доста-
точно велико. Хотя уравнение (3.48) неточно, оно, однако, характеризует поведе-
ние скорости горения без введения математических сложностей и параметров ре-
акции.
3.5.1.4 Модель скорости горения
Если тепловой поток подается в обратном направлении из зоны II в зону I за
счет теплопроводности, то Λ
р
можно записать в следующем виде:
Λ
р
= λ
р
(dТ/dx)
s,р
= ρ
р
с
р
r(Т
s
– Т
0
), (3.49)
и тепловой поток, генерируемый в зоне конденсированной фазы на поверхности
горения Г
S
, равен
Г
s
= ρ
р
rQ
s
, (3.50)
где индекс s означает поверхность горения, а р – зону реакции в конденсирован-
ной фазе на поверхности горения. Граничные условия для уравнения энергии в
конденсированной фазе и на поверхности горения, соответственно, задаются сле-
дующим образом:
Т = Т
0
при x = – ∞
Λ
р
= Λ
g
+ Г
s
при x = 0 (3.51)
Обычно скорость ω
j
одноступенчатой реакции
∑∑
==
′′
⎯→⎯
′
N
i
i
N
i
i
k
ii
MvMv
g
11
может быть представлена как
()
()
∏
=
′
′
−
′′
===
N
h
v
hggii
j
gg
j
gj
h
kvv
dx
d
u
dt
d
1
ερ
ε
ρ
ε
ρω
, (3.52)
где М – обозначение произвольных химических компонентов, N – число парал-
лельных путей реакций в газовой фазе, k
g
– константа скорости реакции,
i
v
′
и
i
v
′
′
–
стехиометрические коэффициенты для компонентов i как реагирующих веществ и
j как продуктов реакции, соответственно. Поэтому обратный тепловой поток из
газовой фазы к поверхности горения получается из уравнений (3.42), (3.48) и
(3.52):
()
()
∑
∏
=
=
′
′
−
′′
=Λ
N
i
N
h
v
hggiiggg
h
kvvQ
1
1
,
ερδ
(3.53)

66
Предположим, что коэффициент температуропроводности на поверхности
раздела между конденсированной и газовой фазой, то есть на поверхности горе-
ния, представлен как
gpg
c
ρ
λ
α
/
0
= . Тогда, используя уравнение неразрывности
массы между конденсированной и газовой фазой
ggp
ur
ρ
ρ
=
, представленное
уравнением (3.1), определяют толщину тепловой волны δ
g
как
g
r
δ
α
=/
0
. Затем,
комбинируя уравнения (3.51) с (3.53) и решая относительно r, получаем
()
()
()
2
1
1
1
,
0
0
/
⎥
⎥
⎦
⎤
⎢
⎢
⎣
⎡
′
−
′′
−−
=
∑
∏
=
=
′
N
i
N
h
v
hggiig
psspp
h
kvvQ
cQTTc
r
ερ
ρ
α
(3.54)
Уравнение (3.54) является упрощенным уравнением для скорости горения.
Если скорости реакции в газовой фазе известны, то скорость горения задается че-
рез плотность газа (давление), температуру поверхности горения, начальную тем-
пературу топлива и физические свойства энергетического материала.
Температура поверхности горения связана со скоростью горения с помощью
уравнения Аррениуса, которое предполагает реакцию разложения
первого поряд-
ка для каждого вида реакционных компонентов на поверхности горения:
()
∑
=
−=
K
j
sjsjsj
RTEZr
1
,,
/exp
ε
, (3.55)
где K – число предполагаемых параллельных, независимых путей реакций гази-
фикации в конденсированной фазе. Уравнения (3.54) и (3.55) при сочетании могут
дать скорость горения и температуру поверхности горения для заданного ряда ус-
ловий.
Обычно реакции газовой фазы в моделях пламени предварительно переме-
шанных газов и газофазные реакции горения энергетических материалов, как
предполагают, являются
бимолекулярными и, следовательно, второго порядка.
Далее мы можем выразить уравнение (3.54) как
()
{}
(
){}
[]
2/1
0
2
0
//
pssppgggg
cQTTckQr −−=
ρρεα
(3.56)
Константа скорости реакции k
g
является функцией температуры и может
быть записана в следующем виде:
k
g
= Z
g
exр(–Е
g
/RТ
g
) (3.57)
Закон идеальных газов также может быть использован и связан с предпола-
гаемыми постоянными в пространстве р и Т
g
:
ρ
g
= р/R
g
Т
g
(3.58)
Уравнения (3.57) и (3.58) при подстановке в уравнение (3.56) дают возмож-
ность получить уравнение для скорости горения для энергетических материалов
топлива при допущениях, приведенных выше:

67
()
()
()
2
1
0
2
2
0
/
/exp
1
⎥
⎥
⎦
⎤
⎢
⎢
⎣
⎡
−−
−
=
pss
ggggg
gg
pp
cQTT
RTEZQ
TR
c
a
pr
ε
ρ
, (3.59)
где Т
g
задается как
Т
g
= Т
0
+ Q
s
/с
р
+ Q
g
/с
g
(3.60)
Скорость разложения на поверхности горения, то есть скорость горения,
может быть выведена из уравнения (3.55):
r = Z
s
еxр (–Е
s
/RT
s
) (3.61)
Нелинейный характер алгебраических уравнений (3.59) и (3. 61) подразуме-
вает необходимость их решения методом итераций.
3.5.2 Расстояние отбрасывания пламени
Если реагирующий газ, образующийся на поверхности горения энергетиче-
ского материала, реагирует медленно в газовой фазе и генерирует светящееся
пламя, то расстояние L
g
между поверхностью горения и фронтом светящегося
пламени называется расстоянием отбрасывания пламени. В газовой фазе, пока-
занной на рис. 3.9, температурный градиент, по-видимому, является небольшим, и
температура увеличивается относительно медленно. В этом случае тепловой по-
ток, передаваемый теплопроводностью, первый член уравнения (3.41) является
незначительным. Аналогично, скорость массовой диффузии, первый член уравне-
ния (3.42),
как предполагается, является небольшим по сравнению со скоростью
массовой конвекции, вторым членом уравнения (3.42).
Таким образом, получаем:
0=+−
ggggg
Q
dx
dT
cu ωρ , (3.62)
0=−−
i
i
gg
dx
d
u
ω
ε
ρ
(3.63)
Скорость реакции для реакции m-порядка может быть задана (игнорируя
температурную зависимость ρ
g
):
()
ggg
m
g
m
gg
RTEZ /exp −=
ρεω
(3.64)
Комбинируя уравнения (3.62) и (3.64), получаем
()
(
)
ggg
m
g
m
gggg
RTEZQuc
dx
dT
/exp/1
1
−=
−
ρε
(3.65)
Зависимость неразрывности (сплошности) потока массы между газовой фа-
зой и твердым телом можно представить в следующем виде:
и
g
= rρ
р
/ρ
g
(3.66)
68
Комбинируя уравнения (3.65) и (3.66) и используя закон идеального газа,
получаем
dT/dx = (1/c
g
ρ
p
r)Q
g
ε
m
(R
g
T
g
)
–m
p
m
Z
g
exp(–E
g
/RT
g
) (3.67)
Скорость горения энергетического материала выражается как
r = ap
n
, (3.68)
где п – показатель степени в законе скорости горения, а – постоянная, завися-
щая от химического состава и начальной температуры топлива. Подставляя урав-
нение (3.68) в уравнение (3.67), получают
()()
(
)
nm
gg
m
gg
m
gpg
pRTEZTRQacdxdT
−
−
−= /exp/1/
ερ
(3.69)
Температурный градиент dТ/dх в газовой фазе приблизительно равен
ΔТ
g
/L
g
, где ΔТ
g
является изменением температуры в зоне газовой фазы. Таким об-
разом, расстояние отбрасывания пламени L
g
составляет:
()
()
ggg
m
gg
m
gpgg
mn
g
RTEZQ
RTacT
pL
/exp −
Δ
=
−
ε
ρ
, (3.70)
~
dmn
pp =
−
(3.70а)
3.5.3 Характеристики скорости горения энергетических материалов
3.5.3.1 Показатель степени в законе скорости горения
Обычно скорость горения энергетических материалов увеличивается ли-
нейно по мере увеличения давления при использовании логарифмических коор-
динат для уравнения (3.68) при постоянной начальной температуре Т
0
, где
r – скорость горения, р – давление. Таким образом, чувствительность к давлению
скорости горения при постоянной начальной температуре n определяется как
0
ln
ln
T
p
r
n
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
∂
∂
= (3.71)
3.5.3.2 Температурная чувствительность скорости горения
Скорость горения любого энергетического материала зависит также от на-
чальной температуры материала, Т
0
, даже когда давление при горении поддержи-
вается постоянным. Температурная чувствительность скорости горения σ
р
опре-
деляется изменениями скорости горения при изменении Т
0
01
01
1
TT
rr
r
p
−
−
=
σ
, (3.72а)
где r
0
и r
1
– скорости горения при Т
0
и Т
1
, соответственно, r – средняя скорость
между Т
0
и Т
1
. Таким образом, величина σ
р
, по-видимому, равна K
–1
. Дифференци-
альная форма уравнения (3.72а) записывается в виде

69
pp
p
T
r
T
r
r
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
∂
∂
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
∂
∂
=
00
ln1
σ
(3.72b)
Используя уравнение (3.68), получаем
(
)
p
p
n
p
T
a
aT
ap
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
∂
∂
=
⎥
⎦
⎤
⎢
⎣
⎡
∂
∂
=
00
1ln
σ
(3.72c)
Температурная чувствительность скорости горения, определяемая уравне-
нием (3.72a), является параметром значительной уместности энергетических ма-
териалов.
3.5.4 Анализ температурной чувствительности скорости горения
Чтобы понять фундаментальную концепцию причины температурной чув-
ствительности, анализ, проведенный в этом разделе, предполагает, что волна го-
рения гомогенна и состоит из стационарных одномерных последовательных реак-
ционных зон. Реакция в газовой фазе происходит с одноступенчатым температур-
ным подъемом от температуры горящей поверхности до максимальной темпера-
туры пламени. Теплопередача в структуре волны
горения энергетических мате-
риалов показана на рис. 3.10. Обратный тепловой поток из зоны III в зону II за
счет теплопроводности Λ
g
= λ
g
(dТ/dx)
s,g
задан уравнением (3.46), а обратный теп-
ловой поток из зоны II в зону I за счет теплопроводности, Λ
р
= λ
р
(dТ/dx)
s,р
задается
уравнением (3.49). Используя интегрированное уравнение энергии [уравнение
(3.51)] на поверхности горения, скорость горения можно представить так:
ϕ
α
Φ=
s
r
(3.73)
Φ = (dТ/dx)
s,g
(3.74)
ϕ = Т
s
– Т
0
– Q
s
/с
р
(3.75)
α
s
=
λ
g
/
ρ
p
c
p
, (3.76)
где α
s
– коэффициент температуропроводности на поверхности горения.
Уравнение (3.73) показывает, что скорость горения энергетических мате-
риалов определяется двумя параметрами: газофазный параметр Ф , который опре-
деляется физическими и химическими свойствами газовой фазы, а параметр кон-
денсированной фазы φ, который определяется физическими и химическими свой-
ствами конденсированной фазы. Когда начальная температура увеличивается от
Т
0
до Т
0
+ ΔТ
0
, то температурный профиль соответствует представленному на
рис. 3.15. Температура горящей поверхности Т
s
также увеличивается до значения
Т
s
+ ΔТ
s
, и конечная температура горения увеличивается с Т
g
до Т
g
+ ΔТ
g
.
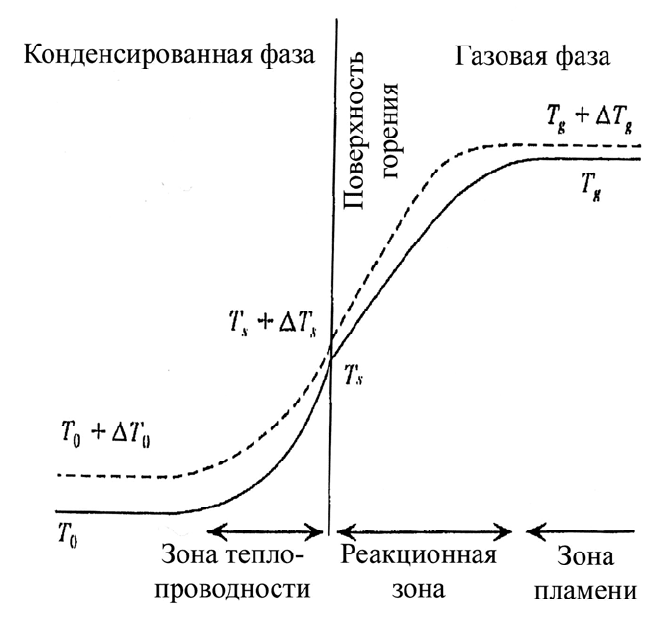
70
Рис. 3.15. Температурные профили в волне горения при различных начальных
температурах энергетического материала
Когда логарифмическая форма уравнения скорости горения, заданная урав-
нением (3.73), дифференцируется относительно начальной температуры энерге-
тического материала при постоянном давлении, то получается следующее выра-
жение:
() ()
{
}
(
)
{
}
p
psspp
p
gs
g
p
TcQTTcdTdxdTTr
000
,
0
//ln//ln/ln ∂−−∂−∂=∂∂
ρλ
(3.77)
Следовательно, физическое свойство α
s
– температуропроводность на горя-
щей поверхности не зависит от Т
0
и уравнение (3.77) записывается:
()()
Ψ
+
Φ
=
∂
∂−∂Φ∂=
рр
р
TТ
00
/ln/ln
ϕ
σ
, (3.78)
где
()
p
T
0
/ln ∂Φ∂=Φ (3.79)
и
()
р
T
0
/ln ∂∂−=Ψ
ϕ
(3.80)
Из уравнения (3.78) видно, что температурная чувствительность состоит из
двух параметров [11] Φ и Ψ: Φ – так называемая "температурная чувствитель-
ность газовой фазы", которая определяется параметрами газовой фазы, и
Ψ – так называемая "температурная чувствительность конденсированной фазы",
которая определяется параметрами конденсированной фазы.
Если предположим, что реакция в газовой фазе записывается уравнением
(3.48), то
обратный тепловой поток от газовой фазы к горящей поверхности опре-
деляют как
λ
g
Φ = α
0
[ω
g
]Q
g
/r (3.81)
