Климнюк С.І., Ситник І.О., Творко М.С., Широбоков В.П. Практична мікробіологія: Посібник
Подождите немного. Документ загружается.


201
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань
Метод уринокультури застосовують переважно для діагностики бактеріо-
носійства у реконвалесцентів. Найчастіше бактерії в сечі виявляють на 3-4 тижні
хвороби. Після ретельного туалету зовнішніх статевих органів сечу краще брати
за допомогою катетера в стерильний посуд. У лабораторії 30-50 мл сечі центрифу-
гують і осад сіють в середовище збагачення (селенітове, Мюллера, Кауфмана), а
також на 1-2 чашки з середовищем Ендо (Плоскирєва, вісмут-сульфіт-агар). Виді-
лення й ідентифікацію проводять так само, як і при дослідженні інших матеріалів.
Метод копрокультури для діагностики захворювання використовують рідко,
оскільки бактерії в фекаліях появляються пізно. Частіше його застосовують для
обстеження реконвалесцентів на бактеріоносійство та здорових осіб, які влашто-
вуються на роботу і працюють в системі громадського харчування, водопостачан-
ня та дитячих закладах. Матеріал у хворих і реконвалесцентів беруть без викори-
стання проносного. Здоровим особам за 3-4 год до забору матеріалу дають 30 г
магнезіальної солі. Пробу відбирають з рідкої частини фекалій. При патологічних
домішках у випорожненнях (слиз, гній, кров) їх включають до взятого матеріалу.
Проби фекалій в кількості 5-10 г набирають дерев’яним шпателем у спеціальні
стандартні стерильні пластмасові патрони одноразового використання або скляні
широкогорлі баночки. На них наклеюють етикетку, де вказують дату забору, прізви-
ще та ініціали хворого і мету дослідження. Краще всього посів зробити біля ліжка
хворого. При неможливості швидко доставити матеріал до лабораторії, його вно-
сять у консервант у співвідношенні 1:3. Найчастіше для цього використовують
рідину, що містить 30 % стерильний розчин гліцерину у фосфатному буфері.
У бактеріологічній лабораторії фекалії сіють одночасно двома способами –
прямим на елективне середовище (вісмут-сульфіт-агар, Плоскирєва, Ендо, Леві-
на) і на одне із середовищ збагачення (селенітове, Мюллера, Кауфмана). Вибір
середовищ проводить бактеріолог.
При прямому висіві на відповідне щільне середовище невелику кількість
випорожнень розміщують у пептонній воді або у 0,85 % розчині хлориду натрію і
залишають на 30 хв для осідання крупних частинок. Із поверхні рідини беруть
краплю матеріалу і засівають у чашки з елективним середовищем.
Посів на середовище збагачення (в ньому сальмонели розмножуються краще
і швидше, ніж супутня мікрофлора) одночасно з прямим посівом є обов’язковим
при дослідженні здорових людей на бактеріоносійство, оскільки вони виділяють
невелику кількість бактерій. Однак, у зв’язку з широким вживанням населенням
різноманітних антибіотиків, необхідно використовувати середовища збагачення і
при посівах випорожнень від хворих, особливо при епідемічних показаннях.
При посіві на середовища збагачення шматочок фекалій емульгують у 10 мл
цього ж середовища. Наступний висів із нього на щільне елективне середовище
доцільно робити вже через 5-6 год підрощування в термостаті.
Спинномозкову рідину досліджують при наявності менінгеальних і менінго-
енцефалітичних синдромів. Посіви гною, ексудату, харкотиння, грудного молока
породіль проводять у такому ж порядку, як вище описано. При дослідженні секцій-
ного матеріалу сіють кров із серця, шматочки паренхіматозних органів, вміст тон-

202
Частина ІІІ. Спеціальна мікробіологія
кого кишечника. В лабораторії матеріал розтирають у ступках із стерильним піском,
переводять у рідку фазу і досліджують так само, як і випорожнення.
Дослідження води на виявлення тифозних і паратифозних мікробів прово-
дять при розслідуванні водних спалахів захворювань та інших епідеміологічних
показаннях. Оскільки збудники у воді знаходяться у невеликій кількості, для їх
надійнішого виявлення застосовують методи, які дозволяють концентрувати бак-
терії з досліджуваного об’єму води. Найкраще це можна зробити за допомогою
мембранних фільтрів. Для цього 2-3 л води пропускають через фільтри № 2 (або
№ 3). Фільтри з адсорбованими на них бактеріями опускають у селенітовий бульйон
або накладають на вісмут-сульфітний агар. Через 8-10 год інкубування в термо-
статі роблять висів із селенітового бульйону на одне з диференціальних щільних
середовищ з метою отримання ізольованих колоній і наступного виділення чис-
тих культур. Із поверхні фільтрів на вісмут- сульфіт-агарі після 24-48 год вирощу-
вання в термостаті пересівають колонії чорного кольору на середовище Ольке-
ницького й ідентифікують виділені культури.
Якщо виявити збудників черевного тифу і паратифів не вдається, можна дослі-
джувати воду на наявність відповідних бактеріофагів. Для цього воду спочатку
фільтрують через фільтр і 1-2 мл фільтрату вносять у стерильну чашку Петрі, залива-
ють 15 мл розтопленого і охолодженого до 45-50 °С МПА, ретельно переміщують. На
поверхню застиглого агару засівають секторами культури збудників черевного тифу
і паратифів. Поява негативних колоній свідчить про присутність відповідного фагу.
Ідентифікація чистих культур. Виділені культури ідентифікують за мор-
фологічними, культуральними, біохімічними властивостями, антигенною струк-
турою та фаголізабельністю. При мікроскопії мазків, забарвлених за Грамом, че-
ревнотифозні і паратифозні бактерії мають вигляд паличок червоного кольору із
заокругленими кінцями розміром 0,5-0,8 г 1-3 мкм, активно рухливі у висячій чи
надавленій краплі.
Ріст у МПБ супроводжується помутнінням. На МПА виростають ніжні, круглі,
гладенькі, прозорі або напівпрозорі колонії розміром 2-4 мм. Однак колонії ти-
фозних мікробів, що мають Vi-антиген, каламутні. У S. paratyphi B колонії грубіші,
через кілька днів по периферії колоній утворюється слизовий валик.
На середовищах Ендо, Левіна, Плоскирєва колонії безбарвні, прозорі, часом
рожевуваті (Ендо) або злегка голубуваті (Левіна). На вісмут-сульфітному агарі
черевнотифозні мікроби утворюють колонії чорного кольору, іноді зі світлим обід-
ком. Паратифозні бактерії на цьому середовищі можуть утворювати коричневі або
зеленуваті колонії. Після зняття колонії на середовищі залишається чорний слід.
На середовищі Олькеницького тифозна паличка розкладає глюкозу до кисло-
ти (жовтіє стовпчик агару), не ферментує лактозу і сахарозу (забарвлення скоше-
ної частини не змінюється), виділяє сірководень (почорніння на межі стовпчика і
скошеної частини). Паратифозні бактерії ферментують глюкозу до кислоти і газу
(пожовтіння та розриви стовпчика агару).
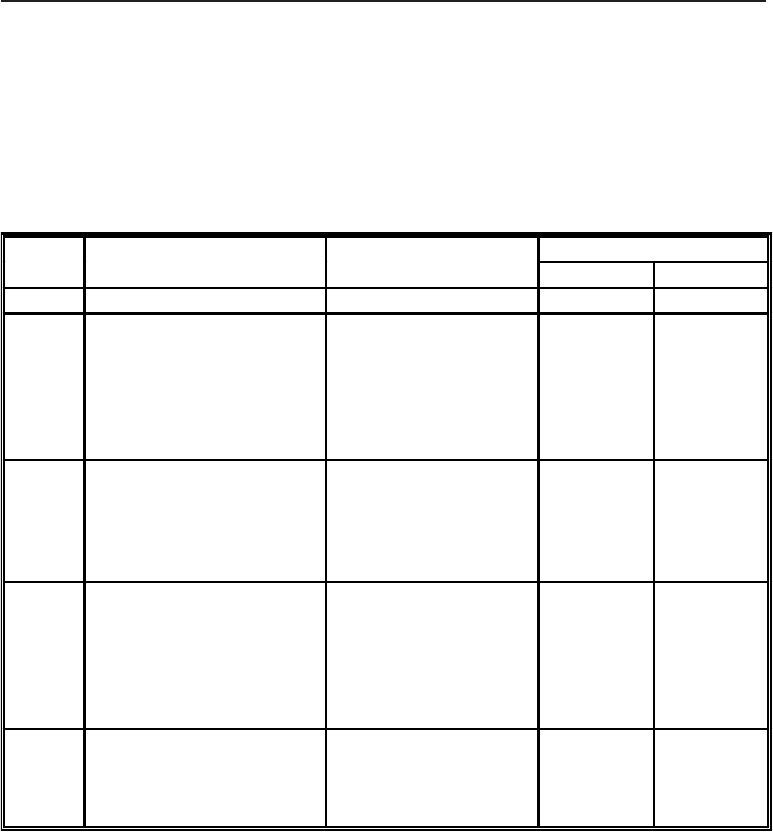
Біохімічні ознаки тифозно-паратифозних мікробів вивчають при посіві на
середовища “строкатого” ряду Гісса (табл. 37).

203
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань
Таблиця 37
Ферментативні властивості ешерихій і тифозно-паратифозних бактерій
Більш надійною є серологічна ідентифікація виділених культур в реакції аг-
лютинації з діагностичними сироватками. Спочатку реакцію ставлять на склі з
адсорбованими аглютинуючими сироватками, які містять антитіла до антигенів
09 (S. typhi), 02 (S. paratyphi A) і 04 (S. schottmuelleri). Якщо виділена культура за
біохімічними властивостями подібна до тифозної, але не аглютинується 09-сиро-
ваткою, її необхідно проаглютинувати з Vi-сироваткою.
Для постановки реакції аглютинації на предметне скло наносять краплю відпо-
відної сироватки і рядом краплю фізіологічного розчину. Бактеріологічною пет-
лею набирають культуру з середовища Олькеницького, емульгують її в краплі фізіо-
логічного розчину і з’єднують із краплею сироватки. При відповідності культури
і сироватки появляється аглютинація, за результатами якої визначають належність
досліджуваної культури до серогрупи. Серовар встановлюють в реакції аглюти-
нації з монорецепторними Н-сироватками.
В разі відсутності в лабораторії адсорбованих монорецепторних сироваток
ставлять розгорнуту реакцію аглютинацію в пробірках (р-ція Грубера) з видовими
тифозними і паратифозними сироватками. Діагностичну сироватку необхідно розво-
дити до титру, вказаного на етикетці ампули. Якщо реакція аглютинації випадає до
титру, або принаймні до половини титру, тоді культура відповідає виду сироватки.
Фаготипування виділених культур. Важливе епідеміологічне значення, особ-
ливо для встановлення джерела інфекції, має фаготипування тифо-паратифозних
мікробів. Збудники черевного тифу з Vi-антигеном лізуються Vi-бактеріофагами.
Їх нараховують 86 типів. Всі вони високоспецифічні. Є набори фагів і для типу-
вання паратифозних сальмонел.
Для фаготипування беруть молоді культури (4-6-годинні) досліджуваних
штамів, набори типових бактеріофагів у тест-розведеннях та стандартне свіжови-
готовлене й добре підсушене середовище. Культуру засівають суцільним газоном,
чашки обов’язково підсушують у термостаті. На поверхню газону пастерівською
піпеткою, штампом-реплікатором або каліброваною петлею наносять типові фаги.
Попередньо дно чашки розмічують на квадрати, в яких вписують номер типового
фагу. Після підсихання крапель чашки інкубують у термостаті 5-6 год і врахову-
ють результати. Фаготип встановлюють за наявністю лізису культури відповід-
ним фагом. Для визначення джерела інфекції проводять також коліцинотипуван-
ня сальмонел.
Останнім часом в добре оснащених мікробіологічних лабораторіях викорис-
товують більш чутливі й специфічні методи лабораторної діагностики черевного
Вид Лактоза Глюкоза Мальтоза Маніт Сахароза Індол H
2
S
Escherichia coli
Salmonella typhi
Salmonella paratyphi A
Salmonella schottmuelleri
кг
-
-
-
кг
к
кг
кг
кг
к
кг
кг
кг
к
кг
кг
кг±
-
-
-
+
-
-
-
±
+
-
+

204
Частина ІІІ. Спеціальна мікробіологія
тифу і паратифів. Так, для виявлення О- і Vi-антигенів в крові, випорожненнях та
інших матеріалах застосовують РЗК, реакцію непрямої гемаглютинації з еритро-
цитарними антитільними (О- і Vi) діагностикумами. Перспективне також викори-
стання реакції коаглютинації, агрегат-аглютинації та ІФА. Для прискореної іден-
тифікації збудників черевного тифу і паратифів застосовують ДНК-зонд, що несе
на собі ген Vi -антигена. Результат отримують через 3-4 год.
Серологічне дослідження проводиться як для діагностики захворювання, так
і для встановлення бактеріоносійства. З діагностичною метою ставлять розгорну-
ту об’ємну реакцію Відаля і РНГА з О- і Vi еритроцитарними діагностикумами.
РНГА є більш надійна й специфічна. Останнім часом все ширше використовують
виявлення антитіл за допомогою методу ІФА. Діагностична цінність серологіч-
них реакцій значно підвищується при постановці їх методом парних сироваток.
Реакція Відаля. Аглютиніни до збудників черевного тифу і паратифів вияв-
ляють у сироватці крові, починаючи з 8-10 дня захворювання й пізніше. Динаміка
їх накопичення досить своєрідна: спочатку появляються антитіла до О-антигену,
але їх титр швидко зменшується після видужування. Н- і Vi-антитіла з’являються
пізніше, але роками зберігаються у високих титрах після хвороби, щеплень і у
бактеріоносіїв. У зв’язку з цим для правильної оцінки серологічної реакції важли-
во одночасно виявляти всі типи аглютинінів.
Для постановки реакції аглютинації Відаля необхідно три компоненти: 1) ан-
титіла (сироватка хворого); 2) антиген (бактерійний або еритроцитарний діагнос-
тикум); 3) 0,85 % розчин хлориду натрію (електроліт).
Для одержання сироватки у хворого з вени, пальця або мочки вуха в стериль-
ну пробірку беруть 2-3 мл крові, ставлять її в термостат на 30 хв для згортання.
Утворений згусток обводять пастерівською піпеткою, відділяючи його від стінок
пробірки, вміщують на 30-40 хв у холодильник, відсмоктують сироватку і роблять
її робоче розведення 1:50. Потім у шести паралельних рядах аглютинаційних про-
бірок роблять наступні розведення сироватки від 1:100 до 1:1600 за стандартною
схемою (табл. 38)
Таблиця 38
Схема постановки реакції Відаля
Номери пробірок
Компоненти
1 2 3 4 5 6 Кс 7 Кд
0,85 % розчин хлориду натрію,
мл
1 1 1 1 1 - 1
Сироватка хворого в розведенні
1:50, мл
1
→
1
→
1
→
1
→
1
↓
1 -
Одержане розведення сироватки 1:100 1:200 1:400 1:800 1:1600 1:100 -
Діагностикум, краплі 2 2 2 2 2 - 2
Інкубація в термостаті при
37 °С –2 год; 18 °С – 18 год
Облік реакції
Примітка: Кс – контроль сироватки, Кд – контроль діагностикумуму.

205
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань
В якості антигенів для реакції аглютинації використовують черевнотифозні
монодіагностикуми 09 і Hd, а також паратифозні О- і Н-діагностикуми. Вони є 3-х
млрд зависі вказаних бактерій, вбитих нагріваннями або формаліном. О-діагнос-
тикуми готують кип’ятінням культур або обробляють їх спиртом, Н-діагностику-
ми – обробкою культур формаліном. В кожну пробірку ряду, окрім шостої, (конт-
роль сироватки – КС) добавляють по 2 краплі діагностикуму. Сьома пробірка є
контролем діагностикуму (КД). Штативи з пробірками енергійно струшують і став-
лять на 2 год у термостат, після чого роблять попередній облік результатів реакції.
Остаточний облік проводять через 18-20 год знаходження пробірок при кімнатній
температурі. При позитивній реакції аглютинації утворюється білуватий осад на
дні пробірки із більш-менш прозорою рідиною над ним. При негативній реакції
рідина залишається каламутною, осад на дні пробірки відсутній. Аглютинацію
вважають специфічною, коли в контрольних пробірках (КС і КД) аглютинат не
утворюється. Під час обліку результатів звертають увагу на характер аглютинатів:
О-аглютинація буде дрібнозернистою, а Н-аглютинація – крупнопластівцевою.
При типовій клінічній картині черевного тифу діагностичним титром реакції
Відаля у хворих, що не прищеплювалися, вважають розведення 1:100 і вище, при
атипових чи стертих формах захворювання – не нижче 1:200. Останнім часом ре-
акцію Відаля не вважають дуже специфічною. Вона може бути позитивною і при
інших захворюваннях, що супроводжуються гарячкою, після щеплення або рані-
ше перенесеної хвороби тощо. І все ж висока специфічність реакції може бути
виявлена при її постановці в динаміці методом парних сироваток. Ні анамнес-
тичні, ні прищепні чи групові антитіла не покажуть наростання титру з другою
сироваткою, взятою через 10-12 днів. Всі ці особливості в якійсь мірі обмежили
постановку цієї реакції з діагностичною метою. Особливо це проявляється при
раньому лікуванні хворих антибіотиками. Останні значною мірою інактивують
антигени (збудники), титр антитіл у таких пацієнтів низький і не може вважатись
діагностичним.
Реакція Vi-гемаглютинації. При серологічній діагностиці черевного тифу і
паратифів останнім часом ширше використовують РНГА, особливо для виявлен-
ня Vi -антитіл. Вона ставиться спочатку з комплексним еритроцитарним діагнос-
тикумом АВСДЕ, потім з черевнотифозним еритроцитарним 09- і Hd діагности-
кумом, і, насамкінець, з Vi -еритроцитарним діагностикумом.
Vi-антитіла при черевному тифі не мають значного діагностичного чи про-
гностичного значення. Виявлення цих антитіл має важливе значення для виявлен-
ня осіб, підозрілих на бактеріоносійство.
Реакцію ставлять у пластмасових планшетах з лунками. Кров у хворих чи
бактеріоносіїв беруть так само, як і для реакції Відаля. Сироватку розводять у
лунках від 1:10 до 1:160 в об’ємі 0,5 мл. У кожну лунку потім вносять по 0,25 мл
еритроцитарного діагностикуму. Планшети ставлять у термостат на 2 год, потім
залишають при кімнатній температурі ще на 18-20 год. Результати враховують за
чотириплюсовою системою: ++++ – еритроцити повністю аглютинувались, на дні
лунки пухкий осад у вигляді перекинутої “парасольки”; +++ – “парасолька” менша,

206
Частина ІІІ. Спеціальна мікробіологія
не всі еритроцити аглютинувались; ++ – аглютинат маленький, є осад неглютино-
ваних еритроцитів; (-) – негативна реакція, на дні лунки щільний осад еритро-
цитів у вигляді “монетного стовпчика”.
Діагностичне значення має реакція в титрі 1:40 і вище. Але для постановки
остаточного діагнозу “бактеріоносійство” потрібно обов’язково виділити чисту
культуру збудника за методом копро- білі- чи уринокультури.
Постановка алергічної проби. Як допоміжний метод діагностики черевного
тифу використовують шкірну алергічну пробу з Vi -тифіном, що містить Vi -алер-
ген, який при взаємодії з Vi-антитілами викликає місцеву алергічну реакцію шкіри
у вигляді почервоніння і набряку через 20-30 хв. Проба з Vi - тифіном стає позитив-
ною в період реконвалесценції й може бути використана для ретроспективної
діагностики.
Сальмонельози (харчові токсикоінфекції)
Гастроентерити сальмонельозної етіології – гострі антропо-зоонозні інфекції,
які викликають численні бактерії з роду Salmonella; характеризуються переваж-
ним ураженням кишкового тракту й інтоксикацією. Всього відомо понад 2200 се-
роварів сальмонел, із них більше 400 є патогенними для людини. Переважна їх
більшість патогенні як для людей, так і для різних видів тварин та птахів. Винят-
ком є сальмонели черевного тифу, паратифу А, які патогенні лише для людини і
викликають зовсім інші клінічні форми захворювань.
Основними збудниками сальмонельозів є S. typhimurium, S. enteritidis, S.
choleraesuis, S. heidelberg, S. anatum, S. haifa, S. derby та ін. Сальмонели мають О-,
Н- і К-антигени. За О-антигеном вони поділяються на 50 серологічних груп, які
позначаються великими літерами латинського алфавіту (A-Z) і цифрами (51-65).
Головним методом лабораторної діагностики сальмонельозів, виявлення бак-
теріоносіїв і контамінації харчових продуктів та інших об’єктів оточуючого сере-
довища є бактеріологічне дослідження.
Взяття досліджуваного матеріалу. Від хворих на сальмонельоз забира-
ють блювотні маси, промивні води шлунка, випорожнення, кров (у перші години
захворювання при підозрі на бактеріємію), кістковий мозок, жовч, сечу, спинно-
мозкову рідину. Для виявлення бактеріоносіїв серед працівників підприємств гро-
мадського харчування, водопостачання та дитячих закладів досліджують фекалії
після прийому проносного. При розтині трупів беруть вміст шлунка і кишок, кров
із серця, шматочки паренхіматозних органів, лімфатичні вузли брижі.
При діагностиці харчових токсикоінфекцій обов’язково беруть також залиш-
ки підозрілої їжі, продукти, з яких її готували, змиви з поверхні столів, кухонних
дощок, рук обслуговуючого персоналу тощо. Досліджуваний матеріал забирають
в стерильний посуд у таких кількостях: випорожнення, блювотні маси – 50 мл;
промивні води – 100 мл; м’ясо і м’ясні продукти – 0,5 кг; креми, масло, морозиво,
молоко, сметану та інші рідкі й напіврідкі продукти – 100-150 г; тушки птахів
направляють цілком.

207
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань
До лабораторії матеріали доставляють в упакованому та опечатаному виг-
ляді. При неможливості швидкої доставки їх зберігають при 4-6
0
С не більше доби.
Перед посівом наважку щільних (густих) матеріалів гомогенізують у сте-
рильній ступці з пептонною водою або 0,85 % розчином хлориду натрію у
співвідношенні 1:5. Блювотні маси та кислі харчові продукти нейтралізують 10%
розчином бікарбонату натрію. Випорожнення розмішують у стерильному фізіоло-
гічному розчині 1:10. Поверхню м’яса, шинки, ковбаси, сиру стерилізують, прикла-
даючи розжарений металевий шпатель, вирізають пробу з глибини, роблять мазки-
відбитки для первинної мікроскопії, потім вносять її у фарфорову ступку, розти-
рають із стерильним піском і добавляють ізотонічний розчин хлориду натрію.
Бактеріологічне дослідження. Посів крові для виділення гемокультури про-
водять так само, як і при черевному тифі у флакон із жовчним бульйоном чи сере-
довищем Рапопорт. Випорожнення, сечу, промивні води, блювотні маси, гній, сек-
ційний матеріал, харчові продукти й змиви обов’язково сіють в середовище нако-
пичення (селенітовий, магнієвий чи жовчний бульйон), а також паралельно на
середовище Плоскирєва або вісмут-сульфітний агар. Крем, масло, морозиво сіють
після їх розтоплення при 43-45 °С (краще з додаванням Твіну-80). Посіви вирощу-
ють при 37 °С. Через 6-8 год із середовища накопичення роблять пересів на агар
Плоскирєва. Наступного дня досліджують ізольовані лактозонегативні колонії
(безбарвні на середовищі Плоскирєва і чорні або зеленкуваті на вісмут-сульфітному
агарі), мікроскопують їх і пересівають на трицукровий агар Олькеницького для
накопичення чистої культури. На третій день виділені культури ідентифікують.
Для вивчення біохімічних властивостей їх сіють у середовища Гісса або дос-
ліджують у стандартних ентеротестах. Більшість сальмонел розкладають глюко-
зу, мальтозу, маніт до кислоти і газу, не ферментують адоніт, лактозу, сахарозу,
саліцин, не продукують індол, виділяють сірководень, не розкладають сечовину,
не розріджують желатин, дають негативну реакцію Фогеса-Проскауера.
Для надійнішої ідентифікації сальмонел використовують реакцію аглютинації
на склі з адсорбованими груповими сироватками А, В, С, Д і Е. Саме серед цих
п’яти серогруп зустрічаються сальмонели, які найчастіше викликають захворю-
вання. При отриманні позитивного результату хоча б із однією груповою сироват-
кою, наступну реакцію аглютинації проводять з адсорбованими О-сироватками,
характерними для даної серогрупи, а потім і з монорецепторними Н-сироватками
(першої, а при необхідності й другої фази). При цьому необхідно користуватись
схемою класифікації сальмонел за Кауффманом і Уайтом (табл. 39).
На основі реакції аглютинації з адсорбованими і монорецепторними сиро-
ватками роблять остаточний висновок про вид і серовар збудника. Можна також
використати реакцію флуоресценції з міченими флуорохромами антитілами і ме-
тод ІФА. Культури, які не аглютинуються сальмонельозними сироватками, іден-
тифікують за морфологічними, культуральними, біохімічними властивостями, а
також за допомогою О-1 бактеріофага, який лізує переважну кількість сальмонел.
Збудники сальмонельозів найчастіше виділяють із фекалій хворих, рідше з
блювотних мас і промивних вод, ще рідше з крові, жовчі та сечі. Ці результати
208
Частина ІІІ. Спеціальна мікробіологія
мають неоднакову діагностичну значущість. Виділення збудників із крові, кістко-
вого мозку, спинномозкової рідини, блювотних мас і промивних вод є беззапереч-
ним підтвердженням діагнозу. Знаходження сальмонел у випорожненнях, сечі,
жовчі може бути обумовлене бактеріоносійством. Важливим доказом етіологіч-
ного значення сальмонел у виникненні гастроентеритів є наростання титру ан-
титіл у реакції аглютинації з автоштамом.
Таблиця 39
Серологічна класифікація сальмонел (фрагмент)
Н-антиген
Група Вид О-антиген
1 фаза 2 фаза
А S. paratyphi A 1, 2, 12 a -
В S. schottmuelleri
S. aboni
S. typhimurium
S. derby
S. haifa
S. heidelberg
1, 4, 5, 12,
1, 4, 5, 12
1, 4, 5, 12
1, 4, 5, 12
1, 4, 5, 12
1, 4, 5, 12
b
b
i
f, g
z
r
1, 2
e, n, x
1, 2
1,2
1, 2
1, 2
С S. hirschfeldii
S. choleraesuis
S. thomson
S. newport
S. bonn
6, 7, Vi
6, 7
6, 7
6, 8
6, 7
c
c
k
e, h
e,v
1, 5
1, 5
1, 5
1, 2
e, n, x
Д S. typhi
S. enteritidis
S. dublin
S. rostoc
S. moscow
S. gallinarum
9, 12, Vi
1, 9, 12
1, 9, 12
1, 9, 12
1, 9, 12
1, 9, 12
d
g, m
g, p
g, p, u
g, q
-
-
1, 7
-
-
-
-
Е S. london
S. anatum
S. amsterdam
S. zanzibar
3, 10
3, 10
3, 10
3, 10
l, v
e, h
g, m, s
k
1, 6
1, 6
-
1, 5
Постановка біопроби. На відміну від паратифозних мікробів А і С сальмо-
нели, що викликають гастроентерити, патогенні для білих мишей. Цю особливість
можна використати для диференціації вказаних бактерій. Білих мишей на початку
аналізу перорально заражують досліджуваним матеріалом, а після виділення куль-
тури – суспензією бактерій. Через 1-2 доби після зараження тварини гинуть від
септицемії. Із крові чи паренхіматозних органів загиблих мишей виділяють куль-
туру сальмонел. Постановка біологічної проби має допоміжне значенння.
Серологічна діагностика. У тих випадках, коли при наявності клінічних симп-
томів, характерних для сальмонельозної токсикоінфекції, мікробіологічне дослі-
дження не проводилось, або збудник не виділено, ставлять реакцію аглютинації з
сироваткою крові перехворілих. Серологічні дослідження проводять також з ме-

209
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань
тою ретроспективного аналізу масових захворювань на підприємствах громадсь-
кого харчування і в організованих колективах.
Сироватку крові беруть у перші дні, а потім через 8-10 днів від початку хво-
роби. Реакцію аглютинації ставлять одночасно з обома сироватками, щоб виявити
наростання титру антитіл в динаміці. Діагностичне значення має підвищення тит-
ру аглютинінів у 4 рази і більше.
Перевагу віддають постановці РНГА з полівалентними еритроцитарними діаг-
ностикумами, що містять антигени серогруп А, В, С, Д, Е. Методика постановки
РНГА така ж сама, як і при черевному тифі. Можливе визначення титру аглю-
тинінів і методом ензиммічених антитіл.
Дизентерія (шигельоз)
Дизентерія – гостра або хронічна інфекційна хвороба, що характеризується
проносом, ураженням слизової оболонки товстої кишки та інтоксикацією організму.
Це одне з найчастіших кишечних захворювань у світі. Його викликають різні види
бактерій роду Shigella: S.dysenteriaе, S.flexneri, S.boydii, S.sonnei (див. вкл., рис. 14).
У повоєнні роки в промислово розвинених країнах дизентерію найчастіше викли-
кають S.flexneri й S.sonnei.
В Україні користуються міжнародною класифікацією цих бактерій, яка вра-
ховує їх біохімічні властивості та особливості антигенної структури. Всього нара-
ховують 44 серовари шигел (табл. 40).
Таблиця 40
Класифікація бактерій роду Shigella
Підгрупа, вид Серовари Підсеровари
A – S. dysenteriae
B – S. flexneri
C – S. boydii
D – S. sonnei
1-12
1
2
3
4
5
6
X
Y
1-18
-
-
1a, 1b
2a, 2b
3a,3b, 3c
4a, 4b
5a, 5b
-
-
-
-
-
Основним методом мікробіологічної діагностики дизентерії є бактеріологіч-
ний. Схема виділення збудника класична: посів матеріалу на середовище збага-
чення та агар Плоскирєва, одержання чистої культури, вивчення її біохімічних
властивостей та ідентифікація за допомогою полівалентних і моновалентних аг-
лютинуючих сироваток.
Взяття матеріалу для дослідження. Позитивний результат мікробіологіч-
ного аналізу значною мірою залежить від своєчасного і правильного забору дослі-

210
Частина ІІІ. Спеціальна мікробіологія
джуваного матеріалу. У хворих і бактеріоносіїв найчастіше беруть випорожнення,
значно рідше – блювотні маси і промивні води шлунка та кишок. Фекалії (1-2 г)
беруть скляною паличкою із судна або пелюшок, включаючи шматочки слизу і
гною (але не крові). Краще всього для дослідження взяти слиз (гній) із місць ура-
ження слизової оболонки під час колоноскопії. При заборі та посіві матеріалу важ-
ливо суворо дотримуватись певних правил.
Бактеріологічне дослідження по можливості потрібно починати до початку
етіотропного лікування. Посуд до взяття фекалій (судна, горшки, банки) ошпарю-
ють окропом і ні в якому разі не обробляють дезинфікуючими розчинами, до яких
шигели дуже чутливі. Досліджуваний матеріал потрібно швидко (біля ліжка хво-
рого) посіяти в середовище збагачення і паралельно на селективний агар в чашці
Петрі. Брати випорожнення можна, не чекаючи дефекації, за допомогою ватного
тампона або ректальних трубок Цимана.
Взятий матеріал або засіяні середовища треба негайно доставити до лабора-
торії. При неможливості посіву в лікарні і швидкої доставки випорожнення збері-
гають у консерванті (30 % гліцерину + 70 % фосфатного буферу) при 4-6 °С не
більше доби.
Збудники дизентерії дуже рідко проникають в кров і сечу, у зв’язку з чим ці
об’єкти звичайно не сіють. Бактеріологічний аналіз секційного матеріалу необхі-
дно проводити якомога скоріше після смерті (товстий кишечник, мезентеріальні
лімфатичні вузли, шматочки паренхіматозних органів). При спалахах дизентерії
досліджують також харчові продукти, особливо молоко, сир, сметану.
Бактеріологічне дослідження. Посіви випорожнень проводять паралельно
на селективне середовище Плоскирєва для отримання ізольованих колоній і обо-
в’язково в селенітовий бульйон з метою накопичення шигел, якщо їх мало в дослі-
джуваному матеріалі. Бактеріологічною петлею вибирають слизово-гнійні шма-
точки, ретельно прополіскують їх у 2-3-х пробірках з ізотонічним розчином хло-
риду натрію, наносять на середовище Плоскирєва і скляним шпателем втирають
в агар на невеликій ділянці. Потім відривають шпатель від середовища і втирають
ним залишковий матеріал досуха в решту незасіяної поверхні. При посіві в 2-3
чашки на кожну з них наносять нову порцію посівного матеріалу. В селенітовий
бульйон грудочки слизу і гною сіють без прополіскування.
При відсутності слизово-гнійних шматочків фекалії емульгують у 5-10 мл
0,85 % розчину хлориду натрію і 1-2 краплі надосаду засівають на середовище
Плоскирєва. У селенітовий бульйон сіють неемульговані випорожнення у
співвідношенні 1:5. При посіві блювотних мас і промивних вод використовують
селенітовий бульйон подвійної концентрації і забезпечують співвідношення по-
сівного матеріалу до середовища 1:1. Засіяні біля ліжка хворого живильні середо-
вища безпосередньо вміщують у термостат. Всі посіви вирощують при 37 °С про-
тягом 18-20 год.
На другий день неозброєним оком або за допомогою лупи 5×-10× досліджу-
ють характер росту на середовищі Плоскирєва, де шигели утворюють дрібні, про-
зорі, безбарвні колонії. Шигели Зонне можуть давати колонії двох видів: одні плес-
