Карнаухов В.Н. Люминесцентный анализ клеток
Подождите немного. Документ загружается.

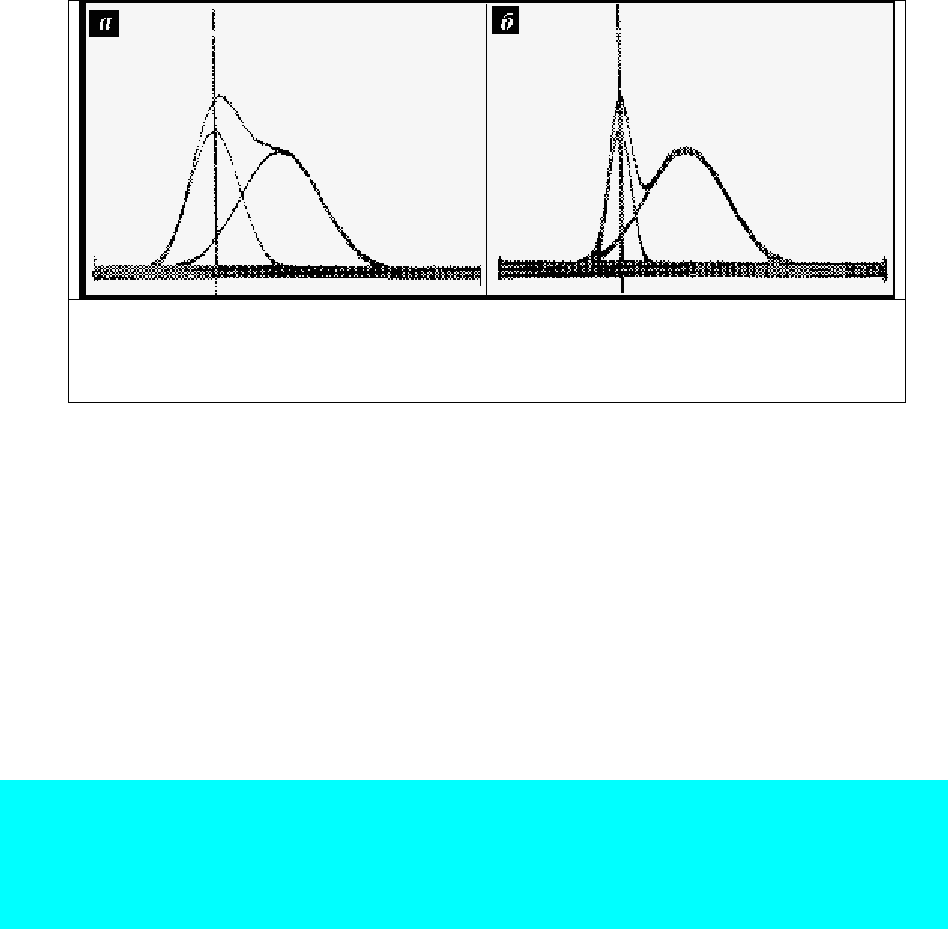
Рис. 75. Синтез суммарных спектров на приборе СК-2. Обратить внимание на
смещение левого максимума люминесценции в суммарном спектре в случае
достаточно широкой (а) полосы компонента. При сужении (б) полосы левого
компонента сдвиг в суммарном спектре не наблюдается.
Более прямой метод устранения взаимного влияния полос излучения и поглощения
красителей состоит в раздельном возбуждении люминесценции каждого из них излучением с заранее
выбранной длиной волны. Интенсивности люминесценции красителей при этом измеряются также
раздельно в области максимумов излучения, что требует коренного изменения техники возбуждения
и регистрации люминесценции. Такой подход был использован Чансом
и соавт. [283] при
раздельном измерении люминесценции восстановленных пиридиннуклеотидов и окисленных
флавопротеинов перфузируемых тканей (печень и сердце), а также И.Я.Барским и Г.В.Папаяном в
микрофлуориметре, описанном ниже [284].
Большие перспективы открываются также с разработкой систем, позволяющих
регистрировать спектры люминесценции образцов через малые и изменяемые промежутки времени
(10
-9
с) после прекращения возбуждения. В этом случае появляется возможность разделить спектры
соединений с разным временем жизни возбужденного состояния.
Глава 4. Люминесцентные красители.2. Исследование
динамики функциональной организации
клеточных структур
В данной главе приводится ряд примеров использования красителей, квантовый выход
которых сильно меняется при связывании их с различными компонентами клеточных структур и
зависит от окружения, для изучения молекулярной организации функциональных механизмов
клетки. Выбор примеров достаточно произволен, и основная задача их - проиллюстрировать как
возможности, так и трудности применения люминесцентных меток для
изучения живой клетки и ее
органоидов.
4.1. Взаимодействие контрактильных белков в процессе
мышечного сокращения
Одной из возможных причин возникновения сил, позволяющих мышце совершать
механическую работу за счет использования потенциальной энергии химических связей АТФ,
является взаимодействие полярных групп сократительных белков. Поэтому исследование топографии
разноименно заряженных полярных групп белков в структуре элементарной ячейки сократительного
аппарата мышцы (саркомера) и ее изменения в процессе сокращения - один из важнейших
аспектов
изучения механизма мышечной деятельности. Использование люминесцентных красителей-меток и
техники спектрального анализа клеток открывает новые возможности в этом направлении.
Для исследования использовались живые и глицеринизированные мышечные волокна psoas
кролика, портняжной мышцы лягушки и запирательного мускула Balanus [54, 285]. Приготовление
глицеринизированных волокон производилось по общепринятой методике [286, 287].
Локализацию красителей в структуре саркомера определяли, фотографируя препараты на
люминесцентном микроскопе. Распределение оптических плотностей на негативах измеряли на
модифицированном микрофотометре МФ-4. Спектры люминесценции регистрировали с помощью
универсального микроспектрофлуориметра, снабженного приставкой для регистрации изменения
интенсивности люминесценции в двух избранных интервалах (10-12 нм) видимой области спектра
[105]. Люминесценцию объекта возбуждали линией излучения дуговой ртутной лампы ДРШ-250 с
длиной волны 365 нм, выделяемой светофильтром УФС-6. Размер фотометрируемого участка
составлял 5×15 мкм. Применение многоканального самописца
позволяло параллельно с изменением
интенсивности люминесценции в двух длинах волн регистрировать натяжение мышечного волокна,
используя для этой цели пьезокерамические датчики или тензодатчики.
Ввиду того, что многие органические красители, в особенности анионные, помимо
электростатического взаимодействия способны к гидрофобному взаимодействию с макромолекулами
белков [288], в первую очередь была изучена гидрофобная структура саркомера. С этой
целью
применялась аммонийная соль 8-анилино-1-нафталеносульфоната (АНС), обладающего
способностью избирательно связываться с гидрофобными участками белковых молекул. Свойство
этого красителя резко (в 20-100 раз) увеличивать интенсивность люминесценции при адсорбции на
гидрофобную область белковых молекул позволило использовать его для обнаружения локальных
деформаций мышечных белков [51, 52], для определения локализации гидрофобных участков в
саркомере [53] и для
оптической регистрации изменения структуры мембраны при возбуждении
нервного волокна.
АНС
8-анилино-1-нафталеносульфонат
С
16
Н
15
N
2
SО
3
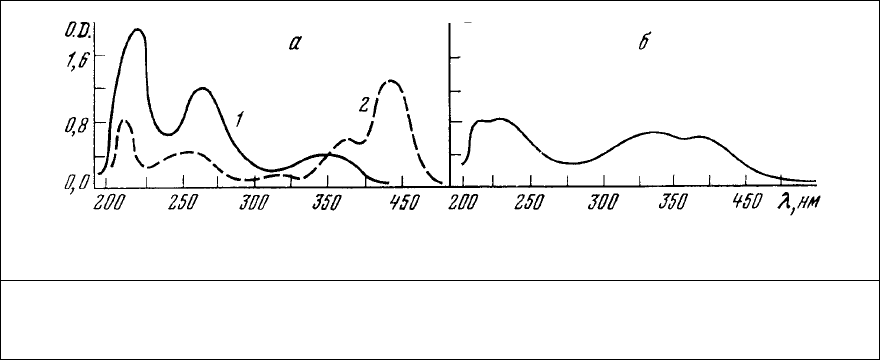
Спектр поглощения этого анионного красителя приведен на рис. 76. Интенсивность
люминесценции АНС с максимумом 548 нм весьма незначительна в растворе и резко
увеличивается при связывании его с волокном. При этом происходит смещение максимума
люминесценции в область 490 нм. Добавление раствора АТФ к препарату окрашенного
волокна вызывает его изотоническое сокращение и увеличение интенсивности
люминесценции.
Рис. 76. Спектры поглощения растворов красителей (фосфатный буфер, рН=6,8). а – АНС
(1) и аурамин 00 (2) в концентрации 10
-5
г/мл; б – тиазоловый желтый в концентрации
2,5⋅10
-5
г/мл.
Это изменение интенсивности люминесценции могло быть обусловлено следующими
факторами:
1. Увеличением количества окрашенного субстрата в поле зрения микроскопа при
сокращении мышечного волокна.
2. Увеличением количества возбуждающего люминесценцию излучения, поглощенного
волокном, за счет увеличения светорассеяния при сокращении [289].
3. Увеличением квантового выхода красителя.
4. Увеличением количества групп, специфически связывающих краситель.
Возможно также, что все эти
факторы вносят свой вклад в наблюдаемое увеличение
интенсивности люминесценции красителя. Локализация АНС в А- и Z-полосах саркомера совпадает
с описанной ранее [53].
С целью изучения распределения электроотрицательных полярных групп белков в структуре
саркомера был использован катионный краситель аурамин ОО, ценным качеством которого является
полное отсутствие его люминесценции в растворе. Электростатическое взаимодействие аурамина ОО
с отрицательно заряженными полярными группами субстрата позволяет молекулам этого красителя
приобрести необходимую жесткость структуры и сопровождается появлением интенсивной
люминесценции их
с максимумом 520 нм.
АУРАМИН ОО
Тетраметилдиамино-дифенилкетоими-
ногидрохлорид
С
17
Н
22
N
3
Cl м. в. 303,84
При окрашивании глицеринизированных миофибрилл аурамин ОО локализуется так же, как и
АНС, в области А- и Z-полос саркомера. Изотоническое сокращение окрашенного аурамином ОО
глицеринизированного волокна под действием АТФ приводит к увеличению интенсивности
люминесценции красителя на 60-70%.
Ввиду того, что роль гидрофобных взаимодействий при связывании катионных красителей с
белками мала
[288], можно предполагать, что в данном случае аурамин ОО выявляет локализацию
электроотрицательных групп белков в структуре саркомера. Аналогичным образом взаимодействует
с мышечными белками и другой катионный краситель - акридиновый оранжевый [206, 290],
основным недостатком которого является значительная люминесценция его в растворе.
Для определения локализации электроположительных групп белков в структуре саркомера
был использован анионный краситель -
тиазоловый желтый. Ценной особенностью, определившей
использование этого красителя, является относительно слабая люминесценция его с максимумом 420
нм в растворе. Интенсивность люминесценции тиазолового желтого резко возрастает при связывании
его субстратом. При этом происходит смещение максимума в область 450 нм.
ТИАЗОЛОВЫЙ ЖЕЛТЫЙ
(Титановый желтый)
С
28
Н
19
N
5
О
6
S
4
Na
2
м. в. 695,75
При окрашивании тиазоловым желтым глицеринизированных миофибрилл оказалось, что он
локализуется так же, как АНС и аурамин ОО, в области А- и Z-полос саркомера. Однако в отличие от
этих красителей, интенсивность люминесценции глицеринизированного волокна, окрашенного
тиазоловым жёлтым, незначительно уменьшается при изотоническом сокращении волокна под
действием АТФ. Поэтому можно предполагать,
что связывание тиазолового желтого с мышечными
белками в отличие от АНС не является гидрофобным.
В то же время, если наблюдаемое увеличение интенсивности люминесценции АНС и
аурамина ОО при сокращении мышечного волокна под действием АТФ может быть объяснено
влиянием чисто физических и аппаратурных факторов, таких, как увеличение количества
окрашенного субстрата в поле
зрения микроспектрофлуориметра или увеличение оптической
плотности волокна при сокращении, то уменьшение интенсивности люминесценции тиазолового
желтого может быть объяснено только взаимодействием его с исследуемым субстратом.
Для выявления локализации полярных групп в структуре саркомера было изучено
взаимодействие более чем 100 различных люминесцентных меток с белками глицеринизированных
миофибрилл. Установлено, что положительно и отрицательно заряженные
полярные группы белков
имеются только в области А- и Z-полос. Там же локализуются и метки гидрофобных участков
белковых молекул.
Ни одним из использованных красителей не удается окрасить I-полосу саркомера. Это
означает, что в актиновых нитях не имеется свободных полярных или гидрофобных групп. Судя по
распределению интенсивности люминесценции в А-полосе (различие
между Н-зоной и областью
перекрытия актиновых и миозиновых нитей), приближение миозиновых нитей «активирует»
появление заряженных групп в актиновых нитях в области перекрытия. Возможно, что именно этот
механизм лежит в основе возникновения положительной обратной связи, обеспечивающей
генерацию силы или перемещение при сокращении.
Исследование изменения полярной структуры саркомера в процессе его
сокращения
представляет достаточно сложную в методическом отношении задачу. Внимательный анализ
накопленного опыта показывает, что известные методы использования красителей-меток
неприменимы для изучения процессов, протекающих при сокращении мышечного волокна, ввиду
резкого изменения оптических и геометрических параметров самого объекта. В этом случае
изменение интенсивности люминесценции красителя, связанного с волокном, зависит от многих, в
том числе и от аппаратурных факторов.
С целью обойти трудности, возникающие в связи со спецификой объекта, были разработаны
новые методические подходы, основанные, в частности, на одновременном применении двух
люминесцентных меток. Измеряемым параметром при этом служит не изменение абсолютной
интенсивности люминесценции
метки, а изменение соотношения интенсивностей люминесценции
двух меток, взаимодействующих с определенными группами белков и между собой. Этот параметр
уже в значительной мере не зависит от аппаратурных факторов и отражает в основном перестройки
макро-молекулярной структуры сократительного аппарата. Такой подход оказался хотя и трудоемким
(особенно этап подбора соответствующих меток, когда из
100-120 предварительно изученных
соединений удается отобрать 2-3 пригодных для дальнейшей работы), но в достаточной мере
перспективным. В частности, таким образом была выявлена донорно-акцепторная пара - тиазоловый
желтый и аурамин ОО.
Оба этих красителя локализуются в одних и тех же участках саркомера - в области А- и Z-
полос. При последовательной окраске вначале аурамином отрицательно,
а затем тиазоловым желтым
положительно заряженных групп белков глицеринизированного мышечного волокна спектр
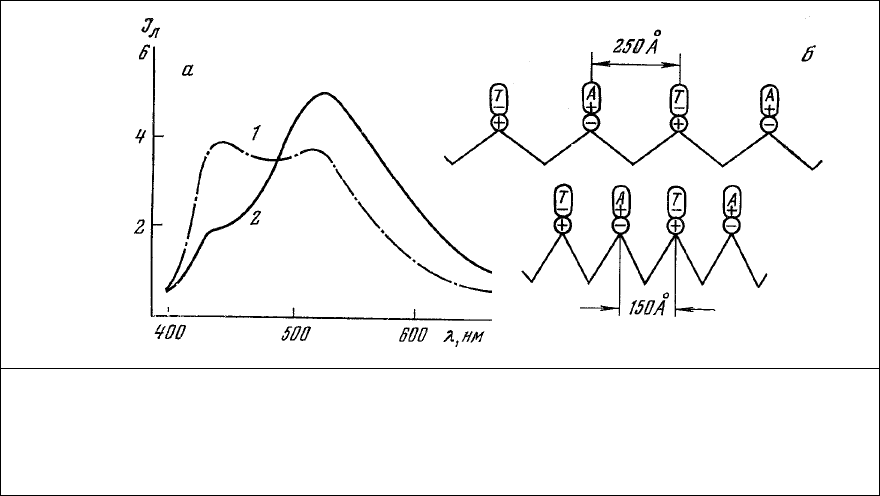
люминесценции его состоит из двух полос излучения (рис. 77, 1) примерно равной интенсивности с
максимумами 450 нм (тиазоловый желтый) и 520 нм (аурамин ОО).
Добавление АТФ в концентрации 10
-2
М к окрашенному таким образом
глицеринизированному волокну приводило к изотоническому сокращению его, сопровождающемуся
уменьшением интенсивности полосы излучения тиазолового желтого и увеличением интенсивности
полосы излучения аурамина ОО (рис. 77, 2).
Рис. 77. Взаимодействие люминесценции меток при сокращении мышцы. а – спектры
люминесценции глицеринового мышечного волокна, окрашенного последовательно
аурамином 00 и тиазоловым желтым, до 91) и после (2) сокращения волокна под
действием АТФ; б – схема возможного распределения полярных групп и люминесцентных
меток в А-диске саркомера. Длина волны возбуждения 365 нм.
Дополнительные исследования [285] показали, что в основе наблюдаемого эффекта лежит
миграция энергии возбуждения от молекул тиазолового желтого к молекулам аурамина ОО
благодаря почти полному перекрытию полосы излучения тиазолового желтого с полосой поглощения
аурамина ОО. При этом степень миграции энергии зависит от расстояния между молекулой-донором
(тиазоловый желтый) и молекулой-акцептором (аурамин
ОО) так, что гашение люминесценции
тиазолового желтого на 10% наблюдается при расстоянии между метками около 250 Å. Сближение
этих молекул до 170-180 Å увеличивает степень гашения люминесценции тиазолового желтого до
70% (рис. 78).
Таким образом, данные о локализации тиазолового желтого и аурамина ОО (А- и Z-полосы) и
зависимости степени гашения люминесценции тиазолового желтого аурамином ОО от расстояния
между ними позволяют интерпретировать приведенный на рис. 77 эффект. По-видимому, в
сократительных белках актомиозиновой области саркомера имеются чередующиеся положительно и
отрицательно заряженные полярные группы, с которыми связываются тиазоловый желтый (—) и
аурамин ОО (+) соответственно. Сокращение окрашенного таким образом глицеринизированного
волокна приводит к сближению разноименных полярных групп сократительных белков и связанных с
ними красителей, что сопровождается гашением люминесценции тиазолового желтого
приблизившимся к нему аурамином ОО. Разноименно заряженные группы сократительных белков
актомиозиновой части несокращенного саркомера расположены на расстоянии более 250 Å. В
противном случае часть люминесценции тиазолового желтого была бы уже погашена и не
наблюдалось бы столь сильного тушения его люминесценции (до 72%), как это показано на рис. 77.
При сокращении волокна эти группы сближаются до расстояния около 150 Å, и степень гашения
люминесценции тиазолового желтого составляет 70-80% (рис. 77, 78). Сближение этих красителей до
меньшего расстояния приводило бы к
практически полному гашению люминесценции, однако, при
полном сокращении волокна всегда остается заметной полоса излучения тиазолового желтого,
интенсивность которой составляет около 15-20% от исходной.
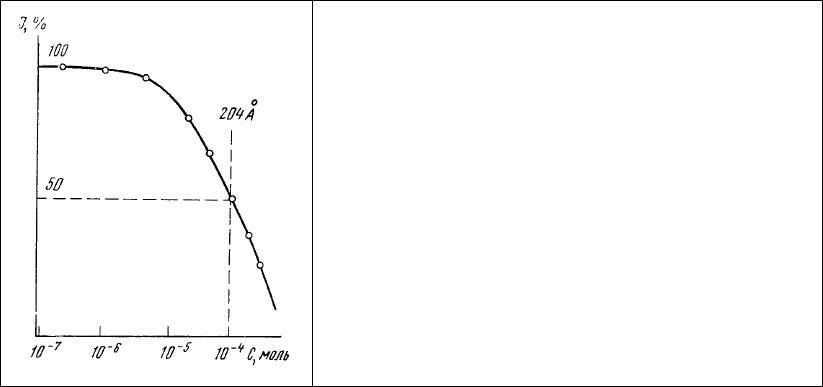
Рис. 78. Зависимость интенсивности
люминесценции раствора (10
-4
М) тиазолового
желтого о концентрации аурамина 00 в этом же
растворе.
Приведенные оценки расстояний между разноименно заряженными группами белков
являются ориентировочными и требуют уточнения, так как, например, сохранение люминесценции
тиазолового желтого при полном сокращении волокна может происходить и за счет связанного в
области Z-полосы красителя, возможно не меняющего свою излучательную способность при
сокращении. В заключение необходимо отметить, что применение метода двойной
окраски к
исследованию живого мышечного волокна наталкивается на определенные трудности, связанные с
многокомпонентностью этой системы. Закономерности изменения спектров люминесценции здесь
более сложные. Естественно, для интерпретации изменения спектра люминесценции окрашенного
аурамином и тиазоловым желтым глицеринизированного волокна необходимо попытаться точнее
установить природу мест связывания этих меток на волокне. Такая попытка может быть сделана
с
использованием модельных объектов.
В качестве модели были выбраны интактные митохондрии [291], позволяющие изменять
количество отрицательно заряженных групп на их поверхности. Известно, что сдвиг соотношения
окисленных и восстановленных форм компонентов дыхательной цепи интактных митохондрий
сопровождается изменением количества полярных групп на внешней митохондриальной мембране
[55, 56, 292].
Изменение окислительно-восстановительного состояния может быть вызвано действием
соответствующих ингибиторов, субстратов или разобщителей окислительного фосфорилирования и
проконтролировано по интенсивности люминесценции НАД⋅Н (460-470 нм) и окисленных
флавопротеинов (520 - 530 нм).
Выделенные митохондрии печени крысы характеризуются спектром люминесценции (рис. 79,
1) с широкой вершиной, состоящей из максимумов излучения НАД⋅Н (460-470 нм) и окисленных
флавопротеинов (520-530 нм). При добавлении к суспензии субстрата окисления - янтарной кислоты
-
наблюдается увеличение интенсивности люминесценции НАД⋅Н и характерные изменения
люминесценции НАД⋅Н в ответ на добавки Са
2+
, что позволяет оценить функциональное состояние
митохондрии в суспензии.
Спектры люминесценции регистрировали на микроспектрофлуориметре. Для возбуждения
люминесценции использовали линию излучения дуговой ртутной лампы ДРШ-250, выделяемую
светофильтром УФС-6. При изучении кинетики интенсивности люминесценции применяли
спектральное двухканальное устройство, позволяющее непрерывно регистрировать на
многоканальном самописце изменение интенсивности люминесценции в полосах шириной 7-10 нм в
заранее
выбранных (460 и 540 нм) участках спектра (рис. 79).
Изменение спектра люминесценции митохондрии при окрашивании их аурамином ОО в
концентрации 10
-5
М (рис. 79, 2) свидетельствует о том, что взаимодействие аурамина с
митохондриальной мембраной приводит к окислению дыхательной цепи митохондрии (на это
указывает снижение интенсивности люминесценции НАД⋅Н). Увеличение интенсивности
люминесценции в области 520-530 нм происходит, по-видимому, как за счет связывания аурамина,
так и за счет увеличения концентрации окисленных флавопротеинов, максимум люминесценции
которых, к сожалению, совпадает с максимумом люминесценции красителя. При повышении
концентрации аурамина наблюдается дальнейший рост интенсивности люминесценции в области
520-530 нм в основном за счет связывания красителя с мембраной митохондрий (рис. 79, 3, 4).
Наиболее отчетливо это прослеживается при титровании, результаты которого приведены
на рис. 80.
Аурамин ОО оказывает разобщающее действие на окислительное фосфорилирование даже в малых
концентрациях, о чем свидетельствует окисление НАД⋅Н, регистрируемое по снижению его
люминесценции (рис. 80, 1а, б).
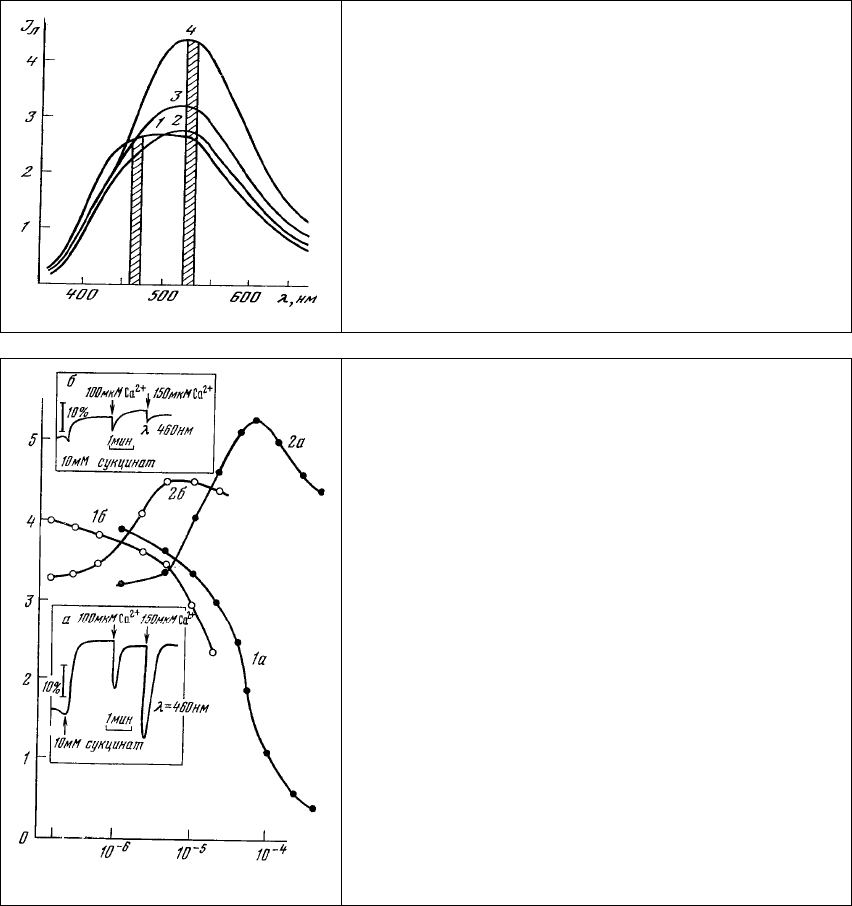
Рис. 79. Изменение спектра люминесценции
суспензии митохондрий при окраске их аурамином
00. Концентрация аурамина 00: 1 – 0; 2 – 10
-5
М; 3 -
2⋅10
-5
М; 4 – 10
-4
М. Длина волны возбуждения 365
нм. Штриховкой показаны спектральные участки
регистрации кинетики (см. рис. 80).
Рис. 80. Изменение интенсивности люминесценции
НАД Н (1) и аурамина 00(2) в суспензии
митохондрий в разных (а, б) функциональных
состояниях при увеличении концентрации
красителя.
При ухудшении функционального состояния
митохондрий (б) наблюдается сдвиг кривых в
сторону меньших концентраций аурамина при
сохранении их формы. По оси ординат –
интенсивность люминесценции в отн. ед. По оси
абсцисс
– концентрация аурамина 00 в молях.
Монотонное изменение интенсивности люминесценции аурамина и НАД⋅Н происходит при
увеличении концентрации красителя до 5.10
-4
М. Дальнейшее увеличение концентрации аурамина
приводит к значительному спаду интенсивности его люминесценции (рис. 80, 2а). Концентрация
5⋅10
-4
М соответствует, по-видимому, насыщению аурамином отрицательно заряженных центров
связывания красителя на мембране митохондрий. Блокирование аурамином этих центров приводит к
резкому окислению НАД⋅Н (рис. 80, 1а), сопровождающемуся, вероятно, уменьшением количества
отрицательно заряженных групп на внешней митохондриальной мембране.
На основании этих экспериментальных данных можно полагать, что в состав отрицательно
заряженных групп
митохондриальной мембраны, с которыми связывается аурамин, входят
специфические места связывания Са
2+
. На обоснованность такого предположения указывает наличие
конкуренции между аурамином и Са
2+
за места связывания. Добавки Са
2+
к суспензии митохондрий,
окрашенных аурамином, приводят к ступенчатому спаду интенсивности люминесценции аурамина,
величина которого постепенно уменьшается (рис. 81, а, 1). Параллельно этому наблюдаются слабые
изменения люминесценции НАД⋅Н, регистрируемые в области 460 нм (рис. 81, а, 2).
Возможно, что отмеченное на рис. 80 снижение интенсивности люминесценции аурамина при
увеличении его концентрации более 5⋅10
-4
М также обусловлено вытеснением молекул красителя с
групп связывания кальцием, концентрация которого в среде растет за счет выхода его из внутреннего
объема митохондрий при окислении дыхательной цепи, сопровождаемом уменьшением
интенсивности люминесценции НАД⋅Н.
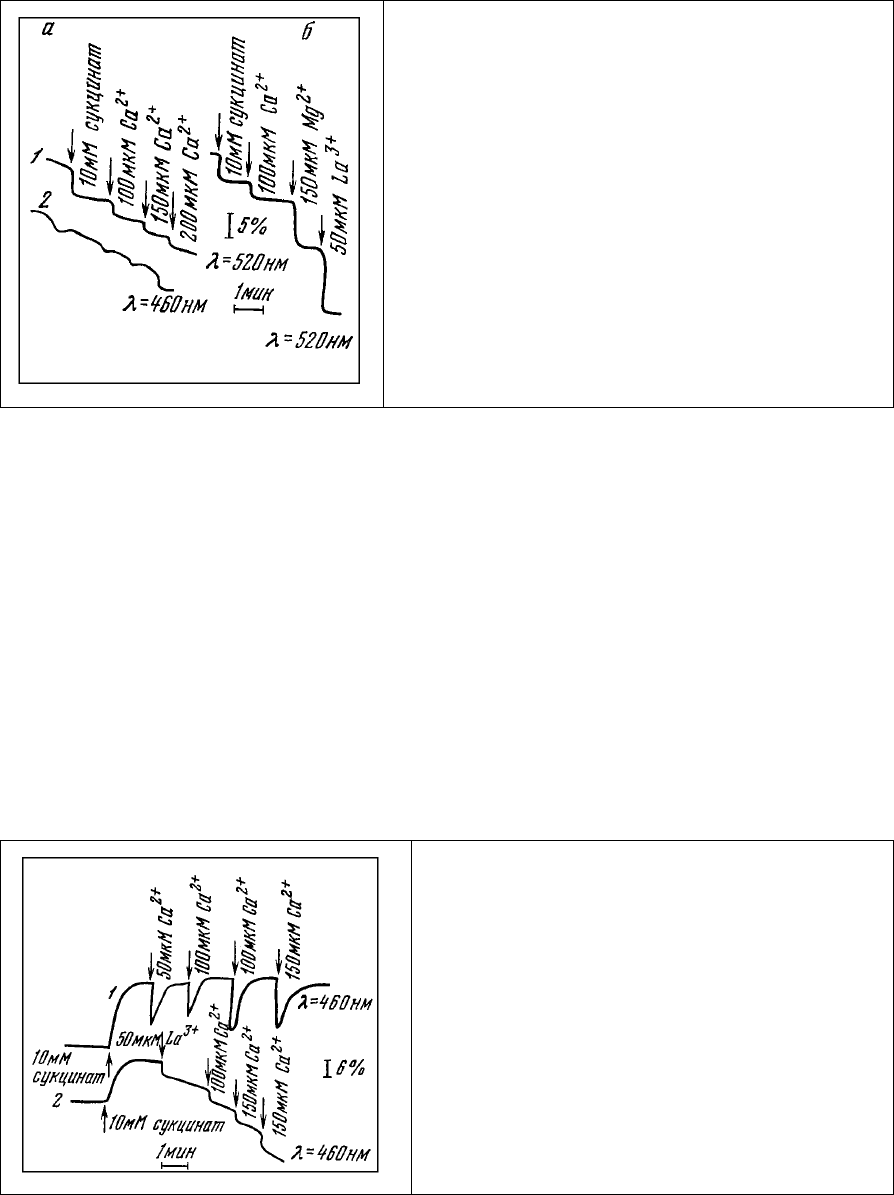
Рис. 81. Изменение интенсивности люминесценции
митохондрий, окрашенных аурамином 00 в
концентрации, выше насыщающей, при
последовательных добавках. а – янтарной кислоты
и Са
2+
, Mg
2+
и La
2+
.
Положение точки перегиба на кривой титрования (рис. 80) зависит от функционального
состояния используемых в опыте митохондрий. При ухудшении этого состояния, регистрируемом по
изменению люминесцентного ответа НАД⋅Н на добавки Са
2+
(рис. 80, а, б) и повышению общей
окисленности дыхательной цепи, точка перегиба смещается в область концентрации аурамина 4⋅10
-5
М при сохранении формы кривых (рис. 80, 1б, 2б).
На возможность взаимодействия аурамина с местами связывания Са
2+
указывает и то, что он
оказывает на митохондриальную мембрану такое же действие, как и лантан - известный ингибитор
энергозависимого накопления Са
2+
в митохондриях [293]. Добавление к суспензии митохондрий La
3+
в концентрации, превышающей количество мест связывания аурамина, приводит к характерному
изменению ответов люминесценции НАД⋅Н на добавление Са
2+
(рис. 82, 2). В этом случае
наблюдается ступенчатое снижение интенсивности люминесценции, так же как и при добавлении
Са
2+
к суспензии митохондрий, окрашенных аурамином в концентрации, выше насыщающей (рис. 81,
а). Добавление Са
2+
, Мg
2+
- и Lа
3+
к суспензии митохондрий, окрашенных аурамином, приводит к
однотипному ступенчатому снижению интенсивности люминесценции красителя (рис. 81, б). По-
видимому, эти катионы конкурируют с красителем за места связывания на митохондриальной
мембране и вытесняют его в раствор, где аурамин теряет способность люминесцировать.
Рис. 82. Изменение интенсивности
люминесценции НАД Н митохондрий в ответ на
добавки янтарной кислоты и Са
2+
. 1 –
интактные миохондрии; 2 – митохондрии,
обработанные 50 мМ La
3+
.
4.2. Изучение динамики кальция при функционировании
клеток
Важнейшая роль ионов Са
2+
в регуляции различных функциональных механизмов клетки в
настоящее время широко известна [294, 295], и потому интерес к методам определения его в клетках
постоянно возрастает.
Одним из наиболее старых применяемых в гистологии методов обнаружения кальция
является метод, основанный на образовании ярко окрашенных лаков его при взаимодействии с
гематоксилином или с ализариновыми красителями [32]. Широко распространен метод с
ализариновым красным S (рис. 83), который образует с кальцием нерастворимый лак красно-
оранжевого цвета. Локализация лака наблюдается при микроскопировании препарата в проходящем
свете. Специфичность этого метода невысока, так как и другие ионы металлов (алюминий, хром,
барий, стронций, железо, бериллий, кадмий, лантан, свинец и т.д.) могут образовывать с
ализариновым красным лаки, окраска которых меняется от ярко-алого для алюминия до пурпурно-
черного для железа [296].
Рис. 83. Спектр поглощения ализаринового
красного S.
По-видимому, более высокой специфичностью обладает люминесцентный вариант метода
обнаружения кальция с ализариновым красным [297-300]. Однако последовательность протекающих
при этом реакций образования продуктов с различными свойствами, в том числе и с оптическими,
достаточно сложна, и ее, по-видимому, полезно рассмотреть подробнее с целью получить основу для
интерпретации наблюдаемой окраски препаратов. При
этом необходимо сразу отметить два
обстоятельства. Первое из них заключается в том, что сами по себе сухие лаки ализаринового
красного S с двухвалентными ионами люминесценцией не обладают. По-видимому, образование лака
- конгломератов и длинных цепочек из молекул красителя, соединенных двухвалентными ионами, -
приводит как к сдвигу спектра люминесценции в инфракрасную область, так
и к резкому повышению
вероятности безызлучательной диссипации поглощенной красителем энергии возбуждающего
люминесценцию излучения.
Второе обстоятельство, которое, по-видимому, необходимо учитывать, заключается в том, что
сам ализариновый красный является типичным анионным красителем, способным к
электростатическому взаимодействию с положительно заряженными группами различных
компонентов биологического объекта, помимо его способности к специфическому взаимодействию с
ионами металлов.
АЛИЗАРИНОВЫЙ КРАСНЫЙ S
С
14
Н
7
О
7
SN
2
⋅Н
2
О
м. в. 360,28
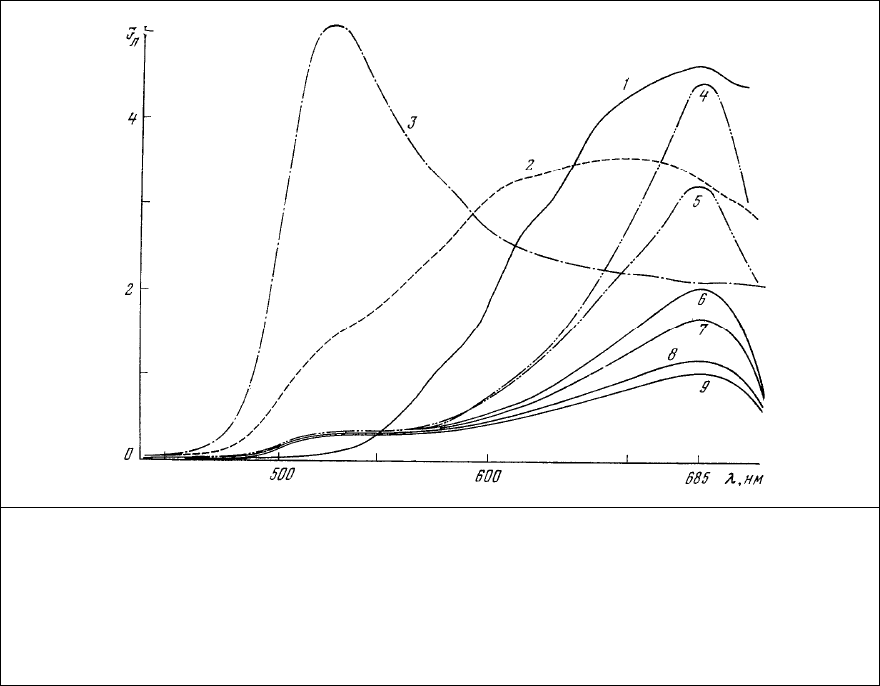
Действительно, кристаллы ализаринового красного S обладают люминесценцией с
максимумом излучения в красной (670-680 нм) области спектра (рис. 84, 1). Растворение кристаллов
в дистиллированной воде приводит к некоторому расширению этой полосы люминесценции и
появлению дополнительного плеча с максимумом в районе 520 нм (рис. 84, 2). Это плечо, по-
видимому, обязано своим происхождением комплексам,
в которых одна молекула ализаринового
красного соединена с одним ионом Са
2+
. На обоснованность такого предположения указывает то, что
при добавлении к раствору красителя раствора СаСl
2
наблюдается выпадение хлопьевидного осадка с
максимумом люминесценции в области 520 нм (рис. 84, 3).
Образовавшийся комплекс оказывается неустойчивым и сразу же после образования спектр
люминесценции его изменяется так, что интенсивность максимума излучения в зеленой области (520
нм) начинает падать одновременно с появлением и ростом полосы люминесценции в красной области
спектра (685 нм). В течение
нескольких минут этот новый максимум становится основным (рис. 84,
4) в спектре люминесценции осадка.
Причиной наблюдаемого изменения спектра люминесценции осадка является, по-видимому,
образование таких комплексов, в которых один ион Са
2+
связывает две молекулы ализаринового
красного S. Происходящее при этом объединение π-орбит двух молекул красителя и приводит,
вероятно, к смещению полосы люминесценции из зеленой в красную область спектра. Полезно
отметить здесь, что спектр люминесценции такого двойного комплекса ализаринового красного S c
Са
2+
(рис. 84, 4) сильно отличается по форме от спектра люминесценции свободных молекул
красителя в растворе (рис. 84, 2) или в кристаллах (рис. 84, 1).
Рис. 84. Спектры люминесценции ализаринового красного S. 1 – кристаллы красителя; 2 –
насыщенный раствор; 3 – осадок выпадающий после добавления CaCl
2
к насыщенному
раствору; 4 – влажный осадок, остающийся после испарения воды из осадка, выпавшего
после добавления CaCl
2
; 5 – 9 – изменение интенсивности люминесценции влажного
осадка при постепенном испарении из него остатков воды. Длина волны возбуждения 436
нм. Осадок, обладающий спектрами люминесценции 3 – 9, в проходящем свете имеет
красный цвет.
В дальнейшем по мере высыхания осадка и испарения из него воды наблюдается постепенное
уменьшение интенсивности красного максимума люминесценции (рис. 84, 4-9), что связано, по-
видимому, с образованием полимерных цепочек из чередующихся молекул красителя и кальция, т.е.
с образованием собственно лака.
Сложность интерпретации результатов взаимодействия клеток с ализариновым красным S
при использовании
только визуального наблюдения может быть проиллюстрирована на примере
рецептора растяжения речного рака. После обработки этого препарата насыщенным раствором
красителя возникает довольно яркая красная люминесценция различных структур этого объекта. При
наблюдении одного и того же препарата, как в свете его люминесценции, так и в проходящем свете
можно видеть, что некоторые структуры,
такие, например, как ядра глиальных клеток, окружающих
нейроны рецептора, не обладают заметной люминесценцией, хотя в проходящем свете в них
наблюдается высокая плотность красного пигмента. В то же время мышечные клетки
характеризуются как высокой плотностью красного пигмента, наблюдаемого в проходящем свете,
так и довольно яркой красной люминесценцией.
Ядра рецепторных нейронов отличаются по
цвету люминесценции (желто-оранжевая) от
мышечных клеток. Таким образом, сравнение окраски препарата в проходящем свете и в свете
люминесценции указывает на большую специфичность люминесцентного варианта. Сравнивая
спектры люминесценции, полученные в модельных опытах (рис. 84) и при изучении различных
участков рецептора растяжения (рис. 85), можно сделать заключение, что, действительно,
наблюдаемое в проходящем свете
распределение красителя обязано своим происхождением как
образованию истинных лаков с Са
2+
(например, нелюминесцирующие осадки в ядрах глиальных
клеток), так и прямому электростатическому взаимодействию ализаринового красного с
положительно заряженными группами белков, а также с ионами Са
2+
, связанными с отрицательно
заряженными группами белков. Спектры люминесценции клеток. содержат две основные полосы
излучения. Одна из них характерна для одиночных молекул красителя (ср. рис. 84, 2 и рис. 85, 3), в то
время как другая полоса с максимумом излучения в области 520 нм принадлежит комплексу одного
иона Са
2+
с одной молекулой ализаринового красного.
Таким образом, люминесценцию различных структур, в том числе мышечных клеток,
следует, по-видимому, отнести за счет электростатического взаимодействия самих молекул красителя
с полярными группами белков. При этом возникает вопрос о специфичности такого взаимодействия и
о роли мест связывания Са
2+
на белках в этом процессе.
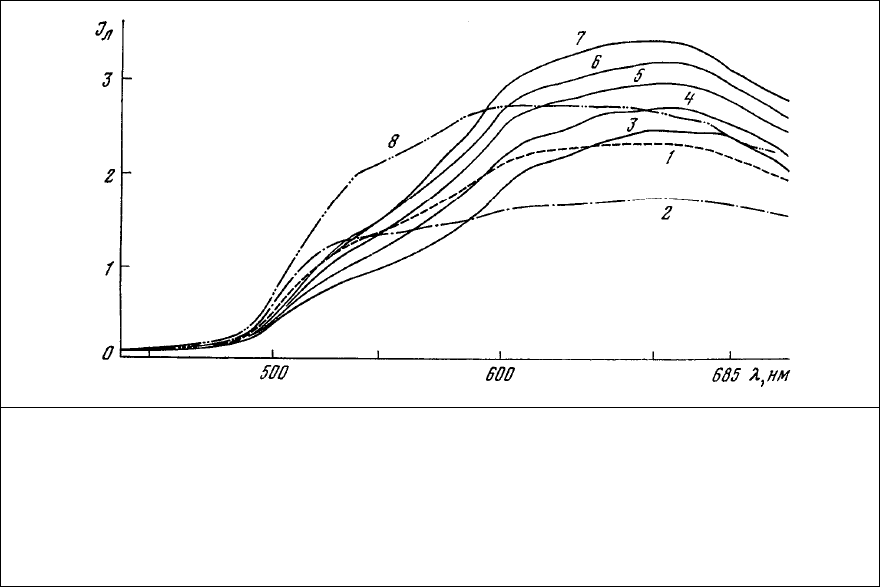
Рис. 85. Спектры люминесценции рецептора растяжения речного рака,
флуорохромированного насыщенным раствором ализаринового красного в течение 10
мин. 1 – аксонный холмик медленно адаптирующегося нейрона; 2 – ядро того же нейрона;
3 – участок медленно адаптирующейся мышцы; 4 – 7 – изменение спектра
люминесценции медленно адаптирующейся мышцы в течение 14 мин после добавления к
препарату (3) нескольких кристаллов ЭДТА; 8 – дендрит медленно адаптирующегося
нейрона после обработки
препарата ЭДТА.
Рост красной люминесценции одного и того же участка мышцы (рис. 85, 3) после добавления
к препарату ЭДТА (рис. 85, 4-7) указывает на возможность взаимодействия красителя с группами
белков, блокированными ионами Са
2+
.
В качестве другого примера люминесцентного индикатора кальция, использовавшегося в
гистохимии, может быть назван флуорексон [301, 302]. Это соединение совместно с тетрациклином
было применено для разработки двухцветной окраски минерализованных тканей [303].
ФЛУОРЕКСОН
2, 4-Бис-[N, N'-ди(карбоксиметил)-
аминометил]флуоресцеин.
Флуоресцеинкомплексон.
Кальцеин С30Н26N2О13
м. в. 622,55
И, наконец, наибольшее распространение в качестве люминесцентной
метки кальция в
последнее время получил антибиотик тетрациклин. Способность тетрациклина образовывать с
кальцием хеллат [304] была использована для разработки методов исследования кальция не только в
минерализованных тканях [305, 306], но и в различных клетках [307] и их органоидах [308-311].
ХЛОРТЕТРАЦИКЛИН
Ауреомицин С
22
Н
23
О
8
N
2
Cl
м. в; 478,9
Весьма интересные данные о росте и минерализации кости были получены при комплексном
применении всех трех упомянутых выше меток [312]. Животным вводили сначала ализариновый
красный S, через неделю - окситетрациклин b еще через неделю - флуорексон.
