Карнаухов В.Н. Люминесцентный анализ клеток
Подождите немного. Документ загружается.

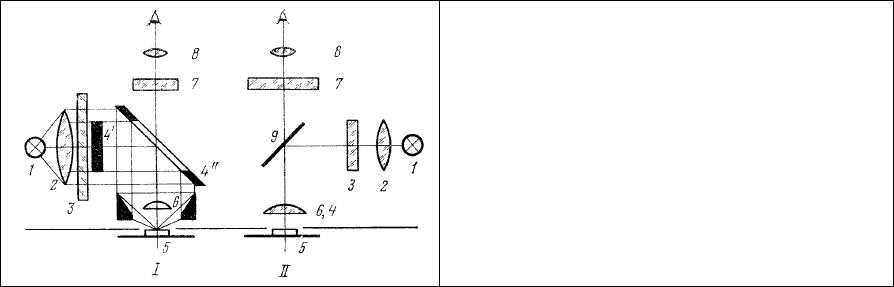
Рис. 3. Фронтальное возбуждение с
эпиобъективом (I) и с применением
интерференционной светоделительной
пластинки по методу Брумберга (II).
В этом отношении, по-видимому, наиболее перспективным является метод возбуждения, при
котором один и тот же высокоапертурный микрообъектив (4, 6) (рис. 3, II) используется и для
концентрирования возбуждающего излучения на объекте (5) и для сбора люминесцентного излучения
этого объекта [17]. Основным преимуществом такой схемы является максимально высокая яркость
люминесценции препарата, пропорциональная четвертой степени апертуры
микрообъектива [18].
Яркость люминесценции Ф препарата определяется уравнением:
Ф = КФ
о
(А
1
2
А
2
2
/
β
2
Г
2
) (6),
где Ф - яркость люминесценции; К - коэффициент, характеризующий особенности прибора и
свойства препарата; Ф
о
- яркость источника возбуждающего излучения; А
1
- апертура
микрообъектива, собирающего люминесцентное излучение препарата; А
2
- апертура конденсора,
концентрирующего на препарате возбуждающее излучение;
β
- увеличение объектива; Г - увеличение
окуляра.
Для случая, когда один и тот же объектив используется и для концентрации возбуждающего
излучения на объекте и для сбора люминесцентного излучения объекта, уравнение (6) приобретает
вид:
Ф = КФ
о
(А
1
4
/
β
2
Г
2
) (6’)
Из этого уравнения следует, что для достижения максимальной яркости люминесценции
необходимо стремиться к увеличению апертуры объектива. Увеличение апертуры микрообъектива
Х10 от 0,2 до 0,4, например, увеличивает яркость люминесценции препарата в 16 раз при прочих
равных условиях. Именно эта высокая начальная яркость препарата дает возможность достаточно
просто осуществлять в дальнейшем спектральный анализ его
люминесцентного излучения с хорошим
соотношением сигнал/шум.
Применение такой (рис. 3, II) системы фронтального возбуждения люминесценции стало
целесообразным только после введения Е.М. Брумбергом и А.С.Гершгориным [19] специального
опак-иллюминатора (рис. 3, II, 9), представляющего собой светоделительную пластинку с
интерференционным покрытием. Спектральные характеристики этих пластинок (см. ниже) таковы,
что они избирательно отражают
на объект под углом 90° излучение УФ или сине-фиолетовой
области спектра, используемое для возбуждения люминесценции препарата (5), и свободно
пропускают свет люминесценции препарата, лежащий в видимой области спектра.
Наличие этих интерференционных светоделительных пластинок [20] является ценной
особенностью отечественных люминесцентных микроскопов [21], позволяющих проводить самые
разнообразные исследования клеток.
В поле зрения люминесцентного микроскопа
перед глазами исследователя открываются
изумительные по своей красоте многоцветные картины собственной и вторичной люминесценции
клеток (см. вкл.). Однако при всей своей высочайшей чувствительности к слабым световым потокам
и к цветовым оттенкам их глаз человека как измерительный прибор обладает одним существенным
недостатком - отсутствием объективности. Оснащение микроскопа дополнительными спектральными
и электронными устройствами позволяет
перевести эти многокрасочные картины на язык
объективных цифровых данных об интенсивностях люминесценции в определенных длинах волн.
Интенсивность люминесценции I
л
вещества определяется выражением
I
л
= kI
п
(7),
где k - квантовый выход люминесценции данного соединения; I
п
- интенсивность поглощенного
веществом возбуждающего люминесценцию излучения, определяемая, согласно закону Ламберта -
Бугера - Бера, уравнением:
I
п
= I
о
(1-10
-
ε
cd
) (8)
При условии, что доля поглощаемого веществом излучения мала и составляет не более 5%
падающего на объект излучения (а это условие практически всегда реализуется, особенно при
микроспектральных исследованиях), уравнение (8) упрощается и принимает вид:
I
п
= I
о
⋅
2,3
ε
cd (8’),
где I
о
- интенсивность падающего на объект возбуждающего люминесценцию излучения;
ε
-
молярный коэффициент поглощения; с - концентрация поглощающего и люминесцирующего
вещества; d - длина оптического пути возбуждающего люминесценцию излучения в объекте.
Тогда уравнение (7), определяющее интенсивность люминесценции вещества, с учетом
выражения (8') приобретает вид:
I
л
= kI
п
= 2,3I
о
k
ε
cd (9)
При изучении люминесценции гомогенного мономолекулярного раствора какого-либо
вещества с постоянным квантовым выходом в кювете толщиной d в правой части уравнения (9)
остается только одна переменная величина с — концентрация вещества в растворе. В этом случае
интенсивность люминесценции I
л
пропорциональна (в определенных пределах) концентрации
люминесцирующего вещества с, что и используется в практике люминесцентного анализа растворов.
При исследованиях же на клеточном уровне ситуация резко изменяется. Клетка как объект
спектральных исследований представляет собой многокомпонентную гетерогенную полидисперсную
систему, весьма сложным образом взаимодействующую с люминесцентной меткой и падающим на
объект излучением [22—24]. В этом
случае в правой части уравнения (9) оказывается по крайней
мере три переменных k, c, d, изменение которых будет приводить к изменению интенсивности
регистрируемой люминесценции I
л
. Объединяя постоянные члены уравнения (9) в постоянный
коэффициент А, получаем
I
л
= I
о
А kcd (9’)
Это означает, что если, например, в двух участках одной и той же клетки зарегистрированы
спектры люминесценции (рис. 4, 1, 2), то в общем случае без привлечения дополнительных данных
нет возможности определить, связано ли изменение интенсивности люминесценции ΔI
л
с изменением
концентрации с люминесцирующей молекулы в изучаемых участках клетки, обязано ли оно своим
происхождением изменению квантового выхода люминесценции k или изменению длины
оптического пути возбуждающего люминесценцию излучения в объекте.
Рассмотрение влияния этих переменных на величину измеряемой интенсивности
люминесценции удобно начать с последнего из перечисленных параметров, а именно с d -
длины
оптического пути возбуждающего излучения в препарате, полагая при этом постоянным квантовый
выход k. Полидисперсность клетки приводит к возникновению многократного рассеяния и отражения
светового луча на внутриклеточных органоидах, таких, как ядро, митохондрии, эндоплазматический
ретикулум, рибосомы, аппарат Гольджи, микротельца и т. д. Ввиду большой вариабельности
коэффициентов преломления этих органоидов, по-видимому, не
существует удовлетворительного
теоретического подхода, позволяющего рассчитать рассеяние в столь сложной полидисперсной
среде, тем более, что значительная часть рассеивающих частиц лежит за пределами разрешения
светового микроскопа и распределение их по форме и размерам остается неизвестным. В то же время
размеры, форма и коэффициент преломления этих частиц, меняясь в широком диапазоне, определяют
рассеивающие свойства объекта [25, 26]. Это означает, что даже при условии постоянства квантового
выхода люминесцирующего вещества получение абсолютных данных о его концентрации в клетке по
измеренной интенсивности люминесценции - крайне трудная задача.
Учитывая, однако, что в большинстве случаев представляют интерес не столько данные об
абсолютной концентрации вещества, сколько сведения о динамике этой концентрации в
процессе тех
или иных изменений функционального состояния клетки, достаточно было бы потребовать
постоянства рассеивающих свойств объекта (а следовательно, и длины оптического пути
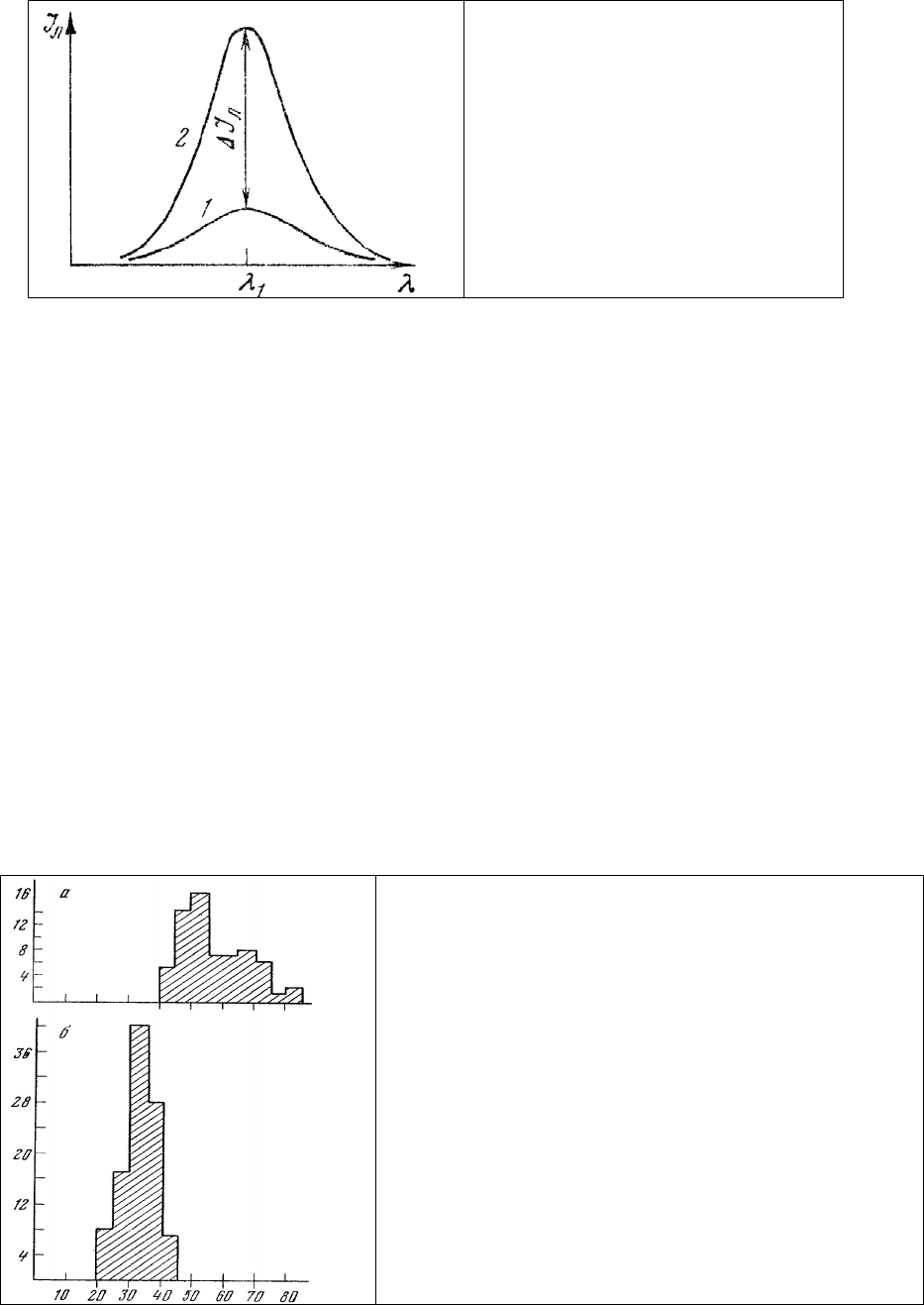
возбуждающего люминесценцию излучения d) при изучении люминесцентной метки-флуорохрома с
постоянным квантовым выходом k, чтобы в правой части уравнения (9') осталась только одна
переменная величина с. Тогда изменение интенсивности люминесценции ΔI
л
, измеренное
микрофлуориметром в длине волны λ
1
, будет определять изменение концентрации флуорохрома (рис.
4).
Рис. 4. Схема одноволнового метода
регистрации (объяснение в тексте).
Такого типа задачи часто возникают при определении содержания в клетке
люминесцирующих веществ или при определении таких важнейших компонентов ее обмена, как
ДНК, РНК, белки, липиды и т. д., с применением флуорохромов – люминесцентных красителей с
постоянным квантовым выходом, специфически связывающихся с изучаемыми веществами. На базе
применения флуорохромов с постоянным квантовым выходом [27—31]
были созданы классическая
люминесцентная гистохимия и цитохимия [32—49]. Измерения интенсивности люминесценции в
одной длине волны, совпадающей с максимумом спектра излучения определяемого вещества, могут
давать надежные результаты в ряде частных случаев, при большом статистическом усреднении
результатов измерения или в тех случаях, когда основную информацию несет именно форма
статистического распределения измеряемых величин в популяции
клеток.
Например, в приведенном на рис.5 случае, когда производилось измерение концентрации
ДНК, выявляемой с помощью люминесцентного варианта [48] метода Фелъгена в ядрах
фибробластов в культуре ткани, задача дифференциации нормальной (а) и синхронизованной (б)
культур легко решается по форме гистограмм распределения ДНК в ядрах. Более того, положение
максимумов гистограммы распределения ДНК в
нормальной культуре (рис.5, а) служит своего рода
«внутренним» стандартом измерения; так, оно соответствует диплоидному (первый максимум) и
удвоенному перед делением клетки (второй максимум) количеству ядерной ДНК. В этом нетрудно
убедиться, фотометрируя разошедшиеся к полюсам хромосомы в готовых к делению, но еще не
разделившихся клетках. Интенсивность люминесценции каждой из групп хромосом
соответствует
левому склону первого максимума гистограммы, а интенсивность всего ядра – правому склону
второго максимума (рис. 5, а).
Рис. 5. Гистограммы распределения ДНК в нормальной
(а) и синхронной (б) культурах фибробластов,
определяемые с помощью люминесцентного варианта
реакции Фельгена. По оси ординат – количество клеток,
по оси абсцисс – содержание ДНК в отн. ед.
Поскольку средняя интенсивность люминесценции окрашенных препаратов может меняться от
опыта к опыту в зависимости от условий окрашивания, чувствительности и других случайных,

трудно учитываемых условий, с целью повышения точности и сопоставимости данных перед
построением гистограммы прибегают к нормированию результатов путем, например, их деления на
величину средней интенсивности люминесценции в контроле. Гистограммы распределения (рис. 6)
Рис. 6. Гистограммы, характеризующие
интенсивность люминесценции ядер
интактной печени через 2,5 ч после (а) и до
(б) гепатэктомии [49]. По оси абсцисс –
отношение интенсивности люминесценции
отдельных ядер печени через 2,5 ч после (I
ОП
)
и до операции (I
К
) к средней интенсивности
люминесценции ядер до операции в каждом
опыте (Ī
К
); по оси ординат – количество
клеток. Окрашено акридиновым оранжевым.
нормированных таким образом величин интенсивностей зеленой (λ==530 нм) люминесценции ядер
клеток печени, окрашенных акридиновым оранжевым, отражают, по-видимому, распределение
концентрации ДНК в данном объекте [49]. Интересно отметить, что по форме гистограмма интактной
печени (рис. 6, б) ближе к гистограмме, характерной для синхронизированной культуры клеток (рис.
5, б). Частичная гепатэктомия приводит, по-видимому, к
ослаблению тканевой регуляции
интенсивности деления клеток, и гистограмма их ядер (рис. 6, а) становится близкой по форме к
гистограмме распределения ДНК в ядрах свободно растущей культуры клеток (рис. 5, а).
В общем же случае при изучении динамики концентраций веществ в клетке в процессе
изменения ее состояния, по-видимому, нельзя пренебречь изменениями ее
рассеивающих свойств (а
следовательно, d) в этом процессе. Например, увеличение синтетической активности клетки может
сопровождаться ростом в ней числа рибосом, что приведет к увеличению интенсивности
люминесценции флуорохрома, специфически связывающегося с РНК не только за счет увеличения
концентрации РНК в клетке, но и за счет увеличения длины пути возбуждающего излучения d
в
препарате в результате увеличения в нем количества рассеивающих частиц (рибосомы, мембраны
эндоплазматического ретикулума и т. д.). Поэтому учет изменения рассеивающих свойств объекта в
общем случае остается необходимым, что методически приводит к переходу на двух- или
многоканальную регистрацию интенсивности люминесценции в двух или более спектральных
интервалах или на регистрацию спектра люминесценции
объекта.
Принципиальная схема микроспектрофлуориметра - прибора, предназначенного для
регистрации спектров люминесценции одиночных клеток и их участков, - приведена на рис.7. Ее
основная часть представляет собой комбинацию люминесцентного микроскопа (рис. 7, 1—10) с
интерференционной светоделительной пластинкой (см. рис.3, II), диспергирующей системы (8, 11,
12) и регистрирующего устройства (13, 14), а также не показанных на схеме источников питания. Что
касается двух дополнительных систем (15—21), то они предназначены именно для контроля
рассеивающих свойств препарата в исследуемой области.
Работа микроспектрофлуориметра осуществляется следующим образом. Из сформированного
коллекторной линзой (2) излучения источника (1) узкополосным фильтром (3) вырезается
возбуждающее излучение в узком спектральном диапазоне λ
1
. Это излучение отражается
интерференционной светоделительной пластинкой (4) и фокусируется микрообъективом (5) на
объект исследования (6), вызывая его люминесценцию. Люминесцентное излучение объекта
собирается микрообъективом (5) и, проходя через интерференционную пластинку (4), формирует на
поверхности сферического зеркала (8) люминесцентное изображение микрообъекта (6), которое
визуально изучается с помощью системы, состоящей из окуляра (10) и
зеркала (9). Между
интерференционной пластинкой (4) и зеркалом (8) размещается широкополосный светофильтр,
отрезающий отраженное и рассеянное микрообъектом возбуждающее излучение λ
1
.
На поверхости сферического зеркала (8) имеется свободный от отражающего покрытия
участок - зонд. Поэтому люминесцентное излучение, создающее изображение клетки, совмещенное с
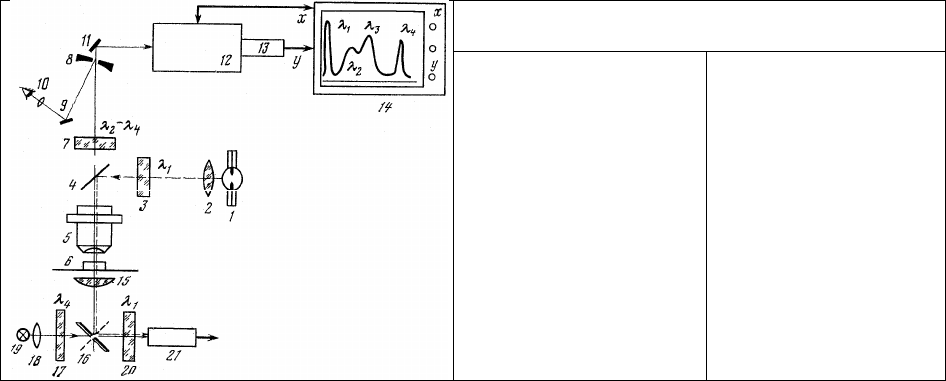
зондом, свободно проходит через зондовое отверстие в диспергирующую систему (обычно
монохроматор) для спектрального анализа. При этом отверстие зонда служит не только полевой
диафрагмой микроскопа, ограничивающей размеры анализируемого участка микрообъекта (6), но и
входной щелью монохроматора (12). За выходной щелью монохроматора размещается приемник
излучения (13) (обычно - фотоэлектронный умножитель), выходной сигнал которого (в
случае
необходимости - через усилитель-согласователь) подается на ось Y двухкоординатного самописца
(14), развертка Х которого тем или иным способом синхронизирована с разверткой монохроматора
(12). При включении развертки монохроматора на самописце регистрируется спектр люминесценции
участка микрообъекта (6), изображение которого совмещено с зондом в зеркале (8).
Рис. 7. Принципиальная схема микроспектро-
флюориметра
источник возбуждающе- го
излучения;
8
– коллекторные лин-зы;
20 – светофильтры воз-
буждения;
светоделительная пластина
с интерференционным
покрытием;
м
икрообъектив;
п
репарат;
з
апирающий светофильтр;
8 – сферическое зеркало
зондовой системы;
1
1, 16 – плоские зеркала;
–
окуляр;
–
монохроматор;
21 – фотоумножитель;
– двухкоординатный
самописец;
–
конденсор;
– узкополосный
светофильтр
вспомогательного
освещения;
19 – лампа накаливания.
Для учета изменения рассеивающих свойств препарата в такой системе (или в ее упрощенной
модификации - микрофлуориметре, когда монохроматор (12) заменен узкополосным светофильтром,
пропускающим в максимуме излучения люминесценции) можно воспользоваться измерением
интенсивности проходящего через микрообъект (6) возбуждающего излучения λ
1
. С этой целью
прошедшее через объект (6) излучение собирается конденсором (15) и с помощью поворотного
зеркала (16) через светофильтр (20), пропускающий излучение с длиной волны λ
1
, направляется на
фотоумножитель (21) для преобразования в электрический сигнал. В дальнейшем этот электрический
сигнал может быть использован либо для постоянного контроля как поглощения и рассеяния
возбуждающего излучения в объекте (6), так и стабильности источника (1), либо для автоматической
компенсации изменения этих величин.
Несколько меньших затрат требует другой способ контроля рассеивающих
и поглощающих
свойств препарата, который заключается в использовании дополнительного стабильного источника
света (19) (обычно - лампа накаливания). При этом из светового потока источника (19),
сформированного коллекторной линзой (18), узкополосным (обычно интерференционным)
светофильтром (17) вырезается узкая полоса, лежащая в свободной от полос люминесценции (λ
2
, λ
3
на планшете 14, рис.7) области спектра (λ
4
). С помощью поворотного зеркала (16) и конденсора (15)
это дополнительное излучение фокусируется на микрообъект (6) и, проходя через него,
примешивается к люминесцентному излучению объекта и потому регистрируется в виде узкой
полосы в соответствующей области спектра (λ
4
). Интенсивность этой полосы характеризует
рассеяние и поглощение в объекте (6) и степень стабильности регистрирующей системы (13, 14).
Таким образом, учет изменения в препарате длины оптического пути d возбуждающего
люминесценцию излучения, причиной которого может быть изменение как рассеивающих свойств
препарата, так и его толщины, а также учет возможной нестабильности измерительной системы в
целом
приводит к значительным усложнениям техники и методики эксперимента, не гарантируя
полностью при этом высокую точность измерений.
Поэтому представляется заманчивым такое построение эксперимента, при котором
перечисленные выше факторы перестают оказывать влияние на точность результатов измерения. Эта
возможность возникает, в частности, когда необходимо знать не столько изменение (в относительных
единицах) концентрации каких-
либо химических компонентов клетки, сколько изменение
соотношения концентраций этих соединений при развитии того или иного внутриклеточного
процесса. Например, одной из важных характеристик состояния клетки может служить отношение
концентраций РНК/ДНК (т.е. количество РНК, синтезируемой на единицу ДНК), которое может
рассматриваться как количественная характеристика интенсивности синтетических процессов в
клетке. При этом
можно независимо измерить концентрации РНК и ДНК и путем деления получить
величину искомого параметра.
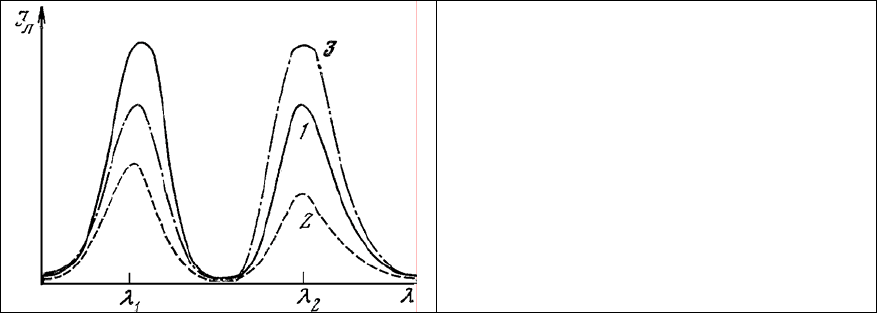
Однако предпочтительнее произвести одновременное измерение в одном и том же препарате
непосредственно отношения концентраций двух представляющих интерес внутриклеточных
соединений. Преимущества такого построения эксперимента вытекают из анализа уравнения (9').
Действительно, если в одном и том же объекте двумя флуорохромами с достаточно далеко
расположенными максимумами излучения пометить два изучаемых биополимера, то спектр
люминесценции исследуемого
участка такого объекта будет иметь вид двугорбой кривой,
приведенной на рис. 8.
Рис. 8. Схема двухволнового метода
регистрации.
При этом интенсивности люминесценции одного из участков клетки в максимумах излучения
λ
1
и λ
2
будут определяться согласно уравнению (9'):
I
лλ1
= I
о
А
1
k
1
c
1
d
1 ;
I
лλ2
= I
о
А
2
k
2
c
2
d
2
(10)
Тогда, учитывая, что d
1
= d
2
, отношение интенсивностей люминесценции
1
лλ1
/
1
лλ2
= А
1
k
1
/
А
2
k
2
⋅
c
1
/
c
2
(11)
при использовании флуорохромов с постоянным квантовым выходом оказывается
пропорциональным отношению концентрации флуорохромов, связанных с биополимерами, и не
зависит от интенсивности возбуждающего люминесценцию излучения I
о
и длины оптического пути
этого излучения в препарате. Изменение любого из этих параметров приведет к одновременному
изменению амплитуды обеих полос люменесценпии (рис. 8, 2), однако не скажется на величине их
отношения. Только изменение соотношения концентрации красителей (а стало быть, помеченных
ими веществ) приведет к изменению соотношения интенсивностей полос люминесценции I
лλ1
и I
лλ2
(рис. 8, 3). Аналогичным образом может быть поставлен эксперимент с тремя и более
флуорохромами-метками. При этом вопросы экранирования, реабсорбции и миграции энергии с
одного красителя на другой подлежат рассмотрению для конкретной ситуации того или иного
метода.
Флуорохромы с постоянным квантовым выходом люминесценции являются основными
красителями, используемыми обычно в классической
люминесцентной цитохимии, когда основная
задача заключается в установлении концентрации тех или иных биополимеров клетки. В качестве
примера могут быть названы флуоресцеин, акридиновый оранжевый, эозин и т. д. В то же время
существуют красители, квантовый выход которых сильно меняется при связывании их с различными
компонентами клеточных структур и зависит от окружения. Такого
типа люминесцентные метки
оказываются наиболее удобными при изучении не столько концентрации биополимера, сколько его
структурного состояния и имеют большое значение в исследовании молекулярной организации
различных функциональных механизмов клетки.
Примером люминесцентных меток с переменным квантовым выходом может служить
широкоизвестный АНС (8-анилено-1-нафталено-сульфонат). Свойство этого красителя,
заключающееся в резком увеличении квантового
выхода люминесценции (в 20 - 100 раз) при
абсорбции его на гидрофобную область белков [50], было использовано для изучения конформации
молекулы гемоглобина, наблюдения локальных деформаций мышечных белков [51 - 52],
определения локализации гидрофобных участков в саркомере поперечно-полосатой мышцы [53, 54] и
наблюдения изменения структуры мембран митохондрий [55 - 56] и нервных волокон [57]. Меток
этого типа довольно много, и АНС не является единственным
в своем роде. Такие красители, как
этидиум бромид, тетрациклин, аурамин, мероцианины и др., с успехом применяются при изучении
молекулярной организации функциональных механизмов клетки [58 - 63]. Даже красители с

постоянным квантовым выходом люминесценции могут приобрести способность к изменению
квантового выхода за счет миграции энергии на близко расположенную молекулу - акцептор. При
этом перемещение акцептора относительно донора может давать информацию о структурных
изменениях макромолекулы, на которой адсорбирована такая пара взаимодействующих меток. В этих
случаях естественно стремление к тому, чтобы концентрация красителя с
переменным квантовым
выходом оставалась постоянной величиной и в правой части уравнения (9') было не более двух
переменных k и d. Однако и в этом случае методика эксперимента должна предусматривать контроль
постоянства концентрации с люминесцентной метки.
Наиболее надежным методом такого контроля является, конечно, измерение концентрации по
поглощению света в максимуме полосы поглощения
красителя. С этой же целью может быть
использована регистрация прошедшего через исследуемый участок объекта возбуждающего его
люминесценцию излучения (см. рис.7), хотя длина волны этого излучения не всегда совпадает с
максимумом полосы поглощения красителя.
Глава 2. Собственная люминесценция клеток
Любая клетка живого организма обладает собственной люминесценцией, которая обязана
своим происхождением различным компонентам ее структуры и метаболизма [9]. Собственная
люминесценция лежит в основе ряда исключительно ценных методов исследования процессов
внутриклеточной регуляции [8-10, 64-66]. В то же время она может служить источником помех и
ошибок при изучении функциональных механизмов клетки с помощью люминесцентных меток,
так
как в ряде случаев интенсивность собственной люминесценции оказывается сравнимой по величине с
интенсивностью так называемой вторичной люминесценции, вызванной введением в клетку
экзогенных красителей-меток. Количество люминесцирующих эндогенных соединений в клетках
велико, и в рамках данной монографии нет возможности полно рассмотреть этот вопрос.
Представляется, однако, необходимым привести ряд примеров, показывающих, что
, по сути дела, в
любой области спектра лежат полосы излучения эндогенных люминесцирующих соединений.
2.1. Спектральные характеристики собственной
люминесценции клеток
Ультрафиолетовая люминесценция. Утверждение о наличии собственной люминесценции у
любых клеток связано, прежде всего, с составляющими их основу белками, обладающими
люминесценцией в ультрафиолетовой области спектра [10, 67]. При воздействии на клетку излучения
с длиной волны в области 280 нм (полоса поглощения белков) наблюдается полоса излучения,
максимум интенсивности которой лежит в области 330-350 нм (рис. 9). Как
было
Рис. 9. Спектры УФ-люминесценции
клеток мышцы (1), нейронов (2), клеток
печени (3), эритроцитов (4) [68].

установлено [68-72], ответственными за ультрафиолетовую люминесценцию белков являются
входящие в их состав ароматические аминокислоты - триптофан, тирозин и фенилаланин.
Индивидуальный спектр люминесценции каждой из этих аминокислот различается по положению
максимума излучения (рис. 10). Поэтому можно было бы ожидать, что спектры УФ-люминесценции
различных белков также будут иметь несколько различающиеся по положению максимумов спектры
люминесценции
в соответствии с относительным содержанием той или иной ароматической
аминокислоты. Однако то обстоятельство, что квантовый выход люминесценции триптофана
намного выше квантового выхода тирозина и фенилаланина, приводит обычно к преобладанию
полосы излучения триптофана в суммарном спектре ультрафиолетовой люминесценции клетки.
Рис. 10. Спектры люминесценции аминокислот
в нейтральном водном растворе при комнатной
температуре [72].
1 – триптофан; 2 – тирозин; 3 – фениланин.
Наиболее яркой УФ-люминесценцией в клетке характеризуются сократительный аппарат [73,
74], митохондрии [75-77], ядрышки [78] и некоторые другие структуры цитоплазмы. Интенсивность
УФ-люминесценции зависит от физиологического состояния клеток и меняется при различных
воздействиях, в том числе и при ионизирующем облучении животных [79-82]. Специально
проведенные исследования с применением специфических ингибиторов дыхания показали, что
характер ультрафиолетовой люминесценции
митохондрии в значительной мере определяется
соотношением восстановленной и окисленной форм дыхательных ферментов и отражает
функциональное состояние митохондрии [83, 84].
Учитывая, что квантовый выход люминесценции ароматических аминокислот не остается
постоянным, а довольно сильно зависит от свойств окружения [10, 15, 16], исследования Уф-
люминесценции могут служить основой для разработки разнообразных методов слежения за
изменениями структуры белковых молекул
при их функционировании в клетке [85]. Весьма
перспективным оказалось, в частности, применение поляризованной УФ-люминесценции при
изучении особенностей конформационных изменений белков в структуре саркомера поперечно-
полосатой мышцы в покое и
при сокращении. Была установлена [86-88] существенная анизотропия в
расположении триптофановых остатков сократительных белков в А- и -зонах саркомера. Оказалось,
что в А-зоне триптофановые остатки белков преимущественно ориентированы вдоль оси мышечного
волокна, в то время как в I-зоне они ориентированы преимущественно перпендикулярно. При
сокращении мышцы уменьшается поляризационная анизотропия обеих зон. Это свидетельствует
о
существенном уменьшении степени ориентации триптофановых остатков белков мышечного волокна
при сокращении.
Синяя и желтая область спектра. Количество веществ, люминесцирующих в этой области,
достаточно велико [9], но только с некоторыми из них мы неизбежно сталкиваемся при изучении
любых клеток. К числу этих веществ следует, прежде всего, отнести такие важнейшие,
встречающиеся у
любых представителей живой природы компоненты систем энергетического
обмена, как восстановленные пиридиннуклеотиды (НАД⋅Н, НАДФ⋅Н) и окисленные флавопротеины
(ФП). Как следует из приведенной на
Схеме метаболизма [89], пиридиннуклеотиды и
флавопротеины находятся в различных участках энергопроизводящих систем клетки: гликолизе,
пентозофосфатном цикле, цикле Кребса, системе окисления жирных кислот и различных путях
терминального окисления. Восстановленные формы НАД и НАДФ обладают характерными
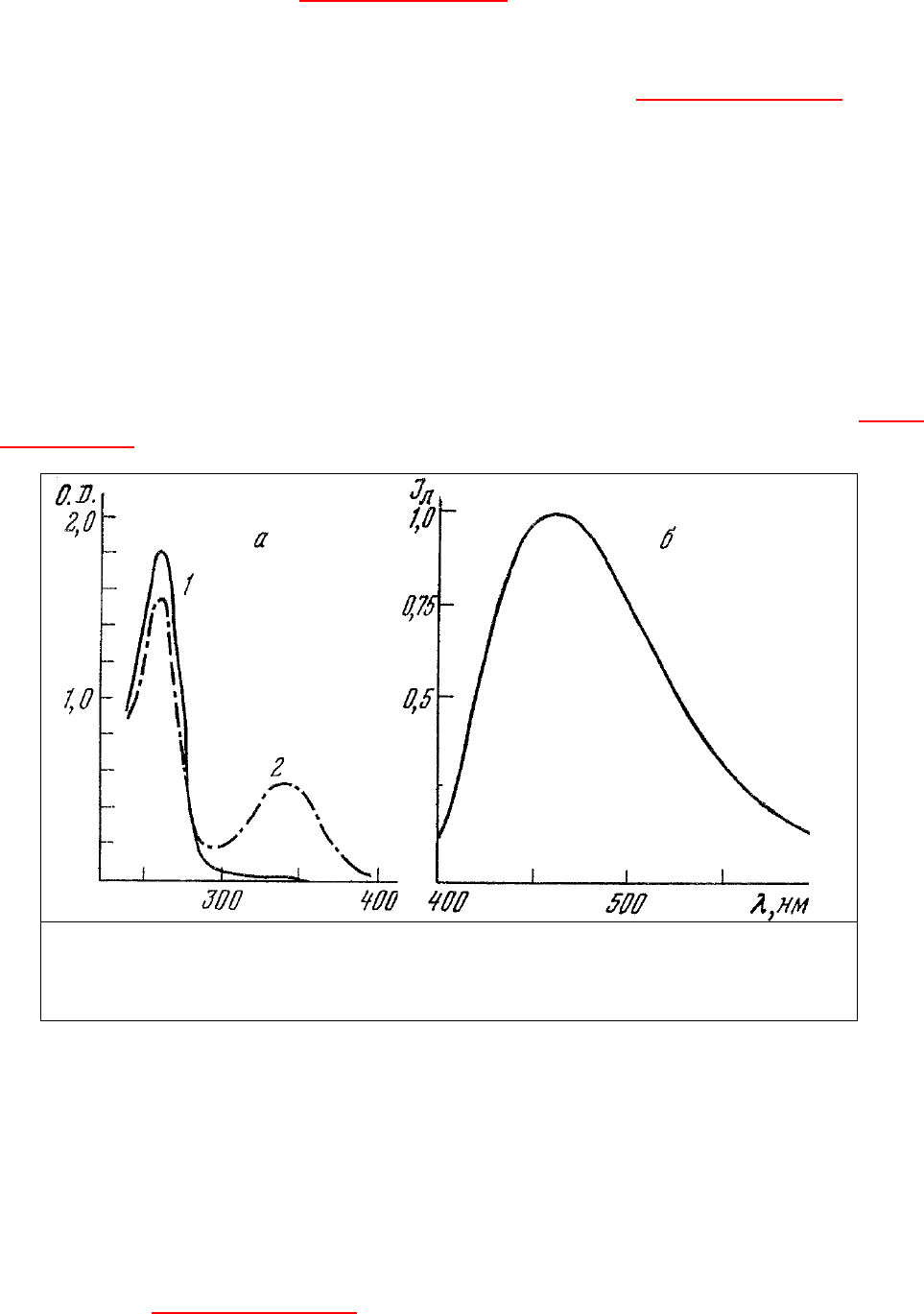
спектрами поглощения, состоящими из двух полос в УФ-области (260 и 340 нм), и полосой
собственной люминесценции, максимум которой лежит в
интервале 465÷480 нм (рис. 11). При
переходе НАД и НАДФ в окисленное состояние они теряют полосу поглощения 340 нм и
способность к люминесценции (Схема метаболизма), как это было установлено Варбургом [90].
При связывании НАД и НАДФ с их дегидрогеназами максимум полосы люминесценции сдвигается в
сторону более коротких длин волн до 440 нм, и ее интенсивность возрастает [91]. Производные
рибофлавина - флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) [9] - являются
простетическими группами многих флавопротеиновых компонентов (
Схема метаболизма). систем
терминального окисления. Окисленные формы ФМН и ФАД обладают характерными спектрами
поглощения (рис. 12) и собственной люминесценции [92]. При переходе этих групп в
восстановленное состояние они теряют полосы поглощения 450 нм и собственной люминесценции
[93].
Присоединение ФМН и ФАД к белковой части молекулы фермента приводит к изменению спектра
поглощения, различному для разных флавопротеинов. Наиболее
часто, однако, в видимой области
происходит сдвиг полосы поглощения от 450 до 455÷ 465 нм и появляется характерное плечо на
кривой поглощения в области 480÷490 нм (рис. 13, б). При этом флавиновая группа может утратить
способность к аутоокислению и потерять полностью или частично собственную люминесценцию.
Примером не люминесцирующих или слабо люминесцирующих флавопротеинов могут
служить
глюкозооксидаза и ксантиноксидаза. Интенсивность люминесценции ФМН и ФАД уменьшается при
связывании их с апоферментами таких флавопротеинов, как оксидаза D-аминокислот (Фп
6
),
электронно-транспортные флавопротеины (Фп
4
и Фп
5
) и цитохром b
5
-редуктаза (Фп
7
) (Схема
метаболизма).
Рис. 11. Спектры поглощения (а) и люминесценции (б) НАД. А – спектры поглощения
водного раствора НАД в окисленной (1) и восстановленной (2) формах [91]; б –
нормированный спектр люминесценции НАД в восстановленной форме в этиловом
спирте.
Исключением является ЛДГ - липоилдегидрогеназа (Фп
1
), в которой на одну молекулу
апофермента приходятся две простетические группы типа ФАД. Интенсивность люминесценции
этого флавопротеина примерно в три раза превышает интенсивность люминесценции эквивалентного
количества свободного ФАД (рис.13, в) и отличается характерным спектром люминесценции,
обладающим помимо основного максимума (530 нм) плечом (540 нм) [92].
Физико-химические характеристики флавопротеинов усиленно исследовались в последние
годы [94-98]
в связи с возможностью использования их, а также пиридиннуклеотидов в качестве
внутриклеточных меток активности энергетического аппарата [65, 98-110]. Этот вопрос будет
подробнее рассмотрен в следующем разделе данной главы.
Следует, однако, остановиться здесь на том обстоятельстве, что, как это следует из
приведенных на
Схеме метаболизма данных, множественность входящих в разные участки общей
энергетической системы пиридиннуклеотидов и флавопротеинов создает ряд методических
трудностей. При люминесцентных спектральных исследованиях клетки в поле зрения прибора
оказываются различные органоиды, и поэтому в общем случае регистрируется суммарный спектр,
состоящий из полос люминесценции нескольких флавопротеинов и пиридиннуклеотидов,
относящихся к разным системам, одна из
которых обычно вносит основной вклад. В этих условиях
люминесцентный спектральный анализ перестает быть чисто физическим методом и используется
скорее как индикаторный инструмент при проведении своего рода функциональной диагностики
спектра по результатам действия на исследуемую клетку различными биохимическими и
физическими факторами, такими, как перевод клетки из аэробного в анаэробное состояние, действие
на нее специфических субстратов и ингибиторов окислительных систем, изменение
физиологического состояния и т. д. [65].
Рис. 12. Спектры поглощения (а, б) и люминесценции (в) флавинов и флавопротеинов.
а: 1 – окисленная форма ФАД, 2 – восстановленная форма ФАД;
б, в: 1 – окисленная форма ФАД, 2 – окисленная форма липоилдегидрогеназы (ЛДГ).
Это означает, что если даже мы полностью уверены (электронно-микроскопический
контроль, морфология и т.д.), что в поле зрения микроспектрофлуориметра локализованы в основном
митохондрии и зарегистрированный спектр люминесценции соответствует ожидаемому для
митохондриальной системы терминального окисления (
Схема метаболизма), то только после
изучения изменения этого спектра при действии специфических именно для этой (митохондрии)
системы ингибиторов (амитал, ротенон, цианистый калий и т.д.) и субстратов (например, сукцинат)
можно идентифицировать структуру как митохондриальную. Некоторые приемы такого типа будут
также рассмотрены ниже.
Среди других, люминесцирующих в синей и желто-зеленой областях спектра
соединений при
исследовании клеток животных можно встретить различные витамины и продукты метаболизма, в
том числе пиридоксали, фолиевую кислоту и ее производные и т.д. [9]. Яркой люминесценцией,
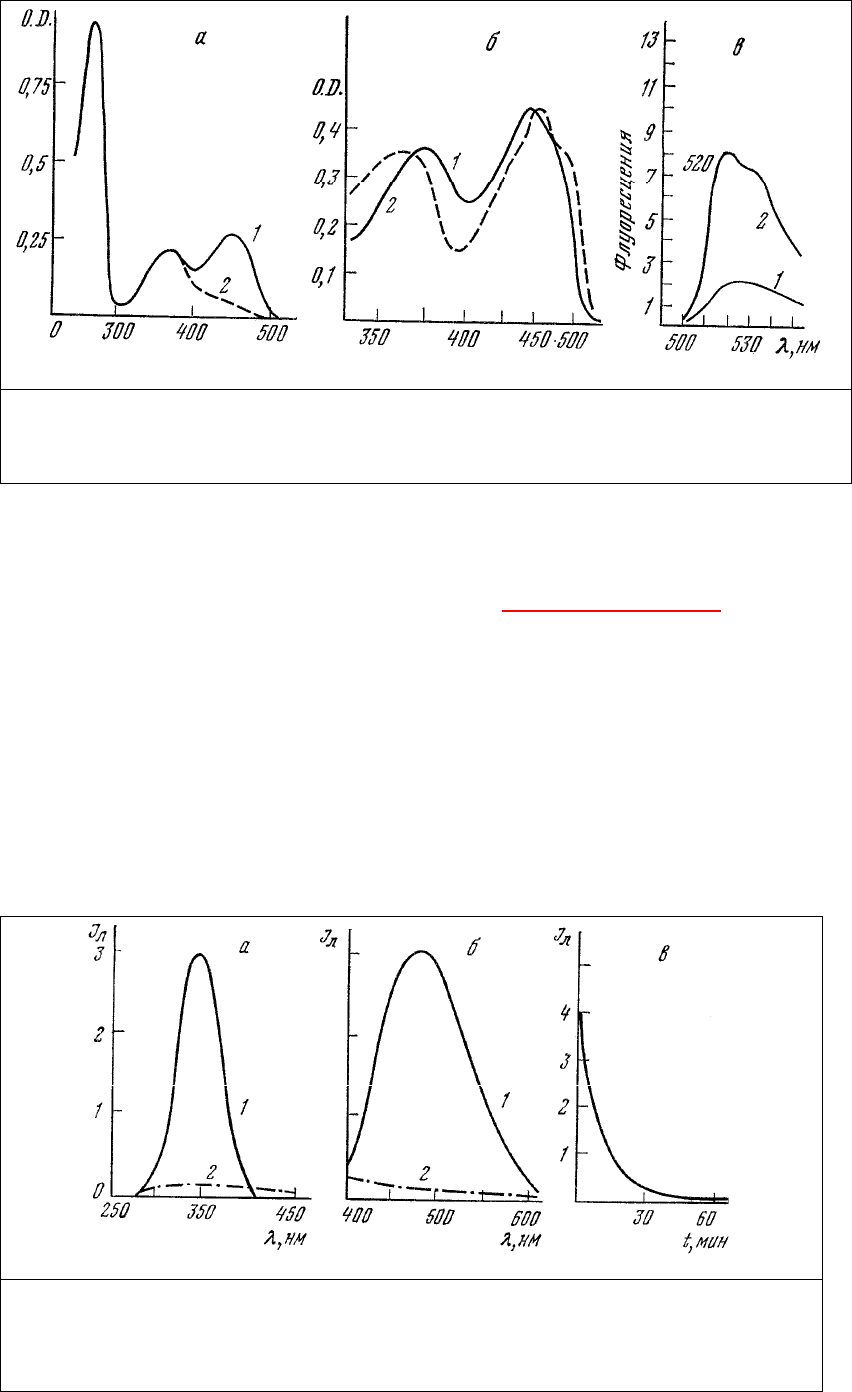
например с максимумом излучения 480 нм [111], обладает витамин А (рис.13). Характерной
особенностью этого соединения является быстрое фотовыцветание - снижение интенсивности
люминесценции под действием возбуждающего ее УФ-излучения
, что может быть использовано для
его индентификации в ткани.
Рис. 13. Спектры возбуждения (а) и люминесценции (б) раствора ацетата витамина
А до (1) и после (2) УФ-облучения и изменение интенсивности люминесценции при
УФ-облучении (в). Спектр возбуждения регистрировался в длине волны 480 нм,
спектр люминесценции – при возбуждении излучения 340 нм.
