Карнаухов В.Н. Люминесцентный анализ клеток
Подождите немного. Документ загружается.

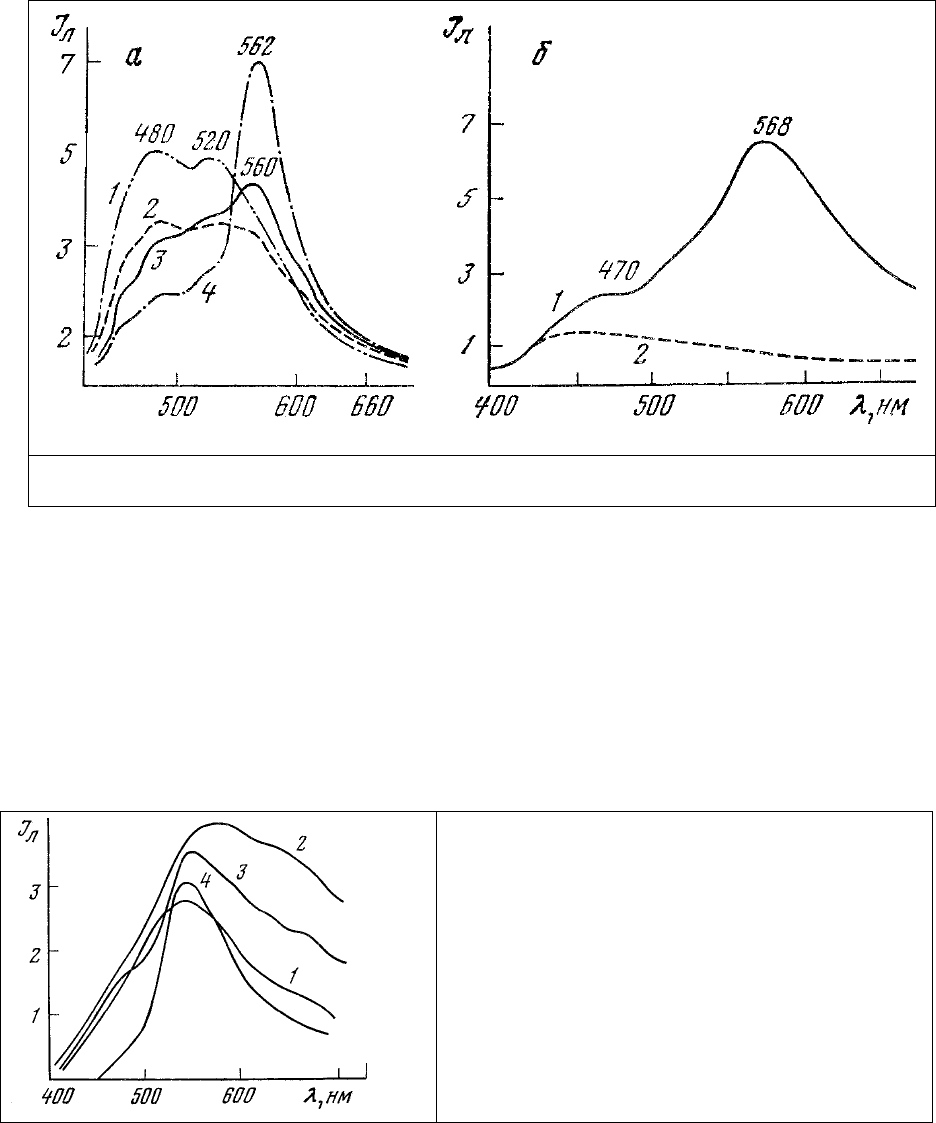
Гранулы внутриклеточного пигмента старения - липофусцина (которые в последнее время
предложено называть каротиноксисомами [65]) - обладают собственной люминесценцией, цвет
которой может варьировать от желтого до оранжевого. Спектры люминесценции срезов коры
головного мозга молодых крыс (рис.14, а, 1) содержат два максимума излучения. Один из них (480
нм) принадлежит восстановленным пиридиннуклеотидам, в то время как другой (520
нм) обязан
своим происхождением окисленным флавопротеинам. Цвет люминесценции срезов голубовато-
белесый без каких-либо включений. В отличие от этого на срезах коры головного мозга старых крыс
на голубовато-белесом фоне люминесценции наблюдаются липофусциновые гранулы разного
размера и формы, люминесцирующие ярко-желтым светом.
Рис. 14. Спектр собственной люминесценции: а – срезов коры головного мозга молодых (1) и
старых (2-4) крыс; б – клеток корня моркови (1); нулевая линия препарата (2).
Соответственно этому в спектрах люминесценции ткани старых животных, кроме полос
излучения восстановленных пиридиннуклеотидов (480 нм) и окисленных флавопротеинов (520 нм),
появляется дополнительная полоса излучения с максимумом 560-565 нм (рис. 14, а, 2). В том случае,
когда липофусцин занимает значительную часть поля зрения, этот максимум увеличивается (рис.14,
а, 3) и становится преобладающим в спектре (рис.14, а, 4) [112-116].
Возможно, что люминесценция
липофусциновых гранул обязана своим происхождением каротиноидам [115], являющимися
важнейшей составной частью этих гранул [65, 114, 117]. Сходные по форме и положению
максимумов излучения спектры люминесценции регистрируются и у каротиноидсодержащих гранул
клеток корня моркови (рис.14, б) и нейронов моллюска большого прудовика [115]. Спектры
люминесценции отдельных гранул липофусцина (рис.15) состоят из полос люминесценции
нескольких соединений
. Вариации относительных интенсивностей этих полос определяют форму
Рис. 15. Спектры собственной люминесценции.
1, 2 – гранулы липофусцина в нейронах головного
мозга коровы (8-10 лет);
3 – каротиноидсодержащие гранулы
(каротиноксисомы) в нейронах моллюска;
4 - β-каротин в масле (аптечный препарат).
Длина волны возбуждения 365 нм.
результирующего спектра люминесценции и цвет свечения самих гранул, который может изменяться
от ярко-желтого (рис.15, 1) до красновато-бурого (рис.15, 2). Основной максимум при этом совпадает
с максимумом спектра люминесценции раствора β-каротина в масле (рис.15, 4) [112—113]. При этом
не исключена возможность, что среди входящих в состав липофусциновых гранул
люминесцирующих соединений имеются и
переокисленные ненасыщенные жирные кислоты [118].
При проведении исследований на фиксированных препаратах с применением флуорохромов
не следует забывать, что действие фиксатора приводит к появлению в препарате люминесценции,
интенсивность которой может оказаться сравнимой с интенсивностью излучения используемого
флуорохрома и явиться, таким образом, источником методических ошибок. Например, при
использовании фиксирующих смесей, содержащих формалин, возникает достаточно яркая
люминесценция клеток в
желто-зеленой области спектра. Это, с одной стороны, создает помехи для
применения флуорохромов с невысоким квантовым выходом, а с другой - может служит основой для
разработки специальной люминисцентно-цитохимической реакции, выявляющей биогенные
моноамины, продукты взаимодействия которых с формальдегидом и являются причиной появления
люминесценции в области 480-520 нм. Такую реакцию можно проводить на
лиофилизированном
материале в парах формальдегида (известный метод Фалька [119-120]) либо непосредственно при
фиксации живых клеток водными растворами формальдегида [121].
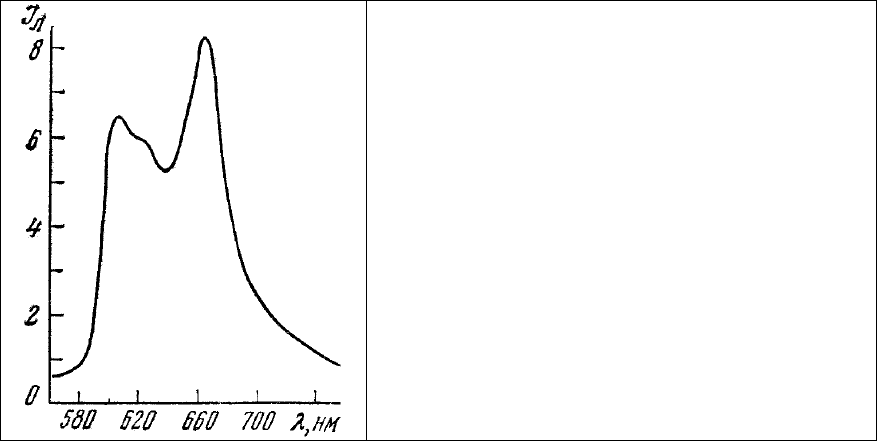
Красная область спектра. В тканях животных люминесценция в красной области спектра
чаще всего связана с присутствием порфиринов [122, 123] в живых клетках. Порфириновая
структура, обладающая яркой и характерной люминесценцией (рис.16), лежит в основе
простетических групп
таких широко распространенных соединений, как цитохромы, пероксидаза,
каталаза, гемоглобин и миоглобин. В гемопротеинах люминесценция «погашена» присутствием
атома железа. Однако в клетках с высокой скоростью синтеза этих соединений могут присутствовать
значительные количества порфиринов, являющихся промежуточным продуктом в синтезе гема. С
другой стороны, патологические нарушения в обмене гемосодержащих соединений, например в
результате некоторых
отравлений [124, 125], также могут приводить к появлению характерной
люминесценции порфиринов в клетках и служить, таким образом, важным диагностическим тестом.
Рис. 16. Спектр люминесценции гематопорфирина
в эритроцитах, обработанных концентрированной
кислотой.
Длина волны возбуждения 436 нм.
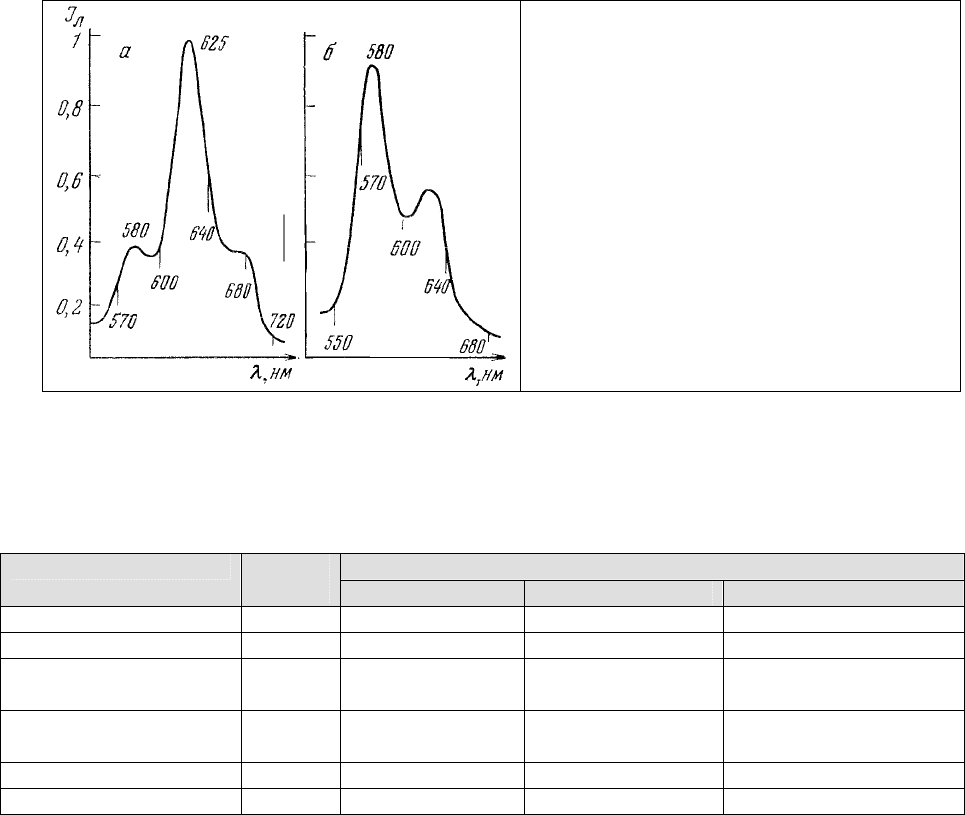
Интересные возможности слежения за физиологическим состоянием некоторых
микроорганизмов открываются при изучении в них обмена порфиринов. Прямой регистрацией
спектров люминесценции порфиринов в популяции дрожжей Candida quilliermondii было
установлено [126], что в процессе основного цикла ферментации, когда в аппарат (ферментер)
поступает необходимое количество субстрата (нормальные углеводороды, соли и микроэлементы), в
дрожжах накапливаются порфирины с
основным максимумом люминесценции около 625 нм (рис. 17,
а).
Во второй же стадии процесса ферментации, характеризующейся прекращением
поступления субстрата, в дрожжах синтезируются порфирины с основным максимумом
люминесценции около 580 нм. Параллельный подсчет мертвых клеток в популяции показал,
что количество их пропорционально интенсивности флуоресценции порфиринов в области
580 нм (рис.17, б). Авторы пришли к выводу, что в нормально растущих дрожжах
накапливаются свободные формы копропорфирина III и протопорфирина IX (табл.1). При
этом концентрация копропорфирина III в 5-10 раз превышает концентрацию
протопорфирина IX (рис.17, а).
При повреждении же дрожжевых клеток в условиях голодания, инактивирующего
действие нагревания, блокирования дыхательной цепи и т. д., происходит накопление
хелатных комплексов копропорфирина III и протопорфирина IX с цинком, содержащимся в
среде культивирования в качестве микроэлемента, что и приводит к наблюдаемому
изменению спектра люминесценции клеток (рис.17, б) [127]. Обнаруженная закономерность
послужила основой способа определения жизнеспособности дрожжей - продуцентов в
микробиологическом синтезе [128].
Рис. 17. Спектры люминесценции
нормально растущих (а) и голодающих (б)
дрожжей [127].
Таблица 1
Спектральные характеристики некоторых порфиринов
Положение максимумов, нм Соединение Раство
-ритель
люминесценция возбуждение поглощение
Копропорфирин III Эфир 625, 690
401, 531, 498, 573
392, 568, 495, 623, 528,
Протопорфирин IX » 635, 700 408, 538, 506, 580 403, 575, 504, 633, 535,
Копропорфирин III
дикатион
0,1н.НС
l
595, 651
400, 548
400, 547, 590
Протопорфирин IX
дикатион
1,5н.НС
1
606, 662
410, 560
407, 554, 600
Zn-Копропорфирин III
578, 628 409, 542
407, 540, 576
Zn-Протопорфирин IX
588, 638 418, 550
417, 548, 585
Необходимо отметить, что при обработке тканей животных некоторыми фиксаторами может
происходить отрыв атома железа от простетической группы ряда внутриклеточных гемопротеинов
(например, миоглобина). В результате на месте локализации этих соединений появляется характерная
люминесценция порфиринов [122], что необходимо учитывать при работе с флуорохромами,
люминесцирующими в этой области спектра. Реакция может быть использована
также и для
разработки цитохимического метода выявления некоторых гемопротеинов в клетках животных.
Именно этот прием используется, например, в криминалистике для обнаружения отдельных
эритроцитов по их порфириновой люминесценции после обработки объекта серной кислотой.
Особенно широко распространены люминесцирующие в красной и желто-оранжевой областях
спектра соединения (хлорофиллы и фикобилины) в клетках растений и
водорослей. При этом
представители разных типов имеют различающийся набор хлорофиллов и фикобилинов [129-131]
(рис.18). Учитывая, что каждое из этих соединений имеет характерное для него положение
максимумов в спектрах поглощения и люминесценции [132-135] (табл. 2), можно ожидать, что и
суммарные спектры люминесценции клеток (например, водорослей), относящихся к разным типам,
будут различаться между собой.
Действительно
, спектры люминесценции одиночных клеток красной водоросли Ceratium
rubrum (рис.19, 2) отличаются от спектров зеленой (рис.19, 3) и бурой (рис.19, 1) водорослей прежде
всего присутствием двух дополнительных полос излучения с максимумами 585 и 640-660 нм,
принадлежащих характерным для этих растений фикоэритрину и фикоцианинам, отсутствующим у
бурых и зеленых водорослей. В то же время положения основного максимума люминесценции
хлорофиллов у них совпадают, отражая то обстоятельство, что хлорофилл а является общим
основным пигментом этих растений (рис.18).

Хлорофилл
Тип
Тип тилакоида
a b c
c
1
c
2
d
R-фикоэритрин
R-фикоцианин
Аллофикоцианин
C-фикоэритрин
C- фикоцианин
Clorophyceae V
Euglenophyceae VI
Xanthophyceae IIIb
Eustigmatophyceae IIIa
Chrysophyceae IIIb
Haptophyceae IIIb
Pheophyceae IIIb
Bacillariophyceae IIIb
Dinophyceae IIIa
Cryptophyceae II
Rhodophyceae I
Cyanophyceae I
Рис. 18. Пигментный состав и структурная организация тилакоидов
хлоропластов у водорослей разных типов
Таблица 2
Положение полос люминесценции (в нм) пигментов растений в растворе [132—135]
и в плетке
Соединение Раствор Клетка Примечание
Хлорофилл а 669, 723 678 рис. 21, 3
Хлорофилл b 649, 708 — —
Хлорофилл с 629, 690 — —
Хлорофилл 696, 752 — —
Бактериохлорофилл 805 — —
Хлоробиум-хлорофилл . 653 — —
R-фикоэритрин 578 572 рис. 21,2; 22, 2
С-фикоэритрин 575 — —
R-фикоцианин 565, 637 640 рис. 22, 3
С-фикоцианин 647 643 рис. 23,б, 2
Аллофикоцианин 660 660 рис. 22, 2
Х
лорофиллы – раствор в этиловом эфире: фикобилины – водный раствор
По-видимому, пигментный состав, а следовательно, и спектральные, в том числе
люминесцентные, характеристики одноклеточных водорослей являются более вариабельными, чем у
клеток многоклеточных водорослей (рис.19), и в большей степени зависят от условий обитания,
возраста и т. д. Однако по приведенным на рис.20 спектрам люминесценции одиночных клеток
одноклеточных зеленых, синезеленых, красных и
диатомовых водорослей можно, пользуясь
сравнением с данными рис.18, установить положение полос люминесценции в живых клетках только
некоторых пигментов. Наиболее четко при этом выделяется полоса излучения 572 нм (рис.20, 2),
принадлежащая R-фикоэритрину, характерному для красных водорослей (рис.18). Что касается полос
излучения хлорофиллов, лежащих в области 670÷690 нм, то кривая 3 (синезеленые) должна отражать
присутствие
только хлорофилла а, в то время как спектры 1 (зеленые), 2 (красные) и 4 (диатомовые)
должны содержать полосы излучения смеси хлорофиллов: a+b, a+d, a+c
1
+c
2
соответственно
(рис.18). Поэтому можно полагать, что основная полоса излучения хлорофилла а в относительно
«чистом» виде наблюдается в спектре синезеленых водорослей (рис.21, 3) и ее максимум лежит в
области 678 нм. Для определения максимумов других хлорофиллов требуется более тонкий анализ.
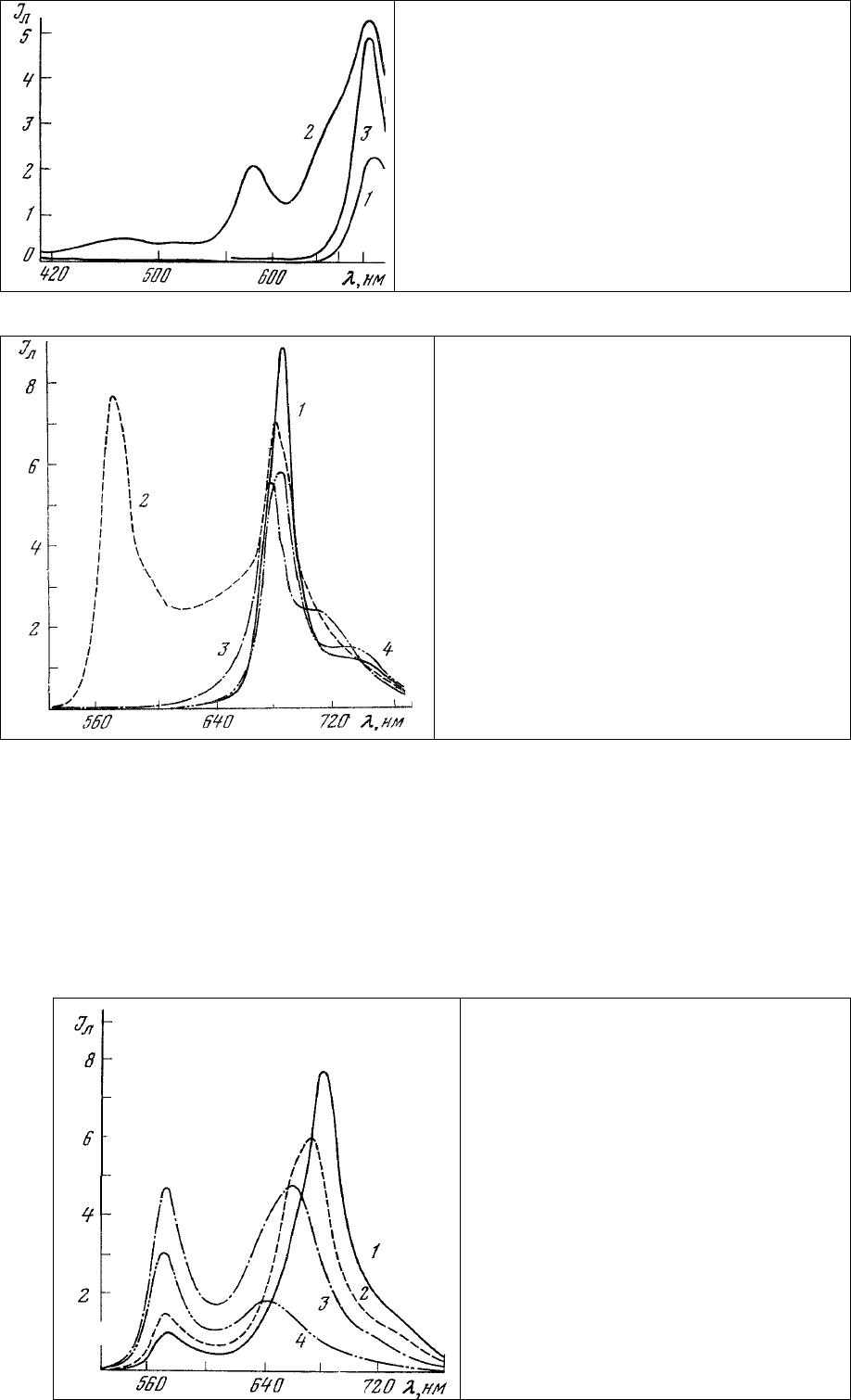
Рис. 19. Спектры люминесценции клеток бурой
(1 – Cystoseira barbata), красной (2 – Ceratium
rubrum) и зеленой (3 – Ulva lactuca) морских
водорослей. Длина волны возбуждения 365 нм.
Рис. 20. Спектры люминесценции
одиночных клеток зеленых (1 – Scenedesmus
quadricauda), красных (2 – Porphyridium
cruentum), синезеленых (3 – Microcystis
aeruginosa) и диатомовых (4 – Biddulphia
mobiliensis) одноклеточных водорослей.
Длина волны возбуждения 436 нм.
Дополнительные сведения могут быть получены при изучении изменений спектральных
характеристик клеток под действием тех или иных факторов. Простейшим в методическом
отношении случаем, по-видимому, является изменение спектров во времени под действием
интенсивного светового облучения. Приведенные на рис.21 данные позволяют по мере «выгорания»
части компонентов спектра установить положение максимумов излучения, маскировавшихся
ранее.
Так, например, по спектру 2 можно определить максимум люминесценции аллофикоцианина (660
нм) и уточнить положение максимума R-фикоэритрина (572 нм). Дальнейшее облучение приводит к
«выгоранию» аллофикоцианина, и положение максимума излучения R-фикоцианина (640 нм)
становится доступным для определения (рис. 21, 3).
Рис. 21. Изменение спектра
люминесценции одиночной клетки
красной водоросли Porphyridium cruentum
(1) через 1 (2), 2 (3) и 3 (4) мин облучения
светом с длиной волны 436 нм. Длина
волны возбуждения 436 нм.
Динамика спектров люминесценции синезеленой водоросли в процессе старения популяции
(рис. 22) указывает на значительные изменения пигментного состава клеток и позволяет определить
положение максимума люминесценции С-фикоцианина (643 нм) в спектре клеток, относящихся к 8-
месячной популяции (рис. 22, б, 2), в котором исчезают близко расположенные полосы
люминесценции других пигментов. Следует обратить внимание и на то
обстоятельство, что по мере
уменьшения интенсивности люминесценции хлорофилла а (678 нм) наблюдается увеличение
интенсивности люминесценции пиридиннуклеотидов (470 нм) и флавопротеинов (520 нм), что
указывает, по-видимому, на происходящую по мере старения культуры смену аутотрофного
(фотосинтетического) способа энергообеспечения на гетеротрофный.
Рис. 22. Спектры люминесценции одиночных клеток синезеленой водоросли Microcystis
aeryginosa в разные сроки культивирования: а – 3 (1), 15 (2) и 120 (3) суток культивирования;
б – 6 (1), 8 (2) и 9 (3) месяцев культивирования. Длина волны возбуждения 365 нм.
Приведенные примеры в какой-то мере показывают перспективность применения
люминесцентного спектрального анализа в исследовании физиологии растительных клеток. Следует
отметить также, что благодаря чрезвычайно яркой люминесценции (высокий квантовый выход)
хлорофиллы используются иногда в люминесцентной цитохимии в качестве специфического
красителя - метки жиров.
Биолюминесценция. Хотя биолюминесценция (способность клеток некоторых видов животных и
микроорганизмов
генерировать свет) встречается не очень часто, это явление требует, тем не менее,
пристального внимания по ряду причин.
1. Биолюминесценция, несомненно, связана с интимными химическими процессами,
протекающими в клетке и ее органоидах, и может быть использована после соответствующего
изучения для тонкого анализа физиологического состояния клеток обладающего способностью к
биолюминесценции организма.
2. Между
молекулярными механизмами ярко выраженной у некоторых рыб, беспозвоночных
и микроорганизмов биолюминесценции и так называемым сверхслабым свечением клеток
теплокровных животных [136-139] существует, по-видимому, некоторая общность, и изучение
биолюминесценции может способствовать более глубокому пониманию процессов, лежащих в
основе сверхслабого свечения тканей и клеток животных.
3. Наконец, биолюминесцентные реакции характеризуются высокой специфичностью и
участвующие
в них вещества могут быть выделены и использованы в качестве хемилюминесцентных
меток некоторых химических компонентов метаболизма. Примером тому может служить
биолюминесцентная реакция экстракта из светлячков, позволяющая определять концентрацию АТФ
в среде [140-142]. По-видимому, наиболее убедительные данные о динамике кальция в процессе
мышечного сокращения были получены Эшли и Риджуэем [143], использовавшими фотопротеин
медузы Aequorea в качестве хемилюминесцентного реагента на кальций [144-147]. Поиск подобного
типа хемилюминесцентных флуорохромов-меток является одним из наиболее перспективных
направлений развития люминесцентного анализа функциональных механизмов живой клетки.
Явление биолюминесценции широко распространено у организмов самого разного уровня
филогенеза [148—153]. Биолюминесцентное излучение может лежать в ультрафиолетовой, синей,
зеленой и красной областях спектра [151, 152]. Следует, правда, отметить
, что ультрафиолетовая и
красная биолюминесценции встречаются редко среди описанных видов. В частности, только у
колониальных кишечнополостных Renilla [154] обнаружена ультрафиолетовая компонента в спектре
излучения. В видимой области спектра биолюминесценция этих кишечнополостных характеризуется
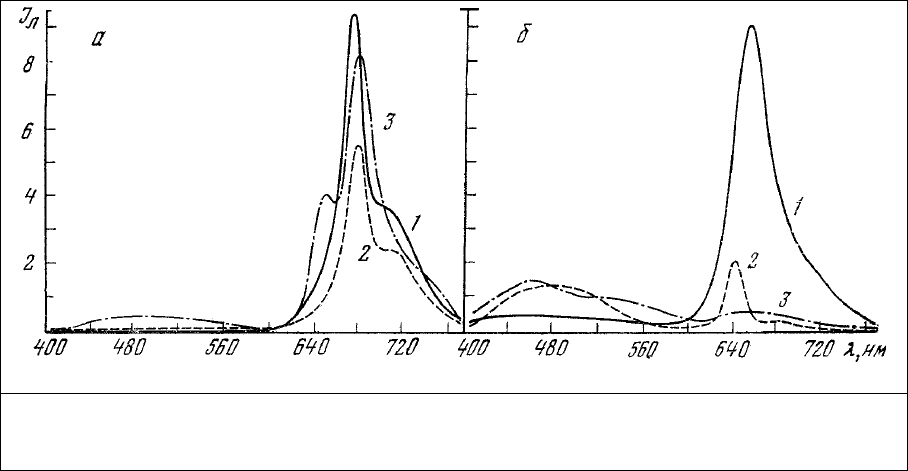
наличием двух максимумов излучения, один из которых (509 нм) является основным. Вторая полоса
излучения меньшей интенсивности расположена в области 540-570 нм и регистрируется (рис.23, а, б)
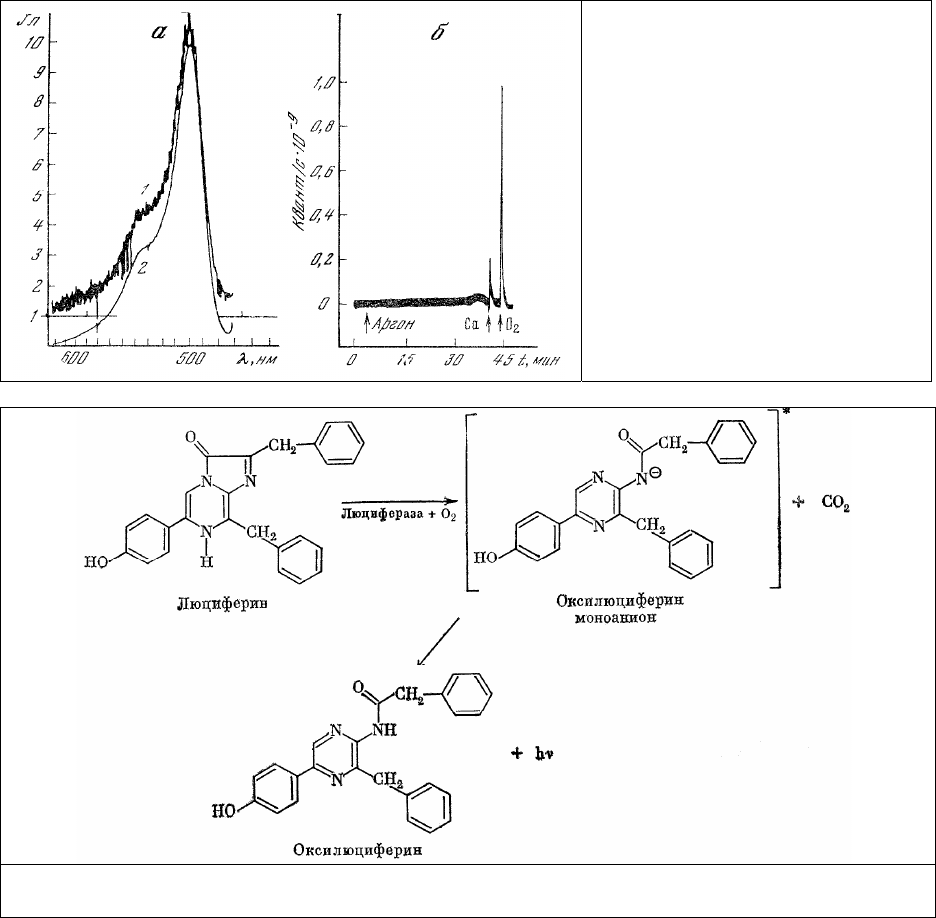
в виде плеча [155, 156]. Аналогичная форма спектров биолюминесценции сохраняется и при
проведении реакции in vitro с выделенным [157] из тканей фотопротеином. При этом в процессе
реакции потребляется О
2
и выделяется СО
2
[158]. Реакция протекает по схеме, приведенной на
рис.24.
Рис. 23. Биолюминесценция
Renilla reniformis. а – спектры
люминесценции целого животного
(1) и люминесценции люциферазы
(2), выделенной из этого
животного [155]; б – зависимость
Са
2+
- индуцируемой
люминесценции люмисом,
изолированных из R reniformis, от
кислорода [159].
Рис. 24. Генерация света (hν) при хемолюминесцентном и биолюминесцентном окислении
синтетического люциферина [158].
В клетках кишечнополостных биолюминесценция локализована в специальных
внутриклеточных гранулах, названных люмисомами [159, 160]. Выделенные люмисомы генерируют
свет при добавлении к ним Са
2+
в присутствии кислорода (рис.24, б). Следует при этом отметить, что
и другие ионы помимо кальция способны стимулировать биолюминесцентное излучение люмисом,
хотя и с несколько меньшей эффективностью (см. ниже).
Добавленный ион Са
2+
+ Sr
2+
+Ва
2+
+Со
2+
+Cu
2+
+ Mn
2+
+Zn
2+
+Fe
2+
+La
2+
+Pb
2+
+Mg
2+
+NH
4
+
+K
+
Биолюминесценция, % 100 26 1 22 24 31 20 21 6 2 <1 <1 <1
Приведенные на рис.23, б данные указывают на возможность использования
биохемилюминесценции фотопротеинов кишечнополостных (в том числе и известного экворина
[161-163] и его синтетических аналогов [161]) в качестве реагента не только на внутриклеточный
кальций [143], но и на кислород.
Желто-зеленая биолюминесценция (рис.23, а) наиболее распространена, хотя у некоторых
видов животных, например «железнодорожный
червь» и фотофоры на теле кальмара Lycoteuthis
diadema, наблюдается биолюминесцентное свечение в красной области.
Можно полагать, что биолюминесценция на уровне организма и популяции несомненно
имеет определенные поведенческие функции [164]. Однако эти функции являются, вероятно,
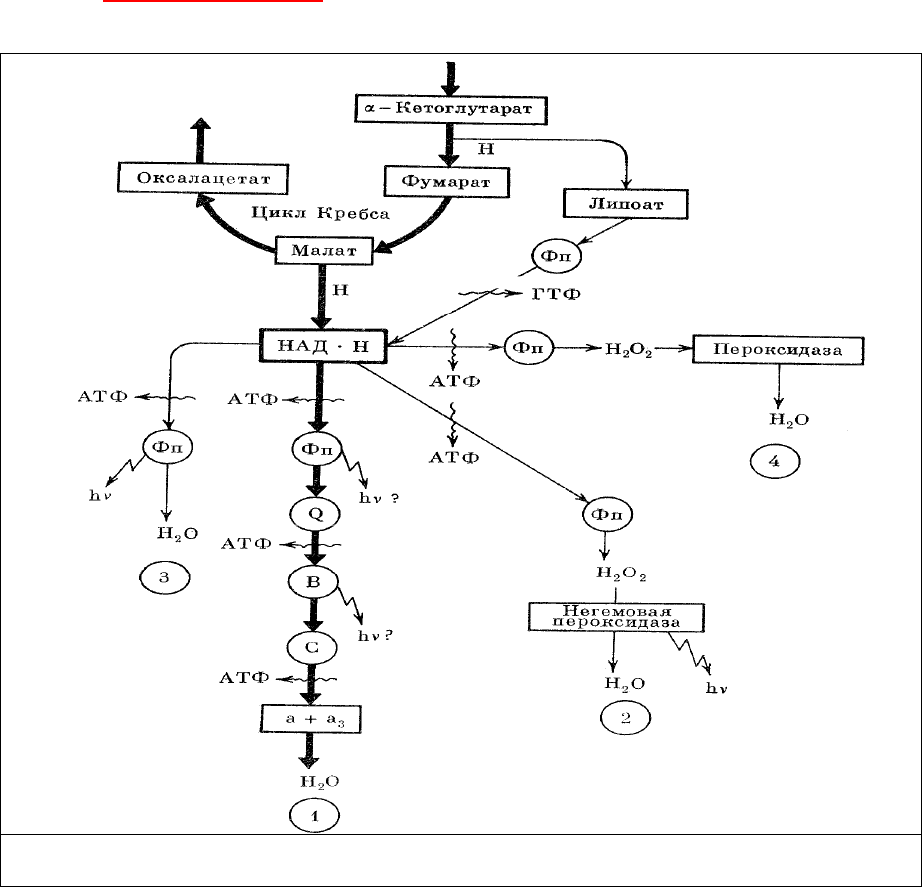
вторичными, и способность клеток организма к генерации света определяется в первую очередь
биохимическими потребностями их энергопроизводящих систем. Экскреция избыточной энергии в
виде светового излучения и предупреждение таким образом нежелательных химических реакций в
клетке или теплового нагрева ее в некоторых ситуациях может оказаться решающим фактором
вообще в существовании клеток и организмов данного
типа. Многие системы терминального
окисления (
Схема метаболизма) имеют своим конечным продуктом перекись водорода Н
2
О
2
,
которая обычно разлагается до воды с помощью гемсодержащих пероксидаз (рис.25, 4).
Рис. 25. Связь биолюминесценции с энергопроизводящими системами окислительного
метаболизма клеток
Однако дезактивация Н
2
О
2
может происходить и с помощью негемовой пероксидазы,
излучающей избыток энергии в виде биолюминесцентного кванта света (рис.25, 2). Реакция типа
люцифераза
LH
2
+ Н
2
О
2
⎯⎯⎯⎯→
L + 2Н
2
О
2
+ h
ν
обнаружена у представителя кишечнодышащих Balanoglossus himinesis [165] и у земляного червя
Diplocardia longa [166].
Системы терминального окисления этого типа (рис.25, 2, 3, 4) обладают низким КПД и, по-
видимому, не используются клетками в нормальном режиме, когда энергообеспечение
осуществляется за счет работы основной высокоэкономичной, но обычно маломощной системы
(рис.25, 1) терминального окисления. Только в условиях напряженного энергетического обмена
,
когда скорость выработка энергии в основной цепи терминального окисления перестает
удовлетворять энергетическим запросам клетки (действие различных физических и химических
раздражителей), происходит переключение путей переноса электронов в систему терминального
окисления с большей мощностью, но и с меньшим КПД, и может возникнуть необходимость в
экскреции неиспользуемой части энергии в виде биолюминесцентного излучения. По-видимому,
именно это обстоятельство и является причиной того, что биолюминесценция возникает у многих
видов животных как реакция на то или иное раздражение или сопровождает возбуждение животного.
В настоящее время трудно определить, обязательно ли присутствие специальной негемовой
пероксидазы в системе (рис.26, 2) или
эту роль могут выполнять непосредственно сами
флавопротеины (рис. 26, 3) и перекись водорода вообще не образуется в этом случае. Красное
биолюминесцентное излучение может, по-видимому, возникать, если экскреция энергии происходит
с более низкого энергетического уровня цепи переноса электронов, например с уровня цитохромов
(рис. 25, 1).
При изучении внутриклеточных механизмов биолюминесценции особый интерес в
связи с
изложенным выше представляет сравнение биолюминесцентных и люминесцентных характеристик
клетки с целью установления взаимосвязи механизмов генерации света с окислительным обменом.
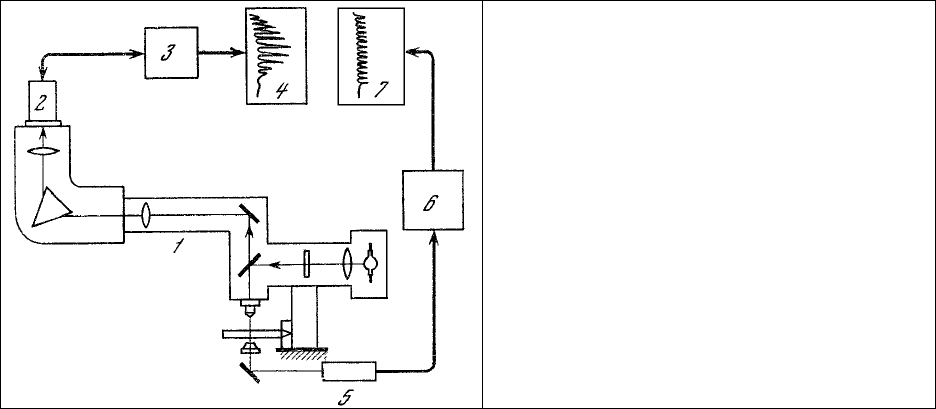
Такое исследование было выполнено на примере фотогенных клеток гребневика Bolinopsis
infundibulum [167] с использованием микроспектрофлуориметра [168] с улучшенными
спектральными характеристиками [169]. Возбуждение люминесценции объекта производилось
линией излучения 365 нм ртутной дуговой лампы ДРШ-250, выделяемой
светофильтром УФС-6.
Размеры фотометрируемого участка 20×100 мкм. Во время регистрации спектров биолюминесценции
полностью отключался источник ультрафиолетового излучения (ДРШ-250) и на объект подавались
прямоугольные импульсы электрической стимуляции c частотой 0,5-1 Гц, вызывавшие световые
вспышки той же частоты (рис. 26).
Рис. 26. Установка для регистрации спектров
биолюминесценции и люминесценции
фотогенных клеток гребневника Bolinonsis
infundibulum.
1 – микроспектрофлуориметр; 2, 5 –
фотоумножители; 3 , 6 – промежуточные
усилители; 4, 7 – одноканальные
регистраторы.
Ввиду того, что при малой частоте (0,5-1 Гц) и длительности (1-5 мс) импульсов
электрической стимуляции биолюминесцентные вспышки характеризуются малой дисперсией
амплитуды, при включении развертки микроспектрофлуориметра в интервале длин волн от 400 до
700 нм регистрировалась последовательность световых импульсов, огибающая которой представляет
собой спектр импульсной биолюминесценции (рис.27, а, 2). В ряде экспериментов применялся
параллельный контроль
стабильности амплитуды световых вспышек с помощью второго
фотоумножителя (рис.26).
Для исследования использовали небольшие кусочки фотогенной ткани (1-3 мм), вырезанные
из меридиональных рядов гребных пластинок. Препараты приготавливали обычно накануне
экспериментов и хранили в чашках Петри при t = 0° 8-12 ч. К началу опытов из этих вырезанных
кусочков ткани образовывались сферические агрегации клеток, окруженные венчиком
бьющихся
гребных пластинок. В отличие от целого животного такие агрегации отвечают на раздражение более
или менее стандартными по форме одиночными световыми импульсами.
Особенностью биолюминесценции гребневика (и хемилюминесценции выделенного из него
фотопротеина) является то, что достаточно интенсивный белый свет полностью инактивирует ее и
открывается возможность сравнивать спектральные характеристики фотогенных клеток в двух
состояниях - способных к биолюминесценции и не способных (инактивированных белым светом).
Биолюминесценция целых гребневиков и агрегаций их фотогенных клеток возникает в ответ
на электрическое, механическое или иное стрессирующее раздражение и имеет импульсный
характер. При этом форма и длительность световых импульсов более или менее стандартны и не
определяются характером стимуляции. При электрическом
раздражении животного появление
биолюминесцентного импульсного ответа запаздывает (рис.28, а) относительно начала стимуляции,
биолюминесцентные импульсы наблюдаются также и после окончания раздражения (рис.28, б).
Только при использовании для электростимуляции импульсов достаточно высокой амплитуды и
малой частоты их следования (0,5-1 Гц) можно получить биолюминесцентный ответ на каждый
стимулирующий импульс.
Рис. 27. Спектры биолюминесценции и
люминесценции фотогенных клеток
гребневника. а – статическая (1) и импульсная
(2) биолюминесценция; б – сравнение спектра
импульсной биолюминесценции фотогенных
клеток (1) со спектрами люминесценции тех
же клеток, адаптированных к темноте (2, 3) и
после облучения видимым светом в течение 40
мин (4). По оси ординат – интенсивность
излучения в отн. ед. по оси абсцисс – длина
волны
в нм. Длина волны возбуждения
люминесценции 365 нм.
Рис. 28. Взаимоотношение биолюминесценции
(1) и электрической стимуляции (2)
фотогенных тканей гребневника.
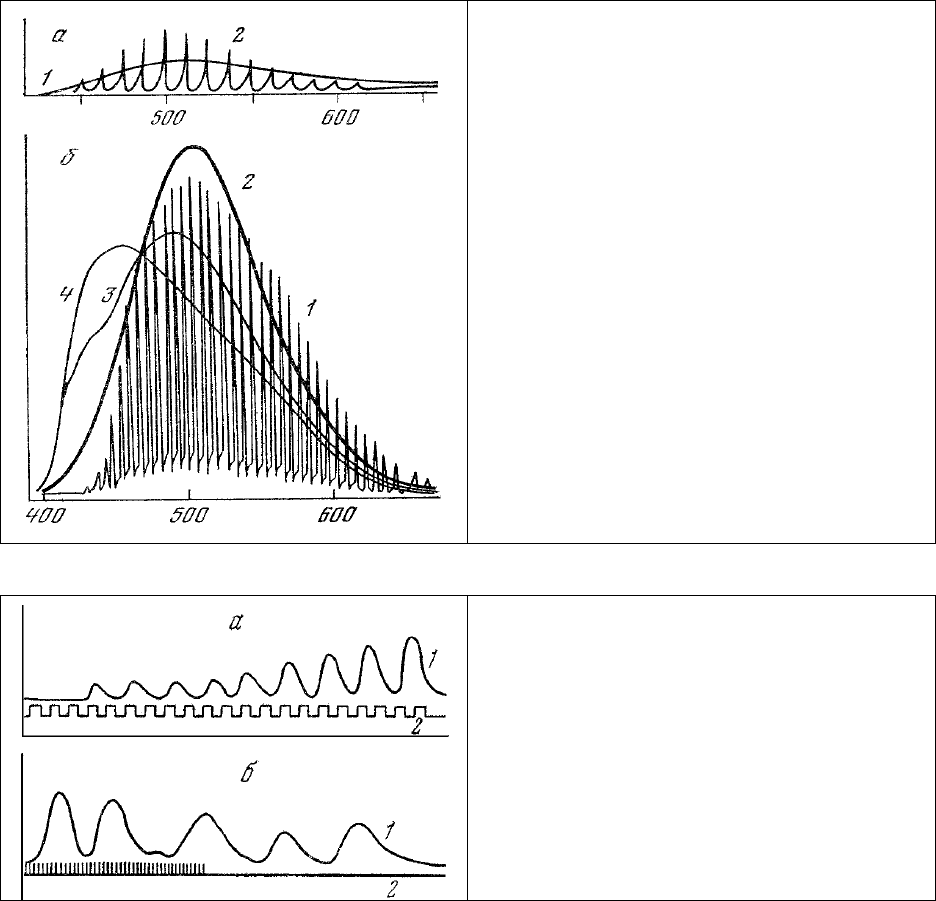
Оказалось, что, как и у многих кишечнополостных (см. рис.23), основной максимум спектра
биолюминесценции гребневика лежит в области 505±5 нм и имеется дополнительный максимум
излучения 540—570 нм (рис.27, б, огибающая 1).
Спектры люминесценции (возбуждаемой УФ-излучением) фотогенных участков агрегаций,
находившихся в темноте и способных к биолюминесценции, характеризуются максимумом
излучения 490 нм .(рис.27, б, 3). Освещение этих
агрегаций ярким видимым светом (15000 люкс)
приводит к потере ими способности высвечиваться в ответ на раздражение и сопровождается, как
оказалось, изменением спектра люминесценции таким образом, что одновременно с уменьшением
полосы с максимумом 490 нм наблюдается увеличение интенсивности полосы с максимумом 465 нм
и последний максимум становится основным в спектре (рис.27, б, 4).
В ряде
случаев на свежеприготовленных препаратах адаптированных к темноте агрегаций
регистрируются спектры люминесценции, отличающиеся большой интенсивностью излучения в
области 505 нм (рис. 27, б, 2) и совпадающие по положению максимума со спектрами
биолюминесценции. Амплитуда таких спектров быстро уменьшается, их максимум смещается в
область 490 нм, и сами спектры приобретают обычно регистрируемую форму (рис.27, б, 3).
Продолжающееся
действие возбуждающего люминесценцию УФ-излучения приводит к дальнейшим
изменениям спектра и приближению его к характерной для неспособных к биолюминесценции
агрегаций форме (рис.27, б, 4). В то же время ритмические биения ресничек агрегаций не только не
подавляются видимым светом в ходе опытов, но, напротив, ускоряются на свету.
При добавлении нескольких капель дистиллированной
воды в камеру с объектом
наблюдается серия вспышек и последующая статическая биолюминесценция, максимум спектра
