Карнаухов В.Н. Люминесцентный анализ клеток
Подождите немного. Документ загружается.

образом, в полностью неактивной в синтетическом отношении клетке нуклеиновые кислоты
представлены, в основном, двухспиральными нуклеиновыми кислотами (ДНК) и характеризуются
низким значением параметра α, близким по величине к таковому для нативной ДНК или ДНП.
Зрелые сегментоядерные нейтрофилы (рис. 44, а) представляют собой, по-видимому, пример клеток
именно такого типа. Активация синтетических процессов в
клетке неизбежно приводит к повышению
величины параметра α либо за счет появления «расплетенных» участков ядерной ДНК при активации
генома клетки, либо за счет накопления различных форм РНК, либо за счет обоих этих факторов.
Хотя, как следует из сказанного выше, параметр α и в общем случае характеризует
синтетическую активность клетки, остается,
однако, заманчивым прецезировать долю
односпиральных участков ДНК в общей массе односпиральных нуклеиновых кислот. Это позволило
бы определить стадии развивающегося процесса активации синтеза в клетке и установить, имеем ли
мы дело с начальной стадией активации генома, в которой вклад односпиральных участков ДНК в
общую массу НК
1
велик, или со второй стадией, когда односпиральные нуклеиновые кислоты
представлены, в основном, различными видами РНК и в большинстве своем - рибосомальной РНК.
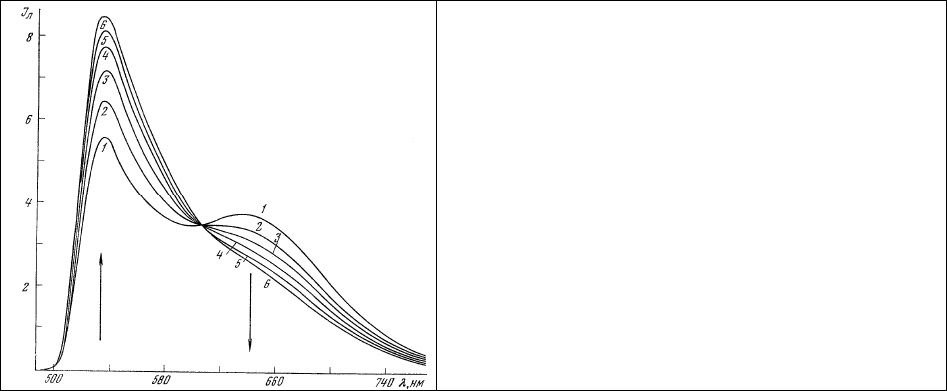
В этом отношении специальный интерес, по-видимому, представляет особенность
фотодеструкции акридинового оранжевого, характерная для бластных клеток, костного мозга,
находящихся на той или иной стадии дифференцировки [224]. В дифференцированных клетках
фотодеструкция («
выгорание») связанного с ними акридинового оранжевого происходит таким
образом (тип I), что одновременно уменьшается интенсивность обеих, мономерной и димерной,
полос излучения, хотя и не обязательно в одинаковой степени (рис. 46, табл. 4).
Совершенно по-иному протекает процесс фотодеструкции красителя, связанного с
упомянутыми выше бластными клетками в препарате костного мозга. Приведенное на рис. 51
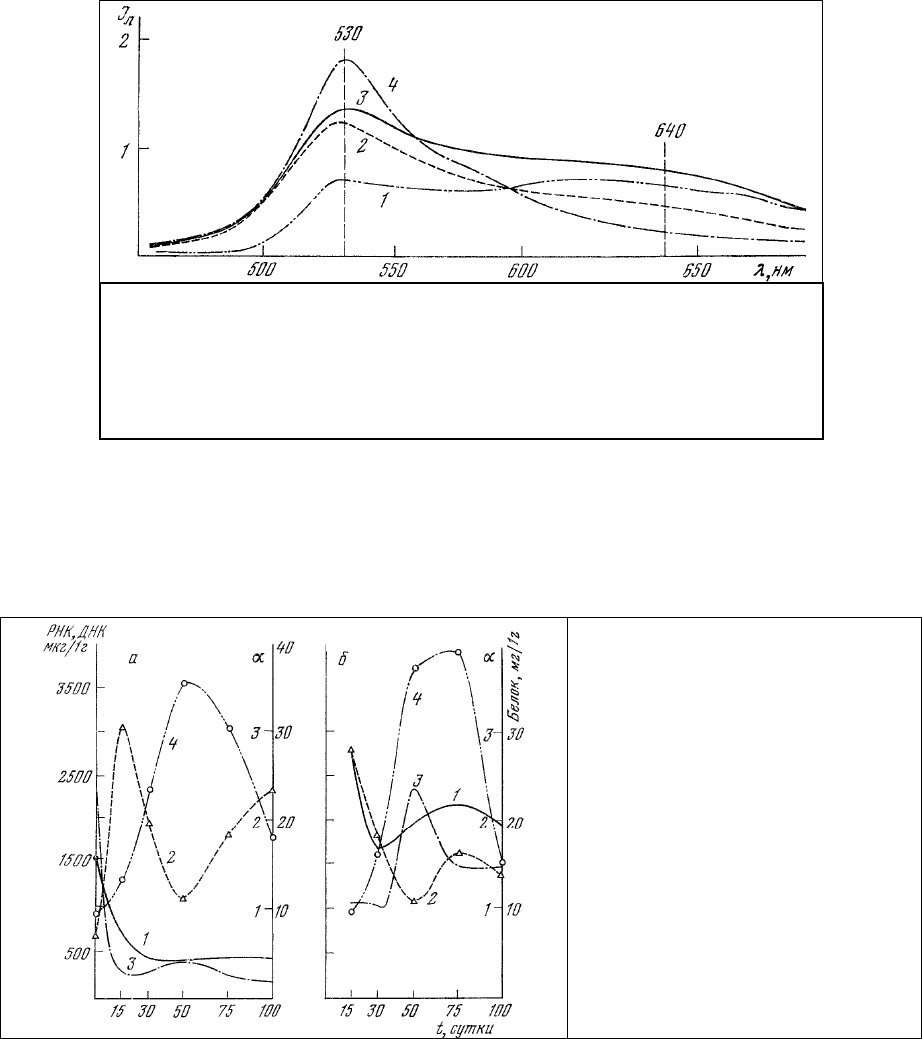
семейство спектров
люминесценции гемоцитобласта свидетельствует о том, что фотодеструкции в
первую очередь подвергаются димеры акридинового оранжевого (тип II). При этом на месте димера
оказывается мономер и потому одновременно с уменьшением интенсивности полосы изучения
димеров (640 нм) наблюдается рост интенсивности полосы излучения мономеров (530 нм)
акридинового оранжевого с четко выраженной изобестической точкой, положение которой в
спектральном
диапазоне (565-605 нм) зависит от исходного соотношения интенсивностей полос
излучения димеров и мономеров в спектре люминесценции клетки.
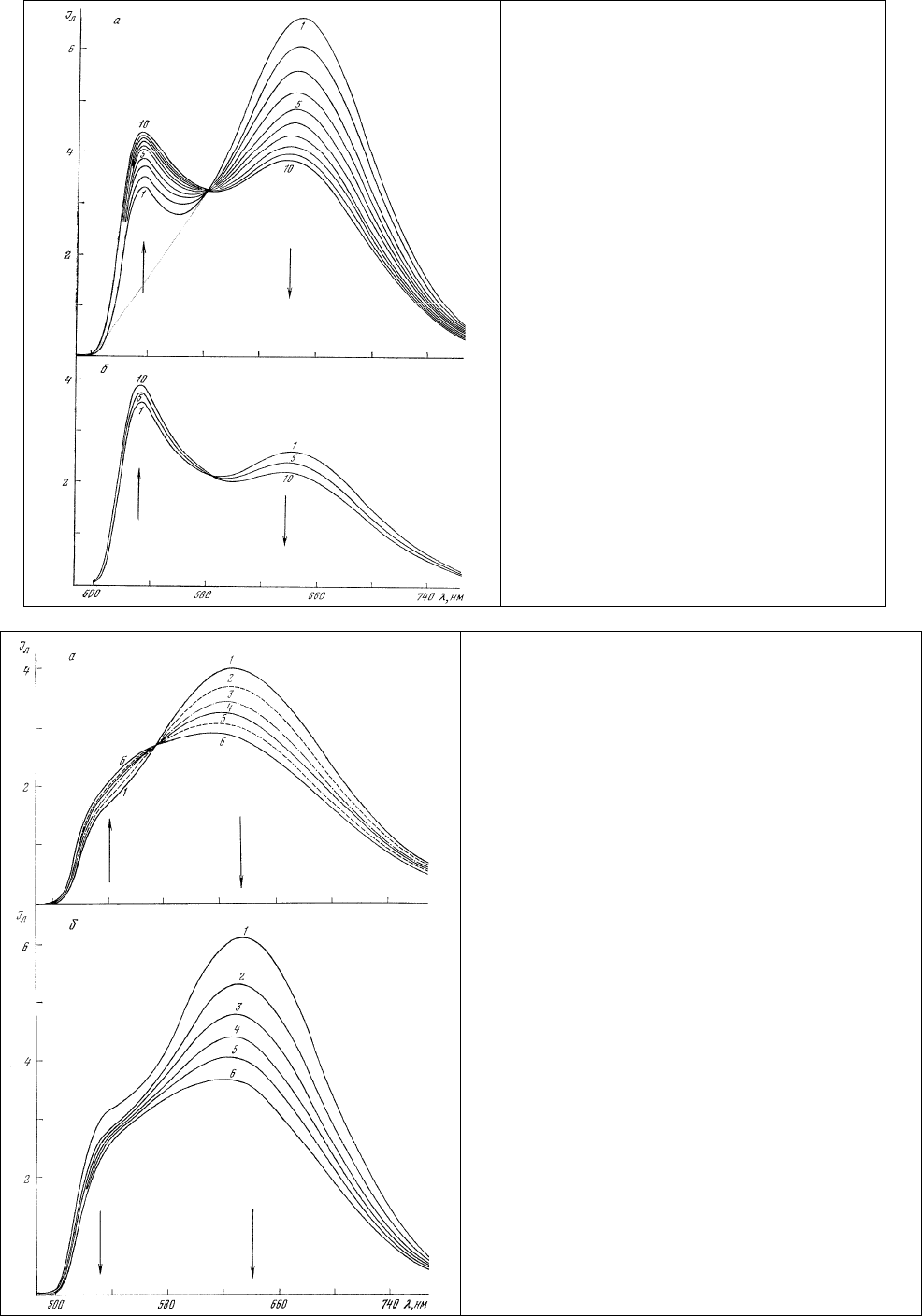
Рис. 51. Действие облучения с длиной волны 436
нм на окрашенный акридиновым оранжевым
гемоцитобласт.
1 – исходный спектр; 2 - 6 – спектры,
регистрируемые с интервалом времени 1мин.
Длина волны возбуждения 436 нм.
Степень выраженности эффекта зависит от степени дифференцированности клетки.
Сравнение динамики изменения спектров люминесценции нормобластов в препарате костного мозга
практически здорового человека показывает, что эффект фотодеструкции красителя с проявлением
изобестической точки (тип II) в большей степени выражен у базофильных нормобластов (рис. 52, а)
по сравнению с более дифференцированными оксифильными нормобластами (рис. 52, б).
Интересно
отметить, что мало отличающиеся между собой по величине параметра α узко- и
широкоплазменные лимфоциты из лимфоузла селезенки четко различаются по типу фотодеструкции
связанного с ними акридинового оранжевого. В то время как у широкоплазменных лимфоцитов
наблюдается фотодеструкция (рис 53 б) типа I (характерная для зрелых дифференцированных
клеток), узкоплазменным лимфоцитам свойственна, хотя и в
малой степени (рис.53, а),
фотодеструкция типа II с выраженной изобестической точкой семейства последовательно
регистрируемых спектров люминесценции.
При более длительном облучении клеток фотодеструкция типа II переходит в тип I, когда
уменьшение интенсивности излучения димеров не сопровождается увеличением интенсивности
излучения мономеров. Это указывает на существование в данных клетках двух типов комплексов
димеров с односпиральными нуклеиновыми
кислотами, один из которых - комплекс с РНК, другой
— комплекс с односпиральными участками ДНК, для которого, по-видимому, и является
характерной фотодеструкция типа II.
Рис. 52.Действие облучения с длиной
волны 436 нм на окрашенный
акридиновым оранжевым базофильные
(а) и оксифильные (б) нормобласты из
костного мозга здорового человека.
1 – исходный спектр: 2 – 10 – спектры,
регистрируемые с интервалом времени 1
мин. Длина волны возбуждения 436 нм.
Рис. 53. Изменение спектров люминесценции
окрашенных акридиновым оранжевым
узкоплазменных (а) и широкоплазменных (б)
лимфоцитов из лимфоузла селезенки человека. 1
– исходный спектр; 2 – 6 – спектры с интервалом
времени 1 мин. Длина волны облучения и
возбуждения 436 нм.
На обоснованность такого предположения указывает то обстоятельство, что фотодеструкция
типа II наиболее ярко выражена у бластных форм клеток крови (гемоцитобласты, проэритробласты,
нормобласты), и уменьшается параллельно увеличению степени дифференцированности клетки.
Аналогичный эффект наблюдается и у делящихся клеток печени в стадии удвоения числа хромосом.
Ядро. Избежать погрешностей, связанных с влиянием внеядерной ДНК, можно, переходя к
характеристике состояний синтетической активности клетки по активности ее ядерного аппарата.
При этом измеряются величины α только в ядре
клетки или, если это представляется интересным, в
ядрышке. Тогда смысл параметра α соответственно меняется и α становится характеристикой либо
активности генома (ядро) клетки, либо активности только ядрышкового аппарата. Таким образом,
открывается возможность прослеживать временные взаимоотношения внутриклеточных
синтетических процессов и органоидов. Геометрическое разрешение и чувствительность
современных микроспектрофлуориметров вполне достаточны для этой цели
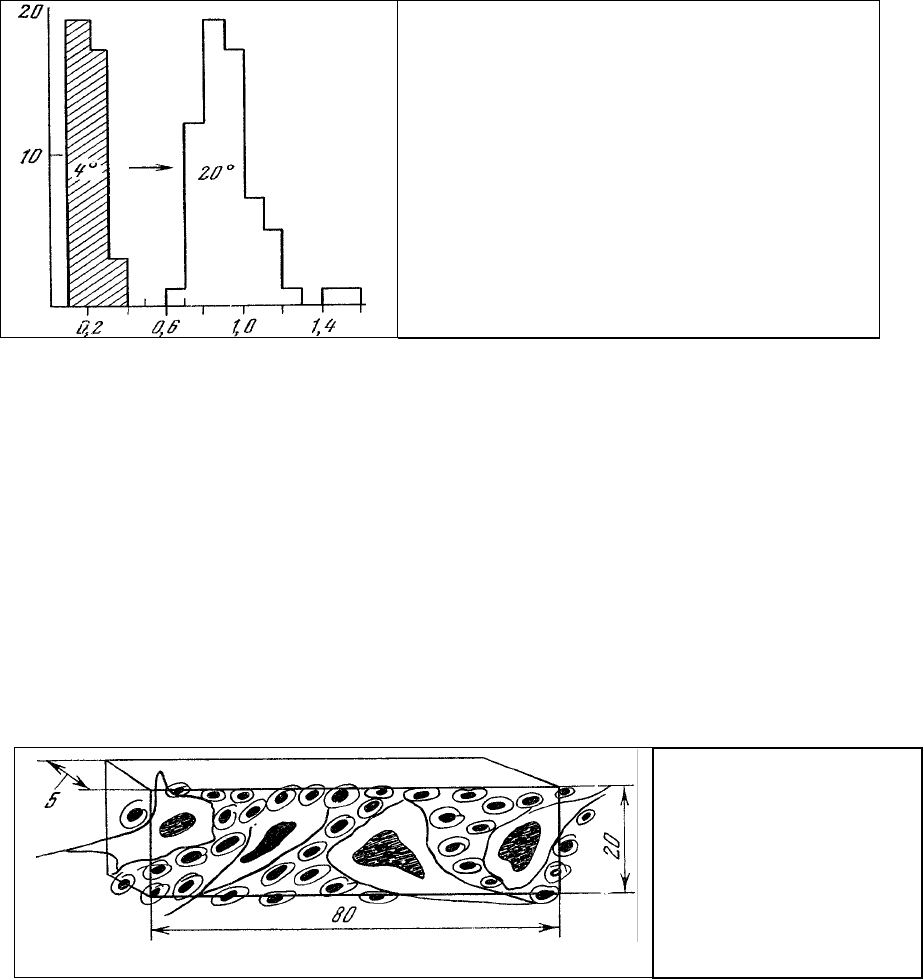
. Приведенные на рис. 54
гистограммы распределения α ядер идентифицированных гигантских нейронов моллюска
показывают, что зависимость от физиологического состояния выражается тем более четко, чем выше
разрешающая способность метода. Изменения активности ядерного аппарата ясно выражены, и для
трактовки физиологического смысла наблюдаемого увеличения α могут быть использованы все
приведенные выше соображения относительно α для
целой одиночной клетки.
Рис. 54. Гистограммы распределения α в ядрах
идентифицированных нейронов БП
2
и БП
4
моллюска Lymnaea stagnalis на холоду (4
0
С) и
при комнатной (20
0
С) температуре. По оси
ординат – число ядер; по оси абсцисс - α.
Ткань. Еще более сложная ситуация возникает, если объектом исследования служит не
одиночная клетка, а целая группа клеток, находящаяся в поле зрения прибора. Такие измерения
представляют зачастую большой интерес, так как они могут позволить сравнить соотношение
концентраций РНК и ДНК в ткани, определяемое оптическими (люминесцентными) методами и
методами классической биохимии.
Однако
физиологический смысл изменения параметра α в этом случае теряет ясность и
однозначность.
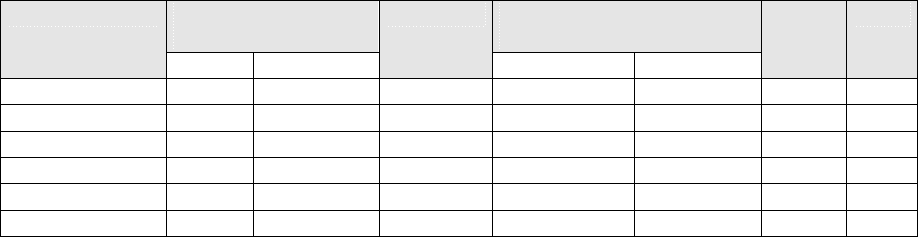
Действительно, при измерениях такого типа входная щель микроспектрофлуориметра,
оставаясь постоянной, выделяет из препарата участок, площадь которого соответствует оптическому
изображению щели (например, 80 × 20 мкм, рис. 55), а объем определяется толщиной среза (5 мкм,
рис. 55). В результате измеряемое отношение интенсивностей красной и
зеленой люминесценции
оказывается отнесенным всегда к определенному объему ткани или при соответствующих пересчетах
к определенному весу ее, т. е. измеренное отношение интенсивностей люминесценции отражает
отношение концентрации веществ.
Рис. 55. Оптическое
вычленение
определенного объема
нервной ткани при
микроспектрофлуориметр
ическом определении
соотношения
концентраций веществ.
Размеры в мкм.
Однако в этом случае возникают те же трудности в физиологической трактовке получаемых
результатов, как и при классических биохимических исследованиях отношений концентраций ДНК и
РНК в различных тканях животных [237, 238]. Суть этих трудностей заключается в том, что
переменным становится не, только числитель (концентрация РНК), но и знаменатель (концентрация
ДНК) в выражении для
параметра α, так как количество клеток и их ядер в оптически выделенном
постоянном объеме (18000 мкм
3
, рис. 55) может быть различным. Более того, может изменяться и
соотношение клеток разного типа. В соответствии с этим будет изменяться и концентрация ДНК,
отражающая количество клеток (ядер) в изучаемом объеме [239, 240]. Поэтому без привлечения
дополнительных сведений, трудно определить, что означает, например, уменьшение параметра α.
Оно может означать как снижение функциональной активности клеток
в данном участке,
сопровождающееся снижением концентрации РНК в них при неизменном количестве клеток и,
следовательно, неизменной (в первом приближении) концентрации ДНК, так и резкое повышение
синтетической активности ткани, сопровождаемое делением клеток и соответствующим ростом их
количества в изучаемом объеме ткани. Связанное с этим увеличение концентрации ДНК,
находящейся в знаменателе, может приводить
к уменьшению параметра даже в случае умеренного
роста концентрации РНК в тех же клетках. В наиболее ярком виде эти закономерности могут
наблюдаться, по-видимому, при изучении участков корешка растения [241], находящихся на разных
расстояниях от зоны роста, в которой параметр α принимает относительно низкое значение ввиду
того, что поле зрения занято
большим количеством мелких, только что разделившихся клеток.
Увеличение размеров клеток, а стало быть, уменьшение количества их в поле зрения прибора
является основной причиной увеличения параметра α по мере удаления от зоны роста, хотя
интенсивность синтеза при этом становится меньше.
Как было упомянуто выше, измерения такого типа дают возможность определить
соотношение концентраций
РНК и ДНК в исследуемых участках ткани. По-видимому, целесообразно
рассмотреть подробнее некоторые аспекты интерпретации результатов. Отношение интенсивностей
красной и зеленой люминесценции препарата, окрашенного акридиновым оранжевым, связано с
концентрацией димеров и мономеров, а следовательно, в рамках сделанных допущений, с
концентрацией РНК и ДНК уравнением
α
= I
640
/I
530
=
ϕ
ε
2
k
2
/
ε
1
k
1
⋅
с
РНК/
с
DНК =
ϕ
A
2
⋅
с
РНК/
с
DНК = В
⋅
с
РНК/
с
DНК,
(20')
где I
640
- интенсивность люминесценции в длине волны 640 нм (димеры); I
530
-интенсивность
люминесценции в длине волны 530 нм (мономеры); k
1
, k
2
- квантовые выходы связанных с
субстратом мономеров и димеров соответственно; ε
1
, ε
2
- коэффициенты экстинкции связанных с
субстратом мономеров и димеров соответственно; (ϕ - коэффициент распределения, характерный для
данной ткани.
Нетрудно видеть, что уравнение (20') отличается от аналогичного выражения для случая
одиночной клетки (20) наличием коэффициента распределения ϕ. Смысл этого коэффициента
достаточно очевиден (рис. 55) и отражает тот факт, что в состав изучаемой ткани могут входить
клетки
разного типа и размера, например, в случае нервной ткани - нейроны и глиальные клетки. В
результате изменения соотношения количества клеток разного типа может меняться соотношение
интенсивностей зеленой и красной люминесценции.
Если полагать средний объем пирамидного нейрона V слоя коры равным 1600 мкм
3
, а объем
глиальной клетки — около 160 мкм
3
[242, 243], то замена одного нейрона на 10 глиальных клеток
приведет к увеличению содержания ДНК в объеме, ранее занятом одним нейроном. Такое изменение
соотношения типов клеток отразится на оптических свойствах объекта, а, следовательно, и на
результатах измерения. Чтобы учесть это, оказывается необходимым ввести в уравнение (20)
коэффициент распределения ϕ, отражающий соотношение всех клеток в
данном объеме.
Тогда для соотношения концентраций РНК и ДНК из уравнения (20') имеем
с
РНК/
с
DНК = α/A
2
ϕ = α/В (21)
Отсюда следует, что для определения отношения концентраций
с
РНК/
с
ДНК, зная отношение
интенсивностей люминесценции α = I
640
/I
530
, необходимо определить коэффициент A
2
, зависящий
только от физических параметров, связанных с субстратом мономеров и димеров красителя, и
коэффициент ϕ , характеризующий соотношение клеток разного типа в изучаемой ткани. Это можно
сделать двумя способами.
Первый из них заключается в прямом измерении физических параметров (квантовых выходов
и коэффициентов экстинкции) и последующем вычислении коэффициента A
2
. Однако даже для
такого достаточно хорошо изученного красителя, как акридиновый оранжевый, имеющиеся в
литературе данные вызывают сомнения относительно возможности их прямого использования для
подобных расчетов. Не меньшие трудности могут возникнуть и при попытке рассчитать
коэффициент распределения ϕ , хотя и это может быть осуществлено.
Второй способ заключается в том, чтобы результаты
люминесцентных измерений
«прокалибровать» по результатам прямого биохимического определения отношения РНК/ДНК в
исследуемой ткани. При этом сразу определяется суммарный коэффициент В в уравнении (21). Такая
«калибровка» может, быть произведена либо по результатам собственного биохимического
определения, либо по литературным данным. Некоторые аспекты этого подхода можно рассмотреть
на примере ткани мозга крысы, подробно изученной биохимическими методами.
Для подобного рода «калибровки» определенный интерес представляют данные о
концентрации ДНК и РНК в различных отделах головного мозга крысы [237, 238]. В табл. 5
приведено сравнение биохимических данных о концентрации нуклеиновых кислот и их соотношений
в некоторых отделах головного мозга крысы с результатами определения соотношения РНК/ДНК
методом измерения интенсивности люминесценции в длинах волн 640 и 530 им. Срезы головного
мозга крысы (возраст 120 дней, фиксация
по Карнуа, заливка в парафин) окрашивались акридиновым
оранжевым в разведении 1:30 000 на цитратфосфатном буфере с рН 5,6 в течение 10 мин (см. рис. 45)
с последующей промывкой (2 мин) и заключением в нелюминеспирующую среду. Измерения
проводили при возбуждении люминесценции в длине волны 365 нм. Размер фоюметрируемого
участка 20×80 мкм, толщина - 5 мкм.
Таблица 5
Сопоставление аоотношения нуклеиновых кислот, определяемых биохимически [238] и
методом окрашивания акридиновым оранжевым
Содержание (мкг/1г
сырого веса)
Интенсивность
люминесценции (отн. ед.)
Отдел мозга
РНК ДНК
РНК/ДНК
640 нм 530 нм
α
В
Большой мозг
Серое вещество 65 36 1,72 10 62 0,16 0,09
Белое вещество 45 40 1,1 24 17 0,14 0,13
Таламус 48 32 1,5 8 36 0,22 0,14
Гипоталамус 59 45 1,25 7 29 0,24 0,19
Гиппокамп 60 38 1,64 1,3 8,4 0,15 0,09
Сопоставление приведенных в табл. 5 данных показывает, что, действительно, величина
коэффициента В в уравнении (21), представляющего собой произведение постоянного множителя А
2
и коэффициента распределения ϕ, является переменной и зависит от соотношения клеток разного
типа в изучаемом участке ткани. При этом близкие по своему клеточному составу ткани, такие, как,
например, кора мозга и гиппокамп, имеют равные коэффициенты В.
Необходимо отметить два обстоятельства, которые важно иметь в виду при проведении такого
рода «калибровки
» люминесцентного метода. Первое из них заключается в том, что биохимические
методы дают весьма усредненные сведения о содержании и соотношении веществ в достаточно
большом объеме ткани, необходимом для проведения химического анализа. Люминесцентный же
метод позволяет проводить определения в очень малых объемах, регистрируя при этом те локальные
вариации концентраций, которые обычно усредняются
при биохимическом анализе ткани. Поэтому,
производя сравнение результатов для определения коэффициента В, в качестве получаемого
люминесцентным методом параметра α необходимо использовать результат, усредненный по
большему числу измерений.
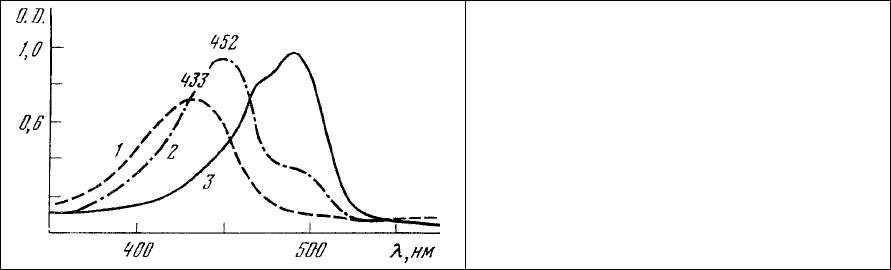
Некоторые представления о локальной вариабельности соотношений интенсивности
люминесценции в 530 и 640 нм можно получить, сопоставляя спектры (рис.56) разных клеток и их
участков. Часть пирамидных
клеток обладает довольно интенсивной красной люминесценцией
цитоплазмы. Соответственно этому полоса с максимумом в 640 нм преобладает в спектре
люминесценции цитоплазмы этих клеток, показывая высокое содержание РНК в них (рис. 56, 1). В то
же время в спектре ядра этой клетки (рис. 56, 2) преобладающей уже является полоса излучения 530
нм, указывая на высокое содержание ДНК
. В случае, если в поле зрения попадает ядро и цитоплазма,
то регистрируется спектр с промежуточным соотношением интенсивностей полос 530 и 640 нм.
Хотя красная люминесценция преобладает по интенсивности только в спектрах цитоплазмы
некоторых нейронов, находившихся, по-видимому, в момент фиксации в состоянии повышенной
функциональной активности, тем не менее она достаточно заметна и
в цитоплазме других
пирамидных нейронов. В отличие от этого в спектре люминесценции целой клетки олигодендроглии,
большую часть которой занимает ядро, преобладающей является полоса люминесценции с
максимумом излучения 530 нм, в то время как излучение в области 640 нм относительно невелико
(рис. 56, 4). Поскольку количество глиальных клеток значительно превышает количество нейронов в
поле
зрения микроспектрофлуометра, при регистрации спектров люминесценции достаточно
больших участков ткани (рис.55) ясно, что именно глиальные клетки будут определять форму
спектра люминесценции в этом случае. Спектральные характеристики, подобные приведенным на
рис.56, могут быть использованы также и для качественного определения специфичности реакций по
распределению красной и зеленой люминесценции в разных внутриклеточных структурах, как это
было отмечено ранее.
Рис. 56. Спектры люминесценции отдельных участков (∅12 мкм)
пирамидных клеток (1 – 3) и клетки олигодендроглии (4) срезов
головного мозга крысы, окрашенных акридиновым оранжевым.
1 – цитоплазма; 2 – ядро; 3 – ядро с прилегающим участком цитоплазмы;
4 – клетка олигодендроглии целиком. Длина волны возбуждения 436 нм.
Второе обстоятельство связано с точным учетом возраста животного ввиду того, что как сами
концентрации определяемых соединений, так и их отношения испытывают значительные изменения
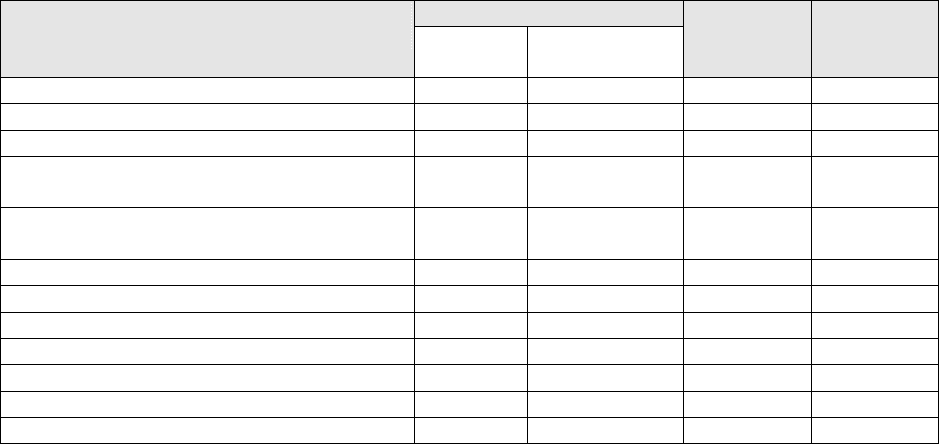
в процессе развития животного. Это можно видеть на примерах изменения содержания РНК, ДНК и
белков в мозжечке и в двигательной области коры больших полушарий мозга крысы (рис.57, по
данным Гейто [238]).
Рис. 57. Изменение концентрации
РНК (1), ДНК (2), отношения
РНК/ДНК (3) и белков (4) в
мозжечке (а) и двигательной зоне
коры больших полушарий (б)
мозга крысы с возрастом.
Такие значительные возрастные изменения концентрации РНК, ДНК и белков связаны как с
изменением внутриклеточного содержания этих соединений, так и с изменением плотности клеток в
ткани. Резкое повышение количества ДНК в мозжечке в течение 0-15 сут может быть связано с тем,
что мозжечок в этот период очень быстро растет, увеличивая свои размеры.
Это обстоятельство в
сопоставлении с тем, что количество ДНК служит показателем числа клеток в данном объеме ткани
[240], позволяет предполагать быстрое увеличение числа клеток в мозжечке после рождения
животного [238].
В течение 15—50 сут наблюдается уменьшение содержания как РНК, так и ДНК в мозжечке,
не означающее, однако, снижения содержания этих веществ в пересчете на одну клетку. По-
видимому, количество ДНК в клетке остается постоянным, а количество РНК несколько возрастает.
Причины наблюдаемого снижения состоят, вероятно, в том, что величины содержания ДНК и РНК
приведены в пересчете на 1 г ткани. Поэтому быстрый рост клеток, сопровождающийся увеличением
количества белка в них (рис. 57, 4), приводит к тому, что относительная доля РНК и ДНК в ткани
становится меньше. Кроме того, уменьшение содержания РНК и ДНК может быть связано и с
уменьшением количества клеток в фиксированном объеме ткани. Бриззи и соавт. [244] приводят
данные о том, что у белых крыс в возрасте 50 сут отмечается наименьшая плотность клеток в коре
мозга. На 10-е сут насчитывается примерно 100000 клеток в 1 мм
3
, на 50-е сут - 70000, а на 100-е сут
число их снова возрастает до 90000. Возможно, что именно этим объясняется повторный рост
содержания ДНК в мозжечке в возрасте от 50 до 100 сут (рис. 57, а, 2). В то же время рост
содержания других, не учтенных здесь компонентов нервной ткани (например, липиды) также может
вносить свой
вклад в наблюдаемые (рис. 57) закономерности, особенно в период 50-100 сут (падение
содержания белков), в случае представления содержания веществ в пересчете на 1 г ткани.
Учитывая изложенное выше, для «калибровки» люминесцентных методов по данным
биохимического анализа необходимо использовать животных одного и того же возраста. В этой связи
могут представить интерес результаты определения содержания нуклеиновых
кислот и белков в
различных участках нервной ткани и в почке белой крысы в возрасте 100 сут (табл. 6.)
Приведенные на рис. 57 соотношения показывают всю сложность интерпретации таких
данных в терминах физиологии ткани и клетки вне зависимости от того, каким методом - прямым
биохимическим или косвенным люминесцентным - они получены. При этом ясно обнаруживается
необходимость иметь более полные, чем соотношение РНК/ДНК, сведения. Уже наличие данных о
содержании белка в изучаемом участке ткани (рис. 57) позволяет резко повысить достоверность
суждения о протекающих в данной ткани процессах. Это лишний раз подчеркивает важность
разработки методов, в том числе и люминесцентных, определения соотношения в клетке и ткани
других компонентов
, таких, как белки и липиды. Некоторые из них будут обсуждены ниже.
Таблица 6
Содержание нуклеиновых кислот и белков в тканях крыс в возрасте 100 сут (по [238])
Содержание (мгк/1 г ткани
Ткань
РНК ДНК
РНК/ДНК
Белок, мг 1 г
ткани
Передняя вентральная кора 407 491 0,94 9,4
Медиальная вентральная кора 390 274 1,47 9,7
Задняя вентральная кора 443 309 1,60 12,8
Передняя дорзальная кора (двигательная
область)
390 274 1,47 15,0
Медиальная дорзальная кора (область
соматиче-ской чувствительности)
422 345 1,31 17,1
Задняя дорзальная кора (зрительная зона) 495 504 1,30 11,8
Задняя дорзальная кора (слуховая зона) 584 456 1,49 15,1
Мозжечок 443 2346 0,19 17,8
Большие полушария 397 448 0,92 17,9
Верхний отдел ствола 376 455 0,87 17,8
Нижний отдел ствола 340 386 0,94 13,5
Почка 850 1176 0,73 27,3
Возвращаясь к рассмотрению метода определения соотношения РНК/ДНК с помощью
акридинового оранжевого и имея в виду приведенные на рис. 57 сведения о соотношении содержания
белков и нуклеиновых кислот, необходимо отметить способность этого красителя к
неспецифическому связыванию путем электростатического взаимодействия с отрицательно
заряженными группами белковой молекулы. Хотя величина люминесценции (530 нм) таких
комплексов
мономеров красителя с белком и невелика, тем не менее, учитывая, что содержание белка
на 1-2 порядка может превышать содержание ДНК, следует считаться с возможностью получения
завышенных данных о содержании ДНК в ткани за счет вклада неспецифически связанных с белком
мономеров акридинового оранжевого.
Существуют различные способы учета этого обстоятельства. Контрольные эксперименты по
избирательной
экстракции исключительно полезны в этом случае. Определенная оценка ситуации
может быть сделана и на основании сравнительного анализа спектров люминесценции отдельных
участков и органоидов клетки (рис. 56).
Способ устранения люминесценции акридинового оранжевого, неспецифически связанного с
белком, путем предварительного ацетилирования полярных групп белков был предложен Риглером
[203]. Другой способ, аналогичный по идее предыдущему, заключается
в предварительной обработке
препарата каким-либо красителем, прочно связывающимся с отрицательно заряженными полярными
группами белков и делающим их неспособными к взаимодействию с акридиновым оранжевым [245].
Если при этом краситель обладает люминесценцией, то, очевидно, такая реакция, кроме
блокирования нежелательных групп белковых молекул, может служить для одновременного
определения соотношения РНК:ДНК:белок в клетке и ткани люминесцентным методом [246, 247].
В заключение этого раздела полезно еще раз отметить ценность метахроматических
красителей, позволяющих не только получить цветовой контраст наблюдаемых в люминесцентном
микроскопе картин, но и достаточно просто воспользоваться преимуществами двух и более
волновых
методов регистрации при возбуждении одного красителя излучением подходящей длины волны.
Акридиновый оранжевый - только наиболее изученный из них. По-видимому, многие из красителей
акридинового ряда обладают метахромазией. А.В.Зеленин [36] отмечает, что столь же яркие и
контрастные картины, как и с акридиновым оранжевым, были получены при окраске корифосфином
О и
эухризином 2GNX. Причем последний имеет по сравнению с акридиновым оранжевым то
преимущество, что он более стоек к выцветанию под действием УФ-облучения и может быть
использован для окрашивания препаратов, фиксированных осмиевой кислотой [248].
КОРИФОСФИН О
Отечественные препараты выпускаются
в виде соли с хлористым цинком
м.в. 287,8 + х136,29
Другие акридиновые красители, такие, как
аурофосфин, акрифлавин (трипафлавин) и акриди
новый желтый, дают меньшее цветовое различие одно- и двухспиральных нуклеиновых
кислот. Учитывая, однако, большую чувствительность аппаратурных методов, было бы полезно
изучить эти соединения, тем более, что, имея различающиеся по положению полос спектры
поглощения (рис. 58), они могут быть более удобны для комплексного окрашивания.
Рис. 58 Спектры поглощения красителей
акридинового ряда.
1 – эухризин 2 GNX; 2 – аурофосфин; 3 –
акридиновый оранжевый.
3.2. Определение соотношения различных веществ в клетке
К сожалению, пока неизвестны надежные метахроматаческие люминесцентные красители,
которые могли бы связываться одновременно как с белками, так и с нуклеиновыми кислотами, давая
комплексы с разным цветом люминесценции. Поиск такого типа красителей является, по-видимому,
одним из наиболее перспективных направлений развития люминесцентной количественной
цитохимии.
В первую очередь, вероятно, могут быть исследованы
красители, метахроматичность которых
уже использовалась ранее в классической гистохимии или в молекулярной биологии. Известно,
например, под фирменным (Serva) названием «Stains all» соединение 4,5,4',5'-дибензо-3,3'-диэтил-9-
метилтиакарбоцианинбромид, используемое для метахроматической окраски акриламидных гелевых
столбиков. При этом белки окрашиваются в красный, ДНК - в синий, РНК — в розовый цвет. Кислые
мукополисахариды приобретают голубую окраску [249]. В качестве селективного красителя
это
соединение применялось в гистохимии [250] с использованием классической микроскопии в
проходящем свете. Можно было ожидать, что если этот краситель обладает способностью к
люминесценции, то его люминесцентное излучение будет обладать метахромазией и положение
полос излучения окажется зависящим от того, с молекулами какого (белки, ДНК, РНК)
внутриклеточного вещества связан краситель.
Проведенные исследования (
рис. 59) показали, что «Stains all» обладает достаточно яркой
метахроматической люминесценцией, но не дает, по-видимому, четкого спектрального разделения
ДНК, РНК и белков и имеет только две характерные полосы в спектре люминесценции (490 и 615
нм).
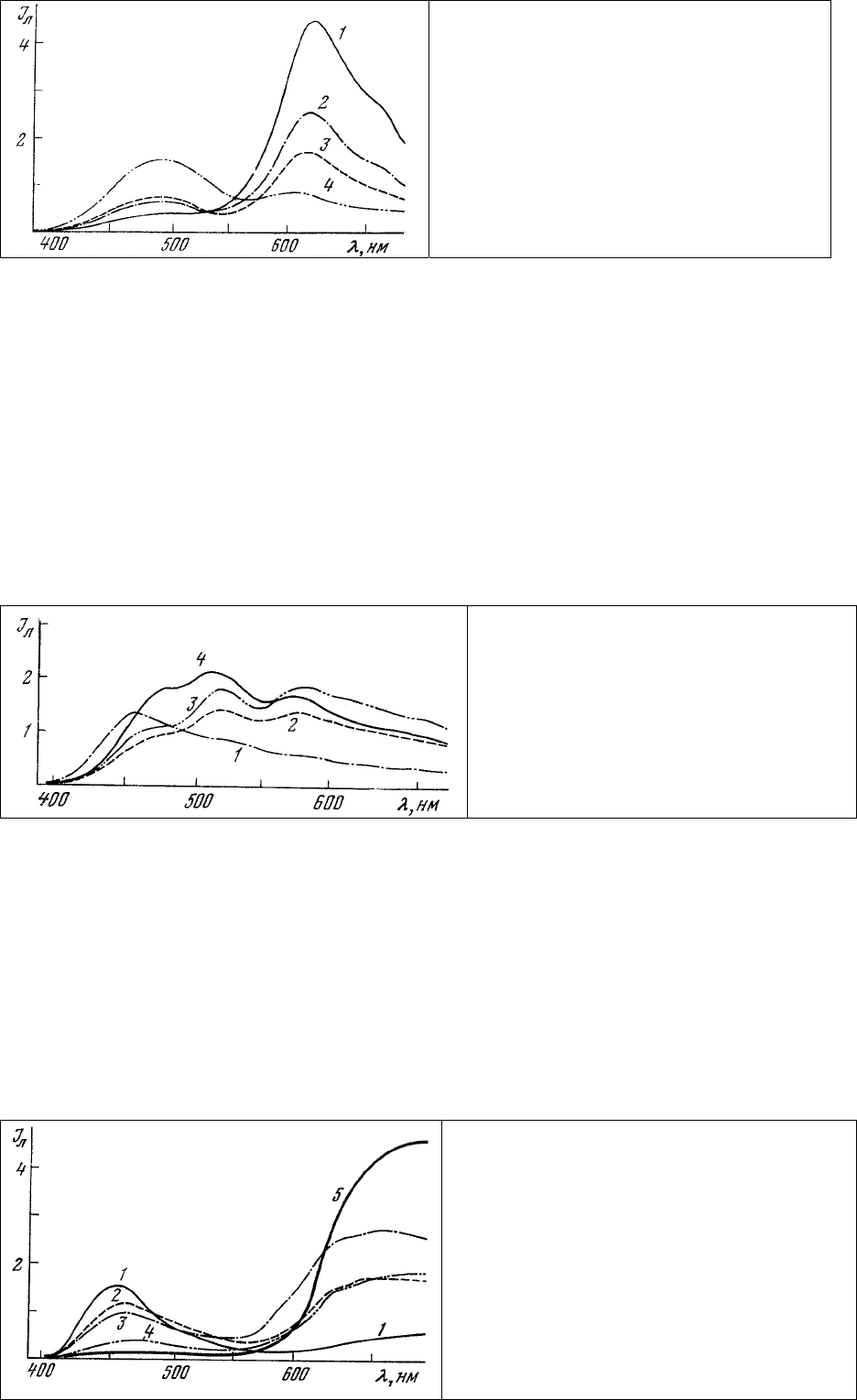
Рис. 59. Спектры люминесценции срезов
головного мозга крысы, обработанных
красителем “Stains all” (10
–4
М раствор в
этиловом спирте).
1 – зубчатая фасция гиппокампа; 2 –
мозолистое тело; 3 – кора (1-й и 2-й слои);
4 – кора (молекулярный слой).
Длина волны возбуждения 365 нм.
В качестве другого примера, еще недостаточно хорошо изученного метахроматического
люминесцентного красителя, может быть назван тиазиновый красный.
ТИАЗИНОВЫЙ КРАСНЫЙ
С
24
Н
15
N
3
O
7
S
3
Na
2
м.в.
599,59
Прежде всего, следует отметить, что он совершенно по-разному взаимодействует с живыми и
фиксированными клетками. При окрашивании срезов мозга, фиксированных по Карнуа, наблюдается
удовлетворительная по своей яркости метахроматическая люминесценция ткани (рис. 60),
характеризующаяся наличием трех полос излучения (454, 515, 580 нм), только одна из которых (454
нм) совпадает по положению с полосой люминесценции раствора (10
-3
М) тиазинового красного, в то
время как две другие (515 и 580 нм) появляются после взаимодействия красителя с объектом.
Рис. 60. Спектры люминесценции водного
раствора (10
–3
М) тиазинового красного
(1) и окрашенных им срезов головного
мозга крысы (2 – 4). Длина волны
возбуждения 365 нм.
Совсем иной вид спектра характерен для тиазинового красного после его взаимодействия с
живыми клетками (рис. 61). И в этом случае у препарата сохраняется имеющаяся у раствора (рис. 60,
1, 61, 1) полоса излучения 454 нм, а вместо характерных для фиксированных клеток полос 515 и 580
нм (рис. 60) появляются широкие неразрешенные полосы с максимумом в области 630-640 нм.
Соотношение интенсивностей полос люминесценции 454 и 630 нм зависит от функциональных
особенностей клетки (рис. 61, 3, 4). Однако, пожалуй, самым интересным свойством тиазинового
красного является способность окрашенных им клеток резко менять спектр люминесценции при их
гибели. Добавление к препарату нескольких капель этилового спирта вызывает гибель клетки и
сопровождается исчезновением полосы люминесценции 454 нм и увеличением
полосы
люминесценции с максимумом 670-680 нм (рис. 61, 2, 5). Механизм этого явления пока не ясен и
представляет интерес скорее для следующей, чем для данной главы.
Рис. 61. Спектры люминесценции водного
раствора тиазинового красного (10
–2
М) и
окрашенных им живых клеток рецептора
растяжения речного рака.
1 - раствор тиазинового красного; 2 –
приядерная область медленно
адаптирующегося нейрона; 3 – быстро
адаптирующаяся мышца; 4 – медленно
адаптирующаяся мышца; 5 – приядерная
область нейрона через 2 мин после добавки к
препарату 0,5 мл этилового спирта.
Длина волны возбуждения 365 нм.
Отсутствие метахроматических люминесцентных красителей, которые уже сейчас можно
было бы рекомендовать для определения в клетке соотношения различных компонентов ее обмена,
определяет другой путь решения той же задачи - поиск пары красителей-меток, специфически
связывающихся с изучаемыми компонентами клетки. При этом входящие в пару соединения должны
удовлетворять нескольким условиям.
1. Максимумы их спектров
люминесценции должны достаточно далеко (60-100 нм) отстоять
друг от друга для раздельной регистрации интенсивности люминесценции каждого из них.
2. Соотношение квантовых выходов должно быть таково, чтобы интенсивности
люминесценции обоих красителей в клетке были одного порядка.
3. Полосы поглощения обоих красителей в видимой области спектра должны совпадать или
быть близкими (20-30 нм) с тем,
чтобы уменьшить возможность миграции энергии возбуждения с
молекулы, люминесцирующей в коротковолновой области спектра, на молекулу, люминесценция
которой лежит в области более длинных волн.
4. Естественно, что оба красителя должны количественно связываться с макромолекулами -
объектами изучения.
На практике обычно выбирается один из компонентов пары и к нему в соответствии с
изложенными выше
требованиями подбирается второй компонент. Иллюстрацией такого подхода
может служить разработка ряда методов определения соотношения веществ в клетке, описываемых
ниже.
ДВУХВОЛНОВЫЕ МЕТОДЫ
Белки и нуклеиновые кислоты. В качестве метки на нуклеиновые кислоты может быть
использован люминесцентный краситель этидиум бромид.
ЭТИДИУМ БРОМИД
2,7-диамино-10-этил-9-фенилфенантридиум бромид
C
21
H
20
N
3
Br
м.в. 394,3
Строго говоря, этидиум бромид относится к разряду красителей с переменным квантовым
выходом, величина которого зависит от субстрата связывания и окружения. Однако, будучи связан с
макромолекулой, этидиум бромид имеет, по-видимому, постоянный квантовый выход. В растворах
квантовый выход люминесценции этидиум бромида крайне мал и потому интенсивность
люминесценции его слаба
. При связывании этидиум бромида с нуклеиновыми кислотами
наблюдается резкое увеличение квантового выхода [251-252], и структуры клетки, содержащие
нуклеиновые кислоты, приобретают яркую малиново-красную люминесценцию с максимумом
излучения 590-610 нм.
Специфичность эффекта увеличения интенсивности люминесценции этидиум бромида при
взаимодействии с нуклеиновыми кислотами крайне высока, о чем свидетельствуют приведенные
ниже данные [251]:
Нативная ДНК 100 28s-фракция РНК 46
ДНК, гидролизованная 17s-фракция РНК 46
ДНКазой 2 4s-фракция РНК 46
Гепарин 0,05 Дрожжевая РНК 46
Плазма крови (кролик) 0,01 РНК гидролизованная
Поли-L-глутаминовая РНК,азой 0,7
кислота 0 Хондриотин сульфат 0,07
dАМФ, dГМФ 0,03 Гиалуроновая кислота 0,1
dТМФ, dЦМФ 0
Общая РНК печени 46
Если взаимодействие с ДНК приводит к возрастанию люминесценции в 100 раз, а с РНК - в 46
раз, то изменение люминесцениии этого красителя при взаимодействии его с другими соединениями
незначительно или полностью отсутствует. Относительно высокий (2 и 0,7) эффект при добавлении
гидролизованных ДНК и РНК связан, по-видимому, с неполным гидролизом, так как эффект при
взаимодействии с основаниями либо полностью отсутствует (ТМФ, ЦМФ), либо очень мал (0,03 для
АМФ и ГМФ
).
Ввиду того, что интенсивность люминесценции этидиум бромида оказалась
