Карнаухов В.Н. Люминесцентный анализ клеток
Подождите немного. Документ загружается.

пропорциональной концентрации нуклеиновых кислот в препарате, было предложено использовать
его в качестве удобного и чувствительного реагента на нуклеиновые кислоты [251]. В дальнейшем на
основе применения этидиум бромида был разработан метод автоматического определения ДНК и
РНК [253]. Чувствительность люминесценции этидиум бромида к окружению послужила причиной
широкого применения его в молекулярной биологии для определения изменений
вторичной и
третичной структуры нуклеиновых кислот [59, 251-256].
Изучая взаимодействие этидиум бромида с живыми клетками, Бурнс установил [257], что
большая часть люминесценции (примерно 80%) этого красителя в клетке обязана своим
происхождением комплексам этидиум бромида с РНК и исчезает после обработки клеток РНКазой.
Остальная часть (20%) приходится, по-видимому, на комплексы с ДНК. Отмечается высокая
специфичность
взаимодействия именно с нуклеиновыми кислотами. Этидиум бромид был
использован также в качестве реактива Шиффа в люминесцентном варианте реакции Фельгена на
ДНК [258].
Поэтому использование этидиум бромида в качестве метки, количественно связывающейся с
нуклеиновыми кислотами (условие 4), представляется достаточно обоснованным. Спектр
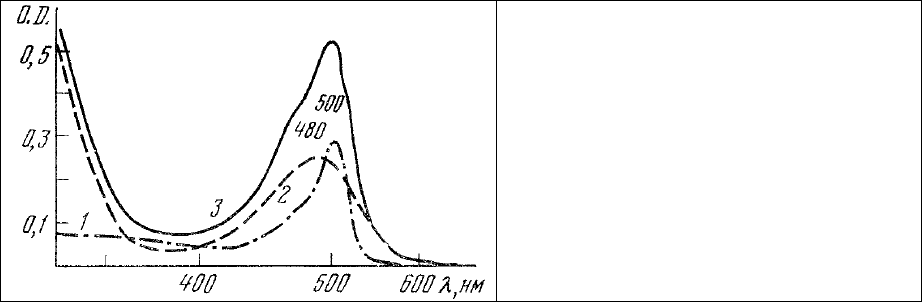
поглощения этого красителя приведен на рис. 62, 3 и имеет максимум в области 480 нм
. Максимум
люминесценции его находится в красной области спектра (590-610 нм).
Таким образом, учитывая спектральные характеристики метки нуклеиновых кислот,
необходимо подобрать в пару к ней метку для белка. По-видимому, наиболее удобными в этом
случае будут красители с люминесценцией в синей или зеленой области спектра.
В качестве такой метки для белка может
быть использован, например, активный [259]
проционовый краситель ДХТАФ [260, 261].
Рис. 62. Спектры поглощения водных
растворов.
1- ДХТАФ (10
–6
М); 2 – этидиум бромид
(5⋅10
–6
М); 3 – смесь ДХТАФ (10
–6
М) и
этидиум бромида (5⋅10
–6
М).
ДХТАФ
Дихлор-симм-триазиниламинофлуоресцеин-1
Мелкокристаллический порошок светло-
желтого цвета. Растворим в этиловом спирте и
водных растворах бикарбоната натрия,
двузамещенного фосфата натрия
м.в. 531,76
Предложенные В.Б. Ивановым [262] в качестве метки на белок проционовые красители были
изучены разными методами [263-266] и показано, что они количественно связываются с белком
(условие 4). Красители этого
типа состоят из двух частей: хромофора, определяющего спектральные
характеристики проциона, и реакционной группы, представляющей собой дихлортриазиновое
кольцо, атомы хлора которого в высокой степени реакционно активны. Было установлено [263], что
при рН 5,6 проционы реагируют с амино- и имино-группами белков, присоединяясь к ним
посредством ковалентной связи. При рН 8,0 они реагируют еще и
с гидроксильными группами
белков и углеводов. Связанный краситель не извлекается не, только спиртом, но и другими, более
сильными органическими растворителями, обесцвечивающими обычно препараты, окрашенные
кислотными и основными красителями [264].
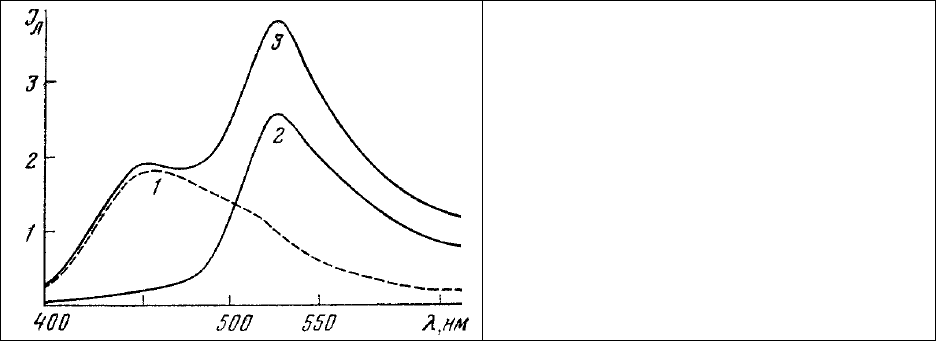
Спектр поглощения ДХТАФ в водном растворе бикарбоната натрия приведен на рис. 62, 3.
Он имеет максимум поглощения 500 нм и максимум люминесценции 527 нм (рис. 63). Таким
образом, расстояние между максимумами люминесценции ДХТАФ и этидиум бромида составляет
70-80 нм (условие 1).
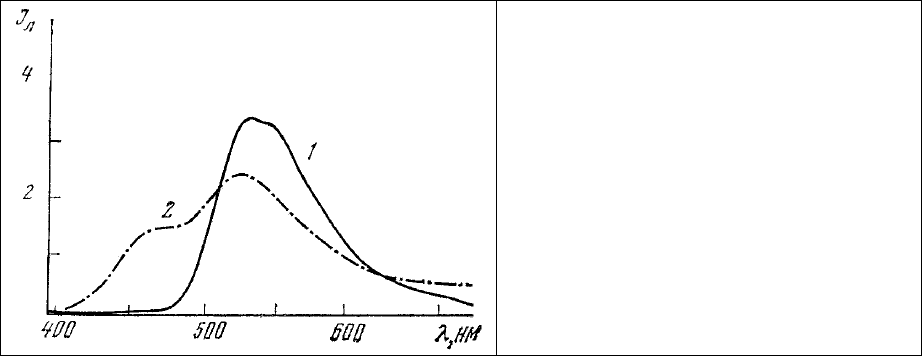
Рис. 63. Спектры люминесценции водного
раствора ДХТАФ.
1 – свежеприготовленный раствор; 2 –
после 2 суток хранения при комнатной
температуре.
Длина волны 365 нм.
Следует особо отметить, что водные растворы активных красителей, в том числе
проционовых, малостабильны, такие соединения достаточно быстро гидролизуются и распадаются на
две части - активную группу и хромофор. Поэтому водные растворы следует применять только в
свежеприготовленном виде. Целесообразно также производить спектральный контроль этих
растворов. Появляющийся при распаде проциона хромофор (например, флуоресцеин
в случае
ДХТАФ) имеет максимум люминесценции, отличающийся по положению в спектральном диапазоне
от максимума люминесценции, который он имел, входя в состав активного красителя (рис. 63). Это
обстоятельство может быть использовано для определения степени сохранности водного раствора
активного красителя. Спиртовые растворы могут храниться достаточно долго.
Что касается условия 3, то хотя формально оно и
выполнено, сопоставление спектров
поглощения (рис. 62) и спектров люминесценции (рис. 64) указывает на возможность реабсорбции
или некоторого гашения люминесценции ДХТАФ за счет поглощения ее длинноволновым склоном
широкой полосы поглощения этидиум бромида. Однако влияние этого эффекта, а также соответствие
избранной пары красителей требованиям условия 2 при экспериментальной проверке оказались
допустимыми.
Методика выбора времени окраски
и концентрации красителя применительно к объекту
исследования и задаче, подробно описанная выше, также применялась и в этом случае. Срезы (5 мкм)
головного мозга крысы (фиксация по Карнуа, заливка в парафин) окрашивали последовательно
спиртовым раствором ДХТАФ (10
-4
М) в течение 2 мин с последующей промывкой в
дистиллированной воде (2 мин). Срезы подвергали дополнительной окраске водным раствором
этидиум бромида (10
-5
М) в течение 2 мин с последующей промывкой в дистиллированной воде (1
мин).
Спектры люминесценции обработанного таким образом препарата содержат два максимума
излучения (рис. 64). Один из них (527-530 им), обязан своим происхождением ДХТАФ, связанному с
белком, в то время как другой (600-610 нм) - этидиум бромиду, находящемуся в комплексе с
нуклеиновыми кислотами. По-видимому, для
анализа результатов и в этом случае удобно
воспользоваться параметром β, представляющим собой отношение интенсивности люминесценции,
связанной с белками (527 нм), к таковой, отражающей содержание нуклеиновых кислот (610 нм). По
своему физиологическому смыслу параметр β представляет собой содержание белка в ткани или
клетке на единицу нуклеиновых кислот. Его увеличение свидетельствует об усилении синтетических
процессов
в клетке. В случае необходимости из величины параметра β можно определить
соотношение белков и нуклеиновых кислот, проведя соответствующую «калибровку» по результатам
биохимических исследований.
Однако во многих случаях на практике величина параметра β может быть использована
непосредственно для определения направленности изменений содержания белков в исследуемой
ткани. Например, при изучении процессов репарации
в головном мозге гиппокампэктомированных
крыс описанным выше методом с акридиновым оранжевым в зоне разрушения было установлено
увеличение параметра α, а, следовательно, отношения РНК/ДНК, что указывало на повышение
интенсивности процессов синтеза белков в этой области.
К аналогичным выводам приводит и анализ приведенных на рис. 64 спектров люминесценции
препаратов, подвергнутых двойной окраске на
белок (ДХТАФ) и нуклеиновые кислоты (этидиум
бромид). Неповрежденные участки гиппокампа характеризуются параметром β = 0,52 - 0,78 (рис. 64,
2, 3), в то время как в области разрушения, где идет интенсивный заместительный синтез, полоса
люминесценции связанного с белком ДХТАФ становится преобладающей в спектре и параметр β
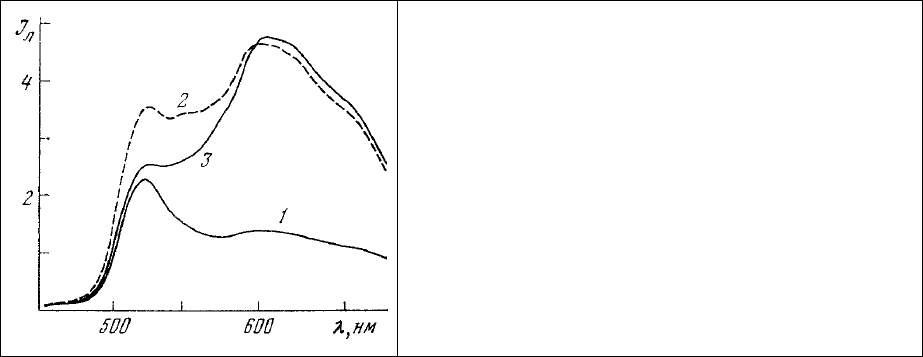
достигает значения 1,68.
Необходимо отметить, что общее понижение уровня кривой 1 (рис. 64) связано с
присутствием в поле зрения большого количества «пустых» участков, еще незаполненных
глиальными клетками. Однако применение двухволнового метода определения отношений
концентрации позволяет и в этом случае получить данные, не зависящие от степени заполненности
клетками поля зрения микроспектрофлуориметра.
Заканчивая этот раздел
, следует подчеркнуть, что описанная пара красителей не, является, по-
видимому, единственной, пригодной для этих целей и, возможно даже, что это не лучший вариант.
Исследователь может сам выбрать пары красителей, наиболее полно удовлетворяющих требованиям
поставленной им конкретной задачи. Например, в описанной паре ДХТАФ может быть заменен
флуоресцеинизотиоцианатом (ФИТЦ), имеющим спектры поглощения
и люминесценции, близкие к
таковым ДХТАФ. Связывание ФИТЦ с белком (условие 4) подробно изучено, так как этот краситель
— один из наиболее часто применяемых для метки антител [39].
Рис. 64. Спектры люминесценции различных
участков среза головного мозга
гиппокампэктомированной крысы, окрашенного
ДХТАФ (белок) и этидиум бромидом (нуклеиновые
кислоты).
1 – разрушенный участок гиппокампа; 2 – участок
гиппокампа вблизи зоны разрушения; 3 –
неразрушенный участок гиппокампа.
Длина волны 365 нм.
ФИТЦ
Флуоресцеинизотиоцианат I
Мелкокристаллический порошок
желтовато-оранжевого цвета, хорошо
растворим в водных растворах
бикарбоната натрия и двузамещенного
фосфата натрия
C
21
H
12
ClNO
5
S м.в. 425,85
При использовании же ДХТАФ в качестве люминесцентной метки на белок следует особенно
внимательно отнестись к выбору оптимального времени окраски препарата и концентрации
красителя. Это связано с интересной особенностью ДХТАФ, заключающейся в том, что
интенсивность люминесценции препарата достаточно быстро достигает плато насыщения и затем
резко падает. В результате увеличение
времени окраски приводит к резкому ослаблению
люминесценции препарата. Правильно окрашенный препарат обладает высокой устойчивостью к
возбуждающему люминесценцию излучению. Люминесценция препарата не уменьшается при
длительной промывке в воде.
Липиды: белки. В ряде случаев возникает необходимость изучения изменения концентрации
липидов по отношению к таким важнейшим компонентам структуры клетки, как белки и
нуклеиновые
кислоты. Естественно, что и для этой цели могут быть разработаны соответствующие
двухволновые методы измерения.
В основе гистохимии липидов лежит метод окрашивания их неполярными
жирорастворимыми красителями [32, 33]. Суть этого метода заключается в том, что неполярные
красители растворяются в жировых веществах клетки значительно лучше, чем в воде и водно-
спиртовых смесях, и поэтому
в процессе окраски ткани переходят из водно-спиртового раствора в
жировые включения препарата. Обычно при использовании методов абсорбционной микроскопии
(наблюдение в проходящем свете) применяются перенасыщенные растворы нафтоловых суданов в
50—70%-ном спирте (этанол, изопропанол и т.д.) [32, 33]. Столь высокая концентрация красителя и
довольно длительная окраска срезов не являются необходимыми при использовании
люминесцентной микроскопии, чувствительность которой примерно на 3 порядка выше
чувствительности абсорбционной микроскопии. При этом появляется возможность применения
весьма малых концентраций люминесцентного красителя-метки на жиры в окрашивающей жидкости,
что, в свою очередь, позволяет исключить в случае необходимости спирты из состава
окрашивающего раствора.
Наиболее хорошо изученным красителем-меткой на липиды является обладающий сильной
голубой люминесценцией 3,4-бензпирен, введенный в гистохимию Бергом [267].
3,4-БЕНЗПИРЕН
(бенз[а]пирен)
Слегка желтоватые игольчатые
кристаллы;
не растворим в воде; слабо растворим в
этиловом спирте; растворимость в насыщенном
водном растворе кофеина 0,00075%
Полное отсутствие полярных групп у этого ароматического канцерогенного соединения делает
его высоко специфическим красителем на липиды. Было изучено действие 3,4-бензпирена на клетки
при их прижизненном окрашивании [268-271] и показана низкая (по сравнению с красителями
акридинового
ряда) токсичность его. Применение 3,4-бензпирена вместе с акридиновым оранжевым
позволило Бревису [272] разработать метод одновременного люминесцентно-микроскопического
выявления липидов, ДНК и РНК в одной и той же клетке прижизненно и в срезах фиксированной
ткани. Метод нашел применение в ряде исследований [273-276].
Для приготовления водного раствора 3,4-бензпирена берут насыщенный раствор кофеина в
воде (75 мг
/10 мл) и добавляют в него 3,4-бензпирен из расчета 2 мг на 100 мл. Полученную смесь
выдерживают в термостате 20—24 ч при температуре 50° С и затем тщательно фильтруют, получая
таким образом готовый к употреблению водный раствор красителя.
При изучении срезов фиксированных препаратов может быть использован также и водно-
спиртовый раствор 3,4-бензпирена. Насыщенный раствор в
абсолютном этаноле (или изопропилене)
разбавляется дистиллированной водой в нужной пропорции (от 50 до 70%) и после энергичного
перемешивания фильтруется перед употреблением. Срезы, окрашенные в водно-спиртовом растворе,
требуют тщательной промывки, так как возможно выпадение мелких сильно люминесцирующих
кристаллов 3,4-бензпирена из остатков водно-спиртовой смеси при переносе препарата в воду для
промывки (рис. 65, 3).
Сопоставление спектров поглощения и люминесценции 3,4-бензпирена со
спектрами поглощения ДХТАФ, ФИТЦ и этидиум бромида указывает на возможность совместного
применения этих красителей при разработке двухволновых методов регистрации соотношения
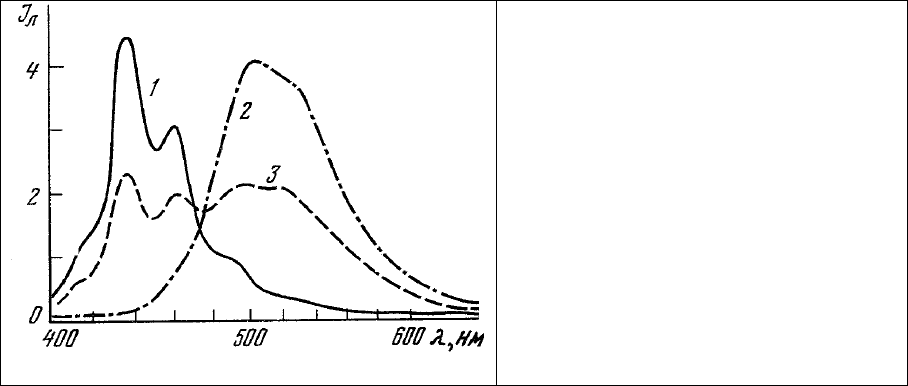
концентраций липиды: белки и липиды: нуклеиновые кислоты. Действительно, узкие линии
излучения 3,4-бензпирена (рис. 65) не перекрываются полностью ни с полосами поглощения ДХТАФ
и этидиум
бромида, ни с полосами их излучения.
Рис. 65. Спектры люминесценции 3,4-
бензпирена.
1 – бензольный раствор; 2 –
кристаллы; 3 – кристаллы в бензольном
растворе.
Длина волны возбуждения 365 нм.
Экспедиционный
микроспектрофлуориметр с
интерференционным светофильтром.
Пример реализации двухволнового метода определения соотношения концентраций липидов
и белков в клетке приведен на рис. 66. Срезы мозга крысы (фиксация Карнуа, заливка в парафин)
обрабатывали водным раствором 3,4-бензпирена в течение 5 мин (выход окраски на насыщение) и
промывали в течение 2 мин в дистиллированной воде. В результате этого липиды, оставшиеся в
препарате после фиксации
Карнуа, заливки в парафин и проводки по спиртам, приобретают яркую
голубую люминесценцию. Наиболее интенсивно люминесцируют стенки кровеносных сосудов и
область мозолистого тела, спектр которого приведен на рис. 66, 1.
Необходимо отметить, что 3,4-бензпирен можно полностью отмыть в 96%-ном этаноле, что
приводит к исчезновению голубой люминесценции срезов. Последующая окраска этого препарата
водным раствором 3,4-бензнирена позволяет вновь получить голубую люминесценцию его той же
интенсивности. Это указывает на строгую специфичность связывания (а вернее, растворения) 3,4-
бензпирена с липидами.
Рис. 66. Спектры
люминесценции одного и того же
участка среза головного мозга
крысы после окраски: 1 – 3,4-
бензпирен; 2 – 3,4-бензпирен и
ДХТАФ; 3 – 3,4-бензпирен и
этидиум бромид.
Длина волны возбуждения 365
нм.
Дополнительная обработка окрашенного таким образом препарата водным раствором
ДХТАФ в концентрации 10
-4
М в течение 2 мин с последующей промывкой в дистиллированной воде
приводит к появлению в спектре его люминесценции дополнительной полосы излучения ДХТАФ,
ковалентно связанного с белком (рис. 66, 2). Некоторое перекрытие люминесценции 3,4-бензпирена с
полосой поглощения ДХТАФ, а также, возможно, явление экранирования возбуждающего излучения
выражается в снижении интенсивности люминесценции 3,4-бензпирена примерно в 2
раза. Особенно
сильно этот эффект сказывается на линии излучения 3,4-бензпирена в 480 нм, совпадающей с
максимумом поглощения ДХТАФ, которая совершенно исчезает в спектре люминесценции препарата
с двойной окраской (рис. 66, 2). В наименьшей степени перекрытие спектра люминесценции 3,4-
бензпирена со спектром поглощения ДХТАФ сказывается, по-видимому, на линии излучения 3,4-
бензпирена в 430 нм.
С учетом
эффекта взаимного экранирования возбуждающего люминесценцию УФ-излучения
365 нм можно, по-видимому, по соотношению интенсивностей люминесценции в 430 и 517 нм
препарата, окрашенного двумя красителями: 3,4-бензпиреном и ДХТАФ, судить о соотношении в
нем концентрации липидов (430 нм) и белков (520 нм).
Разработка других модификаций такого двухволнового метода с использованием вместо
названных красителей (3,4-бензпирена и ДХТАФ
) других пар с иными соотношениями полос
поглощения и люминесценции и применение их для изучения того же препарата является, вероятно,
наиболее прямым методом учета возможных погрешностей, связанных с перекрытием спектров
поглощения и люминесценции красителей, входящих в состав пары. Другим методом определения
взаимного влияния красителей может служить регистрация спектра люминесценции того же
участка
клетки при измененной длине волны возбуждающего излучения. При этом по изменению
соотношения интенсивностей полос в спектре люминесценции может быть определена степень
взаимодействия красителей.
Если количество известных люминесцентных меток на белки с самыми разнообразными
спектрами поглощения и люминесценции достаточно велико, то относительно опробованных и
изученных люминесцентных меток на липиды этого сказать
нельзя, хотя число потенциальных меток
такого типа из разряда ароматических соединений может быть исключительно большим. Поиск и
исследование люминесцентных меток липидов является, по-видимому, одной из перспективных
задач цитохимии.
Использованный в описанных методах неполярный ароматический углеводород 3,4-бензпирен
как люминесцентная метка на липиды обладает только одним, но очень существенным недостатком
— высокой
канцерогенностью. По этой причине применение его в практике лабораторных
исследований не желательно. В качестве метки липидов может быть использован также хлорофилл,
обладающий интенсивной люминесценцией в красной области спектра.
Липиды: нуклеиновые кислоты. Не останавливаясь подробно на этом методе, аналогичном по
идее предыдущему, напомним, что соотношение полос поглощения и люминесценции 3,4-бензпирена
и
этидиум бромида таково, что позволяет использовать их для комплексной окраски препарата с
целью получения сведений о соотношении концентраций липидов и нуклеиновых кислот в
исследуемом участке клетки или ткани. В качестве примера реализации такого подхода на рис.66
приведен спектр люминесценции среза головного мозга крысы, обработанного вначале насыщенным
раствором 3,4-бензпирена в 70%-ном
этаноле (окраска - 3 мин, промывка 20 мин) и докрашенного
затем водным раствором этидиум бромида (10
-5
М, окраска 1 мин, промывка 1 мин). Длительная
промывка после обработки спиртовым раствором 3,4-бензпирена необходима для удаления
(механического) его ярко люминесцирующих кристаллов (рис.65) с поверхности среза.
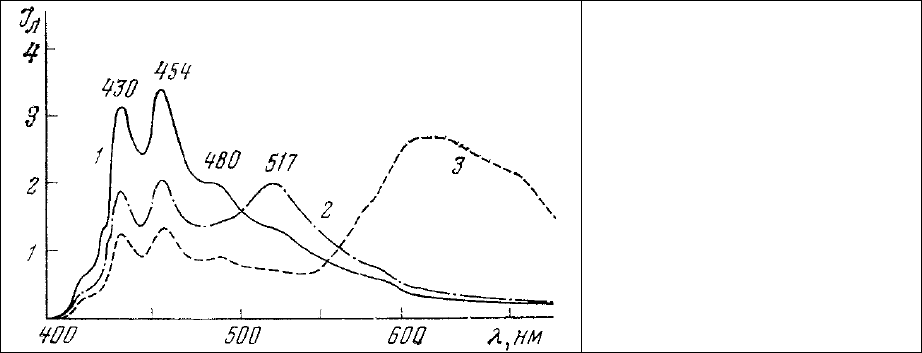
Спектр люминесценции окрашенного таким образом препарата (рис.66) содержит полосы
люминесценции растворенного в липидах бензпирена (430, 454, 480 нм) и этидиум бромида,
связанного с нуклеиновыми кислотами (620 нм). Соотношение интенсивностей люминесценции в
областях 430 и 620 нм может, по-видимому, быть использовано для определения соотношения в
изучаемом участке
клетки липидов и нуклеиновых кислот.
ТРЕХВОЛНОВЫЕ МЕТОДЫ
По своей сути эти методы аналогичны описанным выше двухволновым методам и отличаются
от них только несколько большей сложностью выбора комплекса красителей-меток и интерпретации
результатов. В то же время они несут больше информации, и развитие этих методов представляется
весьма заманчивым.
Определение соотношения липидов
, белков и нуклеиновых кислот. Рассмотрение
трехволновых методов имеет смысл начать именно с этого метода из соображений удобства
изложения, так как он состоит в комбинации только что описанных выше двухволновых методов
определения соотношений липиды : белки и липиды: нуклеиновые кислоты. При этом используются
те же люминесцентные красители-метки - 3,4-бензпирен, ДХТАФ и этидиум
бромид.
Данные о соотношении спектров поглощения и люминесценции этих меток и о
количественном связывании их с липидами, белками и нуклеиновыми кислотами также приведены
выше и нет необходимости повторять их еще раз.
Срезы головного мозга крысы обрабатывают вначале (6 мин) водным раствором 3,4-
бензпирена (или 70%-ным спиртовым раствором 3,4-бензпирена) и в течение 1 мин
докрашивают
затем этидиум бромидом (10
-5
М). В результате такой обработки срез приобретает люминесценцию,
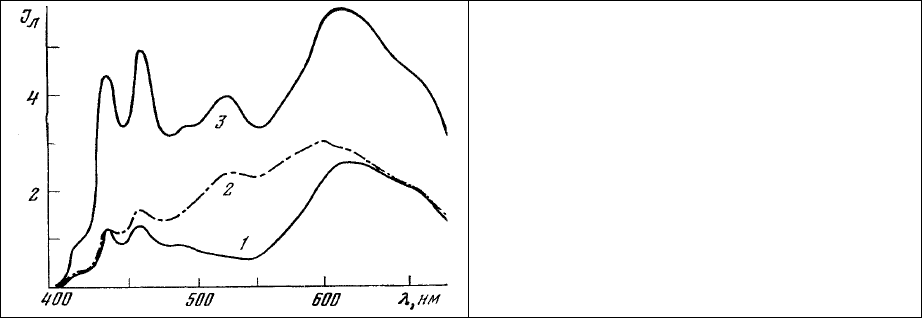
спектр которой представлен на рис.66, 3. Линии люминесценции растворенного в липидах 3,4-
бензпирена в голубой области (430, 450, 480 нм) и широкая полоса люминесценции связанного о
нуклеиновыми кислотами этидиум бромида (620 нм) составляют характерную особенность этого
спектра (рис. 67, 1).
Последующая обработка того же препарата водным раствором ДХТАФ (10
-4
М, время окраски
2 мин, промывка 2 мин) приводит к появлению в зеленой области описанного выше спектра
дополнительной полосы люминесценции (530 нм) ковалентно связанного с белками ДХТАФ (рис. 67,
2, 3). Необходимо при этом отметить, что соотношение интенсивностей люминесценции 3,4-
бензпирена, ДХТАФ и этидиум бромида различно для разных по своей структуре и функциям
участков головного мозга,
что отражает, по-видимому, разное соотношение концентраций липидов,
белков и нуклеиновых кислот в этих участках мозга.
Порядок окраски препарата может быть изменен таким образом, что после обработки 3,4-
бензпиреном следует окраска белков активным красителем (ДХТАФ или ФИТЦ), а затем —
обработка этидиум бромидом. Регистрируемые при этом результаты не отличаются от приведенных
выше.
Рис. 67. Спектры люминесценции участка
среза головного мозга крысы после окраски:
1 – 3,4-бензпирен и этидиум бромид;
2 – тот же участок после дополнительной
окраски ДХТАФ;
3 – другой участок того же препарата.
Определение соотношения липидов, ДНК (двухспиралъных) и РНК (односпиральных
нуклеиновых кислот). Этот метод основав на совместном применении 3,4-бензпирена и
акридинового оранжевого и был предложен впервые Бревисом [272]. Не останавливаясь подробно на
описании метода окраски препарата, рассмотрим получаемые таким методом результаты.
Срез мозга крысы обрабатывают водным раствором 3,4-бензпирена (окраска 6 мин, промывка
1 мин) с
последующей докраской акридиновым оранжевым 1:30 000 (рН 4,6; окраска 8 мин;
промывка 3 мин). В результате такой обработки срез приобретает полихроматическую
люминесценцию. Липидные включения имеют голубой цвет, ядра - зеленые, цитоплазматические
включения и ядрышки - красные. Соответственно этому в спектре люминесценции (рис. 68)
наблюдаются характерные линии излучения растворенного в липидах 3,4-бензпирена (430, 454 нм), а
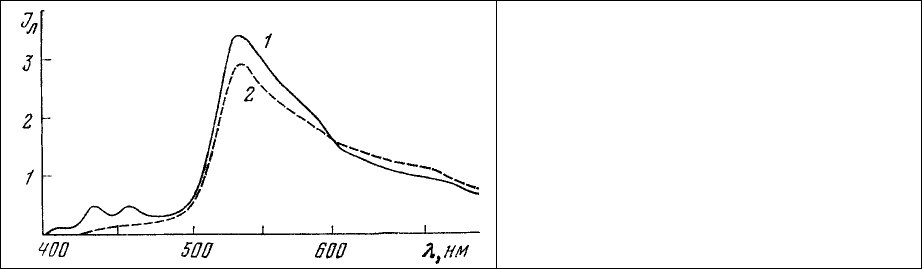
также полосы излучения мономеров (530 нм) и димеров (640 нм) акридинового оранжевого,
связанных с двухспиральными (ДНК) и односпиральными (РНК) нуклеиновыми кислотами.
Рис. 68. Спектры люминесценции участка
среза головного мозга крысы после
окраски: 1 – акридиновый оранжевый; 2 –
3,4-бензпирен и акридиновый оранжевый.
Определение соотношения белков, ДНК (двухспиральных), РНК (односпиралъных
нуклеиновых кислот). В качестве основного красителя при разработке этого метода [246, 247] был
использован акридиновый оранжевый, спектральные характеристики которого подробно описаны
выше. Поэтому для реализации идеи метода было необходимо в пару к акридиновому оранжевому
подобрать такую люминесцентную метку на белки, которая наиболее полно удовлетворяла бы
изложенным выше требованиям. Поиск метки проводился внутри класса активных красителей
проционового типа, аналогичных по своей структуре описанному выше ДХТАФ. С этой целью были
изучены спектральные характеристики проционовых красителей: алого GS, красного GS, ярко-
красного 8ВS, ярко-красного 5ВS, желтого 4RS, ярко-желтого GGS, ярко-оранжевого GS, ярко-
оранжевого 2RS, зеленого 2ВS, печатающего зеленого В и синего 3RS [277].
Спектры поглощения
этих красителей приведены на рис. 69 и 70, а спектры люминесценции наиболее ярко
люминесцирующих из них - на рис 69. Сравнение спектральных характеристик упомянутых
проционовых красителей и акридинового оранжевого показывает, что наиболее подходящим, хотя,
возможно, и не наилучшим, является проционовый печатающий зеленый В, максимум
люминесценции в первой полосе которого лежит в области 450 нм
.
При этом необходимо отметить, что полоса поглощения этого красителя в области 600—700
нм перекрывается частично с полосой люминесценции димеров акридинового оранжевого с
максимумом излучения 640 нм.
При обработке срезов нервных ганглиев брюхоногого моллюска Lymnaea stagnalis (фиксация
замораживанием с замещением или ФСУ (6:3:1), по В.Я. Бродскому [227]) вначале проционовым
печатающим зеленым В (водный раствор, 5⋅10
-4
г/мл, рН 5,6), а затем акридиновым оранжевым
(цитрат-фосфатный буфер; рН 4,1; 10
-4
М) возникает полихроматическая картина люминесценции
гигантских нейронов [247]. Места локализации белков (аксон, нейропиль) характеризуются голубым
свечением, в то время как область ядра, где расположены ДНК и белки, обладает голубовато-зеленой
люминесценцией. Малиновая люминесценция (смесь голубого и красного излучения) специфична
для областей цитоплазмы, богатых как белками, так и РНК (апикальный участок и аксонный
холмик).
Соответственно этому различные по своей структуре [278] и функциям участки гигантского
нейрона (рис. 71) обладают характерными спектрами люминесценции. Основной полосой в спектре
люминесценции аксона является полоса излучения печатающего зеленого В (450 нм), связанного с
белками. Слабая зеленая люминесценция в области 530 нм может быть обязана своим
происхождением комплексам мономеров акридинового оранжевого с цитоплазматической
ДНК и
двухспиральными участками РНК (рис. 71, в).
Область зелено-голубого свечения ядра нейрона демонстрирует наличие двух достаточно
интенсивных полос люминесценции (рис. 71), одна из которых принадлежит связанному с белком
печатающему зеленому В (450 нм). Наибольшей интенсивностью в этом участке клетки обладает
полоса люминесценции комплексов мономеров акридинового оранжевого (530 нм) с
двухспиральными нуклеиновыми кислотами (ДНК
).
Участки клетки, для которых характерна высокая скорость синтеза белков и развитая сеть
шероховатого эндоплазматического ретикулума (апикальный участок, аксонный холмик), имеют
ярко выраженный трехполосный спектр люминесценции (рис.71, а). Наибольшую интенсивность при
этом демонстрирует печатающий зеленый В (белки) и димерная форма акридинового оранжевого
(640 нм), связанная, по-видимому, с односпиральными нуклеиновыми кислотами (РНК
). Слабое
свечение в зеленой области спектра (530 нм) обязано своим происхождением комплексам мономеров
акридинового оранжевого с двухспиральными участками рибосомальной РНК, цитоплазматической
(в том числе - митохондриальной) ДНК.
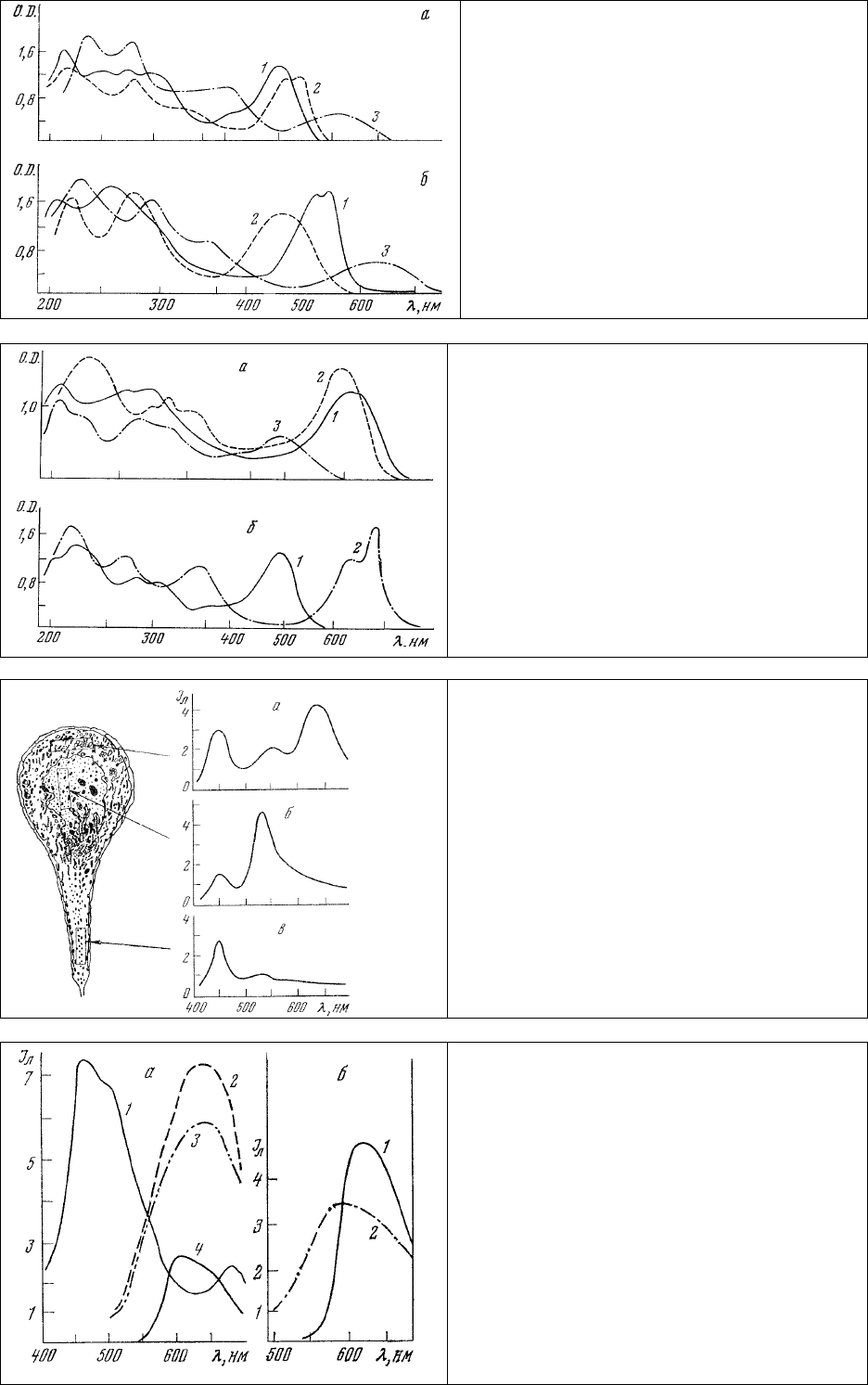
Рис. 69. Спектры поглощения растворов
проционовых красителей в концентрации
5⋅10
-4
г/мл [277]. а: 1 – алый GS, 2 – ярко-
красный 8BS, 3 – зеленый 2BS; б: 1 – синий
3PS, 2 – желтый, 3 – ярко-красный 4RS 5BS.
Рис. 70. Спектры поглощения растворов
проционовых красителей в концентрации
5⋅10
-4
г/мл [277]. а: 1 – красный GS, 2 – ярко-
оранжевый GS, 3 – ярко-желтый G GS; б: 1 –
ярко-оранжевый 2RS, 2 – печатающий
зеленый B.
Рис. 71. Спектры люминесценции различных
участков гигантского нейрона моллюска
Lymnaea stagnalis, окрашенного
проционовым красителем печатающим
зеленым В и акридиновым оранжевым.
а – апикальный участок; б – ядро; в –
проксимальный участок.
Длина волны возбуждения 365 нм.
Рис 72. Спектры люминесценции растворов
проционовых красителей [277].
а: 1 – печатающий зеленый В, 2 – ярко-
оранжевый 2RS, 3 – ярко-оранжевый GS, 4 –
красный - GS; б: 1 – ярко-красный 8ВS, 2 –
желтый 4RS.
Длина волны возбуждения 365 нм.
Приведенные на рис. 72 спектральные характеристики достаточно хорошо согласуются с
полученными разнообразными методами сведениями относительно соотношения белков, ДНК и РНК
в гигантских нейронах моллюсков. Однако необходимо отметить, что комплект использованных в
этом методе красителей (печатающий зеленый В и акридиновый оранжевый), по-видимому, не
является иаилучшим и описание метода приведено здесь скорее
для иллюстрации возможностей,
связанных с новым аспектом применения хорошо известных люминесцентных красителей.
Поиск люминесцирующих в голубой области спектра меток на белки следует, вероятно, в
первую очередь производить среди так называемых оптических отбеливателей. Эти новые в бытовой
химии вещества [279] выполняют свое назначение благодаря способности к интенсивной
люминесценции в голубой области спектра.
Вместе с тем к ним предъявляются требования высокой
стабильности и способности прочно связываться с тканями, в том числе шелковыми и шерстяными.
3.3. Анализ спектральных характеристик
Обсуждение задач, для решения которых двух- и трехволновые методы регистрации являются
наиболее удобными, можно было бы продолжить, включив такие вопросы, как, например,
определение соотношения живых и мертвых клеток, грампопожительных и грамотрицательных
микроорганизмов, специфичность и неспецифичность связывания антител, меченных разными по
цвету люминесценции соединениями и т.д.
Существует, тем не менее,
один методический вопрос, который, хотя бы кратко, должен быть
рассмотрен здесь. Речь идет об определении соотношения интенсивностей полос люминесценции
отдельных красителей в суммарном спектре люминесценции препарата. С возникающими при этом
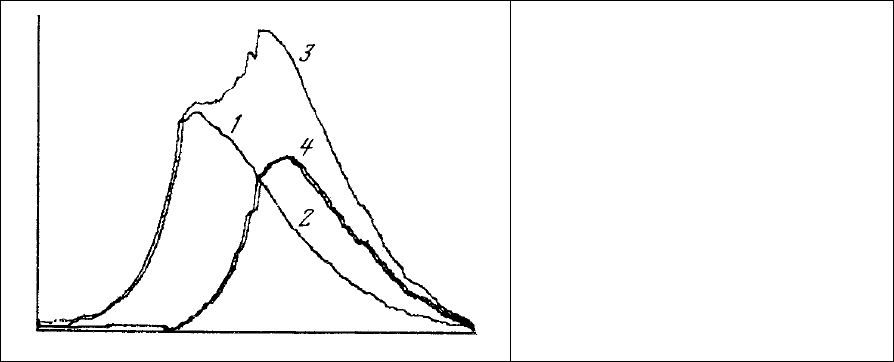
затруднениями мы сталкивались и в предыдущей главе (см. рис. 31). Их можно проиллюстрировать
рис.73, где приведены спектры люминесценции двух красителей и суммарный
спектр их смеси. Если,
например, определять отношение интенсивности люминесценции в 530 нм (максимум кривой 2) к
таковой в длине волны 450 нм (максимум кривой 1), измеряя амплитуды в соответствующих (530 и
450 нм) длинах волн регистрируемого суммарного спектра (рис. 73, 3), будет получена ошибочная
величина этого отношения, равная 2,1. В то же время истинная величина этого
отношения,
определяемая по амплитудам парциальных спектров люминесценции красителей (рис. 73, 1, 2), равна
1,5.
Рис. 73. Суммарный (3) спектр
люминесценции смеси двух красителей (1, 2).
Причиной такой ошибки является то, что суммарный спектр образуется сложением
парциальных спектров. При этом обычно спектры люминесценции красителей представляют собой
относительно широкие полосы асимметричной формы с достаточно резким подъемом в
коротковолновой (относительно максимума) области и медленным плавным спадом в
длинноволновой области спектра. При аддитивном сложении таких парциальных спектров это
обстоятельство
приводит к тому, что длинноволновый спад полосы излучения красителя, максимум
которого расположен в более коротковолновой (по сравнению со вторым красителем) области,
«приподнимает» полосу излучения красителя с более длинноволновым максимумом, как это видно на
примере влияния полосы красителя (1) на амплитуду полосы красителя (2) в их суммарном спектре
(3). В то
же время благодаря резкому спаду коротковолновой части полосы излучения красителя (2)
ее присутствие в суммарном спектре мало влияет на амплитуду люминесценции красителя (1) с
максимумом в более коротковолновой области спектра.
В ряде случаев, когда максимумы люминесценции отстоят достаточно далеко один от другого
(например, 3,4-бензпирен и этидиум бромид, рис. 66), или в случае красителей с линейчатым
спектром взаимным влиянием полос люминесценции красителей можно пренебречь. Однако в
большинстве случаев этот эффект необходимо учитывать. Простейший способ учета вклада
соседних
полос люминесценции в интенсивность излучения в максимуме одного из красителей в суммарном
спектре был описан ранее (рис. 31) и состоит в предварительном нормировании спектра
люминесценции красителя (1). Тогда, измерив его амплитуду в максимуме, можно всегда определить
и интенсивность люминесценции этого красителя в длине волны, совпадающей с максимумом
люминесценции красителя (2). Вычитая
определенный таким образом вклад красителя (1) из общей
интенсивности люминесценции в максимуме красителя (2), получают истинную интенсивность
люминесценции красителя, используемую затем для вычисления безразмерного параметра (ξ, α, β и
т.д.), характеризующего соотношение тех или иных веществ в клетке.
При большом объеме данных перспективным является применение вычислительной техники
для автоматизации
этой процедуры. Информация может вводиться в УЦВМ в виде магнитной записи
[280], перфоленты [281] или непосредственно в графической форме с бланка самописца. В память
машины вводятся также парциальные спектры люминесценции красителей. По соответствующим
алгоритмам УЦВМ производит разбиение суммарных спектров люминесценции препарата на
парциальные спектры соединений, использованных для его окраски.
Например, с помощью
спектрочитающего устройства в УЦВМ «Раздан-2» были введены с
бланка самописца парциальные спектры люминесценции, моделирующие характеристики мышечной
клетки (рис. 30; рис. 74, 1, 2). По требованию оператора в соответствии с алгоритмом УЦВМ
произвела сложение этих спектров (рис. 74, 3), а затем из суммарного спектра вычла один из
составляющих компонентов (рис. 74, 1) и в результате получила, как
это и должно быть, кривую 4
(рис. 74), практически совпадающую по форме и амплитуде с исходным спектром (рис. 74, 2).
Рис. 74. Сложение (3) и вычитание (4)
двух спектров (1, 2) с помощью
УЦВМ.
Трудоемкость анализа при использовании ЦВМ может быть значительно снижена, если
помимо записи спектров в графической форме на самописце будет параллельно производиться запись
той же информации в цифровой форме на магнитный носитель или на перфоленту [281].
Другой подход к решению этой задачи заключается в использовании специализированных
аналоговых вычислительных машин, позволяющих синтезировать суммарный
спектр из отдельных
полос, меняя их форму, амплитуду и положение в спектральном диапазоне. Примером реализации
такого подхода может служить разработанный в Институте белка АН СССР и выпускаемый СКБ БП
АН СССР прибор СК-2 [282].
Подбирая амплитуду и форму составляющих суммарный спектр полос излучения (до 7
отдельных полос) с максимумами, расположенными в известных длинах
волны, исследователь может
синтезировать суммарный спектр, совпадающий с полученным в эксперименте, и таким образом
определить парциальные составляющие анализируемого спектра (рис. 75). Преимуществом такого
способа является то, что в этом случае отпадает необходимость в трудоемкой операции
перекодировки исходных данных из аналоговой формы в цифровую и обратно. Имея в виду
возможность использования этого
прибора не только для полуавтоматического анализа оптических
спектров, но и для обработки спектров ЯМР, ЭПР, хроматографических кривых и т. д., можно
предполагать, что такого типа системы обработки данных будут иметь широкое распространение.
