Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

элементов левой части периода (от лития до азота), а последовательность (5-16) для элементов правой части
периода (от кислорода до неона).
Распределение электронов в молекулах типа А
2
для элементов второго периода показано в табл. 15 и 16.
Как следует из приведенных в этих таблицах данных, только бериллий и неон не могут образовывать
двухатомные молекулы (кратность связи равна нулю). С увеличением кратности связи весьма четко
прослеживается увеличение энергии связи и уменьшение межъядерных расстояний в молекулах. Так,
максимальная энергия связи (940 кДж/моль) и минимальная длина связи (110 пм) отвечают молекуле N
2
, для
которой кратность связи равна 3. У всех остальных молекул А
2
кратность связи меньше трех.
Метод МО весьма убедительно объясняет парамагнетизм молекул кислорода: в молекуле О
2
два электрона,
занимающие вырожденные
x
р
- и
z
p
-орбитали, остаются неспаренными. Парамагнитной должна быть и молекула
В
2
, что подтверждается экспериментальными данными.
Каждой из молекул А
2
отвечает определенная электронная формула. Например, молекуле N
2
отвечает
конфигурация (
s
св
)
2
(
s
p
)
2
(
x,y
св
)
4
(
z
св
)
2
, молекуле О
2
- конфигурация (
s
св
)
2
(
s
p
)
2
(
x,y
св
)
4
(
x
p
)
1
(
y
p
)
1
.
Таблица 15.
Двухатомные гомоядерные молекулы элементов второго периода
(литий - азот)
Распределение
электронов
Молекула
Li
2
Be
2
B
2
C
2
N
2
z
p
x
p
,
y
p
z
св
x
св
,
y
св
s
p
s
св
Кратность
связи
1 0 1 2 3
Энергия связи,
кДж/моль
105 - 288 627 942
Длина связи,
пм
267 - 159 131 110
Магнитные
свойства
Д - П Д Д
Аналогично могут быть рассмотрены в рамках метода МО молекулярные ионы типа А
2
z
. В этом случае
метод МО позволяет судить о закономерностях изменения энергии связи, длины связи и магнитных свойств в
совокупностях подобных молекулярных частиц. Пусть, например, требуется установить, однотипно ли меняются
энергии и длины связей в молекулярных частицах А
2
+
, А
2
и А
2
-
для углерода и кислорода. Распределение
электронов по молекулярным орбиталям приводит к выводу, что в ряду С
2
+
, С
2
и С
2
-
кратность связи растет,
принимая значения 1.5, 2.0 и 2.5; можно предположить, что в этом ряду энергия связи будет возрастать, а длина
связи уменьшаться.
Таблица 16.
Двухатомные гомоядерные молекулы элементов второго периода
(кислород - неон)
Молекула O
2
F
2
Ne
2
Распределение
электронов
z
p
x
p
,
y
p
x
св
,
y
св
z
св
s
p
s
св
Кратность
связи
2 1 0
71

Энергия связи,
кДж/моль
494 155 -
Длина связи,
м
121 142 -
Магнитные
свойства
П Д -
В ряду О
2
+
, О
2
, О
2
-
кратность связи убывает (2.5, 2.0 и 1.5). Для частиц этого ряда следует ожидать
последовательного уменьшения энергии связи и увеличения межъядерных расстояний. Экспериментально
определенные значения Е
св
и d
А-А
, приведенные в табл. 17, подтверждают, что длины связей и энергии связей в
рассматриваемых рядах изменяются именно так. Заметим, что метод валентных связей не позволяет решать
подобные задачи.
Таблица 17.
Энергия и длина связи в молекулярных частицах А
2
+
, А
2
и А
2
-
для углерода и
кислорода
А
2
z
КС Е
св
, кДж/моль d
А-А
, пм
С
2
+
1.5 528 146
С
2
2.0 627 131
С
2
-
2.5 783 127
О
2
+
2.5 643 112
О
2
2.0 494 121
О
2
-
1.5 394 134
Двухатомные гетероядерные молекулы
Двухатомные гетероядерные молекулы типа АВ можно подразделить на две группы, отнеся к первой из них
частицы, построенные из атомов элементов одного периода, а ко второй - из атомов элементов разных
периодов.
Если элементы А и В принадлежат одному периоду, то для описания частиц АВ можно использовать набор
молекулярных орбиталей, построенных для гомоядерных частиц А
2
. Однако в этом случае вклады атомов А и В в
связывающие и разрыхляющие орбитали не будут одинаковы: атом, имеющий большую
электроотрицательность, вносит больший вклад в связывающие МО, атомом с меньшей
электроотрицательностью - в разрыхляющие МО. В результате коэффициенты с
1
, с
2
, с
3
и с
4
в уравнениях (5-13) и
(5-14) не могут быть равны. Если
А
<
В
, то с
2
будет больше с
1
, а с
3
будет больше с
4
. Соответственно граничные
поверхности молекулярных орбиталей перестанут быть симметричными: электронная плотность, отвечающая
"связывающим" электронам будет смещена к атому с большей электроотрицательностью, тогда как вероятность
нахождения "разрыхляющих" электронов будет выше вблизи атома с меньшей электроотрицательностью. В
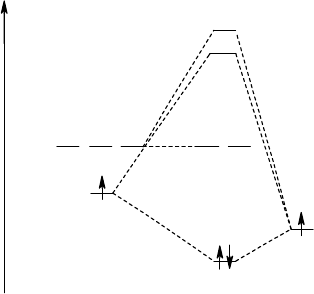
качестве примера на рис. 24 приведены граничные поверхности
z
-орбиталей для подобных молекул (сравни с
рис. 21).
А В
А В
z
z
z
z
р
св
+
+
+
-
-
-
-
Рис. 24.
z
св
- и
z
р
-орбитали молекулы АВ (
А
<
В
)
Применение метода МО к молекулам типа АВ позволяет объяснить некоторые свойства последних, не
находящие объяснения в рамках метода ВС. Так, например, в молекуле оксида углерода(II), согласно методу ВС,
имеет место образования тройной связи, причем одна из -связей образуется по донорно-акцепторному
механизму за счет неподеленной электронной пары кислорода (раздел 5.2.4). Можно ожидать, что молекула СО
будет полярной с отрицательным зарядом на углероде. В действительности же полярность данной молекулы
очень мала и составляет 0,410
-30
Клм. Метод МО объясняет данное явление достаточно убедительно.
Молекула СО изоэлектронна молекуле N
2
и отвечает электронной формуле (
s
св
)
2
(
s
p
)
2
(
x,y
св
)
4
(
z
св
)
2
,
соответственно которой 8 из 10 валентных электронов находятся на связывающих орбиталях. Поскольку
электроотрицательность кислорода больше электроотрицательности углерода, электроны связывающих
орбиталей преимущественно находятся возле атома кислорода, в результате чего перетекание электронной
плотности от кислороду к углероду не наблюдается.
72
Если атомы А и В принадлежат к разным периодам, то построение МО для молекул АВ усложняется; такая
задача может быть решена строго лишь при использовании довольно сложного математического аппарата.
Однако в ряде случаев можно удовлетвориться качественной стороной вопроса.
Рассмотрим в качестве примера строение молекулы газообразного гидрида лития LiH. Атомный базис для
такой молекулы будет включать 5 атомных орбиталей (1s от водорода, 2s, 2p
z
, 2p
x
и 2p
y
от лития). Набор
молекулярных орбиталей для молекулы LiH должен таким образом состоять из пяти МО. Если ядра атомов
расположить на оси z, то 1s-орбиталь атома водорода перекрывается с 2s- и 2p
z
-орбиталями атома лития.
Перекрывание 2p
x
- и 2p
y
- орбиталей с 1s-орбиталью атома водорода является нулевым (см. рис. 6,в), в
результате чего орбитали 2p
x
и 2p
y
перейдут в молекулу гидрида лития как несвязывающие
x
нс
и
y
нс
молекулярные орбитали. Комбинирование перекрывающихся орбиталей с учетом энергетической близости 2s- и
2p-подуровней для лития приводит к следующим МО:
s
св
= 2s + 2p
z
+ 1s
s
р
= 2s - 1s
z
р
= 2p
z
- 1s
Читателю предлагается самостоятельно определить форму соответствующих МО. Энергетическая
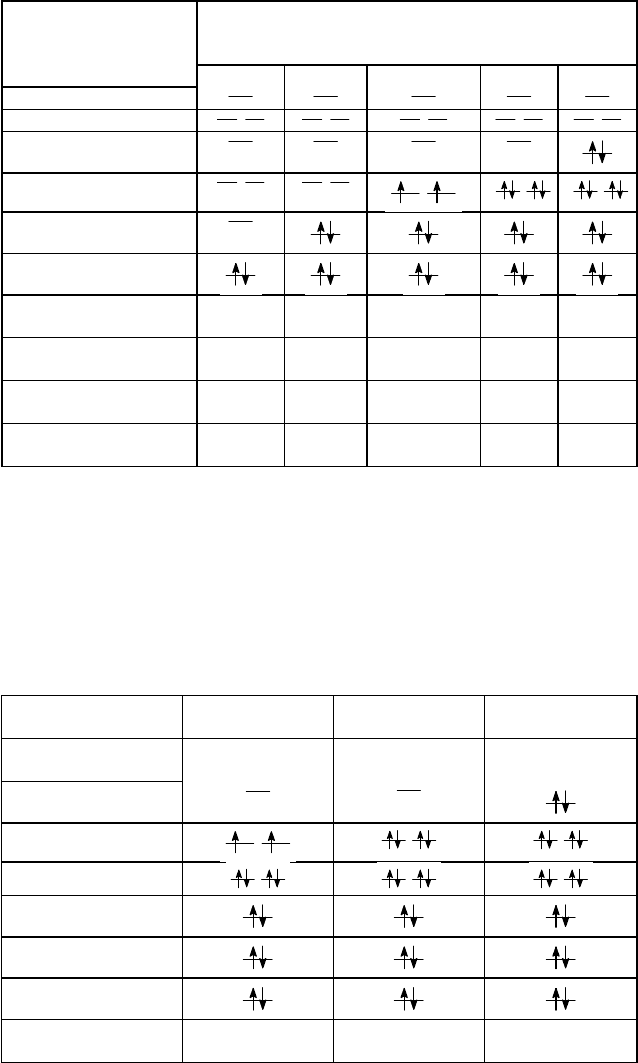
диаграмма для МО молекулы гидрида лития приведена на рис. 25. Число валентных электронов в
рассматриваемой молекуле равно двум, что приводит к электронной формуле (
св
)
2
для гидрида лития.
Поскольку электроотрицательность водорода выше электроотрицательности лития, можно ожидать, что
молекула LiH будет полярной. Экспериментальные данные подтверждают это предположение.
2s
2p
x
2p
y
2p
z
AO
Li
AO
H
св
р
р
нс
нс
z
s
x
y
E
Рис. 25. Энергетическая диаграмма молекулярных орбиталей молекулы гидрида лития - LiH
5.3.2.2. Молекулы, состоящие из трех и более атомов.
Одной из простейших трехатомных молекул является молекула гидрида бериллия. Применим метод МО для
описания ее строения. Пусть ядра атомов Be, H
a
и H
b
лежат на оси z, которая для атомов бериллия и Н
а
направлена слева направо, для H
b
- справа налево. Атомный базис для конструирования МО в данном случае
будет включать 6 АО (2s, 2p
x
, 2p
y
и 2p
z
от атома бериллия, 1s
a
и 1s
b
от двух атомов водорода). При этом 1s-
орбитали атомов водорода будут перекрываться как с 2s-, так и с 2p
z
-орбиталями бериллия, тогда как орбитали
2p
x
и 2p
y
перейдут в молекулу как несвязывающие орбитали
х
нс
,
y
нс
. Из орбиталей 2s, 2p
z
, 1s
a
и 1s
b
могут
быть построены следующие МО:
s
св
= 2s + 1s
a
+ 1s
b
s
p
= 2s - 1s
a
- 1s
b
z
св
= 2p
x
- 1s
a
+ 1s
b
z
р
= 2p
z
+ 1s
a
- 1s
b
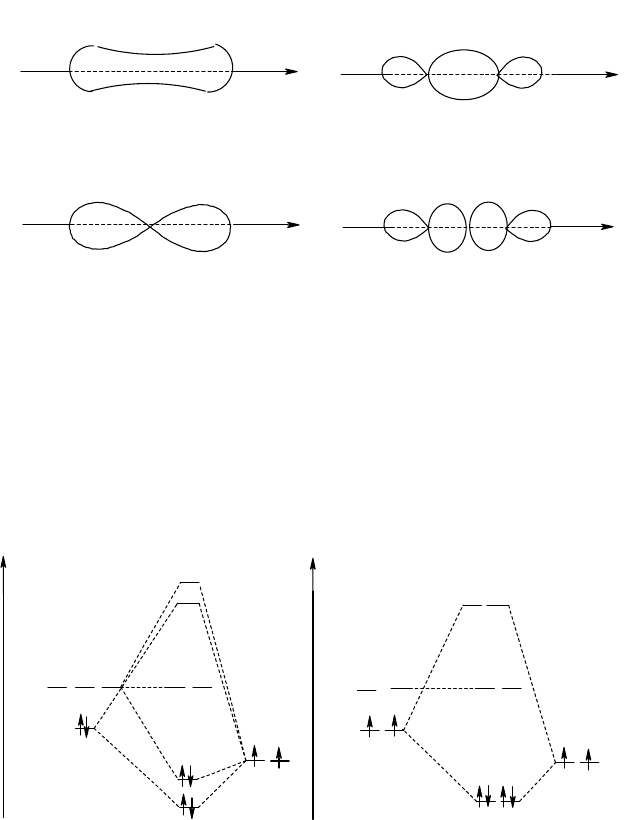
Граничные поверхности и энергетическая диаграмма полученных молекулярных орбиталей ВеН
2
приведены
на рис. 26 и 27,а. Распределение четырех валентных электронов на связывающих МО приводит к электронной
формуле (
s
св
)
2
(
z
св
)
2
, подтверждающей возможность существования молекулы ВеН
2
.
73
.
.
.
.
.
.
.
.
.
.
.
.
+
+
+
-
-
+
-
-
-
+
+
H
a
Be H
b
H
a
Be H
b
H
a
Be H
b
H
a
Be H
b
св
св
р
р
s
s
z
z
z
z
z
z
Рис. 26. Граничные поверхности связывающий и разрыхляющих орбиталей
молекулы гидрида бериллия - BeH
2
В ряде случаев при конструировании МО используют не "чистые", а гибридные атомные орбитали, что
обычно упрощает задачу; тип гибридизации и форма молекулы при этом могут быть установлены по методу
Гиллеспи (раздел 5.2.6.). Так для молекулы ВеН
2
имеет место sp
z
-гибридизация; комбинирование двух sp-
гибридных орбиталей Ве с 1s-орбиталями атомов водорода приводит к образованию двух одинаковых
sp
св
и двух
sp
p
орбиталей (рис. 27,б). Валентные электроны занимают связывающие МО, в результате чего молекуле ВеН
2
отвечает электронная формула (
sp
св
)
4
. Такой подход хорошо объясняет равноценность связей в молекуле
гидрида бериллия.
2s
2p
AO
Be
AO
H
св
р
р
нс
нс
z
s
x y
E
св
s
z
sp
2p
AO
Be
AO
H
св
р
нс
нс
sp
x
y
E
sp
Рис. 27. Энергетическая диаграмма молекулярных орбиталей молекулы гидрида бериллия - BeH
2
(а - без учета
гибридизации, б - с учетом sp-гибридизации)
Используем рассматриваемый прием для описания четырехатомной молекулы аммиака, атом азота которой
подвергается sp
3
-гибридизации, что обуславливает пирамидальную форму молекулы этого соединения. Пусть
координатные оси z атомов водорода направлены по линиям связи NH от водорода к азоту, что обеспечивает
максимальное перекрывание их с sp
3
-гибридными орбиталями атома азота. Атомный базис в этом случае будет
включать четыре АО от азота и три АО от трех атомов водорода (Н
а
, Н
b
и Н
с
). Из орбиталей атомного базиса
следует сконструировать 7 МО. Комбинирование трех sp
3
-гибридов азота с 1s-орбиталями атома водорода дает
три связывающие и три разрыхляющие орбитали с уравнениями волновых функций типа:
sp
3 = sp
3
1s
i
; (i-a,b,c)
Четвертый sp
3
-гибрид с орбиталями атома водорода не перекрывается и переходит в молекулу как
несвязывающая молекулярная орбиталь. Энергетическая диаграмма молекулы NH
3
и распределение на ней
электронов показаны на рис. 28.
В пятиатомной молекуле метана атом углерода также подвержен sp
3
-гибридазации. В этом случае все
гибридные орбитали принимают участие в образовании молекулярных орбиталей типа sp
3
1s (четырех
связывающих и четырех разрыхляющих). Восемь валентных электронов молекулы метана занимают все
связывающие орбитали (рис. 29).
Метод молекулярных орбиталей позволяет объяснить существование соединений, в которых атом водорода
связан с двумя атомами других элементов равноценными связями. Примером подобных частиц может служить
дифторогидрогенат-анион - HF
2
-
, линейный симметричный ион с одинаковыми межъядерными расстояниями F-H
(113 пм). Существование такой частицы можно объяснить, предположив в ней образование трехцентровых
молекулярных орбиталей из 1s-орбитали атома водорода и двух 2p
z
-орбиталей атома F
a
и F
b
.
74
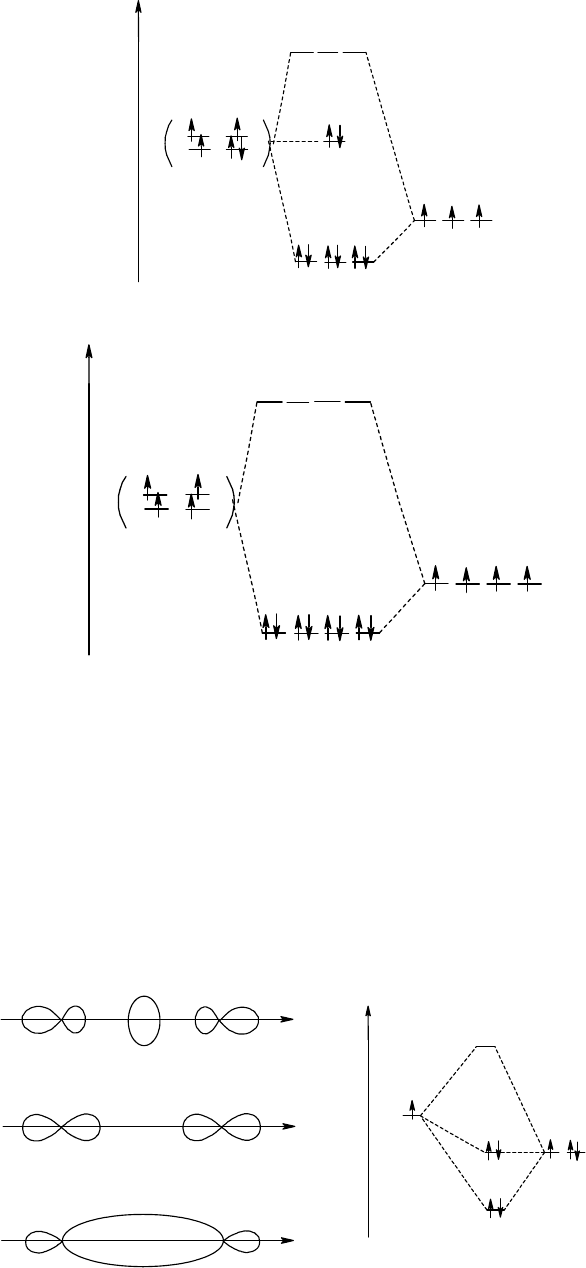
sp
3
AO
N
AO
H
св
E
sp
3
нс
sp
3
р
sp
3
Рис. 28. Энергетическая диаграмма молекулы аммиака - NH
3
sp
3
AO
C
AO
H
св
E
sp
3
р
sp
3
Рис. 29. Энергетическая диаграмма молекулы метана - СН
4
В уравнения молекулярных орбиталей атомные орбитали 2p
za
и 2p
zb
могут входить в виде комбинаций 2p
za
2p
zb
. Комбинация 2p
za
+ 2p
zb
с 1s-орбиталью атома водорода дает связывающую орбиталь
св
= 1s + (2p
za
+ 2p
zb
)
и разрыхляющую орбиталь
p
= 1s - (2p
za
+ 2p
zb
)
Комбинация 2p
za
- 2p
zb
с орбиталью 1s не перекрывается и переходит в HF
2
-
как несвязывающая орбиталь
нс
= 2p
za
- 2p
zb
Граничные поверхности сконструированных МО и энергетическая диаграмма иона HF
2
-
приведены на рис. 30;
валентные электроны заполняют
св
и
нс
-орбитали, что обеспечивает довольно высокую энергию связей F-H в
дигидрогидрогенат-ионе (114,6 кДж/моль).
AO
F
AO
H
св
E
р
нс
= 1s + (2p
za
+ 2p
zb
)
св
= 2p
za
- 2p
zb
нс
= 1s - (2p
za
+ 2p
zb
)
р
+
+
+
+
+
+
-
-
-
-
-
-
Рис. 30. Молекулярные орбитали и энергетическая диаграмма иона HF
2
-
В заключение следует отметить, что метод молекулярных орбиталей в настоящее время является наиболее
широко используемым приемом описания химической связи.
75

5.4. Ионная связь
5.4.1. Особенности ионной связи. Свойства ионных соединений.
Ионная связь, как указывалось в разделе 5.2.7, представляет собой предельный случай полярной связи,
когда электроотрицательности взаимодействующих атомов настолько сильно отличаются друг от друга, что
связывающая электронная пара полностью переходит от атома с меньшей электроотрицательностью к атому с
большей электроотрицательностью, следствием чего является превращение атомов в положительный и
отрицательный ионы.
Ионная связь качественно отличается от ковалентной связи (полярной или неполярной) следующими
особенностями:
1. При образовании ионной связи атомные орбитали взаимодействующих атомов не перекрываются; между
ионами имеет место электростатическое взаимодействие, описываемое законом Кулона. В связи с этим при
описании чисто ионной связи нет необходимости в использовании аппарата квантовой механики. Однако в
реальных веществах в связи с волновой природой электрона последний может находиться в любой точке
пространства, что исключает "стопроцентный" переход связывающей электронной пары к одному из атомов.
Таким образом, чисто ионная связь является химической абстракцией: в реальных системах связь лишь
приближается к ионной.
2. Силовые поля ионов сферически симметричны. Сближение двух противоположно заряженных ионов
нарушает симметрию их полей, но сами поля при этом не исчезают. В результате эти ионы способны
взаимодействовать с другими заряженными частицами, притягивая или отталкивая их. Ионная связь, таким
образом, в отличие от ковалентной, характеризуется ненасыщаемостью. Вследствие ненасыщаемости ионной
связи простейшие агрегаты ионов ("ионные молекулы") существуют лишь в газовой фазе при высоких
температурах. При понижении температуры происходит образование ионных макрокристалов (веществ с
надмолекулярной структурой), в которых каждый ион стремится координировать вокруг себя максимальное
число ионов противоположного знака. Ионная кристаллическая решетка - главное отличие ионных соединений от
ковалентных. Образование более или менее сложных ионных агрегатов возможно и в газовой фазе. Так, в парах
хлорида натрия наряду с ионными пáрами NaCl можно обнаружить такие частицы, как (NaCl)
2
, (NaCl)
3
, [Na
2
Cl]
+
,
[NaCl
2
]
-
.
В связи с ненасыщаемостью ионной связи для ионных соединений не применимо понятие о валентности в
той форме, в какой оно используется в случае ковалентных соединений. Элементы в ионном кристалле
характеризуются координационным числом, равным числу ионов противоположного знака, расположенных на
кратчайшем расстоянии от данного иона, и зарядом ионов, который в случае идеальной ионной связи совпадает
со степенью окисления элемента.
3. В связи со сферической симметрией электростатического поля ионов каждый ион притягивает ионы
противоположного знака в любом направлении, в результате чего ионная связь является ненаправленной.
Геометрия ионного кристалла определяется радиусами ионов, образующих кристаллическую решетку.
Общий тип химической связи обуславливает некоторые общие свойства, присущие ионным соединениям:
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется
сильным электростатическим притяжением между катионами и анионами в соединении. Так, в кристалле
хлорида цезия ион цезия окружают восемь ионов хлора, находящихся на кратчайшем расстоянии от него, а
каждый ион хлора - восемь ионов цезия.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом
состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному
движению. В расплавах ионы такую способность обретают, в результате чего расплавы ионных соединений
хорошо поводят электрический ток.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них
направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла
графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки
сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и
притяжения нарушается, а кристалл раскалывается.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители
характеризуются высокими значениями диэлектрической постоянной, которая связана с энергией
взаимодействия двух заряженных частиц уравнением
E =
Z Z
4 r
+
-
где Z
+
и Z
-
- заряды взаимодействующих частиц, r - расстояние между ними, - диэлектрическая постоянная
среды. Для воды диэлектрическая постоянная составляет 7,2510
-10
Кл
2
Дж
-1
м
-1
, тогда как диэлектрическая
постоянная вакуума (
0
) равна 8,8510
-12
Кл
2
Дж
-1
м
-1
, то есть в 82 раза меньше. Изменение диэлектрической
постоянной при переходе от вакуума к воде в 82 раза понижает энергию взаимодействия, что способствует
распаду вещества на ионы. Примером других жидкостей с высокими значениями диэлектрической
проницаемости могут служить циановодород (158
0
), фтороводород (83,6
0
), муравьиная кислота (57,9
0
),
метиловый спирт (37,9
0
), жидкий аммиак (25,0
0
).
Повышению растворимости ионных соединений в полярных растворителях может благоприятствовать также
сольватация образующихся ионов, являющаяся экзотермическим процессом.
76
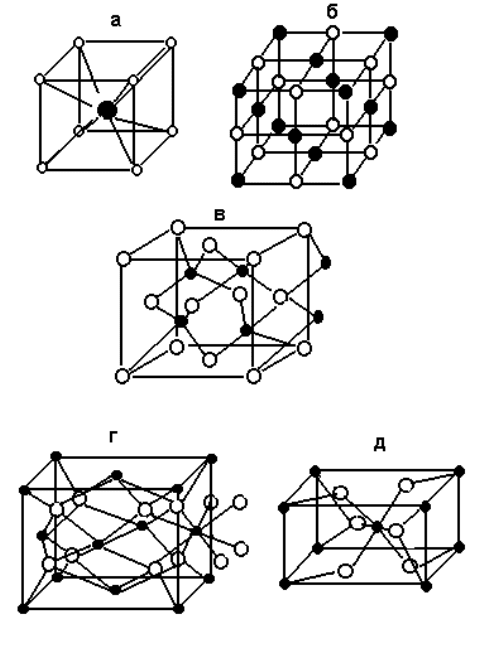
5.4.2. Типы кристаллических решеток ионных соединений.
Ионные радиусы.
Структурные типы ионных кристаллических решеток весьма разнообразны. Несколько наиболее часто
встречающихся структур рассмотрены ниже.
1. Структурный тип хлорида цезия. Одноименные ионы занимают позиции в восьми вершинах куба, в центре
которого находится ион противоположного знака. Таким образом, в кристалле хлорида цезия каждый ион
окружен восьмью ионами хлора, а каждый ион хлора - восьмью ионами цезия (Рис. 31,а). Координационное
число (КЧ) как катиона, так и аниона в подобных решетках равно восьми.
2. Структурный тип хлорида натрия. В кристалле хлорида натрия ионы Na
+
и Cl
-
образуют
взаимопроникающие кубические гранецентрированные решетки, в которых одинаковые ионы находятся в
вершинах куба и в центре граней этого куба. В подобной решетке каждый ион окружен шестью ионами
противоположного знака, образующими октаэдр. КЧ обоих ионов в решетке хлорида натрия равно 6 (рис. 31,б).
3. Структурный тип сфалерита. Сфалерит - минерал, представляющий одну из модификаций сульфида
цинка ZnS. В решетке сфалерита каждый ион цинка окружен четырьмя ионами серы, образующими тетраэдр, и
наоборот (рис. 31,в). Таким образом, для решеток типа сфалерита КЧ как катиона, так и аниона равно четырем.
4. Структурный тип флюорита. В кристалле фторида кальция (минерал флюорит) восемь ионов фтора
образуют куб вокруг каждого иона кальция (КЧ
Ca
2+ = 8), а четыре иона кальция образуют тетраэдр вокруг каждого
иона фтора (КЧ
F
- = 4) (рис. 31,г). Если поменять число и позиции катионов и анионов, то полученная решетка
называется структурой типа антифлюорита. Такую структуру имеет, например, оксид лития Li
2
O.
5. Структурный тип рутила. Минерал рутил является одной из модификаций диоксида титана. В кристалле
рутила координационное число катиона равно шести; шесть ионов кислорода, окружающих ион титана, образуют
почти правильный октаэдр. Координационное число аниона равно трем; три катиона титана располагаются в
вершинах равнобедренного треугольника вокруг иона кислорода (рис. 31.д).
Рис. 31. Некоторые распространенные структуры ионных кристаллов:
а - CsCl, б - NaCl, в - ZnS (сфалерит), г - CaF
2
(флюорит), д - TiO
2
(рутил);
- металл, - неметалл
Теория ионной связи рассматривает расстояние между соседними ядрами катиона и аниона в решетке
ионного соединения как сумму эффективных радиусов катиона и аниона
r = r
+
+ r
-
Значение r может быть установлено экспериментально методами рентгеноструктурного анализа. Для
определения значений r
+
и r
-
при известном значении r измеряют электронную плотность кристалла, а затем
делят межъядерное расстояние на два отрезка в точке, для которой электронная плотность минимальна. Так,
77
например, для кристалла хлорида натрия межъядерное расстояние равно 283 пм, а минимум на кривой
электронной плотности приходится на точку, отстоящую от ядра иона Nа
+
на 116 пм, а от ядра иона Cl
-
на 167 пм.
Эти величины и выбирают в качестве эффективных радиусов катиона натрия и хлорид-аниона.
Ионные радиусы очень мало зависят от природы партнера соответствующего иона, однако на них
существенно влияет координационное число иона в кристаллической решетке. В табл. 18 приведены значения
ионных радиусов натрия и фтора для различных координационных чисел.
Таблица 18.
Ионные радиусы (пм) ионов Na
+
и F
-
при различных значениях
координационных чисел
Ион Координационное число
2 3 4 6 8 12
Na
+
- - 113 116 132 153
F
-
114,5 116 117 119 - -
Как следует из табл. 18, с увеличением координационного числа увеличиваются эффективные радиусы как
катионов, так и анионов. Это явление может быть объяснено возрастанием сил отталкивания с увеличением
числа одноименных ионов, образующих ближайшее окружение. Для катионов на величину ионного радиуса
существенно влияет заряд иона: с увеличением заряда притяжение между катионом и анионом растет, а ионный
радиус уменьшается. Так, для ионов Fe
2+
и Fe
3+
при координационном числе, равном 6, ионные радиусы равны
75 и 69 пм.
Важной характеристикой ионного кристалла является отношение ионных радиусов r
+
/r
-
, в значительной мере
определяющее тип структуры соединения. Так, для кубических решеток при значении r
+
/r
-
от 0,41 до 0,73 обычно
реализуется структурный тип хлорида натрия с координационным числом 6. Если значения r
+
/r
-
укладываются в
интервал 0,73 - 1,37, более предпочтительной оказывается решетка типа хлорида цезия с координационным
числом 8. Для значений r
+
/r
-
, изменяющихся в пределах от 0,23 до 0,41, наиболее типичным оказывается
структурный тип сфалерита с координационным числом 4. Например, значения отношений r
+
/r
-
для иодидов
цезия и меди(I) равны соответственно 0,89 и 0,38, откуда можно предсказать для CsI структуру типа хлорида
цезия, а для CuI - структуру типа сфалерита. Эти структуры действительно присущи указанным соединениям.
Однако известны ионные соединения, нарушающие сформулированные выше правила.
5.3.3. Энергия ионной кристаллической решетки.
Энергией ионной кристаллической решетки называют энергию, выделяющуюся при образовании кристалла
моля ионного соединения из бесконечно удаленных друг от друга катионов и анионов. Таким образом, энергия
кристаллической решетки (Е
кр
) равна по абсолютной величине и обратна по знаку тепловому эффекту реакции:
; BA = nB + mA
)кр(
-
2
z
n
+
1
z
m
-
2
z
(г)
+
1
z
(г)
Н = - Е
КР
Энергия кристаллической решетки ионного соединения может быть определена экспериментально на
основании закона Гесса путем построения так называемых циклов Борна-Габера.
Рассмотрим два пути получения моля хлорида натрия. Первый путь соответствует синтезу моля NaCl из
простых веществ по уравнению
Na(к) + 1/2Cl
2
(г) = NaCl(к); Н
0
298
= -410,9 кДж/моль
Второй путь включает несколько последовательных стадий:
1) сублимация натрия
Na(к) = Na(г); Н
суб
= 108,4 кДж/моль;
2) атомизация молекулярного хлора
1/2Сl
2
(г) = Сl(г); Н
ат
= 121,3 кДж/моль;
3) ионизация атомарного натрия
Na(г) = Na
+
(г) + е
-
; Н
ион
= 495,8 кДж/моль;
4) образование иона хлора по уравнению
Cl(г) + е
-
= Cl
-
(г); Н
эл.ср.
= -348,8 кДж/моль
5) образование кристалла NaCl из ионов
Na
+
(г) + Cl
-
(г) = NaCl(к); Н
КР
(подлежит определению)
Тепловые эффекты всех стадий процесса, кроме последней, могут быть определены экспериментально.
Поскольку тепловой эффект процесса не зависит от пути, по которому протекает реакция
78

Н
0
298
= Н
суб
+ Н
дисс
+ Н
эл.ср.
+ Н
КР
отсюда
Е
КР
= -Н
КР
= Н
суб
+ Н
дисс
+ Н
эл.ср.
- Н
0
298
= 787,6 кДж/моль
5.4.4. Поляризация ионов.
Сближение противоположно заряженных ионов может сопровождаться их взаимной поляризацией (см.
раздел 5.2.7.). При этом электроны аниона притягиваются положительно заряженным ионом, а электроны
катиона отталкиваются отрицательно заряженным анионом. Деформация электронных оболочек ионов приводит
к появлению индуцированных диполей, причем диполь аниона направлен к катиону отрицательным полюсом, а
диполь катиона к аниону - полюсом положительным. Взаимодействие ориентированных друг к другу
противоположными полюсами индуцированных диполей сопровождается дополнительным сближением ионов и
понижением энергии системы. При этом создаются условия, благоприятствующие перекрыванию электронных
орбиталей, в результате чего увеличивается ковалентная составляющая и взаимодействие приобретает черты
полярной связи. Понижение энергии системы, обусловленное взаимной поляризацией ионов, называется
поляризационным эффектом.
Поляризация ионов является двусторонним процессом; каждый из ионов с одной стороны подвергается
поляризации, а с другой - вызывает поляризацию.
Способность иона деформироваться под действием электрического поля определяет его поляризуемость;
способность иона деформировать электронные оболочки других ионов характеризует его поляризующую
способность. Поляризационный эффект определяется как поляризуемостью, так и поляризующим действием
партнеров.
Факторы, влияющие на поляризацию ионов, были изучены К.Фаянсом, сформулировавшим несколько
правил, позволяющих учесть влияние заряда, радиуса и электронной структуры ионов на их поляризуемость и
поляризующее действие:
1. Поляризационный эффект тем выше, чем меньше радиус катиона. Уменьшение радиуса сопровождается
увеличением плотности заряда на "поверхности" иона, в результате чего растет его поляризующее действие.
2. Поляризационный эффект тем выше, чем больше радиус аниона. Чем больше радиус аниона, тем легче
деформируется его электронная оболочка. Таким образом, с увеличением радиуса растет поляризуемость
аниона.
3. Поляризационный эффект тем выше, чем больше положительный заряд катиона и отрицательный заряд
аниона, так как увеличение заряда приводит к возрастанию электрических сил, вызывающих поляризацию.
4. Поляризации ионов благоприятствует отличие электронной структуры иона от конфигурации благородного
газа; электронные конфигурации типа ns
2
np
6
наиболее эффективно экранируют заряд ядра, что понижает
поляризующую способность катиона. Для катионов с близкими радиусами и зарядами наибольший
поляризационный эффект отвечает конфигурации nd
10
(например, ион Hg
2+
), несколько меньший -
конфигурациям nd
1-9
и
(n-1)d
10
np
1-3
(например, ионы Cr
3+
и Pb
2+
).
Поляризационные процессы, в результате которых ионная связь приобретает черты полярной связи,
определенным образом влияет на свойства соединений.
1. Поляризация облегчает разрушение кристаллической решетки ионных соединений. Это явление
обусловлено тем, что в результате поляризации ионы дополнительно сближаются, что приводит к деформации
решетки и делает ее менее устойчивой. Следствием этого процесса является, в частности, понижение
температуры плавления соединений с увеличением поляризационного эффекта. Так, ионы Ca
2+
и Hg
2+
имеют
близкие ионные радиусы (114 и 116 пм); однако поляризующая способность иона ртути, имеющего
конфигурацию 5d
10
, выше поляризующей способности иона кальция, в результате чего соли кальция имеют
более высокую температуру плавления, чем соли ртути с теми же анионами. Например, температуры плавления
бромидов кальция и ртути составляют соответственно 742 С и 238 С.
2. Поляризация ионов понижает способность ионных соединений диссоциировать на ионы в водном
растворе. Так, например, СаCl
2
, для которого поляризационный эффект невелик, является сильным
электролитом, тогда как хлорид ртути(II), содержащий ион Hg
2+
, обеспечивающий высокий поляризационный
эффект, почти не диссоциирует в водных растворах.
3. Поляризация оказывает влияние на растворимость солей в полярных растворителях, сопровождающуюся
диссоциацией электролита на ионы: увеличение поляризационного эффекта обычно сопровождается
понижением растворимости. Так, в случае галогенидов серебра(I) ион Ag
+
имеет конфигурацию d
10
и сильно
поляризует анион, а поляризуемость галогенид-анионов возрастает в ряду F
-
<Cl
-
<Br
-
<I
-
. Фторид серебра
является легко растворимым соединением, тогда как хлорид, бромид и иодид серебра малорастворимы, причем
в ряду Cl
-
- I
-
их растворимость понижается (табл. 19).
Таблица 19.
Растворимость (S) галогенидов серебра в воде при 25 С
Соединение ПР S, моль/л
AgF - 9,8
AgCl 1,810
-10
1,310
-5
AgBr 5,310
-13
7,310
-7
AgI 8,310
-17
9,110
-9
79
4. Поляризация ионов оказывает влияние на цвет ионных соединений. В случае чисто ионной связи цвет
ионных кристаллов определяется цветом образующих кристалл ионов. Поляризуемость ионов увеличивает
ковалентную составляющую связи, что может повлиять на окраску образующегося соединения. Так, например,
ионы иода, свинца и ртути бесцветны, однако иодид свинца(II) имеет золотисто-желтую окрасу, а иодид ртути(II) -
красную.
5.5. Металлическая связь. Зонная теория кристаллов
Металлическая связь - это особый вид химической связи, реализующейся в металлах, сплавах, в
соединениях металлов друг с другом (интерметаллидах) и, несколько реже, в соединениях металлов с
неметаллами низкой электроотрицательности. Основной особенностью металлической связи является ее
электронодефицитность: взаимодействие осуществляется с использованием значительно меньшего числа
валентных электронов, чем это необходимо для образования двухцентровых связей. Так, например, в кристалле
натрия каждый атом имеет в ближайшем окружении восемь таких же атомов, в то время как единственный
валентный электрон позволяет ему образовать лишь одну двухцентровую связь. Совершенно очевидно, что
существование кристалла натрия возможно лишь за счет образования делокализованных связей, охватывающих
все атомы кристалла.
Таким образом, металлическая связь - это многоцентровая связь с дефицитом электронов, объединяющая
большое число атомов за счет обобществления валентных электронов в пределах всего кристалла.
Характерными особенностями металлической связи являются ее ненаправленность и ненасыщаемость.
Вследствие этого веществам с металлической связью присущ ряд общих свойств. Кристаллы таких веществ
обладают высокой электропроводность и теплопроводностью. Типичным веществам с металлической связью
присущи пластичность (ковкость) и характерный металлический блеск.
Заметим, что наряду с металлической связью в кристалле металла могут проявляться и иные виды
взаимодействия, вплоть до образования локализованных связей. Так, в кристалле ниобия, атомы которого
имеют пять валентных электронов, лишь около 25% от их числа идет на образование металлической связи.
Наиболее удовлетворительно металлическую связь описывает зонная теория кристаллов, представляющая
собой распространение метода молекулярных орбиталей на системы с переменным и очень большим числом
атомов (порядка числа Авогадро).
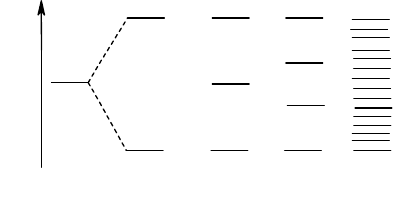
В основе зонной теории кристаллов лежит представление об энергетических зонах. Познакомимся с этим
понятием на примере формирования кристалла щелочного металла, например, натрия. В изолированном атоме
натрия электроны находятся на дискретных энергетических уровнях в соответствии с электронной
конфигурацией 1s
2
2s
2
2p
6
3s
1
. При сближении двух атомов натрия из двух 3s-орбиталей образуются
s
св
и
s
р
молекулярные орбитали (рис. 32).
3s
N=1 N=2 N=3 N=4 N10
23
E
Рис. 32. Формирование 3s-зоны в кристалле натрия
Валентные электроны заполняют
s
св
орбиталь, результатом чего является образование молекулы Na
2
(участие 3р-орбиталей в образовании связи для простоты не учитывается). Взаимодействие трех атомов натрия
приводит к образованию трех МО - связывающей, разрыхляющей и несвязывающей. Агрегату Na
4
будет
соответствовать формирование четырех МО (двух связывающей и двух разрыхляющих). По мере увеличения
числа атомов в агрегате число молекулярных орбиталей будет расти, а отвечающие им энергетические уровни
будут сближаться (рис. 32). При достаточно большом числе атомов (порядка числа Авогадро) формируется
совокупность огромного числа энергетических уровней, в которой энергии двух смежных уровней отличаются на
очень малую величину (порядка 10
-20
- 10
-22
кДж/моль). Подобные совокупности энергетических уровней
называются энергетическими зонами. Так, в рассматриваемом примере происходит формирование 3s-зоны.
Энергетические зоны подчиняются законам квантово-механической теории. Так, для энергетических зон
справедлив принцип Паули: если кристалл состоит из N атомов, емкость s-зоны составляет 2N электронов, р-
зоны - 6N электронов и т.д. Соблюдается также правило Хунда: если в зоне имеются вырожденные уровни,
электроны распределяются так, что число параллельных спинов было максимальным.
Зона, в которой располагаются валентные электроны, называется валентной зоной; ближайшая к валентной
зоне вакантная зона называется зоной проводимости. Так, в случае кристалла натрия валентной зоной является
3s-зона, а зоной проводимости - 3р-зона.
Энергетические зоны распространяются на все атомы кристалла, в результате чего любой электрон,
участвующий в образовании металлической связи, может считаться принадлежащим всем атомам кристалла,
что обеспечивает свободное перемещение электрона по всему кристаллу.
В кристалле металла возможно перекрывание энергетических зон, образованных орбиталями разных
энергетических подуровней. Зоны являются перекрывающимися, если верхний край нижней зоны, например,
валентной зоны, лежит выше нижнего края верхней зоны, например, зоны проводимости. Если зоны не
80
