Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


радиоактивным изотопом
K
40
19
; содержание последнего равно 0,012% от общего числа ядер изотопов калия.
Этот изотоп распадается по уравнению
ν
~
+ e + Ca K
-
40
20
40
19
Период полураспада
19
40
K
- 1,2510
9
лет.
4.7. Искусственная радиоактивность. Изотопная индикация
Искусственной радиоактивностью называются процессы самопроизвольного распада ядер нуклидов,
полученных искусственным путем с помощью ядерных реакций.
Явление искусственной радиоактивности было открыто Ирен и Фредериком Кюри в 1934 г. при изучении
бомбардировки легких элементов (алюминия, магния, бора) -частицами.
Если алюминиевую мишень подвергнуть действию ядер гелия, образующихся при распаде радия, то мишень
начинает испускать нейтроны и позитроны. При удалении источника ядер гелия испускание нейтронов
прекращается, а позитронное излучение сохраняется, однако интенсивность его падает, уменьшаясь наполовину
каждые 2,5 мин. Это явление было объяснено протеканием двух ядерных реакций:
n + P He + Al
1
0
30
15
4
2
27
13
+ e + Si = P
+30
14
30
15
Изотоп
P
30
15
, в отличие от стабильного
P
31
15
, таким образом, является радиоактивным нуклидом,
подвергающемся
+
-распаду. В дальнейшем радиоизотопы были получены для всех химических элементов; их
число в настоящее время составляет около 1300.
Искусственным радионуклидам присущи все виды радиоактивного распада, однако чаще всего они
подвергаются -распаду (как электронному, так и позитронному).
В химическом отношении радиоизотопы почти тождественны изотопам стабильным, однако благодаря
присущей им радиоактивности могут быть обнаружены в исчезающе малых количествах - современные приборы
позволяют регистрировать буквально каждый акт радиоактивного распада. В связи с этим радионуклиды широко
используются в научной и производственной практике для исследования разнообразных объектов методом
изотопной индикации.
Изотопными индикаторами называют вещества, изотопный состав которых отличается от природного,
благодаря чему они могут быть использованы в качестве меченых соединений при изучении самых
разнообразных процессов и явлений. В качестве изотопной метки можно использовать как неординарные
стабильные изотопы (например,
18
О), так и радиоактивные нуклиды; предпочтение обычно отдают
радиоактивным индикаторам, так как они известны для всех элементов и их очень легко обнаружить.
Непрерывный распад радионуклидов позволяет следить за соответствующим элементом в сложных химических
и физических процессах в разнообразных системах, в том числе и в живых организмах.
Методом радиоактивной индикации непосредственно определяют растворимость малорастворимых простых
и сложных веществ, давление пара малолетучих соединений, изучают процессы диффузии, адсорбции,
распределение вещества между фазами. Особый интерес представляет использование радиоактивных
индикаторов при изучении строения химических соединений и механизмов химических реакций.
Рассмотрим несколько примеров использования радиоактивной индикации для решения химических
проблем.
С помощью радиоактивной индикации была доказана полная идентичность связей, образованных по
обменному и донорно-акцепторному механизмами, на примере тетрабромомеркурата(II) калия - K
2
[HgBr
4
]. В
комплексном анионе [HgBr
4
]
2-
, полученном по уравнению
HgBr
2
+ 2Br
-
= [HgBr
4
]
2-
две связи Hg-Br образованы по обменному, а две - по донорно-акцепторному механизму. Соединение K
2
[HgBr
4
]
синтезировали из бромида ртути, не содержащего радиоактивных изотопов, и бромида калия, меченного
радиоактивным изотопом
Br
80
35
, после чего продукт реакции разложили при нагревании на бромиды ртути и
калия. При этом было установлено, что меченые атомы брома равномерно распределяются между HgBr
2
и KBr,
что свидетельствует о равноценности всех связей в [HgBr
4
]
2
.
Использование радиоизотопа
S
35
16
позволило доказать неравноценность атомов серы в тиосульфате
натрия. Тиосульфат натрия синтезировали кипячением раствора сульфита натрия с элементарной серой,
меченной радиоизотопом S*, после чего полученный тиосульфат разлагали на сульфит и серу. Оказалось, что
при этом метка S* полностью оставалась в элементарной сере:
Na
2
SS*O
3
= Na
2
SO
3
+ S*
Если бы атомы серы в тиосульфате были равноценны, изотоп
S
35
16
равномерно распределился бы между
сульфитом и серой.
Примером применения метода радиоактивной индикации для выявления механизма протекания реакции
может служить исследование реакции окисления пропионовой кислоты перманганатом калия. В смесях,
41

содержащих избыток пропионовой кислоты, реакция сопровождается образованием щавелевой кислоты и
диоксида углерода по уравнению:
5C
2
H
5
COOH + 12KMnO
4
+ 18H
2
SO
4
= 5H
2
C
2
O
4
+ 5CO
2
+ 6K
2
SO
4
+ 12MnSO
4
+ 28H
2
O
Обычные методы исследования не позволяют решить вопрос о природе углеродного атома, переходящего в
диоксид углерода - принадлежал ли он ранее карбоксильной группе или углеводородному радикалу пропионовой
кислоты. Использование изотопного индикатора, меченного радиоактивным изотопом углерода
14
С, показало, что
возможны оба пути окисления, причем изменение рН среды изменяет количество СО
2
, полученного по разным
путям окисления.
Метод изотопной индикации позволил решить ряд биохимических и биологических проблем. В частности,
этим путем было доказано, что выделяющийся при фотосинтезе кислород образуется из молекул воды, а не из
диоксида углерода, поглощаемого растениями. Изотопная индикация широко используется при изучении
действия биологически активных веществ и лекарственных препаратов.
4.8. Новые химические элементы
Крупным достижением ядерной химии является получение ряда химических элементов, которые по причине
неустойчивости их ядер не содержатся в сколько-нибудь ощутимых количествах в земной коре.
Можно выделить две группы подобных элементов. К первой группе следует отнести четыре элемента,
расположенных в периодической системе до урана; этим элементам отвечают порядковые номера 43 (технеций),
61 (прометий), 85 (астат) и 87 (франций). Вторую группу образуют элементы, заряды ядер которых превышают
заряд ядра урана (трансурановые элементы).
Элементы с порядковыми номерами 43, 61, 85 и 87 были синтезированы в 30
х
-40
х
годах путем
бомбардировки соответствующих мишеней протонами, дейтронами или ядрами гелия, разогнанными на
циклотроне. Ниже приведены ядерные реакции, использованные при синтезе этих элементов:
n + Tc H + Mo
1
0
99
43
2
1
98
42
n + Pm He +Pr
1
0
149
61
4
2
146
59
n2 +At He + Bi
1
0
211
85
4
2
209
83
He2 +Fr H +Th
4
2
223
87
1
1
230
90
Технеций, прометий и франций накапливаются также в продуктах распада урана в ядерных реакторах.
Для синтеза трансурановых элементов используют различные приемы, из которых наиболее важными
являются метод нейтронной бомбардировки, бомбардировка -частицами, бомбардировка тяжелыми ионами.
Так, при облучении урана нейтронами наблюдается образование ряда трансурановых элементов по схеме:
Fm... Cm
Am)(n, AmPu ) (2n,2Pu Np U) (n, U
256
100
242
96
-
242
95
241
95
-
241
94
239
94
-
239
93
-
239
92
238
92
Ядерные реакции с участием -частиц были применены для синтеза элементов с порядковыми номерами от
96 до 101; в качестве мишени обычно используют трансурановые элементы с более низкими порядковыми
номерами. В качестве примера приведем реакции синтеза некоторых изотопов кюрия и менделевия:
n + Cm He +Pu
1
0
242
96
4
2
239
94
n + Md He + Es
1
0
256
101
4
2
253
99
Бомбардировка тяжелыми ионами позволяет синтезировать элементы с порядковыми номерами,
превышающими 101. Так 105-й и 107-й элементы удалось получить, используя для бомбардировки тяжелые
ионы неона и хрома:
n4 + Db Ne + Am
1
0
261
105
22
10
243
95
n2 +Bh Cr + Bi
1
0
261
107
54
24
209
83
Элемент 110 был получен в количестве 40 ядер бомбардировкой тория ионами кальция.
Синтез трансурановых элементов с очень высокими порядковыми номерами затруднен тем, что с ростом
заряда ядра быстро уменьшается устойчивость ядер. Если период полураспада наиболее устойчивого из
синтезированных изотопов плутония составляет 81 млн. лет (
Pu
244
94
), то для калифорния эта величина равна
900 лет (
Cf
251
98
), для фермия - 100 суток (
Fm
257
100
), для менделевия - 56 суток (
Md
258
101
), для курчатовия - 70
с (
Ku
261
104
), а для 107-го элемента - 0,001 с. Тем не менее, возможность существования относительно
устойчивых ядер в области очень высоких значений порядковых номеров не исключена. Особые надежды
возлагают на дважды магический изотоп
X
310
126
, содержащий 126 протонов и 184 нейтрона. Можно ожидать, что
42

период полураспада такого ядра будет величиной порядка миллиона лет. Однако синтезировать элемент 126
пока не удалось.
4.9. Эволюция элементов во Вселенной
Вселенная поражает наше воображение своими размерами. Так, диаметр нашей Галактики составляет около
90 тыс. световых лет
1
, то есть 8,510
17
км; в ее пределах насчитывается около 150 млрд. звезд. Расстояние
между галактиками представляют величины порядка 1,5 млн. световых лет, причем уже в сфере радиусом 310
9
световых лет число галактик измеряется сотнями миллионов. Во Вселенной сосредоточено огромное количество
материи в вещественной форме, образованной теми же элементами, которые известны и на Земле - никаких
новых элементов в космосе не обнаружено. Однако при постоянстве качественного состава Вселенной ее
количественный элементный состав непрерывно меняется в результате протекания разнообразных ядерных
реакций, местом осуществления которых являются звезды, бесчисленные природные ядерные синтезаторы.
Вопрос об эволюции элементного состава Вселенной рассматривается в настоящем разделе.
Можно выделить два носителя материи в космосе: это космические тела (звезды, планеты, кометы и т.д.) и
космическая диффузная материя (межзвездный газ и космическая пыль).
Одним из основных носителей материи в космосе является межзвездный газ - рассеянные в космическом
пространстве атомы различных элементов. Концентрация межзвездного газа очень низка - 1-2 атома в
кубическом сантиметре; однако в объеме куба с длиной ребра, равной одному световому году, его масса во
много раз превышает массу космических тел в том же объеме. Главными составными частями межзвездного
газа являются атомы водорода (90%) и гелия (9%), на долю всех остальных элементов приходится около 1 %
общего числа атомов.
Если в некотором объеме космического пространства концентрация диффузной материи окажется
достаточно высокой, начинается гравитационное сжатие вещества, сопровождающееся его разогреванием.
После того как температура достигнет некоторой критической величины, атомы водорода ионизируются, образуя
водородную плазму. После того как температура достигает 10-20 млн. К, в водородной плазме начинает
протекает термоядерная реакция синтеза гелия. Этот момент является началом существования звезды.
Ядерный синтез гелия по схеме
4
1
1
H He + 2e + 2
2
4 +
является многостадийным процессом и сопровождается выделением огромного количества энергии (около 650
млн. кДж на моль превращенного водорода). При слишком высоких температурах он протекает по так
называемому протон-протонному циклу, включающему три стадии:
1
1
H + H H + e +
1
1
1
2 +
ν + γ+ He
3
2
H
1
1
+ H
2
1
2
3
He + He He + 2 H
2
3
2
4
1
1
На этой стадии звезда является саморегулирующейся системой: с повышением температуры увеличивается
объем звезды, уменьшается концентрация водорода и замедляется процесс синтеза ядер гелия, что влечет за
собой понижение температуры, сжатие звезды, ускорение термоядерной реакции и повышение температуры.
По мере "выгорания" водорода образующийся гелий накапливается в центральной части звезды,
температура в этой области повышается. При 150 млн. К становятся возможными термоядерные реакции гелия,
сопровождающиеся образованием ядер с четным зарядом и массой, кратной четырем:
2
4
He + He Be +
2
4
4
8
4
8
Be + He C +
2
4
6
12
6
12
C + He O +
2
4
8
16
Ядро
4
8
Be
крайне неустойчиво, ядра
6
12
C, O
8
16
стабильны. С появлением ядер
6
12
C
становится
возможным синтез гелия по углерод-азотному циклу, в котором ядра
6
12
C
являются своеобразным
катализатором:
6
12
C + H N +
1
1
7
13
7
13
N C + e +
6
13 +
γ N H C
14
7
1
1
13
6
7
14
N + H O +
1
1
8
15
8
15
O N + e +
7
15 +
He C H N
4
2
12
6
1
1
15
7
1
1 световой год = 0,307 парсек = 9,4610
12
км.
43
В молодых звездах этот цикл, требующий высоких температур, осуществляется в их ядрах, а протон-
протонный цикл - в периферийных областях.
При температурах около 600 млн. К в ядре звезды начинают протекать термоядерные реакции углерода:
12
12
12
6
12
6
C C
+
Ne + He
Na + H
Mg + n
Mg +
10
20
2
4
11
23
1
1
23
24
1
0
Образующиеся при этом ядра могут взаимодействовать с протонами и ядрами гелия, образуя различные
изотопы как с четными так и с нечетными порядковыми номерами, например,
8
16
O + H F +
1
1
9
17
12
24
O + He Si +
2
4
14
28
В центральной части звезды накапливаются ядра титана, хрома, марганца, железа, кобальта, никеля, меди.
По мере протекания этих процессов усиливается элементное и температурное различие центральной и
периферийной зон звезды. Возникает красный гигант - огромная звезда (диаметр красного гиганта может в сотни
и тысячи раз превышать диметр Солнца) с горячим ядром (порядка 10
8
К) и низкотемпературной поверхностью
(порядка 2000 К). В недрах красного гиганта становится возможным протекание реакций с участием нейтронов,
что приводит к синтезу элементов вплоть до висмута.
Резкое отличие элементного состава и температурного режима ядра звезды и ее оболочки приводит к
нарушению равновесия. Медленные реакции захвата нейтронов уступают место быстрым, протекающим
лавинообразно, и при температуре ядра порядка 10
10
К происходит взрыв сверхновой звезды. При взрыве
мощные потоки нейтронов приводят к образованию ядер тяжелых элементов, вплоть до
98
254
Cf
. Огромные
количества ядер самых разных элементов выбрасываются в космос
Взорвавшаяся звезда затем сжимается и превращается в белый карлик. Температура белого карлика низка,
что исключает протекание термоядерных реакций. Однако в белом карлике могут протекать процессы
радиоактивного распада тяжелых ядер.
Выброшенное при взрывах звезд вещество принимает участие в образовании новых космических тел - звезд
следующего поколения, более богатых тяжелыми элементами. Таким образом, мировое вещество
эволюционирует в направлении уменьшения содержания во Вселенной ядер водорода и увеличения количества
более тяжелых ядер.
5. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
5.1. Химическая связь. Параметры химической связи. Валентность
Теория химической связи занимает центральное место в современной химической науке, поскольку свойства
и реакционная способность вещества определяется прежде всего его химическим строением, т.е. природой
связей между атомами, эти вещества образующими. Химическая связь - это вид взаимодействия атомов,
результатом которого является образование химически устойчивых многоатомных систем (молекул, ионов,
кристаллов, полимеров и т.д.).
Можно выделить две характерные черты, позволяющие отличить химическую связь от других видов
межатомного взаимодействия:
1) образование многоатомной системы сопровождается понижением ее полной энергии сравнительно с
суммой энергии атомов, образующих эту систему;
2) в процессе образования химической связи происходит перестройка электронных оболочек
взаимодействующих атомов, сопровождающаяся перераспределением электронной плотности.
Важнейшими количественными характеристиками химической связи являются энергия связи, длина связи и
валентный угол.
Энергия связи - это энергия, которую необходимо затратить на разрушение данной связи с
образованием изолированных атомов. Обычно энергию связи относят к молю связей и выражают в кДж/моль.
Если молекула состоит из двух атомов, энергия связи равна тепловому эффекту реакции распада молекулы
на атомы. Так, атомизация хлороводорода протекает по уравнению
44

HCl H + Cl; Н = 427,8 кДж/моль
Соответственно и энергия связи Е
H-Cl
составляет 427,8 кДж/моль.
В случае многоатомной молекулы, содержащей несколько одинаковых связей, средняя энергия связи будет
равна тепловому эффекту реакции атомизации молекулы, деленному на число связей в молекуле. Например,
средняя энергия связи О-Н в молекуле воды в соответствии с уравнением
Н
2
О 2Н + О; Н = 927 кДж/моль
составит
кДж/моль 463,5 =
2
H
E
H-O
Следует подчеркнуть, что для многоатомной молекулы энергия связи является усредненной величиной и не
равна энергии, затраченной на последовательный отрыв атомов от молекулы. Так, для отрыва атома водорода
от молекулы воды требуется 499 кДж/моль, а от радикала ОН - 428 кДж/моль. Среднее арифметическое от этих
величин равно энергии связи О-Н. Для большинства соединений энергии связей являются величинами порядка
100-500 кДж/моль.
Длиной связи называется расстояние между ядрами провзаимодействовавших атомов. Длина связи
выражается обычно в нанометрах (1 нм = 110
-9
м) или пикометрах (1 пм = 110
-12
м) и для большинства связей
составляет от 100 до 300 пм. Длина связи зависит от ряда факторов и прежде всего от типа химической связи.
Длина одинарной связи всегда больше длины двойной связи между теми же атомами; тройная связь короче
двойной. Так, средние значения длины одинарной, двойной и тройной связи между атомами азота составляют
145, 125 и 110 пм, между атомами углерода 154, 134 и 120 пм. Существует довольно четкая корреляция между
длиной и энергией связи: увеличение энергии связи благоприятствует уменьшению ее длины. При одинаковых
типе и кратности связи ее длина мало зависит от того, в каком соединении реализуется данная связь. Так, при
всем многообразии соединений углерода длина связи С-С изменяется в пределах 154-158 пм.
Третьим параметром химической связи является валентный угол. Валентный угол - это угол, образуемый
прямыми, проведенными через ядра центрального и присоединенных к нему атомов после образования связей.
Для большинства молекул значения валентных углов изменяются от 90 до 180. Например, для молекул CH
4
,
NH
3
и H
2
O валентные углы составляют 109,5, 107,3 и 104,5 соответственно. Валентные углы меньше 90
являются очень напряженными и реализуются редко.
Атомы различных элементов отличаются друг от друга по способности образовывать связи с другими
атомами и по числу образуемых ими химических связей.
Количественная характеристика способности атома присоединять или замещать атомы того же или другого
элемента называется валентностью. Валентность - весьма сложное химическое понятие, в которое на разных
этапах развития химической науки вкладывали различное содержание. Представление о валентности было
впервые введено в 1853 году Э.Франклендом, обнаружившим, что частное от деления атомных масс элементов
на их эквивалентные массы является целочисленными величинами. Первоначально валентность элемента
определяли числом атомов водорода (валентность по водороду) или кислорода (валентность по кислороду),
присоединяемых атомом данного элемента. После разработки теории строения атома понятие валентность
связывали с зарядом, приобретаемым атомов при образовании соединения (электровалентность) или числом
связей, образуемых атомом (ковалентность). И в настоящее время различные теории химической связи
вкладывают в понятие валентность различный смысл. Этот вопрос будет подробно рассмотрен ниже.
Современная теория химической связи строится на базе квантово-механических представлений.
Предполагается, что электроны молекулы, подобно электронам изолированных атомов, описываются
молекулярными волновыми функциями, через которые могут быть выражены средние значения всех
характеристик молекулы как в стабильном, так и в возбужденных состояниях. Набор волновых функций
молекулы может быть найден путем решения уравнения Шредингера:
H = E
M M
(5-1)
где
М
- молекулярная волновая функция. Однако уравнение (5-1) может быть строго решено только для
одноэлектронного молекулярного иона водорода Н
2
+
. Для более сложных частиц приходится использовать
приближенные методы, сводящиеся к тому, что молекулярную волновую функцию выражают через волновые
функции взаимодействующих атомов. В зависимости от того, как решается эта задача, сложились две основные
концепции описания химической связи: метод валентных связей (метод ВС) и метод молекулярных орбиталей
(метод МО). Эти теории химической связи будут рассмотрены в разделах 5.2 и 5.3.
5.2. Метод валентных связей
5.2.1. Основные принципы метода валентных связей.
Метод валентных связей (метод ВС) исходит из предположения, что в каждой молекуле обязательно
имеются связи, соединяющие два конкретных атома (ковалентные связи). Сущность метода ВС может быть
сведена к следующим основным положениям:
1. Ковалентная связь реализуется за счет образования электронной пары, общей для взаимодействующих
атомов. Подобная двухцентровая, двухэлектронная связь называется ковалентной локализованной связью.
2. Ковалентные двухцентровые связи образуют электроны с антипараллельными спинами. Необходимость
антипараллельности спинов для образования связи была показана В.Гайтлером и Ф.Лондоном, которые в 1927
году, используя уравнение Шредингера, рассчитали изменение потенциальной энергии системы для двух атомов
водорода в зависимости от межъядерного расстояния. При этом было установлено, что в случае параллельных
45
спинов электронов энергия системы непрерывно возрастает по мере сближения атомов. Если же спины
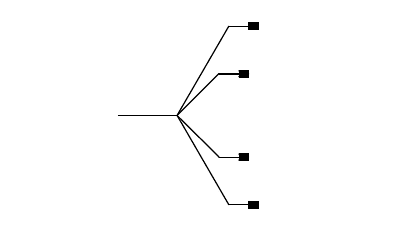
антипараллельны, то при уменьшении межъядерного расстояния потенциальная энергия первоначально
понижается, проходит через минимум, а при дальнейшем сближении атомов начинает быстро расти (рис. 5). В
этом случае молекула водорода образуется; при этом положение минимума на кривой потенциальной энергии
отвечает длине связи в молекуле Н
2
, а глубина минимума - энергии связи.
3. При образовании ковалентной связи происходит перекрывание электронных орбиталей
взаимодействующих атомов. Сущность перекрывания состоит в том, что после образования связи расстояние
между ядрами становится меньше суммы радиусов взаимодействующих атомов. Так, для молекулы водорода
межъядерное расстояние составляет 74 пм, тогда как сумма атомных радиусов равна 106 пм. В результате
возникает область пространства, в которой с достаточной вероятностью может находиться электрон как одного,
так и другого атома (зона перекрывания). В зоне перекрывания каждый электрон, образующий локализованную
связь, описывается волновыми функциями обоих взаимодействующих атомов.
432
0
74
Е,
кДж/моль
r,пм
а
б
Рис. 5. Зависимость энергии молекулы водорода от межъядерного расстояния в случае параллельности (а)
или антипараллельности (б) спинов электронов
Количественной характеристикой перекрывания является интеграл перекрывания
S = dV
-
+
a b
где
a
и
b
- волновые функции электронов атомов, между которыми образуется связь.
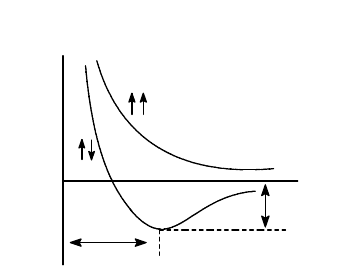
В зависимости от знака волновых функций и ориентации орбиталей в пространстве возможны три типа
перекрывания (рис. 6):
а) Положительное (эффективное) перекрывание. В области перекрывания волновые функции обоих
электронов (
a
и
b
) имеют одинаковый знак. Так, если ядра взаимодействующих атомов А и В расположены на
оси х, то положительное перекрывание будет наблюдаться для орбиталей 1s(a) и 1s(b), 2p
z
(a) и 2p
z
(b), а также
для орбиталей 2p
x
(a) и 2p
x
(b) при условии, что для атома А ось х направлена слева направо, а для атома В -
справа налево (рис. 6,а). При положительном перекрывании растет электронная плотность в зоне перекрывания
и происходит образование связи.
б) Отрицательное (неэффективное) перекрывание. В области перекрывания волновые функции
а
и
b
имеют разный знак. Отрицательное перекрывание имеет место для орбиталей 2p
z
(a) и 2p
z
(b), если для атомов А
и В ось х общая, а оси z направлены в противоположные стороны, а также для орбиталей 2p
x
(a) и 2p
x
(b), если ось
х для обоих атомов направлена слева направо (рис. 6,б). В случае отрицательного перекрывания электронная
плотность в области перекрывания понижается, усиливается взаимное отталкивание ядер и образование связи
становится невозможным.
46
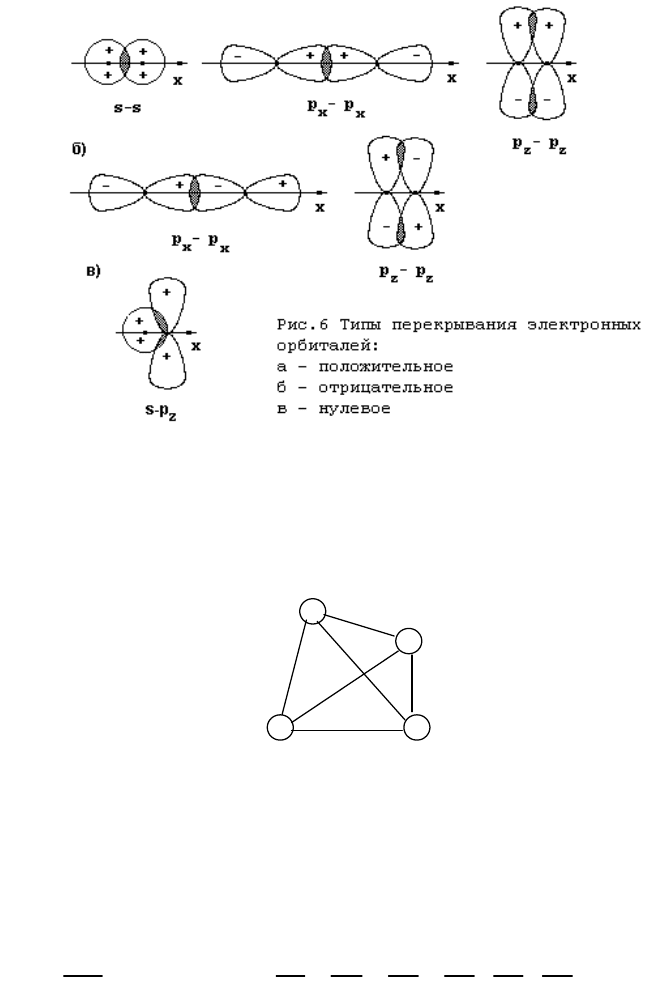
в) Нулевое перекрывание. Перекрывание не сопровождается изменением электронной плотности в зоне
перекрывания. Так, при перекрывании 1s(a)- и 2p
z
(b)-орбиталей (рис. 6,в) наблюдается одинаковое повышение
электронной плотности в области положительных значений z и понижение электронной плотности в области
отрицательных значений z.
4. Молекулярные орбитали (молекулярные волновые функции) конструируются как произведения атомных
орбиталей (атомных волновых функций) и линейные комбинации таких произведений.
Рассмотрим этот вопрос на примере молекулы водорода (рис. 7).
r
ab
r
a2
r
a1
r
12
r
b2
r
b1
+
+
-
-
электрон 1
электрон 2
H
b
H
a
Рис. 7. Ядра и электроны в молекуле водорода
Пусть взаимодействуют два атома водорода в невозбужденном состоянии (Н
а
и Н
b
). Электроны этих атомов
(электрон 1 и электрон 2) описываются волновыми функциями
а
и
b
. Уравнения
а
и
b
для молекулы
водорода одинаковы, так как речь идет об 1s-орбиталях, однако значения этих функций будут отличаться в связи
с различными значениями координат электронов 1 и 2. В такой системе каждое ядро будут притягивать как
электрон 1, так и электрон 2; кроме того будет наблюдаться отталкивание между двумя электронами и двумя
ядрами. Соответственно потенциальная энергия молекулы водорода будет включать шесть слагаемых, а
оператор Гамильтона примет вид:
)
r
1
-
r
1
-
r
1
+
r
1
+
r
1
+
r
1
(e + ) (
2m
- = H
ab12a2b1b2a1
2
2
2
1
2
2
(5-2)
где
1
2
2
2
и
- операторы Лапласа для электрона 1 и электрона 2, а r
ab
и r
12
расстояния между образующими
молекулу ядрами и электронами (рис. 7). Подстановка (5-2) в (5-1) приводит к уравнению Шредингера для
молекулы водорода, которое, однако, не может быть решено строго в отношении волновой функции молекулы
водорода
М
. Поэтому попытаемся сконструировать
М
из атомных орбиталей
a
и
b
. В соответствии с
концепцией М.Борна (раздел 1.3.) вероятность нахождения электрона в некотором объеме VdV будет
определяться величиной
a
2
(1)
, а вероятность пребывания в том же объеме электрона 2 - величиной
b
2
(2)
. Квадрат молекулярной волновой функции
M
2
будет характеризовать вероятность пребывания в объеме dV
как первого, так и второго электрона. Вероятность одновременного осуществления двух независимых событий
равна произведению вероятностей этих событий, отсюда
M
2
a
2
b
2
= ( ) ( )1 2
или
M
a
b
= ( ) ( )1 2
(5-3)
Уравнение (5-3) было использовано В.Гайтлером и Ф.Лондоном для квантово-механического расчета
молекулы водорода. Полученный результат не был особо точным: вычисленные значения длины и энергии связи
оказались равными 87 пм и 303 кДж/моль, тогда как экспериментально определенные значения этих величин
47

составляют 74 пм и 432 кДж/моль. Наблюдаемые расхождения Гайтлер и Лондон объяснили тем, что при
расчете не была учтена неразличимость электронов 1 и 2, в результате уравнению (5-3) эквивалентно уравнение
(5-4)
M
a
b
= ( ) ( )2 1
(5-4),
в соответствии с которым волновая функция
а
описывает электрон 2, а
b
- электрон 1. Уравнение (5-4)
обладает теми же недостатками, что и уравнение (5-3). Гайтлер и Лондон предположили, что достаточно
хорошим приближением к искомой волновой функции молекулы водорода является линейная комбинация
функций (5-3) и (5-4).
Линейной комбинацией двух функций
1
и
2
называется функция
= с
1
1
с
2
2
где с
1
и с
2
- произвольные коэффициенты. Из теории дифференциальных уравнений следует, что если функции
1
и
2
являются решениями дифференциального уравнения, то любые их линейные комбинации также являются
решением этого уравнения.
Если принять, что с
1
= с
2
= 1, то линейное комбинирование уравнений (5-3) и (5-4) приводит к двум
уравнениям молекулярной волновой функции
M+ a b a b
= (1) (2) + (2) (1)
(5-5)
M- a b a b
= (1) (2) - (2) (1)
(5-6)
Из этих уравнений лишь уравнение (5-5) обеспечивает положительное перекрывание, так как
M+
2
a b
2
a b
2
> [ (1) (2)] + [ (2) (1)]
,
тогда как в случае уравнения (5-6) для точек, равноудаленных от обоих ядер,
М-
и
2
М-
равны нулю. Функция
(5-5) симметрична: при перестановке в ней координат электронов 1 и 2 она не меняет знак. Это свидетельствует
о том, что квантовые числа обоих электронов, входящие в уравнение Шредингера (n,, m
) одинаковы. В
соответствии с принципом Паули в системе не может существовать двух электронов в одинаковом квантовом
состоянии, отсюда следует, что образующие связь электроны должны отличаться магнитным спиновым
квантовым числом, т.е. иметь антипараллельные спины.
Важнейшими свойствами ковалентной связи являются ее насыщаемость, направленность и полярность.
5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
Сущность насыщаемости ковалентной связи состоит в том, что атом любого элемента может образовать
лишь конечное число двухцентровых связей, которое не может превысить некоторую постоянную для данного
элемента величину.
Насыщаемость связи обусловлена принципом Паули, справедливым как для изолированных атомов, так и
для атомов, входящих в молекулу. Количество электронов, осуществляющих ковалентную связь, не может
превысить емкость энергетических подуровней, которые "задействованы" при образовании связей данным
атомом.
Так, например, для атома углерода (электронная конфигурация 1s
2
2s
2
2p
2
) валентными являются 2s- и 2р-
подуровни; максимальное число электронов на этих уровнях равно восьми. Соответственно атом углерода не
может образовывать более четырех двухцентровых связей за счет четырех электронных пар. Насыщаемость
связи обеспечивает определенный состав и структуру молекулярных соединений.
Двухцентровая связь может образовываться двумя путями, соответственно чему различают два механизма
образования ковалентной связи.
1. Обменный механизм. Связующие электронные пары формируются из непарных электронов
взаимодействующих атомов по схеме:
A B A
B
+
По обменному механизму образуется, например, связь в молекуле водорода, полученного при взаимодействии
цинка с хлороводородной кислотой:
Zn + 2HCl = ZnCl
2
+ 2H
(5-7)
H H H
H
+
2. Донорно-акцепторный механизм. Двухэлектронная связь образуется за счет свободной (вакантной)
орбитали одного из атомов и неподеленной электронной пары другого атома по схеме:
48
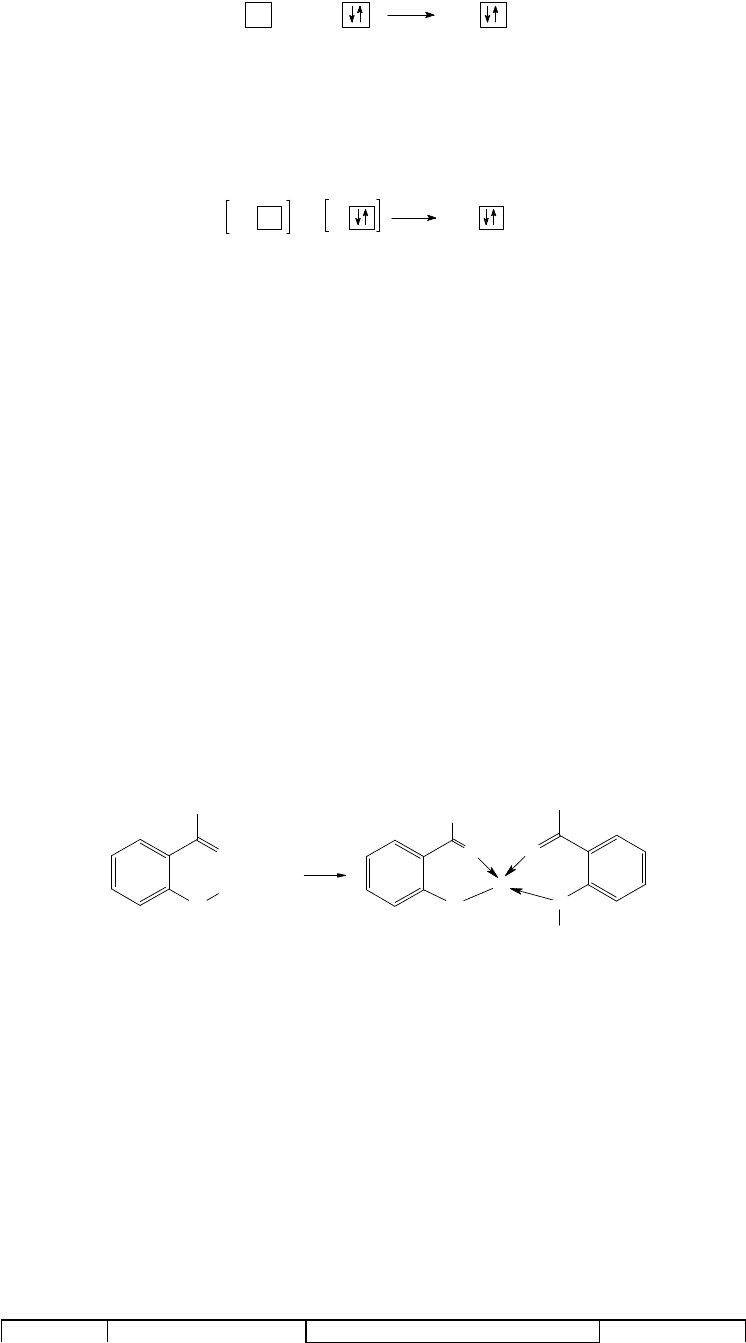
+
B
ABA
При этом атом, предоставляющий для образования связи электронную пару, называется донором, а атом,
предоставляющий вакантную орбиталь, - акцептором. Донорно-акцепторный механизм реализуется, в частности,
в молекулах водорода, образующихся при взаимодействии хлороводородной кислоты с гидридом натрия по
уравнению
HCl + NaH = NaCl + H
2
(5-8)
+
H
HHH
+
_
В уравнении (5-8) катион водорода является акцептором, а гидрид-анион - донором.
Заметим, что связи, образованные по обменному и донорно-акцепторному механизмам, отличаются лишь по
происхождению электронной пары, обеспечивающей связь; по остальным характеристикам (длина связи,
энергия связи, валентные углы) эти связи абсолютно идентичны. Так, в ионе NH
4
+
три связи N-H образованы по
обменному механизму, а одна - по донорно-акцепторному, однако установить, какой из атомов водорода
выступает в качестве акцептора невозможно, так как все связи в ионе аммония идентичны.
При записи химических формул, связь образованную по донорно-акцепторному механизму, иногда
обозначают не черточкой, а стрелкой, направленной от донора к акцептору.
Представление о насыщаемости связи позволяет достаточно строго сформулировать определение
валентности в соединениях с локализованными ковалентными связями. Валентность в соединениях с
локализованными связями (ковалентность) - это мера способности атома к образованию связи,
количественным выражением которой является число двухэлектронных связей, образуемых атомом за счет
непарных электронов, неподеленных электронных пар и вакантных орбиталей, т.е. по обменному и донорно-
акцепторному механизмам.
В соответствии с этим определением нетрудно оценить валентные возможности и максимальную
валентность атома того или иного элемента. Сразу же отметим, однако, что максимальные валентности не
всегда реализуются в действительности.
Рассмотрим вопрос о валентных возможностях элементов на примере элементов второго периода, для
которых валентными являются 2s- и 2р-орбитали (рис. 8).
Открывающий второй период литий, атом которого имеет один валентный электрон, может образовывать
одну связь по обменному механизму, проявляя валентность, равную единице. В то же время наличие у атома
лития трех вакантных орбиталей позволяет ему образовывать еще три связи по донорно-акцепторному
механизму, в результате чего максимальная валентность лития равна четырем. Правда, соединения
четырехвалентного лития весьма немногочисленны. Подобное соединение, например, образуется при
взаимодействии гидроксида лития с салициловым альдегидом:
O
O
H
H
+ LiOH
2
O
H
O
Li
O
H
H
O
В этой реакции в качестве доноров выступают атомы кислорода, имеющие неподеленные электронные пары.
Атом бериллия не имеет неспаренных электронов в невозбужденном состоянии и, соответственно, в таком
состоянии не образует связи по обменному механизму. В то же время, формально он способен образовать
четыре связи по донорно-акцепторному механизму (одну как донор и три как акцептор), но реально такая схема
взаимодействия для бериллия не зарегистрирована. Однако атом бериллия легко переходит в возбужденное
состояние (необходимая для этого энергия составляет 259 кДж/моль), в котором проявляет максимальную
валентность, равную четырем, так как способен образовывать две связи по обменному механизму и две по
дононорно-акцепторному, выступая в качестве акцептора. Примером частицы, в которой бериллий реализует
максимальную валентность, может служить ион [BeF
4
]
2-
.
Элемент Распределение Максимальная валентность Примеры
49
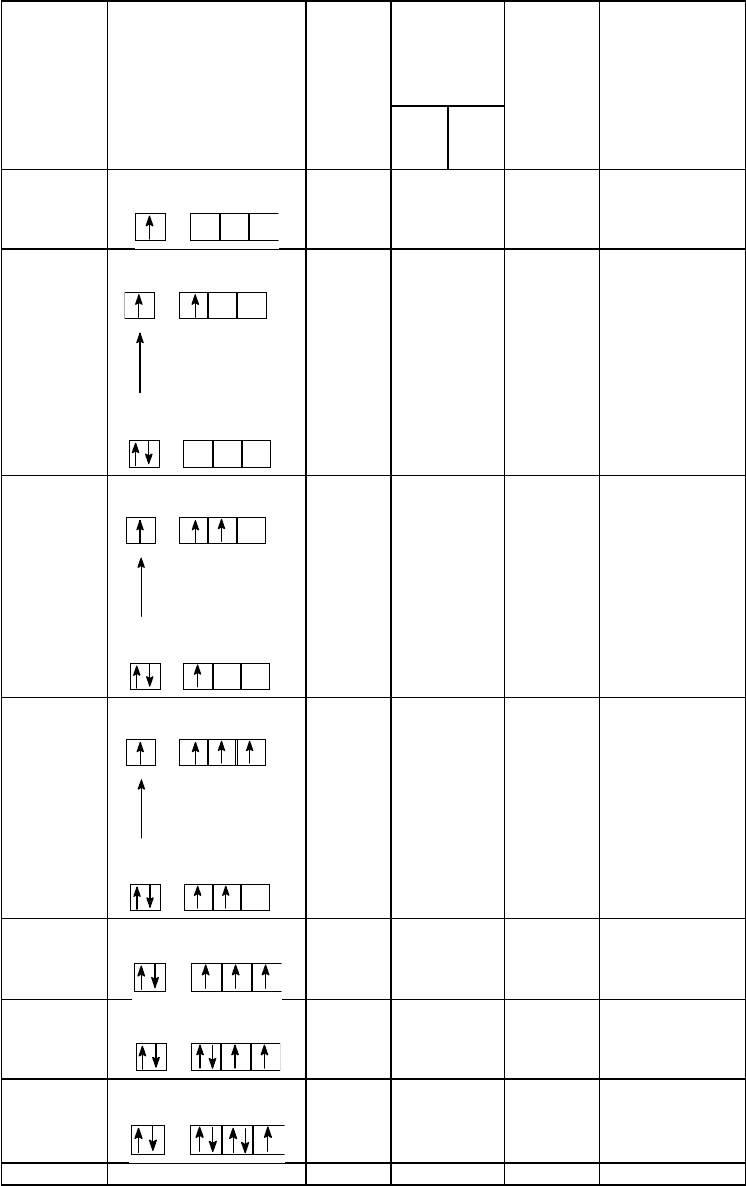
электронов соединений
По
обменн
ому
механи
зму
По
донорно-
акцеп-
торному
механизму
Общая
До-
нор
Ак-
цеп
тор
Li
2s 2p
1 0
1 - 3 4 LLiLH *
)
Be
259 кДж/моль
2s 2p
2 0
11
2p2s
2 - 2 4 [BeF
4
]
2-
B
2s 2p
1 2
12
2p2s
531 кДж/моль
3 - 1 4 [BF
4
]
1-
C
402 кДж/моль
2s 2p
2 2
31
2p2s
4 - - 4 CF
4
N
2s 2p
2 3
3 1 - 4 [NH
4
]
1+
O
2s 2p
2 4
2 2 - 4 Be
4
O(Ac)
6
*
)
F
2s 2p
2 5
1 3 - 4 Нет
Ne 2s
2
2p
6
- 4 - 4 Нет
*) (LH - C
6
H
4
(OH)CHO, Ac - CH
3
COO
-
Рис. 8. Распределение электронов на валентных подуровнях и максимальные значения валентности для
элементов второго периода
Валентные возможности остальных элементов второго периода, реализуемые различными путями, показаны
на рис. 8. Как следует из рис. 8, для всех элементов рассматриваемого периода максимальное значение
50
