Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

аналогию. Так, например, молибден ([Kr]
36
4d
5
4s
1
и вольфрам [Xe]
54
4f
14
5d
4
6s
2
) являются электронными аналогами,
хотя их электронные формулы отличаются по структуре как внешнего, так и внутренних электронных слоев.
Различают полные и неполные электронные аналоги. Полные аналоги имеют аналогичные электронные
конфигурации в любых степенях окисления. Неполные электронные аналоги характеризуются сходными
электронными конфигурациями лишь в некоторых степенях окисления.
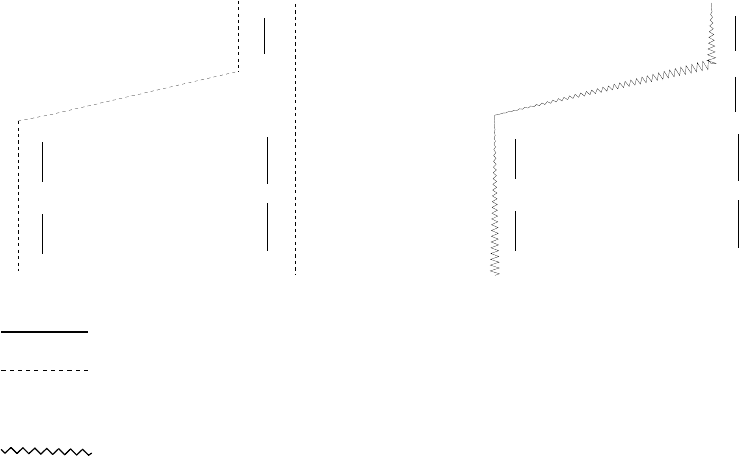
Рассмотрим деление группы на подгруппы электронных аналогов на примере VI группы. Как следует из рис.
4., в группе VI можно выделить три подгруппы полных электронных аналогов, соединенных сплошными линиями.
Первая из них включает кислород и серу, вторая - селен, теллур и полоний, третья - хром, молибден и
вольфрам; электронные конфигурации атомов в любой из этих подгрупп аналогичны, независимо от степени
окисления. Так, все элементы подгруппы селена в степени окисления -2 имеют конфигурацию ns
2
np
6
, в степени
окисления +4 - ns
2
np
2
, в степени окисления +6 - (n-1)d
10
. В то же время элементы VI группы образуют две
подгруппы неполных аналогов. В одну из них входят кислород, сера, селен, теллур и полоний, соединенные на
рис. 4 прерывистой линией. Эти элементы имеют аналогичные электронные конфигурации во всех степенях
окисления, кроме высшей. Действительно, в степени окисления +6 сере отвечает электронная формула [Ne]
10
, а
селену - [Ar]
18
3d
10
, хотя во всех остальных степенях окисления (-2, +4) электронные конфигурации сравниваемых
элементов позволяют считать их аналогами. Вторую подгруппу неполных электронных аналогов образуют
кислород, сера, хром, молибден и вольфрам (пунктирная линия на рис. 4). Для этой подгруппы аналогичные
электронные конфигурации отвечают лишь высшей степени окисления элемента: как видно на рис. 4 в степени
окисления +6 все они имеют конфигурацию благородного газа.
На такие же подгруппы электронных аналогов подразделяются также III-V и VII группы периодической
системы, т.е. все группы, состоящие из p- и d-элементов. Группы, включающие s- и d-элементы, имеют несколько
иную структуру. В этом случае все элементы А-подгруппы являются полными электронными аналогами, в
результате чего в группе могут быть выделены две подгруппы полных электронных аналогов и одна подгруппа
неполных аналогов, объединяющая первые два элемента А-подгруппы и все элементы В-подгруппы: эти
элементы имеют аналогичные конфигурации только в нулевой степени окисления. На рис. 4 показана структура I
группы периодической системы; в этой группе подгруппы полных электронных аналогов образуют элементы
литий, натрий, калий, рубидий, цезий и медь, серебро, золото, а подгруппа неполных аналогов (волнистая линия
на рис. 4.) объединяет литий, натрий, медь, серебро и золото - элементы, имеющие в нулевой степени
окисления электронную конфигурацию ns
1
.
VIII группа, включающая элементы с разным числом валентных электронов, естественно, имеет иную
структуру. Она состоит из пяти подгрупп полных электронных аналогов (неон, аргон; криптон, ксенон, радон;
железо, рутений, осмий; кобальт, родий, иридий; никель, палладий, платина) и одной подгруппы неполных
электронных аналогов (неон, аргон, железо, рутений, осмий) с конфигурацией благородного газа в степени
окисления +8.
Электронная аналогия представляет собой еще более узкий тип аналогии, нежели типовая.
VI группа I группа
Cr [Ar]
18
3d
5
4s
1
Mo [Kr]
36
4d
5
5s
1
W [Xe]4f
14
5d
4
6s
2
O [He]2
2
s
2
2p
4
S [Ne]
10
3s
2
3p
4
Se [Ar]
18
3d
10
4s
2
4p
4
Te [Kr]
36
4d
10
5s
2
5p
4
Po [Xe]
54
4f
14
5d
10
6s
2
6p
4
Cu [Ar]
18
3d
10
4s
1
Ag [Kr]
36
4d
10
5s
1
Au [Xe]
54
4f
14
5d
10
6s
1
Li [He]
2
2s
1
Na [Ne]
10
3s
1
K [Ar]
18
4s
1
Rb [Kr]
36
3s
1
Cs [Xe]
54
6s
1
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
....................
полные электронные аналоги;
- аналоги во всех степенях окисления, кроме высшей;
аналоги в высшей степени окисления;
- аналоги в нулевой степени окисления.
31
Рис. 4. Подгруппы электронных аналогов в VI и I группе периодической системы
3.4.4. Слоевая аналогия.
Сопоставление свойств электронных аналогов приводит к выводу, что даже в подгруппах полных аналогов
уровень близости разных элементов по свойствам не одинаков. Наиболее резко это проявляется в подгруппах,
образованных элементами малых периодов (типическими элементами), в которых элемент II периода,
существенно отличается как от элемента III, так и от всех последующих элементов подгруппы полных или
неполных электронных аналогов. Так, неметалл бор значительно отличается по свойствам как простого
вещества, так и соединений от типичного металла алюминия, кислород отличается от серы, фтор - от хлора. Это
явление получило объяснение в свете представлений о кайносимметричных и палинсимметричных орбиталях
(кайнос - новый, палинос - старый, греч.).
Кайносимметричными орбиталями называются орбитали, для которых впервые реализуется то или
иное значение орбитального квантового числа. Такова, например, орбиталь 1s, для которой впервые
реализуется значение , равное нулю, 2р-орбитали, в случае которых впервые приобретает значение единица,
орбитали подуровней 3d, 4f и т.д. Орбитали той же симметрии, для которых данное значение реализуется во
второй, в третий и т.д. раз, относятся к палинсимметричным орбиталей (например, 2s-, 3p-, 4d-орбитали). Общей
особенностью кайносимметричных орбиталей является наличие лишь одного максимума на кривой радиальной
электронной вероятности. Электроны на кайносимметричных орбиталях не экранируются заполненными
электронными структурами того же типа, в силу чего прочность связи таких электронов с ядром повышена.
Элементы, в атомах которых происходит заполнение кайносимметричных орбиталей валентными
электронами, называются кайносимметричными элементами (кайносимметриками), в отличие от
палинсимметричных элементов (палиносимметриков), в атомах которых заполненные кайносимметричные
орбитали не являются валентными. Кайносимметричные элементы заметно отличаются по свойствам от своих
палинсимметричных аналогов. В частности, для кайносимметриков характерно уменьшение орбитальных
радиусов, повышение энергии ионизации; кайносимметрики зачастую не реализуют высшую степень окисления,
соответствующую номеру группы и числу валентных электронов (кислород, фтор). Отличие кайносимметриков от
палинсимметриков той же группы проявляется тем резче, чем меньше орбитальное квантовое число
кайносимметричных орбиталей. Так, водород, имеющий один электрон на кайносимметричной 1s-орбитали,
обладает уникальными свойствами, о чем уже говорилось выше; р-элементы II периода тоже весьма сильно
отличаются от своих аналогов из III периода. Аналогичное явление, но проявляющееся значительно слабее,
наблюдается для d-элементов IV периода: например, отличие железа от рутения очевидно, но оно не столь
значительно, как отличие бора от алюминия.
В некоторой степени на свойства элементов влияет наличие заполненных электронами предвнешних
кайносимметричных орбиталей, однако этот эффект проявляется значительно слабее. Так, например, литий
(1s
2
2s
1
) не является кайносимметриком, однако кайносимметричные электроны на 1s-орбитали влияют на
свойства этого элемента, обуславливая его отличия от натрия и других щелочных металлов (относительно
низкая термическая устойчивость гидроксида, малая растворимость карбоната, фосфата и т.д.).
Влияние кайносимметричных электронов на свойства элементов позволяет выделить еще один вид аналогии
- слоевую аналогию, проявляющуюся в подгруппах слоевых аналогов. Слоевые аналоги - это типовые аналоги,
не имеющие электронов на внешних и предвнешних кайносимметричных орбиталях.
Рассмотрим слоевую аналогию на примере элементов IIА-подгруппы. В этой подгруппе все элементы
являются полными электронными аналогами, однако бериллий и магний по свойствам существенно отличаются
от щелочноземельных металлов - кальция, стронция и бария. Так, бериллий и магний не взаимодействуют с
холодной водой; им соответствуют малорастворимые гидроксиды; сульфаты бериллия и магния растворимы в
воде; гидриды рассматриваемых металлов являются полимерными соединениями с трехцентровыми связями
Ме-Н-Ме. Щелочноземельные металлы активно вытесняют из воды водород, их гидроксиды являются щелочами;
сульфаты щелочноземельных металлов малорастворимы, а гидриды имеют ионную кристаллическую решетку.
Эти отличия в свойствах могут быть объяснены тем, что кальций, стронций, барий и радий являются слоевыми
аналогами, тогда как бериллий и магний не могут быть к таковым отнесены: бериллий в предвнешнем слое
имеет кайносимметричную 1s-орбиталь, а магний - кайносимметричные орбитали 2р-подуровня. В то же время
бериллий и магний, имеющие в предвнешнем слое разные кайносимметричные орбитали, отличаются по
свойствам и друг от друга. Так, бериллий способен взаимодействовать со щелочами, а магний - нет, гидроксид
бериллия амфотерен, тогда как гидроксид магния проявляет только основные свойства.
Аналогично, используя представление о слоевой аналогии, можно объяснить отличие лития и натрия от
остальных щелочных металлов.
3.4.5. Контракционная аналогия (шринк-аналогия).
Этот тип аналогии проявляется в IVB-VIIIB-подгруппах периодической системы. В этих подгруппах первый
элемент заметно отличается от второго, тогда как второй и третий очень близки по свойствам как простых
веществ, так и их соединений. Подобные "элементы-близнецы" называют контракционными аналогами или
шринк-аналогами (от англ. - shrink, съеживаться).
Существование шринк-аналогов обусловлено, с одной стороны, лантаноидным сжатием (см.раздел 3.3.),
благодаря которому радиусы атомов элементов подгруппы, относящихся к V и VI периодам близки, что влечет за
собой сходство других свойств. В то же время, формирование в VI периоде f-экрана понижает энергию
проникающих к ядру валентных электронов. Наличие у атомов элементов IV периода кайносимметричных 3d-
орбиталей усиливает отличия от их аналогов в V периоде. Например, в подгруппе VIB шринк-аналогами
32
являются молибден и вольфрам, элементы весьма похожие один на другой, но отличающиеся от хрома. Так,
хром окисляется в водных растворах катионами водорода, в то время как молибден и вольфрам устойчивы к
действию кислот, являющихся окислителями по катиону. Соединения хрома в степени окисления +6 являются
сильнейшими окислителями, высший оксид хрома CrO
3
активно взаимодействует с водой, образуя растворимые
хромовые кислоты; соединения молибдена(VI) и вольфрама(VI) окислителями не являются, их триоксиды не
реагируют с водой, молибденовые и вольфрамовые кислоты - малорастворимые соединения. Для хрома весьма
типичны степени окисления +2 и +3; для молибдена и вольфрама эти степени окисления проявляются редко, а
соответствующие соединения являются кластерами, содержащими агрегаты ковалентно связанных атомов
металла.
3.4.6. Горизонтальная аналогия.
Некоторые элементы, относящиеся к одному периоду, и, естественно, не являющиеся ни типовыми, ни
электронными аналогами, тем не менее, обнаруживают значительное сходство друг с другом. Горизонтальная
аналогия наблюдается у d- и f-элементов с более чем наполовину заполненными электронными подуровнями.
Примером горизонтальных аналогов могут служить железо, кобальт и никель, которые при различных
электронных конфигурациях ([Ar]
18
3d
6
4s
2
, [Ar]
18
3d
7
4s
2
и [Ar]
18
3d
8
4s
2
) обладают определенным сходством.
Существование горизонтальной аналогии объясняется тем, что в рядах d- и f-элементов изменение свойств с
увеличением заряда ядра замедляется (вспомним хотя бы то, что все d- и f-элементы являются металлами).
Особенно медленно изменяются свойства во второй половине рядов, где в квантовых ячейках подуровней
происходит образование электронных пар. С другой стороны, горизонтальными аналогами обычно являются
элементы, не реализующие свою высшую степень окисления, отвечающую числу валентных электронов. Так,
для железа число валентных электронов равно восьми, для кобальта - девяти, для никеля - десяти. Однако для
всех этих элементов наиболее характерны степени окисления +2 и +3; железо может проявлять степень
окисления +6, а кобальт и никель - +4: но подобные соединения относительно редки и обычно неустойчивы. В
результате для железа, кобальта и никеля формулы основных классов соединений однотипны (например, МеО,
Ме
2
О
3
, Ме(ОН)
2
, Ме(ОН)
3
и т.д.), а свойства этих соединений, равно как и простых веществ, близки.
Аналогичное явление наблюдается и для платиновых металлов. Триады рутений, родий, палладий и осмий,
иридий, платина являются горизонтальными аналогами. В то же время пары рутений-осмий, родий-иридий,
палладий-платина относятся к шринк-аналогам. В результате все платиновые металлы близки по свойствам.
В ряду лантаноидов элементы подсемейства церия (Ce-Gd) сильнее отличаются друг от друга по свойствам,
чем элементы подсемейства тербия (Tb-Lu); это явление также связано с горизонтальной аналогией.
3.4.7. Диагональная аналогия.
Как указывалось в разделе 3.3, тенденция изменения свойств элементов противоположна для периодов и
подгрупп. В связи с этим можно ожидать проявления определенного сходства между элементами,
располагающимися в периодической системе по диагонали. Этот вид аналогии называют диагональной. Для
проявления диагональной аналогии необходимо, чтобы то или иное свойство изменялось при перемещении на
одно место в периоде и на одно место в группе на одну и ту же по абсолютному значению величину. Это условие
более или менее удовлетворительно выполняется лишь для пар бериллий-алюминий, бор-кремний и, в меньшей
степени, литий-магний. Диагональные аналоги не являются ни типовыми, ни электронными аналогами, для них
характерны разные степени окисления; формулы образуемых ими оксидов, гидроксидов, кислот, солей, гидридов
и других соединений не являются однотипными, однако некоторые общие признаки им присущи. Так,
электроотрицательность бериллия и алюминия, элементов разных групп и периодов, практически совпадает
(1,57 и 1,61 по Полингу), и бериллий, и алюминий - легкие, не корродирующие на воздухе металлы,
взаимодействующие как с кислотами, так и со щелочами; они образуют амфотерные оксиды и гидроксиды. Соли
бериллия и алюминия аналогичны по растворимости, гидриды обоих металлов - полимерные соединения,
являющиеся активными восстановителями.
Учет рассмотренных выше типов аналогии, присущих периодической системе, и закономерностей изменения
свойств элементов в периодах и подгруппах необходим для более достоверного прогнозирования свойств
элементов и их соединений.
4. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
4.1. Элементарные частицы
Атомное ядро - это центральная часть атома, в которой сосредоточена основная масса последнего (около
99,9%). Ядра атомов представляют собой сложные образования, структурными элементами которых являются
элементарные (фундаментальные) частицы.
В настоящее время известно свыше 350 элементарных частиц, различающихся по массе, заряду, спину,
устойчивости и другим характеристикам. Они могут быть классифицированы по присущим им типам
взаимодействия. Можно выделить четыре типа взаимодействий: гравитационные, электромагнитные, слабые и
сильные ядерные взаимодействия. Гравитационные взаимодействия присущи всем элементарным частицам и
не могут быть использованы для их классификации. Электромагнитные взаимодействия осуществляются на
любых расстояниях и протекают за время, превышающее 10
-16
с. Слабые взаимодействия примерно в 100 раз
слабее электромагнитных; они характеризуются конечным радиусом действия и временем, превышающим 10
-10
с. Сильные взаимодействия превышают слабые примерно в 10
13
раз; радиус действия и время протекания их
чрезвычайно малы (величины порядка 10
-3
пм и 10
-23
с). Примеры сильных и слабых взаимодействий будут
приведены ниже.
По типам взаимодействия элементарные частицы делят на три группы:
33
1. Фотон. Единственная частица, участвующая, наряду с гравитационными, только в электромагнитных
взаимодействиях.
2. Лептоны. Частицы, участвующие как в электромагнитных, так и в слабых взаимодействиях. К лептонам
относят 6 частиц: электрон, мюон, -лептон и три вида нейтрино, соответствующих каждой из указанных выше
частиц.
3. Адроны. Частицы, участвующие во всех видах взаимодействий. Адронов известно более двухсот. Они
подразделяются на мезоны, имеющие нулевой или целый спин (в единицах ) и барионы, частицы с полуцелым
спином. К мезонам, в частности, относятся -мезоны или пионы, а к барионам протон и нейтрон.
Каждой элементарной частице соответствует античастица, отличающаяся от частицы знаком заряда или,
при отсутствии последнего, знаком проекции спина частицы на направление магнитного поля; в некоторых
случаях античастицы тождественны частицам.
Излагаемая в следующем разделе теория строения атомного ядра предполагает знакомство с такими
элементарными частицами, как фотон, электрон и отвечающая ему античастица позитрон, электронное нейтрино
и соответствующее ему антинейтрино, протон, нейтрон и -мезоны. Некоторые характеристики этих частиц
(заряд, масса, спин, период полураспада) сопоставлены в табл. 10.
Как следует из табл. 10, фотон, электрон, позитрон, протон, нейтрино и антинейтрино являются стабильными
частицами. Нейтрон вне атомного ядра неустойчив. Распад нейтрона протекает по уравнению
n p + e
-
+
ν
~
и является примером слабого взаимодействия; среднее время жизни нейтрона - 1040 с. Еще менее устойчивы
пионы: среднее время жизни для
+
и
-
составляет 2,5610
-8
с, а для
0
- 2,3110
-16
с.
Позитрон и пи-мезон минус являются античастицами в отношении электрона и пи-мезон плюс, от которых
отличаются зарядом. Подобные античастицы при столкновении с соответствующей частицей подвергаются
аннигиляции; при этом масса частиц полностью превращается в электромагнитное излучение. Так,
взаимодействие электрона и позитрона протекает по уравнению
e
-
+ e
+
2h
с образованием двух фотонов.
Нейтрино и антинейтрино, не имеющие заряда частицы исчезающе малой массы, отличаются по знаку
проекции спина на направление магнитного поля.
Элементарные частицы не следует, однако, рассматривать как некий предел делимости материи. В
настоящее время успешно развивается теория строения адронов. Полагают, что все адроны построены из шести
субъядерных частиц, получивших название кварков и антикварков (М. Гел-Манн и Г. Цвейг, 1964). Так мезоны
являются дикварками (сочетание кварка и антикварка), барионы - трикварками. В рамках кварковой теории число
"истинных" элементарных частиц ограничивается фотоном, лептонами и шестью кварками. Заметим, однако, что
попытки выделить свободные кварки до сих пор не увенчались успехом.
Таблица 10.
Характеристики некоторых элементарных частиц
Частица
Символ
Заряд,
эл.е.з.
Масса покоя
Спин,
Период,
полурас-
пада, с
кг а.е.м. Эл.е.м.
Фотон 0 0 0 0 1
Лептоны
Электрон е
-
-1 9,1095310
-31
5,4858010
-4
1 1/2
Позитрон е
+
+1 9,1095310
-31
5,4858010
-4
1 1/2
Нейтрино
0 4,510
-34
310
-7
510
-4
1/2
Антинейтрин
о
ν
~
0 4,510
-34
310
-7
510
-4
1/2
Адроны
Пи-мезон
плюс
+
+1 2,4896310
-28
0,14991 273,3 0 1,810
-8
Пи-мезон
минус
-
-1 2,4896310
-28
0,14991 273,3 0 1,810
-8
Пи-мезон
нуль
0
0 1,2297910
-28
0,07405 135,0 0 1,610
-16
Протон р +1 1,6726410
-27
1,00728 1836,1 1/2
Нейтрон n 0 1,6749610
-27
1,00867 1838,7 1/2 720
4.2. Теория строения атомных ядер
В настоящее время общепринятой является протонно-нейтронная теория атомных ядер (Д. Иваненко, В.
Гейзенберг, 1932), которая может быть сведена к следующим основным положениям:
1. Ядро состоит только из протонов и нейтронов; легкие элементарные частицы (электроны, позитроны,
мезоны) не могут сколько-нибудь долго находиться в ядре; при образовании подобных частиц они тут же либо
34

поглощаются другими частицами, либо покидают ядро в процессе радиоактивного распада. Протон и нейтрон
объединяют под общим названием нуклон. Число нуклонов в атомном ядре называется массовым числом (А).
Поскольку массы как протона, так и нейтрона в а.е.м. близки к единице, массовое число ядра равно атомной
массе, округленной до целого числа. Число протонов в ядре (Z) равно заряду ядра, совпадающему с порядковым
номером элемента в периодической системы, число нейтронов можно определить по следующей формуле:
N
n
= A - Z
При записи формул атомных ядер (нуклидов) верхним левым индексом при химическом символе элемента
указывается массовое число, нижним левым - число протонов, например,
O
16
8
.
Сопоставление значений А, Z и N
n
для различных ядер позволяет выделить определенные группы нуклидов,
из которых важнейшими являются:
а) изобары - нуклиды, имеющие одинаковые массовые числа при разных значениях Z и N
n
(например,
r
96
40
,
96
39
r,
96
38
ZYS
);
б) изотопы - нуклиды, имеющие одинаковое число протонов при разном числе нейтронов (например,
PbPb, Pb,
208
82
207
82
206
82
);
в) изотоны - нуклиды, содержащие одинаковое число нейтронов (например,
CaK, Ar,
40
20
39
19
38
18
).
Термины "изотоп", "изобар", "изотон" распространяются и на атомы, содержащие соответствующие ядра.
2. Протоны и нейтроны являются взаимопревращающимися частицами. В атомных ядрах непрерывно
протекают процессы превращения протонов в нейтроны и нейтронов в протоны в результате обмена пи-
мезонами в соответствии с уравнениями:
p + n n +
+
+ n n + p
n + p p +
-
+ p + n
Эти процессы, в частности обуславливают стабильность атомных ядер, хотя нейтроны, как указывалось
выше, являются нестабильными частицами. В результате протон и нейтрон можно рассматривать как разные
квантово-механические состояния нуклона. Продолжительность существования пи-мезонов в ядре не
превышает
10
-23
- 10
-24
с.
3. Между нуклонами ядра действуют силы притяжения, называемые ядерными силами. Ядерные силы
обусловлены непрерывным взаимодействием нуклонов, состоящем в многократных актах испускания пионов
одними нуклонами и поглощения этих пионов другими нуклонами. При этом мезонами обмениваются не только
пары протон - нейтрон, но и пары протон - протон и нейтрон - нейтрон; в последних случаях во взаимодействии
участвует пи-мезон нуль. Ядерные силы, таким образом, не зависят от заряда нуклонов. Ядерные силы
относятся к сильным взаимодействиям: их действие проявляется лишь на расстояниях порядка 10
-3
пм и очень
быстро падает при удалении нуклонов друг от друга. Ядерные силы чудовищно велики. Так, например, сила
притяжения между двумя протонами на расстоянии 10
-3
пм в 100 раз больше их электростатического
отталкивания и в 10
38
раз превышает их гравитационное взаимодействие. Следствием этого являются малые
размеры атомных ядер и фантастические высокая плотность ядерного вещества. Если атомы характеризуются
радиусами порядка 100 пм, то радиусы ядер составляют величины порядка 10
-3
-10
-2
пм. Плотность ядерного
вещества достигает 10
14
г/см
3
; напомним, что плотность наиболее тяжелого металла осмия равна 22,5 г/см
3
.
Наряду с ядерными силами в ядре действуют также электростатические силы отталкивания одноименно
заряженных протонов, понижающие устойчивость ядер, особенно имеющих высокий заряд. Элементы с
порядковыми номерами 84 и выше вообще не имеют стабильных изотопов. Лишенные зарядов нейтроны
стабилизируют ядра, ослабляя взаимное отталкивание протонов. С увеличением зарядов ядер отношение N:Z в
них возрастает; у элементов начала периодической системы оно близко к единице и с увеличением порядкового
номера повышается до 1,6 у урана.
4. Расщепление ядра на нуклоны требует преодоления ядерных сил и сопровождается поглощением
энергии. Энергия, которую необходимо затратить, чтобы расщепить ядро на отдельные нуклоны, называется
энергией связи ядра (Е
св
). Такое же количество энергии выделяется при синтезе ядра из нуклонов. Энергию
связи, отнесенную к одному нуклону, называют средней (удельной) энергией связи ядра.
< E
E
А
св
св
Значения средней энергии связи, в отличие от Е
св
, изменяются в относительно узких пределах, составляя
для большинства ядер 6-8 мЭв на каждый нуклон. Максимальные значения <Е
св
> отвечают элементам середины
периодической системы, достигая 8,8 мЭв, что соответствует выделению до 850 млн. кДж на моль
взаимодействующих нуклонов и многократно превышает тепловые эффекты обычных химических реакций.
Выделение столь значительных количеств энергии в соответствии с уравнением Эйнштейна должно ощутимо
сказаться на изменении массы системы. Уменьшение массы ядра сравнительно с массой входящих в состав
ядра нуклонов называется дефектом массы. Дефект массы может быть рассчитан по формуле
m = Zm
p
+ Nm
n
- M
x
35

где m
p
и m
n
- массы протона и нейтрона, M
x
- масса синтезированного ядра. Так, например, для ядра
2
4
He
значение М
х
равно разности масс атома гелия и двух электронов, входящих в этот атом.
М
х
= 4,00260 - 20,00055 = 4,0015 а.е.м.
Тогда
m = 21,00728 + 21,00867 - 4,0015 = 0,0304 а.е.м.
т.е. около 0,8% от массы ядра. Найденному дефекту массы соответствует выделение 28 мЭв энергии на каждое
ядро гелия или 2,710
9
кДж на моль синтезированного гелия.
Атомное ядро является квантово-механическим объектом. Однако разработка законченной квантово-
механической теории атомных ядер встречает серьезные затруднения, связанные как с ограниченностью
сведений о природе ядерных сил, так и с чисто математическими трудностями. Поэтому для объяснения свойств
ядер широко используются модельные представления. Одной из наиболее приемлемых моделей ядра является
оболочечная модель, в известной мере уподобляющая атомное ядро атому (М. Гепперт-Майер, 1948).
Оболочечная модель базируется на предположении, что ядро имеет ряд дискретных ядерных уровней, емкость
которых определяется значениями ядерных квантовых чисел. Эти уровни заполняются нуклонами в соответствии
с правилами квантовой механики, подобно тому как атомные энергетические уровни заполняются электронами.
Не останавливаясь детально на вопросе о квантовании нуклонов, укажем, что полному заполнению ядерных
энергетических уровней соответствуют числа нуклонов, равные 2, 8, 14, 20, 28, 50, 82, 126 и 184. Эти числа
называют магическими; ядра, в которых они реализуются, получили название магических ядер. Эти ядра в какой-
то мере аналогичны атомам благородных газов в периодической системе. Различают ядра, магические по
протонам (например,
28
59
Ni, Sn
50
120
), по нейтронам (например,
BaSr,
136
56
88
38
) и дважды магические ядра,
примерами которых могут служить
PbCa, Si, O, He,
208
82
40
20
28
14
16
8
4
2
. Магические ядра характеризуются большой
устойчивостью и распространенностью в природе сравнительно с ядрами, энергетические уровни которых не
завершены.
4.3. Ядерные реакции
Ядерными реакциями называются превращения атомных ядер, обусловленные их взаимодействием с
элементарными частицами или другими ядрами. В отличие от химических реакций, ядерные реакции всегда
сопровождаются изменением элементного или изотопного состава.
Обычным методом осуществления ядерных реакций является метод бомбардировки, при котором ядра
вещества-мишени подвергаются действию пучка тех или иных частиц, энергия которых достаточна для
преодоления электростатического отталкивания одноименно заряженных частиц. Для получения пучков частиц,
обладающих высокой скоростью и энергией, используют разнообразные ускорители (циклотроны,
синхрофазотроны, линейные ускорители). Иногда для бомбардировки используют частицы, образующиеся при
распаде радиоактивных элементов.
Чаще всего в ядерных реакциях принимают участие четыре частицы: две частицы вступают во
взаимодействие, образуя две новые частицы. Значительно реже наблюдается образование трех и более новых
частиц. Суммы масс и зарядов исходных и образующихся частиц не изменяются (разумеется, без учета дефекта
или приращения масс, соответствующих тепловому эффекту превращения).
Ядерные реакции обычно протекают по схеме:
X + Y U X' + Y'
Взаимодействующие частицы X и Y сливаются в короткоживущее ядро U (так называемое компаунд-ядро),
которое затем распадается на частицы X' и Y'. При записи уравнения ядерных реакций принято указывать
заряды и массовые числа исходных и образующихся ядер. Зачастую используют сокращенную форму записи
подобных уравнений; при этом записывают символы исходного и полученного ядра с указанием массовых чисел,
а между ними в круглых скобках через запятую указывают символы бомбардирующей и образующейся легких
частиц. При такой форме записи ядро
He
4
2
обозначается символом , ядро дейтерия
H
2
1
(дейтрон или
дейтон) - символом d, электрон и позитрон – символами
-
и
+
.
Ядерные реакции классифицируют по природе бомбардирующих частиц. Можно выделить 6 групп ядерных
реакций, соответствующих использованию для бомбардировки нейтронов, протонов, фотонов (-квантов),
дейтронов, ядер гелия и многозарядных тяжелых ионов. Ниже приведены примеры ядерных реакций указанных
типов.
He+ Li= n + B
4
2
7
3
1
0
10
5
или
10
B(n,)
7
Li
n+ Zn = H+ Cu
1
0
63
30
1
1
63
29
или
63
Cu(p,n)Zn
H+ Mg= γ+ Al
1
1
26
12
27
13
или
27
Al(,p)
26
Mg
He+ Na= H+ Mg
4
2
22
11
2
1
24
12
или
24
Mg(d,)
22
Na
H+ O= He+ N
1
1
17
8
4
2
14
7
или
14
N(,p)
17
O
n4 +Ku = Ne+ Pu
1
0
260
104
22
10
242
94
или
242
Pu(22Nе,4n)
260
Ku
36

К ядерным реакциям относятся также термоядерные процессы - реакции синтеза тяжелых ядер из более
легких. Термоядерным реакциям соответствуют огромные тепловые эффекты, однако для начала протекания
таких реакций необходимы очень высокие температуры (порядка 10
6
К и выше). Простейшей термоядерной
реакцией является синтез ядер гелия из протонов:
22e + He H4
+
4
2
1
1
Эта реакция протекает в несколько стадий и является источником энергии многих звезд, в том числе и
Солнца. Неуправляемая термоядерная реакция синтеза гелия осуществляется при взрыве водородной бомбы.
4.4.Радиоактивность. Типы радиоактивного распада
Радиоактивность - это явление самопроизвольного распада неустойчивых атомных ядер,
сопровождающееся корпускулярным или электромагнитным излучением.
Явление радиоактивности было открыто французским физиком А. Беккерелем в 1896 г. при работе с ураном
и его соединениями; фундаментальное изучение этого явления связано с именами Марии и Пьера Кюри,
выделившими из урановых руд радиоактивные элементы полоний и радий, являющиеся в миллионы раз более
мощными излучателями, чем уран. М. Кюри предложен и сам термин радиоактивность. Связь радиоактивности с
распадом атомных ядер была установлена Э. Резерфордом и Ф. Содди.
Системной единицей радиоактивности является беккерель (Бк). Беккерель равен активности образца, в
котором происходит один акт радиоактивного распада в секунду; размерность беккереля - с
-1
. Часто
используемой несистемной единицей радиоактивности является кюри (Ки), соответствующая радиоактивности 1
г радия; 1 Ки = 3,70010
10
Бк.
Различают естественную и искусственную радиоактивность. Первая присуща изотопам, существующим в
природных условиях, вторая имеет место у ядер, полученных искусственным путем. Существует несколько типов
радиоактивного распада, важнейшими из которых являются -распад, -распад, электронный захват, спонтанное
деление ядра и изомерные переходы.
1. -Распад. Сопровождается испусканием двух протонов и нейтронов в виде ядра гелия
2
4
He
и протекает
по уравнению
Z
A
Z-2
A-4
2
4
X Y + He
Образующиеся при -распаде ядра гелия имеют энергию 4 - 9 мЭв и распространяются со скоростью порядка
210
7
м/с. -Распад особо характерен для элементов с высокими значениями заряда ядра. Все элементы,
располагающиеся в периодической системе после висмута, имеют изотопы, подвергающиеся -распаду.
Примером этого типа распада может служить распад ядер радия:
He+ Rn Ra
4
2
222
86
226
88
В настоящее время известно более двухсот изотопов, подвергающихся -распаду.
2. -Распад. Сопровождается испусканием электрона (
-
-распад) или позитрона (
+
-распад) в соответствии с
уравнениями
~
+ e + Y X
-
A
1+Z
A
Z
или
+ e + Y X
+
A
1-Z
A
Z
Энергия -частиц изменяется в широких пределах (от 0,02 до 16 мЭв). Этот тип радиоактивности присущ как
легким, так и тяжелым элементам; известно свыше тысячи изотопов, для которых характерен -распад. При этом
изотопы одного и того же элемента могут подвергаться как
-
-распаду, так и
+
-распаду. Если масса
радиоактивного ядра больше массы стабильного изотопа данного элемента, то оно обычно подвергается
-
-
распаду, если меньше - то
+
-распаду. Например, масса стабильного изотопа углерода равна 12 а.е.м.; ядра
углерода
C
14
6
и
C
11
6
распадаются по уравнениям:
~
+ e + N C
-
14
7
14
6
+ e + B C
+
11
5
11
6
3. Электронный захват. Ядро поглощает орбитальный электрон, находящийся на одном из низших
энергетических уровней, в результате чего один из протонов ядра превращается в нейтрон:
Y e + X
A
1-Z
A
Z
-
Чаще всего захват электрона происходит с ближайшего к ядру К-слоя (К-захват), реже с L- или М-слоя.
Электронный захват, как и
+
-распад, присущ нейтронодефицитным изотопам. Например, К-захвату
подвергаются ядра
Hgи Be
197
80
7
4
+ Li e + Be
7
3
7
4
-
+Au e + Hg
197
79
197
80
Электронный захват часто рассматривается как третий вид -распада.
37
4. Спонтанное деление ядер. Самопроизвольное деление тяжелого ядра на два (реже на три или четыре)
осколка, являющихся ядрами элементов середины периодической системы. Известно очень мало изотопов, для
которых спонтанное деление является единственным видом радиоактивного распада. Примером таких ядер
может служить изотоп менделевия
Md
259
101
. Обычно ядра, способные к спонтанному делению, одновременно
подвергаются также - или -распаду, являющемуся для них основным. При спонтанном делении образуются
самые разнообразные осколки, однако их массы и заряды чаще всего относятся как 3:2.
5. Изомерный переход. Своеобразный тип радиоактивности, при котором не меняется ни масса, ни заряд
ядра. Он наблюдается тогда, когда образовавшееся ядро оказывается в возбужденном состоянии и имеет
избыточную энергию. Подобные ядра способны переходить в невозбужденные ядра, излучая жесткие
электромагнитные колебания (-кванты). Например, при бомбардировке
Br
79
35
нейтронами происходит
образование метастабильного возбужденного ядра брома-80:
35
79
Br + n Br
0
1
35
80 m
(индекс "m" означает метастабильное возбужденное состояние). Далее возбужденное ядро освобождается от
избытка энергии путем перехода нуклонов на более низкие энергетические уровни:
Br Br +
35
80 m
35
80
Период полураспада
Br
80
35
m
составляет 4,42 ч. Пáры ядер, подобные
Br
80
35
m
и
Br
80
35
, называют ядерными
изомерами.
Таковы наиболее важные типы радиоактивного распада. Заметим, что весьма часто тому или иному изотопу
присущи не один, а несколько типов радиоактивного распада, протекающих параллельно. Так, например, изотоп
Li
9
3
может подвергаться - и -распаду.
4.5. Законы радиоактивного распада
Процессам радиоактивного распада присущи некоторые общие закономерности, важнейшими из которых
являются закон радиоактивной постоянной и правило смещения.
Закон радиоактивной постоянной (основной закон радиоактивного распада) может быть сформулирован в
следующей редакции: число ядер, распадающихся в единицу времени, пропорционально числу имеющихся
радиоактивных ядер. Закон этот обусловлен тем, что распад каждого атомного ядра не зависит от поведения
других ядер.
Пусть за отрезок времени t число радиоактивных ядер изменилось от N
0
до N. В соответствии с законом
радиоактивной постоянной скорость распада в каждый момент времени будет пропорциональна величине N:
=
dt
dN
- =
dt
N) - d(N
0
N (4-1)
или
=
N
dN
-dt (4-2)
Коэффициент пропорциональности в уравнениях (4-1) и (4-2) называется радиоактивной постоянной или
константой радиоактивного распада. Проинтегрировав левую часть уравнения (4-2) в пределах от N
0
до N, а
правую - от нуля до t, получим математическое выражение основного закона радиоактивного распада в
интегральной форме:
N = N
0
e
-
t
(4-3)
Значения радиоактивной постоянной зависят от природы радиоактивного изотопа и изменяются в широких
пределах. Так, например, для
Ra
226
88
радиоактивная постоянная равна 1,3610
-11
с
-1
, а для
Rn
222
86
,
образующегося при -распаде радия, - 2,1010
-6
с
-1
.
Величина, обратная радиоактивной постоянной, называется средним временем жизни ядра =
λ
1
.
Следствием из закона радиоактивной постоянной является правило полураспада: отрезок времени, за
который распадается половина имеющихся радиоактивных ядер, есть величина постоянная для данного
изотопа, называемая периодом полураспада (Т
1/2
).
Действительно, если t = Т
1/2
, то N = 1/2N
0
= 2
-1
N
0
. Отсюда в соответствии с (4-3)
1-
λT-
2 =
N
N
e
0
1/2
или
const =
ln2
= T
1/2
(4-4)
38

Поскольку радиоактивный распад может сопровождаться изменением зарядов ядер, образующиеся при
распаде нуклиды занимают в периодической системе иные места, нежели исходные ядра. Для характеристики
подобных перемещений удобно пользоваться так называемым правилом смещения (К. Фаянс, Ф. Содди, 1913):
Нуклид, образующийся в результате
-распада, смещается в периодической системе на две клетки
влево, а нуклид, образующийся в результате
-
-распада, - на одну клетку вправо от исходного радионуклида.
К этому правилу можно добавить, что позитронный распад и электронный захват смещают ядро на одну
клетку влево, а изомерные переходы не смещают ядра. При этом испускание -частицы изменяет массу ядра и
массовое число на четыре единицы, тогда как -распад на массу ядра не влияет. Пусть, например, ядро
Ra
226
88
последовательно испустило 3 -частицы и один электрон. В соответствии с правилом смещения полученный
нуклид сместится в периодической системе на пять клеток влево от исходного ядра, а масса его уменьшится на
12 единиц. Таким образом, продуктом взаимодействия будет ядро
83
214
Bi
.
4.6. Естественная радиоактивность. Радиоактивные ряды.
Радиоактивное равновесие
Естественные радиоактивные изотопы достаточно многочисленны и содержатся в различных природных
объектах (горные породы, минералы, атмосфера, гидросфера, космические тела). К ним относятся все изотопы
элементов, порядковый номер которых превышает 83, а также некоторые изотопы ряда элементов,
расположенных в периодической системе до урана и в основном представленных стабильными изотопами.
Из тяжелых естественных радионуклидов прежде всего, заслуживают внимания относительно
распространенные в земной коре изотопы урана и тория (
ThU, U,
232
90
235
92
238
92
). В результате непрерывно
протекающего распада ядер этих изотопов Земля получает значительное количество энергии - около 5,710
10
кДж/с (величина соизмеримая с количеством тепла, излучаемого в мировое пространство). За счет именно этой
энергии повышается температура при углублении в земные недра.
При распаде изотопов урана и тория протекает ряд последовательных ядерных превращений, при которых
нуклид, образующийся на определенной стадии, становится исходным ядром для следующей стадии.
Совокупность генетически связанных нуклидов, последовательно образующихся один из другого, называется
радиоактивным рядом. Радиоактивный ряд начинается родоначальником ряда - нуклидом с периодом
полураспада, достаточным для того, чтобы этот изотоп не исчез за время существования земной коры (Т
1/2
> 10
8
лет); ряд завершается каким-либо стабильным изотопом. В настоящее время известны три естественных
радиоактивных ряда, в которых происходят только - и
-
-превращения. Все существующие в земной коре
изотопы тяжелых радиоактивных элементов являются членами этих рядов.
1. Ряд урана. Родоначальником ряда является
U
238
92
с периодом полураспада 4,4710
9
лет; завершает ряд
стабильный изотоп свинца
Pb
206
82
. Превращение осуществляется в 14 стадий (8 -распадов, 6
-
-распадов).
Часть радиоактивного ряда урана приведена ниже:
Pb ... Pa Th U
206
82
234
91
234
90
238
92
(4,4710
9
лет) (24,1 сут) (6,7 ч) (стабилен)
Поскольку изменение массового числа членов ряда происходит только при -распаде, для любого нуклида
ряда справедлива формула A = 4n + 2, где А - массовое число изотопа, n - целое число. Ряд образуют изотопы
таких элементов, как протактиний, радий, радон, астат, полоний, висмут, свинец и таллий.
2. Ряд тория. Открывается изотопом
Th
232
90
(Т
1/2
= 1,4010
10
лет). Ряд включает 10 стадий (6- и 4
-
-
распадов) и заканчивается изотопом
Pb
208
82
. Массовые числа членов ряда отвечают формуле A = 4n.
3. Ряд актиноурана. Актиноуран - одно из названий изотопа
92
235
U
(Т
1/2
= 7,0410
8
лет). В результате 11
ядерных превращений (7, 4
-
) заряд ядра понижается на 10 единиц, а массовое число - на 28, что приводит к
образованию стабильного изотопа свинца
Pb
207
82
. Массовое число членов ряда соответствует формуле А = 4n
+3.
В настоящее время удалось искусственно воссоздать четвертый радиоактивный ряд, образуемый изотопами,
для которых А = 4n + 1. Этот ряд начинается изотопом нептуния
Np
237
93
с периодом полураспада 2,1410
6
лет,
включает 7- и 4
-
-превращений и заканчивается стабильным изотопом
Bi
209
83
. Возможно, что когда-то этот ряд
реализовывался в природе, но в связи с недостаточно большим периодом полураспада
Np
237
93
запасы
последнего исчерпались.
В свете представлений о радиоактивных рядах становится понятным, почему в природных образованиях
можно обнаружить радиоизотопы с малыми периодами полураспада (например, полоний, периоды полураспада
изотопов которого не превышают 102 года, или радон, для самого устойчивого изотопа которого период
полураспада равен 2,8 сут), тогда как некоторые изотопы с периодами распада порядка сотен тысяч и миллионов
лет в природе отсутствуют (например,
Np
237
93
). Действительно, ядра изотопов полония, радона, актиния,
39

являющиеся членами радиоактивных рядов, непрерывно образуются при распаде урана и тория, тогда как
количество ядер нептуния, родоначальника ряда, могло только уменьшаться.
Пусть радиоактивному распаду подвергается образец чистого урана-238. В соответствии с приведенной
выше схемой при распаде ядер
U
238
92
будут образовываться ядра
Th
234
90
, а затем
Pa
234
91
по уравнениям
He +Th = U
4
2
234
90
238
92
(4-5)
ν
~
+ e + Pa =Th
234
91
234
90
(4-6)
В соответствии с законом радиоактивной постоянной в начальный момент времени скорость реакции (4-6)
будет равна нулю, так как ядра
90
234
Th
в системе отсутствуют. По мере образования ядер
90
234
Th
скорость
процесса (4-6) будет увеличиваться вплоть до того момента, когда число образующихся по реакции (4-5) ядер
тория станет равно числу ядер тория, распадающихся по уравнению (4-6):
n
обр
(Th) = n
расп
(Th)
Но число образующихся ядер тория равно числу распадающихся ядер урана-238:
n
обр
(Th) = n
расп
(U)
отсюда
n
расп
(U) = n
расп
(Th)
т.е. в единицу времени распадается одно и то же число ядер урана и тория.
Аналогичное заключение может быть вынесено для всех членов радиоактивного ряда, кроме стабильного
изотопа, этот ряд завершающего (
Pb
205
82
). Система, таким образом, приходит в состояние, когда скорости
распада всех изотопов, образующих радиоактивный ряд, становятся одинаковыми. Это состояние называют
радиоактивным равновесием. Для радиоактивного равновесия справедлив закон Ф. Содди: в ряду
радиоактивных элементов при установлении радиоактивного равновесия количества превращающихся
атомов всех изотопов ряда за одну секунду есть величина постоянная.
Скорость радиоактивного распада, как следует из закона радиоактивной постоянной, пропорциональна числу
имеющихся радиоактивных ядер
v = N
Отсюда в состоянии радиоактивного равновесия для ряда, содержащего n членов, из которых последний
устойчив, справедливо уравнение:
1
N
1
=
2
N
2
=
n-1
N
n-1
= const
или, с учетом уравнения (4-4),
1-n1/2,
1-n
1/2,2
2
1/2,1
1
T
N
= ... =
T
N
=
T
N
(4-7)
Таким образом, чем устойчивее данный изотоп, тем большее число его ядер содержит система в состоянии
радиоактивного равновесия.
Следует отметить, что радиоактивное равновесие не является истинным термодинамическим равновесием и
G для него не равно нулю, поскольку радиоактивный распад не является обратимым процессом (см. раздел
8.4.1).
Уравнение (4-7) может быть использовано для определения периодов полураспада относительно
устойчивых ядер. Так, например, период полураспада
92
238
U
, измеряемый миллиардами лет, трудно
определить непосредственно. Однако его можно установить, зная период полураспада одного из членов ряда и
содержание этого изотопа в системе, например,
Ra
226
88
(Т
1/2
= 1,6110
3
лет). В соответствии с (4-7)
Ra)N(
U)N(
Ra)(T = U)(T
236
88
238
92
238
881/2
238
921/2
В уранините, природном минерале урана, для которого радиоактивное равновесие можно считать
установившимся, отношение ядер урана и радия равно по данным анализа 2,810
6
, отсюда
Т
1/2
(
U
238
92
) = 1,6110
3
2,810
6
= 4,510
9
лет
Естественная радиоактивность присуща и некоторым элементам, имеющим стабильные изотопы. Примером
таких элементов может служить калий, который представлен в земной коре, наряду со стабильным
19
39
K
,
40
