Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


В многоэлектронном атоме электроны внешнего электронного слоя испытывают отталкивание со стороны
электронов более глубоких внутренних слоев, в результате чего энергия валентных электронов повышается, а их
связь с ядром ослабевает. Внутренние электроны как бы экранируют ядро, вследствие чего последнее действует
на валентные электроны так, как будто заряд его меньше действительного, равного порядковому номеру
элемента. Так, для атома натрия ядро с зарядом +11 экранируют 10 электронов, находящихся на 1s-, 2s- и 2р-
подуровнях. Если бы в атоме натрия имел место только эффект экранирования, ядро притягивало валентный
электрон так, как если бы его заряд был равен +1.
2. Эффект проникновения электрона к ядру
Вероятностная модель атома предполагает, что электрон может находиться на любом расстоянии от ядра,
хотя и с разной вероятностью. Наиболее вероятное расстояние между ядром и электроном определяется
положением главного максимума на кривой радиальной вероятности, однако любой электрон, в том числе и
валентный, часть времени пребывает на меньших расстояниях от ядра, как бы погружаясь под внутренние слои
электронов. При этом энергия электрона уменьшается, а притяжение его ядром усиливается, как если бы
произошло увеличение заряда ядра. Кажущийся заряд ядра, соответственно которому ядро действует на
внешние электроны, называется эффективным зарядом ядра (Z
эфф
). Эффективный заряд ядра
Z
эфф
= Z - S
где Z - истинный заряд ядра, а S - константа экранирования, значение которой определяется характером
внутренних подуровней, заполненных электронами. Для атома натрия, например, Z
эфф
= 2,06 эл.ед.
При одинаковом значении главного квантового числа эффект проникновения тем больше, чем больше
максимумов имеет кривая радиальной вероятности. Как указывалось в разделе 1.4, число максимумов на кривой
радиальной вероятности равно (n-). В результате эффект проникновения электрона к ядру максимален для s-
электронов, меньше для р-электронов и еще меньше для d-электронов. Поскольку проникновение электрона к
ядру понижает энергию орбитали, энергия подуровней многоэлектронного атома при одинаковом значении n
будет возрастать в ряду E
ns
<E
np
<E
nd
.... Если сравниваемые подуровни принадлежат разным уровням, то для
оценки их энергии необходимо одновременно учитывать главное квантовое число, увеличение которого
повышает энергетический уровень электрона, и орбитальное число, увеличение которого ослабляет
проникновение электрона к ядру, что также влечет за собой повышение энергии электрона. Оба эти фактора для
большинства атомов позволяет учесть правило, сформулированное В.М. Клечковским: энергетические
подуровни многоэлектронного атома заполняются электронами в порядке возрастания суммы главного и
орбитального квантовых чисел; при равных значениях суммы (n + ) сначала заполняется подуровень с
меньшим значением главного квантового числа.
Располагая подуровни в порядке возрастания суммы (n+) и значений n в этих суммах, получим
последовательность заполнения энергетических подуровней, называемую рядом Клечковского.
Таблица 4.
Главное и орбитальное квантовые числа электронных орбиталей
n+
n
Подуровень
n+
n
Подуровень
1 0 0 1s 6 4 2 4d
2 2 0 2s 5 1 5p
3 2
3
1
0
2p
3s 7
6
4
0
3
6s
4f
4 3 1 3p 5 2 5d
4 0 4s 6 1 6p
5 3 2 3d 7 0 7s
4 1 4p 8 5 3 5f
5 0 5s 6 2 6d
Для составления электронной формулы элемента по Клечковскому достаточно распределить электроны по
подуровням в соответствии с табл. 4, а затем записать подуровни в порядке возрастания главного и
орбитального квантовых чисел. Так, например, для титана (заряд ядра +22) 22 электрона полностью заполнят
подуровни 1s, 2s, 2p, 3s, 3p и 4s (всего 20 электронов); оставшиеся два электрона окажутся на следующем по
энергии подуровне 3d, что приводит к электронной формуле 1s
2
2s
2
2p
6
3s
2
3p
6
3d
2
4s
2
.
Электронные формулы часто записывают в сокращенной форме: входящие в формулу сформированные
подуровни, соответствующие конфигурации благородного газа, обозначают химическим символом этого газа в
квадратных скобках с указанием числа электронов на заполненных подуровнях. При использовании этой формы
записи электронная формула титана примет вид: [Ar]
18
3d
2
4s
2
. Иногда ограничиваются лишь записью строящихся
и достраивающихся подуровней (например, 3d
2
4s
2
для титана).
Электронные формулы по Клечковскому для большинства элементов (особенно I-IV периодов) хорошо
согласуются с экспериментально определенными конфигурациями; из первых 104 элементов, для которых
электронные конфигурации установлены довольно надежно, полное совпадение имеет место для 83, в том числе
21

для всех s- и р-элементов. Большая часть наблюдаемых отклонений связана с явлением так называемого
"провала" электрона, в результате которого электрон переходит с s-подуровня высшего слоя на d-подуровень
предшествующего. Так, по Клечковскому, хрому должна соответствовать электронная формула [Ar]
18
3d
4
4s
2
, тогда
как в действительности этому элементу отвечает конфигурация [Ar]
18
3d
5
4s
1
. Двойной провал электрона
наблюдается у палладия (конфигурация [Kr]
36
4d
10
5s
0
).
У лантаноидов и актиноидов возможны также отклонения, связанные с переходом одного или двух
электронов с (n-2)f-подуровня на (n-1)d-подуровень. Так, например, лантану (Z = +57) отвечает электронная
формула [Kr]
36
4d
10
4f
0
5s
2
5p
6
5d
1
6s
2
, а не [Kr]
36
4d
10
4f
1
5s
2
5p
6
6s
2
, вытекающая из правила Клечковского.
Отклонения некоторых электронных конфигураций от правила Клечковского обусловлены тем, что последнее
учитывает только два квантовых числа (n и l), тогда как состояние электрона определяется четырьмя
квантовыми числами. В результате рассмотренные выше электронные формулы не дают указаний на
распределение электронов по вырожденным орбиталям подуровня. На этот вопрос позволяет ответить правило
Хунда: электроны распределяются по вырожденным орбиталям так, чтобы суммарный спин их был
максимальным. Суммарный спин равен алгебраической сумме значений m
s
всех электронов. Спины электронов с
одинаковыми значениями m
s
называют параллельными, с разными - антипараллельными.
Из правила Хунда можно сделать следующий вывод: при построении подуровня электроны стремятся занять
максимальное число вырожденных орбиталей. При этом электроны сначала заполняют орбитали подуровня по
одному, ориентируя спины параллельно, и лишь после того, как не остается свободных орбиталей, начинают
формироваться электронные пары.
При записи электронных формул вырожденные орбитали обозначают клеточками или горизонтальными
черточками (квантовые ячейки), а спин электрона - стрелками, направленными вверх (m
s
=+1/2, -спин) или вниз
(m
s
= -1/2, -спин). Так, например, электронная формула азота 1s
2
2s
2
2p
3
соответствует трем различным
распределениям электронов по орбиталям 2р-подуровня:
или
В соответствии с правилом Хунда реализуется первая схема, так как ей отвечает суммарный спин 3/2, тогда
как второму и третьему распределению электронов - 1/2.
Установлено, что наиболее устойчивыми являются электронные структуры, отвечающие полностью
заполненным подуровням (p
6
, d
10
, f
14
) и наполовину заполненным подуровням, все орбитали которых заняты
неспаренными электронами с параллельными спинами (p
3
, d
5
, f
7
). Это позволяет объяснить явление провала
электрона: последнее наблюдается тогда, когда переход электрона приводит к появлению устойчивой структуры
на d-подуровне, близкой к структурам d
10
и d
5
. Так, провал электрона в случае хрома приводит к появлению
устойчивой конфигурации d
5
. Конфигурация (n-1)d
9
ns
2
вообще не реализуется ни у одного элемента: она
переходит в более устойчивую конфигурацию (n-1)d
10
ns
1
(медь, серебро, золото).
Пользуясь правилом Клечковского, следует помнить, что оно позволяет установить лишь
последовательность заполнения электронами энергетических уровней, но не реальное распределение этих
подуровней по энергиям в конкретном атоме. В периодах слева направо энергия подуровней понижается, однако
для разных подуровней по-разному. В результате энергия ns-подуровня в атоме может стать выше энергии (n-
1)d-подуровня. Поэтому правилом Клечковского нельзя пользоваться для определения электронных
конфигураций ионов. Так, например, иону Cr
3+
отвечает электронная формула [Ar]
18
3d
3
, а не [Ar]
18
3d
2
4s
1
или
[Ar]
18
3d
1
4s
2
.
3. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА В СВЕТЕ КВАНТОВО-МЕХАНИЧЕСКИХ
ПРЕДСТАВЛЕНИЙ
3.1. Современная формулировка Периодического закона
Периодический закон был открыт Д.И. Менделеевым в 1869 году на основании анализа свойств известных в
то время 63 химических элементов и их соединений. В 1871 году Д.И. Менделеев сформулировал этот закон в
следующей редакции: свойства простых тел, а также формы и свойства соединений элементов находятся в
периодической зависимости от атомных весов элементов.
Открытие общей закономерности, связывающей все химические элементы, во многом определило
дальнейшее развитие химической науки. Периодический закон был открыт эмпирически - уровень развития
естественных наук середины XIX века исключал возможность теоретического обоснования причин
периодичности свойств элементов, - однако само существование подобной закономерности подсказывало, что
объяснение ее следует искать во внутреннем строении атомов элементов. В дальнейшем сформировавшаяся
под влиянием Периодического закона теория строения вещества позволила углубить формулировку
Периодического закона, высветив его связь с квантово-механической картиной микромира, и объяснить
периодический характер изменения свойств элементов и их соединений.
Первым успехом теории строения вещества в развитии Периодического закона явилось установление
физического смысла порядкового номера элемента в периодической системе. В решении данного вопроса
важную роль сыграло изучение рентгеновских спектров излучения элементов. Рентгеновские спектры
значительно проще оптических, они включают небольшое число серий (K,L и т.д.), каждая из которых состоит из
22
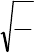
повторяющихся характеристических линий (K
,K
... L
,L
и т.д.), отличающихся для разных элементов лишь
длиной волны. В 1913 году ученик Э. Резерфорда Г. Мозли, сопоставляя спектры различных химических
элементов, обнаружил закономерность, названную впоследствии законом Мозли:
Квадратные корни обратных значений длин волн характеристических линий рентгеновских спектров
находятся в линейной зависимости от порядкового номера элемента в периодической системе. Закон Мозли
выражается следующим уравнением:
1
a(Z - b)
где - длина волны характеристической линии рентгеновского спектра для разных элементов (например, K -
первой линии серии К), Z - порядковый номер элемента, а и b - коэффициенты, постоянные для каждой линии
спектров. Связь рентгеновских спектров со строением атомов очевидна, в силу чего Мозли предположил, что
порядковый номер элемента равен заряду ядра атома этого элемента. Несколько позже предположение Мозли
было экспериментально подтверждено Э. Резерфордом и Дж. Чедвиком, которые, исследуя прохождение -
частиц через платиновую и медную фольгу, доказали тождественность порядкового номера элемента и заряда
ядра атома. Открытия Мозли, Резерфорда и Чедвика позволили по-новому сформулировать Периодический
закон:
Cвойства элементов находятся в периодической зависимости от заряда ядер их атомов. Существуют и
другие формулировки Периодического закона, акцентирующие внимание на различных сторонах вопроса. Одна
из них будет рассмотрена в разделе 3.2.
3.2. Структура периодической системы элементов:
периоды, группы, подгруппы элементов
Периодическая система элементов является графическим выражением Периодического закона.
Структурными фрагментами периодической системы являются множества элементов, свойства которых
изменяются монотонно, и множества аналогичных по свойствам элементов.
Периодическая система построена из периодов, групп и подгрупп элементов. Квантово-механическая теория
позволила дать исчерпывающие определения этим понятиям, вскрыв их физический смысл.
Период - это совокупность элементов, расположенных в порядке возрастания зарядов их ядер, в атомах
которых электроны распределены по одному и тому же числу энергетических уровней. Число уровней, на
которых распределяются электроны, равно номеру периода. Поскольку для находящихся в невозбужденном
состоянии атомов известных элементов электроны заполняют энергетические уровни от первого до седьмого,
периодическая система включает семь периодов. Каждый период содержит определенное число элементов,
регламентируемое принципом Паули, который обуславливает конечную емкость энергетических уровней и
подуровней, и правилом Клечковского, определяющим порядок заполнения уровней и подуровней электронами.
У элементов I периода электроны заполняют первый энергетический уровень. Энергетическая емкость этого
уровня равна двум, соответственно, элементам данного периода отвечают две электронные формулы - 1s
1
и 1s
2
.
Первая из них соответствует атому водорода, вторая - атому гелия. Первый период, таким образом, представлен
двумя элементами.
У следующего элемента - лития - третий электрон находится на 2s-подуровне (конфигурация 1s
2
2s
1
), поэтому
литием открывается II период. В этом периоде последовательно заполняются подуровни 2s (до
двухэлектронного) и 2р (до шестиэлектронного). Второй период содержит, таким образом, 8 элементов и
завершается неоном с электронной формулой 1s
2
2s
2
2p
6
. Аналогично у элементов III периода происходит
заполнение 3s- и 3p-подуровней, начиная с натрия ([Ne]
10
3s
1
) и заканчивая аргоном ([Ne]
10
3s
2
3p
6
). Третий
энергетический уровень включает также подуровень 3d, однако у калия, в соответствии с правилом Клечковского,
девятнадцатый электрон попадает на подуровень 4s, в результате чего калий открывает IV период, а число
элементов в третьем периоде равно восьми. У кальция построение подуровня 4s завершается (электронная
конфигурация [Ar]
18
4s
2
), после чего, начиная со скандия, 21-ого элемента с электронной формулой [Ar]
18
3d
1
4s
2
,
электроны заполняют подуровень 3d, построение которого завершается у цинка ([Ar]
18
3d
10
4s
2
). Далее происходит
заполнение подуровня 4р (ряд элементов от галлия - [Ar]
18
3d
10
4s
2
4p
1
- до криптона - [Ar]
18
3d
10
4s
2
4p
6
).
Соответственно IV период содержит 18 элементов. Аналогично у элементов пятого периода последовательно
застраиваются подуровни 5s, 4d и 5p; число элементов в этом периоде, который открывается рубидием и
завершается ксеноном (конфигурации [Kr]
36
5s
1
и [Kr]
36
4d
10
5s
2
5p
6
), также равно 18. У элементов VI периода
происходит заполнение электронами подуровней 6s, 4f, 5d и 6p, в силу чего этот период содержит 32 элемента.
Однако после заполнения 6s-подуровня очередной электрон у атома лантана поступает на 5d-орбиталь
([Xe]
54
5d
1
6s
2
), вместо ожидаемого по правилу Клечковского заполнения подуровня 4f. Однако у следующих за
лантаном элементов (лантаноидов) происходит постепенное заполнение 4f-орбиталей от 4f
2
у церия до 4f
14
у
иттербия. Исключением является лишь атом гадолиния, имеющий конфигурацию [Xe]
54
4f
7
5d
1
6s
2
вместо
ожидаемой [Xe]
54
4f
8
6s
2
. Это явление может быть объяснено особой устойчивостью наполовину построенного
уровня 4f
7
, в связи с чем конфигурация 4f
7
5d
1
энергетически выгоднее конфигурации 4f
8
.
Теория строения атома отвечает на вопрос об элементах, открывающих и завершающих период. Период
открывается щелочным металлом потому, что в атомах этих элементов начинается построение нового
энергетического уровня (конфигурация ns
1
); период завершается благородным газом, так как благородные газы
имеют завершенную конфигурацию 1s
2
или ns
2
np
6
, после которой начинает строиться уровень (n+1), а значит,
открывается следующий период. На протяжении каждого периода электронные конфигурации изменяются
монотонно без повторения сходных электронных структур; соответственно и свойства элементов в периоде
меняются закономерно от щелочного металла до галогена и благородного газа. Исключением является первый
23
период, содержащий кроме благородного газа гелия, лишь один элемент - водород. В результате у водорода
проявляются признаки, сближающие его как со щелочными металлами (электронная конфигурация, типичная
степень окисления +1, способность образовывать положительно заряженный ион, восстановительные свойства),
так и с галогенами (степень окисления -1, некоторые физические и химические свойства водорода и его
соединений). Первый, второй и третий периоды, состоящие из двух или восьми элементов, называют малыми;
четвертый, пятый и шестой, содержащие 18 или 32 элемента, - большими. Седьмой период по своей структуре
также является большим, однако не все элементы этого периода открыты, в силу чего он является
незавершенным.
Сопоставление электронных структур атомов элементов, расположенных в порядке возрастания зарядов их
ядер, позволяет установить причину периодичности. Периодичность изменения свойств химических элементов
является следствием периодического повторения сходных электронных конфигураций с возрастанием
заряда атомных ядер. Это положение может рассматриваться как еще одна формулировка Периодического
закона.
В зависимости от того, подуровни какого типа строятся у данного атома (s, p, d или f), различают s-, p- ,d- и f-
элементы.
Периодический характер изменения свойств элементов, являющийся следствием периодичности повторения
сходных электронных конфигураций, приводит к появлению совокупности элементов, обладающих в той или
иной мере сходными свойствами. Наиболее широким типом подобных множеств элементов являются группы
периодической системы. Группа - это совокупность элементов с одинаковым числом валентных электронов,
т.е. электронов на орбиталях высшего уровня и на недостроенных внутренних подуровнях.
В периодической системе можно выделить семь групп, отвечающих приведенному выше определению, для
которых номер группы совпадает с числом валентных электронов; эти группы открываются такими элементами
как литий, бериллий, бор, углерод, азот, кислород, фтор. К первой группе по числу валентных электронов
следовало бы отнести также водород, однако этот элемент, как уже отмечалось, по физическим и химическим
свойствам стоит ближе к галогенам, чем к щелочным металлам. С галогенами водород сближает и то, что для
построения структуры благородного газа ему не хватает одного электрона. В силу этого водород относят и I, и к
VII группе. Лантаноиды и актиноиды по группам не распределяют, а выносят из системы в виде отдельной
двухрядной таблицы. Особое положение в периодической системе занимает VIII группа; для элементов этой
группы число валентных электронов может быть равно восьми (благородные газы, начиная с неона, железо,
рутений и осмий), но может быть и больше восьми (например, у кобальта и никеля) или меньше восьми (гелий).
Таким образом, VIII группа не укладывается в принятое определение группы и является таковой лишь
формально.
Как уже указывалось, в малых периодах в каждую группу попадает по одному элементу от периода
(разумеется, кроме первого периода, посылающего элементы только в I(VII) и VIII группы). У элементов IV-VII
периодов происходит как построение внешнего, так и достройка внутренних слоев, в результате чего одно и то
же число валентных электронов может быть, достигнуто двумя путями и от каждого периода в группу попадают
два элемента. Так, например, селен ([Ar]
18
3d
10
4s
2
4p
4
) и хром ([Ar]
18
3d
5
4s
1
) относятся к VI группе, так как число
валентных электронов у них одинаково и равно 6; в случае селена эти электроны находятся на 4s- и 4p-
орбиталях, в случае хрома - на 3d- и 4s-орбиталях. В результате группа включает сходные элементы, например,
серу и селен, и элементы существенно отличающиеся по свойствам. Структурными элементами периодической
системы, объединяющими в пределах группы близкие по свойствам элементы, являются подгруппы. Подгруппа -
это совокупность элементов с одинаковым числом валентных электронов, распределенных на орбиталях
одного и того же типа. Подгруппы, образованные s- и p-элементами, называются А-подгруппами.
Периодическая система включает восемь А-подгрупп, открывающихся литием, бериллием, бором, углеродом,
азотом, кислородом, фтором и неоном. У элементов этих подгрупп валентные электроны занимают s- и р-
орбитали внешнего электронного слоя. Подгруппы, образованные d-элементами, называются В-подгруппами; их
в периодической системе 10. Валентные электроны в этом случае распределяются на s-орбиталях внешнего и d-
орбиталях предшествующего электронного слоя. Элементами, открывающими эти подгруппы, являются скандий,
титан, ванадий, хром, марганец, железо, кобальт и никель, медь и цинк. Еще 14 двухэлементных подгрупп,
называемых С-подгруппами, образуют f-элементы; в каждую из С-подгрупп попадает один лантаноид и один
актиноид. Всего периодическая система включает 32 подгруппы, причем все они без исключения укладываются в
приведенное выше определение.
Существует более сотни вариантов представления периодической системы. Остановимся на наиболее часто
используемых на практике формах. В зависимости от того, является ли основным структурным элементом
периодической системы группа или подгруппа, различают короткую и длинную формы периодической системы. В
случае короткой формы элементы распределяются по подгруппам: каждая группа, кроме восьмой, разбивается
на две подгруппы, записываемые в два столбца; VIII группа состоит из четырех столбцов. Семейства
лантаноидов и актиноидов в виде двух горизонтальных рядов выносят из основной таблицы. Длинная
(длиннопериодная) форма системы состоит из 32 вертикальных столбцов, отвечающих 32 подгруппам,
записываемым в следующей последовательности: IA, IIA, IIIA, I-XIVC, IV-XB, III-VIIIA.
Каждая из указанных форм имеет свои достоинства и недостатки. Короткая форма более компактна, в ней
легче выделить совокупности элементов с одинаковым числом валентных электронов. Длинная форма
позволяет лучше проследить за связью между электронной формулой элементов и их положением в
периодической системе.
В настоящее время Международным союзом теоретической и прикладной химии (IUPAC) рекомендована к
всеобщему пользованию периодическая система, состоящая из 18 вертикальных столбцов, соответствующих А-
24

и В-подгруппам; эти столбцы называются группами, а понятие "подгруппа" исключается. Лантаноиды и
актиноиды из основной таблицы выносят и помещают внизу в два ряда.
3.3. Закономерности изменения свойств элементов в периодах и подгруппах
периодической системы
Свойства химических элементов могут быть подразделены на непериодические и периодические.
Непериодические свойства с возрастанием порядкового номера элемента изменяются более или менее
монотонно на протяжении всего ряда элементов. Примером подобных свойств могут служить атомная масса
элемента и длины волн характеристических линий рентгеновских спектров. Периодические свойства в
значительной мере определяются электронной конфигурацией атома, которая, изменяется периодически.
Подобные свойства изменяются относительно монотонно на протяжении периода; переход же к следующему
периоду сопровождается скачкообразным изменением свойства. Если, например, данное свойство возрастает,
то переход от последнего элемента периода к первому элементу следующего периода сопровождается резким
уменьшением значения соответствующей характеристики элемента. К периодическим свойствам относятся такие
физические характеристики, как эффективный заряд ядра, радиус атома, энергия ионизации, сродство к
электрону, электроотрицательность, степень окисления. Периодически изменяются также химические свойства
элементов, однако сопоставление их затруднено отсутствием соответствующих количественных характеристик.
Поскольку периодические свойства зависят не только от типа заполняемых электронами валентных
энергетических подуровней и числа электронов на этих подуровнях, изменения свойств элементов даже в
пределах периода или подгруппы зачастую отклоняются от строгой монотонности и носят скорее характер
определенной тенденции. Нарушение монотонного изменения тех или иных характеристик атомов в
горизонтальных рядах p-, d- и f-элементов получило название внутренней периодичности; нарушение
монотонности изменения свойств в подгруппах элементов называется вторичной периодичностью. Причины,
обуславливающие вторичную и внутреннюю периодичность, будут рассмотрены ниже.
3.3.1. Эффективный заряд ядра.
Как указывалось в разделе 2.4, эффективный заряд ядра (Z
эфф
) - это заряд, соответственно которому ядро
действует на валентные электроны. При расчете эффективного заряда ядра учитываются эффекты
экранирования и проникновения электрона к ядру. Эффективный заряд совпадает с истинным лишь для
водорода и одноэлектронных ионов, для всех остальных атомов эффективный заряд меньше порядкового
номера. Существует ряд способов расчета эффективных зарядов ядер. В настоящем пособии использованы
величины Z
эфф
, рассчитанные Э. Клементи по методу самосогласованного поля.
Эффект экранирования зависит от типа орбитали, занятой электроном. Наиболее слабо экранируют ядро
валентные электроны внешнего электронного слоя, наиболее сильно - электроны внутренних электронных
слоев. При перемещении по периоду слева направо истинный заряд ядра увеличивается от элемента к элементу
на единицу, тогда как электроны, поступающие, во внешний электронный слой или на d-подуровень
предвнешнего слоя (в случае d-элементов больших периодов) понижают эффективный заряд ядра меньше, чем
на единицу. Таким образом, в периодах с увеличением порядкового номера эффективные заряды ядра должны
расти. После завершения периода очередной электрон поступает на следующий энергетический уровень,
начинает строиться новый электронный слой, внешние электроны становятся предвнешними, их экранирующее
действие возрастает и эффективный заряд ядра понижается. В табл. 5 и 6 приведены значения Z
эфф
для
элементов II и IV периодов. Как следует из табл. 5 и 6, и для малого и для большого периодов значения Z
эфф
с
увеличением порядкового номера элемента монотонно возрастают.
В подгруппах периодической системы от элемента к элементу возрастает главное квантовое число
валентных энергетических подуровней. С повышением главного квантового числа экранирующее действие
валентных электронов несколько понижается. В результате в А- и В-подгруппах эффективные заряды ядер
должны расти с увеличением порядкового номера элемента. Значения Z
эфф
для элементов подгрупп IVA, VIA и
IVB, приведенные в табл. 7 и 8, подтверждают это заключение. Внутренняя и вторичная периодичность для
эффективных зарядов ядер не проявляются.
Таблица 5
Свойства элементов II периода (Z
эфф
- эффективный заряд ядра, r
орб
- орбитальный радиус атома, I - энергия
ионизации, Е
эл
- сродство к электрону, - электроотрицательность по Полингу)
Элемент Z
эфф
, эл.ед. r
орб
, пм I
1
, эВ/ат Е
эл
,
эВ/ат
Li 1,28 159 5,19 0,62 0,98
Be 1,98 104 9,32 0 1,57
B 2,42 78 8,30 0,28 2,04
C 3,14 62 11,26 1,27 2,56
N 3,83 52 14,53 -0,07 3,04
O 4,45 45 13,62 1,46 3,44
F 5,10 40 17,42 3,40 3,98
Ne 5,76 35 21,56 0 -
Таблица 6.
Свойства элементов IV периода (обозначения те же, что и в табл. 5)
Элемент Z
эфф
, эл.ед. r
орб
, пм I
1
, эВ/ат I
3
, эВ/ат
25
K 3,50 216 4,24 46,0 0,82
Ca 4,40 169 6,13 50,92 1,00
Sc 4,63 157 6,56 24,76 1,30
Ti 4,82 148 6,82 27,48 1,54
V 4,98 140 6,74 29,32 1,63
Cr 5,13 145 6,77 30,96 1,66
Mn 5,23 129 7,44 33,70 1,55
Fe 5,43 123 7,89 30,65 1,83
Co 5,58 118 7,87 33,50 1,88
Ni 5,71 114 7,64 35,17 1,91
Cu 5,84 119 7,73 36,83 1,90
Zn 5,97 107 9,39 39,72 1,65
Ga 6,22 125 6,00 30,71 1,81
Ge 6,78 109 7,90 34,20 2,01
As 7,45 100 9,82 28,35 2,18
Se 8,29 92 9,75 32,00 2,55
Br 9,03 85 11,84 35,90 3,96
Kr 9,77 80 14,00 36,40 3,00
Таблица 7.
Свойства элементов подгрупп IVA и VIA (обозначения те же, что и в табл. 5)
Под-
группа
Элемент Z
эфф
,
эл.ед.
r
орб
, пм I
1
,
эВ/ат
Е
эл
,
эВ/ат
IVA C 3,14 62 11,26 1,27 2,55
Si 4,29 107 8,15 1,38 1,90
Ge 6,78 109 7,90 1,24 2,01
Sn 9,11 124 7,34 1,25 1,80
Pb 12,39 122 7,42 1,14 1,87
VIA O 4,45 45 13,62 1,46 3,44
S 5,46 81 10,36 2,08 2,58
Se 8,29 92 9,75 2,02 2,55
Te 10,81 111 9,01 1,97 2,10
Po 14,22 121 8,43 1,87 2,00
Таблица 8.
Свойства элементов подгрупп IB и VIB (r
мет
- металлический радиус атома; остальные обозначения те же,
что и в табл. 5)
Под-
группа
Эле-
мент
Z
эфф
,
эл.ед.
r
орб
, пм r
мет,
пм
I
1
,
эВ/ат
Е
эл
, эВ/
ат
IB Cu 5,84 119 128 7,73 1,23 1,90
Ag 8,03 129 144 7,58 1,30 1,93
Au 10,94 119 144 9,23 2,31 2,54
IVB Ti 4,82 148 146 6,82 0,21 1,54
Zr 6,45 159 160 6,83 0,52 1,33
Hf 9,16 148 159 7,50 0 1,30
3.3.2. Атомные радиусы.
Поскольку атом не имеет определенных размеров, атомные радиусы представляют собой в известной мере
условные величины. Различают орбитальные и эффективные атомные радиусы.
Орбитальные радиусы (r
орб
) - это расстояния от ядра до главного максимума функции радиального
распределения электронной плотности. Эти величины рассчитаны квантово-механическими методами для всех
элементов периодической системы.
Эффективные радиусы (r
эфф
), в отличие от орбитальных, определяют экспериментально из значений
межъядерных расстояний в молекулах или в кристаллах. При этом предполагается, что межъядерное
расстояние равно сумме эффективных радиусов соседних атомов (одинаковых для простых веществ, разных -
для сложных). Совершенно очевидно, что эффективные атомные радиусы в этом случае будут зависеть не
только от природы элемента, но и от типа химической связи в молекуле или в кристалле. Соответственно
различают ковалентные, ионные, металлические и ван-дер-ваальсовские радиусы, отвечающие агрегатам с
ковалентной, ионной, металлической связью и с межмолекулярным взаимодействием (например, кристаллам
благородных газов). Естественно, что тип связи в кристалле весьма сильно влияет на значение эффективного
радиуса. Поэтому при сопоставлении элементов с разными типами связи в кристаллах простых веществ
рационально использовать орбитальные радиусы, не зависящие от типа связи. Если в рассматриваемых
совокупностях элементов тип связи одинаков (например, для металлов В-подгрупп), сопоставление
эффективных радиусов также позволяет выносить весьма ценные заключения.
26
На атомные радиусы элементов оказывают влияние следующие факторы:
1. Эффективный заряд ядра. Увеличение Z
эфф
при прочих равных условиях усиливает притяжение валентных
электронов к ядру и, следовательно, уменьшает радиус.
2. Число энергетических уровней, заполненных электронами. Увеличение числа электронных слоев атома
способствует увеличению его радиуса.
3. Электронная конфигурация атома. Заполнение валентными электронами соответствующих энергетических
подуровней делает атом более компактным, уменьшая его радиус. Можно ожидать, что наибольшее влияние на
радиус будет оказывать образование электронных структур ns
2
, np
6
, nd
10
, nf
14
и, в меньшей степени, np
3
, nd
5
, nf
7
. С
другой стороны, заполнение электронами внутренних d- и f-подуровней благоприятствует проникновению
валентных электронов к ядру. Образующиеся при этом d
10
и f
14
экраны как бы "придавливают" проникающий под
них электрон к ядру, понижая его энергию и уменьшая радиус атома.
Проанализируем закономерности изменения атомных радиусов в периодической системе элементов. В
периодах число электронных слое не изменяется, а эффективный заряд ядер растет. Можно ожидать, что в
периодах слева направо будет наблюдаться тенденция к уменьшению атомных радиусов. Действительно, как
следует из табл. 5, для элементов II периода по ряду Li - Ne орбитальные радиусы атомов последовательно
понижаются от 159 пм у лития до 35 пм у неона без каких-либо нарушений монотонности. Несколько сложнее
изменение атомных радиусов в больших периодах. Так, в IV периоде (табл. 5) атомные радиусы монотонно
уменьшаются по рядам s-элементов (К - Са) и d-элементов (Sc - Zn) с незначительными отклонениями у хрома и
меди, возможно, обусловленными провалом электрона. Далее наблюдается нарушение монотонности: радиус
атома галлия (электронная формула [Ar]
18
3d
10
4s
2
4p
1
) значительно больше атомного радиуса предшествующего
ему цинка (электронная формула [Ar]
18
3d
10
4s
2
). Это явление можно объяснить, с одной стороны, завершением
формирования у цинка подуровня 3d
10
, а с другой - появлением у галлия структуры 4s
2
4p
1
, способствующей
увеличению радиуса атома. В ряду Ga - Kr радиусы атомов р-элементов монотонно уменьшаются. По
аналогичной схеме изменяются радиусы атомов элементов V периода.
Для VI периода наблюдается резкое уменьшение радиуса при переходе от элемента IIIB-подгруппы к
элементу IVB-подгруппы: если в V периоде орбитальный радиус иттрия отличается от орбитального радиуса
циркония на 10 пм, то для лантана и гафния разность атомных радиусов составляет 44 пм. Это явление связано
с тем, что в IV периоде между лантаном и гафнием "вклиниваются" 14 элементов - лантаноидов, по ряду которых
атомные радиусы уменьшаются от 198 пм (церий) до 155 пм (лютеций). Уменьшение атомных радиусов в ряду
лантаноидов называют лантаноидным сжатием или лантаноидной контракцией. Лантаноидная контракция имеет
большое значение для объяснения закономерностей изменения свойств элементов.
Рассмотрим характер изменения атомных радиусов в подгруппах периодической системы. При перемещении
по подгруппе сверху вниз растет число электронных слоев, на которых распределяются электроны, что должно
сопровождаться увеличением атомных радиусов. В то же время возрастание эффективного заряда ядер в
подгруппах способствует уменьшению радиусов атомов, аналогичное влияние на радиус оказывает также и
формирование d
10
- и f
14
-экранов. В А-подгруппах периодической системы число электронных слоев является
определяющим фактором: в подгруппах s- и р-элементов наблюдается явная тенденция к увеличению атомных
радиусов с возрастанием порядкового номера элемента. Так, в подгруппе VIA (табл. 6.) атомные радиусы
монотонно возрастают от кислорода (r
орб
= 45 пм) до полония (r
орб
= 121 пм). Несколько более сложный характер
изменения атомных радиусов имеет место в подгруппе IVА (табл. 6). В этой подгруппе переход от углерода к
кремнию сопровождается значительным увеличением атомного радиуса, тогда как при переходе от кремния к
германию эта характеристика атома почти не изменяется; радиус атома олова, следующего элемента IVА-
подгруппы, существенно больше радиуса атома германия, тогда как при переходе от олова к свинцу атомный
радиус не только не увеличивается, но даже несколько уменьшается. Наблюдаемая в IV-подгруппе вторичная
периодичность находит достаточно убедительное объяснение. В атоме углерода электроны образуют два
электронных слоя, а в атоме кремния - три, вследствие чего радиус атома кремния должен быть больше радиуса
атома углерода. Для атома германия увеличение числа электронных слоев до четырех должно способствовать
увеличению атомного радиуса; однако в атоме германия заполнен 3d-подуровень. Эти два эффекта
компенсируют друг друга, результатом чего является близость радиусов атомов кремния и германия. Для атома
олова число электронных слоев возрастает до пяти, а новые типы электронных экранов не образуются (экран
4d
10
аналогичен 3d
10
), поэтому радиус атома олова больше радиуса атома германия. В атоме свинца
формируется шестой электронный слой, но в то же время появляется 4f
14
-экран, что видимо, влияет на размеры
атома сильнее, чем наличие нового электронного слоя; в результате радиус атома свинца несколько меньше
радиуса атома олова.
Для В-подгрупп периодической системы на характер изменения атомных радиусов существенное влияние
оказывает лантаноидная контракция, приводящая к уменьшению атомного радиуса третьего элемента
подгруппы, относящегося к VI периоду, сравнительно с ожидаемой величиной. В табл. 7 приведены орбитальные
и металлические радиусы элементов подгрупп IB и IVB. Для обеих подгрупп переход от первого элемента ко
второму сопровождается увеличением атомного радиуса, тогда как при переходе от второго элемента к третьему
металлические радиусы практически не изменяются, а орбитальные даже уменьшаются.
Заметим, что в случае подгруппы IIIB, для которой лантаноидная контракция не наблюдается, атомные
радиусы изменяются так же, как и в А-погруппах (для скандия, иттрия и лантана орбитальные радиусы равны
157, 169 и 192 пм).
3.3.3. Энергия ионизации.
Энергия ионизации - это количество энергии, необходимое для отрыва электрона от атома или иона
данного элемента. Различают первую, вторую, третью и т.д. энергии ионизации, соответствующие удалению
27
первого, второго, третьего и т.д. электрона атомной частицы. Энергию ионизации обозначают символом I
n
(n =
1,2,3...) и выражают в эВ/атом или в кДж/моль. Напомним, что 1 эВ 1,6021910
-19
Дж; в расчете на 1 моль
атомов это составляет 96,486 кДж/моль.
Энергия ионизации является сложной функцией ряда характеристик атома. Повышению энергии ионизации
способствует увеличение эффективного заряда ядра, наличие в атоме полностью или наполовину заполненных
валентными электронами энергетических подуровней, уменьшение радиуса атома, формирование экранов,
усиливающих проникновение валентных электронов к ядру.
В периодах, как было показано выше, с увеличением порядкового номера элемента эффективный заряд
ядер растет, а атомные радиусы уменьшаются, следовательно, в периодах энергия ионизации должна проявлять
тенденцию к увеличению, однако меняющиеся электронные структуры атомов будут нарушать монотонность
изменения этого свойства. Этот вывод хорошо согласуется с экспериментальными данными. Так, для элементов
II периода (табл. 4) тенденция к возрастанию первой энергии ионизации очевидна: для лития значение I
1
равно
5,39 эВ/атом, а для неона 21,56 эВ/атом. Однако монотонность изменения свойства нарушается при переходе от
бериллия к бору и от азота к кислороду. Это явление связано с появлением заполненного 2s-подуровня у
бериллия (1s
2
2s
2
) и наполовину заполненного 2р-подуровня у азота (1s
2
2s
2
2p
3
); эти структуры отличаются
повышенной устойчивостью, что затрудняет отрыв электрона от атомов бериллия и азота. В результате в ряду р-
элементов II периода проявляется внутренняя периодичность.
В больших периодах периодической системы также наблюдается тенденция к увеличению энергии
ионизации. В качестве примера в табл. 5 сопоставлены энергии ионизации I
1
и I
3
для элементов IV периода. Как
следует из табл. 5, значения I
1
в IV периоде изменяются от 4,34 эВ/атом у калия до 14 эВ/атом у криптона.
Нарушение монотонности, наблюдаемое при переходе от цинка к галлию и от мышьяка к селену, связано с
появлением у цинка и мышьяка устойчивых структур 3d
10
и 4p
3
, соответственно. В ряду d-элементов, однако, не
проявляется внутренняя периодичность: по ряду Cr-Mn-Fe энергия ионизации монотонно увеличивается, хотя у
марганца сформирована устойчивая конфигурация 3d
5
. Это явление можно объяснить тем, что все d-элементы
IV периода имеют сходные конфигурации внешнего электронного слоя - 4s
2
или, в случае провала электрона -
4s
1
. В результате все эти элементы теряют первый электрон с энергетического подуровня 4s независимо от
числа электронов на 3d-подуровне. Совершенно иная картина наблюдается, если сопоставить третьи энергии
ионизации рассматриваемых d-элементов, отвечающие потере одного или двух электронов с 3d-подуровня.
Значение I
3
марганца больше соответствующих характеристик для хрома и железа, и в ряду d-элементов
отчетливо проявляется внутренняя периодичность.
В А-подгруппах периодической системы сверху вниз увеличиваются атомные радиусы элементов, откуда
можно ожидать, что энергии ионизации в А-подгруппах будут уменьшаться, хотя возможность вторичной
периодичности для данного свойства не исключается. Действительно, для элементов подгруппы VIA значения
первой энергии ионизации монотонно уменьшаются, а в IVA-подгруппе I
1
убывает от углерода к кремнию,
незначительно понижается при переходе от кремния к германию, заметно уменьшается у олова и несколько
увеличивается у свинца (табл. 6). Вторичная периодичность для первой энергии ионизации в подгруппе
обусловлена теми же причинами, что и немонотонность изменения атомных радиусов в этой группе.
Для подгрупп d-элементов изменение энергии ионизации носит более сложный характер. В связи с
лантаноидной контракцией, приводящей к уменьшению атомных радиусов элементов VI периода, и
сформированным у этих элементов 4f-экраном у третьих элементов В-подгрупп наблюдается значительное
увеличение энергии ионизации. В качестве примера в табл. 7 рассмотрены изменения I
1
для подгрупп IB и IVB;
как следует из приведенных данных значения энергии ионизации для первого и второго элементов подгрупп
близки, а для третьего - возрастают.
3.3.4. Сродство к электрону.
Сродство к электрону (Е
эл
) - это энергетический эффект присоединения электрона к атомной частице.
Как и энергия ионизации, сродство к электрону выражается либо в эВ/атом, либо в кДж/моль. К сожалению, эта
характеристика атомов вплоть до настоящего времени с достаточной надежностью определена далеко не для
всех элементов. Сродство к электрону относительно точно можно определить для неметаллов, образующих
отрицательные ионы: сродство к электрону для такого элемента будет равно по абсолютной величине и обратно
по знаку энергии ионизации однозарядного отрицательного иона. Для металлов, не образующих отрицательных
ионов, сродство к электрону устанавливают приближенно косвенными и не всегда надежными методами. В
результате для ряда металлов значения сродства к электрону до сих пор не определены с достаточной
достоверностью, что существенно затрудняет анализ закономерностей изменения этого свойства элементов.
Можно ожидать, что возрастанию сродства к электрону будет способствовать увеличение эффективного
заряда ядра и степени устойчивости электронных конфигураций, образующихся после присоединения к атому
электрона. Можно предположить, что характер изменения сродства к электрону в периодах и подгруппах схож с
изменением энергии ионизации с той разницей, что элементам с устойчивыми конфигурациями типа s
2
,p
6
,p
3
,d
10
,d
5
и т.д., будут отвечать особо низкие значения Е
эл
, а наибольшие значения этого свойства будут присущи
конфигурациям, на один электрон отстающим от устойчивых.
В табл. 4 сопоставлены значения Е
эл
для элементов II периода. Как следует из таблицы, нулевые и
отрицательные значения сродства к электрону отвечают бериллию, азоту и неону, в атомах которых
сформированы устойчивые конфигурации 2s
2
, 2p
3
и 2p
6
; для остальных элементов прослеживается отчетливая
тенденция к возрастанию Е
эл
с увеличением порядкового номера. Максимальное значение Е
эл
отвечает фтору -
элементу, которому недостает одного электрона для приобретения устойчивой конфигурации благородного газа.
В А-подгруппах сродство к электрону уменьшается с увеличением порядкового номера элемента, хотя и не
строго монотонно, что может быть проиллюстрировано данными табл. 7, в которой приведены значения Е
эл
28

элементов подгрупп IVA и VIA. Из общей закономерности здесь выпадают углерод и кислород - элементы,
открывающие подгруппы. Причиной этого является то, что углерод и кислород - кайносимметричные элементы;
вопрос о элементах-кайносимметриках и особенностях их свойств будет рассмотрен в разделе 3.4.
Анализ изменения Е
эл
в В-подгруппах затрудняет отсутствие надежных данных о значениях сродства к
электрону для многих d-элементов. Для некоторых В-подгрупп зарегистрировано увеличение сродства к
электрону с возрастанием порядкового номера; для других подгрупп значение Е
эл
проходит через максимум
(табл. 7).
3.3.5. Электроотрицательность.
Электроотрицательность элемента - это характеристика, определяющая способность атома
притягивать к себе электроны, участвующие в образовании химических связей.
Существует ряд методов количественной оценки электроотрицательности, из которых наиболее популярным
является метод, предложенный Л. Полингом и основанный на сопоставлении энергий связей между
одинаковыми и различными атомами.
Пусть атомы А и В образуют гомоядерные двухатомные молекулы (А
2
и В
2
) и гетероядерную молекулу АВ.
Если электроотрицательности атомов А и В (
А
и
В
) равны, то общая электронная пара в молекуле АВ в равной
мере принадлежит обоим атомам. Полинг предположил, что в этом случае энергия связи А-В (Е
АВ
) должна
равняться среднему геометрическому энергий связи в молекулах А
2
и В
2
, а
E = E - E E
A-B A-A B-B
0
Если же Е не равно нулю, то это свидетельствует о том, что электроотрицательности А и В не одинаковы.
Связь между электроотрицательностями элементов и величиной Е выражается уравнением
EKχ-χ
BA
Приняв электроотрицательность фтора равной 4, Полинг рассчитал относительные значения
электроотрицательности для большинства химических элементов.
Очень простой прием расчета абсолютных значений электроотрицательности был предложен Р.
Малликеном. По Малликену электроотрицательность элемента равна полусумме первой энергии ионизации и
сродства к электрону для этого элемента
=
I + E
эл
2
Однако, как уже указывалось, значения Е
эл
известны не для всех элементов, что ограничивает использование
абсолютных величин электроотрицательности.
Сопоставление электроотрицательности элементов в периодах и подгруппах показывает, что она является
периодическим свойством. В периодах значения электроотрицательности возрастают. Это обусловлено тем, что
электроотрицательность тем больше, чем прочнее удерживает атом собственный электрон, мерой чего является
энергия ионизации, и чем активнее он присоединяет электрон извне, мерой чего является сродство к электрону.
В периодах же слева направо наблюдается тенденция к увеличению как I, так и Е
эл
. В табл. 4 и 5 приведены
значения электроотрицательности элементов II и IV периодов.
В А-подгруппах по тем же причинам значения электроотрицательности с ростом порядкового номера
убывают, хотя возможны и некоторые нарушения монотонности, связанные со вторичной периодичностью (табл.
6). В подгруппах d-элементов прогнозирование характера изменения электроотрицательности встречает
серьезные затруднения. Как видно из табл. 7, значения электроотрицательности в В-подгруппах могут и
уменьшаться (подгруппа IVB), и увеличиваться (подгруппа IB).
3.3.6. Степени окисления элементов.
Степень окисления элемента - это условный заряд, который приобретет атом в соединении, если все
валентные электроны перейдут к атомам элементов с большей электроотрицательностью.
Степень окисления является формальной величиной и, как правило, не позволяет судить об истинном
заряде того или иного атома в соединении, однако она весьма полезна для составления химических формул и
подбора коэффициентов в уравнениях реакций; по значениям степени окисления классифицируют соединения
элементов.
Для большинства химических элементов степень окисления может принимать несколько значений; особым
разнообразием отличаются степени окисления d-элементов. Так, например, марганец в своих соединениях
реализует степени окисления от -1 до +7 (табл. 9).
Таблица 9.
Степени окисления марганца в его соединениях
Степень окисления Соединение
-1 H[Mn(CO)
5
]
0 Mn
2
(CO)
10
+1 Mn(CO)
5
Br
+2 MnO
+3 Mn
2
O
3
+4 MnO
2
+5 K
3
MnO
4
+6 K
2
MnO
4
29

+7 KMnO
4
Явно периодическим свойством является высшая положительная степень окисления элементов,
определяемая числом валентных электронов. При анализе изменения степеней окисления следует, однако
учитывать, что многие элементы в известных соединениях не реализуют свою высшую степень окисления.
В малых периодах, состоящих только из s- и р-элементов высшая степень окисления монотонно возрастает,
принимая значения, равные номеру А-подгруппы, в которой находится данный элемент. Так, в I периоде для
водорода, который может быть отнесен как к IА-, так и к VIIA-подгруппе, максимальная степень окисления равна
+1; для элементов II и III периодов степень окисления меняется от +1 до +7; степень окисления +8 у легких
благородных газов (Ar,Ne) не реализуется, кислород и фтор также не реализуют высшие степени окисления,
равные +6 и +7.
Та же закономерность изменения высших степеней окисления сохраняется для рядов s- и р-элементов в
больших периодах с той лишь разницей, что ксенон и, возможно, радон, элементы VIIIА-подгруппы, в своих
соединениях реализуют степень окисления +8. Однако в IV и последующих периодах между s- и р-элементами
внедряются декады d-элементов, число валентных электронов которых меняется от трех до двенадцати. В рядах
d-элементов высшие степени окисления меняются от +3 в IIIВ-подгруппе до +8 в VIIIВ-подгруппе (рутений,
осмий). В подгруппах кобальта, никеля, меди и цинка значения степени окисления, соответствующее числу
валентных электронов, в известных соединениях не проявляются. Так, степень окисления никеля в описанных
соединениях не превышает +4, золота +5, цинка +2. Степени окисления, превышающие +8, для элементов не
зарегистрированы.
В А- и В-подгруппах периодической системы высшие степени окисления (если они реализуются) одинаковы
для всех элементов подгруппы. При этом в А-подгруппах устойчивость соединений, в которых элемент проявляет
высшую степень окисления, при перемещении сверху вниз понижается, а в В-подгруппах - повышается.
3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
Как уже указывалось, следствием периодического повторения сходных электронных конфигураций является
наличие совокупностей элементов, сходных по тем или иным характеристикам. Подобные элементы называют
аналогами, а их совокупности - подгруппами аналогов. Признаки, по которым формируют подобные
совокупности, равно как и степень сходства аналогов, могут быть различными; соответственно различают
групповую, типовую, слоевую, контракционную, горизонтальную и диагональную аналогии.
3.4.1. Групповая аналогия.
Проявляется у элементов, входящих в одну группу периодической системы, и является наиболее широким
видом аналогии. Групповые аналоги могут весьма сильно отличаться как по свойствам простых веществ, так и по
свойствам соединений этих элементов, однако некоторые общие признаки им все же присущи. Поскольку общим
для элементов группы является число валентных электронов, все групповые аналоги характеризуются
одинаковым высшим значением степени окисления, если оно может быть реализовано. Так, элементы VI группы,
как неметаллического, так и металлического характера, за исключением кислорода, проявляют высшую степень
окисления +6; у кислорода степень окисления в известных соединениях не превышает +4 (центральный атом
кислорода в молекуле озона), хотя формально степень окисления +6 для этого элемента не запрещена. Отметим
также, что в высшей степени окисления элементы группы образуют сходные как по физическим, так и по
химическим свойствам соединения. Сера и хром, например, резко отличаются по свойствам друг от друга в
элементарном состоянии; их соединения, отвечающие степени окисления +4, не обнаруживают сходства, а
степени окисления +2 и +3, не типичные для серы, весьма характерны для хрома. В то же время соединения
серы(VI) и хрома(VI) во многом аналогичны. Так, высшие оксиды этих элементов SO
3
и CrO
3
являются типичными
кислотными оксидами, реагирующими с водой с образованием серной (H
2
SO
4
) и хромовой (H
2
CrO
4
) кислот. Как
серная, так и хромовая кислоты проявляют окислительные свойства и склонны к образованию поликислот
(например, H
2
S
2
O
7
и H
2
Cr
2
O
7
). Как сульфаты, так и хроматы бария и свинца являются практически
нерастворимыми солями; относительно низкая растворимость присуща сульфату и хромату кальция, причем для
обеих солей с повышением температуры растворимость не растет, а понижается.
3.4.2. Типовая аналогия.
Проявляется в A-, B- и C-подгруппах периодической системы и является более узким видом аналогии, чем
групповая. Типовые аналоги характеризуются одинаковым числом валентных электронов, распределенных на
орбиталях одного типа. Распределение одного и того же числа валентных электронов типовых аналогов по
орбиталям одинакового типа обуславливает сходство этого вида аналогов как в простых веществах, так и в
соединениях этих элементов. Однако у разных представителей подгруппы это сходство может проявляться не в
одинаковой мере, потому что, как будет показано ниже, подгруппа типовых аналогов может включать в себя
более тонкие виды аналогии.
3.4.3. Электронная аналогия.
Проявляется у элементов, имеющих сходные электронные формулы. Элементы, входящие в подгруппу
электронных аналогов, аналогичны по конфигурации внешнего электронного слоя и достраивающихся
внутренних подуровней. Отнесению к электронным аналогам не препятствуют отличия в конфигурации
благородного газа, включенного в электронную формулу ([He]
2
, [Ne]
10
и т.д.); при этом конфигурация [Xe]
54
4f
14
считается эквивалентной конфигурации благородного газа. Провал электрона также не нарушает электронную
30
