Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


SbH
3
+ KClO + KOH K
3
SbO
4
+ NaCl
Учитывая, что SbH
3
не является электролитом, приходим к уравнениям полуреакций:
SbH
3
+ 11OH
-
- 8e
-
= SbO
4
3-
+ 7H
2
O │1
ClO
-
+ H
2
O + 2e
-
= Cl
-
+ 2OH
-
│4
и итоговому ионному уравнению
SbH
3
+ 4ClO
-
+ 3OH
-
= SbO
4
3-
+ 4Cl
-
+ 3H
2
O
Достоинством метода ионно-электронного баланса является то, что при описании ОВР он использует только
реально существующие частицы, участвующие во взаимодействии. Однако этот прием не может быть так жестко
алгоритмизирован, как метод электронного баланса, и применим только для реакций, протекающих в растворах.
9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций.
Гальванический элемент.
Рассмотрим процессы, которые будут наблюдаться, если металлическую пластинку (электрод) опустить в
воду. Поскольку все вещества в какой-то мере растворимы, в такой системе начнет протекать процесс перехода
в раствор катионов металла с их последующей гидратацией. Освобождающиеся при этом электроны будут
оставаться на электроде, сообщая ему отрицательный заряд. Отрицательно заряженный электрод будет
притягивать катионы металла из раствора, в результате чего в системе установится равновесие
M M
n+
+ ne
-
, (9-67)
при котором электрод будет иметь отрицательный заряд, а прилегающий к нему слой раствора - положительный.
Уравнение (9-67) описывает полуреакцию, для которой окисленной формой являются катионы M
n+
, а
восстановленной формой - атомы металла М.
Если в рассматриваемую систему ввести соль, отщепляющую при диссоциации катионы M
n+
, равновесие
(9-67) сместится в сторону обратной реакции; при достаточно высоком значении концентрации M
n+
становится
возможным осаждение ионов металла на электроде, который при этом приобретет положительный заряд, тогда
как прилегающий к поверхности электрода слой раствора, содержащий избыток анионов, зарядится
отрицательно. Знак заряда электрода в конечном итоге будет определяться химической активностью металла,
способствующей появлению отрицательного заряда, и концентрацией катиона металла в растворе, увеличение
которой способствует появлению положительного заряда. Однако в любом случае в такой системе формируется
двойной электрический слой и возникает скачок потенциала на границе раздела электрод - раствор.
Скачок потенциала на границе раздела электрод - раствор называется электродным или окислительно-
восстановительным потенциалом.
В рассмотренном нами примере металл электрода подвергался химическим изменениям. Это условие
отнюдь не является обязательным для возникновения электродного потенциала. Если какой-либо инертный
электрод (графитовый, платиновый) погрузить в раствор, содержащий окисленную и восстановленную формы
(ОФ и ВФ) какой-то полуреакции, то на границе раздела электрод - раствор также возникнет скачок потенциала.
Возникновение электродного потенциала в этом случае будет определяться протеканием полуреакции
ОФ + ne
-
ВФ (9-67)
Смещение равновесия (9-67) в сторону прямой реакции будет способствовать появлению на электроде
положительного заряда, а в сторону обратной реакции - отрицательного. Электрод при этом не будет изменяться
химически; он будет лишь служить источником или приемником электронов, присоединяемых или отдаваемых
веществами, восстанавливающимися или окисляющимися на поверхности электрода.
Таким образом, любая окислительно-восстановительная реакция может быть охарактеризована
определенным значением окислительно-восстановительного потенциала. Значение электродного потенциала
зависит от природы и концентрации окисленной и восстановленной форм, а также от температуры. Эта
зависимость выражается уравнением Нернста
y
red
x
ox
C
C
ln
nF
RT
EE
(9-68)
где R - универсальная газовая постоянная, Т - абсолютная температура, n - число электронов, соответствующее
переходу окисленной формы в восстановленную, F - число Фарадея (96485 Кл·моль
-1
), C
ox
и
C
red
- концентрации
окисленной и восстановленной формы, x и y - коэффициенты в уравнении полуреакции, Е˚ - электродный
потенциал, отнесенный к стандартным условиям (р = 101,326 кПа, Т = 298 К, C
ox
=
C
red
=1 моль/л). Величины Е˚
называют стандартными электродными потенциалами.
Абсолютные значения электродных потенциалов измерить невозможно: использование любых
измерительных приборов в этом случае привело бы к появлению новых, контактных, разностей потенциалов.
Однако можно определить относительные значения электродных потенциалов, сравнивая измеряемый
потенциал с другим, принятым за эталон. В качестве такого эталонного потенциала используют стандартный
161
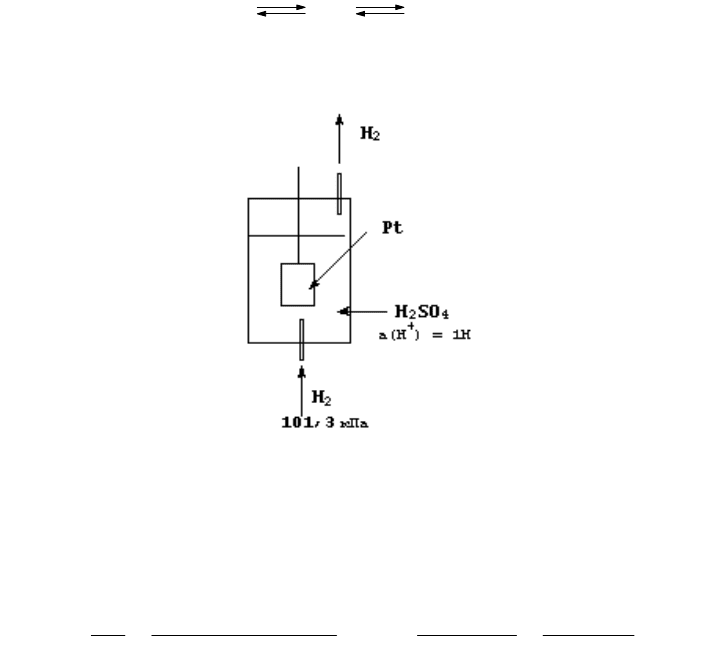
потенциал водородного электрода. Водородный электрод представляет собой платиновую пластинку, покрытую
слоем пористой платины (платиновая чернь) и погруженную в раствор серной кислоты с активностью катионов
водорода, равной 1 моль/л, при температуре 298 К. Платиновая пластинка насыщается водородом под
давлением, равным 101,326 кПа (рис. 66). Абсорбированный платиной водород является более активным
компонентом, чем платина, и электрод ведет себя так, как если бы он бы выполнен из водорода. В результате в
системе возникает электродный потенциал за счет полуреакции
Н
2
2Н 2Н
+
+ 2е
-
Этот потенциал условно принимают равным нулю. Если окисленная форма той или иной полуреакции является
более активным окислителем, чем катион водорода, значение электродного потенциала этой полуреакции будет
величиной положительной, в противном случае - отрицательной. Величины стандартных электродных
потенциалов приводят в справочных таблицах.
Рис. 66. Схема строения водородного электрода
Уравнение (9-68) позволяет рассчитывать значения электродных потенциалов при различных условиях.
Пусть требуется определить электродный потенциал полуреакции
MnO
4
-
+ 8H
+
+ 5e
-
= Mn
2+
+ 4H
2
O,
если температура равна 320 К, а текущие концентрации MnO
4
-
, Mn
2+
и Н
+
равны соответственно 0,800, 0,0050 и
2,00 моль/л; значение Е˚ для этой полуреакции равно 1,51 В. В соответствии с (9-68)
1,57B
0,0050
20,800
ln
964855
3208,314
1,51
)C(Mn
)C(H)C(MnO
ln
nF
RT
EE
8
2
8-
4
Электродный потенциал связан с изменением свободной энергии Гиббса при протекании данной
полуреакции. Пусть обратимая полуреакция, которой соответствует электродный потенциал Е, протекает в
изобарно-изотермических условиях. Тогда работа, совершаемая системой, выразится уравнением
A = pΔV + w, (9-69)
где pΔV - работа расширения, а w - электрическая работа, совершаемая зарядом, перемещающимся между
точками с разностью потенциалов Е. В соответствии с первым законом термодинамики тепловой эффект
процесса
Q
p
= ΔU + A = ΔU + pΔV + w =ΔH + w,
откуда
ΔН = Q
p
– w,
а изменение свободной энергии Гиббса
ΔG = ΔH - TΔS = Q
p
-w - TΔS (9-70)
Однако для обратимого изобарно-изотермического процесса в соответствии с уравнением (8-26)
Q
p
= TΔS
следовательно
ΔG = -w
Если превращение моля окисленной формы в восстановленную сопровождается присоединением n электронов,
то соответствующая электрическая работа
162

w = nFE
Отсюда для данной полуреакции
ΔG = -nFE (9-71)
или при стандартных условиях
ΔG˚ = -nFE˚ (9-72)
Электродные потенциалы могут быть использованы для определения направления окислительно-
восстановительных процессов. Пусть окислительно-восстановительной реакции соответствуют полуреакции
X(1) + n
1
e
-
= Y(1); ΔG
1
= -n
1
FE
1
, (9-73)
X(2) + n
2
e
-
= Y(2); ΔG
2
= -n
2
FE
2
(9-74)
Cовершенно очевидно, что одна из этих полуреакций должна протекать слева направо (процесс восстановления,
сопровождающийся присоединением электронов), а другая - справа налево (процесс окисления, при котором
электроны теряются). Изменение энергии Гиббса для рассматриваемой реакции будет определяться разностью
электродных потенциалов полуреакций
ΔG = aΔG
2
- bΔG
1
= -nF(E
2
- E
1
) (9-75)
где a и b - множители, уравнивающие число отданных и присоединенных в процессе реакции электронов (n = an
1
= bn
2
). Чтобы реакция протекала самопроизвольно величина ΔG должна быть отрицательной, а это будет иметь
место тогда, когда Е
2
> Е
1
. Таким образом, в процессе ОВР из двух окисленных форм восстанавливается та, для
которой электродный потенциал больше, а из двух восстановленных форм окисляется та, для которой
электродный потенциал меньше. Если реакция протекает при стандартных условиях, то
ΔG˚ = -nF
)EE(
12
и для определения ее направления достаточно сравнить электродные потенциалы полуреакций.
Пусть, например, необходимо определить направления реакции
MnO
4
-
+ 5Fe
2+
+ 8H
+
= Mn
2+
+ 5Fe
3+
+ 4H
2
O (9-76)
при стандартных условиях. Запишем уравнения перехода двух окисленных форм в восстановленные и по
справочным таблицам найдем соответствующие значения электродных потенциалов:
Fe
3+
+ 1e
-
= Fe
2+
│5 ; E
1
= 0,77 B; (9-77)
MnO
4
-
+ 8H
+
+5e
-
= Mn
2+
+5Fe
2+
+4H
2
O │1 ; E
2
= 1,51 B; (9-78)
Поскольку Е
2
> E
1
, полуреакция (9-78) будет протекать слева направо, а полуреакция (9-77) - справа налево.
Таким образом, процесс (9-76) будет протекать в направлении прямой реакции. Как видно из приведенного
примера, электродные потенциалы сравнивают независимо от того, сколько электронов участвует в
полуреакциях. Это связано с тем, что число электронов уже учтено в уравнении (9-71), согласно которому
nF
ΔG
E
Потенциалы полуреакций уже отнесены к одному электрону, в силу чего нет необходимости как-либо изменять
эти величины. Если бы мы рассчитывали величины ΔG, то числа электронов, отданных восстановителем и
присоединенных окислителем, как видно из уравнения (9-71) следовало бы учесть.
Используя значения электродных потенциалов, можно рассчитать константу равновесия ОВР. Решим эту
задачу для реакции (9-76). Уравнения электродных потенциалов, обеспечивающих равновесие, в соответствии с
(9-68), (9-77) и (9-78) примут вид:
52
53
11
][Fe
][Fe
ln
5F
RT
EE
,
][Mn
]][H[MnO
ln
nF
RT
EE
2
8
4
22
(концентрацию воды можно считать постоянной). Поскольку система находится в состоянии равновесия, то для
нее ΔG, а, следовательно, и Е
2
- Е
1
, равны нулю, откуда
163

0
][Fe
][Fe
ln
5F
RT
][Mn
]][H[MnO
ln
5F
RT
EEEE
52
53
2
4
1212
Следовательно
lnK
5F
RT
][Fe]][H[MnO
]][Fe[Mn
ln
5F
RT
EE
528
4
532
12
( 9-79)
где К - константа равновесия реакции (9-76). Решая уравнение (9-79) относительно К, имеем:
62
2988,314
0,77)(1,51964855
RT
)E5F(E
103,8eeK
12
Реакция (9-76), таким образом, является практически необратимой.
Окислительно-восстановительные реакции, как уже указывалось, сопровождаются переносом электронов от
восстановителя к окислителю. Если разделить процессы окисления и восстановления в пространстве, можно
получить направленный поток электронов, т.е. электрический ток. Устройства, в которых химическая энергия
окислительно-восстановительной реакции преобразуется в энергию электрического тока, называются
химическим источниками тока или гальваническими элементами.
В простейшем случае гальванический элемент состоит из двух полуэлементов - сосудов, заполненных
растворами соответствующих соединений, в которые погружены электроды. Полуэлементы соединены U-
образной трубкой (сифоном), заполненной раствором электролита, или полупроницаемой мембраной, что дает
возможность ионам переходить из одного полуэлемента в другой. Если электроды не соединены внешним
проводником, то полуэлементы находятся в состоянии равновесия, обеспечиваемым определенным зарядом на
электродах. Если же цепь замкнуть, равновесие нарушается, так как электроны начнут переходить с электрода,
имеющего меньший электродный потенциал, на электрод с большим электродным потенциалом. В результате в
системе начнет протекать окислительно-восстановительная реакция, причем на электроде с большим значением
потенциала будет идти процесс восстановления, а на электроде с меньшим значением потенциала - процесс
окисления. Электрод, на котором протекает реакция восстановления, называется катодом; электрод, на котором
протекает реакция окисления, называется анодом.
В качестве примера рассмотрим элемент Даниэля-Якоби, который состоит из медного и цинкового
электродов, погруженных в растворы сульфатов этих металлов (рис. 67).
Рис. 67. Схема строения медно-цинкового гальванического элемента
В этом элементе окисленными формами являются катионы Zn
2+
и Cu
2+
, восстановленными формами - цинк и
медь. Уравнения полуреакций для системы имеют вид:
Zn
2+
+ 2e
-
= Zn
0
; E
1
= -0,76 B (9-80)
Cu
2+
+ 2e
-
= Cu
0
; E
2
= 0,34 B (9-81)
Поскольку Е
2
> E
1
, полуреакция (9-80) будет протекать справа налево, а реакция (9-81) - слева направо, т.е. в
системе будет протекать реакция
Zn + Cu
2+
= Zn
2+
+ Cu
Процесс будет идти до тех пор, пока не растворится цинковый электрод или не разрядятся все ионы меди. В
случае медно-цинкового элемента катодом является медный электрод (на нем ионы Cu
2+
восстанавливаются до
металлической меди), а анодом - цинковый электрод (на нем атомы цинка окисляются до ионов Zn
2+
).
Электродвижущая сила элемента равна разности электродных потенциалов катода и анода
ΔЕ = Е
катода
- Е
анода
При стандартных условиях
ΔЕ = 0,34 - (-076) = 1,10 В
164
Для записи гальванических элементов используют приведенную ниже форму:
Анод │ Анодный раствор ││ Катодный раствор │ Катод
Для анодного и катодного растворов указывают концентрации соответствующих ионов в момент начала работы
гальванического элемента. Так, элементу Даниэля-Якоби с концентрациями CuSO
4
и ZnSO
4
, равными 0,01 моль/
л, отвечает запись:
Zn │ Zn
2+
(0,01 M) ││ Cu
2+
(0,01 M )│ Cu
Путем измерения ЭДС гальванических элементов определяют стандартные электродные потенциалы тех
или иных полуреакций. Пусть, например, необходимо установить Е˚ полуреакции
Fe
3+
+ 1e
-
= Fe
2+
Для этого достаточно собрать гальванический элемент
Pt│H
2(г)
(101,3 кПа), H
+
(1M)││Fe
3+
(1M), Fe
2+
(1M) │Pt
и измерить его ЭДС. Последняя равна 0,77 В, откуда
H
H
Fe
Fe
EΔEE
2
3
0,77 + 0 = +0,77 В
9.3.6.4. Электролиз.
Пропуская через раствор или расплав электролита электрический ток, можно осуществлять окислительно-
восстановительные реакции, которые не протекают самопроизвольно.
Процесс раздельного окисления и восстановления на электродах, осуществляемый за счет протекания
электрического тока от внешнего источника ЭДС, называется электролизом.
При электролизе анодом является положительный электрод, на котором протекает процесс окисления, а
катодом - отрицательный электрод, на котором осуществляется процесс восстановления. Названия "анод" и
"катод", таким образом, не связаны с зарядом электрода: при электролизе анод положителен, а катод
отрицателен, а при работе гальванического элемента - наоборот. В процессе электролиза анод является
окислителем, катод - восстановителем.
Количественно процесс электролиза описывают законы М. Фарадея (1833):
1. Масса выделенного на электроде вещества пропорциональна количеству электричества, прошедшему
через раствор или расплав.
2. Для выделения на электроде одного моля эквивалентов любого вещества затрачивается одно и то же
количество электричества.
Обобщенно законы Фарадея выражаются уравнением:
F
τI
Mm
Э
где m - масса продукта электролиза, I - сила тока, - время пропускания тока, F - константа, равная 96485
Кл
.
моль
-1
(число Фарадея), М
э
- эквивалентная масса.
Как уже указывалось, электролизу подвергаются как растворы, так и расплавы электролитов. Наиболее
просто протекает электролиз расплавов. В этом случае на катоде происходит восстановление катиона, а на
аноде - окисление аниона электролита. Например, электролиз расплава хлорида натрия протекает по
уравнениям:
Катодный процесс: Na
+
+ 1e- = Na | 2
Анодный процесс: 2Cl
-
- 2e- = Cl
2
| 1
Уравнение электролиза: 2NaCl = 2Na + Cl
2
Электролиз растворов протекает значительно сложней, так как в этом случае электролизу могут
подвергаться и молекулы воды. При электролизе вода может и окисляться, и восстанавливаться соответственно
следующим полуреакциям:
1) восстановление воды (катодный процесс)
2Н
2
О + 2е
-
= Н
2
+ 2ОН
-
; Е˚ = -0,83 В (9-82)
2) окисление воды (анодный процесс)
2Н
2
О - 4е
-
= 4Н
+
+ О
2
; Е˚ = 1,23 В (9-83)
(Здесь и в дальнейшем приводятся значение Е˚, отвечающие превращению окисленной формы в
восстановленную). Поэтому при электролизе водных растворов наблюдается конкуренция между электродными
процессами с различными значениями электродных потенциалов. При этом в идеальном случае на катоде
165

должна протекать полуреакция с наибольшим значением электродного потенциала, а на аноде - полуреакция с
наименьшим значением электродного потенциала. Однако для реальных процессов значение электродных
потенциалов - не единственный фактор, влияющий на характер взаимодействия.
В идеальном случае для того, чтобы электролиз начался, необходимо приложить к системе внешнюю ЭДС,
превышающую на бесконечно малую величину (ΔU) ЭДС гальванического элемента, построенного на данной
ОВР. Однако в действительности напряжение, необходимое для начала электролиза, будет несколько больше.
Это явление обусловливают относительно медленная диффузия ионов к электроду, адсорбционные процессы,
десорбция газообразных продуктов электролиза и т.д. Добавочная ЭДС, необходимая для начала процесса
электролиза на электродах, называется перенапряжением. Перенапряжение складывается из перенапряжения
на катоде (ΔЕ
кат
) и перенапряжения на аноде (ΔЕ
ан
). Для большинства металлов значения перенапряжения
невелики; исключением являются железо (ΔЕ = 0,24 В) и никель (ΔЕ = 0,23 В); высокое перенапряжение отвечает
кислороду (порядка 0,5 В) и особенно водороду, для которого перенапряжение может достигать 0,7 - 1,6 В в
зависимости от металла, на котором выделяется водород. В результате напряжение, которое нужно приложить к
электролизной ячейке, должно составить
U = (E
анкаткатан
ΔEΔEΔU)E
В большинстве случаев выбор между конкурирующими реакциями при электролизе можно сделать на
основании следующих правил:
1. Если металл в ряду стандартных электродных потенциалов стоит правее водорода, то на катоде
восстанавливается металл.
2. Если металл в ряду стандартных электродных потенциалов стоит левее алюминия (включительно), на
катоде восстанавливается либо ион водорода, либо вода по уравнению (9-82).
3. Если металл в ряду стандартных электродных потенциалов занимает место между алюминием и
водородом, на катоде идет параллельное восстановление и металла, и водорода или воды.
4. Если электролит содержит анионы кислородсодержащих кислот, гидроксила или фторид-анион, на аноде
окисляется вода по уравнению (9-83). Во всех остальных случаях на аноде окисляется анион электролита. Такой
порядок окисления восстановителей на аноде объясняется тем, что полуреакции
F
2
+ 2e
-
=2F
-
отвечает очень высокий электродный потенциал
(E
2,87 В), и она практически никогда не реализуется, если
имеется другая конкурирующая реакция. Что же касается кислородсодержащих анионов, то продуктом их
окисления является молекулярный кислород, которому соответствует высокое перенапряжение (0,5 В на
платиновом электроде). По этой причине, в частности, при электролизе водных растворов хлоридов на аноде
окисляются ионы хлора, хотя электродный потенциал полуреакции
2Cl
-
- 2e
-
= Cl
2
;
B 1,36E
выше, чем электродный потенциал окисления воды (E
0
= 1,23 В).
На процесс электролиза оказывает влияние также материал электрода. Различают инертные электроды,
которые не изменяются в процессе электролиза (графит, платина), и активные электроды, подвергающиеся при
электролизе химическим изменениям.
Рассмотрим некоторые примеры электролиза растворов.
Пример 1. Электролиз водного раствора сульфата меди с инертными электродами.
CuSO
4
= Cu
2+
+ SO
2
4
Катодный процесс: Cu
2+
+ 2e
-
= Cu; E˚ = 0,34 B | 2
Анодный процесс: 2H
2
O - 4e
-
= 4H
+
+ O
2
; E˚ = 1,23 B
| 1
Уравнение электролиза: 2Cu
2+
+ 2H
2
O = 2Cu + 4H
+
+ O
2
или
2СuSO
4
+ 2H
2
O = 2Cu + 2H
2
SO
4
+ O
2
Пример 2. Электролиз водного раствора сульфата меди с медным анодом.
Катодный процесс: Сu
2+
+ 2e
-
= Cu; E˚ = 0,34 B
Анодный процесс: Cu
0
- 2e
-
= Cu
2+
; E˚ = 0,34 B
Электролиз сводится к переносу меди с растворяющегося анода на катод.
Пример 3. Электролиз водного раствора сульфата натрия с инертными электродами.
Na
2
SO
4
= 2Na
+
+ SO
2
4
Kатодный процесс: 2H
2
O + 2e
-
= H
2
+ 2OH
-
; E˚ = -0,83 B | 2
Анодный процесс: 2H
2
O - 4e
-
= 4H
+
+ O
2
; E˚ = 1,23 B | 1
Уравнение электролиза: 2H
2
O = 2H
2
+ O
2
Электролиз сводится к разложению воды.
Пример 4. Электролиз водного раствора хлорида натрия с железным катодом.
NaCl = Na
+
+ Cl
-
166

Катодный процесс: 2H
2
O + 2e
-
= H
2
+ 2OH
--
= -0,83 B | 1
Анодный процесс: 2Cl
-
- 2e
-
= Cl
2
; E˚ = 1,36 B | 1
Уравнение электролиза: 2Cl
-
+ 2H
2
O = H
2
+ Cl
2
+ 2OH
-
или
2NaCl + 2H
2
O = 2NaOH + H
2
+ O
2
Электролиз широко используется в промышленности для получения ряда активных металлов (алюминия,
магния, щелочных и щелочноземельных металлов), водорода, кислорода, хлора, гидроксида натрия, пероксида
водорода, перманганата калия и ряда других практически важных веществ. Электролиз применяется также для
защиты металлов от коррозии путем нанесения на защищаемый объект прочных металлических пленок.
9.4. Коллоидные растворы
9.4.1. Общая характеристика коллоидных растворов и методы их получения.
Если какую-либо фазу подвергнуть измельчению (диспергированию) и равномерно распределить в другой
фазе, то полученная при этом система называется дисперсной; фаза, подвергнутая диспергированию,
называется дисперсной фазой (ДФ), а фаза, в которой ДФ распределена, - дисперсионной средой (ДС).
По размерам частиц ДФ дисперсные системы подразделяются на два типа:
1. Грубодисперсные системы. Диаметр частиц ДФ превышает 10
-5
см (100 нм). По агрегатному состоянию ДФ
грубодисперсные системы подразделяют на суспензии (ДФ твердая) и эмульсии (ДФ жидкая). Примером
суспензии может служить взмученная в воде глина, примером эмульсии - молоко. Грубодисперсные системы
неустойчивы и при стоянии самопроизвольно разделяются на ДФ и ДС.
2. Тонкодисперсные (микрогетерегенные) системы или коллоидные растворы. Коллоидные растворы занимают
промежуточное положение между грубодисперсными системами и истинными растворами, в случае которых
растворенное вещество распадается на молекулы и ионы и перестает образовывать индивидуальную фазу.
Выделение коллоидных растворов в отдельный класс химических объектов обусловлено двумя причинами:
а). коллоидные растворы характеризуются чрезвычайно большой удельной поверхностью дисперсной фазы
V
S
S
уд
,
где S - поверхность частиц, V - их объем; так, поверхность 1 см
3
частиц с диаметром 10
-6
см составляет 600 м
2
.
б). в микрогетерогенных системах значительная часть молекулярных или атомных частиц вещества находится на
поверхности раздела фаз и обладает избыточной поверхностной энергией; очевидно, что в результате этого
свойства вещества в глубине фазы и на ее поверхности не будут одинаковыми.
Фактически в коллоидных системах мы имеем дело с принципиально новым состояние вещества, которое
является предметом изучения отдельной химической дисциплины - коллоидной химии. Коллоидная химия - это
физическая химия дисперсных систем и поверхностных явлений.
Микрогетерогенные системы могут быть классифицированы по ряду признаков.
I. По агрегатному состоянию дисперсной фазы и дисперсионной среды. По этому признаку можно выделить 9
классов дисперсных систем:
Класс ДФ/ДС Система
1 Т/Ж
Коллоидные растворы
твердых веществ (золи)
2 Ж/Ж Эмульсии
3 Г/Ж Пены
4 Т/Т Сплавы, стекла, минералы
5 Ж/Т Студни (гели), капиллярные
системы
6 Г/Т Минералы, пористые системы
7 Т/Г Аэрозоли
8 Ж/Г Аэрозоли
9 Г/Г
Флуктуации плотности
разряженных газов
II. По силе взаимодействия между частицами дисперсной фазы. Различают
а) свободнодисперсные системы (золи), частицы которых слабо взаимодействуют друг с другом;
б) связнодисперсные системы (гели), частицы которых сильно взаимодействуют друг с другом.
III. По природе частиц дисперсной фазы. В этом плане выделяют три группы коллоидных растворов.
1. Суспензоиды - коллоидные растворы, в которых дисперсная фаза сохраняет свою кристаллическую
решетку. Коллоидные частицы в этом случае - это мельчайшие кристаллики ДФ. Суспензоиды образуют
вещества, нерастворимые в данном растворителе. Примером их могут служить коллоидные растворы металлов,
оксидов, малорастворимых гидроксидов и солей. Суспензоиды обычно не очень устойчивы и при изменении
условий могут разрушаться. Они не образуются самопроизвольно. Частицы суспензоидов проходят через
бумажные фильтры, но задерживаются полупроницаемыми мембранами. Максимальные концентрации
суспензоидов малы (порядка 0,1 масс.%); частицы дисперсной фазы малоактивны относительно дисперсионной
среды и слабо гидратируются.
167
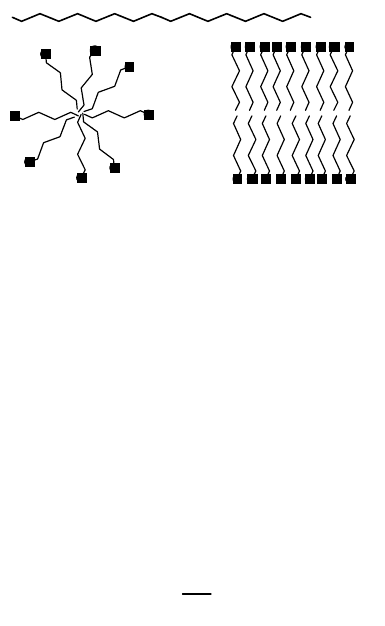
2. Ассоциативные или мицеллярные коллоиды, образованные поверхностно-активными веществами (ПАВ).
Поверхностно-активными веществами называют вещества, способные накапливаться на поверхности раздела
фаз, понижая поверхностное натяжение. Молекулы подобных веществ имеют легко гидратируемую
(гидрофильную) функциональную группу и длинный негидратируемый (гидрофобный) радикал. Примером ПАВ
могут служить натриевые или калиевые соли высших карбоновых кислот (мыла), гидрофильной группой которых
является карбоксильная группа (рис. 68,а). При растворении в воде ионы карбоновых кислот стремятся
"спрятать" углеводородные радикалы, образуя ассоциаты (мицеллы), в которых гидрофобные группы
ориентированы внутрь частицы, а гидрофобные - наружу. Подобные ассоциаты могут быть двух типов:
глобулярные мицеллы (рис. 68,б) и пластинчатые мицеллы (рис. 68,в). Мицеллярные коллоидные растворы
могут образовываться самопроизвольно. Их устойчивость значительно выше, чем устойчивость суспензоидов.
а)
COO
-
Na
+
б) в)
Рис. 68. Мициллярные коллоиды:
а) – молекула ПАВ;
б) – глобулярная мицелла;
в) – пластинчатая мицелла
3. Молекулярные коллоиды, являющиеся растворами высокомолекулярных соединений (белков, полимеров),
молекулы которых имеют размеры коллоидных частиц. Фактически такие растворы являются истинными, но в
связи с размерами частиц им присущи свойства коллоидных растворов. Растворы высокомолекулярных
соединений обладают неограниченной устойчивостью. Если из такого раствора удалить растворитель, то
выделившееся высокомолекулярное соединение можно снова перевести в состояние коллоидного раствора,
добавив растворитель. Поэтому молекулярные коллоиды называют обратимыми.
Коллоидным растворам присущи некоторые специфические свойства. Так, характерным свойством
коллоидных растворов является их способность к светорассеянию. Размеры коллоидных частиц близки к длине
волн видимого света, поэтому свет при прохождении через коллоидный раствор рассеивается. В результате
наблюдатель, глядя на раствор в направлении, перпендикулярном световым лучам, видит светящийся конус
(эффект Фарадея-Тиндаля). Интенсивность рассеяния света обратно пропорциональна четвертой степени длин
волн
4
λ
K
I
В силу этого коллоидные системы наиболее сильно рассеивают лучи синей части спектра, а менее всего -
красной. По этой причине конус Тиндаля имеет голубой цвет.
С малыми размерами коллоидных частиц связано также то, что они находятся в постоянном хаотическом
движении (броуновское движение): в каждый момент времени равнодействующая столкновений коллоидной
частицы с молекулами растворителя не равна нулю, в результате чего частица движется по ломаной траектории.
Поскольку коллоидные растворы занимают промежуточное положение между грубодисперсными системами
и истинными растворами, их можно получать двумя путями: либо измельчением частиц ДФ до размеров
коллоидных частиц (методы диспергирования), либо соединением отдельных атомов, ионов и молекул в
коллоидную частицу (методы конденсации). Получая коллоидный раствор методом диспергирования, вещество,
взятое обычно в виде суспензии, измельчают либо механически с помощью так называемых коллоидных
мельниц, либо действием ультразвука. Методы конденсации более разнообразны. Различают физическую и
химическую конденсацию. В случае физической конденсации для получения коллоидного раствора используют
фазовые переходы. Так, например, коллоидный раствор натрия в бензоле можно получить быстрым
охлаждением смеси паров натрия и бензола (метод конденсации из паров). Коллоидный раствор серы можно
получить методом замены растворителя: насыщенный раствор серы в этаноле, являющийся истинным
раствором, по каплям вводят в большое количество воды, в которой сера нерастворима и переходит в
коллоидное состояние. Для получения коллоидных растворов методами химической конденсации используют
разнообразные реакции образования малорастворимых соединений. Для того, чтобы при этом образовывался
коллоидный раствор, а не осадок, реакцию проводят в очень разбавленных растворах, причем один из реагентов
берется в избытке. Так, коллоидный раствор сульфата бария можно получить, добавив к 0,001М раствору
сульфата натрия небольшие количества раствора хлорида бария. Коллоидный раствор серы получают при
взаимодействии разбавленных растворов тиосульфата натрия и серной кислоты по уравнению
Na
2
S
2
O
3
+ H
2
SO
4
= Na
2
SO
4
+ SO
2
+ S + H
2
O
золь
Для получения коллоидного раствора гидроксида железа(III) используют реакцию гидролиза: в кипящую воду по
каплям добавляют раствор FeCl
3
; образующийся по уравнению
168

FeCl
3
+ 3H
2
O = Fe(OH)
3
+ 3HCl
золь
гидроксид железа (III) в осадок не выпадает, а переходит в коллоидное состояние.
При получении коллоидных растворов металлов часто используют электродуговой метод, сочетающий черты
дисперсионного и конденсационного методов. Например, для получения коллоидного раствора золота в очень
разбавленный раствор карбоната или гидроксида натрия погружают золотые электроды и подают на них
разность потенциалов, достаточную для образования электрической дуги. При температуре электрической дуги
металл электродов испаряется, переходя в атомарное состояние; пары металла, быстро охлаждаясь в растворе,
конденсируются и образуют коллоидные частицы.
Полученные описанными методами коллоидные растворы обычно содержат растворимые примеси. Для
удаления низкомолекулярных примесей используют ряд методов. Основным из них является метод диализа,
основанный на использовании мембран, проницаемых для молекул и ионов, но непроницаемых для коллоидных
частиц. Сосуд, стенки которого полупроницаемы, заполняют коллоидным раствором и погружают в проточную
воду; за счет диффузии низкомолекулярных примесей в воду золь постепенно освобождается от этих примесей.
Очистку золей от ионных примесей можно ускорить, если проводить диализ в электрическом поле
(электродиализ). Другим методом очистки коллоидных растворов является ультрафильтрация: фильтрование
золя под давлением через жесткие мелкопористые фильтры.
9.4.2. Строение коллоидных частиц.
Рассмотрим строение коллоидной частицы суспензоида на примере коллоидного раствора сульфата бария,
полученного методом химической конденсации при взаимодействии хлорида бария с сульфатом натрия, взятом
в избытке:
BaCl
2
+ Na
2
SO
4
= BaSO
4
+ 2NaCl
избыток золь
При взаимодействии реагентов ионы Ва
2+
и SO
2
4
образуют мельчайшие кристаллики сульфата бария
(агрегаты). Если концентрации реагентов велики, эти агрегаты быстро растут и выпадают в осадок. Однако при
низких концентрациях и наличии избытка одного из реагентов в системе начинают протекать процессы
адсорбции, препятствующие укрупнению кристаллов. Адсорбцией называется процесс самопроизвольного
увеличения концентрации частиц на поверхности раздела фаз. Образовавшиеся агрегаты адсорбируют из
раствора определенные ионы; установить, какой из ионов будет концентрироваться на поверхности агрегата,
можно по правилу Фаянса-Паннета: на поверхности твердого тела в первую очередь адсорбируются ионы,
входящие в его кристаллическую решетку или способные замещать какой-либо ион в этой решетке. Эти ионы
называют потенциалопределяющими ионами. В рассматриваемом случае в растворе будут присутствовать ионы
натрия и сульфат-ионы, образующиеся при диссоциации сульфата натрия
Na
2
SO
4
= 2Na
+
+ SO
2
4
Очевидно, что на поверхности агрегатов будут адсорбироваться сульфат-ионы. Агрегат с адсорбированными
потенциалопределяющими ионами образует ядро коллоидной частицы
[│BaSO
4
│
m
∙nSO
2
4
]
где число формульных единиц в агрегате (m) представляет величину порядка нескольких тысяч, а n<<m.
Наличие у ядер одноименного электрического заряда препятствует их дальнейшему укрупнению.
Несущее отрицательный заряд ядро притягивает из раствора ионы противоположного знака, называемые
противоионами. В рассматриваемом случае в роли противоионов выступают катионы натрия. Концентрирование
противоионов у поверхности ядра сопровождается, с одной стороны, понижением энергии системы, что
благоприятствует процессу концентрирования противоионов, а с другой - повышением энтропии системы, что
этому процессу не благоприятствует. В результате 2n катионов натрия, необходимых для компенсации заряда
ядра, образуют два слоя противоионов: адсорбционный, жестко связанный с поверхностью, и диффузный,
противоионы которого обладают определенной подвижностью и с ядром жестко не связаны. Противоионы
адсорбционного и диффузного слоя находятся в состоянии динамического равновесия. При изменении условий
ионы могут переходить из адсорбционного слоя в диффузный и обратно. Ядро с адсорбционным слоем
противоионов образует гранулу, которая является компактной частью коллоидной частицы. Гранула и
диффузный слой противоионов образуют собственно коллоидную частицу или мицеллу. Если из 2n ионов натрия
2(n-x) входят в адсорбционный слой, а 2х - в диффузный, мицелла сульфата бария имеет вид:
{[│BaSO
4
│
m
·nSO
2
4
]2(n-x)Na
+
}
2x-
2xNa
+
│ гранула │
│ мицелла │
Таким образом, мицелла в целом электронейтральна, но гранула имеет заряд; именно этот заряд
препятствует укрупнению коллоидных частиц и обеспечивает устойчивость золя. Схема строения коллоидной
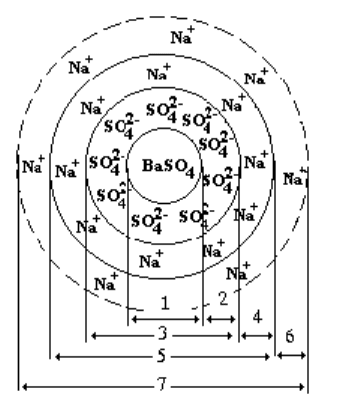
частицы сульфата бария, полученного при избытке сульфат-ионов, показана на рис. 69.
Коллоидная частица пребывает в состоянии хаотического движения; в связи с этим гранула частицы
непрерывно смещается относительно диффузного слоя противоионов, и на границе раздела гранула -
диффузный слой противоионов возникает скачок потенциала, называемый электрокинетическим потенциалом
коллоидной частицы. Наличие у гранулы электрического заряда вызывает ее направленное перемещение в
электрическом поле. Это явление называется электрофорезом. Одновременно к другому электроду, заряд
169
которого одноименен заряду гранулы, перемещаются противоионы, увлекая вместе с собой гидратирующий их
растворитель (явление электроосмоса). В случае рассматриваемого золя сульфата бария коллоидные частицы
будут перемещаться к аноду, а растворитель - к катоду.
Если получить золь сульфата бария при избытке хлорида бария, то в роли потенциалопределяющих ионов в
соответствии с правилом Фаянса-Паннета выступят ионы бария, а в качестве противоионов - ионы хлора. В этом
случае мицелла будет иметь следующее строение:
{[│BaSO
4
│
m
·nBa
2+
]2(n-x)Cl
-
}
2x+
2xCl
-
Рис. 69. Строение коллоидной частицы BaSO
4
, полученной в избытке сульфата натрия:
1 – агрегат; 2 – слой потенциалопределяющих ионов; 3 – ядро; 4 – адсорбционный слой противоионов;
5 – гранула; 6 – диффузный слой противоионов; 7 – мицелла
Как уже отмечалось, коллоидные растворы, в отличие от истинных растворов, термодинамически
нестабильны, однако они способны длительное время существовать без разделения на дисперсную фазу и
дисперсионную среду. Можно выделить две составляющие устойчивости коллоидных растворов:
1. Кинетическая устойчивость. Характеризует способность коллоидных частицмёперн 7- не оседать из
дисперсионной среды. Кинетическая устойчивость обусловлена броуновским движением частиц,
препятствующим их оседанию. Чем меньше размеры частиц, тем выше кинетическая устойчивость золя.
2. Агрегативная устойчивость. Определяет способность золя сохранять степень дисперсности, т.е.
способность системы длительно существовать без укрупнения частиц дисперсной фазы. Агрегативная
устойчивость зависит от двух факторов. Первым из них является электростатический фактор, обусловленный
наличием электрического заряда у гранул, который препятствует их сближению и укрупнению. Вторым фактором
является гидратация коллоидных частиц. Если частицы окружены плотной гидратной оболочкой, то это
препятствует их "склеиванию" и укрупнению. Для суспензоидов этот фактор обычно особого значения не имеет,
так как суспензоиды обычно гидратируются очень слабо (лиофобные коллоиды). Однако для ассоциативных
коллоидов и растворов высокомолекулярных соединений роль этого фактора очень велика (лиофильные
коллоиды).
При изменении условий устойчивость коллоидного раствора может быть нарушена, следствием чего явится
разрушение системы. Так, устойчивость коллоидного раствора понижается, если в него вводить тот или иной
электролит. При добавлении электролита возрастает концентрация противоионов в жидкой фазе, в результате
чего противоионы начинают переходить из диффузного слоя в адсорбционный. Заряд гранулы при этом
понижается, а вероятность столкновения частиц с последующим их склеиванием возрастает. Процесс
укрупнения частиц дисперсной фазы называется процессом коагуляции. Коагулирующее действие электролита
характеризуется порогом коагуляции - минимальной концентрацией коагулятора, достаточной для разрушения
коллоидного раствора. Порог коагуляции очень сильно зависит от заряда коагулирующего иона. Для одно-, двух-
и трехзарядных ионов пороги коагуляции относятся как 1:0,016:0,0014.
Укрупнившиеся частицы дисперсной фазы утрачивают кинетическую устойчивость и оседают на дно сосуда.
Этот процесс называется седиментацией. Процессы коагуляции и седиментации взаимосвязаны: коагуляция
подготавливает седиментацию, седиментация завершает коагуляцию.
Коагуляции коллоидных растворов способствует также повышение температуры, так как такое воздействие
смещает адсорбционное равновесие в сторону десорбции.
Процесс коагуляции в ряде случаев обратим. Обратный переход выпавшего в результате коагуляции и
седиментации осадка в коллоидный раствор называется пептизацией. Пептизация может быть вызвана
введением в раствор избытка потенциалопределяющих ионов. Например, мицелла золя гидроксида железа(III),
образованная при избытке хлорида железа имеет следующее строение:
{[│Fe(OH)
3
│
m
∙nFe
3+
]3(n-x)Cl
-
}
x+
3xCl
-
170
