Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

аА + bB = A
a
B
b
скорость реакции
v = k
.
C
A
.
C
A
...C
A
.
C
B
.
C
B
...C
B
(а раз) (b раз)
или
v = k
b
B
a
A
CC
, (8-41)
где С - концентрации реагентов, k - коэффициент пропорциональности, который не зависит от концентрации и
называется константой скорости реакции. Константа скорости зависит от природы реагирующих веществ и от
температуры; она численно равна скорости реакции при концентрациях реагентов, равных единице. Например,
для одностадийной реакции
2NO + Cl
2
= 2NOCl
v = k
2
Cl
2
NO
CC
Если реакция многостадийна, то закон действия масс и уравнение (8-41) можно применить к каждой стадии
процесса. При этом определяющее влияние на процесс будет иметь скорость самой медленной стадии. Отсюда
следует, что стехиометрические коэффициенты уравнения реакции нельзя переносить в кинетическое уравнение
скорости (8-41), если нет уверенности в том, что эта реакция протекает в одну стадию.
Если реакция гетерогенна, то скорость ее будет зависеть от поверхности соприкосновения веществ,
участвующих во взаимодействии. Так, для реакции
mA(г) + nB(к) = A
m
B
n
(к)
скорость реакции
B
m
A
SkCv
, (8-42)
где S
B
- поверхность вещества В, соприкасающаяся с газом А. Если S
B
допустимо считать величиной постоянной,
то уравнение (8-42) примет вид:
m
A
Ckv
Для реакций между газообразными веществами концентрации в уравнении (8-41) могут быть заменены
парциальными давлениями соответствующих газов, так как в соответствии с уравнением состояния идеального
газа давление и концентрация связаны соотношением
CRTRT
V
ν
p
Так, для реакции
С(графит) + СО
2
(г) = 2СО(г),
которую можно рассматривать как одностадийную,
22
COCO
pkkCv
2. Влияние температуры
C повышением температуры возрастает кинетическая энергия молекул. В результате увеличивается доля
частиц, преодолевших энергетический барьер, определяемый энергией активации процесса, и образовавших
активированный комплекс. Отсюда следует, что с повышением температуры скорость реакции должна
возрастать.
Влияние температуры на скорость реакции позволяет приближенно оценить правило Вант-Гоффа (1884):
При повышении температуры на каждые 10˚С скорость гомогенной реакции возрастает в одно и то же
число раз.
В соответствии с этим правилом
10
TT
12
12
γkk
(8-43)
где k
1
и k
2
- константы скорости реакции при температурах Т
1
и Т
2
, γ - температурный коэффициент скорости
реакции, зависящий от природы реагирующих веществ и принимающий для большинства реакций значения от
двух до четырех. Правило Вант-Гоффа является эмпирическим.
Более строго температурная зависимость скорости реакции передается уравнением С. Аррениуса, согласно
которому
121

RT
E
a
eAk
(8-44)
где А - предэкспоненциальный множитель, физический смысл которого будет объяснен ниже, е - основание
натурального логарифма, Е
а
- энергия активации процесса.
Как следует из уравнений (8-43) и (8-44), скорость процесса резко возрастает с повышением температуры.
Так, например, при стандартных условиях взаимодействие водорода с кислородом протекает чрезвычайно
медленно: для смеси, содержащей 1 моль/л кислорода и 2 моль/л водорода, потребовалось бы 36 миллиардов
лет, чтобы прореагировало 15% этих веществ. При 500˚С для достижения такого же результата потребуется 5
мин, а при 700˚С водород и кислород взаимодействуют практически мгновенно. Таким образом, скорость
химической реакции весьма чувствительна к изменению температуры.
3. Влияние энергии активации
С увеличением энергии активации уменьшается доля частиц, преодолевающих энергетический барьер, что
влечет за собой уменьшение скорости реакции. Взаимосвязь константы скорости с энергией активации выражает
уравнение (8-44). Поскольку температура слабо влияет на энергию активации, при расчетах с использованием
уравнения (8-44) величину Е
а
можно считать для данной реакции постоянной. Влияние энергии активации на
скорость реакции весьма существенно. Так, при стандартных условиях понижение энергии активации на 20 кДж
влечет за собой увеличение константы скорости в 3000 раз, а на 100 кДж в 310
17
раз.
4. Влияние энтропии активации
Необходимым условием осуществления химического акта для реакций столкновения является надлежащая
ориентация молекул в момент столкновения, позволяющая образоваться активированному комплексу. Так, если
для реакции
А
2
+ В
2
= 2АВ
активированный комплекс имеет форму, представленную на рис. 58,а, столкновение, показанное на рис. 58,b
будет благоприятствовать протеканию реакции, а на рис. 58,c - нет. Вероятность надлежащей ориентации
взаимодействующих молекул характеризует энтропия активации S
a
. Изменение этой характеристики в процессе
реакции
1
2
a
W
W
RlnΔS
(8-45)
где W
1
- число возможных ориентаций молекул, W
2
- число ориентаций, благоприятствующих взаимодействию.
Величина ΔS
a
входит в предэкспоненциальный множитель уравнения (8-44):
R
ΔS
a
eZA
(8-46)
где Z - множитель, пропорциональный общему числу столкновений взаимодействующих частиц при
концентрациях, равных 1 моль/л. Для реакций столкновения W
2
< W
1
и ΔS
a
< 0. Для реакций возбуждения W
2
=
W
1
и Δ S
a
= 0. С учетом энтропии активации уравнение (8-44) примет вид:
RT
E
R
ΔS
aa
eZek
(8-47)
Чем сложнее структура молекул, тем меньше будут W
2
, ΔS
a
и, следовательно, константа скорости.
A
A
B
B
A
2
B
2
A
2
B
2
a b c
Рис. 58. Благоприятное (b) и неблагоприятное (c) столкновение при образовании
активированного комплекса (a)
5. Влияние катализатора
122

Катализаторами называют вещества, изменяющие скорость химической реакции, но остающиеся в
результате реакции химически неизмененными и в том же количестве.
Изменение скорости реакции в присутствии катализатора называется катализом.
Катализаторы могут как ускорять, так и замедлять химические процессы. Катализаторы, увеличивающие
скорость реакции, называются положительными, а катализаторы, уменьшающие скорость реакции -
отрицательными или ингибиторами. Так, например, для реакции
2Н
2
О
2
= 2Н
2
О + О
2
положительным катализатором является диоксид марганца MnO
2
, а отрицательным - гептаоксодифосфат натрия
Na
4
P
2
O
7
. Иногда катализатором является один из продуктов реакции. Такое явление называется автокатализом.
Например, реакция окисления щавелевой кислоты перманганатом калия по уравнению:
2MnO
4
+5H
2
C
2
O
4
+ 6H
+
= 2Mn
2+
+ 10CO
2
+ 8Н
2
О (8-48)
непосредственно после смешивания растворов реагентов протекает весьма медленно, однако постепенно
скорость процесса возрастает, достигает максимума, а затем начинает понижаться. Это явление,
противоречащее, казалось бы, закону действия масс, связано с тем, что реакцию (8-48) катализируют ионы Mn
2+
,
концентрация которых по мере протекания реакции возрастает.
Характерной чертой катализаторов является избирательность их действия. Зачастую одни и те же реагенты
в присутствии различных катализаторов образуют разные продукты взаимодействия. Так, при нагревании паров
этанола может происходить как его дегидратация, так и его дегидрирование. Первая реакция катализируется
оксидом алюминия, вторая - медью:
Al
2
O
3
С
2
Н
5
ОН = С
2
Н
4
+ Н
2
О
Cu
C
2
H
5
OH = CH
3
CHO + H
2
По фазовому состоянию различают гомогенные и гетерогенные катализаторы. Гомогенный катализатор
находится в одной фазе с реагирующими веществами; катализ в этом случае называют гомогенным катализом.
Гетерогенный катализатор образует самостоятельную фазу. Изменение скорости реакции под действием
гетерогенного катализатора, называется гетерогенным катализом; в этом случае процесс протекает на
поверхности раздела фаз. Так, для реакции разложения пероксида водорода Na
4
P
2
O
7
является гомогенным
катализатором, а MnO
2
- гетерогенным.
Механизм действия катализаторов (как гомогенных, так и гетерогенных) сводится к тому, что катализатор
изменяет энергию активации процесса, понижая ее при положительном катализе и повышая при отрицательном.
Механизм гомогенного катализа объясняет теория промежуточных соединений, согласно которой
катализатор вступает во взаимодействие с одним или несколькими реагентами, образуя интермедиаты, которые
затем вступают в реакцию, сопровождающуюся освобождением катализатора.
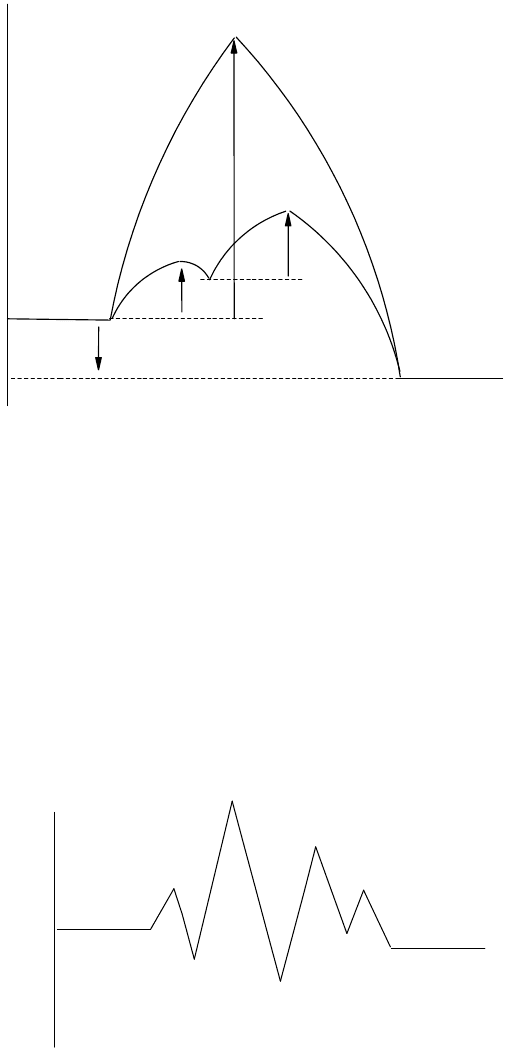
Пусть реакция
А + В = АВ = АВ
характеризуется высокой энергией активации (Е
а
) и протекает медленно. В присутствии катализатора К эта
реакция осуществляется в две стадии
А + К =АК = АК
АК + В = АКВ = АВ + К
с энергиями активации E
а
΄ и Е
а
˝. Если энергия активации каждой стадии меньше Е
а
, скорость реакции возрастет,
и в системе будет иметь место положительный катализ. Путь такой реакции показан на рис. 59. Еcли окажется,
что E
а
΄ < Е
а
, но Е
а
˝ > Е
а,
то катализатор поведет реакцию по пути с большей энергией активации и скорость
реакции уменьшится (отрицательный катализ или ингибирование).
123
A + B + K
A
...
K + B
...
AK + B
AK
...
B
...
AB + K
A
...
B
...
E
a
E
a
'
E
a
"
H
Рис. 59. Механизм гомогенного катализа
Механизм гетерогенного катализа более сложен и включает стадию адсорбции одного из реагентов на
активных центрах поверхности катализатора. Активные центры представляют совокупности атомов, обладающие
избыточной поверхностной энергией и геометрическим соответствием молекулам адсорбируемого реагента.
Адсорбированная молекула деформируется силовым полем активного центра, ее реакционная способность
повышается, она образует поверхностное соединение с катализатором, которое затем легко взаимодействует с
другим реагентом. В результате принцип геометрического соответствия реагента и активного центра
нарушается, и продукт реакции десорбируется, освобождая место для следующего химического акта. Стадии,
через которые проходит реакция
А + В = АВ,
катализируемая гетерогенным катализатором, схематически показаны на рис. 60. Молекула А переходит в
активированное состояние, обеспечивающее адсорбцию А на катализаторе. Далее катализатор и А образуют
активированный комплекс АК, а затем промежуточное соединение АК. Это соединения образует с реагентом
В активированный комплекс АКВ, который затем превращается в адсорбированный продукт реакции АВ с
освобождением катализатора. Последняя стадия процесса - десорбция соединения АВ, которой предшествует
активизация адсорбированных молекул АВ.
A + B + K
AB + K
H
1
2
3
4
5
6
7
Рис. 60. Механизм гетерогенного катализа: 1 – активированные для адсорбции молекулы А;
2 – адсорбированные молекулы А;
3 – активированный комплекс АК;
4 – промежуточное соединение АК;
5 – активированный комплекс АКВ;
6 – адсорбированное соединение АВ;
7 – активированные для десорбции молекулы АВ
На действие катализатора могут оказывать влияние те или иные вещества. Вещества, усиливающие
действие катализатора, называются промоторами (активаторами). Так, незначительные добавки сульфатов
щелочных металлов значительно повышают активность V
2
O
5
, катализирующего окисления оксида серы(IV) в
оксид серы(VI) (сернокислотное производство). Вещества, снижающие или полностью подавляющие активность
катализатора, называются каталитическими ядами. Так, при окислении SO
2
в SO
3
в присутствии платины
платиновый катализатор быстро выходит из строя, если диоксид серы содержит следы летучих соединений
мышьяка. Действие промоторов и каталитических ядов связано с тем, что они изменяют количество активных
124

центров на поверхности катализатора, причем первые способствуют их формированию, а вторые - разрушают
или блокируют активные центры.
В качестве конкретного примера гомогенного катализа рассмотрим процесс термического разложения
ацетальдегида. Реакция
СН
3
СНО = СН
4
+ СО
протекает медленно, так как энергия активации процесса велика. Катализатором для этой реакции является
газообразный иод, в присутствии которого взаимодействие протекает по уравнениям:
СН
3
СНО + I
2
= CH
3
I + HI + CO,
CH
3
I + HI = CH
4
+ I
2
Промежуточными соединениями в этой реакции являются CH
3
I и HI.
8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции.
Механизмы реакций.
Химические реакции можно классифицировать по числу частиц, вступающих во взаимодействие.
Число частиц, участвующих в элементарном химическом акте одностадийной реакции, называется
молекулярностью реакции. Выделяют следующие группы реакций:
1. Мономолекулярные реакции. В химическом акте участвует одна частица в соответствии с уравнением:
A = X + Y + ...
Кинетическое уравнение для мономолекулярных реакций имеет вид:
v = kC
A
Примером подобных реакций могут служить реакции изомеризации и разложения, например, реакция
разложения азометана
H
3
C-N=N-СH
3
N
2
+ C
2
H
6
,
скорость которой пропорциональна концентрации азометана. Не следует, однако, считать, что все реакции, в
которых участвует лишь один реагент, - это мономолекулярные реакции. Известно много реакций большей
молекулярности, протекающих при столкновении одинаковых молекул.
2. Бимолекулярные реакции. В элементарном химическом акте взаимодействуют две частицы (разные или
одинаковые) по уравнению:
А + В = X + Y + ...
В этом случае
v = kC
A
C
B
Это весьма распространенная группа реакций, примером которых могут служить реакции гидролиза (омыления)
сложных эфиров, например
СН
3
СООС
2
Н
5
+ ОН
-
CH
3
COO
-
+ C
2
H
5
OH
3. Тримолекулярные реакции. Число частиц, участвующих в химическом акте, равно трем, что соответствует
уравнениям:
A + B + D = X + Y + ...,
v = kC
A
C
B
C
D
Подобные реакции встречаются весьма редко, так как вероятность одновременного столкновения трех частиц
очень мала. Примером тримолекулярной реакции может служить реакция образования оксохлорида азота(III)
2NO + Cl
2
= 2NOCl
Cкорость этой реакции пропорциональна концентрации хлора и квадрату концентрации оксида азота(II):
2
Cl
2
NO
CkCv
Реакции, молекулярность которых выше трех, невозможны: слишком мала вероятность одновременного
столкновения четырех и более частиц.
Если реакция включает несколько стадий, каждой из них отвечает определенная молекулярность. Так
реакция
H
2
+ I
2
= 2HI
протекает в две стадии (раздел 8.3.1.)
I
2
= 2I,
2I + H
2
= 2HI
первая из которых мономолекулярна, а вторая - тримолекулярна.
125

Определение молекулярности отдельных стадий многостадийныых реакций - весьма сложная задача,
которая не всегда может быть решена достаточно надежно. В силу этого для кинетической характеристики
сложных многостадийных процессов используется так называемый порядок реакции.
Пусть реакция, число и характер стадий которой неизвестны, протекает по суммарному уравнению
аА + bB + ... = dD + ..., (8-49)
где a, b, d - стехиометрические коэффициенты. Экспериментальное исследование этой реакции показало, что ее
скорость пропорциональна концентрации А, возведенной в степень α, и концентрации В в степени β
(естественно, α и β не равны а и b). Тогда скорость реакции (8-49)
β
B
α
A
CkCv
Сумма показателей степеней при концентрациях в кинетическом уравнении называется общим
порядком данной реакции, а сами показатели степени - порядками по каждому веществу. Так, порядок
реакции
(8-49) равен α + β; реакция имеет порядок α по веществу А и порядок β по веществу В.
В качестве конкретного примера рассмотрим кинетику реакции окисления ионов Tl
+
ионами Co
3+
2Co
3+
+ Tl
+
= 2Co
2+
+ Tl
3+
(8-50)
Для этой реакции экспериментальным путем были получены следующие данные:
№
эксперимента
3
Co
C
, моль/л
Tl
C
, моль/л
v,
условн. ед.
1 0,1 0,1 1
2 0,3 0,1 3
3 0,3 0,2 6
4 0,3 0,3 9
5 0,4 0,1 4
Сопоставление значений скорости реакции для смесей с одинаковыми концентрациями Со
3+
(№№ 2, 3, 4)
свидетельствуют, что скорость процесса пропорциональна концентрации Tl
+
в первой степени. В смесях с
одинаковыми концентрациями ионов Tl
+
(№№ 1,2,4) скорость реакции также прямо пропорциональна первой
степени концентрации Со
3+
. Отсюда можно заключить, что реакция (8-50) является реакцией второго порядка,
порядки реакции по Со
3+
и Tl
+
равны единице, а кинетическое уравнение реакции имеет вид:
TlCo
CkCv
3
На практике порядок реакции обычно устанавливают, подбирая такие значения показателей степеней при
концентрациях, которые обеспечивали бы постоянство константы скорости. С этой целью используют уравнения,
связывающие константу скорости с концентрацией реагентов и временем протекания реакции. Выведем такое
уравнение для мономолекулярных реакций. Пусть для реакции
А = В + ...
в начальный момент времени концентрация А равнялась С
0
моль/л, а спустя время уменьшилась до С моль/л.
Тогда скорость реакции
kC
dτ
dC
dτ
C)d(C
v
0
или
kdτ
C
dC
(8-51)
Интегрируя левую и правую части уравнения (8-51) в пределах от С
0
до С и от нуля до , имеем
kτ
C
C
ln
0
или
C
C
ln
τ
1
k
0
(8-52)
Если та или иная реакция является реакцией первого порядка, то независимо от числа стадий процесса она
будет следовать уравнению (8-52). Следовательно, если подстановка значений С для различных значений
приводит к одинаковым значениям k, можно утверждать, что исследуемая реакция является реакцией первого
порядка. Если окажется, что величины k, рассчитанные по (8-52), не являются постоянными, проверяют
126

соответствие реакции уравнениям скорости бимолекулярных и тримолекулярных реакций. С этими уравнениями
Вы познакомитесь в курсе физической химии. Если и эти операции окажутся неудачными, пытаются эмпирически
подобрать подходящие порядки реакции по каждому веществу.
Порядок реакции, таким образом, является чисто формальной величиной, позволяющей количественно
охарактеризовать скорость реакции, но не дающей информации о числе стадий процесса и их характере. В силу
этого порядок реакции может принимать дробные, нулевые и даже отрицательные значения. Так, например,
скорость реакции разложения гидрида сурьмы на поверхности сурьмы описывается уравнением
0,6
SbH
3
kCv
Реакции каталитического окисления оксида углерода(II) на платиновом катализаторе
Pt
2СО + О
2
= 2СО
2
соответствует кинетическое уравнение
CO
O
C
C
kv
2
т.е. общий порядок этой реакции равен нулю, а порядки по кислороду и оксиду углерода(II) равны
соответственно 1 и -1.
Как указывалось в разделе 8.3.1, химическая кинетика изучает не только скорости, но и механизмы
химических реакций. Различают молекулярный, ионный и радикальный механизмы химических процессов.
1. Молекулярный механизм. Реакция протекает между молекулами. Например, молекулярный механизм
соответствует реакции разложения этана под воздействием ультрафиолетового излучения
hν
С
2
Н
6
= С
2
Н
4
+ Н
2
В этом случае молекула этана, поглотив квант лучистой энергии, переходит в возбужденное состояние
(активированный комплекс), а затем разрушается, образуя этилен и водород.
2. Ионный механизм. Реагирующие вещества распадаются на ионы, между которыми затем протекает
реакция. Примером подобных процессов являются разнообразные реакции в растворах электролитов. Обычно
такие реакции отличаются низкими энергиями активации и высокими скоростями.
3. Радикальный механизм. Реакция включает стадию образования радикалов, т.е. частиц, содержащих
неспаренные электроны. Энергия активации радикальных реакций мала, так как реакционная способность
радикалов весьма высока. Радикалами могут быть как отдельные атомы с неспаренными электронами
(например, Н, Cl, О), так и атомные агрегаты (ОН, NH
2
, СН
3
). Примером радикальной реакции может
служить вторая стадия взаимодействия иода с водородом
2I + H
2
= 2HI,
энергия активации которой составляет 18 кДж/моль. Заметим, что первой стадии этого процесса соответствует
молекулярный механизм.
8.3.4. Некоторые типы многостадийных реакций.
Среди многостадийных химических процессов можно выделить несколько групп реакций, представляющих
особый интерес: это параллельные, последовательные, сопряженные и цепные реакции.
Параллельные реакции представляют системы реакций, имеющих одинаковые исходные вещества, но
разные продукты взаимодействия. Так, например, при нагревании триоксохлората(V) калия KClO
3
одновременно
протекают две реакции:
2KClO
3
= 2KCl + 3O
2
(8-53)
и
4KClO
3
= 3KClO
4
+ KCl (8-54)
В случае реакции (8-53) одним из продуктов взаимодействия является кислород, а в случае реакции (8-54) -
тетраоксохлорат(VII) калия - KClO
4
. Можно добиться преимущественного протекания одной из этих реакций. Так,
при введении в систему катализатора MnО
2
взаимодействие преимущественно протекает по уравнению (8-53).
Но и в этом случае какие-то количества KClO
4
будут образовываться.
Последовательные реакции - это системы реакций, в которых каждый продукт предшествующей стадии
является реагентом в последующей стадии. Последовательные реакции очень распространены. Так, например,
при электрохимическом окислении хлорида калия до тетрахлората(VII) калия, протекающем на аноде по
суммарному уравнению
Cl
-
+ 4H
2
O – 8e
-
= ClO
4
+ 8H
+
промежуточными продуктами, подвергающимися последующему окислению, являются хлор и ионы ClO
-
,ClO
2
,
ClO
3
.
127

Сопряженными реакциями называются процессы, один из которых инициирует другой. Примером подобных
реакций может служить окисление триоксобромной(V) кислотой HBrO
3
сернистой и триоксомышьяковой(III)
кислот при их совместном присутствии. H
2
SO
3
и H
3
AsO
3
являются восстановителями, окисляющимися достаточно
активными окислителями до H
2
SO
4
и H
3
AsO
4
. Триоксобромная(V) кислота окисляет H
2
SO
3
, но не окисляет H
3
AsO
3
;
однако при действии HBrO
3
на смесь этих кислот, окисляется как сернистая, так и триоксомышьяковая(III)
кислота. Это явление объясняется тем, что восстановление НВrO
3
сернистой кислотой протекает ступенчато;
образующаяся в качестве промежуточного продукта оксобромная(I) кислота НВrО способна окислять H
3
AsO
3
.
Цепные реакции - это сложные системы параллельных, последовательных и сопряженных реакций, в случае
которых первичное активирование частицы приводит к превращению большого числа молекул.
Простейшим типом цепных реакций являются реакции с неразветвленными цепями. Эти цепные реакции
включают стадии зарождения, продолжения и обрыва цепи. Рассмотрим неразветвленную цепную реакцию,
протекающую при действии света на смесь водорода с хлором. Зарождением цепи в этом случае является
реакция образования атомных радикалов хлора при поглощении молекулой хлора кванта лучистой энергии
hν
Cl
2
= 2Cl
Продолжение цепи обеспечивается протеканием реакций
H
2
+ Cl = HCl + H
H+ Cl
2
= HCl + Cl
.................................
Обрыв цепи может произойти за счет образования молекул водорода и хлора из радикалов:
Н + Н = Н
2
Cl + Cl = Cl
2
Заметим, однако, что далеко не всегда образование молекул Н
2
и Cl
2
из атомов обрывает цепь. Образовавшиеся
из атомарного водорода или хлора молекулы обладают избыточной энергией и очень легко вновь распадаются
на атомы. Для обрыва цепи необходимо, чтобы какая-нибудь частица увела избыточную энергия от "горячих"
молекул Н
2
и Сl
2
. Это наблюдается, когда столкновение происходит на стенке сосуда или при столкновении
"горячей молекулы" в момент ее образования с какой-нибудь частицей, которой может быть передана
избыточная энергия. Радикалы могут также связываться примесями, присутствующими в системе. Средняя
длина цепи зависит от природы реагирующих веществ. При фотосинтезе хлороводорода поглощение кванта
лучистой энергии приводит к образованию нескольких десятков тысяч молекул хлороводорода.
Более сложным типом цепных реакций являются разветвленные процессы, включающие стадии, когда из
одного радикала образуются два и более новых радикалов. Эта стадия называется разветвлением цепи.
Примером подобного процесса может служить взаимодействие водорода с кислородом, включающее следующие
стадии:
Н
2
+ О
2
= ОН + ОН, (8-55)
Н
2
+ОН = Н
2
О +Н, (8-56)
Н+ О
2
= ОН + О, (8-57)
Н
2
+ О = ОН + Н (8-58)
....................................
Реакция (8-55) соответствует зарождению цепи, (8-56) - продолжению цепи, (8-57) и (8-58) - разветвлению цепи.
Подобные реакции обычно протекают лавинообразно и приводят к взрыву.
8.4. Химическое равновесие
8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
Химические реакции могут быть подразделены на необратимые и обратимые процессы. Необратимые
реакции протекают в направлении превращения реагентов в продукты реакции до тех пор, пока хотя бы один из
реагентов не прореагирует количественно. Примером необратимых процессов могут служить реакции
2KClO
3
= 2KCl + 3O
2
,
Cu + 4HNO
3
= Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O
Обратимые реакции способны протекать одновременно в двух противоположных направлениях; в случае таких
процессов взаимодействие исходных веществ приводит к образованию продуктов реакции (прямая реакция),
которые, однако, способны взаимодействовать друг с другом с образованием исходных веществ (обратная
реакция). К таким реакциям можно отнести взаимодействие азота с водородом:
N
2
+ 3H
2
2NH
3
Заметим, что многие реакции, кажущиеся необратимыми, фактически таковыми не являются. Например, реакция
осаждения сульфата бария или реакция нейтрализации
Ba
2+
+ SO
2
4
= BaSO
4
↓,
128
H
+
+ OH
-
= H
2
O
являются, строго говоря, обратимыми, так как сульфат бария в какой-то мере растворим, а вода, пусть крайне
незначительно, но все же диссоциирует на ионы водорода и гидроксила. О таких реакциях говорят, что они
практически необратимы.
Пусть в системе протекает обратимая гомогенная одностадийная реакция
aA + bB dD + eE (8-59)
Кинетические уравнения, отвечающие этой реакции, имеют вид:
b
B
a
A11
CCkv
(прямая реакция), (8-60)
e
E
d
D22
CCkv
(обратная реакция) (8-61)
Если смешать некоторые количества веществ А и В, то в первый момент скорость прямой реакции будет
максимальна, а скорость обратной реакции будет равна нулю, так как веществ D и Е в системе нет. По мере
образования веществ D и Е скорость прямой реакции будет уменьшаться, а скорость обратной реакции -
увеличиваться. В конце концов, скорость прямой реакции станет равна скорости обратной реакции, после чего
изменение концентраций реагентов и продуктов реакции прекратится: в единицу времени будет образовываться
столько молей D и Е, сколько молей этих веществ будет превращаться в А и В.
Состояние системы, в котором скорости прямой и обратной реакции равны, называется химическим
равновесием.
Концентрации реагентов и продуктов реакции, при которых система находится в состоянии равновесия,
называются равновесными концентрациями. Равновесные концентрации обычно обозначают, заключая формулу
соответствующего соединения в квадратные скобки.
Если система находится в состоянии равновесия (v
1
=v
2
), правые части уравнений (8-60) и (8-61) равны, т.е.
k
1
[A]
a
[B]
b
= k
2
[D]
d
[E]
e
,
откуда
ba
ed
2
1
BA
ED
k
k
Отношение констант скорости есть величина постоянная, не зависящая от концентрации. Эта величина
называется константой равновесия
ba
ed
2
1
BA
ED
k
k
K
(8-62)
Таким образом, для системы, находящейся в состоянии равновесия, отношение произведения концентраций
продуктов реакции к произведению концентраций реагентов является постоянной для данной реакции и данной
температуры величиной, называемой константой равновесия. Константа равновесия не зависит от концентраций,
но зависит от природы реагирующих веществ и температуры. Заметим, что любое равновесие может
устанавливаться при различных значениях равновесных концентраций. Необходимо лишь, чтобы выражение
ba
ed
BA
ED
равнялось константе равновесия вне зависимости от того, чему равны величины [A], [B], [D] и [E].
Если реакция протекает между газообразными веществами, то концентрации взаимодействующих веществ в
уравнении (8-63) могут быть заменены парциальными давлениями газов в газовой смеси, так как давление газа
пропорционально его концентрации. В этом случае
b
B
a
A
e
E
d
D
pp
pp
K
Поскольку, согласно уравнению состояния идеального газа (1-9),
RT
p
C
,
численные значения К и К′ будут различными.
Пусть реакция
А + 2В АВ
2
(8-63)
протекает в две стадии
А + В АВ;
BA
AB
K
1
(8-64)
AB + B AB
2
;
BAB
][AB
K
2
2
(8-65)
129

Найдем произведение констант равновесия реакций (8-64) и (8-65):
2
2
21
BA
][AB
KK
= К (8-66)
Произведение К
1
.
К
2
есть константа равновесия реакции (8-63), рассчитанная в предположении, что эта реакция
одностадийна. Таким образом, независимо от числа промежуточных стадий стехиометрические коэффициенты
уравнения реакции входят в уравнение константы равновесия как показатели степени при соответствующих
концентрациях. Так, реакция
N
2
+ 3H
2
2NH
3
явно не может быть одностадийной, однако для нее
3
22
2
3
]][H[N
][NH
K
Рассмотрим, в какой мере уравнение (8-62) может быть применено к гетерогенным процессам. Пусть
вещества В и Е в уравнении (8-59) являются кристаллическими. Тогда скорости прямой и обратной реакции
будут пропорциональны не концентрациям, а поверхностям (S) веществ В и Е:
B
a
A11
SCkv
,
E
d
D22
SCkv
В состоянии равновесия поверхности S
В
и S
Е
будут постоянны и войдут в значение константы равновесия.
Отсюда для гетерогенного процесса
a
d
[A]
[D]
K
Таким образом, уравнение (8-62) применимо и для гетерогенных процессов, но концентрации веществ,
образующих индивидуальную фазу, в него не включаются. Например, для реакции
СаСО
3(к)
СаО
(к)
+ СО
2(г)
K = [CO
2
]
т.е. равновесие устанавливается тогда, когда концентрация (или давление) диоксида углерода достигает
определенного значения.
Еще раз подчеркнем, что установление химического равновесия отнюдь не означает, что в системе
прекращается протекание прямой и обратной реакций. Эти реакции продолжают протекать, но с одинаковой
скоростью. Химическое равновесие, таким образом, является динамическим, т.е. подвижным.
Рассмотрим термодинамические условия установления состояния равновесия. Химическое равновесие
всегда устанавливается самопроизвольно и, следовательно, является состоянием, наиболее устойчивым в
данных условиях. Независимо от того, скорость какого процесса, прямого или обратного, преобладает в
неравновесной системе, переход к равновесию сопровождается понижением свободной энергии Гиббса. Отсюда
следует, что в состоянии равновесия энергия Гиббса принимает минимальное значение. Это значение G будет
сохраняться, пока равновесие не будет нарушено. Отсюда следует, что пока система пребывает в состоянии
равновесия, ΔG для нее равно нулю. Константа равновесия связана с изменением энергии Гиббса уравнением
RTlnKΔG
T
, (8-67)
где
T
ΔG
- изменение энергии Гиббса при температуре Т, стандартном давлении и концентрациях веществ,
участвующих во взаимодействии, равных 1 моль/л. Вывод уравнения (8-67) будет рассмотрен в курсе
физической химии.
8.4.2. Смещение химического равновесия.
Если в системе установилось химическое равновесие, концентрации реагентов и продуктов реакции могут
оставаться постоянными сколь угодно долго. Однако изменение условий, в которых находится система, может
привести к нарушению равновесия. При этом равенство (8-62) будет нарушено в результате изменения либо
концентраций участвующих во взаимодействии веществ, либо значения константы равновесия. В результате
какое-то время одна из реакций (прямая или обратная) будет протекать со скоростью, превышающей скорость
второй реакции; спустя некоторое время равновесие в системе восстановится, но уже при других значениях
равновесных концентраций.
Изменение равновесных концентраций, обусловленное нарушением условий равновесия, называется
смещением равновесия. Если при этом увеличиваются равновесные концентрации продуктов реакции, говорят о
130
