Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


замещаются с одинаковой вероятностью. Пусть на молекулу аммиака заместился Сl(1) (рис. 43, б). Теперь
наименьшее транс-влияние в комплексе будет испытывать Сl(3), транс-лигандом которого является молекула
аммиака, тогда как транс-лигандами Сl(2) и Сl(4) будут ионы хлора, располагающегося в ряду транс-влияния
левее аммиака. Поэтому на второй стадии процесса произойдет замещение на аммиак либо Сl(2), либо Cl (4); и в
том, и в другом случае образуется цис-изомер дихлородиамминплатины (рис. 43, в). При протекании реакции (6-
4) на первой стадии на ион хлора может с равной вероятностью заместиться любая молекула аммиака, так как
все они испытывают одинаковое транс-влияние со стороны NH
3
(рис. 44, а, б). На второй стадии процесса
заместится та молекулу аммиака, транс-лигандом которой является ион хлора, т. е. NH
3
(3), с образованием
транс-изомера.
Pt
H
3
N NH
3
H
3
N NH
3
+ Cl
-
- NH
3
Pt
H
3
N NH
3
H
3
N Cl
+ Cl
-
- NH
3
Pt
Cl NH
3
H
3
N Cl
2 1
3 4
2 1
2 1
3 4
3 4
Рис. 44. Образование транс-измера [Pt(NH
3
)
2
Cl
2
]
Экспериментальные данные подтверждают, что продуктом реакции (2) является цис-изомер, а продуктом
реакции (3) транс-изомер дихлородиамминплатины.
7. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
7.1. Типы агрегатного состояния
При разных температурах и давлениях вещества могут иметь различный уровень организации, т. е.
находиться в различных агрегатных состояниях. В зависимости от расстояния между частицами в веществе,
соотношения потенциальной и кинетической энергии частиц, а также силы их взаимодействия можно выделить
четыре типа агрегатного состояния: твердое, жидкое, газообразное и плазменное.
По степени упорядоченности частиц вещества указанные типы агрегатных состояний делятся на
конденсированные и неконденсированные. Для конденсированных состояний характерен высокий уровень
упорядоченности. Различают ближний и дальний порядок, присущие веществу. Под ближним порядком
понимают упорядоченное расположение частиц лишь на относительно малых расстояниях (около 5-10 нм).
Образуемые при этом агрегаты частиц находятся в состоянии хаотического движения. Дальний порядок
подразумевает упорядочение частиц на любых расстояниях в рассматриваемом образце. Для конденсированных
систем характерным является то, что объем их мало зависит от температур и, особенно, от давления. К
конденсированному состоянию относят твердое и жидкое состояние.
Неконденсированное состояние характеризуется низким уровнем упорядоченности вещества, при котором
взаимодействие между частицами незначительно, и им зачастую можно пренебречь. Вещество в
неконденсированном состоянии не имеет постоянного объема, а стремится равномерно распределиться в
предоставленном ему пространстве. Таким состояниями являются газообразное и плазменное.
Каждое конкретное химическое вещество не обязательно способно существовать во всех агрегатных
состояниях. Так, например, карбонат кальция CaCO
3
или малахит Cu
2
(OH)
2
CO
3
не могут существовать в жидком
и газообразном состояниях: при нагревании эти вещества разлагаются на оксид металла, диоксид углерода и, в
случае малахита, воду.
Остановимся на характеристике каждого из указанных состояний вещества.
7.2. Твердое состояние вещества
Для вещества, находящегося в твердом состоянии, расстояние между частицами являются величинами того
же порядка, что и размеры частиц, а средняя потенциальная энергия частиц много больше их средней
кинетической энергии. Поэтому движение частиц в твердом веществе весьма ограничено: они не движутся
поступательно, хотя и совершают колебательные движения относительно некоторых центров. В результате
твердые вещества при постоянных условиях сохраняют не только свой объем, но и форму. Твердое состояние
весьма характерно для веществ: все вещества при достаточно низких температурах и высоких давлениях могут
существовать в твердом состоянии. При стандартных условиях около 95% веществ являются твердыми.
Твердые вещества подразделяются на кристаллические и аморфные.
7.2.1. Кристаллическое состояние.
Кристаллическое состояние наиболее типично для твердых веществ. Главной особенностью
кристаллических тел является наличие в них дальнего порядка: частицы вещества определенным образом
ориентируются друг относительно друга, образуя пространственную кристаллическую решетку, состоящую из
повторяющихся фрагментов. Любая кристаллическая решетка может быть представлена как трансляция
некоторого элемента ее, называемого элементарной ячейкой. При построении элементарной ячейки проводят
три координатные оси (кристаллографические оси), образующие углы (, , ), которые соответствуют
выбранному кристаллу и не обязательно равны 90. На этих осях откладывают отрезки а (ось х), b (ось y) и с (ось
z), ограничивающие ячейку и называемые параметрами ячейки (рис. 45).
101
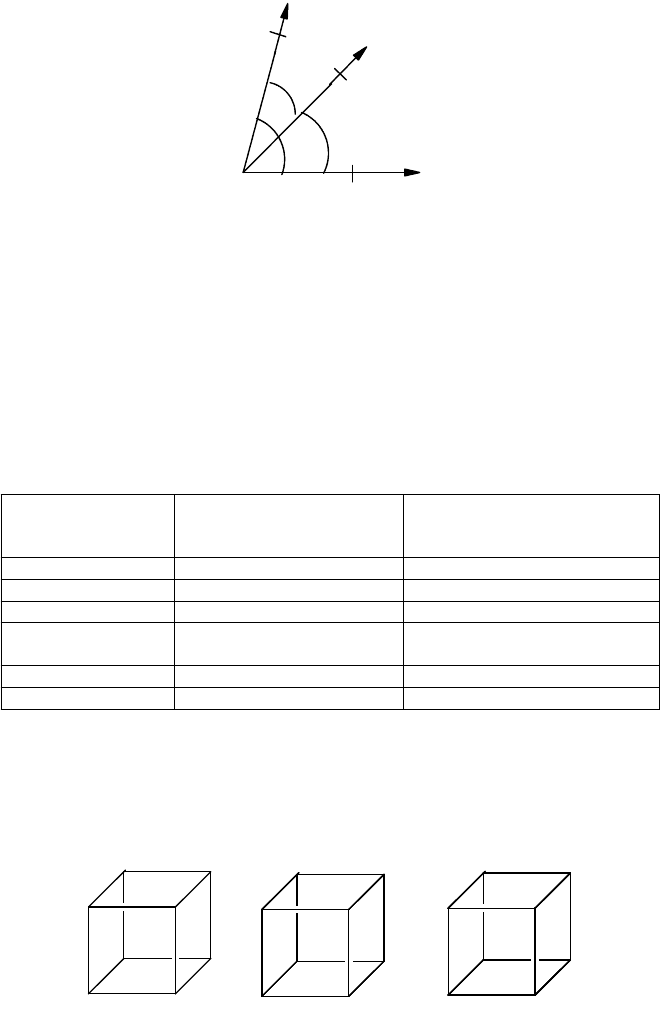
a
b
c
Рис. 45. Параметры кристаллической решетки
Транслируя элементарную ячейку с параметрами а, b, с и углами , , , можно построить любой кристалл,
подобно тому как из кирпичей складывают здание. На практике параметры и углы ячейки определяют методами
рентгеноструктурного анализа.
Все кристаллы в зависимости от значений параметров и углов можно разделить на семь
кристаллографических систем (сингоний). Различают кубическую, тетрагональную, тригональную,
гексагональную, ромбическую, моноклинную и триклинную сингонии; отвечающие им элементарные ячейки
приведены в табл. 22.
Таблица 22.
Сингонии кристаллов
Сингония Элементарная ячейка Примеры
Триклинная ; аbс CuSO
4
5H
2
O
Моноклинная ==90, 90; аbс Na
2
CO
3
10H2O
Ромбическая ===90; аbс KNO
3
Гексагональная и
тригональная
==90, =120; а=bс
Pb
3
(OH)
2
(CO
3
)
2
NaIO
4
3H
2
O
Тетрагональная ===90; а=bс SnO
2
Кубическая ===90; а=b=c NaCl
Каждой сингонии может отвечать несколько видов решеток. Так, к кубической сингонии относятся кубическая
примитивная решетка (частицы находятся в вершинах куба), кубическая объемно-центрированная (частицы
находятся в вершинах куба и в точке пересечения пространственных диагоналей) и кубическая
гранецентрированная (частицы располагаются в вершинах куба и в точке пересечения диагоналей граней куба).
Эти решетки изображены на рис. 46.
o
o
o
o
o
oo
o
o
o
o
o o
o
o
o
o
o
o
o
o
o
o
oo
o
o
o
o
o
o
Примитивная Объемно-центриро- Гранецентри-
ванная рованная
Рис. 46. Виды кубических решеток
Кристаллическая решетка обусловливает ряд свойств, присущих рассматриваемому состоянию вещества.
Так, кристаллические вещества имеют определенную температуру плавления. Если кристаллическое вещество
нагревать, то при некоторой температуре оно начнет плавиться. Так как разрушение кристаллической решетки
сопровождается поглощением энергии, плавление является эндотермическим процессом. В результате
температура системы кристалл - расплав будет оставаться постоянной, пока твердая фаза не превратится в
жидкость.
Другим характерным свойством кристалла является присущая ему анизотропия. Анизотропией называется
зависимость свойств вещества от направления. Так, если из кубического кристалла поваренной соли вырезать
пластинку, параллельную диагонали одной из граней, покрыть ее тонким слоем парафина и прикоснуться к
поверхности нагретой стеклянной палочкой, то на поверхности появится пятно расплавленного парафина,
имеющее форму овала. Теплопроводность пластинки, таким образом, в разных направлениях не одинакова.
Точно так же, если из кристалла NaCl вырезать стержни с поперечным сечением в 1 мм
2
и испытать их на
разрыв, то стержень, вырезанный перпендикулярно грани куба разорвется при приложении к нему силы, равной
5,6 Н, а стержень, вырезанный параллельно диагонали грани, - при 11,3 Н.
102
Кристаллическое состояние вещества является равновесным, следовательно термодинамически наиболее
стабильным.
В зависимости от вида частиц, образующих решетку, и типа химической связи, соединяющей эти частицы,
различают четыре типа решеток.
Молекулярные решетки. В узлах решетки располагаются молекулы вещества, связанные силами
межмолекулярного взаимодействия или водородными связями. Поскольку эти типы взаимодействия являются
слабыми, вещества с молекулярной решеткой легкоплавки, летучи и имеют низкую твердость. Примером
подобных веществ могут служить твердый кислород, твердый диоксид углерода, лед, нафталин.
Ионные решетки. В узлах решетки находятся положительно и отрицательно заряженные ионы,
объединенные ненасыщаемой и ненаправленной ионной связью. Такие кристаллы тверды, но хрупки, нелетучи,
многие из них растворимы в полярных растворителях. Более подробно вопрос о ионных решетках рассмотрен в
разделе.5.4.2.
Ковалентные решетки. Узлы решетки занимают атомы, соединенные ковалентной связью. Вещества с
ковалентными решетками обычно тверды, тугоплавки, нелетучи. Примером подобных веществ может служить
алмаз, в кристалле которого каждый атом углерода образует четыре -связи с четырьмя соседними атомами
углерода.
Металлические решетки. В узлах решетки находятся положительно заряженные ионы металла,
объединенными коллективизированными электронами. Образующаяся в таких кристалла металлическая связь
рассмотрена в разделе.5.5. Подобные решетки имеют все металлы.
Кристаллическая решетка со строго определенными параметрами и повторением абсолютно одинаковых
фрагментов в известной мере условна и отвечает идеальному кристаллу. В реальных природных и
синтетических кристаллах обычно имеют место заметные нарушения в расположении частиц, образующих
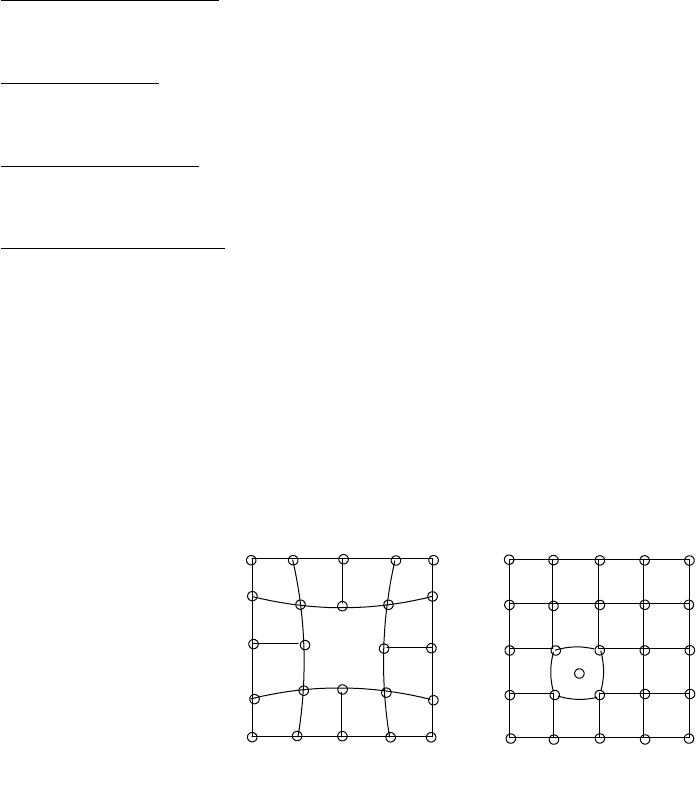
решетку. Подобные нарушения называют дефектами кристаллической решекти. Простейшим видом дефектов
являются точечные дефекты, связанные с неправильным расположением отдельных частиц, образующих
решетку. Такими дефектами являются вакансии и дефекты внедрения. Вакансии связаны с отсутствием
структурных элементов в отдельных узлах решетки, приводящем к искажению структуры кристалла в области
вакансии (рис. 47, а). Дефекты внедрения обусловливает проникновение атома или другой частицы в
пространство между узлами решетки (рис. 47, б). Так, например, атомы углерода могут внедряться в
кристаллическую решетку железа. Таким образом, реальные кристаллы лишь приближаются к идеальной
структуре. Наличие дефектов весьма сильно сказывается на свойствах кристалла.
а) б)
Рис. 47. Дефекты кристаллических решеток
а - вакансия; б – дефект внедрения
В настоящее время разработаны методы получения некоторых видов кристаллов, практически свободных от
дефектов. Так, кристаллы оксида магния, приближающиеся к идеальному кристаллу, можно получить методом
газотранспортных реакций. Реакция
МgО
(к)
+ СО
(г)
Мg
(г)
+ СО
2(г)
при очень высоких температурах протекает слева направо (прямая реакция), а при не слишком высоких - справа
налево (обратная реакция). Оксид магния нагревают до температуры возгонки в атмосфере СО; при этом в
горячей части реактора протекает прямая реакция. Газовая смесь охлаждается в другой части реактора; в этих
условиях имеет место обратная реакция, и на подложке кристаллизуется бездефектный оксид магния.
Полученные таким путем нитевидные кристаллы МgО ("усы") очень сильно отличаются по свойствам от
обычного оксида магния. Так, например, их прочность на разрыв примерно в 200-300 раз выше, чем у оксида
магния, полученного путем разложения карбоната магния.
7.2.2. Аморфное состояние.
Аморфные тела, как и кристаллические тела, способны сохранять свою форму, но, в отличие от последних,
не имеют строго упорядоченной кристаллической решетки. Это конденсированное состояние характеризуется
наличием только ближнего порядка. Свободному перемещению агрегатов в аморфном теле препятствует
высокая вязкость среды, в результате чего система не может перейти в кристаллическое состояние. В
результате аморфное состояние не является равновесным, хотя и способно к длительному существованию. Как
будет показано ниже, аморфные тела фактически являются переохлажденными жидкостями, "твердость"
которых обусловлена высокой вязкостью.
103
Свойства аморфных тел существенно отличаются от свойств кристаллических тел. Так, аморфные тела не
имеют определенной температуры плавления: при нагревании они постепенно размягчаются и без
скачкообразного изменения свойств переходят в жидкое состояние. Аморфные тела изотропны: их свойства во
всех направлениях изменяются одинаково.
Типичными аморфными веществами являются силикатные стекла и разнообразные органические полимеры.
Многие вещества в зависимости от условий и способа получения могут существовать как в аморфном, так и в
кристаллическом состоянии; таковы, например, оксид бора В
2
О
3
и бораты, диоксид кремния SiО
2
, диоксид
германия GеО
2
.
Как уже указывалось, процесс перехода аморфного состояния в кристаллическое протекает
самопроизвольно, но с очень малой скоростью. Однако его можно ускорить. Так, скорость кристаллизации стекла
ускоряется, если стекло подвергнуть действию радиоактивного излучения.
7.3. Жидкое состояние вещества
В жидкостях расстояния между частицами вещества существенно больше размеров частиц, в результате
чего часть пространства, занятого телом, не заполнена сколько-нибудь плотно упакованными частицами.
Средняя потенциальная энергия частиц жидкости близка к их средней кинетической энергии, в силу чего
молекулы жидкости способны двигаться поступательно. Поэтому жидкость, сохраняя постоянный объем, не
имеет постоянной формы, приобретая форму сосуда, который она заполняет. В то же время расстояние между
частицами жидкости не настолько велико, чтобы в жидкости не наблюдалось определенной упорядоченности. В
жидкостях имеет место ближний порядок, проявляющийся в том, что число ближайших соседей молекулы
жидкости и их взаимное расположение в среднем одинаково для всех частиц, но он не переходит в порядок
дальний. В жидкости возможно образование агрегатов с упорядоченным расположением частиц, но эти агрегаты
ориентированы друг относительно друга беспорядочно и обладают некоторой свободой перемещения в
пространстве. Агрегаты жидкости не стабильны; они образуются, распадаются, обмениваются частицами с
другими агрегатами. В результате жидкости изотропны.
Наличие в жидкостях определенной упорядоченности подтверждается при исследовании дифракции потоков
электронов, нейтронов и рентгеновских лучей в жидких веществах. Особенно четко общие черты жидкостей и
твердых тел проявляются при температурах, близких к температуре кристаллизации.
Жидкостью, структура которой изучена наиболее детально, является вода. Как указывалось в разделе 5.7,
кристаллы твердой воды (льда) образуются за счет водородных связей; при этом каждая молекула воды
образует связи с четырьмя соседями, находящимися в вершинах тетраэдра. Дж. Бернал и Р. Фаулер на
основании данных рентгеноструктурного исследования твердой и жидкой воды показали, что плавление воды
сопровождается разрушением лишь части, причем не слишком большой, водородных связей льда. Так, при 0 С
разрушается лишь 9% водородных связей, при 25 С - 11%, а при 100 С - 20%. О наличии определенной
упорядоченности молекул в жидкой воде свидетельствует и определение числа молекул, составляющих
ближайшее окружение молекулы воды. Это число близко к четырем, составляя 4,4 при 2 С и 4,6 при 30 С, т. е.
не слишком отличаются от координационного числа воды в кристалле льда.
7.4. Газообразное состояние вещества
Для вещества в газообразном состоянии потенциальная энергия молекул много меньше их кинетической
энергии. В связи с этим расстояние между молекулами газа очень велико, а силы взаимодействия их друг с
другом весьма малы. В силу этого собственный объем молекул газообразного вещества очень мал сравнительно
с объемом газа. Следствием указанных особенностей газа является присущее газам стремление к расширению:
газ стремится занять весь предоставленный ему объем.
Газ, для которого потенциальная энергия частиц и их собственный объем равны нулю, называется
идеальным газом. Молекулы идеального газа движутся независимо друг от друга, силы притяжения между ними
отсутствуют, а энергия идеального газа равна сумме кинетических энергий всех его молекул. Идеальный газ -
наиболее простое агрегатное состояние вещества, его характеристики не зависят от природы молекул газа, а
только от их числа. В результате идеальный газ подчиняется очень простым закономерностям, называемым
газовыми законами. Важнейшими из них являются следующие:
1. Закон Авогадро
Этот закон рассмотрен в разделе 1.2
2. Закон Бойля-Мариотта
Объем данной массы газа при постоянной температуре обратно пропорционален давлению газа.
3. Первый закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален его абсолютной
температуре.
4. Второй закон Гей-Люссака (закон объемных отношений)
Этот закон рассмотрен в разделе 1.2
5. Закон Дальтона
Давление газовой смеси равно сумме парциальных давлений газов, образующих эту смесь.
Парциальным давлением газа называется давление, производимое молекулами данного газа в смеси газов.
Перечисленные газовые законы объединяет уравнение состояния идеального газа (уравнение Менделеева-
Клапейрона):
PV = RT
104
где Р - давление газа, V - его объем, - количество вещества, R - универсальная газовая постоянная (8,314
Дж/мольК). Т - абсолютная температура. Вывод уравнения состояния рассмотрен в разделе 1.3.1.
Реальные газы достаточно точно следуют законам идеального газа при высоких температурах и низких
давлениях. При понижении температуры и повышении давления возрастает влияние собственного объема
молекул газа и сил притяжения между ними на состояние газа; в результате этого отклонения характеристик газа
от величин, вычисленных по уравнению состояния, становятся значительными.
Состояние реального газа описывает уравнение Ван-дер-Ваальса. Для моля газа оно имеет вид:
RTb))(V
V
a
(P
2
где a и b - параметры, учитывающие собственный объем молекул (b) и взаимодействие между ними (a). Эти
параметры определяют экспериментально для каждого газа.
7.5. Плазма
Плазмой называется ионизированный газ, содержащий заряженные частицы (электроны, ядра атомов,
газовые ионы).
Во многих отношениях плазма ведет себя как обычный газ и подчиняется газовым законам, но в то же время
качественно отличается и от неионизированного газа, и от систем свободно движущихся заряженных частиц. От
газов плазма отличается своей электропроводностью, а от потоков заряженных частиц - своей
электронейтральностью: в плазме положительный заряд ионов и ядер компенсируется отрицательным зарядом
электронов. Плазму получают, подвергая газ действию высоких температур, электрических разрядов (дуговых,
тлеющих, коронных), потоков фотонов высоких энергий и радиоактивных частиц.
Различают низкотемпературную (холодную) и высокотемпературную (горячую) плазму.
Низкотемпературная плазма имеет температуру 2-100 тыс. К. В такой "холодной" плазме наряду с ионами и
электронами возможно существование неионизированных частиц (атомов и молекул). Так, например, в холодной
плазме аргона присутствуют наряду с электронами и ионами Ar
+
и Ar
2
также электронейтральные атомы
аргона. В низкотемпературной плазме возможно протекание химических реакций. Продуктами этих реакций могут
быть частицы, которые невозможно получить иным путем. Так, ионы Ar
+
в аргоновой плазме могут
взаимодействовать с молекулами водорода по уравнению
Ar
+
+ Н
2
= ArН
+
+ Н
Температура горячей плазмы превышает 100 тыс. К. В такой плазме нет незаряженных частиц, так как
молекулы подвергаются полной ионизации. Химические реакции в горячей плазме невозможны, но в ней при
достаточно высоких температурах могут протекать термоядерные процессы.
В заключение заметим, что, кроме перечисленных, возможны и промежуточные агрегатные состояния. Так,
уже рассмотренные выше аморфные твердые вещества можно рассматривать как жидкости, обладающие
некоторыми свойствами твердых тел. Очень интересным является жидкокристаллическое (мезоморфное)
состояние: вещество в этом случае является жидкостью, для которой, однако, имеет место наличие дальнего
порядка. В таком состоянии могут существовать при определенных температурах вещества, имеющие
вытянутые, асимметричные молекулы, например, пара-азоксианизол
N
N
O
O
CH
3
-
+
При плавлении этого вещества молекулы ориентируются параллельно друг другу с образованием
мезоморфной фазы (рис. 48).
Рис. 48. Ориентация молекул в мезоморфной фазе жидкого кристалла
105
В жидких кристаллах, с одной стороны, наблюдается дальний порядок расположения частиц, а с другой
стороны, сохраняется подвижность частиц, обусловливающая текучесть, характерную для жидкости. Жидкие
кристаллы анизотропны.
8. ТЕОРИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
8.1. Предмет и основные понятия теории химических процессов
Химические реакции являются одним из важнейших объектов изучения химической науки. Теория
химических процессов изучает общие закономерности, присущие различным реакциям, направление протекания
этих реакций, влияние тех или иных факторов на химическое взаимодействие. Основными разделами теории
химических процессов являются химическая термодинамика, химическая кинетика и учение о химическом
равновесии, а предметом изучения - термодинамические системы.
Термодинамические системы - это тело или совокупность тел в объеме, отграниченном от окружающей
среды реальными или условными перегородками.
Можно выделить три типа термодинамических систем:
1. Изолированные системы. Не обмениваются с окружающей средой ни веществом, ни энергией.
Изолированная система - абстрактное понятие, не реализуемое в окружающем нас мире. Реальные системы
могут лишь приближаться к изолированным.
2. Закрытые системы. Обмениваются с окружающей средой энергией, но не обмениваются веществом.
Примером такой системы может служить герметизированный сосуд, заполненный газом: если погружать такой
сосуд то в горячую, то в холодную воду, энергия системы будет меняться, а количество вещества - нет.
3. Открытые системы. Обмениваются с окружающей средой и веществом, и энергией. В качестве примера
открытой системы можно привести работающую доменную печь. Организмы человека, животных и растений
тоже являются открытыми системами.
Вещества, способные к самостоятельному существованию, которые могут быть выделены из системы,
называются составными частями системы. Пусть, например, система образована смешиванием растворов
хлорида бария и сульфата калия. Число составных частей этой системы будет равно шести, так как из системы
можно выделить BaCl
2
2H
2
O, BaCl
2
, K
2
SO
4
, BaSO
4
, KCl и H
2
O.
Любая система включает одну или несколько фаз. Фаза – это совокупность частей системы, одинаковых
по составу, физическим и химическим свойствам и отделенных от других частей системы поверхностями
раздела. Так, например, насыщенный раствор хлорида натрия является однофазной системой, состоящей из
двух составных частей. Система, содержащая лед, жидкую воду и водяной пар - трехфазная система с одной
составной частью.
Системы, состоящие из одной фазы, называются гомогенными, системы, включающие несколько фаз -
гетерогенными. Переход вещества из одной фазы в другую называется фазовым переходом. Примером фазовых
переходов могут служить плавление, кристаллизация или кипение вещества.
Важной характеристикой системы является ее компонентность. Совершенно очевидно, что для образования
той или иной системы не обязательно необходимы все составные части этой системы. Наименьшее число
составных частей системы, необходимое и достаточное для ее образования, называется компонентностью
данной системы, а необходимые составные части - компонентами (независимыми составными частями).
Так, например, число компонентов системы, состоящей из карбоната кальция, оксида кальция и диоксида
углерода, в которой протекает реакция
СаСО
3
↔ СаО + СО
2
(8-1)
равно двум (двухкомпонентная система). Действительно, для образования этой системы достаточно взять два
любых вещества из трех составных частей. В общем случае число компонентов равно числу составных частей
минус число протекающих в системе реакций.
8.2. Основы химической термодинамики
8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики.
Энтальпия.
Термодинамика - это наука, изучающая переходы энергии из одной формы в другую и от одной части
системы к другой при протекании различных процессов. Раздел термодинамики, изучающий системы, в которых
происходят химические реакции и фазовые переходы, называется химической термодинамикой.
Для характеристики состояния системы термодинамика использует так называемые термодинамические
функции, к которым относятся внутренняя энергия (U), энтальпия (H), энтропия (S), свободная энергия Гиббса
(G), свободная энергия Гельмгольца (F) и химический потенциал (μ). Общим для термодинамических функций
является то, что все они являются функциями состояния. Изменение термодинамических функций зависит
только от начального и конечного состояния системы и не зависит от пути, по которому протекает данный
процесс. Остановимся на характеристике первых двух термодинамических функций.
Внутренняя энергия (U) - это совокупность всех видов энергии термодинамической системы, кроме
кинетической энергии ее движения как целого и потенциальной энергии ее положения в каком-либо внешнем
поле.
Частями внутренней энергии является энергия движения тел, образующих систему, энергия движения
молекул, атомов, ионов, электронов, внутриядерная энергия и т.д. Поскольку во внутреннюю энергию входят все
виды энергии, заключенные в материи, в том числе и те, о которых мы ничего не знаем, абсолютные значения
106

внутренней энергии не могут быть определены. Однако можно определить изменение внутренней энергии в
результате какого-либо процесса:
ΔU = U
2
- U
1
(8-2)
где U
1
и U
2
- внутренняя энергия процесса в начальном и конечном состояниях системы.
Пусть система представляет собой сосуд, в котором свободно движется поршень, оказывающий на газ,
находящийся внутри сосуда, давление р. В системе протекают процессы, сопровождающиеся выделением или
поглощением теплоты. Если эти процессы являются химическими реакциями или фазовыми переходами, то
количество теплоты, поглощаемое системой, называется тепловым эффектом реакции или фазового перехода
(Q). Реакции, протекающие с поглощением тепла (Q > 0), называются эндотермическими, с выделением тепла (Q
< 0) - экзотермическими. Если поршень в сосуде движется свободно, процесс протекает при постоянном
давлении (изобарный процесс с тепловым эффектом Q
p
); если поршень фиксирован, процесс осуществляется
при постоянном объеме (изохорный процесс с тепловым эффектом Q
V
) (рис. 49).
mA nB
p
Рис. 49. Осуществление изобарного и изохорного процесса
Пусть в системе имеет место эндотермическая реакция (Q > 0). В этом случае поглощенная системой
теплота может израсходоваться на увеличение внутренней энергии системы на величину ΔU и на совершение
работы А против внешних сил (например, на поднятие поршня). В соответствии с законом сохранения энергии
Q = ΔU + A (8-3)
или
ΔU = Q - А (8-4)
Уравнение (8-4) является математическим выражением первого закона термодинамики:
В любом процессе увеличение внутренней энергии системы равно количеству теплоты, сообщенной
системе, минус количество работы, совершенной системой против внешних сил.
Естественно, значения ΔU и А могут быть как положительными, так и отрицательными; в последнем случае
внутренняя энергия системы понижается, а внешние силы совершают определенную работу.
Совершаемую системой работу можно представить как сумму двух величин:
А = А(р) + А΄
где А(р) - работа, совершенная против внешнего давления, А΄ - все другие виды работы (например, работа,
связанная с электрическим или магнитным полем). Рассмотрим случай, когда А΄ = 0. Тогда
2
1
V
V
pdVA(p)
Если реакция протекает при постоянном объеме, то V
1
= V
2
и А(р) = 0, откуда в соответствии с (8-3)
Q
V
= ΔU
Тепловой эффект изохорного процесса равен изменению внутренней энергии системы.
Если в процессе реакции постоянным остается давление, то
Vp )
1
V
2
p(V
2
V
1
V
dVpA(p)
,
а
Q
p
= ΔU + pΔV (8-5)
Подставив в уравнение (8-5) значения ΔU и ΔV, имеем:
Q
p
= (U
2
- U
1
) + p(V
2
-V
1
) = (U
2
+ pV
2
) - (U
1
+ pV
1
)
или
Q
p
= H
2
- H
1
= ΔH , (8-6)
где
H = U + pV (8-7)
107

- термодинамическая функция, называемая энтальпией. Таким образом, тепловой эффект изобарного процесса
равен изменению энтальпии системы.
Отметим, что энтальпия, как и внутренняя энергия, является функцией состояния и определяется лишь
начальным и конечным состоянием системы, но не зависит от пути, по которому протекает процесс. Поскольку в
выражение (8-7) входит внутренняя энергия, абсолютное значение Н неопределимо. В связи с тем, что
химические реакции часто проводят при постоянном давлении, энтальпия широко используется для выражения
тепловых эффектов.
8.2.2. Термохимия. Закон Гесса.
Термохимия - раздел химической термодинамики, рассматривающий тепловые эффекты реакций и
связанные с ними расчеты. Такие расчеты выполняют с использованием термохимических уравнений, которые
отличаются от обычных химических уравнений следующими особенностями:
1. Коэффициенты в термохимических уравнениях указывают не число атомов и молекул, участвующих во
взаимодействии, а количества вещества исходных соединений и продуктов реакции. В силу этого в подобных
уравнениях допустимо использование дробных коэффициентов, которые обычно подбирают таким образом,
чтобы коэффициент перед целевым продуктом реакции равнялся единице.
2. В термохимических уравнениях указывается тепловой эффект реакции (обычно величина ΔН). Тепловой
эффект при этом относят к числу молей реагентов и продуктов реакции, определяемых коэффициентами
уравнения, и выражают в кДж. Если же тепловой эффект относят к молю целевого продукта реакции,
размерность ΔН - кДж/моль.
3. В термохимических уравнениях обязательно указывают агрегатное состояние реагентов и продуктов
реакции, поскольку фазовые переходы сопровождаются выделением или поглощением энергии; агрегатное
состояние вещества обозначают сокращениями (к) - кристаллическое, (ж) - жидкое, (г) - газообразное, (р) -
растворенное.
Тепловые эффекты часто относят к стандартным условиям (температура 298 К, давление 1,01325
.
10
5
Па);
стандартные энтальпии обозначают символом
298
ΔH
.
Термодинамические уравнения более информативны, чем обычные химические уравнения. Так, из
уравнения реакции
2Н
2
+ О
2
= 2Н
2
О
следует лишь, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды.
Термохимическое уравнение этой реакции имеет вид:
2Н
2
(г) + О
2
(г) = 2Н
2
О(г);
298
ΔH
= -483,64 кДж (8-8)
Из него следует, что при образовании двух молей водяного пара из двух молей водорода и моля кислорода
в газообразном состоянии выделяется 483,64 кДж теплоты. Если расчет имеет целью определить тепловой
эффект образования моля газообразной воды, уравнение (8-8) можно зависать так:
Н
2
(г) +
2
1
О
2
(г) = Н
2
О(г);
298
ΔH
= -241,83 кДж/моль
Поскольку термохимические уравнения и их тепловые эффекты относят к макроколичествам веществ, с ними
можно выполнять разнообразные алгебраические операции: их можно складывать, вычитать, умножать на
некоторые величины и т.д.
Основным законом термохимии, на основании которого проводят термохимические расчеты, является закон,
сформулированный Г. И. Гессом в1841 г.:
Тепловой эффект химической реакции определяется начальным и конечным состоянием системы и не
зависит от пути проведения процесса и числа промежуточных стадий.
Так, например, если реакцию
А(г) + 2В(г) = АВ
2
(г); ΔН
1
(8-9)
провести в две стадии
А(г) + В(г) = АВ(г); ΔН
2
, (8-10)
АВ(г) + В(г) = АВ
2
(г); ΔН
3
(8-11)
то сумма тепловых эффектов реакций (8-10) и (8-11) будет равна тепловому эффекту реакции (8-9)
ΔН
1
= ΔН
2
+ ΔН
3
Связь между тепловыми эффектами химической реакции и ее отдельных стадий может быть представлена
наглядно с помощью энтальпийных диаграмм. На энтальпийных диаграммах значениям энтальпии для
различных состояний системы соответствуют ступеньки, расстояние между которыми равны тепловым эффектам
перехода из одного состояния в другое (рис. 50); стрелки, направленные вниз, соответствуют выделению
энергии, стрелки, направленные вверх, - ее поглощению.
108

A + 2B
AB+ B
AB
2
H
1
H
3
H
2
H
Рис. 50. Энтальпийная диаграмма для реакции А + 2В = АВ
2
Закон Гесса позволяет решать многие практически важные задачи. Прежде всего отметим, что этот закон
позволяет выражать тепловые эффекты реакций через энтальпии образования веществ, участвующих во
взаимодействии.
Энтальпия образования - это изменение энтальпии системы при синтезе одного моля вещества из
простых веществ. Эта величина обозначается символом ΔН
f
. Если процесс протекает в стандартных условиях,
энтальпию образования называют стандартной (
298 f,
ΔН
). Значения стандартных энтальпий образования для
различных соединений приводятся в термодинамических справочниках.
Энтальпии простых веществ по определению равны нулю. Если элемент образует несколько простых
веществ, то равным нулю принимается значение
298 f,
ΔН
для той аллотропной модификации, которая при
стандартных условиях наиболее устойчива (например, графит в случае углерода).
Рассмотрим связь между тепловым эффектом реакции и энтальпиями образования реагентов и продуктов
взаимодействия. Пусть для реакции
aA + bB = cC + dD; ΔН (8-12)
энтальпии образования веществ, участвующих во взаимодействии, равны ΔН
f
(A), ΔН
f
(B), ΔН
f
(C) и ΔН
f
(D). На
энтальпийной диаграмме (рис. 51) протеканию реакции (8-12) соответствует тепловой эффект ΔН. Осуществим
реакцию (8-12) иным путем: превратим соединения А и В в соответствующие простые вещества с тепловым
эффектом ΔН
разл
, а затем из этих простых веществ синтезируем соединения С и D с тепловым эффектом ΔН
синт
.
Тепловой эффект ΔН
синт
соответствует синтезу из простых веществ с молей соединения С и d молей соединения
D. Следовательно
ΔН
синт
= сΔН
f
(С) + d ΔН
f
(D)
Аналогично, для реакции разложения
ΔН
разл
= -(аΔН
f
(А) +bΔН
f
(В))
В соответствии с законом Гесса для реакции (8-12)
ΔН = ΔН
синт
+ ΔН
разл
= (сΔН
f
(С) + d ΔН
f
(D)) - (аΔН
f
(А) +bΔН
f
(В))
или
ΔН = Σn
i
ΔН
f
(прод) - Σm
j
ΔН
f
(реаг), (8-13)
где Σn
i
ΔН
f
(реаг) и Σm
j
ΔН
f
(прод) - суммы энтальпий образования реагентов и продуктов реакции, умноженных на
стехиометрические коэффициенты.
H
разл
H
H
синт
aA + bB
H
cC + dD
простые вещества
Рис. 51. Определение теплового эффекта по энтальпиям образования
Отсюда можно сформулировать следующее правило:
109

Тепловой эффект химической реакции равен разности суммы энтальпий образования продуктов реакции
и суммы энтальпий образования исходных веществ, умноженных на стехиометрические коэффициенты
уравнения реакции.
Рассчитаем в качестве примера тепловой эффект реакции термического разложения карбоната кальция в
стандартных условиях:
СаСО
3
(к) = СаО(к) + СО
2
(г);
298 f,
ΔН
Для карбоната кальция, оксида кальция и диоксида углерода энтальпии образования
298 f,
ΔН
равны
соответственно -1206,9, -635,5 и -393,5 кДж/моль. В соответствие с (8-13)
ΔН
298
= ΔН
f,298
(СаО) + ΔН
f,298
(СО
2
) - ΔН
f,298
(СаСО
3
)
ΔН
298
= -635,5 + (-393.5) - (-1209.9) = 177,9 кДж
Закон Гесса широко используется для определения тепловых эффектов, которые трудно или невозможно
определить экспериментально. Так, например, практически невозможно опытным путем определить энтальпию
образования оксида углерода(II), т.е. тепловой эффект реакции
С(графит) +
2
1
О
2
(г) = СО(г); ΔН
1
- ? (8-14)
поскольку даже при недостатке кислорода графит частично будет окисляться до диоксида углерода. В то же
время легко поддаются экспериментальному определению тепловые эффекты следующих реакций:
С(графит)
+ О
2
(г) = СО
2
(г); ΔН = -393,5 кДж/моль, (8-15)
СО(г)
+
2
1
О
2
(г) = СО
2
(г); ΔН
2
= -283,0 кДж/моль (8-16)
Поскольку реакции (8-14) и (8-16) являются двумя стадиями реакции (8-15),
ΔН = ΔН
1
+ ΔН
2
,
ΔН
1
= ΔН - ΔН
2
= -393,5 -(-283,0) = -110,5 кДж/моль.
Закон Гесса позволяет рассчитывать также некоторые энергетические характеристики вещества, которые
затруднительно измерить непосредственно (например, энергию связи, энергию кристаллической решетки и т.д.).
Рассмотрим этот вопрос на примере термохимического расчета энергии связи.
Энергия связи (Е
св
) - это энергия, которую нужно затратить на разрушение моля связей данного типа.
Совершенно очевидно, что энергия связи равна по абсолютной величине и противоположна по знаку энтальпии
связи (ΔН
св
)
Е
св
= - ΔН
св
(8-17)
Пусть требуется установить энергию связи Е
H-I
в молекуле иодоводорода. Для этого необходимо определить
тепловой эффект реакции
H(г) + I(г) = HI(г); ΔН
св
(8-18)
Экспериментальному определению ΔН
св
препятствуют процессы образования молекул Н
2
и I
2
из атомов
водорода и иода, протекающие наряду с реакцией (8-18).Однако поставленную задачу можно решить, если
известны тепловые эффекты реакций атомизации молекул иода и водорода, синтеза иодоводорода из
молекулярного иода и водорода, а также фазового перехода кристаллического иода в газообразный. Все эти
эффекты могут быть определены экспериментально и составляют:
2
1
H
2
(г) +
2
1
I
2
(к) = HI(г); ΔН = 26,3 кДж/моль, (8-19)
2
1
I
2
(к) =
2
1
I
2
(г); ΔН
1
= 31,2 кДж/моль,
2
1
I
2
(г) = I(г); ΔН
2
= 74,4 кДж/моль,
2
1
Н
2
(г) = Н(г); ΔН
3
= 216,1 кДж/моль
(условия стандартные). Осуществим реакций (8-19) так, чтобы одной из промежуточных стадий была реакция
(8-18).
110
