Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


Ag
+
+ Cl
-
= AgCl↓; ΔH˚ = -65,5 кДж/моль.
9.3.4.2. Гидролиз солей.
Одним из типов обменных реакций в растворах являются реакции гидролиза, т.е. реакции обменного
взаимодействия вещества с водой. Гидролизу подвергаются различные классы неорганических и органических
соединений: бинарные соединения ряда неметаллов, соли, сложные эфиры, углеводы и т.д. Примером реакции
гидролиза может служить, например, гидролиз сульфида кремния
SiS
2
+4H
2
O = H
4
SiO
4
+ 2H
2
S
Реакции гидролиза следует отличать от реакций гидратации, при которых происходит присоединение воды тем
или иным веществом. Так, например, реакция омыления уксусноэтилового эфира
СН
3
СООС
2
Н
5
+ Н
2
О СН
3
СООН + С
2
Н
5
ОН
является реакцией гидролиза, а взаимодействие этилена с водой
С
2
Н
4
+ Н
2
О С
2
Н
5
ОН
- реакцией гидратации. В настоящем разделе рассмотрен вопрос о гидролизе солей в водных растворах.
Гидролизом соли называется обменное взаимодействие ионов соли с молекулами воды,
сопровождающееся изменением концентрации ионов водорода и гидроксила в результате смещения
равновесия диссоциации воды.
Гидролиз является следствием поляризационного взаимодействия ионов соли с молекулами воды,
гидратирующими данный ион. Гидролизу могут подвергаться как катионы, так и анионы соли. Катионы, как
указывалось в разделе 9.3.1, гидратируются за счет присоединения молекул воды по донорно-акцепторному
механизму и путем образования водородных связей между координированными и некоординированными
молекулами воды. Пусть катион X
z+
присоединяет 4 молекулы воды, выступая акцептором электронных пар
кислорода, а одна из координированных молекул воды образует водородную связь с внешнесферной молекулой
воды (рис. 65,а). Катион X
z+
поляризует координированную молекулу Н-О′-Н′, причем индуцированный в
молекуле воды диполь ориентирован отрицательным полюсом к иону Х
z+
, а положительным - к атомам водорода.
В результате связь О'Н′ ослабевает и разрывается, а связь Н′∙∙∙О″ упрочняется и переходит в ковалентную. В
растворе увеличивается концентрация отщепляемых ионов гидроксония. Гидролиз катиона, таким образом,
протекает по уравнению
X
z+
+ H
2
O XOH
(z-1)+
+H
+
Катион гидратируется тем сильнее, чем больше его поляризующее действие, т.е. чем выше положительный
заряд иона и меньше его радиус. Таким катионам соответствуют слабые основания.
Анионы в растворах гидратируются за счет образования водородных связей (рис. 65,б). Взаимодействие
отрицательного заряда аниона с диполем молекулы воды приводит к усилению акцепторных свойств атома
водорода Н′. В результате водородная связь Y∙∙∙Н′ переходит в ковалентную, а полярная связь О″- Н′
разрывается. Гидролиз протекает по уравнению
Y
z-
+ H
2
O
Y
(z-1)-
+ OH
-
а раствор приобретает щелочную реакцию. Анион гидролизуется тем сильнее, чем выше его отрицательный
заряд и меньше радиус. Легко гидролизующимся анионам соответствуют слабые кислоты.
H
2
O
X
H
2
O
H
2
O
O' H'
H
... ...
O''
H
H
Z+
H
2
O
X
H
2
O
H
2
O
O' H'
(Z-1)+
+ H
3
O
+
а)
Y
Z-
б)
::
..
..
.. ..
O"
H
H'
Y
::
..
..
H
(Z-1)-
+ OH
-
Рис. 65. Механизм гидролиза солей:
а) гидролиз катиона:
б) гидролиз аниона.
151
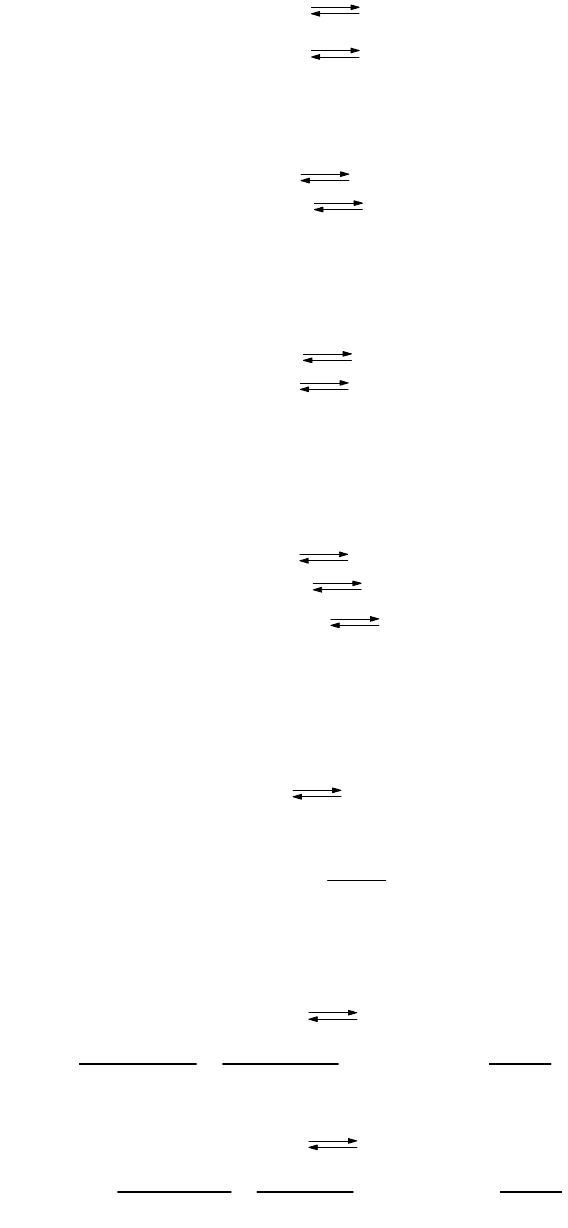
По характеру гидролиза соли можно разделить на три типа.
1. Соли, образованные слабыми кислотами и сильными основаниями (например, CH
3
COONa, K
2
S, Ca(NO
2
)
2
и
др.). В случае подобных соединений соль гидролизуется по аниону, а раствор приобретает щелочную реакцию
(рН > 7). Так гидролиз ацетата натрия протекает по уравнению
CH
3
COONa + H
2
O CH
3
COOH + NaOH
или
CH
3
COO
-
+ H
2
O CH
3
COOH + OH
-
2. Соли, образованные сильными кислотами и слабыми основаниями (например, NH
4
Cl, AlCl
3
, Zn(NO
3
)
2
и
др.). Для таких солей имеет место гидролиз по катиону, в результате чего раствор приобретает кислую реакцию
(рН < 7). Например, гидролиз хлорида аммония описывается уравнениями
NH
4
Cl +H
2
O NH
3
∙H
2
O + HCl;
NH
4
+ H
2
O NH
3
∙H
2
O + H
+
Продуктом гидролиза является гидратированный аммиак.
3. Соли, образованные слабыми кислотами и слабыми основаниями (например, CH
3
COONH
4
, Al
2
S
3
,
Fe(CH
3
COO)
3
и др.). В этом случае гидролизу подвергаются и катион, и анион. Реакция среды будет
определяться относительной силой образующихся кислоты и основания; раствор может быть нейтральным,
слабокислым, слабощелочным. Так, ацетат аммония гидролизуется по уравнениям
CH
3
COONH
4
+ H
2
O NH
3
∙H
2
O + CH
3
COOH;
NH
4
+ CH
3
COO
-
NH
3
∙H
2
O + CH
3
COOH
Поскольку константы ионизации уксусной кислоты и гидратированного аммиака одинаковы (1,8∙10
-5
), раствор
ацетата аммония имеет нейтральную реакцию.
Соли, образованные сильной кислотой и сильным основанием (например, хлорид натрия, сульфат калия),
гидролизу не подвергаются.
Если катион или анион многозарядны, то гидролиз протекает ступенчато. Так катион алюминия
гидролизуется в три стадии:
Al
3+
+ H
2
O Al(OH)
2+
+ H
+
;
Al(OH)
2+
+ H
2
O Al(OH)
2
+ H
+
;
Al(OH)
2
+ H
2
O Al(OH)
3
+ H
+
В таком случае доминирующей обычно является первая стадия, т.е. гидролиз иона с максимальным значением
заряда, причем процесс этот обратим. Однако в некоторых случаях при растворении соли может наблюдаться
полный гидролиз, сопровождающийся превращением соли в соответствующие кислоту и основание. Полному
гидролизу подвергаются соли, образованные очень слабыми кислотой и основанием, особенно если один из
продуктов гидролиза выделяется в виде газа. Так, например, сульфид алюминия не может существовать в
водных растворах в связи с количественным протеканием реакции
Al
2
S
3
+ 6H
2
O 2Al(OH)
3
+ 3H
2
S
Количественно процесс гидролиза характеризуют степенью и константой гидролиза. Степенью гидролиза
называется отношение числа подвергшихся гидролизу частиц (N
гидр
) к общему числу частиц (N):
N
N
h
гидр
Константа гидролиза представляет собой константу равновесия реакции обменного взаимодействия соли с
водой. Пусть гидролизу подвергается соль XY, диссоциирующая на катион X
+
и анион Y
-
. Уравнение константы
гидролиза этой соли будет зависеть от типа гидролиза:
а) соли, гидролизующиеся по катиону:
Х
+
+ Н
2
О ХОН + Н
+
,
K
гидр
осн
OH
K
K
]][OH[H
]][OH[X
[XOH]
][X
][XOH][H
2
; (9-44)
б) соли, гидролизующиеся по аниону:
Y
-
+ H
2
O HY + OH
-
,
кисл
OH
гидр
K
K
]][OH[H
]][Y[H
[HY]
][Y
][HY][OH
K
2
; (9-45)
в) соли, гидролизующиеся по катиону и аниону:
152
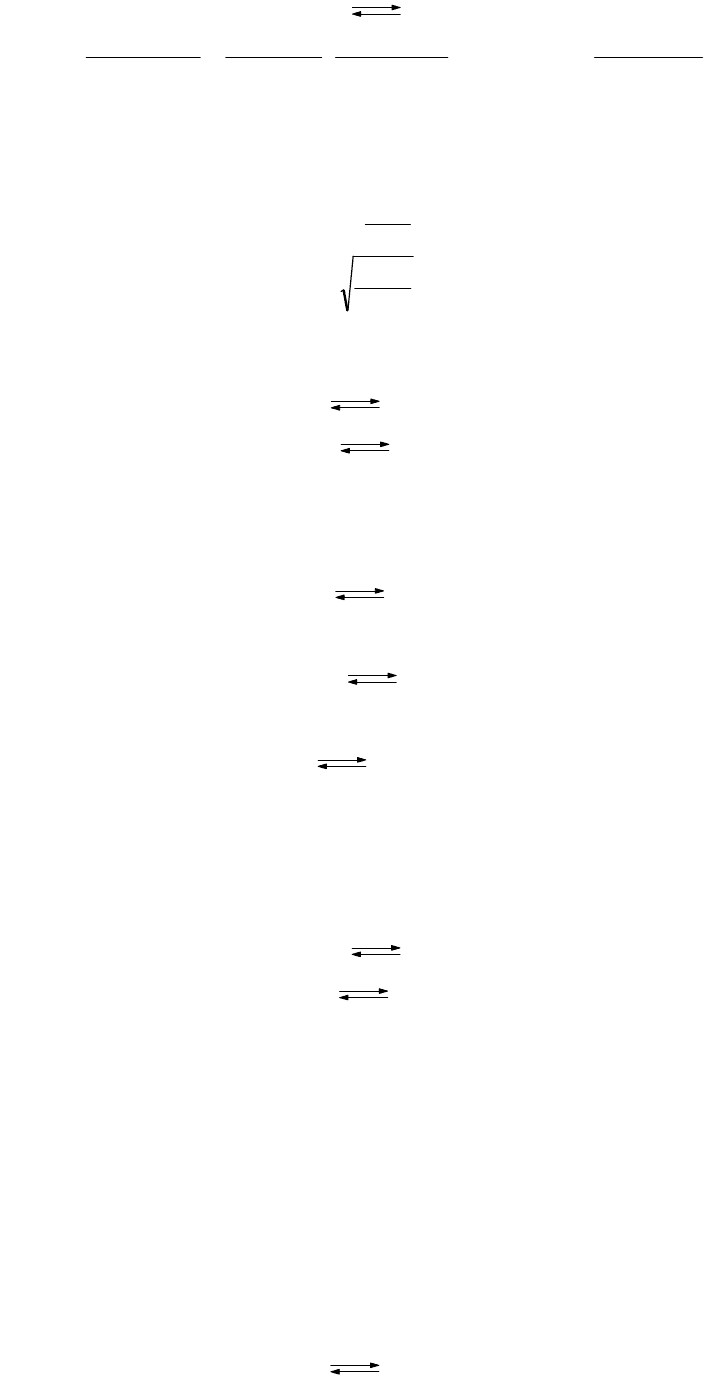
X
+
+ Y
-
+H
2
O HY + XOH,
оснкисл
OH
гидр
KK
K
]][OH[H
]][OH[X
[XOH]
]][Y[H
[HY]
]][Y[X
[HY][XOH]
K
2
; (9-46)
где К
кисл
и К
осн
- константы ионизации кислоты и основания. При выводе уравнений констант гидролиза
допускалось, что концентрация воды в растворе постоянна. Как следует из уравнений (9-44), (9-45) и (9-46), соль
тем сильнее гидролизуется, чем меньше К
кисл
и К
осн
, т.е. чем слабее кислота и основание, образующие соль.
Константа и степень гидролиза связаны соотношением, аналогичным уравнению закона разбавления (9-29):
;
h1
Ch
K
2
гидр
(9-47)
C
K
h
гидр
(9-48)
На смещение гидролитических равновесий влияют концентрация раствора и температура. Как следует из
уравнения (9-48), с уменьшением концентрации степень гидролиза увеличивается. Так, для карбоната натрия,
гидролизующегося по уравнению
Na
2
CO
3
+ H
2
O NaHCO
3
+ NaOH,
или
СО
3
2-
+ Н
2
О НСО
8-
+ ОН
-
,
степень гидролиза при 25˚С с изменением концентрации раствора от 0,1 моль/л до 0,001 моль/л возрастает от
2,7% до 34%.
Реакции гидролиза эндотермичны, поэтому, в соответствии с принципом Ле Шателье, при нагревании
гидролиз усиливается. Например, для хлорида хрома(III) в децимолярном растворе степень гидролиза по
уравнению
Cr
3+
+ H
2
O Cr(OH)
2+
+H
+
при 0˚С составляет 4%, а при 100˚С - 42%. При нагревании могут реализоваться более высокие ступени
гидролиза, чем при низких температурах. Так, ацетат железа(III) при комнатной температуре гидролизуется по
уравнению
Fe
3+
+ CH
3
COO
-
+ H
2
O Fe(OH)
2+
+ CH
3
COOH
Однако при нагревании раствора этой соли происходит образование осадка по уравнению
Fe
3+
+ 3CH
3
COO
-
+ 2H
2
O Fe(OH)
2
CH
3
COO↓ +2CH
3
COOH
Гидролитические процессы зачастую весьма сложны. Выше рассмотрены лишь первичные реакции
гидролиза. Продукты этих реакций могут подвергаться дальнейшим химическим превращениям, образуя
многоядерные комплексы. Так, например, установлено, что при гидролизе хлорида олова(II) в растворе, кроме
ионов Sn(OH)
+
, образуются ионы [Sn
2
(OH)
2
]
2+
[Sn
3
(OH)
4
]
2+
. В некоторых случаях при гидролизе образуются не
гидроксососоли, а оксосоли. Так, гидролиз нитрата ртути(II) в зависимости от концентрации и температуры может
протекать по уравнениям:
3Hg
2+
+2NO
3
-
+ 2H
2
O Hg
3
O
2
(NO
3
)
2
↓ + 4H
+
или
Hg
2+
+H
2
O HgO↓ + 2H
+
В последнем случае продуктом гидролиза является оксид ртути(II).
9.3.5. Теории кислот и оснований.
Кислоты и основания - классы химических соединений, отличительным признаком которых является их
способность реагировать друг с другом, вступая в кислотно-основное взаимодействие. Однако вплоть до
настоящего времени нет единого мнения о том, какие признаки являются необходимыми и достаточными для
отнесения того или иного процесса к кислотно-основному взаимодействию, в связи с чем нет и единой теории
кислот и оснований. Ниже рассмотрены наиболее важные теории кислот и оснований, к которым следует отнести
ионную теорию Аррениуса, теорию сольвосистем Франклина, протолитическую теорию Бренстеда-Лоури и
электронную теорию Льюиса. Каждая из этих теорий по-разному определяет понятия кислота и основание.
1.Ионная теория кислот и оснований (С. Аррениус, 1887).
Ионная теория связывает отнесение электролитов к кислотам и основаниям с характером диссоциации этих
соединений. В соответствии с этой теорией кислотам и основаниям даются следующие определения:
Кислоты - это электролиты, отщепляющие при диссоциации в качестве катионов только ионы
водорода (гидроксония), например,
HCl = H
+
+ Cl
-
,
СН
3
СООН Н
+
+ СН
3
СОО
-
153
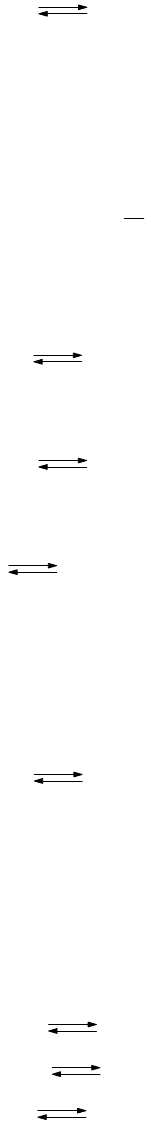
Основания - это электролиты, отщепляющие при диссоциации в качестве аниона только ионы
гидроксила, например,
NaOH = Na
+
+ OH
-
,
Ca(OH)
2
Ca
2+
+ 2OH
-
Общие свойства, присущие кислотам (способность определенным образом изменять окраску индикаторов,
вступать в реакцию нейтрализации, реагировать с некоторыми металлами с выделением водорода), согласно
ионной теории - это фактически свойства, присущие катиону водорода в растворе. Именно этот ион вступает в
реакцию нейтрализации
Н
+
+ ОН
-
= Н
2
О
и обусловливает растворение металлов в кислотах по уравнению
M + nH
+
= M
n+
+
2
n
H
2
Точно так же общие свойства оснований - это свойства присутствующих в растворе ионов гидроксила.
Ионная теория впервые объяснила явление амфотерности. Согласно этой теории соединениям типа R-O-H в
зависимости от прочности связей R-О и О-Н присущи три типа диссоциации. Если связь R-О прочнее связи О-Н,,
диссоциация электролита протекает по уравнению
R-O-H H
+
+ RO
-
(9-49)
и соединение является кислотой. Если связь R-О менее прочна, чем связь О-Н, то электролит диссоциирует по
уравнению
R-O- H R
+
+OH
-
(9-50)
и является основанием. В тех же случаях, когда связи R-O и О-Н близки по прочности, электролит диссоциирует
как по уравнению (9-49), так и по уравнению (9-50)
H
+
+ RO
-
R-O-H ↔ R
+
+OH
-
(9-51)
Если к раствору такого электролита добавить кислоты, то ионы водорода будут связывать ионы гидроксила в
молекулы воды и равновесие сместится в сторону реакции (9-50), а электролит будет функционировать как
основание. При введении в систему основания, ионы гидроксила будут связывать ионы водорода, что приведет к
смещению равновесия в сторону реакции (9-49), в которой электролит выступает как кислота. Подобные
электролиты, проявляющие в зависимости от условий свойства и кислот, и оснований, называют амфотерными.
Идеальным амфотерным электролитом, хотя и очень слабым, является вода, диссоциирующая по
уравнению
Н
2
О Н
+
+ ОН
-
и отщепляющая ионы, характерные как для кислоты, так и для основания.
Ионная теория удовлетворительно объясняет процессы кислотно-основного взаимодействия в водных
растворах, но не пригодна для описания таких процессов в неводных средах. В рамках этой теории
затруднительно объяснить, почему хлорид аммония в растворах отчетливо проявляет свойства кислоты
(вступает в реакцию нейтрализации, реагирует с магнием с выделением водорода), а аммиак, не содержащий
гидроксильных групп, по свойствам является типичным основанием.
2. Теория сольвосистем (Э. Франклин, 1914).
Теория сольвосистем позволяет распространить ионную теорию на неводные системы с
самоионизирующимися растворителями.
Сопоставим уравнения диссоциации воды, типичной кислоты и типичного основания
H
2
O + H
2
O H
3
O
+
+ OH
-
;
HCl + H
2
O H
3
O
+
+ Cl
-
;
NaOH Na
+
+ OH
-
Как следует из приведенных уравнений, кислота при диссоциации в водном растворе образует тот же катион, что
и вода, а основание - тот же анион. Этот признак кислот и оснований лежит в основе теории сольвосистем,
определяющей понятия кислота и основание следующим образом:
Кислота - это вещество, отщепляющее в растворе тот же катион, что и диссоциирующий
растворитель.
Основание - это вещество, отщепляющее в растворе тот же анион, что и диссоциирующий
растворитель.
Кислота и основание в сольвосистемах способны взаимно нейтрализовать друг друга по схеме:
154
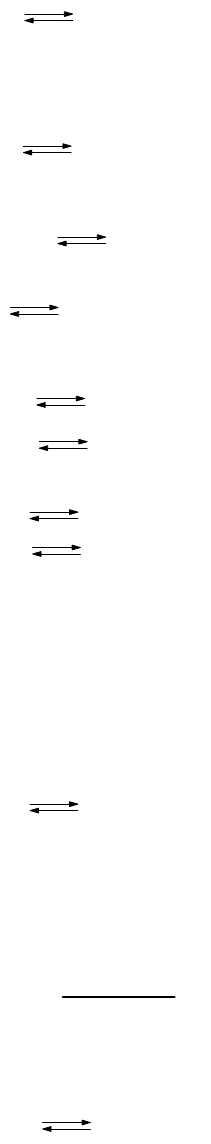
кислота + основание = соль + растворитель (9-52)
Так, например, жидкий аммиак диссоциирует по уравнению
NH
3
+ NH
3
NH
4
+ NH
2
,
отщепляя катион аммония и дигидронитрид-анион. Соответственно соединения, отщепляющие при растворении
в жидком аммиаке ионы NH
4
+
, будут проявлять свойства кислот, а ионы NH
2
-
- оснований. Примером такой
кислоты может служить хлорид аммония, диссоциирующий по уравнению
NH
4
Cl NH
4
+ Cl
-
,
а примером основания - дигидронитрид (амид) натрия. Как кислота и основание, хлорид аммония и
дигидронитрид натрия способны вступать в реакцию нейтрализации
NH
4
Cl + NaNH
2
NaCl + 2NH
3
Весьма интересным самоионизирующимся растворителем является жидкий фтороводород, диссоциирующий
по уравнению
3HF H
2
F
+
+ HF
2
В жидком фтороводороде свойствами кислоты будут обладать такие соединения, как трифторид бора и
пентафторид сурьмы, которые диссоциируют по уравнениям
BF
3
+ 2HF H
2
F
+
+ [BF
4
]
-
,
SbF
5
+ 2HF H
2
F
+
+ [SbF
6
]
-
Свойства оснований в рассматриваемом растворителе будут проявлять такие вещества, как хлороводород и
даже азотная кислота:
HCl + 2HF H
2
Cl
+
+ HF
2
,
HNO
3
+ 2HF H
2
NO
3
+
+ HF
2
Теория сольвосистем включает ионную теорию кислот и оснований как частный случай, в котором
растворителем является вода.
3. Протолитическая теория кислот и оснований (Й. Бренстед и Т. Лоури, 1923).
Согласно протолитической теории сущность кислотно-основного взаимодействия состоит в передаче
протона кислотой основанию, соответственно чему понятиям кислота и основание даются следующие
определения:
кислота - это соединение, которое в кислотно-основной реакции является донором протона;
основание - это соединение, которое в кислотно-основной реакции является акцептором протона.
Реакция передачи протона кислотой основанию называется протолитической реакцией. Для кислоты НА и
основания В она протекает по уравнению
НА + В А
-
+ ВН
+
(9-53)
а
1
b
2
b
1
а
2
При этом кислота, потерявшая протон, превращается в частицу, потенциально способную протон присоединять,
т.е. в новое основание. Аналогично основание, присоединившее протон, превращается в новую кислоту. Кислота
и основание, образовавшееся из этой кислоты после ее депротонирования, называются сопряженными. Так, для
реакции (9-53) сопряженными кислотами и основаниями являются пары НА и А
-
, ВН
+
и В. Часто сопряженные
кислоту и основание обозначают символами a и b (от acidum - кислота и base - основание) с одинаковыми
индексами. Константа равновесия процесса (9-53)
[HA][B]
]][A[BH
K
п
(9-54)
называется константой протолиза.
В качестве примера рассмотрим в рамках протолитической теории взаимодействие уксусной кислоты с
аммиаком
CH
3
COOH + NH
3
NH
4
+ CH
3
COO
-
а
1
b
2
a
2
b
1
В этой реакции СН
3
СООН выступает как донор протона и является кислотой; сопряженным с ней основанием
будет ацетат-ион. Присоединяющий протон аммиак играет роль основания; он превращается в сопряженную
кислоту - ион аммония.
В качестве кислот и оснований Бренстеда могут выступать молекулы, катионы и анионы. Соответственно
этому кислоты Бренстеда делятся на нейтральные (например, СН
3
СООН), катионные (например, NH
4
+
) и
анионные (например, НSО
4
-
). Ниже приведены уравнения диссоциации этих кислот:
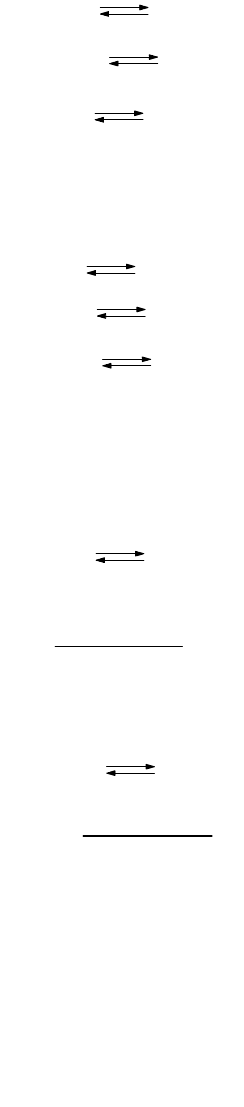
155
CH
3
COOH + H
2
O H
3
O
+
+ CH
3
COO
-
; (9-55)
а
1
b
2
a
2
b
2
NH
4
+ H
2
O H
3
O
+
+ NH
3
; (9 -56)
a
1
b
2
a
2
b
1
HSO
4
-
+ H
2
O H
3
O
+
+ SO
2
4
(9-57)
a
1
b
2
a
2
b
1
На аналогичные классы могут быть подразделены и основания. Примером нейтральных оснований может
служить аммиак, катионных - ион гидразония N
2
Н
5
+
, анионных - карбонат-ион. Эти соединения являются
акцепторами протонов по уравнениям:
NH
3
+ H
2
O NH
4
+
+ OH
-
; (9-58)
b
1
a
2
a
1
b
2
N
2
H
5
+
+ H
2
O N
2
H
6
+ OH
-
; (9-59)
b
1
a
2
a
1
b
2
CO
2
3
+ H
2
O HCO
3
-
+ OH
-
(9-60)
b
1
a
2
a
1
b
2
Заметим, что в приведенных выше примерах уравнения диссоциации сами по себе являются
протолитическими реакциями. При этом в реакциях (9-55) - (9-57) вода выступает как основание, а в реакциях (9-
58) - (9-60) - как кислота.
Несомненным достоинством протолитической теории является то, что она позволяет количественно
охарактеризовать силу кислот и оснований, используя константы равновесия соответствующих реакций. Пусть в
растворе кислоты НА имеет место равновесие
НА + Н
2
О Н
3
О
+
+ А
-
(9-61)
Сила кислоты тем больше, чем больше константа равновесия (9-61)
[HA]
]][AO[H
K
3
a
(9-62)
(концентрация воды в растворе может считаться постоянной и в уравнении (9-62) входит в значение константы
К
а
). Константу К
а
называют константой кислотности. Аналогично для основания В, диссоциирующего по
уравнению
В + Н
2
О ВН
+
+ ОН
-
константа равновесия
[B]
]][OH[BH
K
b
(9-63)
называемая константой основности, характеризует силу основания, которая тем больше, чем больше значение
К
b
.
Для оценки силы кислот и оснований часто используют отрицательный десятичный логарифм константы
кислотности или основности (показатель константы)
pK
a
= -lgK
a
; pK
b
= -lgK
b
Чем сильнее кислота или основание, тем меньше значение pK
a
или pK
b
.
Протолитическая теория может быть распространена и на неводные растворы. Например, взаимодействие
циановодорода с амидом калия в жидком аммиаке сводится к протолитической реакции
HCN + NH
2
= NH
3
+ CN
-
a
1
b
2
a
2
b
1
причем циановодород в этих условиях проявляет свойства сильной кислоты.
Протолитическая теория кислот и оснований является более широким обобщением, чем ионная теория и
теория сольвосистем. В то же время этой теории присущи и некоторые ограничения: в рамках рассматриваемой
теории к кислотам могут быть отнесены лишь протонсодержащие соединения.
4. Электронная теория кислот и оснований (Г. Льюис, 1926).
Согласно электронной теории кислотно-основное взаимодействие сводится к образованию между кислотой и
основанием ковалентной связи по донорно-акцепторному механизму. В рамках данной теории
кислота - это соединение, которое в кислотно-основном взаимодействии является акцептором
электронной пары (кислота Льюиса);
156
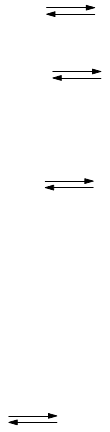
основания - это соединения, которые в кислотно-основном взаимодействии являются донором
электронной пары (основания Льюиса).
Взаимодействие кислоты и основания по электронной теории сопровождается образованием солеподобного
соединения, называемого аддуктом. Многие аддукты устойчивы и могут быть выделены как индивидуальные
соединения; некоторые аддукты существуют только в растворах.
Электронная теория позволяет распространить представления о кислотно-основном взаимодействии на
очень широкий круг соединений и химических реакций. В соответствии с этой теорией кислотами могут быть
весьма разнообразные вещества. Ниже приведены важнейшие группы кислот Льюиса и примеры кислотно-
основных реакций с их участием.
1. Протон Н
+
:
Н
+
+ ОН
-
= НОН
кислота основание аддукт
2. Катионы - центральные атомы в комплексах (Ag
+
, Cu
2+
, Al
3+
и др.):
Cu
2+
+ 4NH
3
= [Cu(NH
3
)
4
]
2+
,
кислота основание аддукт
Al
3+
+ 6F
-
= [AlF
6
]
9-
,
кислота основание аддукт
3. Галогениды и псевдогалогениды, в которых не реализовано высшее значение координационного числа
(SnCl
4
, BF
3
, Hg(CN)
2
и др.):
SnCl
4
+ 2Cl
-
= [SnCl
6
]
2-
;
кислота основание аддукт
BF
3
+ NH
3
= F
3
BNH
3
;
кислота основание аддукт
Hg(CN)
2
+ 2CN
-
= [Hg(CN)
4
]
2-
кислота основание аддукт
4. Оксиды с двойными и тройными связями, у которых атом с наименьшей электроотрицательностью может
быть акцептором (CO
2
, SO
2
, SO
3
и др.):
SO
3
+ H
2
O H
2
SO
4
,
кислота основание аддукт
СO
2
+ H
2
O HCO
3
-
кислота основание аддукт
5. Амфотерные гидроксиды при взаимодействии с сильными основаниями (Al(OH)
3
, Sn(OH)
2
, Cr(OH)
3
и др.):
Al(OH)
3
+ 3OH
-
[Al(OH)
6
]
3-
кислота основание аддукт
В качестве оснований Льюиса могут выступать как молекулы с неподеленными парами на гибридных
орбиталях (H
2
O, NH
3
, N
2
H
4
), так и лиганды-анионы в координационных соединениях (OH
-
, F
-
, CN
-
). Таким образом,
электронная теория рассматривает реакции комплексообразования как кислотно-основные процессы.
Следует, однако, отметить, что кислоты Бренстеда не могут быть причислены к кислотам Льюиса, так как при
протекании протолитической реакции образуются новая кислота и основание, а не аддукт. Теория Льюиса
рассматривает кислоты Бренстеда как продукты нейтрализации протона основанием, т.е. как аддукты, а
протолитическую реакцию (9-53) - как процесс вытеснения основания А
-
более сильным основанием В.
Например, в случае реакции
NH
4
+
+ OH
-
NH
3
+ H
2
O
NH
4
+
рассматривается как аддукт, образующийся при нейтрализации H
+
основанием NH
3
, а сама реакция
трактуется как процесс вытеснения основания NH
3
более сильным основанием ОН
-
.
Протолитическая и электронная теории взаимно дополняют друг друга, однако при использовании их всегда
необходимо указывать, какие кислоты и основания, Бренстеда или Льюиса, имеются в данный момент в виду.
9.3.6. Окислительно-восстановительные реакции в растворах.
9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
Окислительно-восстановительными реакциями (ОВР) называются процессы, сопровождающиеся
изменением степени окисления элементов.
157

Поскольку для любой химической реакции алгебраическая сумма степеней окисления элементов для
каждого вещества, участвующего во взаимодействии, и для реакции в целом равна нулю, ОВР являются
двуединым процессом, при протекании которого происходит повышение степени окисления одних и понижение
степени окисления других элементов.
Процесс, сопровождающийся повышением степени окисления элементов, называется процессом окисления;
элемент, степень окисления которого в процессе реакции повышается, называется восстановителем.
Процесс, сопровождающийся понижением степени окисления элемента, называется восстановлением;
элемент, степень окисления которого понижается, называется окислителем.
Формально ОВР можно рассматривать как реакции, сопровождающиеся переносом электронов от одних
атомов или ионов к другим. При таком подходе процесс, идущий с присоединением электронов является
процессом восстановления окислителя, т.е. элемента, электроны присоединяющего, а процесс, протекающий с
потерей электронов, является процессом окисления восстановителя, т.е. элемента, электроны отдающего. Так,
например, взаимодействие олова с хлором протекает с образованием хлорида олова(IV), содержащeго
полярные связи Sn-Cl со смещением электронной плотности к атомам хлора, являющегося более
электроотрицательным элементом, чем олово. Соответственно степени окисления олова и хлора в простых
веществах равны нулю, а в продукте взаимодействия - +4 и -1
Sn
0
+ 2Cl
0
2
= Sn
+4
Cl
1
4
(9-64)
(Напомним, что знак степени окисления записывают перед числом в отличие от знака иона, который ставят
после числа, например, Sn
+4
и Sn
4+
). Для этой реакции окислителем является хлор, а восстановителем - олово;
процессы окисления и восстановления протекают по уравнениям
Sn
0
- 4e
-
= Sn
+4
(окисление)
Cl
0
+ 1e
-
= Cl
-1
(восстановление)
Понятия "окисление" и "восстановление" распространяются также на ионы и на вещества, содержащие атомы,
присоединяющие или отдающие электроны.
Различают четыре типа ОВР:
1. Межмолекулярные ОВР, при которых окислитель и восстановитель являются разными элементами,
входящими в состав разных молекул, например, реакция (9-64).
2. Внутримолекулярные ОВР, в случае которых окислитель и восстановитель входят в состав одной и той же
молекулы. К этому типу реакций относятся реакции разложения, например,
2Hg
+2
O
-2
= 2Hg
0
+ O
0
2
3. Реакции диспропорционирования, в случае которых в качестве окислителя и восстановителя выступают
атомы одного и того же элемента в одной и той же степени окисления, например,
3Cl
0
2
+ 6KOH = KCl
+5
O
3
+ 5KCl
-1
+ 3H
2
O
4. Реакции контрдиспропорционирования, для которых окислителем и восстановителем являются атомы
одного и того же элемента в разных степенях окисления, которые становятся одинаковыми в продуктах реакции,
например,
KI
+5
O
3
+ 5KI
-1
+ 3H
2
SO
4
= 3I
2
+ K
2
SO
4
+ 3H
2
O
9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
Для того чтобы записать уравнение ОВР, необходимо, прежде всего, знать, какие вещества образуются в
результате реакции. В общем случае этот вопрос решается экспериментальным путем. Однако зачастую знание
химических особенностей тех или иных окислителей и восстановителей позволяет достаточно надежно (хотя и
не со стопроцентной гарантией) предсказать состав продуктов взаимодействия.
Если продукты реакции известны, стехиометрические коэффициенты в уравнении реакции могут быть
найдены путем уравнивания числа электронов, присоединяемых атомами окислителя и теряемых атомами
восстановителя. Используют два метода подбора коэффициентов в уравнениях ОВР - метод электронного
баланса и метод ионно-электронного баланса. Рассмотрим эти приемы.
Метод электронного баланса
В основе метода лежит принцип сохранения электрического заряда в процессе химической реакции, в
результате чего вещества реагируют в таком соотношении, которое обеспечивает равенство числа электронов,
отданных всеми атомами восстановителя и присоединенных всеми атомами окислителя. Для подбора
коэффициентов целесообразно использовать следующий алгоритм:
1. Записать схему ОВР (исходные вещества и продукты реакции).
2. Определить элементы, степень окисления которых меняется в процессе реакции.
3. Составить схемы процессов окисления и восстановления.
4. Найти множители, уравнивающие число электронов, присоединенных атомами окислителя и потерянных
атомами восстановителя (балансирующие множители). Для этого найти наименьшее общее кратное для
электронов, присоединенных одним атомом окислителя и отданных одним атомом восстановителя;
158

балансирующие множители будут равны наименьшему общему кратному, деленному на число присоединенных
электронов (для окислителя) и отданных электронов (для восстановителя).
5. Определить и ввести в уравнение коэффициенты при веществах, содержащих элементы, степень
окисления которых изменяется (опорные коэффициенты), путем деления балансирующих множителей на число
атомов окислителя или восстановителя в формульной единице вещества. Если частное от деления не является
целочисленным, балансирующие множители следует увеличить в необходимое число раз.
6. Найти и расставить дополнительные коэффициенты, уравнивающие число атомов, не изменивших
степень окисления (кроме водорода и кислорода); при этом, если среда кислая, сначала уравнять атомы
металлов, а затем анионы кислот, если среда щелочная или нейтральная - наоборот.
7. Уравнять число атомов водорода, дописывая в случае необходимости воду в правую или левую часть
уравнения.
8. Проверить, правильно ли подобраны коэффициенты, по кислороду.
Рассмотрим в качестве примера составление уравнения взаимодействия перманганата калия с сульфатом
железа(II) в сернокислой среде по стадиям предложенного алгоритма:
1. KMnO
4
+ FeSO
4
+ H
2
SO
4
→ MnSO
4
+ Fe
2
(SO
4
)
3
+ K
2
SO
4
2. KMn
+7
O
4
+ Fe
+2
SO
4
+ H
2
S0
4
→ Mn
+2
SO
4
+ Fe
3
2
(SO
4
)
3
+ K
2
SO
4
3. Fe
+2
- 1e
-
= Fe
+3
(окисление)
Mn
+7
+5e
-
= Mn
+2
(восстановление)
4. Fe
+2
- 1e
-
= Fe
+3
│5 │ 10
Mn
+7
+ 5e
-
= Mn
+2
│1 │2
5. Опорные коэффициенты: при KMnO
4
- 2:1=2, при FeSO
4
- 10:1=10, при MnSO
4
- 2:1=2, при Fe
2
(SO
4
)
3
- 10:2=5.
2KMnO
4
+ 10FeSO
4
+ H
2
SO
4
→ 2MnSO
4
+ 5Fe
2
(SO
4
)
3
+ K
2
SO
4
6. Среда кислая, поэтому уравниваем вначале атомы калия, потом - сульфат-ионы:
2KMnO
4
+ 10FeSO
4
+ 5H
2
SO
4
→ 2MnSO
4
+ 5Fe
2
(SO
4
)
3
+ K
2
SO
4
7. Поскольку левая часть уравнения содержит 10 атомов водорода, дописываем в правую часть 5 молекул воды:
2KMnO
4
+ 10FeSO
4
+ 5H
2
SO
4
= 2MnSO
4
+ 5Fe
2
(SO
4
)
3
+ K
2
SO
4
+ 5Н
2
О (9-65)
8. Число атомов кислорода (не считая кислород, входящий в сульфат-ионы) в правой и левой частях уравнения
равно 8. Коэффициенты подобраны правильно.
При протекании ОВР возможны случаи, когда окислитель или восстановитель в то же время расходуется на
связывание продуктов окисления или восстановления без изменения степени окисления соответствующего
элемента. В этом случае коэффициент при веществе с двойной функцией равен сумме опорного и
дополнительного коэффициентов и вводится в уравнение после того, как будет найден дополнительный
коэффициент. Так, реакция между цинком и очень разбавленной азотной кислотой протекает по уравнению
4Zn + 10HNO
3
= 4Zn(NO
3
)
2
+ NH
4
NO
3
+3H
2
O
Zn
0
- 2e
-
= Zn
+2
│4
N
+5
+ 8e
-
= N
-3
│1
Как следует из схем окисления-восстановления, на окисление четырех атомов цинка необходима одна молекула
азотной кислоты (опорный коэффициент при HNO
3
- 1); однако на образование четырех молекул нитрата цинка и
одной молекулы нитрата аммония требуется еще девять молекул HNO
3
, вступающих в реакцию без изменения
степени окисления азота (дополнительный коэффициент при HNO
3
- 9). Соответственно коэффициент при
азотной кислоте в уравнении реакции будет равен 10, а в правую часть уравнения следует ввести 3 молекулы
воды.
Если одно из веществ выполняет одновременно функцию и окислителя, и восстановителя (реакции
диспропорционирования) или является продуктом как окисления, так и восстановления (реакции
контрдиспропорционирования), то коэффициент при этом веществе равен сумме опорных коэффициентов при
окислителе и восстановителе. Например, в уравнении реакции диспропорционирования серы в щелочной среде
3S
0
+ 6NaOH = Na
2
S
+4
O
3
+ Na
2
S
-2
+ 3H
2
O
S - 4e
-
= S
+4
│1
S + 2e
-
= S
-2
│2
коэффициент при сере равен трем.
Иногда при протекании ОВР наблюдается изменение степени окисления более чем двух элементов; в этом
случае коэффициенты уравнения могут быть определены однозначно, если все окислители или все
восстановители входят в состав одной молекулы. При этом расчет отданных или присоединенных электронов
рационально проводить для формульной единицы вещества, содержащего эти окислители или восстановители.
159

В качестве примера рассмотрим взаимодействие сульфида мышьяка(III) с азотной кислотой по стадиям
приведенного алгоритма.
1. As
2
S
3
+ HNO
3
→ H
3
AsO
4
+ H
2
SO
4
+ NO
2. As
3
2
S
2
3
+ HN
+5
O
3
→ H
3
As
+5
O
4
+ H
2
S
+6
O
4
+ N
+2
O
В реакции участвуют два восстановителя (As
+3
и S
-2
) и один окислитель (N
+5
).
3. N
+5
+ 3e
-
= N
+2
│28
As
2
S
3
- 28e
-
= 2As
+5
+ 3S
+6
│ 3
4. Наименьшее общее кратное - 84, балансирующие множители - 28 и 3.
5. 3As
2
S
3
+ 28HNO
3
→ 6H
3
AsO
4
+ 9H
2
SO
4
+ 28NO
6. Дополнительных коэффициентов нет.
7. В левую часть уравнения следует ввести
4
2
281818
молекулы воды:
3As
2
S
3
+ 28HNO
3
+ 4Н
2
О = 6H
3
AsO
4
+ 9H
2
SO
4
+ 28NO
8. Число атомов кислорода как в левой, так и в правой части уравнения равно 88. Коэффициенты подобраны
правильно.
Если в ОВР участвуют органические вещества, то для них степени окисления не определяют, так как в этом
случае каждый атом может иметь свое значение степени окисления, причем зачастую не целочисленное. При
составлении схем окисления-восстановления для таких реакций следует руководствоваться следующими
правилами:
1) присоединения атома кислорода тождественно потере молекулой двух электронов;
1) отщепление атома кислорода тождественно присоединению двух электронов;
3) присоединение атома водорода тождественно присоединению одного электрона;
4) отщепление атома водорода тождественно потере одного электрона.
Ниже в качестве примера приведено уравнение реакции окисления этилового спирта дихроматом калия:
3C
2
H
5
OH + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
=
3CH
3
COOH + 2Cr
2
(SO
4
)
3
+ 2K
2
SO
4
+ 11H
2
O
C
2
H
5
OH + [O] - 2[H] - 4e
-
= 3CH
3
COOH │3
Cr
+6
+ 3e
-
= Cr
+3
│4
Превращение этилового спирта в уксусную кислоту требует присоединения атома кислорода и потери двух
атомов водорода, чему соответствует потеря четырех электронов.
Метод электронного баланса является универсальным методом, применимым к любым ОВР, протекающим в
газовой фазе, в конденсированных системах и в растворах. Недостатком метода является то, что прием этот
формален и оперирует с не существующими реально частицами (Mn
+7
, N
+5
и т. д.).
Метод ионно-электронного баланса
При составлении уравнений ОВР этим методом записываются не схемы потери и присоединения
электронов, а ионные уравнения процессов окисления и восстановления (уравнения полуреакций). В уравнения
полуреакций, кроме ионов, являющихся окислителем и восстановителем, включают также в зависимости от
условий воду, ионы водорода или гидроксила. Итоговое уравнение находят, суммируя уравнения полуреакций,
умноженные на множители, уравнивающие число отданных и присоединенных электронов. Так, например, для
реакции (9-65) реальными окислителем и восстановителем являются ионы MnO
4
-
и Fe
2+
. Уравнения полуреакций
в этом случае имеют вид:
MnO
4
-
+ 8H
+
+ 5e
-
= Mn
2+
+ 4H
2
O │1
Fe
2+
- 1e
-
= Fe
3+
│5
В уравнениях полуреакций совокупность ионов и молекул, способных присоединять электроны, называется
окисленной формой (в рассмотренном примере MnO
4
-
+ 8H
2
O для первой и Fe
3+
для второй полуреакции), а
совокупность ионов и молекул, способных отдавать электроны, - вoсстановленной формой (Mn
2+
, Fe
2+
).
Складывая уравнения полуреакций, умноженные на балансирующие множители (1 и 5), приходим к ионному
уравнению:
MnO
4
-
+ 5Fe
2+
+ 6H
+
= Mn
2+
+ 5Fe
3+
+ 4H
2
O
В качестве второго примера приведем составление уравнения реакции окисления гидрида сурьмы
оксохлоратом(I) натрия в щелочной среде, протекающей по схеме:
160
