Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

÷
÷
÷
÷
÷
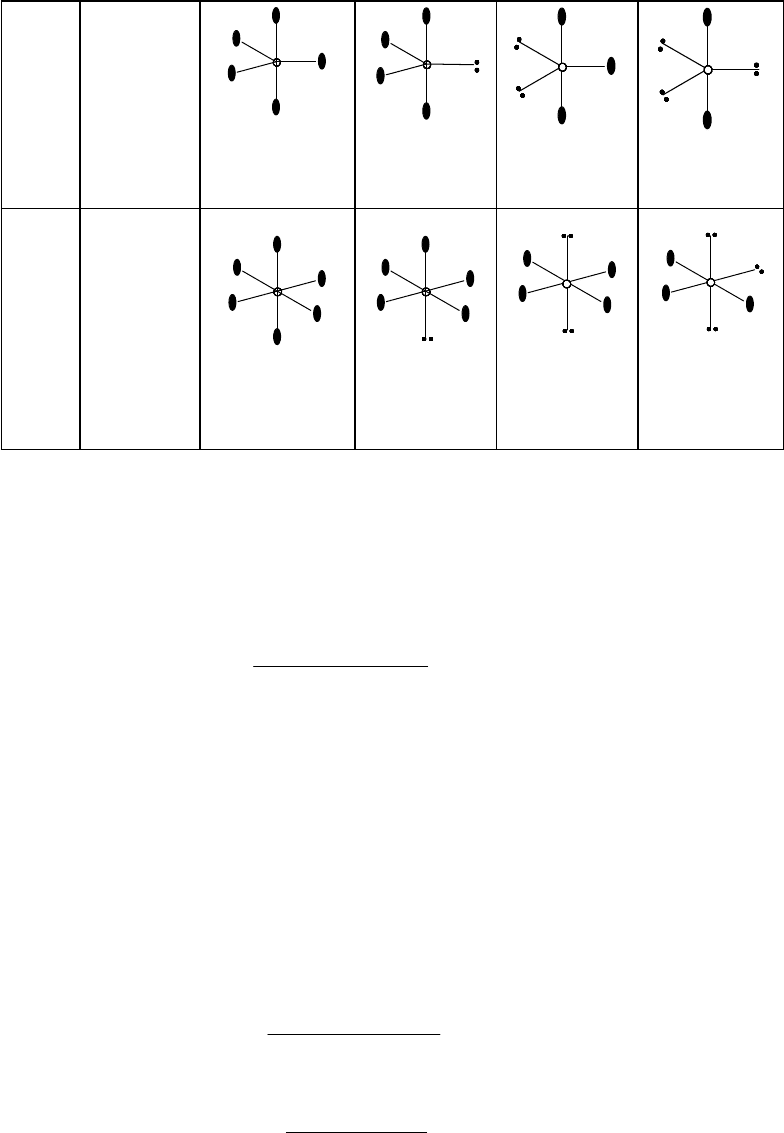
тригональная
бипирамида
PF
5
(P)
÷
÷
÷
÷
бисфеноид
SF
4
(S)
÷
÷
÷
T-форма
IF
3
(I)
÷
÷
Линейная
XeF
2
(Xe)
6 sp
3
d
2
÷
÷
÷
÷
÷
÷
октаэдр
SF
6
(S)
÷
÷
÷
÷
÷
тетрагона-
льная
пирамида
BrI
5
(Br)
÷
÷
÷
÷
квадрат
XeF
4
(Xe)
÷
÷
÷
Т-форма
[XeF
3
]
-
(Xe)
Рассмотрим несколько примеров определения формы молекул по методу Гиллеспи.
Если в молекуле отсутствуют цепочки, содержащие более трех атомов, то для определения ее геометрии
достаточно установить тип гибридизации и число неподеленных ЭПВО центрального атома, выбрать по табл. 11
идеальный тип молекулы и внести коррективы, связанные с ожидаемым искажением формы молекулы. Пусть,
например, необходимо определить форму молекулы оксофторида ксенона XeO
2
F
2
, в которой центральным
является атом ксенона, образующий четыре - и две -связи. Числа ЭПВО и неподеленных пар для этой
молекулы составляют
N =
8 + 2 2 + 2 1 - 2 2
2
= 5
ЭПВО
; n
Н
= 5 - 4 = 1
В соответствии с табл. 11 ксенон подвергается sp
3
d-гибридизации, а образующаяся молекула имеет форму
бисфеноида, в котором атомы кислорода образуют связи за счет экваториальных орбиталей, обеспечивающих
этим атомам максимальное удаление от орбитали, занятой неподеленной парой, а атомы фтора, имеющие по
три неподеленные пары, находятся в транс-положении. Можно ожидать, что длина двойных связей Xe=O будет
меньше длины одинарных связей Xe-F, а углы OXeO и FXeF в связи с наличием неподеленной пары на
экваториальной орбитали будут меньше 120 и 180 соответственно. Эти предположения хорошо согласуются с
результатами экспериментального определения формы рассматриваемой частицы (рис. 15,а): молекула XeO
2
F
2
действительно имеет форму слегка искаженного бисфеноида (d
Xe=O
= 171 пм, d
Xe-F
= 190 пм, OXeO = 105,7 ,
FXeF = 174,7).
При определении геометрии сложных молекул, содержащих цепочки из четырех и более атомов,
рационально разбить молекулу на фрагменты и определить геометрию каждой из таких частей. Например, при
определении формы газообразного метабората натрия Na-O-B=O следует порознь определить форму
фрагментов O=B-O и B-O-Na. Для атома бора в O=B-O
N =
3 + 1 2 + 1 1 - 1 2
2
= 2;
ЭПВО
n
H
= 2 - 2 = 0
т.е. этот фрагмент имеет линейную форму. Для атома кислорода в B-O-Na
N =
3 + 1 1 + 1 1
2
= 2;
ЭПВО
n
H
= 4 - 2 = 2
Этот фрагмент, таким образом, имеет угловую форму, а валентный угол близок к 109,5 . Как следует из рис.
15,б, молекула NaBO
2
действительно представляет собой сочетание линейного и углового фрагментов с
валентными углами 180 и 109 . Можно было ожидать, что в молекуле метабората натрия длина связи B=O
будет меньше длины связи B-O, однако этого не наблюдается. Возможно причиной этого является
делокализация -связи в рассматриваемой частице (см.разд.5.2.5).
61

O
Xe
O
F
F
а)
O B O
Na
..
O
S
O
б)
в)
С
FeС
С
С
С
O
O
O
O
O
г)
Рис. 15. Определение геометрии молекул XeOF
2
(а), NaBO
2
(б), SO
2
(в) и Fe(CO)
5
(г) по методу Гиллеспи
Если частица является ионом, то при расчете числа ЭПВО следует вычесть заряд иона из числа валентных
электронов. Определим геометрию иона IO
2
F
2
-
. Для атома иода, являющегося центральным и образующего
четыре - и две -связи
5; =
2
(-1) - 22 - 12 + 22 + 7
= N
Эпем
n
H
= 5 - 4 = 1
Рассматриваемый ион должен иметь форму бисфеноида, что подтверждено экспериментально.
Число ЭПВО можно рассчитать также, исходя из электронных конфигураций ионов, образующих данную
частицу. Например, ион [AlF
6
]
3-
образован ионом Al
3+
и шестью ионами F
-
; связи в этой частице образованы по
донорно-акцепторному механизму, причем ион F
-
предоставляет для образования связи электронную пару.
Отсюда для атома алюминия
N =
0 + 6 2
2
= 6;
ЭПВО
n
H
= 6 - 6 = 0
Алюминий, таким образом, подвергается sp
3
d
2
-гибридизации, а ион [AlF
6
]
3-
имеет форму октаэдра.
Если в частице имеются нелокализованные связи, следует определить геометрию всех канонических форм,
а затем усреднить полученные структуры. Например, для молекулы диоксида серы возможны две канонические
формы, отличающиеся тем, с каким атомом кислорода (правым или левым) атом серы образует двойную связь:
O S
..
..
..
..
..
..
:
S O
..
..
..
..
..
..
:
и
O O
Для атома серы
N =
6 + 1 2 - 1 2
2
= 3; n = 3 - 2 = 1
ЭПВО H
(являющийся акцептором атом кислорода электронов на образование связи не предоставляет); отвечающая
этой канонической форме частица должна иметь угловое строение и разные длины связей S=O и SO.
Усреднение структур канонических форм приводит к симметричной угловой молекуле, в которой длины связей
сера-кислород одинаковы (рис. 15,в).
Надежность метода Гиллеспи применительно к соединениям s- и p-элементов весьма высока: вероятность
правильного предсказания геометрии молекул составляет 90-95%.
Применение теории отталкивания ЭПВО к соединениям d-элементов встречает определенные затруднения,
однако в ряде случаев дает вполне удовлетворительные результаты, особенно для элементов, содержащих на
валентном уровне от одного до семи, а также десять электронов. При этом для d-элементов, имеющих
вакантные d-орбитали, становятся возможными некоторые типы гибридизации, не реализующиеся в случае s- и
p-элементов. Так, для шести, пяти и четырех ЭПВО, наряду с гибридизацией типа sp
3
d
2
, sp
3
d, sp
3
становятся
возможными и энергетически более предпочтительными d
2
sp
3
-, dsp
3
и d
3
s-гибридизация. При расчете числа
ЭПВО для атомов d-элементов следует брать от центрального атома не все валентные электроны, а лишь то
число их, которое обеспечивает проявляемую атомом степень окисления. Так, например, при определении
геометрической формы пентахлорида вольфрама WCl
5
от атома вольфрама следует брать не шесть, а пять
электронов, так как в рассматриваемом соединении вольфрам имеет степень окисления +5. Тогда
N =
5 + 5 1
2
= 5; n = 5 - 5 = 0
ЭПВО H
Вольфрам, таким образом, подвергается dsp
3
-гибридизации, а молекула пентахлорида вольфрама имеет
форму тригональной бипирамиды.
В качестве второго примера определим форму иона [Fe(CN)
6
]
3-
. Этот ион можно представить как результат
сочетания иона Fe
3+
, не вносящего вклад в валентную оболочку, и шести ионов CN
-
, каждый из которых, выступая
в роли донора, предоставляет для образования связей электронную пару. Соответственно для атома железа
62

N =
0 + 6 2
2
= 6; n = 6 - 6
ЭПВО H
= 0
Атом железа находится в состоянии d
2
sp
3
-гибридизации, а ион [Fe(CN)
6
]
3-
имеет форму октаэдра.
Для элементов, содержащих на d-подуровне 8-9 электронов, надежность предсказания формы молекул
понижается. В этом случае, в частности, четырем ЭПВО может отвечать не только sp
3-
или d
3
s-гибридизация, что
приводит к образованию тетраэдрических молекул, но и dsp
2
-гибридизация, в результате которой образуются
частицы квадратной формы. Например, ионы [NiCl
4
]
2-
и [PdCl
4
]
2-
изоэлектронны; связь в обеих частицах
образуется по донорно-акцепторному механизму. В результате как для никеля, так и для палладия
N =
0 + 4 2
2
= 4; n = 4 - 4 = 0
ЭПВО H
,
что соответствует образованию тетраэдрических молекул. В действительности же форму тетраэдра имеет лишь
ион [NiCl
4
]
2-
, тогда как ион [PdCl
4
]
2-
является квадратным (dsp
2
-гибридизация).
Последовательно принимая за центральный различные атомы, можно установить типы гибридизации всех
атомов, образующих данную молекулу. Пусть, например, необходимо определить геометрию и типы
гибридизации всех атомов молекулы пентакарбонила железа - Fe(CO)
5
. В этом соединении пять молекул :СО:
присоединены к атому железа по донорно-акцепторному механизму за счет неподеленной электронной пары
атома углерода. Для геометрии молекулы необходимо определить форму фрагментов FeC
5
и FeCO. Принимая
атом железа за центральный и учитывая, что степень окисления железа в пентакарбониле равна нулю, имеем
N (Fe) =
0 + 5 2
2
= 5; n = 5 - 5 = 0
ЭПВО H
Атом железа, таким образом, подвергается dsp
3
-гибридизации, а фрагмент FeC
5
имеет форму тригональной
бипирамиды. Для атома углерода в фрагменте Fe-CO
N (C) =
4 + 0 + 1 4 - 2 2
2
= 2; n = 2 - 2 = 0
ЭПВО H
Фрагмент Fe-CO, таким образом, линеен, атом углерода находится в состоянии sp-гибридизации. Для
атома кислорода
N (O) =
6 + 1 2 - 2 2
2
= 2; n = 2 - 1 = 1
ЭПВО H
что указывает на sp-гибридизацию атома кислорода. В целом форма молекулы Fe(CO)
5
показана на рис. 15,г.
Случаи несовпадения реальной и предсказанной по методу Гиллеспи геометрии молекул относительно
редки. Так, например, в молекулах газообразных дигалогенидов кальция атом металла имеет две ЭПВО, чему
соответствует sp-гибридизация и линейная форма молекул. По экспериментальным данным молекулы CaCl
2
,
CaBr
2
и CaI
2
действительно линейны: однако молекула CaF
2
является угловой с валентным углом, равным 140 .
Для атома кислорода в гидроксиде натрия N
ЭПВО
= 4, n
H
= 2; в соответствие с табл. 11 молекула гидроксида
натрия должна быть угловой. В действительности же молекула NaOH линейная.
Приведенные исключения не дают, однако, оснований разочаровываться в методе отталкивания
электронных пар валентной оболочки, который при всей его простоте в большинстве случаев позволяет
правильно предсказывать форму даже весьма сложных молекул.
5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
Пусть между атомами А и В, электроотрицательности которых равны
А
и
В
, возникает локализованная
ковалентная связь. При этом в зависимости от значений
А
и
В
возможны три случая:
1.
А
и
В
равны или очень близки по значениям. Образующаяся при этом общая электронная пара в равной
мере принадлежит обоим взаимодействующим атомам, а возникающее электронное облако симметрично
относительно ядер атомов А и В. Подобная связь называется неполярной. Чистая неполярная связь реализуется
в гомоядерных молекулах, образованных атомами одного элемента в одной и той же степени окисления
(например, в молекулах Cl
2
, P
4
, S
8
). Примером гетероядерной связи, очень близкой к неполярной, может служить
связь Р-Н в молекуле фосфина РН
3
(электроотрицательности водорода и фосфора по Полингу равны
соответственно 2,20 и 2,19).
2.
А
и
В
умеренно отличаются друг от друга. В этом случае общая электронная пара смещается в сторону
атома с большей электроотрицательностью, в результате чего связь становится асимметричной. Такая связь
называется полярной. Вследствие несимметричного распределения электронной плотности относительно ядер А
и В полярная связь представляет собой диполь - электронейтральную систему, в которой центры тяжести
положительного и отрицательного заряда не совпадают. Как и любому диполю, полярной связи присущи три
количественные характеристики:
1) заряд, возникающий на полюсе диполя (q); эта величина может быть как положительной, так и
отрицательной и соизмерима с зарядом электрона (1,6010
-19
Кл),
2) длина диполя (), равная расстоянию между полюсами диполя; эта величина принимает значения в
пределах от нуля до 10
-10
м;
3) дипольный момент, представляющий собой произведение абсолютного значения заряда полюса на длину
диполя
= q
63

Единица дипольного момента имеет размерность Клм; обычно дипольные моменты представляют собой
величину порядка 10
-30
Клм. На практике часто используется внесистемная единица дипольных моментов -
Дебай (D): 1D = 3,3310
-30
Клм. Дипольный момент является вектором, направленным от положительного
полюса к отрицательному.
В отличие от заряда полюса и длины диполя, измерить которые порознь довольно сложно, значение
дипольного момента относительно легко определяют экспериментально, измеряя диэлектрическую
проницаемость вещества при разных температурах.
Заметим, что неподеленные электронные пары тоже характеризуются определенными дипольными
моментами, направленными от ядра атома, которому принадлежит неподеленная пара.
3.
А
и
В
очень сильно отличаются друг от друга. В этом случае связывающая электронная пара переходит к
атому с большей электроотрицательностью, в результате чего этот атом превращается в отрицательный ион, а
его партнер - в положительный. Между образовавшимися ионами действуют электростатические силы, не
связанные с перекрыванием электронных орбиталей. Возникающая при этом связь называется ионной связью;
особенности этого вида взаимодействия будут рассмотрены в разделе 5.4.
Ковалентные молекулы могут содержать одну или несколько связей одинаковой или различной полярности.
Векторная сумма дипольных моментов всех связей и неподеленных пар молекулы называется дипольным
моментом молекулы. По значениям дипольных моментов молекулы могут быть подразделены на два типа:
1) неполярные молекулы - молекулы, для которых дипольный момент равен нулю;
2) полярные молекулы - молекулы, для которых дипольный момент принимает отличные от нуля значения.
Дипольные моменты некоторых молекул приведены в табл. 13.
Таблица 13.
Дипольные моменты некоторых молекул
Молекула
10
30
Клм
Молекула
10
30
Клм
H
2
0 CO
2
0
N
2
0 H
2
O 6,10
O
2
0 H
2
S 3,40
HF 6,36 NO
2
0,97
HCl 3,42 NH
3
4,94
HBr 2,63 PH
3
1,83
HI 1,40 NF
3
0,70
CO 0,33 CCl
4
0
NO 0,53 CHCl
3
3,17
O
3
1,73
Асимметричное распределение электронной плотности в молекуле по направлению полярных связей можно
учесть, приписав атомам в молекуле некоторый эффективный заряд (не путать с эффективным зарядом ядра,
раздел 2.4). Эффективный заряд атома в молекуле можно рассматривать как меру полярности ковалентной
связи. Так, например, для молекулы хлороводорода эффективный заряд на атоме хлора составляет -0,18 эл.ед.,
а на атоме водорода +0,18 эл.ед., откуда можно заключить, что связь в молекуле HCl на 18% ионная, а на 82%
ковалентная.
Полярность молекул определяется не только полярностью связей в ней, но и геометрической формой
частицы. Так, например, в молекулах BeF
2
и H
2
O связи Be-F и Н-О полярны, однако дипольный момент молекулы
фторида бериллия равен нулю, а для воды составляет 6,110
-30
Клм. Это явление объясняется тем, что для
линейной молекулы BeF
2
F F
Be
Be-F
Be-F
2
векторная сумма двух противоположно направленных дипольных моментов
BeF
равна нулю. Молекула воды -
угловая молекула
H
O
H
HO
HO
2
в результате чего сумма дипольных моментов связей Н-О нулю не равняется.
На полярность молекул оказывает также влияние ориентация дипольных моментов неподеленных
электронных пар молекулы. Так, молекулы NH
3
и NF
3
, имеющие одинаковую тригонально-пирамидальную форму,
существенно отличаются по полярности (
3
NH
μ
= 4,910
-30
Клм,
3
NF
μ
= 0,710
-30
Клм). Это объясняется тем,
что электроотрицательность азота выше электроотрицательности водорода, но ниже электроотрицательности
фтора. В результате в молекуле аммиака дипольные моменты связей N-H направлены от водорода к азоту;
суммирование их с дипольным моментом неподеленной пары приводит к увеличению дипольного момента
молекулы NH
3
(рис. 16,а). В случае молекулы трифторида азота дипольные моменты связей N-F и неподеленной
пары направлены в противоположные стороны и при сложении частично компенсируют друг друга (рис. 16,б).
64

H
N
H
H
..
F
N
F
F
..
а)
б)
NH
3
= 4,9 10
-30
Кл м
. .
NF
3
= 0,7 10
-30
Кл м
.
.
Рис. 16 Дипольные моменты связей и неподеленной электронной пары в молекулах NH
3
(а) и NF
3
(б)
Если та или иная молекула испытывает действие внешнего электростатического поля, в ней происходит
перераспределение электронной плотности, центры тяжести положительного и отрицательного заряда
смещаются, в результате чего неполярная молекула может стать полярной, а дипольный момент полярной
молекулы возрастает. Этот процесс называется поляризацией молекулы, а возникающий при этом диполь -
наведенным или индуцированным диполем. Значение индуцированного диполя зависит от природы молекулы и
напряженности поля (Е):
Е
= Е (5-11)
Величина в уравнении (5-11) называется поляризуемостью молекулы. Чем больше поляризуемость, тем
легче деформируется молекула под воздействием внешнего поля. Источником внешнего электрического поля
могут являться ионы или полярные молекулы, окружающие деформируемую частицу.
5.2.8. Недостатки метода валентных связей.
Наряду с очевидными достоинствами, методу валентных связей присущи определенные ограничения и
недостатки.
1. Метод ВС не способен объяснить существование частиц, связь в которых осуществляется за счет одного
электрона (одноэлектронная связь). Примером таких частиц может служить молекулярный катион водорода Н
2
+
;
эта частица существует в газовой фазе и характеризуется определенными длиной и энергией связи (106 пм,
255,7 кДж/моль).
2. Метод ВС не всегда адекватно отражает физические свойства молекул, в частности, их магнитное
поведение. Так, по методу ВС молекула О
2
должна быть диамагнитной, так как все электроны в ней спарены.
Реально же молекулярный кислород парамагнитен, причем магнитная восприимчивость молекулы кислорода
соответствует наличию в ней двух неспаренных электронов.
3. Метод ВС не рассматривает возбужденные состояния молекул, в силу чего не может быть использован
для объяснения спектров поглощения веществ и присущей им окраски.
4. При качественной характеристике химической связи метод ВС прост и нагляден, однако математический
аппарат метода весьма сложен, громоздок и неудобен для выполнения количественных расчетов с
использованием ЭВМ.
5.3. Метод молекулярных орбиталей
5.3.1. Основные принципы метода молекулярных орбиталей.
Метод молекулярных орбиталей (ММО), являющийся в настоящее время наиболее широко используемым
приемом описания химической связи, базируется на иных представлениях, нежели метод валентных связей,
рассмотренный в разделе 5.2.
Если метод валентных связей стремится выделить в молекуле отдельные пары атомов, между которыми
возникают двухцентровые локализованные связи, то метод молекулярных орбиталей рассматривает молекулу
как единую частицу, электроны которой заселяют молекулярные орбитали, принадлежащие молекуле как
целому. В результате описание молекулы по методу молекулярных орбиталей имеет много общего с описанием
многоэлектронного атома (раздел 2.5.). Основное отличие между молекулярными орбиталями, используемыми
методами ВС и МО, состоит в том, что в случае МВС молекулярные орбитали являются двухэлектронными
волновыми функциями, описывающими поведение пары электронов, образующих локализованную связь, тогда
как в случае ММО молекулярные орбитали представляют одноэлектронные волновые функции и описывают не
электронные пары, а каждый электрон соответствующей молекулы (как в многоэлектронном атоме). Подобные
МО обычно являются многоцентровыми и, как и атомные орбитали, характеризуются определенным набором
квантовых чисел, определяющих энергию и пространственное расположение орбитали. Чтобы описать молекулу
по методу МО, необходимо по определенным правилам сконструировать из атомных орбиталей
взаимодействующих атомов набор молекулярных орбиталей, построить энергетическую диаграмму, расположив
полученные орбитали в порядке возрастания их энергий, а затем распределить на них электроны молекулы.
Метод МО более универсален и прост по сравнению с методом ВС, но уступает последнему в наглядности. Свое
развитие ММО получил в трудах Р. Малликена, Ф. Хунда и ряда других исследователей.
Существует несколько вариантов ММО, отличающихся принципами конструирования молекулярных
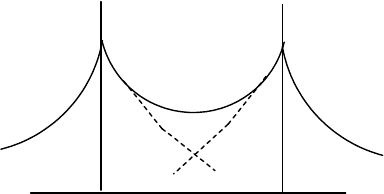
орбиталей; наиболее популярным из них является метод МО ЛКАО (аббревиатура тезиса: "Молекулярная
орбиталь - линейная комбинация атомных орбиталей"), в случае которого волновая функция молекулы
МО
конструируется по уравнению
МО
= с
i
i
(5-12)
65
где
i
- атомные орбитали входящих в молекулу атомов, с
i
- коэффициенты, определяющие "долю" участия
данной атомной орбитали в сформированной МО. Набор атомных орбиталей, используемых для построения
молекулярных орбиталей, называется атомным базисом. В основе метода МО ЛКАО лежат следующие
положения:
1. Состояние каждого электрона в многоатомной молекуле описывается молекулярной волновой функцией
МО
, квадрат которой в любой точке пространства пропорционален вероятности нахождения электрона в объеме
dV, включающем данную точку.
2. Число молекулярных орбиталей равно числу атомных орбиталей, образующих атомный базис.
3. Каждой МО соответствует определенный энергетический уровень; заполнение орбиталей электронами
начинается с самого нижнего уровня (как в многоэлектронном атоме).
4. Молекулярные орбитали подчиняются принципу Паули и правилу Хунда: на каждой МО могут находиться
два электрона с антипараллельными спинами; при наличии нескольких вырожденных МО электронные пары на
них начинают формироваться лишь после того, как все эти орбитали заполнятся неспаренными электронами.
5. Не все орбитали атомного базиса можно комбинировать в молекулярные орбитали. Комбинируемые
орбитали должны перекрываться (перекрывание может быть как положительным, так и отрицательным), быть
близкими по энергии и обладать сходной симметрией относительно оси связи. Если хотя бы одно из этих
условий не выполняется, соответствующие атомные орбитали переходят в молекулу без изменения.
Рассмотрим построение молекулярных орбиталей по методу МО ЛКАО на примере молекулы водорода.
Пусть электроны атомов водорода Н
а
и Н
b
описывают волновые функции
а
и
b
(
а
= 1s
a
, b = 1s
b
). Примем за
ось связи координату z, считая ее направленной для Н
а
слева направо, а для Н
b
- справа налево. Учитывая, что
линейное комбинирование допускает как сложение, так и вычитание волновых функций, уравнения МО (5-12) для
молекулы водорода приобретут вид:
+
= с
1
а
+ с
2
b
(5-13)
-
= с
3
а
- с
4
b
(5-13)
Примем для простоты, что с
1
= с
2
= с
3
= с
4
= 1. Тогда,
+
=
а
+
b
-
=
а
-
b
На рис. 17 приведены кривые волновых функций
а
и
b
(пунктирная линия) и кривая молекулярной волновой
функции
+
(сплошная линия); чтобы найти значения последней достаточно сложить значения
а
и
b
,
отвечающие каждой точке оси z. Как следует из рисунка 17, для областей отрицательных значений координаты z
а
и
b
практически совпадают с кривой
+
, а в пространстве между ядрами атомов водорода
+
больше нуля при
любых значениях z. Поскольку
+
2
=
а
2
+
b
2
+ 2
а
b
>
а
2
+
b
2
вероятность нахождения электронов между ядрами, определяемая значением
+
2
, будет больше, если
электроны будут располагаться на орбитали
+
, чем если каждый их них находился на одной из атомных
орбиталей. Соответственно возрастает плотность отрицательного заряда между ядрами, что приводит к
сближению ядер. В результате молекулярные орбитали, являющиеся суммой атомных орбиталей,
характеризуются более низкой энергией, чем комбинируемые атомные орбитали; заселение таких орбиталей
электронами стабилизирует образующуюся молекулу, в силу чего орбитали, представляющие сумму атомных
орбиталей, называются связывающими молекулярными орбиталями (СМО).
a
b
a
b
H
a
H
b
Рис. 17. Волновые функции
а
,
b
и
+
Для молекулярной орбитали
-
значение
b
следует брать со знаком минус, в результате чего для точки,
равно удаленной от ядер атомов Н
а
и Н
b
, значение
-
становится равным нулю (рис. 18), плотность электронного
облака между ядрами понижается, а энергия системы при расположении электронов на
-
-орбитали
увеличивается, что влечет за собой дестабилизацию частицы. Орбитали, представляющие разность атомных
орбиталей, называются разрыхляющими молекулярными орбиталями (РМО).
66
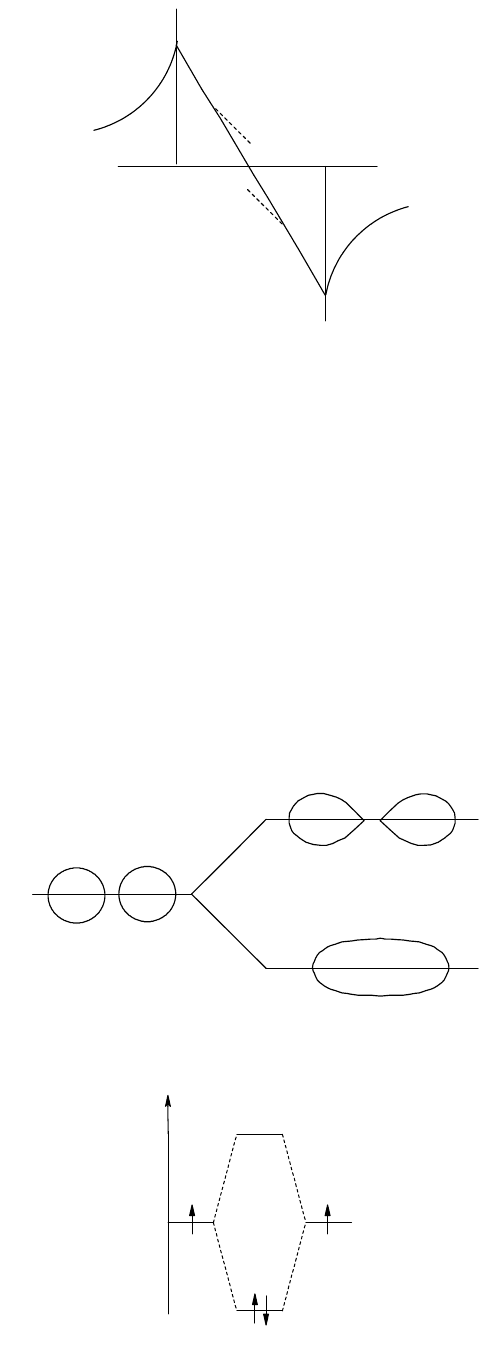
a
b
a
b
H
a
H
b
Рис. 18. Волновые функции
а
,
b
и
-
Если атомные орбитали не могут быть скомбинированы в связывающие или разрыхляющие молекулярные
орбитали, то они переходят в молекулу без изменений и называются несвязывающими молекулярными
орбиталями; заселение несвязывающих орбиталей электронами не влияет на энергию частицы.
Граничные поверхности связывающей и разрыхляющей орбиталей, сконструированных из 1s
a
и 1s
b
-
орбиталей с указанием знака волновых функций показаны на рис. 19. Как следует из рис. 19, обе МО являются
симметричными относительно оси связи: поворот этих орбиталей вокруг оси z на 180 не сопровождается
изменением знака волновой функции. Подобные орбитали называют сигма-орбиталями и обозначают символом
с верхним индексом, указывающим является ли данная орбиталь связывающей, разрыхляющей или
несвязывающей ("св.", "р", "нс") и с нижним индексом, указывающим на то, из каких АО сконструирована данная
МО. Так, орбитали, построенные из 1s
a
и 1s
b
-орбиталей, можно обозначить символами
s
св
(или
1s
св
) и
s
р
(или
1s
р
).
Энергетические характеристики орбиталей атомного базиса и полученных из них молекулярных орбиталей
удобно выражать с помощью энергетической диаграммы. На подобных диаграммах откладывают значения
энергии атомных орбиталей и построенных из них молекулярных орбиталей (в середине); пунктирные линии на
диаграмме показывают, из каких АО сконструированы МО (рис. 20). Валентные электроны взаимодействующих
атомов распределяют по молекулярным орбиталям в порядке возрастания энергии последних, что дает
определенную электронную формулу (электронную конфигурацию) молекулы и позволяет охарактеризовать ее
свойства. Так, в случае молекулы водорода два валентных электрона займут орбиталь
s
св
(рис. 20), чему
соответствует электронная формула (
s
св
)
2
.
+
+
+
+
-
-
.
.
.
.
.
+
+
z
z
z
1 s
a
1 s
b
1 s
a
+ 1 s
b
1 s
a
- 1 s
b
H
a
H
b
H
a
H
b
s
s
р
с в
.
+
+
Рис. 19. Граничные поверхности молекулярных орбиталей молекулы водорода
H
a
H
b
1 s
a
1 s
b
H
2
E
s
s
p
с в
Рис. 20. Энергетическая диаграмма системы из двух атомов водорода
67

Метод МО не требует использования понятия валентность. В то же время важное значение для описания
молекул приобретает характеристика, называемая кратностью связи. Кратность (порядок) связи определяют как
полуразность числа электронов на связывающих и разрыхляющих орбиталях:
КС =
1
2
[n (CMO) - n (PMO)]
e e
(5-15)
Кратность связи может быть как целочисленной, так и дробной величиной.
Метод молекулярных орбиталей позволяет оценить ряд важнейших характеристик молекул. К ним относятся:
1. Принципиальная возможность существования частиц. Частица может существовать, если кратность связи
для нее больше нуля. При кратности связи, равной нулю, частица неустойчива.
2. Энергия связи. Энергия связи тем выше, чем больше кратность связи. При одинаковых значениях
кратности связи энергия связи для различных частиц могут отличаться в зависимости от природы последних.
3. Длина связи (межъядерное расстояние). Межъядерное расстояние тем меньше, чем больше кратность
связи.
4. Магнитные свойства частиц. По своему отношению к внешнему магнитному полю частицы делятся на две
группы:
а) парамагнитные частицы, втягиваемые магнитным полем; такие частицы содержат неспаренные
электроны;
б) диамагнитные частицы, выталкиваемые магнитным полем; все электроны таких частиц спарены.
Метод МО позволяет установить, содержит ли частица неспаренные электроны и, следовательно, является
ли она парамагнитной или диамагнитной.
5.3.2. Применение метода молекулярных орбиталей.
5.3.2.1. Двухатомные молекулы.
Метод молекулярных орбиталей может быть использован для объяснения и предсказания возможности
существования и свойств самых различных молекулярных частиц. Простейшим объектом описания по методу
МО являются двухатомные молекулы и молекулярные ионы. Эти частицы могут быть подразделены на
двухатомные гомоядерные молекулы, состоящие из двух атомов одного химического элемента, и двухатомные
гетероядерные молекулы, образованные атомами двух разных элементов. Остановимся последовательно на
характеристике каждой из этих групп молекул.
Двухатомные гомоядерные молекулярные частицы элементов I периода.
Первый период периодической системы содержит всего два элемента (водород и гелий), для которых
валентной является 1s-орбиталь, что позволяет использовать для гомоядерных двухатомных частиц элементов
первого периода набор МО, приведенный на рис. 20 (
s
св
и
s
р
-орбитали). Рассмотрим, возможно ли
существование двухатомных молекул Н
2
и Не
2
. Как следует из табл. 14, два валентных электрона в молекуле
водорода заполняют
s
св
- орбиталь, тогда как
s
р
- орбиталь остается вакантной. Отсюда кратность связи в
молекуле водорода равна 1:
KC =
1
2
2 0) = 1(
,
что обеспечивает ее стабильность.
Метод МО объясняет также диамагнетизм молекулы водорода: эта молекула не содержит неспаренных
электронов (табл. 14).
Молекула может как терять, так и присоединять электроны, превращаясь в молекулярные ионы. В табл. 11
сопоставлены электронные конфигурации ионов
H
2
+
,
H
2
-1
и
H
2
-2
. Как следует из табл. 11,
H
2
+
и
H
2
-1
,
имеющие кратность связи, равную 0,5, способны к существованию, что подтверждается экспериментом, в то
время как ион
H
2
-2
абсолютно неустойчив. В то же время энергии связи в ионах
H
2
+
и
H
2
-1
будут меньше
энергии связи в молекуле Н
2
, а длины связей - больше. Действительно, для молекулы Н
2
эти характеристики
равны 435 кДж/моль и 74 пм, а для иона
H
2
+
- 256 кДж/моль и 106 пм.
То, что связь в ионе
H
2
+
осуществляется лишь одним электроном, объясняется в рамках метода МО без
каких-либо дополнительных допущений, тогда как метод ВС одноэлектронную связь не объясняет. Метод МО
объясняет также невозможность существования молекул водорода с параллельными спинами электронов: в
этом случае один из электронов оказался бы на
s
св
-, а другой на
s
р
-орбитали, чему бы соответствовала
кратность связи, равная нулю.
Для молекулы Не
2
(табл. 14) число валентных электронов равно четырем, а кратность связи - нулю.
Молекула Не
2
, таким образом, существовать не может. В то же время для молекулярного иона Не
2
+
КС =
0,5 = 1) - (2
2
1
в силу чего существования катиона дигелия возможно. Действительно, образование ионов Не
2
+
(Е
св
= 241
кДж/моль, d
Не-Не
= 108 пм) подтверждено экспериментально при пропускании тихого электрического разряда
через газообразный гелий.
Из рассмотренных частиц электронной формуле (
s
св
)
1
отвечает ион Н
2
+
, формуле (
s
св
)
2
- молекула Н
2
,
формуле (
s
св
)
2
(
s
р
)
1
- ионы Н
2
-1
и Не
2
+
, (
s
св
)
2
(
s
р
)
2
- Не
2
и Н
2
-2
.
68
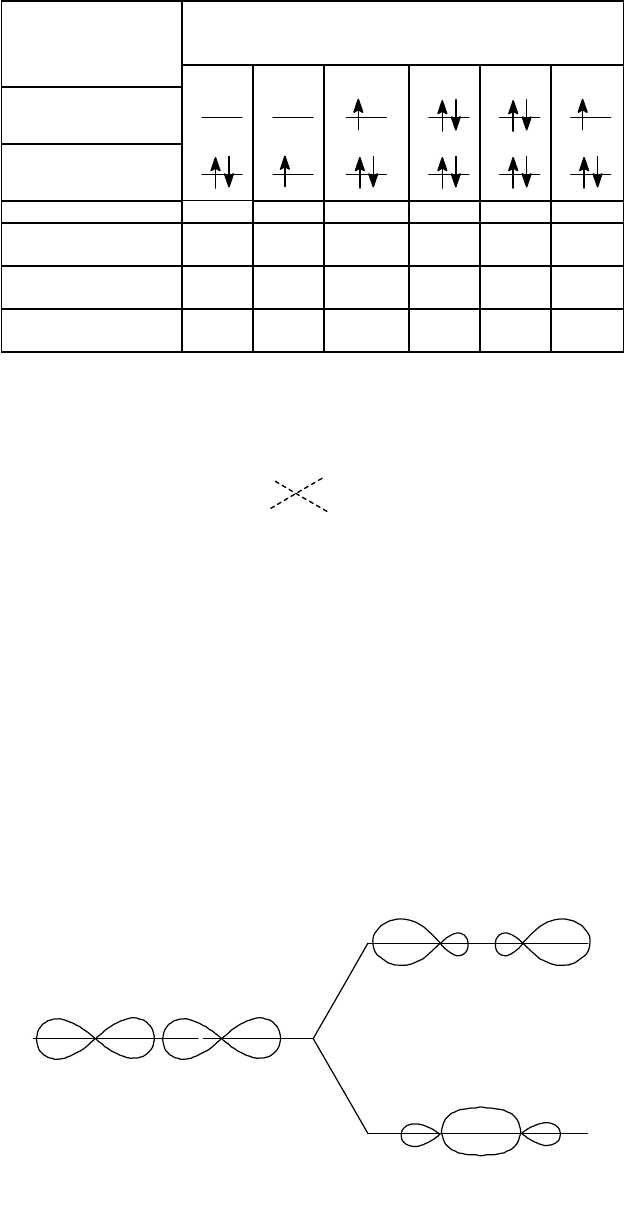
Таблица. 14.
Двухатомные гомоядерные молекулы и молекулярные ионы элементов первого периода
Распределение
электронов
Молекулярная частица
Н
2
Н
2
+
Н
2
-
Н
2
2-
Не
2
Не
2
+
s
р
s
св
Кратность связи 1 0,5 0,5 0 0 0,5
Энергия связи,
кДж/моль 435 256 15 0 0 241
Длина связи,
Пм 74 106
нет
данных - - 108
Магнитные
свойства* Д П П - - П
*) Д - диамагнитные молекулы, П - парамагнитные молекулы
Двухатомные гомоядерные молекулы элементов II периода.
Для элементов второго периода валентными являются как 2s-, так и 2р-орбитали, в результате чего атомный
базис будет включать 8 АО (по четыре от каждого атома):
2s
a
-----------2s
b
2p
za
---------2p
zb
2p
xa
---------2p
xb
2p
ya
---------2p
yb
Пунктиром соединены АО, способные перекрываться, если линей связи является ось z. В результате набор
МО для рассматриваемой группы молекул будет включать восемь орбиталей. Некоторые осложнения вносит тот
факт, что в этом случае 2s-орбитали перекрываются не только взаимно, но и с 2р
z
-орбиталями. Вопрос о том,
будут ли вносить вклад 2р
z
-орбитали в формирование
s
- орбиталей, а 2s- орбитали в построение
z
- орбиталей,
зависит от их энергетической близости. Если разность энергий 2s- и 2p-подуровней велика, 2p
z
-орбитали не
будут участвовать в построении
s
- орбиталей. Если же эти подуровни близки по энергиям, то комбинирование
2s и 2p
z
-орбиталей в МО становится возможным.
Рассмотрим более простой случай, когда разность энергий 2s- и 2р-орбиталей высока и соответствующие
волновые функции не смешиваются. В этом случае комбинирование 2sa и 2sb -орбиталей происходит так же, как
и в случае 1s-орбиталей; в результате образуются молекулярные орбитали
s
св
и
s
р
. Комбинирование 2p
za
и 2p
zb
АО иллюстрирует рис. 21; связывающая и разрыхляющая МО, полученные при этом, являются сигма-
орбиталями (
z
св
и
z
р
), так как при повороте вокруг оси z на 180 волновая функция не меняет знак.
z
z
z
2p
za
2p
zb
+
-
+
+
+
+
-
-
-
-
-
-
2p
za
+ 2p
zb
2p
za
- 2p
zb
z
z
св
р
Рис. 21. Построение
z
св
- и
z
p
-орбиталей
Орбитали 2p
xa
и 2p
xb
перекрываются выше и ниже линии связи; комбинирование их приводит к образованию
связывающей и разрыхляющей МО, граничные поверхности которых показаны на рис. 22. Поворот этих
орбиталей вокруг оси z на 180 сопровождается переменой знака волновой функции; подобные орбитали
называются -орбиталями. При этом орбиталь, представляющая сумму АО, будут связывающей (
x
св
-орбиталь),
69
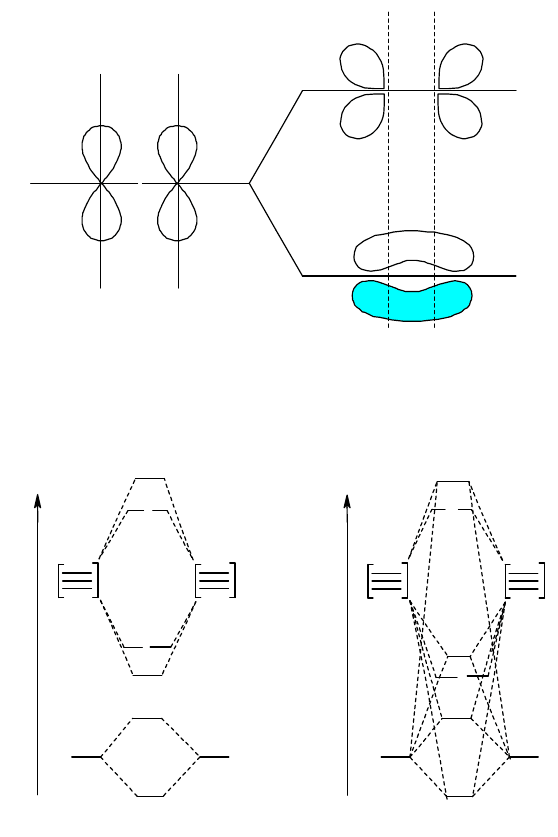
а разность - разрыхляющей (
x
р
-орбиталь). Аналогичные орбитали дает комбинирование 2p
ya
и 2p
yb
-орбиталей;
орбитали
y
св
и
y
р
имеют такую же энергию, что и орбитали
x
св
и
x
р
, поскольку энергии АО 2p
x
и 2p
y
одинаковы.
Энергии построенных МО тем ниже, чем ниже энергии комбинируемых атомных орбиталей и чем сильнее
последние перекрываются; в результате полученные МО в порядке возрастания их энергии располагаются в
следующий ряд:
s
св
<
s
p
<
z
св
<
x
св
=
y
св
<
x
p
=
y
p
<
z
р
(5-16)
Энергетическая диаграмма молекулярных орбиталей двухатомных гомоядерных молекул элементов второго
периода со значительным энергетическим отличием 2s- и 2p-подуровней приведена на рис. 23,а.
Если энергии 2s- и 2p-орбиталей близки, становится возможной частичная гибридизация этих орбиталей, в
результате чего 2p
z
-орбитали вносят некоторый вклад в
s
-орбитали, а 2s-орбитали - в
z
молекулярные
орбитали. При этом энергия
s
-орбиталей понижается, в а
z
повышается, в результате чего энергия
z
св
-
орбитали становится выше энергии орбиталей
x,y
св
, что приводит к ряду
s
св
<
s
p
<
x
св
=
y
св
<
z
св
<
x
p
=
y
p
<
z
р
(5-17)
и энергетической диаграмме, изображенной на рис. 23,б.
z
z
z
2 p
x a
2 p
x b
+
-
+
+
+
+
-
-
-
-
2 p
z a
+ 2 p
z b
2 p
z a
- 2 p
z b
.
.
. .
x
x
x
x
с в
р
-
Рис. 22. Построение
x
св
и
x
р
-орбиталей
Е
а )
Е
б )
s
с в
s
z
z
p
s
s
z
z
p
p
с в
2 s
a
2 s
a
2 s
b
2 s
b
2 p
a
2 p
a
2 p
b
2 p
b
x , y
x , y
x , y
x , y
с в
с в
р
р
с в
p
с в
Рис. 23. Энергетические диаграммы молекулярных орбиталей двухатомных гомоядерных молекул
второго периода:
а) - различие Е
2p
и E
2s
велико;
б) - различие Е
2p
и E
2s
мало.
Во втором периоде при перемещении слева направо разности энергий подуровней 2р и 2s возрастают от 190
кДж/моль у лития до 2600 кДж/моль у неона. В связи с этим последовательность (5-17) соблюдается для
70
