Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

валентности равно четырем. Однако эта валентность реализуется не у всех элементов. Уже кислород проявляет
валентность четыре крайне редко; примером таких соединений является основной ацетат бериллия
Be
4
O(CH
3
COO)
6
, имеющий следующее строение:
Be
O
Be
Be
Be
O
O
O
O
O
O
O
O
O
O
O
O
O
O
=
O
O
CH
3
Центральный атом кислорода образует в этом соединении четыре связи с атомами бериллия.
Соединения четырехвалентного фтора и тем более четырехвалентного неона не получены.
Все рассмотренные выше элементы могут проявлять валентность меньше максимальной. Так, бериллий в
газообразном фториде бериллия BeF
2
двухвалентен; в образовании связей в этом случае принимают участие
лишь две из четырех валентных орбиталей бериллия.
Валентность в ковалентных соединениях обычно принимает значения от единицы до восьми. Валентность,
превышающая восемь реализуется редко; например, в соединении OsO
4
P(C
2
H
5
)
3
осмий девятивалентен.
В заключение, обобщая сказанное выше, сформулируем несколько общих правил, характеризующих
валентность как свойство элемента.
1. Валентность элемента в ковалентных соединениях равна числу электронных орбиталей его атома,
участвующих в образовании химических связей по обменному и донорно-акцепторному механизмам.
2. Максимальное значение валентности элемента не может превысить число орбиталей валентных
подуровней его атома.
3. Максимальная теоретически возможная валентность элемента определяется номером периода, но не
зависит от номера группы, в которой находится элемент.
5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
Ковалентная связь тем прочнее, чем сильнее перекрываются атомные орбитали взаимодействующих
атомов. Действительно, чем полнее перекрывание атомных орбиталей, тем выше электронная плотность между
ядрами, ниже энергия образовавшейся частицы и, следовательно, выше энергия связи. Поскольку атомные
орбитали ориентированы в пространстве строго определенным образом (раздел 2.4), для максимального
перекрывания электронных орбиталей необходимо, чтобы взаимодействующие атомы были определенным
образом ориентированы друг относительно друга. В результате образующиеся молекулы должны иметь
определенную геометрическую форму, обеспечивающую максимальное перекрывание и наиболее прочную
связь.
В качестве примера рассмотрим строение молекулы теллуроводорода. Теллур, аналог кислорода, имеет
электронную конфигурацию 5s
2
5p
4
. Образование связей в молекуле Н
2
Те происходит за счет перекрывания 1s-
орбиталей двух атомов водорода с двумя 5р-орбиталями атома теллура (например, 5p
x
и 5p
z
). Поскольку 5p
x
-
орбиталь направлена по оси х, а 5p
z
-орбиталь - по оси z, максимальное перекрывание будет наблюдаться тогда,
когда ядро одного атома водорода окажется на оси х, а другого - на оси z (рис. 9,а). Вследствие этого молекула
теллуроводорода должна иметь угловую форму с углом между связями Те-Н, близким к 90 , т.е. углу между
орбитали p
x
и p
z
. Экспериментально определенное значение валентного угла в молекуле Н
2
Те составляет 90,25 .
Аналогично молекула гидрида сурьмы SbH
3
, в которой связи образуются в результате перекрывания трех 5р-
орбиталей сурьмы с 1s-орбиталями трех атомов водорода, должна иметь форму тригональной пирамиды с
прямыми углами при вершине. Действительно, валентные углы для молекулы SbH
3
составляют 91,6 , т.е. весьма
близки к ожидаемым (рис. 9,б).
Более сложная картина наблюдается в том случае, когда атом предоставляет для образования связей
орбитали различных подуровней. Рассмотрим это вопрос на примере молекул газообразного фторида бериллия.
Атом бериллия в этом соединении образует две связи с атомами фтора по обменному механизму, что требует
перехода электронной конфигурации невозбужденного атома 2s
2
в конфигурацию 2s
1
2p
1
(раздел 4.2.2). В
результате можно ожидать, что связи в молекуле ВеF
2
не будут равноценными, так как одна из них образуется за
счет s-электрона, а вторая - за счет р-электрона. Однако в действительности обе связи в молекуле BeF
2
абсолютно равноценны как по длине, так и по энергии. Аналогичное явление наблюдается для молекул BF
3
и
CF
4
, все связи в которых идентичны. Для объяснения этих и множества других подобных фактов Л.Полингом
была предложена теория гибридизации электронных орбиталей, основные положения которой рассмотрены
ниже.
Л.Полинг показал, что понижение энергии системы при образовании молекул становится более
значительным, если волновые функции орбиталей, используемых атомом для образования связей, заменить их
линейной комбинацией. Подобное "смешивание" волновых функций атома называется гибридизацией
электронных орбиталей, а полученные в результате этой операции "смешанные" волновые функции -
гибридными орбиталями. В результате гибридизации из нескольких отличающихся по энергии, форме граничной
поверхности и кривой распределения электронной плотности орбиталей образуется такое же число одинаковых
51

по энергии и форме граничной поверхности гибридных орбиталей. Последние ориентированы в пространстве
таким образом, чтобы отталкивание между электронами было минимальным.
y
x
z
.
.
y
x
z
.
.
.
а)
б)
Te H
H
Sb H
H
H
Рис. 9. Перекрывание атомных орбиталей при образовании молекул TeH
2
(a) и SbH
3
(б)
Рассмотрим простейший тип гибридизации, являющийся результатом смешивания s-орбитали и одной р-
орбитали (например, р
х
) этот тип гибридизации называется sp-гибридизацией. Линейная комбинация
взаимодействующих орбиталей
s
и
px
выразится уравнением
sp
= c
1
s
+ c
2
px
где коэффициенты с
1
и с
2
определяют доли s- и р-характера полученной гибридной орбитали. Поскольку в
данном случае s- и р-орбитали вносят в гибридную орбиталь одинаковые вклады, коэффициенты с
1
и с
2
равны по
абсолютной величине, хотя могут отличаться по знаку, так как линейное комбинирование подразумевает как
сложение, так и вычитание комбинируемых функций. Численные значения с
1
и с
2
можно найти, исходя из того,
что гибридная функция должна быть нормированной (раздел 1.3). В этом случае
1 = dV
2
sp
откуда
1 = dVc + dVc2c + dVc = dV)c + (c
2
px
2
2pxs21
2
s
2
1
2
px2s1
Поскольку s -и р-орбитали нормированы порознь, интегралы
dV
2
s
и
dV
2
px
равны единице.
Интеграл
dV
pxs
является интегралом перекрывания s- и р-орбиталей, принадлежащих одному атому.
Подобные орбитали обладают особым свойством, называемым ортогональностью: полное перекрывание любых
двух орбиталей, принадлежащих одному атому, всегда является нулевым. Чтобы убедиться в этом достаточно
взглянуть на рис. 10, на котором показано перекрывание s- и р
х
-орбиталей.
+
+
+
-
x
s
p
x
(+)
sp
+
+
-
-
+
+
+
-
x
s
p
x
sp
+
+
-
-
(-)
x
x
+
+
+
+
-
-
-
-
Рис. 10. Построение sp-гибридных орбиталей
Области перекрывания s-орбитали каждым из лепестков р
х
-орбитали равны, однако для положительных
значений х перекрывание положительно, а для отрицательных - отрицательно, в результате чего полное
перекрывание равно нулю. Отсюда интеграл перекрывания
dV
pxs
также равен нулю, соответственно
52

2
1
= c ;
2
1
= c 1; = c + c
21
2
2
2
1
что приводит к двум уравнениям гибридных орбиталей
) + (
2
1
=
pxs
(+)
sp
) - (
2
1
=
pxs
(-)
sp
Изменение граничных поверхностей орбиталей при гибридизации показано на рис. 10. Как следует из рис.
10, при нулевом полном перекрывании орбиталей (свойство ортогональности) перекрывание будет
положительным в области положительных значений
рх
и отрицательным там, где
рх
< 0. В результате
гибридные орбитали приобретают форму асимметричной гантели. Такая форма обеспечивает большее
перекрывание при образовании связи, чем в случае "чистых" атомных орбиталей. Поэтому образование связей с
участием гибридных орбиталей энергетически более выгодно.
Образовавшиеся гибридные орбитали ориентируются в пространстве так, чтобы силы отталкивания между
находящимися на них электронами были минимальными. В случае sp-гибридизации гибридные орбитали
ориентируются по одной оси в разные стороны, а угол между ними составляет 180 .
Гибридные орбитали подчиняются всем квантово-механическим законам: на гибридной орбитали могут
находиться не более двух электронов с антипараллельными спинами (принцип Паули), на вырожденных
гибридных орбиталях электроны распределяются так, чтобы суммарный спин их был максимальным (правило
Хунда). Именно по этой причине sp-гибридизация для атома бериллия приводит к распариванию 2s
2
-электронов
и распределению их по одному на орбиталях двухкратно вырожденного sp-уровня.
Не все атомные орбитали могут быть гибридизованы. Устойчивая гибридизация требует соблюдения
определенных условий:
1. Гибридизируемые орбитали должны быть близки по энергии. По этой причине s- и р-орбитали
гибридизируются лишь тогда, когда они принадлежат одному и тому же энергетическому уровню. В случае d-
орбиталей дело обстоит несколько иначе. Поскольку (n-1)d-орбитали не слишком сильно отличаются по энергии
от ns-орбиталей, возможны три варианта гибридизации:
а) Внешняя гибридизация, при которой гибридизируются s-, p- и d-орбитали, принадлежащие одному
энергетическому уровню и характеризующиеся одинаковым значением главного квантового числа. В случае
этого типа гибридизации d-орбитали записываются после p-орбиталей (например, sp
3
d
2
);
б) Внутренняя гибридизация - гибридизируются (n-1)d-, ns- и np-орбитали. При записи данного типа
гибридизации d-орбитали предшествуют s-орбиталям (например, d
2
sp
3
);
в) Смешанная гибридизация - в гибридизации участвуют как nd-, так и (n-1)d-орбитали. В случае смешанной
гибридизации число (n-1)d-орбиталей указывается перед ns-орбиталями, число d-орбиталей - после np-
орбиталей (например, dsp
3
d).
2. Гибридизируемые орбитали должны иметь достаточно высокую электронную плотность. В подгруппах
периодической системы с увеличением главного квантового числа размеры орбиталей увеличиваются, а число
электронов на валентных орбиталях не изменяется, в результате чего электронная плотность понижается.
Поэтому в подгруппах элементов при перемещении сверху вниз способность к гибридизации атомных орбиталей
убывает. Именно по этой причине в рассмотренных выше молекулах TeH
2
и SbH
3
связи образуются за счет p-
орбиталей (рис. 9), а гибридизация не наблюдается.
Случай sp-гибридизации был рассмотрен выше. Этот тип гибридизации сопровождается образованием из s-
и одной р-орбитали двух гибридных орбиталей и обеспечивает валентный угол, равный 180 . sp-Гибридизации
соответствует образование линейных молекул, примером которых может служить молекула газообразного
гидрида бериллия (рис. 11,а).
В случае sp
2
-гибридизации смешиваются s- и две р-орбитали. Полученные при этом асимметричные
гибридные орбитали лежат в одной плоскости, образуя равносторонний треугольник; угол между смежными
орбиталями составляет 120. sp
2
-Гибридизации подвергается, например, атом бора в молекуле ВН
3
, имеющей
форму равностороннего треугольника (рис. 11,б). Следует отметить, что молекула ВН
3
нестабильна и существует
лишь в газовой фазе при высокой температуре, а при обычных температурах она димеризуется в диборан В
2
Н
6
.
При sp
3
-гибридизации из s- и трех р-орбиталей образуется четыре гибрида, направленные от центра
тетраэдра к его вершинам. Валентный угол в молекулах с sp
3
-гибридизацией центрального атома составляет
109,5 ; примером молекул с данным типом гибридизации может служить молекула метана (рис. 11,в).
.
.
.
.
.
.
.
.
.
а) б)
в)
Рис. 11 Строение молекул BeH
2
(а), BH
3
(б) и CH
4
(в)
53
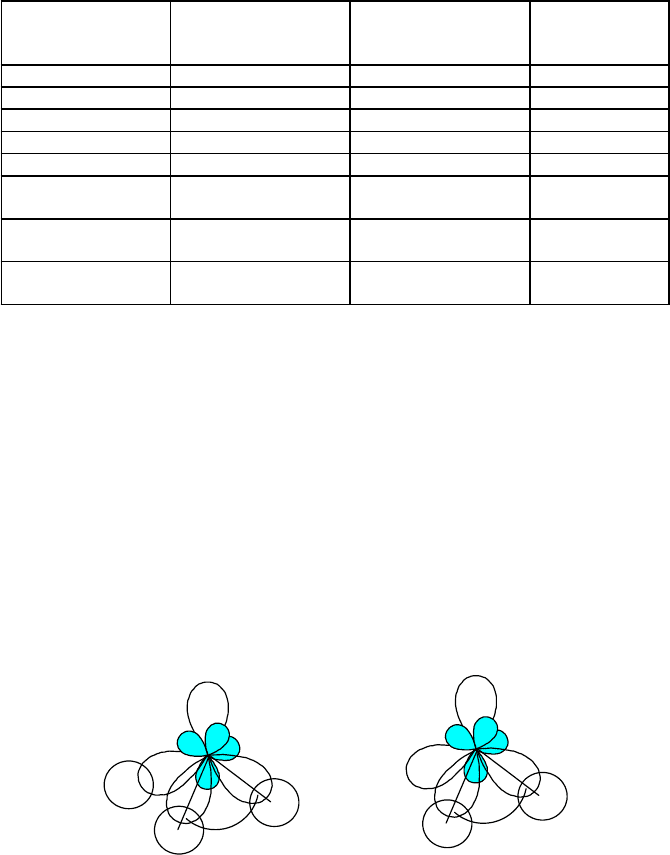
Некоторые типы гибридизации с участием d-орбиталей представлены в табл. 11, в которой приведены
геометрические модели гибридных орбиталей, значения валентных углов и примеры молекул и ионов,
центральный атом которых подвергается данному типу гибридизации.
Как правило, все орбитали, образующиеся при гибридизации данного типа, эквивалентны как по значениям
валентных углов, так и по длине образующихся связей. Исключением является sp
3
d-гибридизация, в случае
которой пять гибридных орбиталей образуют тригональную бипирамиду. При этом три орбитали располагаются в
экваториальной плоскости (экваториальные орбитали), а две орбитали направлены перпендикулярно этой
плоскости (аксиальные орбитали). Валентные углы, отвечающие этому типу гибридизации, не одинаковы (120
между экваториальными орбиталями, 180 между аксиальными орбиталями и 90 между экваториальными и
аксиальными орбиталями). Связи, образованные за счет экваториальных и аксиальных орбиталей, несколько
отличаются как по длине, так и по энергии. Так, в молекуле PСl
5
длина связей P-Cl равна 202 пм для
экваториальных и 212 пм для аксиальных орбиталей. Существует мнение, что dsp
3
-гибридизация не является
индивидуальной, а представляет собой сочетание sp
2
-гибридизации (экваториальные орбитали) и pd-
гибридизации (аксиальные орбитали). При таком подходе причины неэквивалентности гибридных орбиталей
фосфора в PCl
5
становятся очевидными.
Таблица 11.
Некоторые типы гибридизации с участием s-, p- и d-орбиталей
Тип
гибридизации
Геометрическая
модель гибридных
орбиталей
Валентные
углы,
Примеры
sp Прямая линия 180 BeF
2
dp Прямая линия 180 [Re
2
Cl
8
]
2-
sp
2
Треугольник 120 BF
3
sp
3
Тетраэдр 109,5 [BF
4
]
1-
d
3
s Тетраэдр 109,5 [MnO
4
]
1-
dsp
2
Квадрат
90,
180
[AuCl
4
]
1-
sp
3
d Тригональная
бипирамида
90,
120, 180
PCl
5
sp
3
d
2
Октаэдр
90,
180
SF
6
На гибридных орбиталях могут находиться как неспаренные электроны, так и электронные пары, гибридные
орбитали могут также оставаться вакантными. В результате подвергшийся гибридизации атом может
образовывать связи как по обменному, так и по донорно-акцепторному механизму. Наличие в образовавшейся
молекуле неподеленных пар на гибридных орбиталях оказывает влияние на геометрию частицы, искажая
валентные углы, соответствующие данному типу гибридизации. Неподеленная пара электронов менее оттянута
от ядра центрального атома, чем связывающая, находящаяся между ядрами. В связи с этим неподеленная
электронная пара оказывает большее отталкивающее действие на другие электронные пары, нежели
связывающая. В результате углы между орбиталями, занятыми связывающими парами, уменьшаются, а
неподеленными - увеличиваются. В качестве примера рассмотрим строение молекул аммиака и воды (рис. 12).
При образовании молекулы аммиака атом азота подвергается sp
3
-гибридизации; на четырех гибридных
орбиталях распределяются пять электронов, что приводит к появлению неподеленной электронной пары;
соответственно молекула аммиака имеет форму тригональной пирамиды (рис. 12,а). Валентный угол,
отвечающий sp
3
-гибридизации, равен 109,5, однако наличие неподеленной электронной пары приводит к его
сжатию до 107,3.
Образование молекул воды также сопровождается sp
3
-гибридизацией; две из четырех гибридных орбиталей
заполняют неподленные пары, а остальные используются на образование связей О-Н по обменному механизму.
В результате молекула воды имеет угловую форму, а валентный угол сжимается до 104,5.
.
.
.
..
N
H
H
H
107,3
o
а)
.
.
..
O
H
H
104,5
o
б)
..
Рис. 12 Строение молекул NH
3
(а) и H
2
O(б)
По мере того как в результате сжатия угол между гибридными орбиталями, занятыми несвязывающими
электронными парами, приближается к 90, т.е. к углу между "чистыми" р-орбиталями, форма гибридных
орбиталей меняется, приближаясь к форме р-орбиталей. Одновременно гибридная орбиталь, занятая
неподеленной парой, приобретает форму s-орбитали. Гибридизация, при которой форма гибридных орбиталей
перестает быть идентичной, называется неполной гибридизацией. Изменение формы орбиталей существенно
влияет на свойства образующихся связей. Так в молекуле фосфина РН
3
валентный угол НРН равен 93,5, в
54

результате чего орбиталь, занятая неподеленной парой, имеет сильно выраженный s-характер, а орбитали,
занятые связывающими парами - р-характер. В результате фосфор в молекуле фосфина значительно слабее
проявляет донорные свойства, чем азот в молекуле аммиака.
Когда центральный атом в молекуле использует неподеленную пару для образования связи по донорно-
акцепторному механизму, сжатие валентного угла исчезает, если неподеленная пара одна, или уменьшается,
если неподеленных пар несколько. Так, присоединение аммиаком иона водорода приводит к образованию
тетраэдрического иона NH
4
+
, все валентные углы в котором равны 109,5. Ион гидроксония, образующийся при
присоединении иона водорода к молекуле воды, имеет форму тригональной пирамиды, для которой валентные
углы НОН равны 109,0.
При образовании молекул может наблюдаться и расширение валентных углов. Это явление имеет место
тогда, когда на одной из гибридных орбиталей молекулярной частицы остается неспаренный электрон.
Например, атом азота в молекуле NO
2
, подвергается sp
2
-гибридизации, две гибридные орбитали используются
на образование связей с атомами кислорода, а на третьей сохраняется неспаренный электрон, который слабее
отталкивает связывающие электронные пары, чем неподеленная пара. В результате валентный угол в молекуле
диоксида азота составляет 131, а не 120.
Гибридизация электронных орбиталей существенно повышает прочность связи. По данным Л.Полинга
относительная прочность связей, образованных за счет различных "чистых" и гибридных орбиталей,
характеризуется следующими значениями:
Тип орбитали s p sp sp
2
sp
3
Относительная прочность
связи
1,00 1,73 1,93 1,99 2,00
В то же время тип гибридизации слабо влияет на прочность образующихся связей.
5.2.4. Кратность ковалентной связи.
Между двумя атомами в молекуле возможно образование не только одной, но и нескольких локализованных
связей. Ковалентные связи, осуществляемые двумя и более электронными парами называются кратными
связями, в отличие от связи, осуществляемой одной электронной парой, называемой одинарной. Число
электронных пар, связывающих два атома, называется кратностью связи.
При образовании кратных связей всегда соблюдается следующее правило: электронные облака
взаимодействующих атомов, образующие кратные связи не могут перекрываться в одном и том же направлении,
т.е. иметь одинаковое расположение в пространстве. Так, например, если между двумя атомами, ядра которых
лежат на оси х образовалась связь в результате перекрывания двух p
x
-орбиталей, то вторая связь за счет
перекрывания s- или d
x2-y2
орбиталей возникнуть не может, так как эти орбитали перекрываются в том же
направлении, что и p
x
-орбитали.
В зависимости от характера перекрывания различают три вида ковалентной связи.
1. Сигма-связь (-связь). Перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии,
соединяющей ядра взаимодействующих атомов. -Связь, таким образом, включает координатную ось,
соединяющую ядра, которая в данном случае является осью симметрии связывающего электронного облака. -
Связь может быть образована орбиталями любого типа (s-, p-, d-орбитали), если эти орбитали положительно
перекрываются по линии связи; наиболее прочная -связь образуется за счет гибридных орбиталей, так как эти
орбитали перекрываются лучше, чем "чистые" орбитали. В силу этого образованию -связи обычно
предшествует гибридизация, если последняя возможна. На рис. 6,а и 13,а приведены примеры перекрывания
различных типов орбиталей (s-, p
x
- ,
d
x y
2 2
-, sp-гибриды), приводящие к образованию -связей.
2. Пи-связь (-связь). Перекрывание орбиталей происходит в направлении, перпендикулярном линии связи
(боковое перекрывание). Образующееся при этом связывающее электронное облако имеет плоскость
симметрии, включающую линию связи и одну из координатных осей. Поскольку линии связи (ось х)
перпендикулярны как ось у, так и ось z, между двумя атомами могут возникнуть две -связи, для которых
электронные облака не будут пространственно совмещаться. -Связь может образовываться за счет как р-, так и
d-орбиталей. На рис. 13,б показано перекрывание пар p
z
- и d
xy
-орбиталей, приводящее к образованию -связей.
s-Орбитали, перекрывающиеся только по линии связи, образовывать -связи не могут; не образуют -связи
также пары типа p
za
-p
yb
, так как их перекрывание нулевое.
Поскольку перекрывание атомных орбиталей при образовании -связей происходит вне области
максимальной плотности электронных облаков, прочность -связи меньше прочности -связи. Тем не менее
образование -связей дополнительно стабилизирует молекулу. Поэтому, если -связь образуется за счет
гибридной орбитали, реализуется тот тип гибридизации, который обеспечивает одновременное образование
максимального числа -связей.
3. Дельта-связь (-связь). Перекрывающиеся орбитали расположены в двух параллельных плоскостях,
перпендикулярных линии связи. -Связь может образоваться в результате перекрывания
xy
d
-орбиталей
взаимодействующих атомов, если линией связи является ось z (рис. 13,в); при этом между двумя атомами
возможно образование только одной -связи. Гибридные орбитали, а также чистые s- и р-орбитали -связей не
образуют.
Таким образом максимальная теоретически возможная кратность связи между двумя атомами равна
четырем (одна -, две - и одна -связь).
55
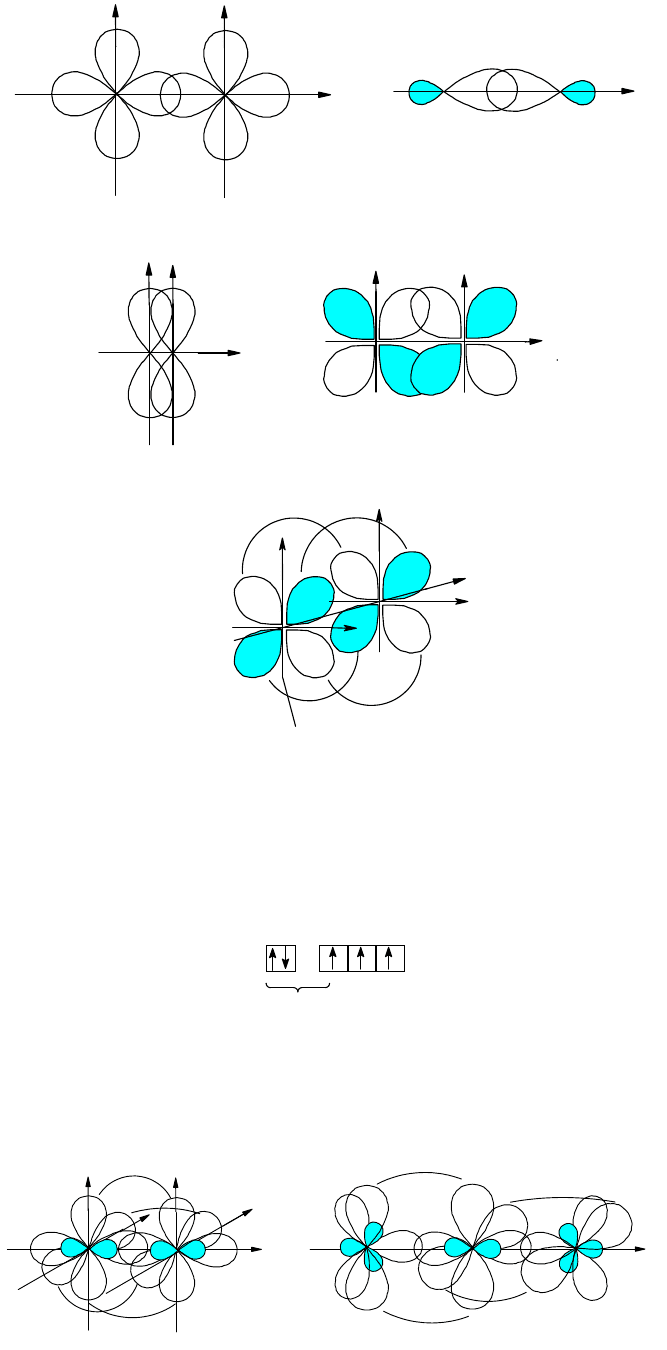
+ + + +
-
-
-
-
x
y
y
(d
x
2
-
y
2)
a
- (d
x
2
-
y
2)
b
+
+
-
-
(sp
x
)
a
- (sp
x
)
b
a)
+
+
-
-
(p
z
)
a
- (p
z
)
b
б)
+
+
+
+
-
-
-
-
(d
xz
)
a
- (d
xz
)
b
x
x
z z
z
z
x
+
+
+
+
-
-
-
-
z
(d
xy
)
a
- (d
xy
)
b
в)
x
x
y
y
Рис. 13. Перекрывание электронных орбиталей при образовании -(а), -(б) и -связей (в)
В качестве примера соединения с - и -связями можно привести молекулу азота N
2
. Атом азота, имеющий
электронную конфигурацию 1s
2
2s
2
2p
3
, характеризуется наличием на валентных энергетических подуровнях
электронной пары и трех неспаренных электронов. Наиболее выгодным типом гибридизации в данном случае
является sp-гибридизация, при которой сохраняются две "чистые" р-орбитали, обеспечивающие образование
двух -связей:
32
2p2s
N
sp-гибридизация
На двух sp-гибридных орбиталях каждого атома азота распределяются три электрона (электронная пара и
неспаренный электрон); электронные пары остаются неподеленными, а непарные электроны образуют -связь,
направленную по оси х. Неспаренные электроны образуют две -связи, ориентированные взаимно
перпендикулярно. Структура молекулы :NN: приведена на рис. 14,а.
x
a)
z
z
z
y
y
y
N
N
z
z
y
y
x
O
O
C
Рис. 14 Строение молекул азота(а) и диоксида углерода(б)
56
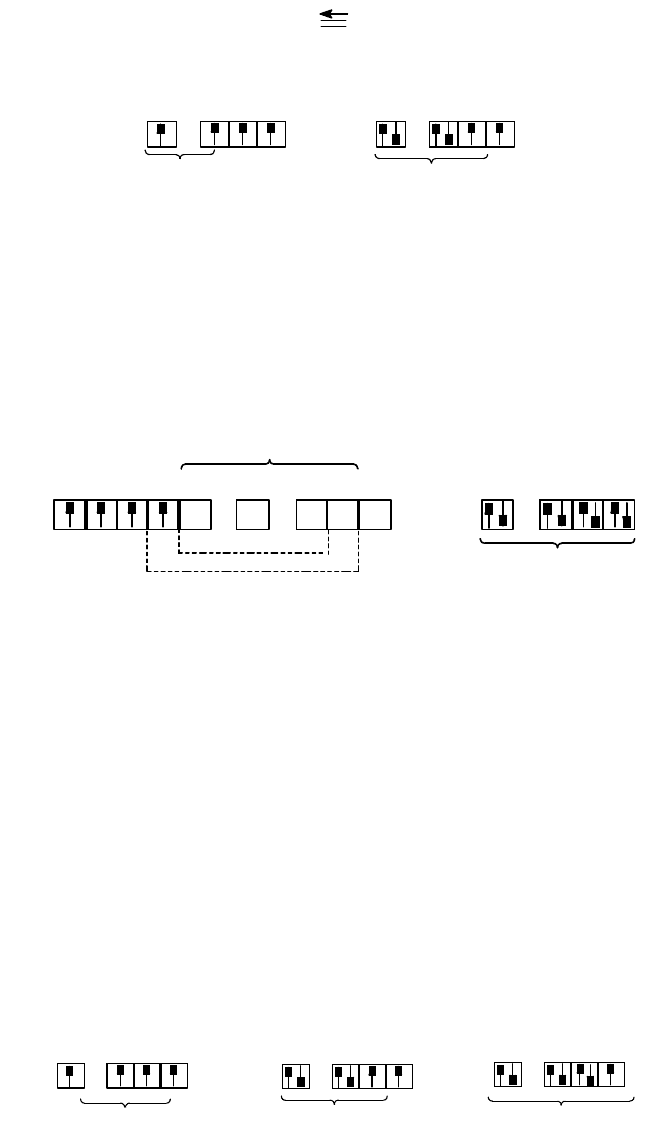
Аналогичную структуру имеет молекула оксида углерода(II), изоэлектронная молекуле азота. Однако в этой
молекуле одна из -связей образуется по донорно-акцепторному механизму за счет неподеленной пары
кислорода и вакантной орбитали углерода, что приводит к структуре
С О
:
:
При образовании молекулы диоксида углерода атомы углерода и кислорода подвергаются sp- и sp
2
-
гибридизации соответственно:
2
2p
2s
O
sp -
гибридизация
2p
2s
C
sp-гибридизация
В результате атом углерода образует по одной -связи и по одной -связи с каждым атомом кислорода.
Строение молекулы СО
2
показано на рис. 14,б. Заметим, что в рассматриваемой молекуле каждый атом
кислорода имеет по две неподеленные электронные пары на sp
2
-гибридах.
-Связь реализуется значительно реже, чем - и -связи. Примером соединения с -связью может служить
ион [Re
2
Cl
8
]
2-
. Соединения, содержащие этот ион можно получить восстановлением производных рения(VII)
фосфорноватистой кислотой, например,
2KReO
4
+ 2H
3
PO
2
+ 8HCl = K
2
[Re
2
Cl
8
] + 2H
3
PO
4
+ 4H
2
O
В ионе [Re
2
Cl
8
]
2-
рений имеет степень окисления +3, чему соответствует электронная конфигурация 5d
5
;
конфигурация иона Cl
-
- 3s
2
3p
6
. Распределение электронов по валентным орбиталям показано ниже:
2
2
y
x
x -y
d sp p -
гибридизация
z
2
z
5d
Re
3
3p
3s
Cl
-
sp -
гибридизация
2p
2s
d p -гибридизация
При образовании [Re
2
Cl
8
]
2-
атом рения подвергается двум типам гибридизации. Орбитали
d
x y
2 2
, s, p
x
и p
y
каждого атома гибридизуются по схеме dsp
2
, образуя четыре гибридные орбитали, лежащие в одной плоскости;
эти орбитали вакантны и образуют с ионами хлора -связи по донорно-акцепторному механизму. Орбитали
d
z
2
и p
z
образуют два dp-гибрида, ориентированные линейно по оси z, на которой лежат ядра атомов рения. У
каждого атома рения одна dp-орбиталь остается вакантной, а вторая идет на образование -связи между
атомами рения, направленной по оси z. Оставшиеся у атома рения три "чистые" d-орбитали, занятые
неспаренными электронами, позволяют образовать между атомами рения две -связи (за счет d
xz
и d
yz
-
орбиталей) и одну -связь (за счет d
xy
-орбитали).
5.2.5. Делокализованные многоцентровые связи.
Теория резонанса.
Используя концепцию двухэлектронных локализованных связей, можно построить структурные формулы
большинства ковалентных соединений. Однако полученный результат не всегда достаточно хорошо согласуется
с экспериментальными данными для соответствующих частиц, в связи с чем представление о связях,
соединяющих два атома пришлось дополнить представлениям о связях, объединяющих три, четыре и более
атомов. Подобные связи получили название делокализованных многоцентровых связей.
Рассмотрим вопрос об образовании многоцентровых связей на примере строения карбонат-аниона. Ион
СО
3
2-
формально можно представить как результат соединения атома углерода, атома кислорода и двух
однозарядных анионов кислорода, распределение электронов в которых показано ниже:
3
2p
2s
O
-
sp -гибридизация
2
sp -гибридизация
C
2s
2p
sp -гибридизация
O
2s
2p
2
Определим строение карбонат-аниона, используя представление о локализованных двухцентровых связях.
Для этого необходимо предположить, что атомы углерода и кислорода, не несущие заряда, подвергаются sp
2
-
гибридизации, что позволяет им соединиться двойной связью; ионы О
-
в состоянии sp
3
-гибридизации образуют с
углеродом лишь по одной -связи. В результате ион СО
3
2-
должен иметь форму равнобедренного треугольника,
поскольку в образовавшейся частице двойная связь короче одинарных. В действительности же ион СО
3
2-
имеет
форму равностороннего треугольника. Причиной наблюдаемого противоречия является произвольный выбор
атома кислорода, присоединенного двойной связью. Действительно, иону СО
3
2-
отвечают три равноценные
формы:
57
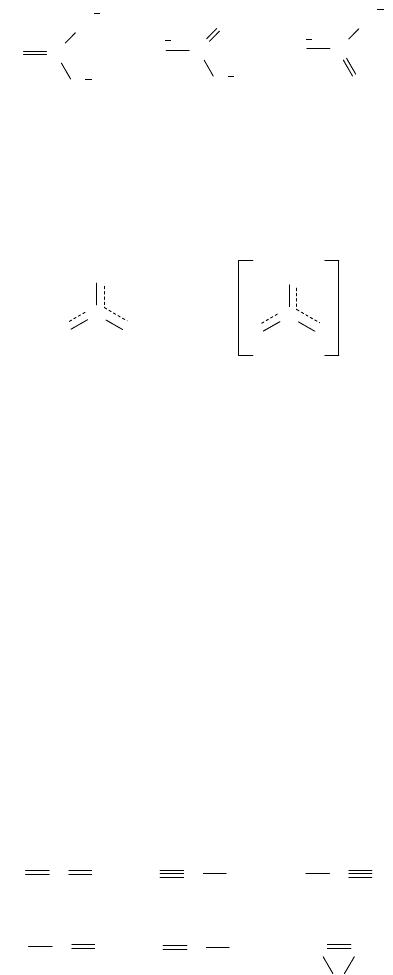
O С
O
O
O С
O
O
O С
O
O
Подобные формы принято называть каноническими. Картина, отвечающая истинному строению иона СО
3
2-
не соответствует ни одной из этих структур; согласующийся с экспериментальными данными результат можно
получить, если предположить, что в карбонат-ионе происходит одновременное перекрывание четырех p
z
-
орбиталей (если частица расположена в плоскости ху) всех атомов кислорода и атома углерода, приводящее к
образованию четырехцентровой -связи, охватывающей всю частицу. Делокализованную -связь обозначают
пунктиром. Одновременно происходит делокализация отрицательного заряда на все атомы кислорода, в
результате чего строение СО
3
2-
выражается следующей формулой :
О
С
О О
-2/3
-2/3 -2/3
О
С
О О
2-
Теория многоцентровых связей была разработана Л.Полингом и получила название теории резонанса.
Пусть частице отвечают канонические формы I, II и III, отличающиеся распределением одинарных, двойных
и тройных связей, а также зарядов на атомах; эти канонические формы описываются волновыми функциями
I
,
II
и
III
, энергии которых составляют Е
I
, E
II
и E
III
. Методами квантовой механики можно доказать, что энергии
Е
I
, E
II
и E
III
будут всегда больше, чем энергия состояния, волновая функция которого является линейной
комбинацией волновых функций
I
,
II
и
III
.
' = с
1
I
+ c
2
II
+ c
3
III
(5-10)
Выше отмечалось, что волновая функция тем лучше описывает систему, чем меньше соответствующая ей
энергия. В силу этого функции ' следует отдать предпочтение сравнительно с волновыми функциями
отдельных канонических форм. Наложение отвечающих им структур получило название резонанса. Волновую
функцию, описывающую резонансную структуру, называют резонансно-гибридной, а разность энергий между
энергиями форм I-III и энергией резонансно-гибридной функции - энергией резонанса. Чем больше энергия
резонанса для той или иной канонической формы, тем больший вклад вносит волновая функция этой формы в
уравнение резонансно-гибридной волновой функции (5-10).
Существует несколько правил, позволяющих выбрать канонические формы, вносящие значительный вклад в
резонансно-гибридную функцию.
1. Положение ядер во всех канонических формах должно быть одинаковым. Изомеры, в том числе и
таутомеры, не являются каноническими формами.
2. Канонические формы должны иметь максимальное число связей.
3. В канонических формах не должны соседствовать атомы с одноименными зарядами.
4. Канонические формы должны иметь одинаковое число неспаренных электронов (при наличии последних).
Так, например, для молекулы оксонитрида азота N
2
O можно записать шесть канонических форм:
N N O
-
+
:
:
.
.
. .
(I)
N N O
-
+
:
. .
(II)
.
.
.
.
:
N N O
+
:
..
..
(III)
2-
+
N N O
:
:
. .
. .
(IV)
N N O
+
:
. .
(V)
.
.
:
N N
O
(VI)
.
. - . .
:
:
..
.
.
..
Однако реальный вклад в гибридно-резонансную функцию будут вносить только формы I и II; форма III
запрещена правилом 3, формы IV и V - правилом 2, форма IV - правилом 1.
Основной вывод к которому приводит теория резонанса, может быть сформулирован следующим образом :
реальная структура частицы является наложением структур ее канонических форм.
5.2.6. Предсказание геометрической формы молекул.
Представления о направленности связи и теория гибридизации электронных орбиталей позволяют
объяснить геометрическую форму молекул веществ с ковалентными связями, но не предсказать ее.
Теоретический расчет геометрической конфигурации частицы квантово-механическими методами представляет
собой очень сложную и не всегда имеющую однозначное решение задачу. Однако существует довольно простой
прием, позволяющий с достаточно высокой надежностью качественно оценить геометрию молекул. Этот прием
был разработан Р.Гиллеспи и получил название теории отталкивания электронных пар валентной оболочки, так
как связывает форму частицы с силами отталкивания, действующими между электронными парами,
сформированными при образовании соответствующей молекулы. Чтобы определить геометрическую форму
молекулы по методу Гиллеспи, необходимо знать электронные конфигурации атомов, порядок соединения этих
атомов в молекуле, число - и -связей в образовавшейся частице. Теория Гиллеспи особо результативна для
молекул, образованных s- и р-элементами.
58
Теория отталкивания электронных пар валентной оболочки может быть сведена к следующим основным
положениям:
1. На геометрическую форму молекулы основное влияние оказывает число электронных пар валентной
оболочки (ЭПВО), к которым относятся электронные пары, образующие -связи и остающиеся неподеленными;
ЭПВО обычно занимают гибридные орбитали. Электронные пары, образующие -связи, занимают "чистые"
атомные орбитали и не влияют принципиально на геометрию молекул. Чтобы узнать число ЭПВО для того или
иного атома необходимо сложить число валентных электронов данного атома с числом электронов,
предоставленных присоединенными атомами для образования связей, а затем из полученной суммы вычесть
число электронов, пошедших на образование -связей, которое равно удвоенному числу -связей, и разделить
полученный результат на два. Так, например, в случае молекулы СО
2
, имеющей две - и две -связи, каждый
атом кислорода предоставляет по два электрона на образование связей с атомом углерода, а атом углерода
предоставляет по два электрона на образование связей с каждым атомом кислорода. Соответственно число
ЭПВО для атома углерода равно
2 =
2
22 - 22 + 4
= (С)N
ЭПВО
а для атома кислорода
3 =
2
12 - 12 + 6
= (O)N
ЭПВО
Число связывающих ЭПВО (n
C
) равно числу -связей, образуемых рассматриваемым атомом (n
); разность
n
Н
= N
ЭПВО
- n
равна числу неподеленных ЭПВО.
2. Поведение электронных пар валентной оболочки аналогично поведению точечных одноименных зарядов
на поверхности сферы: электронные пары ориентируются так, чтобы отталкивание между ними, а следовательно
и энергия системы, были минимальны. Это положение позволяет определить тип гибридизации, характерный
для того или иного числа ЭВПО.
Пусть валентная оболочка атома в молекуле включает две электронные пары. Два одноименных точечных
заряда, оказавшись на поверхности сферы, расположатся на концах диметра большого круга; соответственно
две ЭПВО должны занять орбитали, обеспечивающие валентный угол 180. Отсюда можно заключить, что в
случае двух ЭПВО атом подвергается sp-гибридизации (например, атом углерода в молекуле СО
2
).
С помощью несложных расчетов можно показать, что максимальному удалению и минимальному
отталкиванию трех ЭПВО будет отвечать ориентация орбиталей от центра к вершинам равностороннего
треугольника, лежащего в плоскости большого круга, т.е. sp
2
-гибридизация. Четырем ЭПВО соответствует
тетраэдрическая конфигурация (sp
3
-гибридизация). В случае пяти ЭПВО наиболее выгодным является
распределение электронных пар по орбиталям, направленным к вершинам тригональной бипирамиды (sp
3
d-
гибридизация). Шести ЭПВО соответствует октаэдрическая конфигурация, обеспечиваемая sp
3
d
2
-гибридизацией.
Если на валентной оболочке находится более шести электронных пар, вопрос о конфигурации не может быть
решен однозначно. Так семи ЭПВО с равной вероятностью могут отвечать три формы координационного
многогранника: пентагональная бипирамида, октаэдр с дополнительной вершиной над одной из граней и
тригональная призма с дополнительной вершиной над боковой гранью.
3. Неподеленные электронные пары, сосредоточенные возле одного атома занимают больший объем
околоядерного пространства, чем связывающие электронные пары, распределенные между двумя атомами. В
результате наибольшее отталкивание имеет место между двумя неподеленными парами, наименьшее - между
двумя связывающими парами. Следствием неэквивалентности неподеленных и связывающих электронных пар
является искажение валентных углов.
4. Форма молекулы определяется соотношением связывающих и неподеленных ЭПВО. Если центральный
атом, для которого устанавливается тип гибридизации, не имеет неподеленных пар, форма молекулы
определяется только типом гибридизации этого атома. При наличии неподеленных пар, занимающих гибридные
орбитали, форма координационного многогранника изменяется в зависимости от числа неподеленных пар.
Идеальные геометрические формы, отвечающие различным значениям числа ЭПВО и неподеленных
электронных пар (n
H
), приведены в табл. 11. В табл. 11 включены также примеры молекул той или иной формы; в
скобках указан атом, для которого определяется тип гибридизации.
Как следует из табл. 11, в случае двух ЭПВО возможно образование только линейных молекул. Для трех
ЭПВО молекулы могут быть треугольными (n
H
= 0), угловыми (n
H
= 1) и линейными (n
H
=2). Наличие в валентной
оболочке четырех электронных пар допускает образование тетраэдрических (n
H
= O), тригонально-
пирамидальных (n
H
= 1), угловых (n
H
= 2) и линейных (n
H
= 3) молекул.
Если число ЭПВО равно пяти и все пары являются связывающими, молекула имеет форму тригональной
бипирамиды. При наличии неподеленных ЭПВО для определения геометрии молекулы необходимо знать, какие
орбитали, аксиальные или экваториальные, занимают неподеленные электронные пары. Расчет показывает, что
более выгодным является экваториальное положение; действительно, занимающие экваториальное положение
неподеленные пары имеют только двух ближайших соседей под углом 90 , тогда как при аксиальном положении
таких соседей было бы три, что привело бы к более сильному отталкиванию. В результате молекула с одной
неподеленной парой имеет форму бисфеноида, с двумя - Т-форму, а трем неподеленным парам соответствуют
линейные молекулы.
59
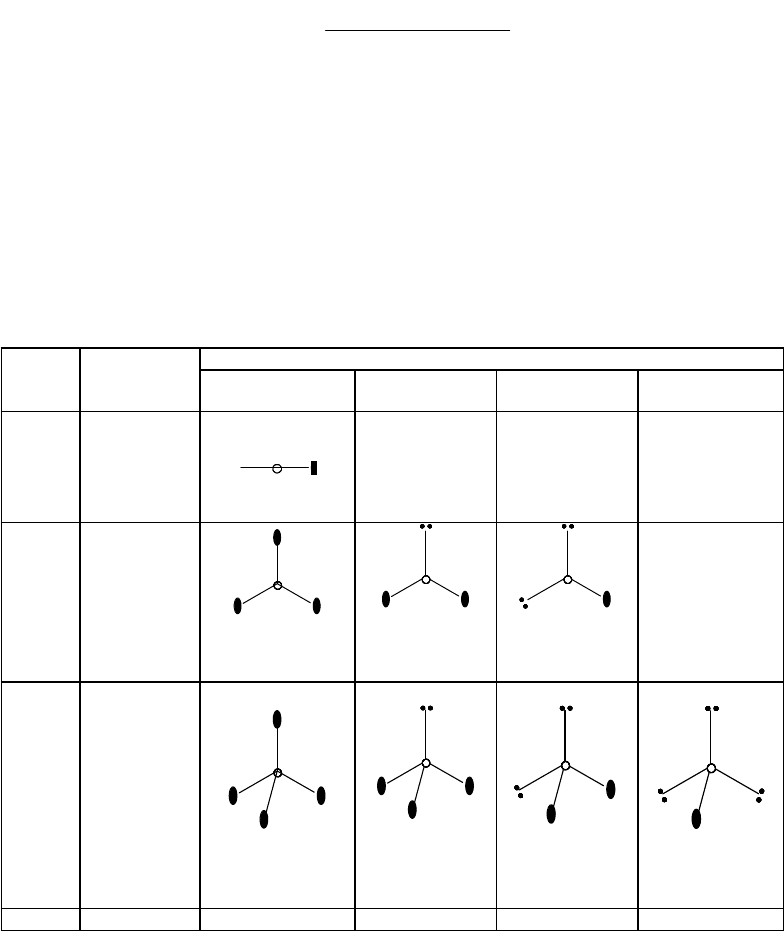
В случае шести ЭПВО неподеленные пары, стремясь к максимальному взаимному удалению, занимают в
октаэдре транс-положения друг относительно друга. В силу этого для шести ЭПВО реализуются следующие
формы молекул: октаэдр (n
H
= 0), тетрагональная пирамида (n
H
= 1), квадрат (n
H
= 2), Т-форма (n
H
= 3). Четырем и
пяти неподеленным парам должны отвечать линейные молекулы, однако обнаружить подобные соединения не
удалось.
Приведенные в табл. 11 геометрические формы молекул являются идеальными; в реальных же молекулах
возможны определенные искажения их геометрии. Рассмотрим причины, обуславливающие эти искажения.
1. Наличие в молекуле неподеленных электронных пар. В соответствии с третьим положением теории
Гиллеспи наличие неподеленных пар приводит к сжатию валентных углов в молекулах. Так, например, в
идеальном случае валентные углы молекулы SF
4
(N
ЭПВО
= 5, n
H
= 1) равнялись бы 180 (F
акс
SF
акс
), 120
(F
экв
SF
экв
) и 90 (F
акс
SF
экв
); в действительности соответствующие углы равны 173,1 , 101,5 и 87,8. Искажение
валентных углов тем сильнее, чем ниже в соответствующей подгруппе находится данный элемент.
2. Наличие в молекуле двойных и тройных связей. Двойные и тройные связи короче одинарных и занимают
больший объем у центрального атома, что приводит к сжатию валентных углов между парами, образующими
одинарную связь. Так для молекулы COCl
2
, в которой атом кислорода образует с углеродом двойную связь, а
атомы хлора - одинарные, числа ЭПВО и неподеленных пар составляют
3 =
2
21 - 12 + 21 + 4
=N
ЭПВО
n
H
= 3 - 3 = 0
В соответствии с табл. 11 молекула COCl
2
должна иметь форму равностороннего треугольника с валентными
углами, равными 120. В действительности же эта молекула имеет форму равнобедренного треугольника (d
C=O
=
117 пм, d
C-Cl
= 175 пм,
ClCO
= 124 ,
СlCCl
= 111 ).
3. Неравноценность присоединенных атомов. Если присоединенные атомы имеют различные радиусы, то и
длины связей, и валентные углы в образовавшейся молекуле не будут одинаковы. Так, для молекулы CCl
4
и
CHCl
3
число ЭПВО и неподеленных пар одинаково (N
ЭПВО
= 4, n
Н
= 0). Однако молекула тетрахлорида углерода
имеет форму правильного тетраэдра (dC-Cl = 176 пм, ClCCl = 109,5 ), а молекула хлороформа является
искаженным тетраэдром (d
C-Cl
=176 пм, d
C-H
= 110 пм, ClCCl = 111,3 , HCCl = 107,5).
Таблица 12.
Типы молекул, отвечающие различным числам связывающих и неподеленных
электронных пар
Число
ЭПВО
Тип гибри-
дизации
Число неподеленных пар
0 1 2 3
2 sp
Ч
:
линейная
BeF
2
(Be)
линейная
AlF (Al)
3 sp
2
÷
÷ ÷
треугольник
BF
3
(B)
÷ ÷
угловая
SnCl
2
(Sn)
÷
линейная
NH (N)
4 sp
3
÷
÷
÷
÷
тетраэдр
CF
4
(C)
÷
÷
÷
тригональная
пирамида
NH
3
(N)
÷
÷
угловая
Н
2
О (О)
÷
линейная
IF (I)
5 sp
3
d
60
