Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.

потенциал
электрода
дол){(ен
стать
отрицательнее
|1а 0,\2
в,
для
чего
ему
ну}кно
сообщить
ок.ол9
2
ркцл
на
см2
(если
ститать
емкость
д{ойного
сло1
равной
18рР
на см2).
Ёсли
бь:
дах<е
веёь поляризационнь1а
тБй
Ф-;-а|;;;,
тратился
только
на
зарях<ение
поверхности'
то потребовалось
бьт
2#у
сек.,
т. е.
около
30 минут,
чтобь:
установилось
новое
значение
потенциала.
1аким
образом,
бо}ьгпая
величина
емкости
двойнослойного
конденсатора
осло)княет
поляризационн^ь_[е
и3мерения
при
крайне
низких
плотностях
тока
(например,
!0_10
а/:м").
|-!о
указаннь!м
причинам
изучение
области
ни3ких
перенапря>кений
на
металлах
с
вь|соким
значением
константь1
с
сопрях<ено
с больтлими
экспериментальнь1ми
трудностями.
||ростоесоотно1|-|ение(136),
?
-
!,2
установленное
1афелем
на
ос-
\60лоп
новании
недостаточно
точного
',
] *{
;::";,ъч:};;Ё#':'#т'|;3-
-|
{г
верено
для
ряда
металлов
в
031
//*/
очень
1широком
интервале
! //
плотностей
тока.
Ёапример,
1
-/
мо)кно
с
уверенностьюсйазать,
0''1
-{'
что
для
ртутного
электрода
1 /
оно
оправдь|вается
в интерва-
',1
/
ле плотностей
тока
от 10_7
до
|
а/см2
с постояннь1ми
3наче-
|
н||ямикоэффициентоваи
6; с
несколько
мень1пей
увв
я
'7
-6
-'
-ч
\!-!1снэ
3{#1##,#у";,#|,]{3,
3#!;'"',..Р":"-ъ;:}";;Ё-;:!:ът''}Ё;##,"'.]-";
плотностей
тока
.
1
|00
а/см2
{4'16].
1аким
образом,
мо}кно
и3менять
плотность
тока
или
скорость
реакции
в
миллионьт
|тл|т
да)|{е
в миллиардь1
ра3
и при
этом
сохранить
одну
и ту )<е
количественную
3ависимость.
Б
{имической
кинетике
нет
-другого
примера'
в
котором
уравнение
скорости
реакции
сохранялос^ь
бь:
в таком
1пироком
интервале
изменения
самой
вёличины
скорости.
Фбь:чно
в таких
сйуваях'в
3ависимости
от
условий
изменяется
механизм
реакции'
а
следовательно'
изменяются
и 3аконом"р"'""'.
Ё
этом
отно1|]ении
уравнение
(136)
является
замечательнь1м
посвоей
простоте
и по^1пирине
интервала
скоростей,
для
которого
оно
применимо.
(-ущес_твуют'
однако'
электродь1'
для
которь1х
в
некотором
интервале
плотностй
тока
получается
более
сложная
зависимост,.
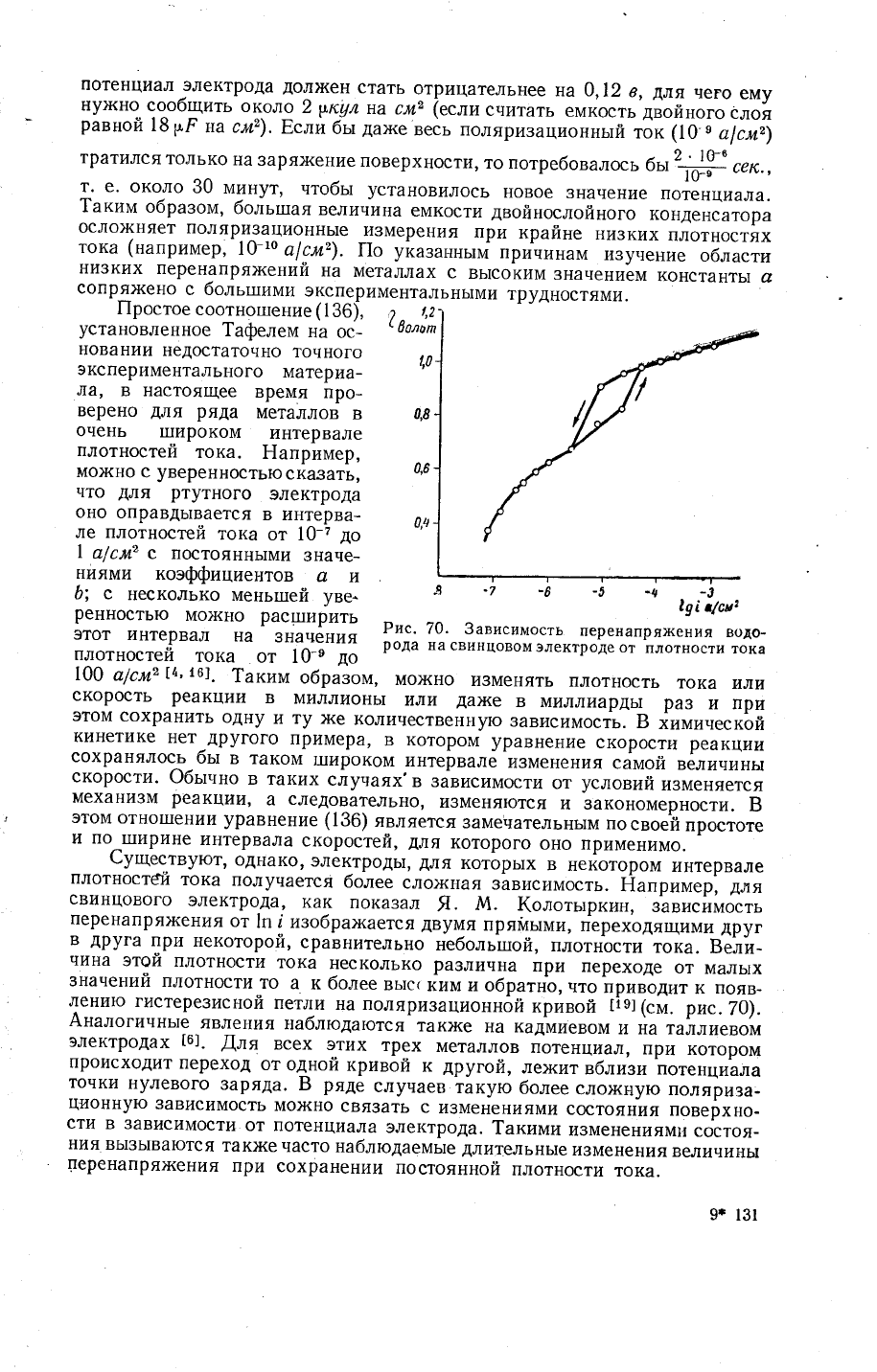
Ё,,рйй.р;_;;;
свинцового
электрода'
как
показал
я.
м.
1(олоть;ркин,
зависимость
перенапря)кения
от
1п ! изобрах<ается
двумя
пряйь:ми,
Ёереходящими
друг
в
друга
при
некоторой,
сравнительно
небольгшой,
плотности
тока.
3елй-
чина
этой
плотности
тока
несколько
различна
при
переходе
от
маль|х
значений
плотности-то
а
к более
вьтсс
кими обратнБ,
н'о}р','дит
к появ-
*:нию
гистере3исной
петли
на поляризационной
кривой
|]9](с'.
рис.70).
Аналогичнь|е
явления
наблюдаются
так}ке
на кадмиевом
и на таллиевом
электродах
|6].
длц
всех
э-тих
трех
металлов
потенц\4ал'
при
котором
происходит
переход
от
одной
кривой
к
другой,
ле'{ит
вблизи потенциала
точки
нулевого
заряда.
Б
ряде
случаев
такую
более
сло>кну}о
поляриза-
ционную
3ависимость
мо)<но
связать
с
изменениями
состояния
поверхно_
сти
в 3ависимости-от
потенциала
электрода.
[акими
и3менениям].|
состоя-
ния.
вь]зь|ваются
такх(е
часто
наблюдаемые
длительнь]е
изменения
величины
церенапря)кения
при
сохранении
постоянной
плотности
тока.
9* 131

Ёекоторь:ми
исследователями
вь1ска3ь]валось
утвер)кдение,
что
при
сильном
увеличении
плотности
тока
рост
перенапрях{ения
замедляется
и
что велич|4на
перенапря'{ения
стремится
к предельному
значению или
дах{е
начинает
сни)кат639
[201.
3ти
работьт
вь13ь1вают'
однако'
ряд
возра-
:кений,
и
реальность
описанного
явления
сомнительна.
так,
чтмь! избе)кать
необходимости
внесения
поправки
на омическое
падение
потенциала
в
ра_
створе'
авторь1
эти
и3меряли
спад
потенциала
после
ра3мь1кания
тока
и экстраполировали
значения
потенциала
Р1а момент
размь1кания.
как
у)ке
бьтло
упомянуто,
при
больтших
плотностях
тока
такая
экстраполяция
лег_
;;;;;";;"{
'
',ц'о.'м.
!,ля
случая
ртутного
электрода
бь:ло
показ&ЁФ
[3],
что
;ри
правильном
учете
зависимости
потенциала
отвремени'
протек1пего
после
ра3мь]кания
тока
(см.
ни>ке),
ре3ультать]'
полученнь1е
по описанному
методу,
подтвер}кдают
применимость
уравнения
1афеля
и
в
области вь1со-
ких
плотностей
тока.
Б
некоторьтх
случаях
аномальнь1е
зависимости
перенапрях{ения
от
плотности
тока
наблтодаются
при наличии
3агрязнений,
пони}(а1ощих
пере'-
напря)кение
на
катоде'
если
последние
адсорбиру1отся
ли1пь
при
сильной
кат6дной
поляризаци1
[2т1.
Б
ряде
работ
опись1валось
приблих{ение
тока
при вь1делении
водорода
к
предельному
значени1о
по мере
увеличения
катодной
поляризации.
||ос|еднее
свяъано,
однако,
о6ь|чно
с
концентрационной'
а не
с
электро_
химической
поляризацией;
предельное
3начение
тока
в этих
случаях
удается
увеличить
усилением
переме1шивания.
во3мо)кность
приблих(ения
й
предельному
току
вь]деления
водорода'
обуслоЁленному
медленностью
электрохимического,
а
не
дифузионного
процесса,
в случае
\!-элект-
рода
в\нРстоящее
время
все
}ке
не мо)кет
бь]ть
окончательно
отверг-
нута
|16!.
"
Беличина
водородного
перенапрях{ения
в
сильной
степени
зависит
от температурь|'
а именно__с
повь11пением
температурь1
величина
пере-
напря}кения'
какправило'
сни)кается.
!,ля
металлов
с
вь1соким
перенапря-
}1(ением,
как
ртуть'
свинец
и
др.,
величина
температурного
коэффициента
перенапря)кения
при
средних
плотностях
тока
составляет
примерно
2-14
мв-на
градус.
Ёаклон
кривь1х
зависимости
1
от
19|, т. е.
константа
6
в
уравнении
(136)
увеличивается
с
ростом
температур-ь|'
в
первом
прибли>кении
про;орционально^
1бсолютной
температуре'
Аначе говоря'
постоянная
@
в
уравнении
(]36б) практически
не
3ависит
от'температурь|'
Аля
температурньго
коффициента
перенапрпкения
мь1
получаем
'по'
этому
вь|ра)кение
(#),
:$+4:';
(13в)
ёа
]ак
как#<о,
то температурнь1й
коэффициент
перенапрях<ения
по
своей
абсолтотной
величине
большле
при
маль!х
плотностях
тока и мень1пе
при
вь1соких
плотностях
тока,
как это
видно
из
рис.
7\,
на
котором
изобра-
х(ень1
кривь1е
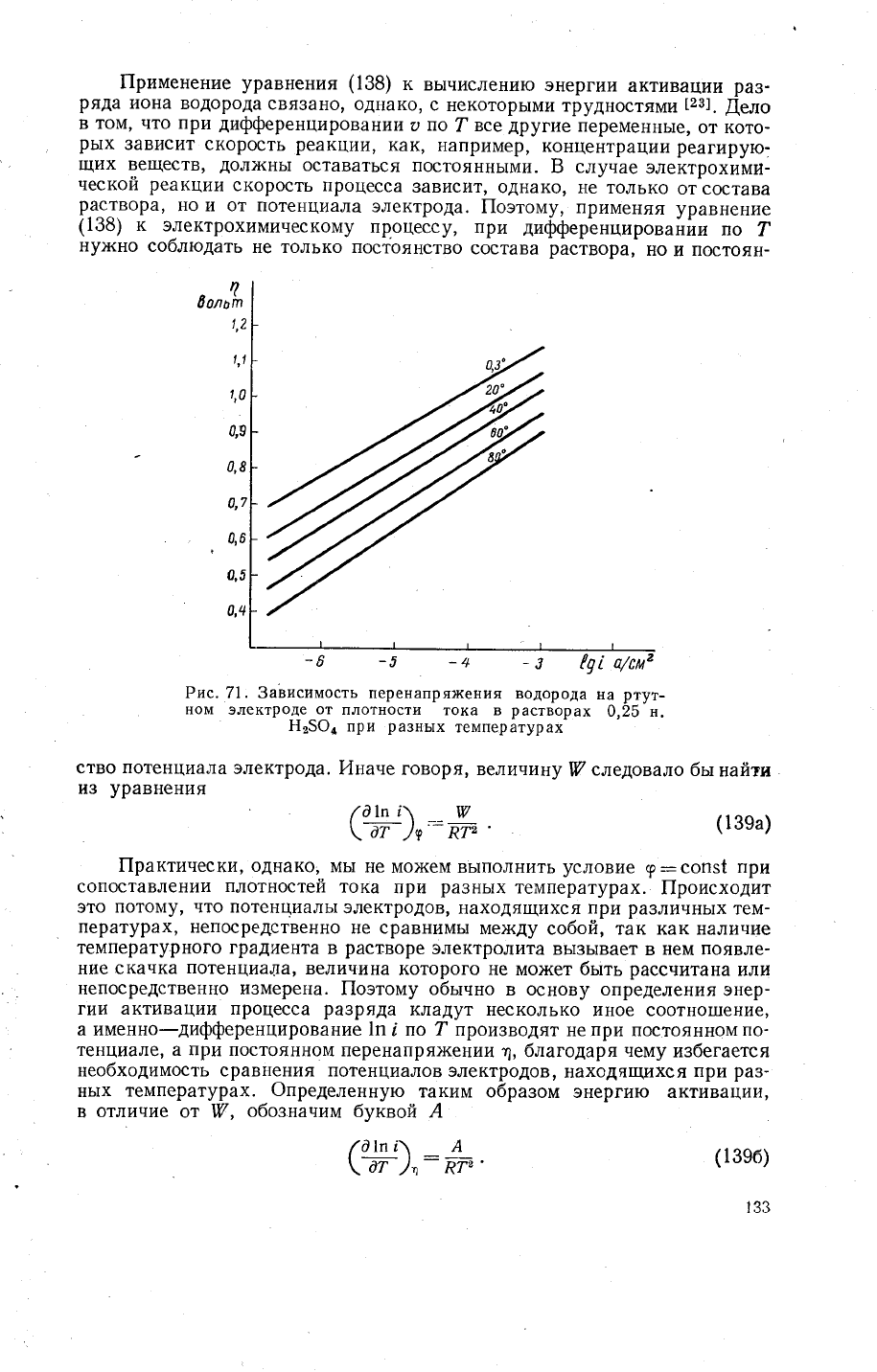
водородного
перенапря)кения
н^а
рц:н9у^эле_к_троде^Р
рас_
;;;'ъ
о|Б
".
н'5б;
при темпёратуЁах
0,3,,
20', 40',
60"
и в0о
с
!22]'
_
€ни>кение
величинь1
водородного
перенапрях{ения
с
повь|1шением
тем-
пературь|
ука3ь1вает
на
ускорение
реайции
разряда
иона
водорода'-Аз
3ависимости
скорости
реакции
от температурь|'
как
известно,
п'1о}кет
быть
определена
величина
энергии
активац14и-
реакции.
(-оотно1пение
у9кду
тейпературнь1м
коэффициентом
скорости
реакции
о
и энергиеи
актива_
1\ии у вь|ра)кается
уравнением
Аррениуса
ё|по
у
ат
-ю'
132
(130)
||рименение
уравнения
(138)
к
вь1числению
энергии
активации
ра3-
ряда
иона
водорода
свя3ано'
однако'
с
некоторь|ми
трудностями
!23].
дело
в
том' что при
дифференшировании
о
по
[
все
другие
переменные'
от кото_
рь1х
зависит
скорость
реакции'
как'
например'
концентрации
реагирую_
щих
веществ'
долх{нь1
оставаться
постояннь1ми.
Б слунае
электрохими-
ческой
реакции
скорость процесса
завт4сит,
однако'
не только
от состава
ра_створа'
но и от потенциала
электрода.
|[оэтому, применяя
уравнение
(133)
к
электрохимическому
пРоцессу, при
диф6ерёншировайии
по
7
ну'<но
соблюдать
не только постоянство
состава
раствора'
но
и
постоян-
величину
||
следовало
бынайтн
(139а)
в,',|,,
',
1,1
-6
-5
_4
-3 {9|'а/см2
Рие' 7\ 3а!исимость перенапря'кения
водорода
на
ртут-
ном
электроде
от
плотности
тока в
растворах
0'25 н.
Ё25Ф*
при
разнь|х
температурах
ство
потенциала
электрода.
Анане
говоря'
и3
уравнения
/01п
!\
у
\ттг /я
==
&,
||рактинески' однако;
мь1
не
мох{ем вь1полнить
условие
?:
соп5{
при
сопоставлении
плотностей
тока
при
ра3нь1х
температурах.
|1ро|1сходит
это
потому' что потент\иаль1
электродов'
находящихся
при
различньтх
тем-
пературах' непосредственно
не сравнимы
ме}<ду
собой, так как наличие
температурного градиента
в
растворе
электролита
вь13ь]вает
в
нем появле-
ние скачка
потенциада'
величина
которого не мо)кет бьтть
рассну|тана
у|л|1
непосредственно и3мерена.
|{оэтому обьтчно
в основу определения
энер-
гути акт|4вации процесса
ра3ряда
кладут несколько
иное соотно1пение'
а именно-дифференширование 1п
!
по 7 производят
не
при
постоянном
по-
тенциале' а
при
постоянном
перенапря)кении
1'
благодаря
нему
избегается
необходимость
сравнения потенциалов
электродов,
находящихся
при
раз_
ньтх
температурах.
Фпределенну}о
таким образом
энерги}о активации,
в
отличие
от $(,
обоз'начим
буквой
А
(139б)
|33
1'0
0,9
0,8
0,7
0,6
0,5
0'ц
/0 1п|\ А
\_ат- ),-
РФ

(ак
показал
1емкин
(23],
ме}{ду
|/
и А
существует
следующая
простая
зависимость
|(:'А*ац,
где
{-количество
тепла'
поглощаемое
при
образовании
1
грамм-экви_
валента
ионов
водорода
из
газообра3ного
молекулярного
водорода
при
рав-
новесном
потенциале
Р,еличина А
(как
и
|Р)
зависит
от
т].
Аействительно'
как легко
вы_
вести и3
уравнения
(136б)'
А:
Ао-в.Рт1'
( 140)
где .А'_величина
А
лри
Ё€1 величина
А,
равна
2!
этой
величинь:.
1:0.
|1о
наиболее
точнь]м
даннь1м для
0, 1
н.
700 кал.
Ёи>ке будет
уточне1{
физинеский
смь1сл
$
4.
ток оБмвнА
Ёаличие
двух
разнь]х
кинетических
закономерностей
для
процесса
вь1деления
водорода
при вь1соких
и
при низких
значениях
перенапря>ке_
ния
не
дол>кно
бьтть истолковано
как
ре3ультат
существования
двух
ра3_
личнь1х
механизмов
этого
процесса.
Ёапротив,
легко
пока3ать'
что
появление
пропорциональности
ме}кду
перенапрях{ением
и
плотностью
тока
при ни3ких
перенапря)кениях
является
естественным
следствием
логарифмической
зависимост|\
лри вь|соких
плотностях тока.
Ёих<епри'
водимое
рассу)кдение
!{е
связано
с предполо>кением
о
правильности
како-
го-либо
определенного
механизма'
реакции.
Ао
сих
пор под
силой
(или плотностью)
анодного или
катодного
тока
мь1
всегда
лонимали
величину
тока'
текущего
во внетшней
шепи
(напри-
мер' от
источника
тока)
и
проходящего
через
рассматриваемьтй
эл_е_ктрод
Б
равновесном
состоянии
изйеряемьтй
внеп:ний
ток
равен
нулю.
1(ак
из-
вестно'
с молекулярно-кинетической
точки
зрения
с_остояние
равновесия'
однако,
нель3я
рассматривать
как состояние
покоя.
?[ех<ду
молеку_лярнь1м
водородом
и утонамт1
водорода
в
растворе
имеет
место
постояннь|й
обмен.
Ёекоторое
число молекул
переходит
в ионное
состояние'
отдавая электроду
'
электронь];
одновременно
с этим
эквивалентное
количество
ионов.!аз!я^
х(ается'
3ахвать1вая
изли!пние
электронь1.
|1од
величиной
тока обмена
!0
подра3умевают
количество
электричества'
участвующее
в единицу
вре-
мени в
такой
реакции
обмена.
Ёаличие
тока обмена
при
равновесном
потенциале
мо)кет
бь:ть
до-
казано
методом
мечень1х
атойов.
Бсли,
например'
погрузить
водородньтй
электрод
в
раствор'
содер)кащий
тя>келую воду,
но
нась|щеннь|й
обь:чньтм
водородом'
то
да>ке
при отсутствии
поляри3ац|1и
электрода
мо)л{но
дока-
3ать'через
некоторое
время
наличие
тя}келого
водорода-дейтерия-в
га-
зовой
ф1зе.
8ще более
наглядно
мо>кно обнарух{ить{ок
обмена
при пом.ощи
неустойнивого
и3отопа
водорода
с атомнь1м
весом
3-трития,
которьгй
яв-
ляется
радиоактивнь]м.
необходимо,
однако'
отметить'
что
при
количест'
венном
определении
тока обмена
таким
путем
ну)кно
учесть
ра3личие'
существующее
мех(ду
реакционной
способностью
ра3личнь1х
и3отопов.
}ак,
ток обмена
ме}кду
дейтерием
и ионом
)'
несколько
мень[пе
тока
обмена
ме)кду
водородом
и ионом
н*.
при по1|ризации
электрода
равновесие
нару1пается
и
числоо6разо-
вав1пихся
в единицу
времени
ионов
у)ке
не
равняется
числу
исче3нув1пих.
1(оличество
электринёства,
потребляемое
в единицу
времени
на
см2
поверхности
в
процессе
ра3ряда
водороднь]х
ионов,
назовем
плотностью
134

!
тока
разряда
и обозначим
чеРез
].
Аналогично определим
плотность тока
ионизацита
].
|1ри
катодной
поляри3ац|1и
электрода
величина
тока
разряда
пре-
вь!1пает величину
тока
иони3ац||и
на величину
поляризующего
катодного
тока
[у:т_т.
(141)
т
||о
мере
роста
тока
катодной
поляризации
величина
! возрастаец
напротив'
нет никаких
оснований предполо)кить
во3растание
величиньт
!.
|[ри
достаточно
сильной
поляризации мох{но'
следовательно'
пренебречь
з+
!
по сравнению
с
| и
при6ли>кенно
считать
!у
*
!.
Бнегшний. ток анодной поляризации
равен
избьттку
тока иони3ации
над
током
разряда:
+
+
]ь:|_!.
(1{1а)
€овертпенно
аналогично
при
достаточно
вьтсокой
анодной
поляри3а_
ции
мо)кно
приблих<енно считать
!д**!.
|{ри
равновесии
измеряемь]й внегпний
ток
равен
нулю'
и
ток
ра3ряда
по
величине
равен
току
иони3ации
й:й:1,'
где |о,
по
определению'-величина
тока обмена.
|.1зло>кенные
рань!пе
опьттнь]е
закономерности'
связывающие
пере_
напря)кение и
плотность
тока'
относились
к величине
непосредственно
и3меряемь|х
катодного
и анодного
токов' а
не
к величине
токов
разряда
|1л|1 ионизации.
|!ос кол ьку'
одна
ко,
лога
рифмичес
ка я
зависимость
наблю-
дается
в области
больш_тих поляри3аций, в
которой
величина
катодного
и анодного
токов
мо)кет
бьтть при6ли}кенно
приравнена
соответственно
величине
тока
разряда
||
тока
ионизац\4и,
то отсюда
мо)кно
заключить'
что
логарифминеская
зависимость характерна
ут
для
этих
токов.
}равнение
(136)
для
катодной
поляри3ации
поэтому мох(но
л||-
сать
в виде
1дк:ак*0к
(\42\
ак
(где
Ё,'
:'_ф),
а
для
анодной
поляри3аци14
.
?)А
'|!ь:а^+0ьА1
или
3:&'ёБ,
(143)
сА
--
(где
к"
:е
"Б\.
€делаем
единственное
допущение,
что
такая
логарифмическая
зави'
симость
для
токов
ра3ряда
и ионизат\ии'
сохраняющаяся в п:ирокой
обла-
сти потенциалов'
сохраняется
и
в
области,
6лизкой к
равновесному
потенциалу
водородного электрода.
1огда
для
катодного тока
при
маль1х
поляризациях мо)кно написать
1к
1)А
!к:т_7: ь'ей
_
п''е,'
Аз
условия
равновесия
|-=0
при
т]к:т]А:0 следует,.что
Р,'
:Ё"
-
!о.
[(роме
того'
по определению
перенапря'{ения'
согласно
уравнениям
(135)
1к
п7 пли
7=:Ё'ей,
(144)
135
и
(135а),
1к:
_1д.
}равнение
(144)
мо)кно'
таким образом,
переписать
в виде
!к 1к
!к: !о
("й
_
'_Б).
||ри
малой
поляри3ации
электрода,
когда величина перенапря>т<ения
мала
по
сравненито
с
6у и 6д,
[,1Ф)к}{Ф
разлох{ить
экспоненциальнь1е
члень|
уравнения
|А+а)
в
Ряд
и ограничиться
первь]ми
двумя
членами
разло_
х(ения
!у'---
]о
(145)
.'
^\
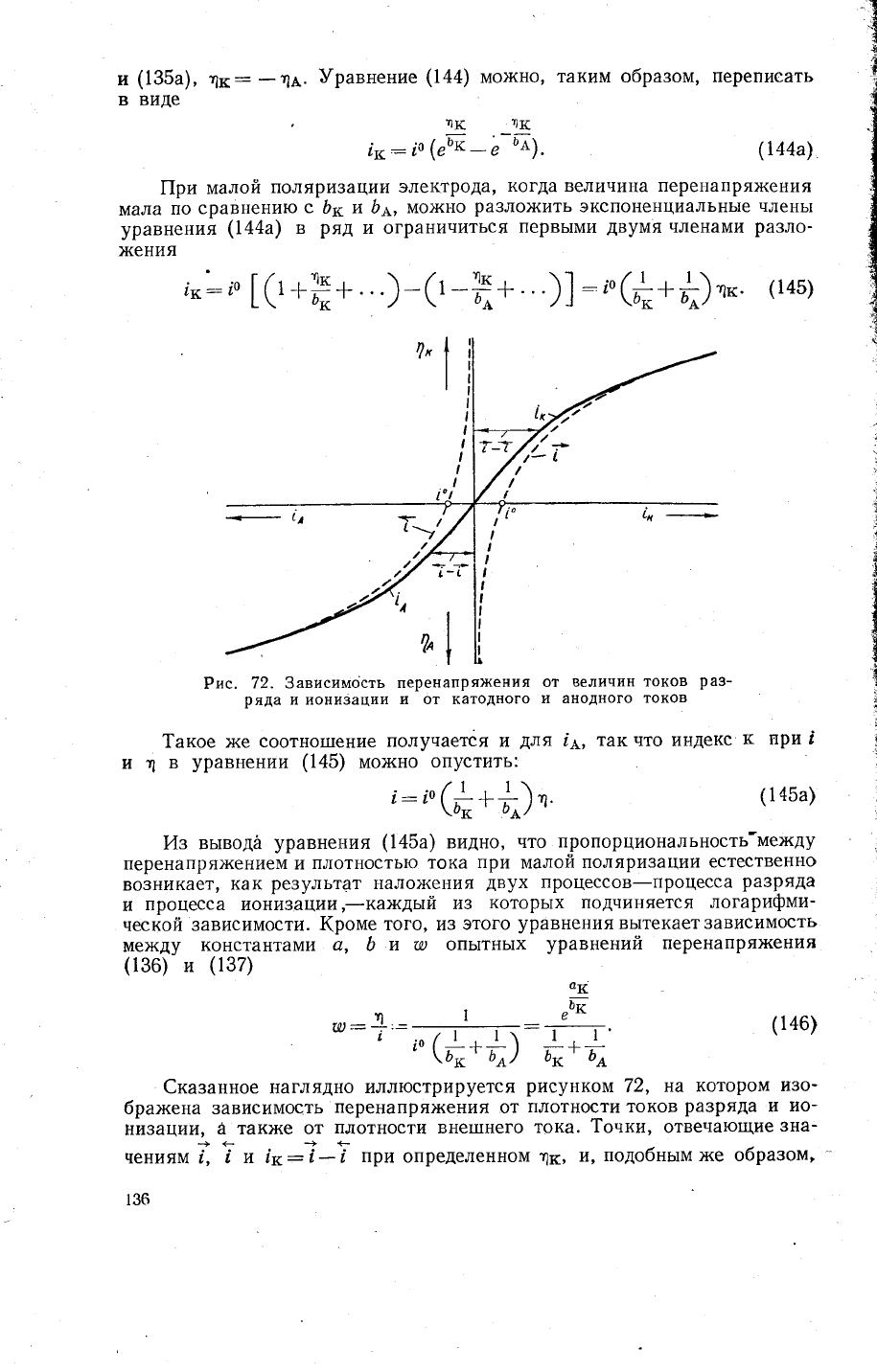
Рис.
72. 3ависимость
перенапря)кения
от
величин токов
раз-
ряда
|1 ионизации
и от катодного
и анодного
токов
1акое )ке
соотно1пение
получается и
для
!д,
так
что индекс
к
при
|
и
т]
в
уравцении
(145)
мо>кно
опустить:
[(,**+...)-('_*+
)]
:л(Б**),"
!.
/_
(++а|
(146)
т-'
,'/
':,(+**),
( 1
{5а)
йз
вьтводА
уравнения
(1{5а)
видно'
что
пропорциональность_мех<ду
перенапря)кением
и
плотностью
тока
при
малой
поляризации
естественно
во3никает'
как
результат
налох<ения
двух
процессов-процесса
разряда
и
процесса иони3ац\4|1,-ка>кдьтй
из
которьтх подчиняется
логарифми-
ческой 3ависимости.
1(роме того' из
этого
уравнения
вь1текает
зависимость
ме>кду
константами с' б
и ш опь1тнь]х
уравнений
перенапрях(ения
(136)
и
(137)
ок
-",-т)
_
|
,ф
щ'_|-';/т;5-[
''
"
(',.
*т;)
й+т;
€казанное наглядно иллюстрируется
рисунком
72, на
котором
и3о-
бра>кена 3ависимость
перенапря}кения
от
плотности токов
ра3ряда
|1
|\о-
!1изаци|4,
а так}ке от
плотности вне1пнего
тока.
1о9ки,
отвеча1ощие
3на_
+ё++
чениям
],
!
ут |к:1_|
при
определеннФ[
1к,
и,
подобньтмх<е образом,
136

точки' отвечающие 3начениям !,
'
и 1ь:!- !
при
определенном
т1д,
}1€11161
на
прямых' параллельнь|х
оси
абсцисс, проходящих
при соответ-
ствующих
3начениях
т1у
|1!1А
1/ь.
Аз
рис.
72
видно,
что вбли3и
равновес_
ного
потенциала
(т:0)
кривая,
построенная по абсол}отнь|м значениям
разностей
абсцисс логарифмических кривь1х' представляет
собой прямую'
проходящуто
через
начало координат;
при
увеличении
лоляри3а\ии
прямолинейность
нару1]]ается' и кривая
для
вне1пнего
тока все боль-
гпе приблих(ается
к
логарифмическим
кривь1м.
1очки
пересечения кривь|х
++
для
! и ]
с
осью абсцисс
(со
знанением перенапря)кения
1
:0)
дают
вели-
чину
тока обмена. 3 полулогарифмическом
мас1птаф эти
кривь]е
прини-
мают вид'
указанньтй
на
рис.
73. |[рп
этом способе
изобрах<ения
кривь1е
для
тока
разряда
|!
для
тока
ионизат\ии обладают прямолинейным
тече-
нием
во
всей
области
плотностей
тока.
(
Рис. 73. 3ависимость
перенапря)кения
от
логарифма
плот_
ности токов
,,.,*}',
#";#;;#.ъ 1'%"''.','фма
катод-
Ёапомним,
что и3
поляри3ационнь1х
измерений
мо>т<но
непосредствен-
но определить ли1пь кривь]е
3ависимости перенапря>кения
от вне1пнего
тока.
}}{з
р|4с'
73 вь]текает'
что
и3
поляризационнь1х измерений мох{но
кос-
веннь!м
путем
найти
ток
обмена' если экстраполировать
прямолинейнь|й
участок
кривой перенапря)кения (в
полулогарифмитеской си€т€й€ кФФ!:
дипат) до
значения перенапря)кения'
равного
нулю*.
$
5. влиянив
состАвА
РАств0РА
нА
ввличину
п вРв нА
пР
яжЁ\1ия
водоРодА
Больтпое
значение
для
вь]яснения механизма
электрохиминеской
реак-
ции
катодного
выделения водорода
и
для
определения
причин возникно-
вения
перенапрях{ения
имеет
исследование
вл||яния состава
раствора
на
ве_
личину перенапря}кения. Б
зарубех<ной
электрохимической литературе
*
Б следующих параграфах'
в
которых булут
рассматриваться
опытные
данные
главнь|м
образом
катодной
реакции
выделения
водорода (а
йе
анодной
реакт1ии
иони_
зации водорода),
мы
опустим
в
тех местах' где
это не мо)кет вь|звать недоразумения'
индекс
1(
в вьтра:кен|1ях
для
катодного
перенапря)кения
т]к'
для
констант
а*
п
0*
и
для
катодного
тока
'к
(,
без индекса
с отрицательным
знаком буАет
соответствовать
в
этом
случае анодному току).
-Р
!
8ольп|
\37
этот
вопрос
неоднократно
рассматривался'
но не бьтл
правильно
ре|шен.
Б
больтшинстве
старь1х
работ,
в обзорах и
унебниках
прочно
укоренилось
представление
о
не3ависимости
величинь| перенапря}{(ения
от
состава
раствора
и,
в частности'
от
концентрации водороднь|х ионов
или
р\1
раствора.
Б
действительности'
однако, как это вь1текает
из иследований
чегпского
ученого
[ерасименк6
[63!
ц, особенно, из
работ
советских авторов'
состав
раствора
оказь|вает
сильное
влияние на кинетику
вь|деления
водорода
и
на величину
перенапря)кения.
Б
рамках
данного
курса
нет
возмо)кности
привести
полностью весь
экспериментальнь:й материал;
остановимся
ли1пь
на нескольких
ва)кнь!х
случаях.
Б не
очень
концентрированнь1х
растворах
сильнь1х
кислот' не содер_
>кащих
посторонних
электролитов
(например,
нейтральнь]х
солей), пере-
напря)кение
водорода'
действительно'
ле
3ависит от
концентрации кислоты,
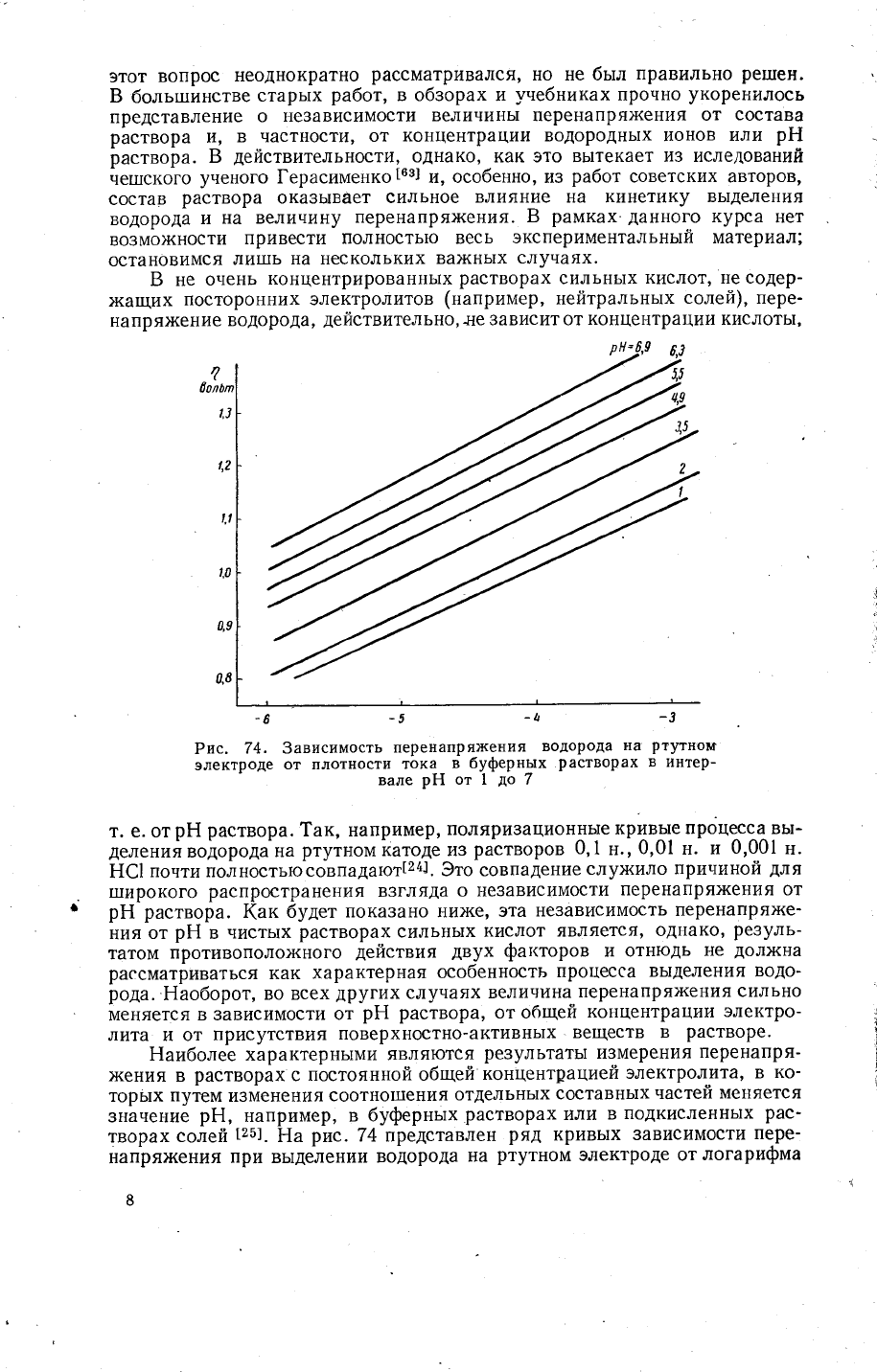
Рис.
74' 3ависимость
перенапря)кения
водорода
на
ртутном
электроде
от плотности
тока
в
буферных
Растворах
в интер-
вале
рЁ{
от 1
до
7
т. е. от
рЁ
раствора.
1ак, например'
поляризационнь'|е
крчв}Р
процесса вь!_
деления
водорода
на
ртутном
катоде из
растворов
0,1
н.,
0,01
н. и
0,001
н.
Ё€1
почти полностьюсовпадают[24].
3то совпадение
слух{ило
прининой
для
1пирокого
распространения
взгляда
о независимости
перенапря}кения от
рЁ раствора.
1(ак будет
показано ни)ке'
эта
независимость
перенапря)ке_
ния
от
рЁ
в
нистьтх
растворах
сильнь|х
кислот является,
однако'
резуль_
татом
противополо)кного
действия
двух
фат<торов
и отнюдь
не
долх{на
рассматриваться
как
характерная
особенность
процесса
вь1деления водо'
рода.
Ёаоборот'
во всех
других
случаях
величина-перенапря)кения
сильно
меняется
в зависимости
от
рЁ раствора,
от общей
концентрации
электро-
лита и от
присутствия
поверхностно_активнь1х'веществ
в
растворе.
Ёаиболее характернь1ми
являются
ре3ультать]
измерения
перенапря-
'(ения
в
растворах
с
постоянной общей
концентрацией
электролита'
в
ко_
торь|х
путем
изменения
соотно1пения
отдельнь1х
составнь]х
частей
меняется
значение
рЁ,
например' в
буферньтх
растворах
|4л|4
в
подкисленнь1х
рас-
творах
солей
!25].
на
рис.74
представлен
ряд
кривь1х
3ависимости
пере-
напрях{ения
при вь1делении
водорода
на
ртутном
электроде
от
логарифма
8
-3
-ц
-5
-6
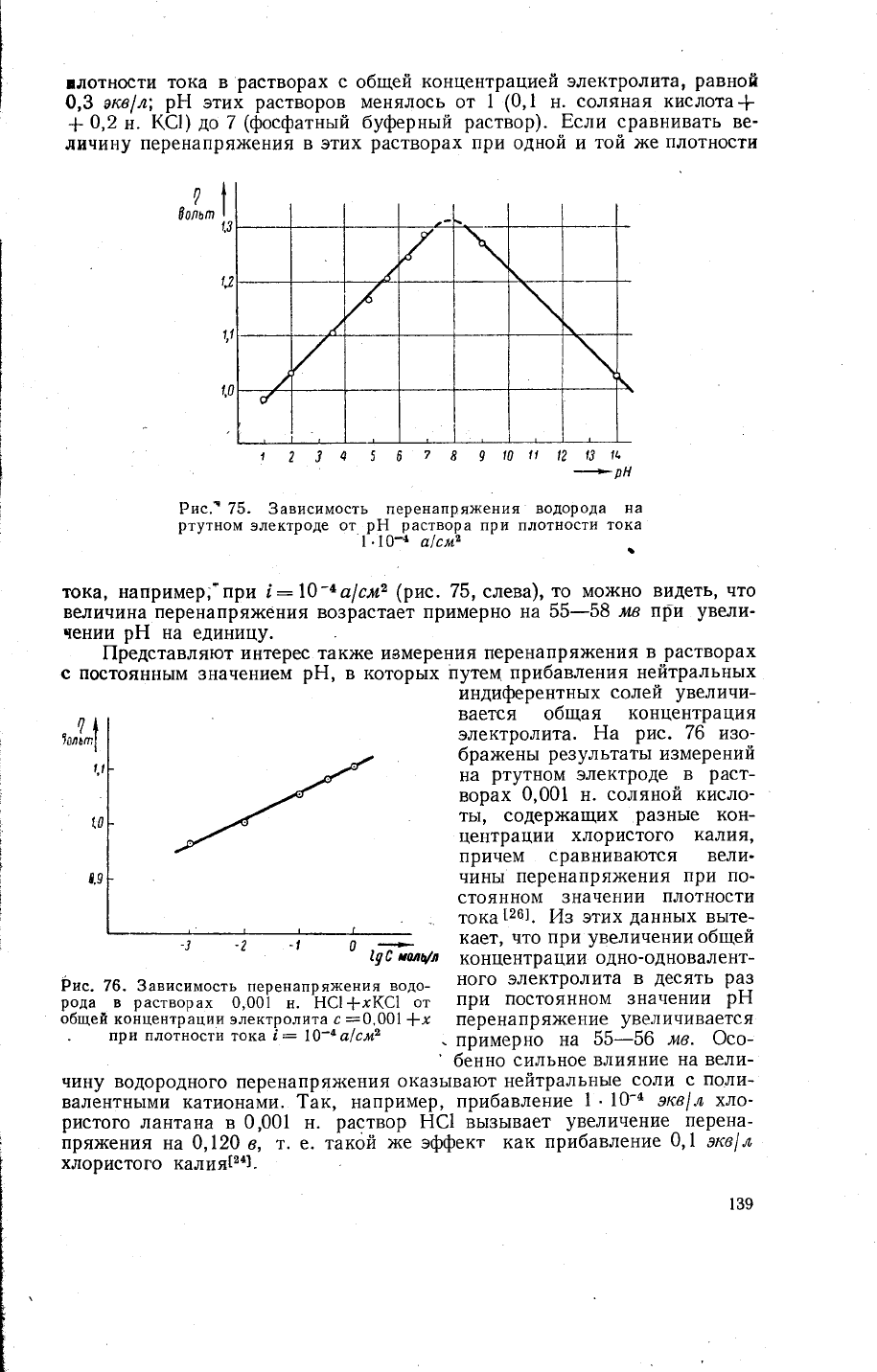
]дотности
тока в
растворах
с
общей
концентрацией
электролита'
равной
0,3
экв|л;
рЁ
этих
растворов
менялось от
1
(0,1
н.
соляная кислота}
у0,2
н.
кс|)
до
7
(фосфатный
буферньтй
раствор).
.Рсли
сравнивать
ве-
дичину
перенапрях{ения в этих
растворах
при
одной
и
той )ке
плотности
?\
0ольп
|
|.3
Рис.'75. 3ависимость перенапря)кения
водорода
на
ртутном
электроде от.
рЁ
раствора
при плотности
тока
\.\0-ц
а/см2
тока' например,'при
|:\0-4а|см2
(рис.7б,
слева),
то
мох(но
видеть,
что
величина перенапря)кения
во3растает
примерно на
55-58
мв т1рп
увели-
чении
рЁ
на
единицу.
||редставляют
интерес так)ке
измерения
перенапря)кения
в
растворах
с постояннь|м
значением
рн,
в которь|х
путем прибавления
нейтральньтх
индиферентньтх
солей
увеличи-
,'!'),
',1
,\0
0.9
-3 -2
-|
0
с{полцл
ёис. 76. 3ависимость перенапряжения
водо-
рода
в
растворах
0'001
н. Ё(|*я(€1
от
о6щей
концентрации
электролита
с
:0,001
*х
. при плотности
тока
!:
10-ца/см2
вается
общая
концентрация
электролита.
Ёа
рис.
76 и3о-
бра>кеньт
ре3ультать]
измерений
на
ртутном
электроде
в
раст-
ворах
0,001
н.
соляной кисло-
ть1' содер)кащих
ра3нь|е
ко1{-
центрации
хлористого
калия'
причем
сравниваются
Бё.[[-
чинь|
перенапрях{ения
при
по-
стоянном
значении
плотности
тока[26].
йз этих
даннь!х
вь]те-
кает, что
при
увеличенииобщей
концентрации
одно-одновалент-
ного электролита
в
десять
ра3
при постоянном
3начении
рн
перенапрях(ение
увеличивается
примерно
на
55-56 мв.
Фсо-
бенно
сильное
влияние
на вели-
чину водородного
перенапрях(ения
ока3ь1ватот нейтральнь1е
соли с
поли-
валентнь1ми катионами. 1ак,
например,
прибавление
1'10-4
экв|л
хло-
ристого
лантана
в
0,001 н.
раствор
Ё61
вьтзьтвает
увеличение^перена-
прях<ения
на 0,120
6, т. е.
тАкоа
х<е
эффект
как
прибавление
0,\
экв|л
хлористого
калутя[2,1.
139

Аналогичнь]е закономерности
наблюдаются 17 11а
других
металлах'
например' на
}.{|,
хотя часто
они
вь]ра)кень1 менее
четко' чем на
ртутном
электроде.
Аля
щелочньтх
раетворов
имеется
пока
еще относительно
неболь-
тпой
экспериментальньтй материал.
Р1епосредственное
количественное
и3учение процесса вь1деления водорода
на
ртутном
электроде
при
рн
больгпем 3 становится затруднительнь1м' так как потенциал
вь]деления
водорода сдвигается
у)ке
настолько
в отрицательную сторону'
что наряду
с вь1делением
водорода начинается
процесс
разряда
ионов
щелочнь1х
мстал-
лов с
образованием амальгамь1. ||о
этой причине
скорость
реакции
вь]деле-
ния водорода на
ртутном
электроде в
щелочном
растворе
при
данном
пере-
напрях{ении
'мо)кет
бьтть
определена
только по
объему
вь1деля1ощегося
водорода
или
косвеннь]м путем
из
даннь1х
по
кинетике
ра3ло}кениц
амаль-
гам
щелочнь!х
металлов
|27'8]
(см.
главу
\л111).
Ёа
других
,металлах'
на
которь]х перенапря)кение
водорода мень1пе
(например,
на
нике]|е
или
платине),
возмо)кнь| прямь|е
измерения
[131.
||олувенньте
для
никелевого и
ртутного
электродов
ре3ультаты
пока-
3ь]ва}от'
что
в
щелочнь1х
растворах'
в
отличие от кисль|х' перенапряжение
водорода не
увеличивается'
а' наоборот,
умень1пается
приблизительно
на 53
мв
при
увеличении рЁ
на
единицу,
?. €. при
десятикратном
увели-
чении концентрации
щелочи.
3акономерность эта'
однако' не
соблюдается
в случае платинового
электрода' на котором перенапрях(ение
в
щелочнь|х
растворах
мало 3ависит от
концентрации.
Б
нормальном
растворе
щело-
чи
перенапря;|{ение
на никелевом электроде принимает
почти
такое
же
значение'
как
у1 в нормальной
кислоте;
на
ртути
оно в
щелочном
растворе
несколько
вь|1ше.
1(ривьте
зависимости
перенапрях(ения
от
рЁ
для
ртут-
ного электрода
в
кислом
и
ще4очном
растворах
с постоянной
обпюй
кон-
,центрацией электролита приведень1 на
рис.
75.
йзлох<енньте прость|е количественнь]е
3акономерности соблюдаются
в
не
очень
концентрированнь1х
растворах
электролита.
Б
растворах
с коп-
центрат1ией
электролита' превь1|'пающей
0,5-1
экв
|
л, наблюдаются
откло-
нения'
возрастающие по
мере
увеличения
концентрации.
Бопрос
о
величине
перенапря)кения
водорода
в концентрирован-
нь1х
растворах
имеет боль:пое практическое
значение,и6о в
технике часто
приходится
иметь
дело
с концентрированнь1ми
растворами'
например'
в
пРоцессах
электрометаллургии
(электрорафинирование
меди
и
других
металлов),
промы1пленного
электролиза'
корро3ии
металлов и
др. де-
тальное
изучение перенапря)кения
в
концентрированнь|х
растворах
кис-
лот'
проведенное
3.
А. Р1офа, показало' что наблтодающаяся в
ра3-
бавленньтх
растворах
независимость
перенапрях{ения
от
концентрации
кислотьт
нару1шается и что
перенапряжение по
мере
роста
концентрации
кислоты 3акономерно
падает. Ёа
рис.
77 лриведень|
кривь1е зависимости
перенапрях{ения
отлогарифма
плотности тока
в
растворах
соляной
кйсло_
тьт. Берхня
я кривая изобра>кает
3начения
перенапря)кени
я в
0, 1
н.
растворе.
1(ак
ух<е
ска3ано
вь]1пе' кривь1е перенапрят{ения
в
более
разбавленных
растворах
практически
совпадают
с
кривой
для
0,1
н.
раствора.
1(ривьте
перенапря)кения
для
более
концентрированнь1х
растворов
располагаются
ни)ке; эти кривь|е
у)ке
не
параллельнь|
друг другу.
€ни>кение перенапря-
х(ения при маль1х
плотностях
тока и не сли1пком
вь1соких
концентрациях
заметно
больтше,
чем
при
больш:их;
в очень
концентрированнь1х
раство-
рах
оно
достигает
нескольких
десятых
вольта. 1аким образом,
ффект
сних<ения перенапря}кения
весьма 3начителен-он соответствует
увеличе-
нито плотности
тока' т.
е. скорости
реакции
при
одном и
том
'(е
3наче-
\1'1||
перенапря)кения
(прямая
А-А')
в несколько ть1сяч
раз|?].
14о
