Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.

точка
нулевого
3аряда'
значение
о можно
принять
равным
20'10_6
кцл|см2.
Фтсюда
вь1текает'
что
ток заря}|{ения
для
ука3анного
потенциала_вели-
чина
порядка
2
.
|0_7
а.3еличина
тока восстанов.т1ения
зависит
от
кон-
центрации
реагирующего
вещества
по
уравненито
(1
17).
[ля
ни3ких
кон-
шентраший
(10_6
окв|л)
величина
то{а
3аря}кения
сравнима
с величиной
тока
электрохимической
реакции.
|[о этой
причине при
количественнь1х
исследованиях
в
случае'
маль|х
концентраций
реагирующих
веществ необ-
ходимо
учесть
величину
тока заря)кения
и ввести соответствутош{}ю
поправку в
наблтодаемь:й
ток.
€уществование
тока 3аря)кения
ограничи_
вает
применение
полярографического
метода тнализа
при ни3ких
концен_
трациях определяемого
вещества
(ни>ке
\0_ь
экв|л).
$
6. поляРогРАФичвскив
мАксимумь!
||ри
рассмотрении
дифу3ионнь]х
явлений на
капельном
электроде
мь1
предполатал|!'.что
рост
капли н"е*Р*зэ]Рзя}д'еР.9"ц9дцРания
раствора'
т. е.
происходит
таким
>ке
путем' как'
например'
рост
надуваемого
ре3и-
нового 1пара' все
элементь1
поверхностц
которого перемещаются_строго
в
радиальном
направлеции
(см.
рис.
60).
,1
36
-
0,5
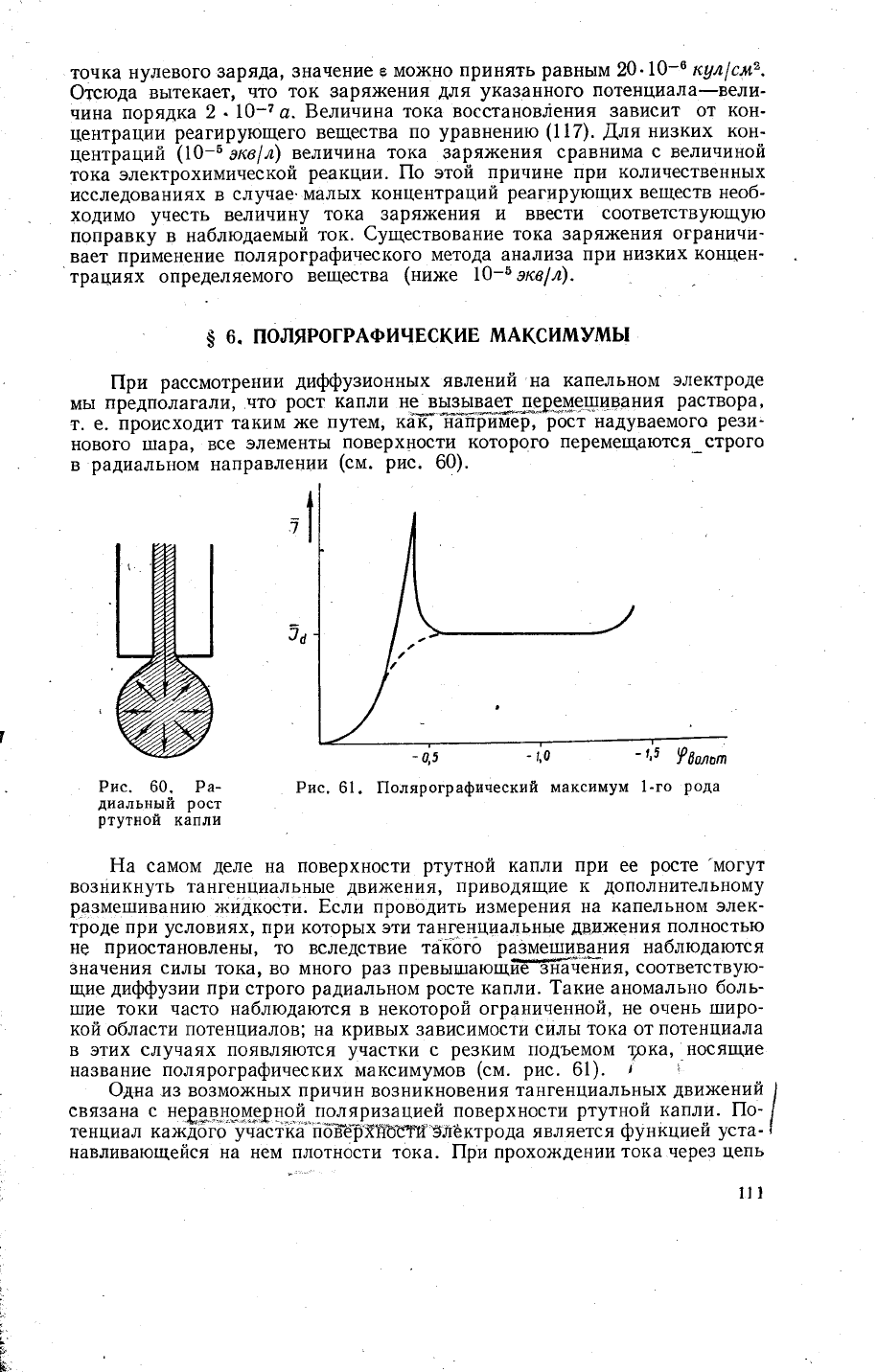
Рис.
61. ||олярографияеский
максимум
1-го
рода
-
1,5
-
1,0
Рис. 60. Ра-
диальный
рост
ртутной
капли
Ёа самом
деле
на
поверхности
ртутной
капли
при
ее
росте
'могут
во3никнуть
танген11иальнь1е
дви}кения'
приводящие к
дополнительному
разме[шиванию
>кйдкости. Рсли проводить и3мерения
на
капельном элек-
троде при
условиях'
при которь1х
эти танген'циальнь1е
дв'их{ения
полностью
не
приостановлень|'
то вследствие
такого
р3!$9*у-чгция
наблюдаются
3начения
силь|
тока' во
много
ра3
превь]1шающиэ-5начения'
соответствую-
щие
диффузии
при
строго
радиальном росте
капли. 1акие аномально
боль-
1пие
токи часто
на6людаются в некоторой
ограниненной,
не очень
1|]иро-
кой области потенциалов; на кривь]х зависимости
силь|
тока
от
потенциала
в
этих случаях появляются
участки
с
ре3ким
подъемом
Рка,
нося|]дие
название
полярографических
максимумов
(см.
рис.
61).
!
\
Фдна из возмох{нь1х причин
во3никновения
тангенциальнь1х
двих<ений
/
связана с нед.*Р'..-н.-=9}{роной поляоизацией поверхности
ртутной
капли. !-[о-
]
тенциал каждого
уйтйа
йов'фяьости'элёктрода являётся
функциеи
уста-
.
навливающейся на нем плотности тока. ||ри прохо>кдении
тока
чере3
цепь
11 1
{9
г
&

[
[
ь
с капельнь1м"электродом
ток
не
распределяется
впол!1е'
равномерно
вдоль
его поверхности;. плотность
тока
6оль1пе
в ни)кних
частях капли
в первую
очередь 1следствие
того' что верхняя
настЁ?бй|[8йс!?орой
"'Ё,""и
экра!+ируется
концом
капилляра.
||о этой причине
потенциал
на
различ-
нь|х
участках
поверхности
несколько
различен'
что приводит
в свою
оче-
редь
к нерав номер-н9му!
д4Ёп
ределению
@-!Ёич_ного
натя)кения на
ка
пле.
Бсли пограни\{Ё6е
натя>кение
в
разлинйЁх
местах
поверхност|т
ка[1'л!1
различно'
то
происходит
двих(ение
ртути
вдоль поверхности
от
участков
с мень1пим поверхностнь!м
натя}{ением
(стремящихся
расллириться)
к
участкам
с боль:пим
3начецием
поверхностного
натя}кения
(стремящимся-
сократиться)*.
Рсли
электрохимическая
реакция
восстановления
происходит при
потенциалах'
соответствующих
полох(ительной
ветви
электрокапилляр-
ной
кривой,
?. €. при потенц|1алах'
ле'<ащих подо),ц,!в.дь}{ее
потенциала
точки
нулевого
заряда'
то
двих{ение
поверхности
направлено от верхних
частел?
ртутной
капли
к
них{ним
ее частям
(так
назьтваемь|е
положитель-
нь1е
полярографитеские
максимумьт). 3то
вь1звано
тем' что
них{ние части
каплу1'
на
которых
плотность
тока боль:ле
и которь]е'
следовательно,-об_
лада!от
более
отРц$зн!ьц|цм'"дошд!]ц!а.]1ом'
в этом
случае
имеют более
вь|сокое
значенйЁйБерхностного
натя)кения.
.{,ополйительнь:й
приток
разря>л<аемого
вещества,
обусловленньтй
переме1пиванием'
осуществляется
в этих
условиях
главнь1м
образом сверху'
что
умень1пает
концентрацион-
ную
поляри3ацию'
сдвигает потенциал
верхних
частей капли в
поло'х{и-
тель}1у}о сторону
и
еще
боль:пе
увеличивает
ра3ность
потенциалов
и
ра3-
ность
пограничных
натя>кений ме}кду
ра3нь]ми
частями капли,
т' е.
еще
больгце
увеличивает
тангенциальное
дви)кен]{е
(рис.
62а). 1акое
усилен-
ное
разме1пивание
мох{ет вь|3вать
увеличение
сильт
тока
в
десятки
раз.
||ри
увелинении
отрицательного
потенциала
капл|4 при
прй6ййё1йй*к
потенциалу
точки электрокапиллярного
максимума
градиент поверхност-
ного натях(ения
вдоль
поверхности
капли
исчезает'
двих{ения
останав-
ливаются
и.
ток
ре3ко
падает
до
величиньт
обьткновенного
дифузион_
ного
тока.
|{ри потенциалах'
соответствующих
отрицательной
ветви электрока-
пиллярной кривой,
электрохимичес-кая
реакция
приводит к
во3ник_
новению о6ратно
направленного
двих{ения'
так как
более отрица-
тельному потенциалу
ни>кней
чаети
капли
соответствует более
ни3кое
значение поверхностното
натя>кения
(отрицательнь1е
полярографические
максимумь1,
рис.
62б).
в
этом случае
подача
восстанавливаемого
вещества
осуществляется снизу
и не
'
увеличивает
разность
потенциалов
ме}кду
1 [радиенты потенциала'
а следовательно'
и тангенциальнь|е
дви)кения
вдоль
поверхности
ртути
возникают
и в
том случае'
когда свободная
капля
ртути
падает
в
растворе
электролита' в
котором поддерживается
постоянное
электрическое
поле.
Бследствие
реактивного
отталкивания
от
окру}кающей
среды
тангенциальное
дви}кение
поверхности
приводит
к
дви)кению
капли
в
целом'
которое
легко
наблюдать.
Фтноси_
тельная простота геометрических
условий
позволяет
дать
в
этом случае точное матема_
тическое выра)кение
для
скорости
дви)кения
капли
по
направлению
электрического
лоля о:
еЁг
':'*'**
"
'
где
6_напря)кение
поля' е_плотность
9аряда !та поверх!{ости
ртути'
/-!а!и}с
капли'
р
и
р'-вязкости
окружающего
раствора
и
ртути'
1с_уделъная
электропровод-
ность
раствора.
|1риведенное
уравнение
бьтло подтвер)кдено
измере1|иями отклонения
под
действием
электрическото
поля
ртутных
капель'
падающих в вя3ком
глицериновош
растворе
[?1.
п2
4.
{
л
.{
:1
;1
}
4
{
]
{
*
1
*]
*
.
!
{
$
1
.{
!
:{
(
133
верхней
и ни)кней
частями
капли'
а, наоборот'
умень1{]ает
ее
при
определеннь]х
*условиях
настолько'
что
дви)кения
поверхности
приоста-
навлива1отся.
Бследствие
этого
отрицательнь1е
полярогр)ринес''ие
макси_
мумьт
обь:нно
вь1рах{еньт
слабее
поло}кительньтх.
Бойее
по!робньтй
анали3
Рис.
62.
[вих<ение
поверхности
ртутной
к.апли'
вь!3ванное неравномерной
лоляризацией:
а)
при
поло)кительном
заряде
поверхности
ртути;
. б)
лри
отрицательном
заряде
поверхности
ртути
условий
возникновения
двих<ения
|8]
приводит
к вь1воду'
что
и в
случае
отрицательнь1х
максимумов
увеличе.ние
поляризации
даль1пе
и3вестного
предела
приводит
к
сстановке
тангенциальнь!х
двих<ений
и спаданию
силь|
тока.
1ак
как
неравномерность
поляризации
связана
с
различием
в
омическом
ладении
-
потен_
циала
по
путям
тока к
ра3личнь1м
частям
калли,
то
описаннь1е
полярографические
максимумь1 (как
поло)кительнь1е'
так
и
отрицательнь1е
проявляются
сильнее
при
боль|пом
удельном
сопротивлении
рас-
твора
и значительной
плотности
тока'
т.
е. при
низ-
кой концецтрациц
фца
и
относительно
йь:соко:}
концентрации
восстанавливающегося
вещества.
'
.(ругая
возмо)кная причина
возникновенутя
тан-
геРциальнь1х
дви)кений
поверхности
ртутной
капли,
как пока3ала
1.
А.
1(рюкова
[9!,
связана
с
самим
вь]-
текание\{
ртути
из
капилляра
и
с процессом
роста
кап-
л|1,
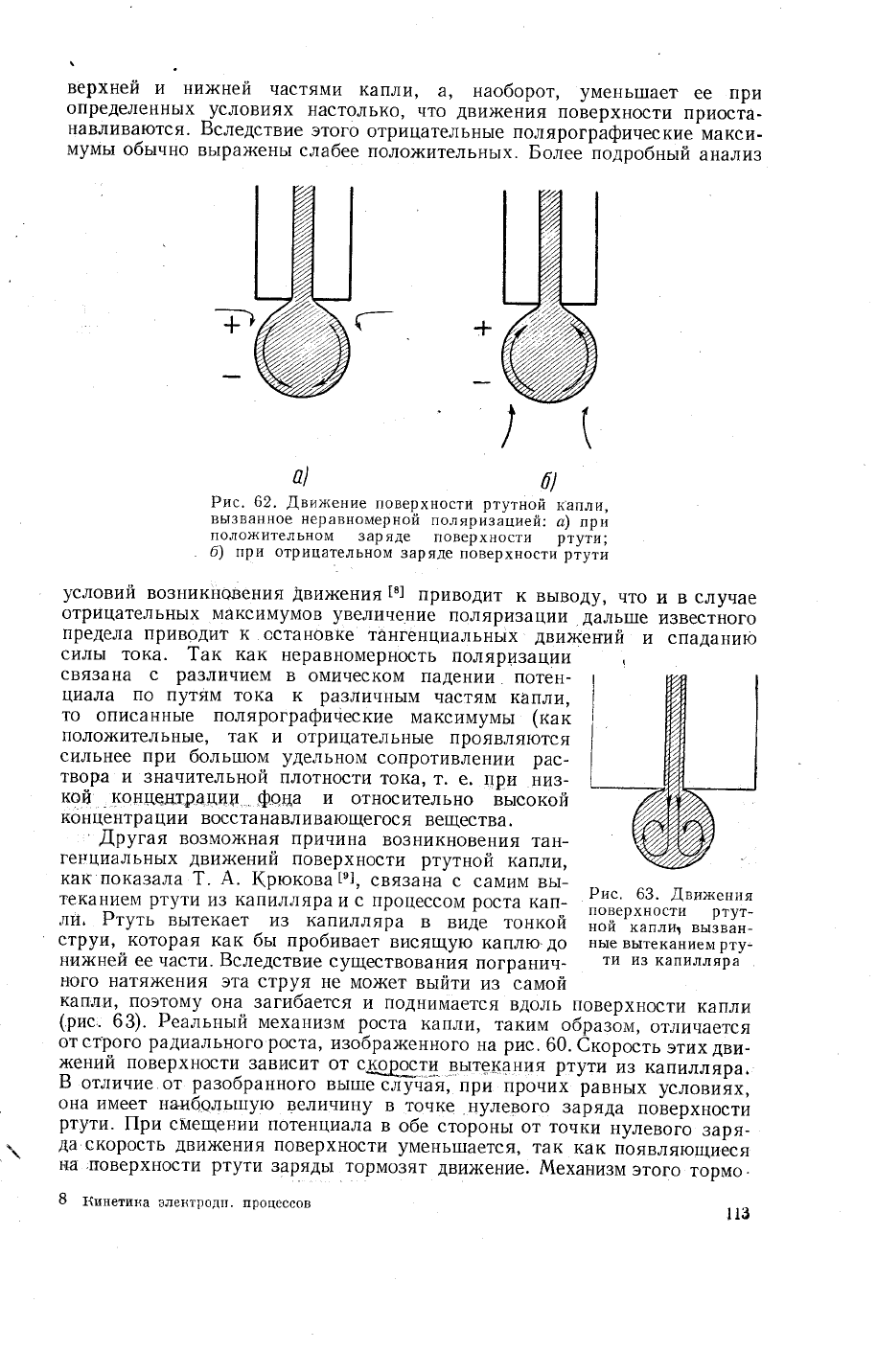
Ртуть
вь|текает 14з капилляра
в виде
тонкой
струи' которая
как
бь| пробивает
висящую
каг[лю.до
них<ней
ее части. Бследствие
существования
погранич-
г]ого
натя)ке|1ия
эта струя
не мо)кет
вьтйти
из
само]?
капли'
поэтому
она
загибается
и
поднимается
вдоль поверхности
капл|1
(рис.
63).
Реальньтй
механизм
роста
капл|4,
-[аким
образом,
отличается
от строго
радиального
роста'
изобра>кенного
на
рис.
60.
(корость
этих
дви_
х<ений поверхности-зависит
от сщР19ти*
вь!тецания
ртути
и3
каг{илляра.
Б
отличие'от
разобранного
вь:гпей}ная'
при
прочих
равнь1х
условиях'
она
имеет наиб9льгпу{о
величину
в точке
нулевого
3аряда
поверхности
ртути.
при смещении потенциала
в
обе стороньт
от точки
нулевого
3аря-
да
скорость
двих<ения
поверхности
умень1шается'
так
как
появляю1шиеся
}{.а
'поверхности
ртути
зарядь1
тормо3ят
двих{ение.
}1еханизм
этого
тормо.
б]
0)
Рис.
63.
Аву;>кения
поверхности
ртут-
ной
капли1 вызван_
нь1е
вь1текание}1
рту.
ти из
капилляра
8
1{инетина
элентрод|,. процессов
113

}кения,которое'какпока3ь]ваетколичественнаятеория'пропорцио.
нально
квадрат}:
ц_чр:р+',р"тной
плотности
3аряда
калл\4
и
обратно
п оопооциональ
но
у:|ел!
ной
эле
ктроп
роводности
раствора,
будет
ра
зъяс
не
н
д}',тп".
1акипд
образом,
увеличение
тока
в
этом
слу!]а"
"-1{е:"'-::9-1'
сказьтвается
в
точке
нулевого
заР1да
и
медленно
умень1пается
с
удале-
нием
потенц'1ала
в
обе"
фбронБт
"о{
этой
точки
(рис.
64).
д:1аксимумь:
накривых3ависимостисиль]токаотнапря)<ения,вь13ваннь]евь1тека-
нием
ртути,
',, "''!йем
полярографинескими
максимумами
2-го
рода,
вотличие
от
вь11пеописаннь|х
максимумов
1-го
рода.
|1о
при(]инам'
которь]е
булут
ра3ъяснень1
них{е'
максимумь1
2-го
рода
проявляются
сильнее
при
в!тсокоа
концентрации
фона.
капли
обьтчно
Аз
сказанного
следует'
что
у
поверхности
ртутнои
дол)кнь]существоватьтечения'приводящиекра3ме1пиванию'<идкости.
-1'5
-2,0
+ о
&льтп
|''с9
'
1
"|
$
}'
*
.!'
з
н
,}
-{
Рис.
64.
|1олярографический
максимум
второго',рода
",
,''Ёрй.ййй,йй'Ё
кривой
в
растворе
3
н'
(€|*
}з._1о:;!'.
Ё9€12
(сплош!:ая
кривая)'
|[унктирна1
1_Р."-
вая
"ь:ража"е'
1йачения
силь|
тока'
не
исках(еннь|е
тангенциальными
дви)кениями
поверхности'
(трелхи
обозначают
относительные
3начения
скорости
двих{е_
ния
поверхности
при
различнь1х
потенциалах
}ти
течения
могут
6ьтть
сделань|
видимь1ми,
если
в
)кидкости'суспенди_
ровать
мелкораздробленньтй
поро11]ок'.
например'
активированного
угля'
5'';';;;';_#ф;;;"
(в
особенноёти
эфект
2-го
рола)
неразрывно
свя3ань|
;
;;а;;'
-'йЁ',,'.'
электрода'
и
поэтому'
казалось
бьт,
нельзя
не
учи-
'ь?ват,
усиление
дифузии
и3_3а
ра3ме1пива}{ия
х{идкости'
1ем
не
менее
,Ё'1й,""а
тока'диффу3ии,
определяемая
в
полярогра'
фияескихисследованиях'вомногихслучаяххоро1цосогласуетсясо3на-
чениями.'
вь1численнь1ми
при
помощи
пр'""д"""*х
вь:гше_формул д':тя
диф_
фузии
к
радиальн'
р'стуйй
капле;
-иначе
191"Р_]:^]?]генциальнь!е
Ави-
х(ения
поверхности
в
этйх
и3мерениях
не
ска3ь1ваются.
3то
мо>кно
объ-
яснить
только
тем,
что
удалось
-найти
условия'
при
которь]х
описаннь|е
тангенциальнь1е
дви)кения
поверх}|ости
ртути
практически
полность}о
подавляются,т.е.прикоторь1хповерхностьнеобладаетподвижностью'
-й6й"'""",ой
х<идкой
поверхности'
и
ведет
себя-
так'
как
поверхность
раздуваемо"'
р"''й'.'.'
Ёу.,'ря.
)/словия
эти
6ьтли
найдень1
сначала
опь]тнь]мпутемитолькозапоследнеевремяполучилитеоретическое
истолкование.*'"н;ъъ'.;ййи*,.
хотя
и
не
единственньтй,
спосо6
подавления
тангенци-
альнь|х
дви)кении,
давно
ух(е
применяемьтй'
заклю-чается
в
прибавлении
й;;;;"р'
""о''"'"*
количеств
вещества,
способного
адсорбироваться
!|4
;!
1
,}
.,,!
\
,|
;
*
!
1
|
,
|
|
1
:
;
]
*
}
]
1
+
|
!
!

на
поверхности
ртути.
.&1еханизм
действия
такого
поверхностно-актив_
ного
вещества
мо>кно
себе
представить
следующим
образом. |1ри
дви>кении
п6!'ё}хньёти
ртути,
например'
от ни>кней к-
верхней йасти капли'
поверх-
ностная
концентрацтая
адсор6ированнь!х
молекул
и3меняется: в них<ней
части капли'
в
которой поверхность
растягивается'
эта концентрация
па-
дает;
в
верхней части' где
поверхность
сокращается'
она
увеличивается.
Б
ни>кней части капли'
6лагодаря
частичному
отводу адсорбированньтх
молекул'
поверхностное
натя}{ение
повь11пается;
увеличение
концентра_
ции
адсорбироБанньтх
молеф#'б"}фхйёй'
части
капли
приводит'
напро_
тив'
к
сни)кению
!оверхностного
натя)кения. Б
рфультате
появляются
силь1'
дей*с!Бующие
вдоль поверхности
от
верхней части капл14 к
ни}кней,
т. е. в сторону' противополо)кную
дви)кенито
поверхности' и стремящиеся
его остановить.
|1ри
наличии
адсорбированнь]х
частиц поверхность
обла_
дает
поэтому
как
бьт некоторой
упругостью.
|1ри благолриятнь1х
условиях
ффект
тормо)кения'
свя3аннь|й
с адсорбцией,
настолько велик' что
танген_
циальное
движение
поверхности
ртути
пол1-1остьто приостанавливается.
.[[егко понять'
что
зарядь|
двойного
слоя
дол>кнь1
ока3ь|вать
тормо3я-
щее
действие
на
двих(ения
поверхности
подобно
адсорбированным моле_
кулам.
.[|,ействительно'
при
растягива|]ии
3аря}кенной поверхности
ее
на-
тяжение возрастает'
а
при
с}катии-убьтвает. 1ак
как
ра3л14ч|4я
в
поверх_
ностной
плотности
3арядов
в
ра3нь]х
частях капли
могут вь!равниваться
благодаря
объемной
электропроводности
раствора'
то
ффект
тормох(ения
зарядами ска3ь1вается
сильнее
всего
при
ни3ких концентрациях
электро-
лита'
что приводит
к
су)кению
о6ластц потенциалов'
в которой
наблю_
даются
максимумь1
2_го
рода,
по
мере пони}кения
концентрации
фна'
|1олная
теория этих
явлений
разработана
сравнительно
недавно' и под_
робное
ее
рассмотрение
в
рамках
настоящей книги
невозмох{но|{0].
Бсякое
воздействие'
приостанавливающее
тангенциальное
дви)кение
поверхносту!,
как,
например'
прибавление
в
раствор
поверхност!1Ф-2(1!.18_
ных веществ'
приводит
к
подавлени}о
максимумов
и
к
установлению
силь|
_тока'
согласующейся
с
уравнением
йльковича.
йзмерения
тока при
нал|4чи\4 полярографических
максимумов так)ке
могут
применяться
в а|1ал\4тической
химу!у!, так как
умень1пение
скорости
дви>кения
поверхности
ртутной
капли'
в
ре3ультате
которого
умень-
шается
и ток
максимума'
является
мерой содерх<ания
в
растворе
поверх_
ностно-а
ктив
ных
веществ.
Б
ел ичи на пол я
рографинес
кого
ма
ксимума
может
слу'(ить'
таким
образом,
для
определения
следов
органических
поверх_
ностно-активнь!х
веществ'
которь!е
не восстанавливаются
на
ртутном
ка-
пельном
катоде
и
не
могут
бь:ть определень|
обь:чнь:ми
полярографине_
скими
методами[11!.
$
7.
дРугив
ФоРмь!
поляРогРАФичвского АнАли3А
1(апельнь:й
электрод
обладает
двумя
основнь|ми
достоинствами,
обе-
спечившими
его
111ирокое
внедрение в
практику
электрохимического
ис_
следования:
1) поверхность
ртутной
калли
благодаря
постоянному
обнов_
лению
не загрязняется'
и
свойства
ее всегда хоро1по
воспрои3водимы;
2)
прта постоянной
скорости
капан!4я
величина предельного
|ока
д;фу_
3ии
имеет
вполне
определенное
3начение' которое
мо)кет
бьтть
предвь|чис_
лено теоретически
по
уравнению
(117).
(ак
видно' однако'
из
$
5 и
6,
применение
электрода
с
и3меняющейся во
времени
и
подви)кной
поверх_
ностью влечет
за
собой
и
ряд
неудофтв. 3
последнее
время
бь:ли предло_
жень|
и
другие
варианть] полярографического
метода'
в которь|х
эти
труд_
8*
|15

{
,',
ности
обходятся.
1ак,
вместо
капельного
электрода
-мо>кно
исполь3овать
,р.й,.ш'йс"
",ерд,'й
электрод'
например'
дисковьй
электрод;
предель-
нь1й
ток в
этом
случае
вь1числяется
по
уравнению
(85)' Бсли
увеличивать
наг1ря)кение'
налох{енное
на
вращающийся
электрод'
находящийся
в
рас-
тво'е
восстанавливающихся
веществ'
то
как
и
в
случае
капельного
элек-
трода,получаетсярядволн'вь{сотакоторь1хпропорциональнаконцен.
трац|1у1
этих
веществ.
'
Бр-ашающийся
твеьдь1й
электрод'
сделаннь1й
на_
пример,
и3
платиньт,
свободен
от
вь11пеупомянуть|х
недостатко-в
Р:у]::::
капельного
электрода
и
мо)кет
бьтть
применен
для
исследования
реакции'
протекающих
пр' более
г{оло>кительнь1х
потенциалах,
при
которь1х
ртуть
ух(е
подвергается
окислению.
Фднако
применение
его
требует.определен_
ного
механического
устройства
для
поддер>кания
постоянной
скорост11
вращения.
Ёекоторое
неудобство
заключается
такх{е
в
том' что
поверхность
такого
электрода
изменяется
в
случае
вь1деления
твердь1х
веществ
в
ре-
зультате
электрохимической
реакции'
'
14нтересна;
форма
3ависимости
тока
от напрях(ения
получается
в
слу_
чае
нало_)кения
возраста1ощего
во
времени
напря)кения
на электрод'
нахо-
дящийся
в покоящейся
>кидкости.
и
в
этом
случае
сила
тока
во3растает
Бри'
прибли}кении
к
потенциалу,
прч
котором
возмо)кно
восстановление
р1створевного
вещества.
при.
дальнейшем
во3растании
напря)кения
ток'
однако'
не
переходит.в
постъяннь1й
предельнь1й
ток
дифузии,
как
в
случае
враш{ающегося
электрода,
так
как
с.
тече_нием
време.ни
фронт
дифу3ии
удаляется
от
поверх;ости-электрода
(см'
$
10
главьт
[),
и
подана
вещества
к электроду_
замеддяется.
Бмёсто
волнь|'
характеризующей
реаццию
восстановления
на
обьтчной
полярограмме'
в
этом
случае'получается
кри-
Бй/"
й'..'мумом.
1ак
как в
обь{чнь:х
условиях
в6лизи
поверхности
элек-
тродавсегдапроисходитнекото-роеразме1пивание)кидкости'вь]зва;111ое
изменениями
плотности
раствора
при электролизе'
то
для
исполь3оват{ия
последнего''метода
необходимо'
проводить
изменение
потенциала
32|'
'(Ф'
;;;;;й
проме)куток
времени,
в
течение
которого
фронт
диффу3ии
не
:}0пе_
вает
еще
отоити
от
по;ерхности
на
расстояния'
на
которь|х
у)ке
сказывает-
ся переме1шивание
}ки'кости,
вь13ванное
естественной
конвекцией'
не_
обходймо
учесть
при
этом'
что
при
бьтстром
изменении
потенциала
замет_
ная
часть
тока.
тратится
на
3арях{ение
поверхности
электрода
(см.
$
4
введения).
Рсли
время'
в
течение
которого
производится
и3менение
потец_
ц|1ала,-мало
по
сравнению
с
периодом
капан|тя|
то
и
при этой
форме
поля-
рографического
;нали3а
мо)кно
использовать
капельнь1й
электрод
и
со_
хранить
его
преимущества'
свя3аннь1е
с
возмо)кностьто
обновления'поверх_
!Б-''.
!дя
за1иси
и3менения
силь]
тока
во
времени
при"бь1стром
и3мене'
|1|4и
потенциала
необходимо
применять
осциллограф1]'!'
;
!
;
*
}
литвРАтуРА
к
глАвв
|!
'
1" |(
тексту
-
,
1.
,,
Ёеуц6уз[у,
€1тегп.
||з1у,
16,256(|922);
Р|ту1./т{а9"47,303(1923)
;.;.
_т
: и
'
,
| ё,
6о11.
1гау.
с[:[п._ёзк,
о,
{9в
(|93{);..}.
с1т[п.
р|туз.'
35'
п:о
с[э'зв5;
п.й.6;
г1''7}1у"'1"в"."й.'к1_а'Ё
а !,
Рес.'1гау.'с1-'!гп''
56;
1013
(1937)'
.
3.н'
5|ге|г1;;,'ь:
й.а]'._;._й
,.м.'у.
51ас[е\Бег9'7.
Б1е|<-
!(ос1:еФ,
653
244
(1951).
<1'
^9
ао
.
оос
4.
я'
п.
г
о *
#т
е й
ц
ж{х,'2,
147
(1947)'
жФх',26'
336
(1962)'
'
5.
и'
!(
о л
ьт'
;
ф"
;'4у:'!
у-[!."
*
Ё,
п'}"р.''раф11;.9:Р'а60-470
(1918)'
-
6.о.л.капцй;
;ъ.
Б.Ёе*:ман,
ж4х'5'}тв1:эБо1:
14'
Б' 3ль'
п.й,н]р,.<9спехисовреценной.биологии},23'161(1947).
1!6
1
,:

7. и.
^.
Б
а
г
о
ц
к
а я,
жФх'
23' 123\
(1949).
8.А.
н. Фрумкин
и 3.
г. /1
евин,
[Ф4,
2|, 1335
09ц7);
т. и.
попова-
и т. А.
крюкова'
[Ф{'
25,283(1951).
9.
т. А. |(
р
ю к
о
в
а,
}{Ф{,
2!' 365
(|947).
10.
А.
н. Фрумкин
и
3.
[.
/|евич,БФ{,'21'1|8309+7);1.А.
(рю'
кова
и
А.
н.
Фру*кин,
[Ф['
23' 819
(1949).
11.
т. А.
1(
р
ю к
о
в
а,
€борник
<Ёовь:е
методы
исследования поверхностных
явлений>,
и3д.
Ан сссР'
122
(1950).
12.
я'
[ е й
р
о в с к и й, 1ехника
полярографипеского
исследования
(1951};'
Р. 9
е 1а }л а
у,
).
р}луз.
со11. с[:егп.,
56'57о' 586
(1951).
2. Ф6щая
|.
и. |(ольтгоф
и
Аж.
"г1
ингейн, |1олярография,
[осхимиздат(!94в).
2.
я.
г ейровский,
[1о.тгярографинеский
метод
(1937).
3.
я.
[
е
й
р
о в с к и й, 1ехника
полярографинеского исследования,
Азд'во
иносгр,
лит-рь|,
(1951).
а.
м.
у. $1ас!е1}ег8,
Ро1аго9гар}:1вс}:е Агбе|1зтпе1[го6еп,
Бег1!п
(1950).
5.
.!.
Б еугоу $и
у,
Ро1аго9гар}:!е, !й'|еп
(1941).

|лпва
|!|
водоРоднов
пвРвнАпРяжвнив
$
1.
элвктРохимичвскАя
поляРи3Ация
||осле
того
как
реагирующая
частица
посредством
диффузии
или
миграции
подо1пла
к
поверхдости
электрода'..
она
посту_пает
в
поле его
молекулярного
воздействия.
8сли
реагируюшей
частицей
является ион'
то он-дойх<ен
войти
в состав
двойного
слоя;
нейтральная
молекула
мо-
)кет адсорбироваться
поверхностью
электрода.
3ти.стаАии
пред1шеству]от
собственйо
электрохимиче6кой
реакции'
при
которой
происходит
передача
зарядов
от
электрода
к
реагирую1цей
частице.
^
йо>кет
возникнуть
вопрос
о
том' игр&ет
ли
скорость
этих
адсорб-
ционнь1х
стаА|4й
существенную
роль
в электрохимической
кинетике'
до
настоящеговремениприизученииэлектрох-и-мическихпроцессовэти
явления
учить|вались
относительно
редко'
Ёа
основании
имеющихся
опь1тнь1х
даннь|х
мох{но
сказать'
что
6ольшинство
такого
рода
адсорб-
ционнь1х
процессов
протекает
достаточно-бьтстро
и
поэтому
они не
дол)кнь!
влиять на кинетику
прошесса
в
целом.
9то
подтвер}кдается'
в частности'
и3мерениями
емкости
дво[]ного
слоя
ртутного
электрода
переменнь|ми
го/айи
ра3личной
частоть1'
о
которь1х
уйе
говорил^ось
во
введении.
9ти
"зм.ре*й"
бьтли
доведень|
до
частот
порядка
100-200:ь|с.
герц'
причем
измеренная
емкость
оказалась
независимой
от частоть].
последнее
показь1-
Б2€1,
т116
равновесие
в
двойном
слое
успевает
установиться
за время'
которое
мало
по сравнению
с
таким
периодом
колебаний
переменного
тока*.
€
другой
сторонь1'
и3
опь1та
сл_едует'
что
сами
электрохимические
ре_
акции
часто
протекают
с небольшой
скоростью.
!,ля
того
чтобь1
увеличить
эту
скорость
(инь!ми
словами,
для
того
чтобь1
сделать
возмо)кнь|м
прохох(_
дение
тока
определенной
плотности),
необходимо
и3менить
значение
по_
тенциала
по
сравнению
с
равновеснь1м.
1акое
смещение
потенциала
припрохо)кдениитокавомногихслучаяхнель3яприписатьконцентра-
цйонн6й
поляризаци|т'
так
как
о!1о
наблюдается
и
тогда,
когда
не мо'{ет
*
Б
некоторых
случаях
необходимо,
однако'
учить|вать
ной стадии, пред1пествующей
собственно
электрохимическои
вернемся к
рассмотрению
таких
примеров.
118
медленность
адсорбшион-
реакции.
Ёи>ке
мы еще

бь:ть и
речи
о
недостатке
Реагирующего
вещества
у
поверхности
электро-
да.
таким
образом,
в
этих
случаях
появляется
поляри3ация иного
рода'
часто именуемая
электрохимической
поляри3ацией.
по мере
усовер1шен-
ствования
измерительной
техники
количество
электрохимических
реак_
ций,
при
протекании
которь|х
удалось
наблюдать
такую
поляри3ацию'
сильно возросло.
Беличина
смещения
потенциала электрода
от
равновесного
его 3наче-
ния
получила в
электрохимии
на3вание
перенапря)кения.
[вление
поляри3ации
электродов
при прохо)кдени_и_19ре3
них
электри-
ческого тока
бьтло
известно
еще в
первой
половине
{,1!, в.
Б более
ран_
них
работах
это явление
часто
объяснялось
наличием
некоторого
переход-
ного сопротивления
мех{ду электродом
и
раствором.
Б
40]х гг.
про1шлого
века профессор
физики
|1етербургского
универ_
ситета акаА. э:
[.
./[енц
!:]
и
А. €. €авелье3
[2)
указали
на олли6очность
такого
представления
и
дали
четкое
ра3граничение
ме)кдуобь1чнь1м
сопро-
тивлением и
поляризацией.
они отметили'
что в
отличие
от
омического
па_
дения
напрях{ения,
которое линейно
3ависит
от
силь| тока,
величина
лоля-
ризации
при вь1делении
га3ов
ли1пь
медленно
во3растает
при
увеличе_
ъ1и|1
силь|
тока.
Работами ленца и
савельева
6ь1лт'|
зало)кень! основь1
коли-
!{ественного
изучения
поляризационнь1х
явлений.
3лектрохимики
у)ке
давно
о6рат14ли
внимание
на
тот
факт,
нто
элек-
тролитическое
вьтделение
водорода
из
воднь]х.
растворов
на
катодах
и3
ра3личнь1х
металлов сопровох{дается
значительной
поляризацией.
||оэ_
тому
эта
сравнительно
простая и в
то
)ке
время
одна
и3 наи6олее
ва)кнь1х
для
техники
электрохимических
реакций
6ьтла
наи6олее
полно и
всесто-
ронне
и3учена.
3а
последние
два десятилетия
в
€оветском
€оюзе бьтл
проведен
Ряд
работ
по изучению
процесса
разряда
ионов водорода
и вь1деления
водорода
в
газообра3ном
состоянии' а
так>1<е
по
изучению
других
электрохимических
процессов.
Б
этих
работах
применялись
новь|е точнь1е
методь!
исследова_
ния'
в
3начительной
мере исключающие
возмо>кность
исках{ения
ре3уль-
татов
посторонними
факторами.
Б последующих
параграфах
и3лагаются
в
первую очередь
ре3ультаты,
г]олученнь|е
в
этих
работах.
Фтносительно
боль1пое
вни\{ание'
уделенное
и3лох{ению
опь1т1,!ь1х
даннь1х
для
реакции
вь1деления
водорода и
их теоре_
тическому обсух{дению,
обусловлено
тем'
что
на примере
этой
реакции
легко проследить
ряд
закономерностей
электрохимической
кинетики'
ко-
торь{е являются
общими
и могут
бьтть
прилох{ень1
и
к
другим
электрохи-
мическим
реакциям.
3кспериментальная
методика'
ра3работанная
на примере
реакции
вь1деления
водорода и описанная
них{е'
такх{е
применима к исследованию
поляри3ационнь1х явлений
при
других
электроднь]х
процессах.
\\
2.
РАв11оввснь!й
водоРоднь|й
элвктРод
и пЁРвнАпРяжвнив
водоРодА
||ри
погру)кении
электрода
|1з'ллатинутрованной
платинь1 в
раствор
электролита'
нась1щеннь]й
га3ообра3нь]м
водородом'
на нем'
как и3вестно'
устанавливается
равновесие
мех(ду
молекулам|4,
адсор6||рованнь!ми
ато-
мами
и ионами
водорода
(А)
!19
н2=2н?21]-*2е.

||отенциал
платинового
электрода
принимает
значение'
определяемое
этим
равновесием.
3ависимость
потенциала от активности водороднь|х
ионов
в
растворе
&т+
А Ф^|
парциального
давления
газообразного
водорода
над
раствоРом Рнэ
дается
термодинамическим
уравнением
,^
-
,^0
ур-ур
(134)
€огласно
общепринятому
определенито электродных
потенциалов,
константа
чь
Аля
равновесного
водородного электрода
условно
считается
равной
нулто
(нормаль-ная
водородная [пкала
электроднь1х
поте'нциалов).
3начение
потенциала
равновесного
водородного электрода' естествен-
но'
не
зависит от материала
электрода. |1римененйе
платинированной пла-
тинь| свя3ано с тем' что
на таком электроде бьютро
устанавливаются рав-
новесные
условия
для
реакции
(А)
и
что на
нем не протекают
дРугие
электрохимические
реакции
с
участием
материала электрода.
|[ри пропуска|1|1и тока
чере3
электрод
равновесие
(А)
наруштается,
и
на
поверхности электрода в
зависимости от
направления
тока
протекает
электрохимическая
реакция
восстановления
ионов
водорода
с
образова-
нием молекулярного
водорода
(если
электрод
слу)кит катодом) или о6-
ратная реакция
ионизац|ту1 молекул'
водорода
(если
он
служит анодом).
|[отенциал электрода
сдвигается от
равновесного
значения в первом
с-лу-
чае в
отрицательную
сторону'
во втором случае в
полох<ительную
(ка_
тодная
и анодная
поляри3ация электрода).
Белинина
сдвига
потенциала
завт4сит
от природь1
металлического
электрода'
от
плотности тока'
от
со-
става
раствора
и от
других
факторов.
Б
рассмотренном
случае
платиниро-
ванной пдатинь1 поляризация очень
мала;
в
других
случаях
она
мох(ет
составить несколько
десять1х
вольта у1
у1ногда
превь|1пает
вольт.
1ак, например'
при
катодном
вь1делении
водорода на
ртутном
электро_
де
из однонормального
раствора
соляной кислоть] при
плотности тока
]
:
1 . 1
0-д
а|
см2
потенциал сдвигается
на
0,94 в
в отрицательную
сторону
по сравнению с
равновеснь1м
водороднь|м
потенциалом.
|!редельньтй
диф-
фузионньтй
ток
ионов
водорода
|4 в этФй
растворе
в
зависимости от
усло-
вий переметливан|4я мо)кет принимать 3начения
порядка 0,1 или
| а|см2,
т.
е'
он в несколько ть1сяч
раз
превосходит
упомянутую
плотность
тока.
(ак
вьттекает и3 законов
концентрационной
поляри3ации'
и3ложеннь!х
в
главе 1
(уравнение53),
сдвиг потенциала'
вь|званнь1й концентрационнь|ми
изменениями в6лизи поверхности электрода' в
этих
условиях
ничто)кно
мал' и
им практически
мо}{но
пренебрень.
6мещение
потенциала на
0,94 в
поэтому
не мо)кет
быть
обусловлено
концентрационной
поляризашией.,
а
завис|1т
от
других
причин'
очевидно'
связаннь1х с
электрохимическои
реакцией,
протекающей
на
поверхности электрода
при
прохох{дении тока.
1(ак
ух<е
бьтло
указано
в
предьтдущем параграфе'
перенапря)кением
электрохимической
реакции
назь1вается величина
сдвига
потенциала
электрода' обусловленного электрохимической
поляризацией.
)/добно
ра3-
личать величинь1 анодного и
катодного перенапряя<ений
т]д
и
т?к. Рсли мьт
обозначим чере3
9р
потенциал
равновесного
водородного
электрода'
а чере3
9-потенциал
поляризованного электрода' то
для
анодной
реакции
(например,
реакции
ионизат\и|1 молекул
водорода) перенапря'(ение
равно
для
катодной
реакции'
в ходе
ную
сторону'
120
1ь:9_9р1
(135)
которой
потенциал сдвигается
в отрицатель-
1к:9р-9.
(135а)
'
дт'
@н'
{.]п'^
'
рЁ;
