Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.

СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 401
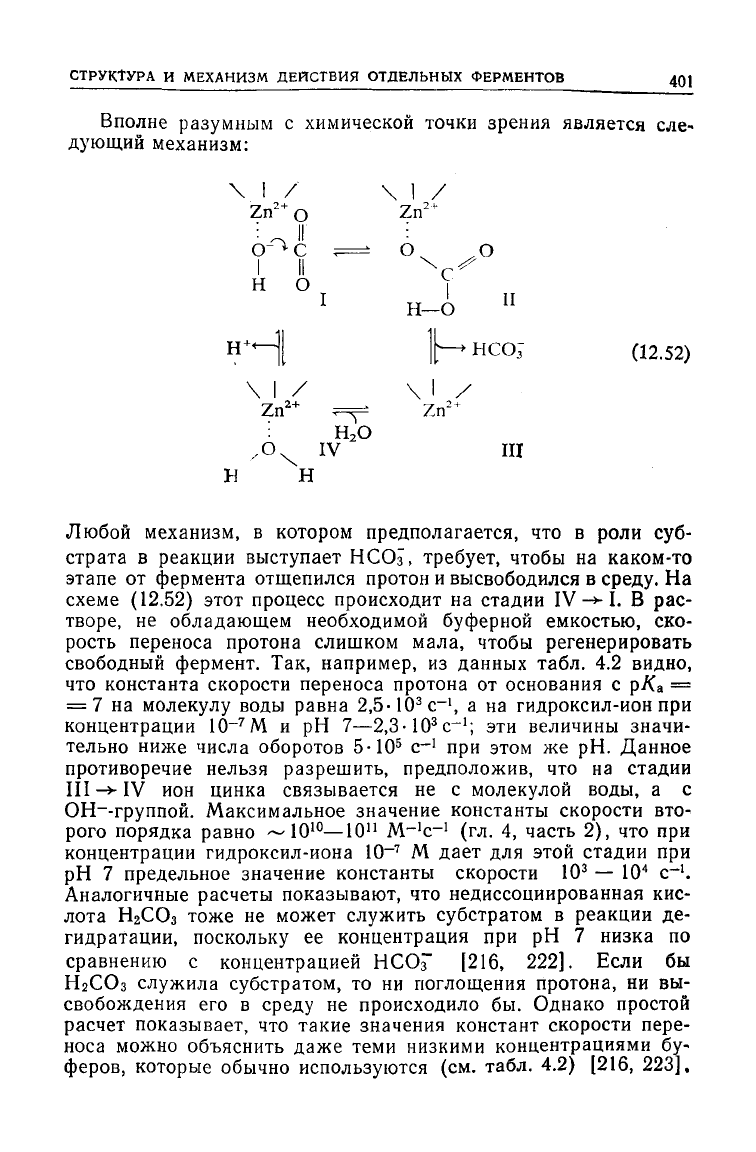
Вполне разумным с химической точки зрения является сле-
дующий механизм:
\ I / \ 1 /
Zn
2+
о
Zn
2+
О
А
С ^=^ О О
I
II
х
с
^
НО |
1
н-о »
11
HCOJ
(12.52)
\ I / \ I /
Zn
2+
^=
Zn
2+
; н
2
о
,о
х
iv щ
н н
Любой механизм, в котором предполагается, что в роли суб-
страта в реакции выступает
НСОз,
требует,
чтобы на каком-то
этапе от фермента отщепился протон и высвободился в
среду.
На
схеме
(12.52)
этот процесс происходит на стадии IV
-*•
I. В рас-
творе, не обладающем необходимой буферной емкостью, ско-
рость переноса протона слишком мала, чтобы регенерировать
свободный фермент. Так, например, из данных табл. 4.2 видно,
что константа скорости переноса протона от основания с рКа =
=
7 на молекулу воды равна
2,5-10
3
с-
1
, а на гидроксил-ион при
концентрации
10~
7
М и рН
7—2,3-10
3
с~
1
;
эти величины значи-
тельно ниже числа оборотов 5-Ю
5
с-
1
при этом же рН. Данное
противоречие нельзя разрешить, предположив, что на стадии
III-»-IV ион цинка связывается не с молекулой воды, а с
ОН~-группой. Максимальное значение константы скорости вто-
рого порядка равно
~10
10
—10"
М-'с-
1
(гл. 4, часть 2), что при
концентрации
гидроксил-иона 10~
7
М
дает
для этой стадии при
рН
7 предельное значение константы скорости 10
3
— 10
4
с~'.
Аналогичные расчеты показывают, что недиссоциированная кис-
лота Н
2
СО
3
тоже не может служить субстратом в реакции де-
гидратации, поскольку ее концентрация при рН 7 низка по
сравнению с концентрацией НСО~ [216, 222]. Если бы
Н
2
СО
3
служила субстратом, то ни поглощения протона, ни вы-
свобождения его в
среду
не происходило бы. Однако простой
расчет показывает, что такие значения констант скорости пере-
носа можно объяснить
даже
теми низкими концентрациями бу-
феров, которые обычно используются (см. табл. 4.2) [216, 223],
402
ГЛАВА
12
Недавно
это
положение было проверено
в
ходе
экспериментов
с
применением
растворов,
не
обладающих буферной емкостью:
скорость реакции дегидратации оказалась аномально низкой.
Добавление
10 мМ
буфера приводит
к
восстановлению макси-
мальной скорости
[224, 225].
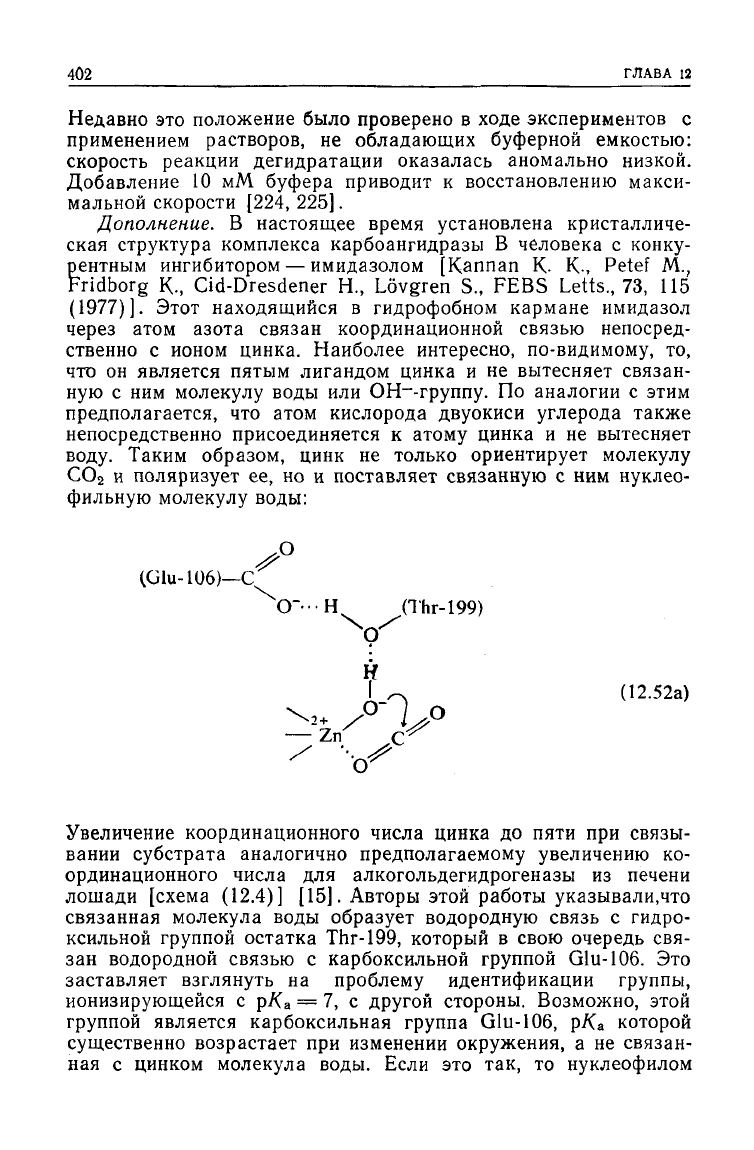
Дополнение.
В
настоящее время установлена кристалличе-
ская
структура
комплекса карбоангидразы
В
человека
с
конку-
рентным
ингибитором
—
имидазолом [Kannan
К- К-,
Petef
М.,
Fridborg
К.,
Cid-Dresdener
H.,
Lovgren
S.,
FEBS Letts.,
73, 115
(1977)]. Этот находящийся
в
гидрофобном кармане имидазол
через атом азота связан координационной связью непосред-
ственно
с
ионом цинка. Наиболее интересно, по-видимому,
то,
что
он
является пятым лигандом цинка
и не
вытесняет связан-
ную
с ним
молекулу воды
или
ОН~-группу.
По
аналогии
с
этим
предполагается,
что
атом кислорода двуокиси
углерода
также
непосредственно присоединяется
к
атому цинка
и не
вытесняет
воду.
Таким образом,
цинк
не
только ориентирует молекулу
СО
2
и
поляризует
ее, но и
поставляет связанную
с ним
нуклео-
фильную молекулу воды:
(Glu-Шб)—С
О"--Н (Thr-199)
9^
I
(12.52а)
—
Zn
Увеличение координационного числа цинка
до
пяти
при
связы-
вании
субстрата аналогично предполагаемому увеличению
ко-
ординационного
числа
для
алкогольдегидрогеназы
из
печени
лошади [схема
(12.4)]
[15].
Авторы
этой работы указывали,что
связанная
молекула воды образует водородную связь
с
гидро-
ксильной
группой остатка Thr-199, который
в
свою очередь
свя-
зан
водородной связью
с
карбоксильной группой Glu-106.
Это
заставляет взглянуть
на
проблему идентификации группы,
ионизирующейся
с рК
а
= 7, с
другой
стороны. Возможно, этой
группой является карбоксильная группа Glu-106,
p/C
a
которой
существенно возрастает
при
изменении окружения,
а не
связан-
ная
с
цинком молекула воды. Если
это так, то
нуклеофилом

СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 403
является не гидроксил-ион, как это изображено на
схеме
(12.52,а), а неионизированная молекула воды, активируемая
остатком Glu-106 по механизму общего основного катализа при
участии гидроксила остатка
Thr-199.
Ж.
Гликолитические
ферменты
Большинство
гликолитических ферментов получено в кри-
сталлическом виде, и их кристаллическая
структура
установле-
на.
Современное состояние рентгеноструктурных исследований в
этой
области было освещено Блэйком [226]. К сожалению, ами-
нокислотная
последовательность установлена только для
нескольких ферментов. Два из них — лактатдегидрогеназа и
глицеральдегид-3-фосфат—дегидрогеназа — были рассмотрены
ранее,
в разд. А. Здесь мы остановимся лишь на отдельных
интересных вопросах, связанных с некоторыми из этих фермен-
тов.
1. Триозофосфатизомераза
[227—229]
Триозофосфатизомераза весьма эффективно катализирует
взаимопревращения
D-глицеральдегид-З-фосфата и диоксиаце-
тонфосфата:
с
сн
2
он
Н—С—ОН
*=fc
С=О (12.53)
СН
2
ОРОГ
СН
2
ОРО
3
2
"
Кристаллическая
структура
фермента из мышц цыпленка была
установлена с разрешением 2,5 А [230—231]. Фермент является
симметричным димером с мол. весом 53 000, каждая из иден-
тичных цепей которого содержит 247 аминокислотных остатков.
Никаких
указаний на наличие какой-либо кооперативности
между
субъединицами в процессе катализа не зыявлено.
а.
Структура
фермент-субстратного
комплекса
Указанный
фермент предоставляет ученым редкую возмож-
ность прямо исследовать фермент-субстратный комплекс с по-
мощью рентгеноструктурного анализа. Катализируемая реакция
представляет собой простое равновесное взаимопревращение
субстрата и продукта, причем константа равновесия реакции

404
ГЛАВА
12
(~20)' такова, что равновесие сильно сдвинуто в сторону обра-
зования
диоксиацетонфосфата. Это позволило установить кри-
сталлическую
структуру
комплекса фермента с ацетонфосфатом
с разрешением 6 А, воспользовавшись разностным Фурье-мето-
дом;
субстрат
проникал внутрь кристаллов фермента с помощью
диффузии [230, 232]. Удалось не только локализовать некоторые
конформационные
изменения в ферменте, но и определить поло-
жение субстрата относительно
двух
кислотно-основных катали-
тических групп фермента и выяснить механизм реакции. Из
исследований фермента в растворе известно (см. ниже), что
реакция
протекает через образование промежуточного соедине-
ния
цис-ентола
[232, 234] с переносом протона при участии
одного основания, возможно, карбоксильной группы остатка
Glu-165 [235—237]. Согласно рентгеноструктурным данным,
карбоксильная
группа глутаминовой кислоты располагается на
одинаковом расстоянии от С-3- и С-2-атомов субстрата, что
обусловливает перенос протона
между
ними. Установлено так-
же, что имидазольное кольцо His-95 находится на равном рас-
стоянии
от карбоксильного и гидроксильного кислорода, что
также обеспечивает перенос протона от одного из этих атомов на
другой.
2. Эксперименты с использованием в качестве меток
дейтерия и трития и механизм действия ферментов,
катализирующих кето-альдольную изомеризацию
Одним из наиболее важных методов исследования механиз-
ма действия ферментов,
участвующих
в переносе водорода
между
двумя углеродными атомами, состоит в использовании
изотопов водорода. Эти эксперименты с каждым годом стано-
вятся
все сложнее, и, чтобы лучше в них разобраться, стоит
рассмотреть их в ретроспективном плане.
1
В растворе такие субстраты, как
альдегид
и кетон, частично гидрати-
рованы:
R\ R\ /ОН
;с=о + н
2
о ?=± \/
R
x
W Х)Н
При
25° С около 55% диоксиацетонфосфата и 3,3% глицеральдегид-3-фосфа-
та находятся в негидратированных кетоформах, которые и являются суб-
стратами в ферментативных реакциях. Константа равновесия для процесса
взаимопревращения негидратированных кетоформ равна поэтому 330, причем
преобладающей формой является негидратированная кетоформа диоксиаце-
тонфосфата [Trentham D. R., McMurray С. Н., Pogson С. I., Biochem. J. 114,
19 (1969); Reynolds S. J.,
Yates
D. W., Pogson C. I., Biochem. J., 122, 285
(1971)].

СТРУКТУРА
И
МЕХАНИЗМ
ДЕЙСТВИЯ
ОТДЕЛЬНЫХ ФЕРМЕНТОВ 405
а.
Обмен
протонов
со
средой:
ендиол
в качестве
промежуточного
соединения
[233, 238—240]
Первые эксперименты, проведенные в водных растворах,
обогащенных дейтерием или тритием, показали, что в продукты
реакций,
катализируемых маннозо-6-фосфат-, глюкозо-6-фос-
фат-, рибозо-5-фосфат- и триозофосфатизомеразами, стереоспе-
цифически
включается до одного моля изотопа.
D
\с^
н—с—он
I
Е.
D
2
O
I
(12.54)
н-с—он
•> с=о
I
I
R R
Всегда считалось, что результаты этих экспериментов исключа-
ют возможность прямого переноса гидрид-иона и указывают на
образование протонов, которые
могут
обмениваться со средой.
Было
высказано предположение, что в качестве промежуточного
соединения
образуется ендиол
RC(OH)=C(OH)H
[238].
б.
Выявление
внутримолекулярного
переноса
протона:
цис-ендиол
и
участие
в
переносе
только
основания
[234]
Следующим достижением было выявление того факта, что
помимо
обмена протона со средой, происходит внутримолеку-
лярный
перенос водорода (трития) между двумя углеродными
атомами:
Н Н
н
х
.о I I
х
с^
н—с—он т—с—он
I
E, Н
2
О | [
Т—С—ОН * С=О + (некоторое С=О
(12.55)
I
| количество) |
R R R
Проще
всего объяснить это явление следующим образом. Три-
тий,
связанный с С-2-атомом субстрата, переносится на катали-
зирующее основание; некоторое количество трития, прежде чем
перейти на С-1-углеродный атом, обменивается с протонами во-
ды, а остальная часть атомов включается в положение С-1 до
того, как успеет высвободиться в раствор. Из этого можно
сделать два важных вывода:
1. Перенос осуществляется только основанием (если, ска-
жем, основание «отбирало» бы протон от атома С-2, а отдель-
ный
остаток кислоты переносил свой протон на С-1, то никакого
переноса не происходило бы).
406
ГЛАВА
12
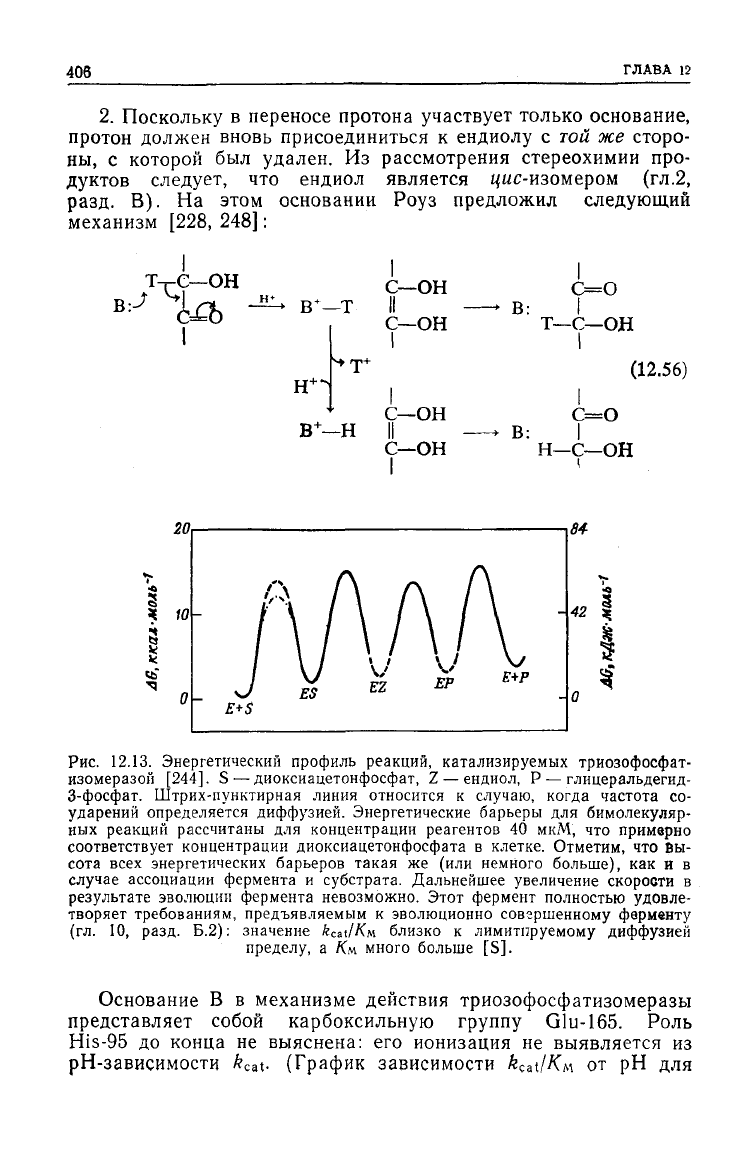
2. Поскольку в переносе протона
участвует
только основание,
протон
должен вновь присоединиться к ендиолу с той же сторо-
ны,
с которой был удален. Из рассмотрения стереохимии про-
дуктов
следует,
что ендиол является ц«с-изомером (гл.2,
разд. В). На этом основании Роуз предложил следующий
механизм [228, 248]:
T-i-C—
ОН
В:
.J
+
—Н
с—он
II
с—он
I
с—он
II
с—он
В:
С=О
I
Т—С—ОН
(12.56)
В:
С=О
Н—С—ОН
Рис.
12.13. Энергетический профиль реакций, катализируемых триозофосфат-
изомеразой [244]. S — диоксиацетонфосфат, Z — ендиол, Р — глицеральдегид-
3-фосфат. Штрих-пунктирная линия относится к случаю, когда частота со-
ударений определяется диффузией. Энергетические барьеры для бимолекуляр-
ных реакций рассчитаны для концентрации реагентов 40 мкМ, что примерно
соответствует
концентрации диоксиацетонфосфата в клетке. Отметим, что Вы-
сота
всех
энергетических барьеров такая же (или немного больше), как и в
случае
ассоциации фермента и
субстрата.
Дальнейшее увеличение скорости в
результате
эволюции фермента невозможно. Этот фермент полностью
удовле-
творяет требованиям, предъявляемым к эволюционно совгршенному ферменту
(ГЛ.
10, разд. Б.2): значение fccat/Км близко к лимитируемому диффузией
пределу,
а Км много больше [S].
Основание
В в механизме действия триозофосфатизомеразы
представляет собой карбоксильную группу Glu-165. Роль
His-95 до конца не выяснена: его ионизация не выявляется из
рН-зависимости
&cat- (График зависимости k
ca
\/Kn от рН для

СТРУКТУРА И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ
4
07
фермента из мышц цыпленка представляет собой колоколооб-
разную кривую, характеризующуюся рКа = 6 и 9,
тогда
как
рН-зависимость
fe
C
at
изображается сигмоидной кривой, в кото-
рой
проявляется только более низкое значение рКа [241].
рН-зависимость
kcat/Км
для фермента, выделенного из дрож-
жей, также описывается сигмоидной кривой, отражающей
ионизацию
группы с более низким значением р/(
а
[242].
рН-зависимость
скорости химической модификации Glu-165 по-
казывает, что р/(а этого остатка равен 3,9 [242, 243]; см. гл. 5,
разд. Б.2.в и гл. 7, разд. Ж)
в.
Построение энергетического профиля для реакции [244]
Самое последнее достижение в исследовании указанных вы-
ше реакций с применением радиоактивных изотопов состоит в
исчерпывающем анализе обмена тритием
между
водой и про-
дуктом и остающимся субстратом в стационарных условиях,
обмена тритием
между
меченным тритием субстратом и раство-
ром и продуктом, а также первичных кинетических изотопных
эффектов
для скорости реакции. Из этих данных удалось опре-
делить все константы скорости для механизма
(12.56)
и постро-
ить энергетический профиль для реакции, катализируемой трио-
зофосфатизомеразой (рис. 12.13).
3. Глюкозо-6-фосфат—изомераза [228, 229]
Другой гликолитический фермент, D-глюкозо-б-фосфат—изо-
мераза, катализирует взаимопревращение
между
глюко-
зо-6-фосфатом и фруктозо-6-фосфатом. Кристаллическая струк-
тура
фермента, выделенного из мышцы свиньи, была установ-
лена с разрешением 3,5 А. Фермент является симметричным
димером с мол. весом 120 000 [245].
Последовательность реакций, катализируемых глюко-
зо-6-фосфат—изомеразой, более сложна, чем в
случае
триозо-
фосфатизомеразы.
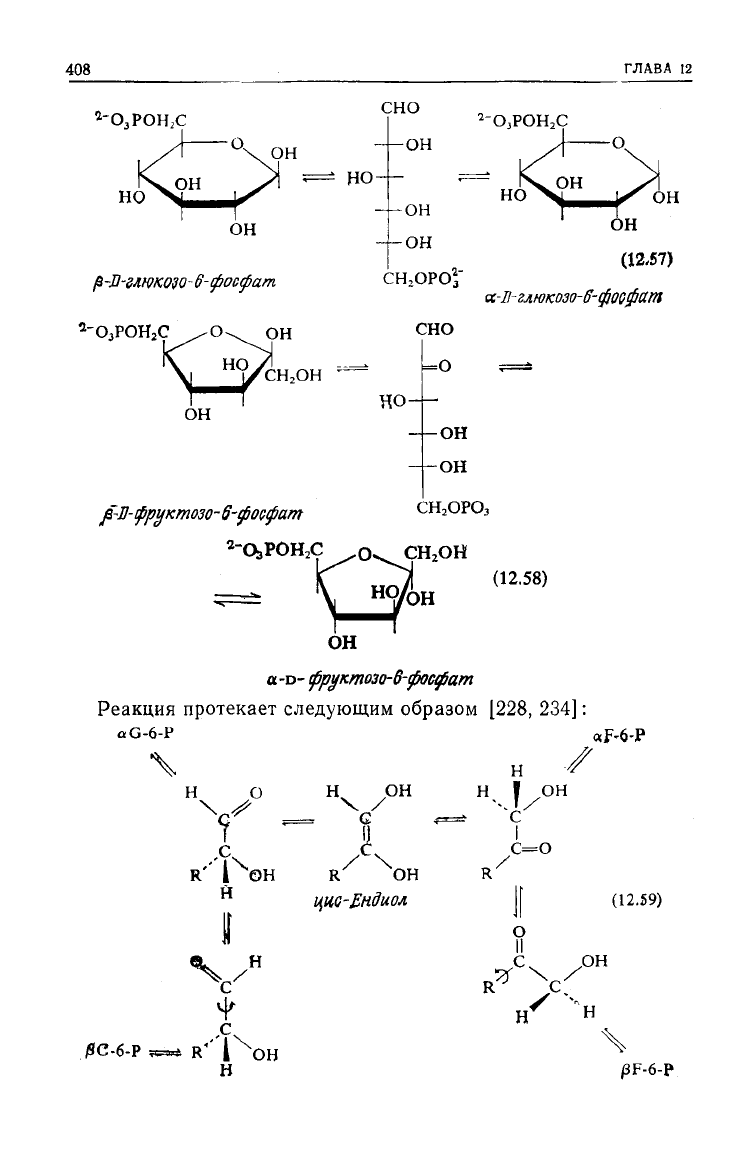
В растворе сахара
существует
в виде цикли-
ческих полуацеталей, представляющих собой равновесную смесь
а- и р-аномеров (глюкозо-6-фосфат на 38% представлен сс-фор-
мой
и на 62% —реформой; для фруктозо-6-фосфата эти величи-
ны
составляют 20 и 80% соответственно) [228]. Субстрат, уча-
ствующий в реакции изомеризации, находится в раскрытой
форме [246—248]. В растворе эта форма присутствует лишь в
очень небольшом количестве, и, следовательно, первая стадия
реакции
представляет собой катализируемое ферментом рас-
крытие кольца. а-Аномер реагирует быстрее р-аномера, однако
оба они
участвуют
и образуются в
ходе
реакции.
408
ГЛАВА
12
а
-О
3
РОН
2
С
но
I— .
он
р-Д-глюкозо-
6-
фосфат
сно
он
но-f-
OJPOHJC
-он
-он
-он
но
он
(12-57)
а-П-глюкозо-6-фоофш
н
2
-О
3
РОН
2
С^О\
ОН
но
сн,он
-
он
f-П-фруктозо-б-фосфат
сно
=о
НО—
-он
-он
СН
2
ОРО
3
1^
*^ч
К
но/он
он
(12.58)
a-D-
фруктозо-6-фосфат
Реакция
протекает следующим образом [228, 234]:
aG-6-P
«F-6-P
\
Н /
НО Н ОН Н I ^ОН
I
С.
цно-Ендиол
,с
R''
|
X
OH R
/
ОН R
I
с=о
с
(12.59)
1?
,с
/ЗС-б-Р
***t
R'' 1
Х
ОН
н
\
СТРУКТУРА И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ
ФЕРМЕНТОВ
409
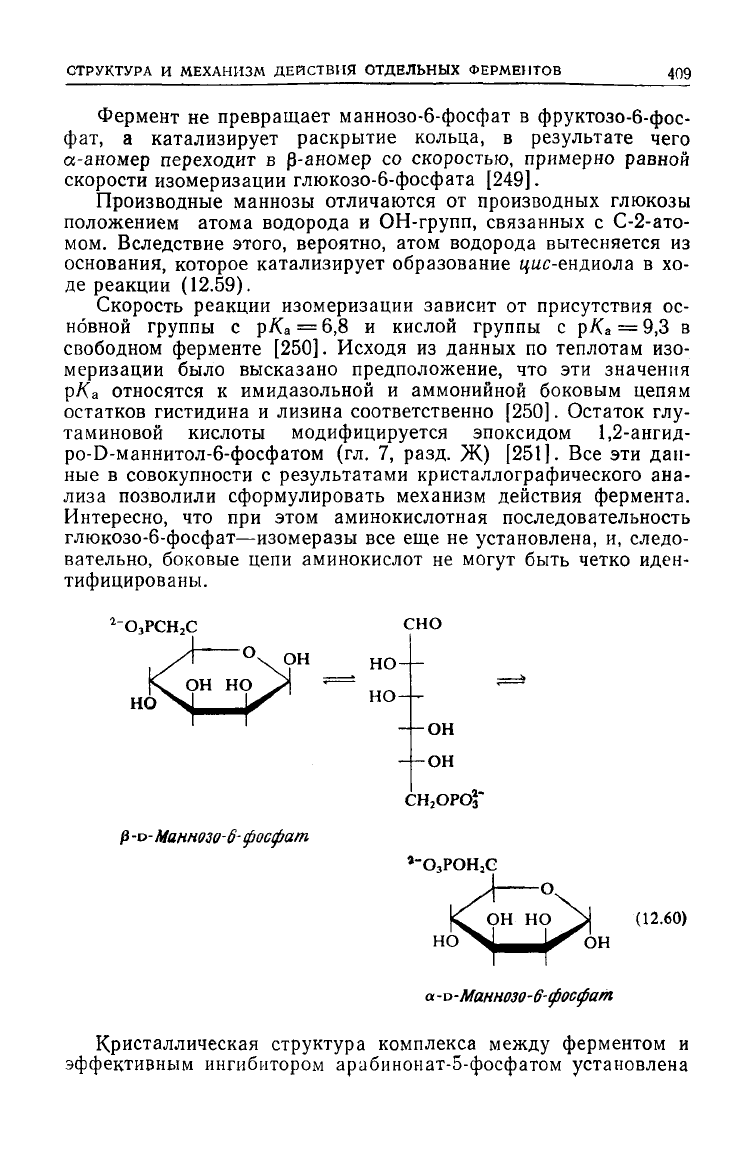
Фермент не превращает маннозо-6-фосфат в фруктозо-6-фос-
фат, а катализирует раскрытие кольца, в
результате
чего
а-аномер переходит в fj-аномер со скоростью, примерно равной
скорости изомеризации глюкозо-6-фосфата [249].
Производные маннозы отличаются от производных глюкозы
положением атома водорода и ОН-групп, связанных с С-2-ато-
мом. Вследствие этого, вероятно, атом водорода вытесняется из
основания,
которое катализирует образование цис-ендиола в хо-
де реакции (12.59).
Скорость реакции изомеризации зависит от присутствия ос-
новной
группы с р/Са = 6,8 и кислой группы с рКз = 9,3 в
свободном ферменте [250]. Исходя из данных по теплотам изо-
меризации было высказано предположение, что эти значения
рКа относятся к имидазольной и аммонийной боковым цепям
остатков гистидина и лизина соответственно [250]. Остаток глу-
таминовой кислоты модифицируется эпоксидом
1,2-ангид-
po-D-маннитол-б-фосфатом (гл. 7, разд. Ж) [251]. Все эти дан-
ные в совокупности с результатами кристаллографического ана-
лиза позволили сформулировать механизм действия фермента.
Интересно,
что при этом аминокислотная последовательность
глюкозо-6-фосфат—изомеразы все еще не установлена, и, следо-
вательно, боковые цепи аминокислот не
могут
быть четко иден-
тифицированы.
2
О
3
РСН
2
С
уА °\ОН
К
он но^|
$-о-Маннозо-6-фосфат
сно
но-
но-
-он
—он
СН
2
ОРОГ
-O
3
POHjC
(12.60)
а-и-Маннозо-6-фосфат
Кристаллическая
структура
комплекса
между
ферментом и
эффективным
ингибитором арабинонат-5-фосфатом установлена
410
ГЛАВА
12
с-с
•А
+
\
н
ОРОГ
он
ОН
с-о
ч
О
Ч
С°
Н
кон
ч
с=о
о
н
он
В:
с=о
с,-о
I:-
о
н
V
I
н
он
ОРО?
он
В:
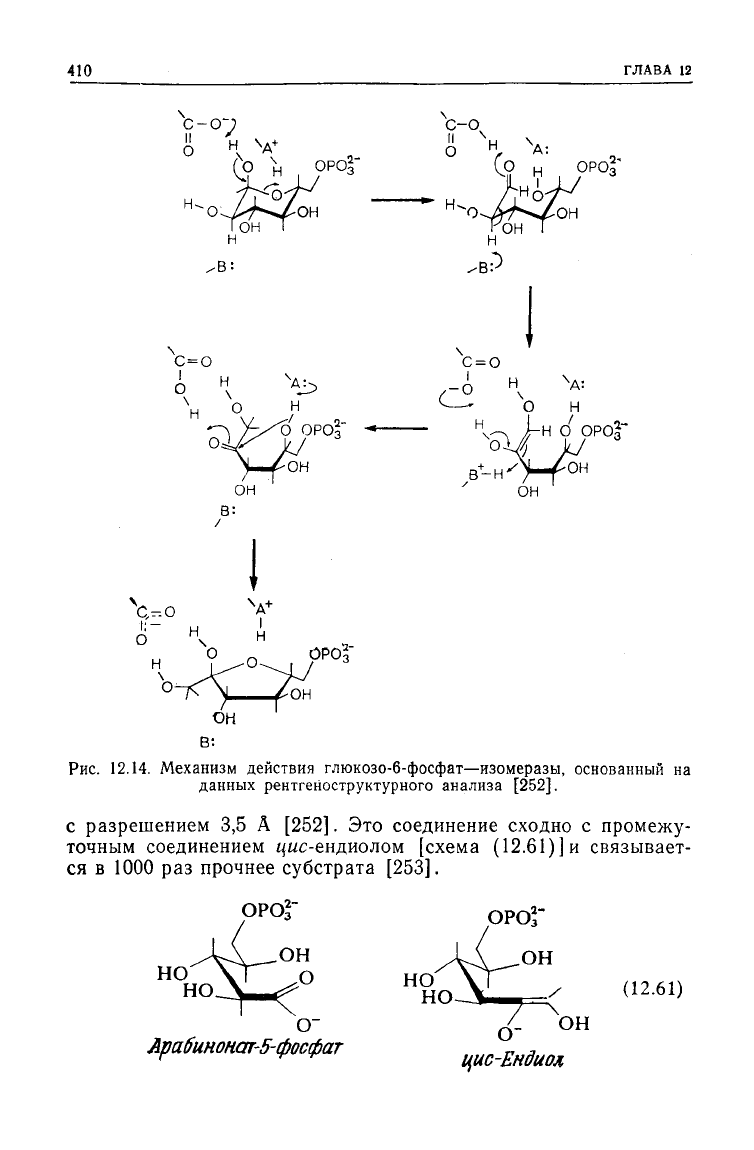
Рис.
12.14.
Механизм действия глюкозо-6-фосфат— изомеразы, основанный
на
данных рентгеноструктурного анализа [252].
с разрешением 3,5 А [252]. Это соединение сходно с промежу-
точным соединением цис-ендиолом [схема
(12.61)]
и связывает-
ся
в 1000 раз прочнее субстрата [253].
ОРОГ
но
ОРОГ
но
он
о
О"
(12.61)
Арабинонт-5-фосфат
О"
цис-Ендиол
ОН
