Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 361
Аналогичная ситуация имеет место и в
случае
алкогольдегидро-
геназы печени, где роль ВН+ в стабилизации переходного состо-
яния
и ориентации субстрата играет либо присоединенная к
цинку
молекула воды, либо сам ион
Zn
2+
.
Следствием направленности образующейся водородной свя-
зи
является то, что спирт присоединяется предпочтительно к
основной
форме катализатора (В),
тогда
как альдегид к кислой
(ВН+).
Значение рКа основания В в составе тройного комплекса
E.NAD+.RCH
2
OH
уменьшается, а в составе комплекса
E.NADH.RCHO
— увеличивается. Это означает, что высвобож-
дающийся при окислении протон не покидает тройного комплек-
са, а захватывается каталитической группой, и наоборот. Вы-
свобождение протона в раствор происходит только при замене
одних молекул субстрата другими [18, 41, 63, 71].
Столь же четкое объяснение получила и природа специфич-
ности
дегидрогеназ. Энантиомеры субстратов L-лактат- и
D-глицеральдегид-З-фосфат—дегидрогеназ не
могут
связываться
продуктивно, гидрофобный карман алкогольдегидрогеназы не
связывает заряженную боковую цепь лактата и т. д. Происходят
ли
в процессе катализа конформационные изменения или имеет
место деформация — неизвестно.
Основная
кинетическая особенность ЫАО+-зависимых дегид-
рогеназ состоит в том, что NADH обычно связывается более
прочно,
чем
NAD+.
Каковы структурные предпосылки такого
различия
— неясно; отметим только, что заряженное никотина-
мидное кольцо более гидрофильно, чем его восстановленная
форма
в NADH. Прочное связывание NADH приводит к
тому,
что диссоциация комплексов E.NADH является в значительной
мере лимитирующей стадией при насыщающих концентрациях
реагентов и физиологическом рН. Более того, хотя константа
равновесия для реакции окисления в растворе такова, что рав-
новесие сдвинуто в сторону образования NAD+ и спирта, благо-
даря более прочному связыванию NADH константа равновесия
для связанных с ферментом реагентов оказывается не столь
неблагоприятной для образования NADH и альдегида: констан-
та равновесия
между
двумя тройными комплексами в реакциях
с участием лактатдегидрогеназы близка к единице.
Б.
Протеазы
Протеазы удобно классифицировать в соответствии с харак-
тером их активности и природой функциональных групп. Сери-
новые протеазы являются эндопептидазами, имеющими реакци-
онноспособный
сериновый остаток, и обладают максимальной
активностью при рН, близких к 7,0. Кислые протеазы представ-

362
ГЛАВА
12
ляют собой эндопептидазы с реакционноспособными карбок-
сильными группами и обладают максимальной активностью при
низких
рН (за исключением химозина, активность которого со-
храняется вплоть до нейтральных рН). Тиоловые протеазы яв-
ляются эндопептидазами, отличающимися от сериновых протеаз
присутствием реакционноспособных цистеиновых остатков. Кар-
боксипептидазы представляют собой цинксодержащие
экзо-
пептидазы, специфичные по отношению к определенным С-кон-
цевым остаткам белков и функционирующие при нейтральном
рН.
За исключением лейцинаминопептидазы, мол. вес которой
равен 250 000, все перечисленные протеазы представляют собой
небольшие мономерные ферменты с мол. весом от 15 000 до
35 000, легко поддающиеся кинетическим и структурным иссле-
дованиям, в связи с чем относятся к наиболее хорошо изученным
ферментам. Несмотря на то что эти ферменты катализируют
одну и ту же реакцию, механизм каталитического действия
протеаз разных классов различается. Некоторые механизмы
изучены достаточно полно, для них построены химические моде-
ли,
другие
исследованы лишь в общих
чертах.
В данном разделе для описания подцентров связывания ши-
роко используются условные обозначения, введенные Бергером
и
Шехтером [уравнение (1.6)]. (Расщепляемая связь пептидно-
го субстрата занимает участок
между
подцентрами Si и Si,
С-конец субстрата занимает подцентры S{ — S'
n
, a N-конец —
S, —S
n
.)
1. Сериновые протеазы
Эти ферменты уже рассматривались нами в разных разде-
лах. Основной материал распределился следующим образом:
классификация
ферментов, их специфичность — гл. 1, разд. В;
структура
активного центра, фермент-субстратный комплекс,
ацилфермент и комплекс
между
ферментом и продуктом — гл. 1,
разд. Г; кинетика-реакций и установление их механизма — гл.7,
разд. Б; рН-зависимость каталитического процесса и состояние
ионизации
активного центра — гл. 5, разд. Е и Ж.2.а; использо-
вание энергии связывания для увеличения k
ca
t — гл. 10,
разд. А.4; стабилизация переходного состояния, специфическая
сольватация переходного состояния — гл. 10, разд.
В.5.в.
В этом
разделе вкратце рассмотрены все перечисленные вопросы.
Катализируемый сериновыми протеазами гидролиз субстра-
тов, эфиров или амидов, сопровождается образованием промежу-
точного ацилфермента в
результате
ацилирования субстратом
гидроксильной группы Ser-195. В
случае
амидов образование
ацилфермента при насыщающих концентрациях субстрата явля-

СТРУКТУРА И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 363
ется медленной стадией, а гидролиз эфиров часто сопровожда-
ется его накоплением.
Атака
Ser-195
карбоксильной группы суб-
страта, по всей вероятности, приводит к образованию высоко-
энергетического тетраэдрического промежуточного соединения:
О
II
Е—OH.R—С—X
—>
Е—OH + R—СО
2
Н.
(12.19)
Механизм катализа и
структура
промежуточных соединений,
образующихся в
ходе
реакций с участием сериновых протеаз,
определены с помощью более прямых экспериментов, чем в
случае
любого
другого
фермента или класса ферментов. Выяс-
нить
структуру
сериновых протеаз удалось главным образом
благодаря установлению кристаллической структуры сокристал-
лизованных комплексов трипсина и некоторых природных поли-
пептидов-ингибиторов, имитирующих субстраты (гл. 1, разд. Г).
Из
этих исследований известно, что активный центр фермента
комплементарен переходному состоянию субстрата, которое
структурно очень близко к тетраэдрическому
аддукту
остатка
Ser-195
и углеродного атома карбонильной группы субстрата.
Более того,
структура
фермента при связывании субстрата не
искажается. Исследование связывания небольших пептидов с
помощью ЯМР-спектроскопии показывает, что при связывании
эти
пептиды также не деформируются. (Определение кристал-
лической структуры комплекса трипсина с панкреатическим ин-
гибитором трипсина при высоком разрешении ясно показывает,
что реакционноспособная пептидная связь деформируется таким
образом, что ее конфигурация приближается к конфигурации
пептидной связи в тетраэдрическом промежуточном соединении.
Однако, поскольку эта связь уже деформирована до присоеди-
нения
к ферменту, «сконструированный» ингибитор связывается
очень прочно, т. е. является аналогом естественного переходного
состояния.)
а.
Система
с
переносом
заряда
Долгое время полагали, что основный имидазол остатка
His-57 увеличивает нуклеофильность гидроксильной группы
Ser-195, действуя как общий основный катализатор: активность

364
ГЛАВА
12
понижается при низких рН в соответствии с изменением состоя-
ния
ионизации основания с р/(а£^7, характерным для остатка
гистидина; His-57 модифицируется аффинной меткой — то-
зил-Ь-фенилаланинхлорметилкетоном — с необратимой потерей
ферментативной активности (гл. 7, разд. Ж) [72].
^2^
(12
-
20)
Для кристаллографов явилось полной неожиданностью выявле-
ние
того факта, что карбоксильная группа
Asp-102
также
входит
в
состав активного центра с образованием каталитической триа-
ды, названной «системой с переносом заряда» [73].
^ (12.2!)
о ^/
Хотя карбоксильная группа полностью погружена
вглубь
бел-
ковой
глобулы, она окружена полярными остатками и связан-
ными
с белком молекулами воды. Было высказано предположе-
ние,
что погруженная карбоксильная группа ионизирована в
активном
протонированном состоянии фермента; позже это
предположение подтвердилось (гл. 5, разд. Ж.2.е) [74]. Еще
один
сюрприз преподнесли исследователям данные, полученные
с помощью ЯМР [75], а затем и с помощью ИК-спектроскопии
[76],
которые показали, что группа, ионизующаяся с р/С
а
~ 7,
принадлежит погруженному внутрь белковой глобулы аспарта-
ту, а не His-57 (гл. 5, разд. Ж.2). Если эти данные правильны, то
имидазол His-57 остается непротонированным в химотрипсине
вплоть до рН 2, поскольку на графике зависимости активности
от рН не обнаруживается данной стадии ионизации при низких
рН
[77].
Как
все эти факторы влияют на катализ — неизвестно. Было
высказано
предположение, что
между
Asp-102
и His-57 в
ходе
реакции
(12.22)
происходит перенос протона [75].
(12.22)
Очень интересно было бы заменить каким-нибудь образом
Asp-102
аспарагином и затем определить каталитическую ак-
тивность такого фермента. По мнению автора, при этом значение
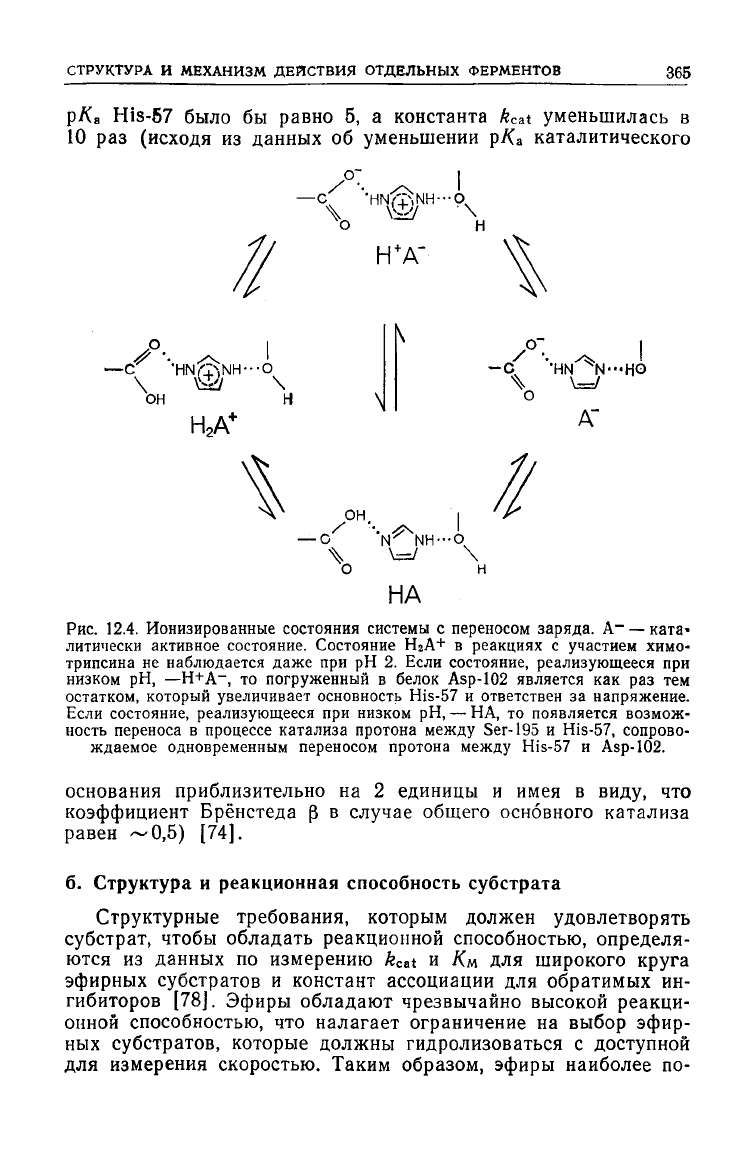
СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 365
рК
а
His-57 было бы равно б, а константа
&
C
at
уменьшилась в
10 раз (исходя из данных об уменьшении р/(
а
каталитического
—еГ '"HN^NH-O
н
Н
+
А"
\
Ш \
ОН
Н
Н
2
А
+
—
С
-
HN Is
А"
ОН. |
—
С 'Н
У
NH--O
%
\=/ \
О Н
НА
Рис.
12.4. Ионизированные состояния системы с переносом заряда. А~ — ката-
литически
активное состояние. Состояние НгА+ в реакциях с участием химо-
трипсина
не наблюдается даже при рН 2. Если состояние, реализующееся при
низком
рН,
—Н+А~,
то погруженный в белок
Asp-102
является как раз тем
остатком,
который увеличивает основность His-57 и ответствен за напряжение.
Если
состояние, реализующееся при низком рН, — НА, то появляется возмож-
ность
переноса в процессе катализа протона между Ser-195 и His-57, сопрово-
ждаемое
одновременным переносом протона между His-57 и Asp-102.
основания
приблизительно на 2 единицы и имея в
виду,
что
коэффициент
Брёнстеда р в
случае
общего основного катализа
равен ~0,5) [74].
б.
Структура
и
реакционная
способность
субстрата
Структурные требования, которым должен удовлетворять
субстрат,
чтобы обладать реакционной способностью, определя-
ются из данных по измерению
&
C
at
и /См для широкого круга
эфирных
субстратов и констант ассоциации для обратимых ин-
гибиторов [78J. Эфиры обладают чрезвычайно высокой реакци-
онной
способностью, что налагает ограничение на выбор эфир-
ных субстратов, которые должны гидролизоваться с доступной
для измерения скоростью. Таким образом, эфиры наиболее по-

366
ГЛАВА
12
лезны
для
определения стерических требований, предъявляемых
к
ацильному фрагменту субстрата. Амиды
и
пептиды настолько
нереакционноспособны,
что
использовать можно только произ-
водные специфических субстратов
—
фенилаланина, тирозина
и
триптофана. Теперь
эти
исследования удается проводить
в
соче-
тании
с
рентгеноструктурным анализом.
Таблица
12.2
Структурные требования при деацилировании
ацилхимотрипсинов (RCO
2
E) (25° С)
а)
R—
СНз—
СбН
5
СН
2
СН2—
СН
Я
(ЫНСОСН
3
)—
L-C
6
H
5
CH
2
CH
(NHCOCH3)—
fe
cat
для деацили-
рования,
0,01
0,178
0,12
111
*ОН~
для гйдро-
/ лиза
RCO2CH3,
М-'с"
1
0.19
0,15
2,48
1,94
а
) Dupaix
A.,
Bechet J.-J., Roucous
С,
Biochem. Biophys.
Res. Commun.,
41, 464
(1970); Березин
И. В.,
Казанская
Н. Ф.,
Клесов
A. A.,
FEBS Letts.,
15, 121
(1971);
см.
табл.
7.3.
/. Стадия
деацилирования.
В
табл.
12.2
приведены данные
по
деацилированию различных ацилферментов. Соответствую-
щие данные
для
аминокислот приведены
в
табл.
7.3.
Наиболь-
шей реакционной способностью обладает производное
аце-
тил-Ь-фенилаланина.
Как
указывалось
в гл. 1, в
химотрипсине
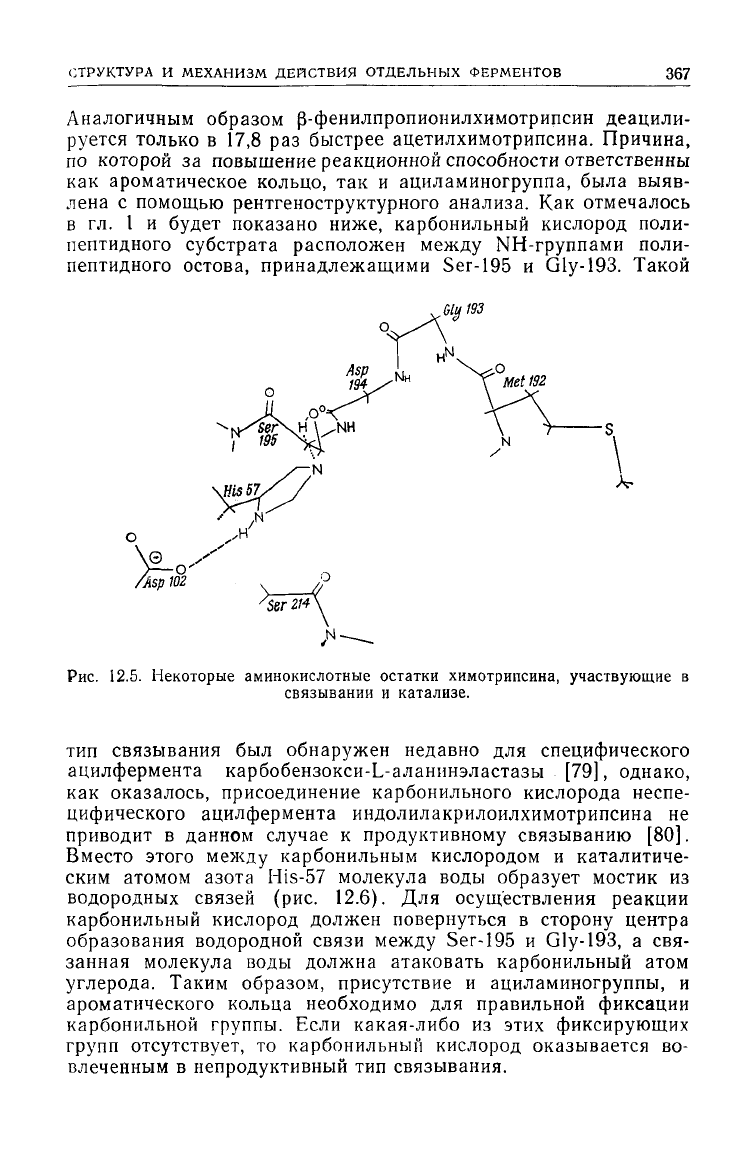
имеется четко выраженный карман
для
связывания ароматиче-
ской
боковой цепи аминокислоты
и
центр образования водород-
ной
связи (С=О-группа
Ser-214)
с
NH-группой
в
СНзСОЫН-фрагменте субстрата
(рис.
12.5).
При
замещении
в
ацетилфенилаланине С
6
Н
5
СН2-
и
CH
3
CONH-rpynn водородом
и
образовании простой ацетильной группы скорость деацилирова-
ния
уменьшается
в 10
4
раз
(правда, десятикратное уменьшение
скорости обусловлено индукционным эффектом CH
3
CONH-rpyn-
пы,
как это
видно
из
значений констант скорости катализируе-
мого гидроксил-ионами гидролиза эфиров; последняя колонка
табл. 12.2). Интересно,
что в
повышении реакционной способно-
сти
участвуют
как
ароматическое кольцо,
так и
ациламиногруп-
па (табл. 12.2). Ацетилглицинхимотрипсин деацилируется толь-
ко
в 12 раз
быстрее ацетилхимотрипсина,
и, как
видно
из
значе-
ний
констант скорости гидролиза, катализируемого гидроксил-
ионами,
это
увеличение обусловлено исключительно индукцион-
ным
эффектом ациламиногруппы,
а не
влиянием связывания.
СТРУКТУРА
И
МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ
367
Аналогичным образом р-фенилпропионилхимотрипсин деацили-
руется только в 17,8 раз быстрее ацетилхимотрипсина. Причина,
по
которой за повышение реакционной способности ответственны
как
ароматическое кольцо, так и ациламиногруппа, была выяв-
лена с помощью рентгеноструктурного анализа. Как отмечалось
в гл. 1 и
будет
показано ниже, карбонильный кислород поли-
пептидного субстрата расположен
между
NH-группами поли-
пептидного остова, принадлежащими
Ser-195
и Gly-193. Такой
Рис.
12.5. Некоторые аминокислотные остатки химотрипсина,
участвующие
в
связывании и катализе.
тип связывания был обнаружен недавно для специфического
ацилфермента карбобензокси-Ь-аланинэластазы [79], однако,
как
оказалось, присоединение карбонильного кислорода неспе-
цифического ацилфермента индолилакрилоилхимотрипсина не
приводит в данном
случае
к продуктивному связыванию [80].
Вместо этого
между
карбонильным кислородом и каталитиче-
ским
атомом азота His-57 молекула воды образует мостик из
водородных связей (рис. 12.6). Для осуществления реакции
карбонильный кислород должен повернуться в сторону центра
образования водородной связи
между
Ser-195
и Gly-193, а свя-
занная
молекула воды должна атаковать карбонильный атом
углерода.
Таким образом, присутствие и ациламиногруппы, и
ароматического кольца необходимо для правильной фиксации
карбонильной группы. Если какая-либо из этих фиксирующих
групп
отсутствует,
то карбонильный кислород оказывается во-
влеченным в непродуктивный тип связывания.
368
ГЛАВА
12
2. Стадия
ацилирования.
Как указывалось в гл. 10, запол-
нение
подцентров S
2
, S
3
, S
4
и S
6
часто увеличивает
&
C
at
для
гидролиза полипептидных субстратов без уменьшения /См. При-
чина
такого явления неизвестна. Энергия связывания с подцент-
ром Si' также используется для увеличения
&
C
at,
а не для по-
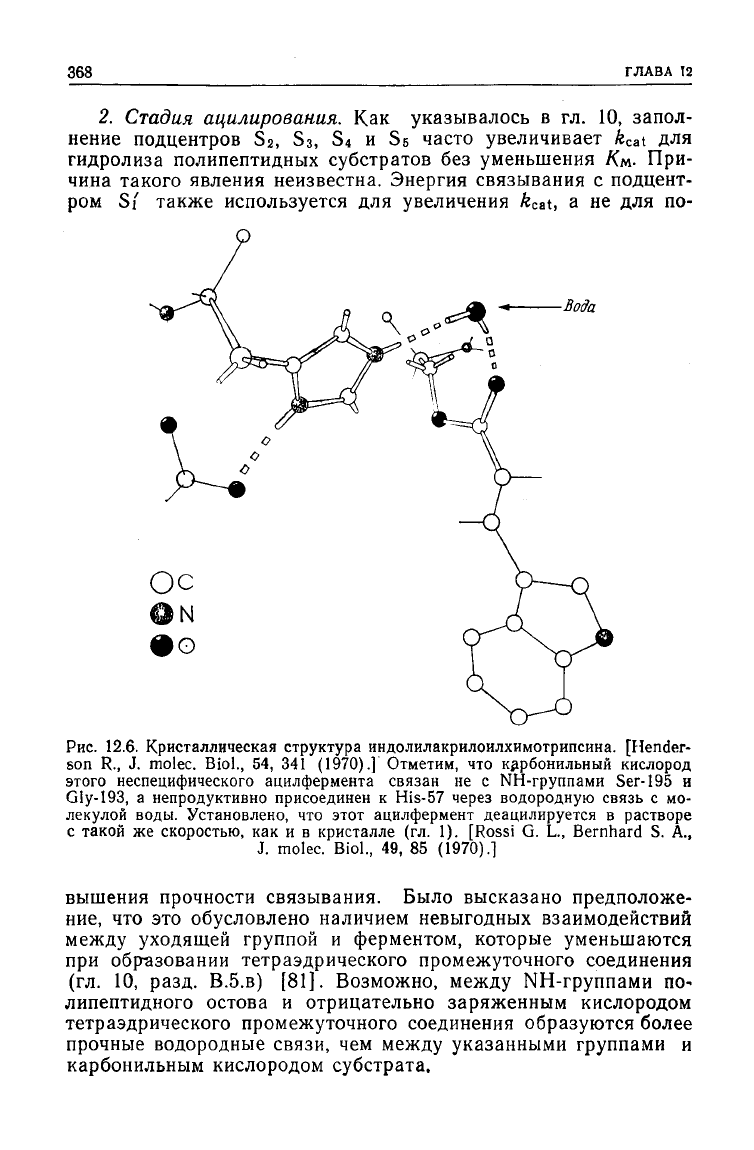
Вода
Рис.
12.6. Кристаллическая
структура
индолилакрилоилхимотрипсина. [Hender-
son R., J. molec.
Biol.,
54, 341
(1970).]
Отметим, что карбонильный кислород
этого неспецифического ацилфермента связан не с NH-группами
Ser-195
и
Gly-193, а непродуктивно присоединен к His-57 через водородную связь с мо-
лекулой воды. Установлено, что этот ацилфермент деацилируется в растворе
с такой же скоростью, как и в кристалле (гл. 1).
[Rossi
G. L., Bernhard S. A.,
J. molec.
Biol.,
49, 85 (1970).!
вышения
прочности связывания. Было высказано предположе-
ние,
что это обусловлено наличием невыгодных взаимодействий
между
уходящей группой и ферментом, которые уменьшаются
при
образовании тетраэдрического промежуточного соединения
(гл. 10, разд.
В.5.в)
[81]. Возможно,
между
NH-группами по-
липептидного остова и отрицательно заряженным кислородом
тетраэдрического промежуточного соединения образуются более
прочные водородные связи, чем
между
указанными группами и
карбонильным
кислородом субстрата.
СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 369
в.
Описание
механизма
реакции
Кинетические и структурные данные позволяют качественно
описать механизм ащилирования химотрипсина хорошим поли-
пептидным субстратом [81].
В специфическом кармане химотрипсина
между
атомом во-
дорода N-ациламиногруппы субстрата и карбонильной группой
Ser-214
образуется водородная связь. Все располагающиеся
Ч_/
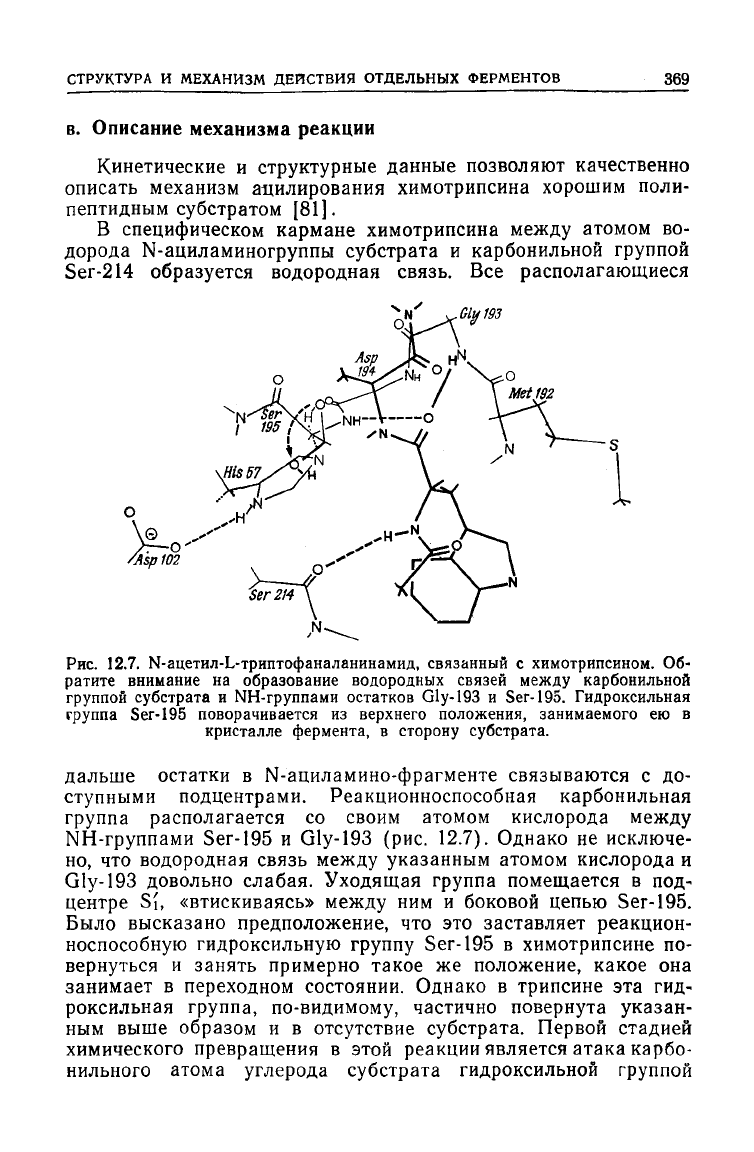
Рис.
12.7. Ы-ацетил-Ь-триптофаналанинамид, связанный с химотрипсином. Об-
ратите внимание на образование водородных связей между карбонильной
группой субстрата и NH-группами остатков Gly-193 и Ser-195. Гидроксильная
группа
Ser-195
поворачивается из верхнего положения, занимаемого ею в
кристалле фермента, в сторону субстрата.
дальше остатки в N-ациламино-фрагменте связываются с до-
ступными подцентрами. Реакционноспособная карбонильная
группа располагается со своим атомом кислорода
между
NH-группами
Ser-195
и Gly-193 (рис. 12.7). Однако не исключе-
но,
что водородная связь
между
указанным атомом кислорода и
Gly-193 довольно слабая. Уходящая группа помещается в под-
центре Si, «втискиваясь»
между
ним и боковой цепью Ser-195.
Было
высказано предположение, что это заставляет реакцион-
носпособную гидроксильную группу
Ser-195
в химотрипсине по-
вернуться и занять примерно такое же положение, какое она
занимает в переходном состоянии. Однако в трипсине эта гид-
роксильная группа, по-видимому, частично повернута указан-
ным
выше образом и в отсутствие субстрата. Первой стадией
химического превращения в этой реакции является атака карбо-
нильного атома
углерода
субстрата гидроксильной группой
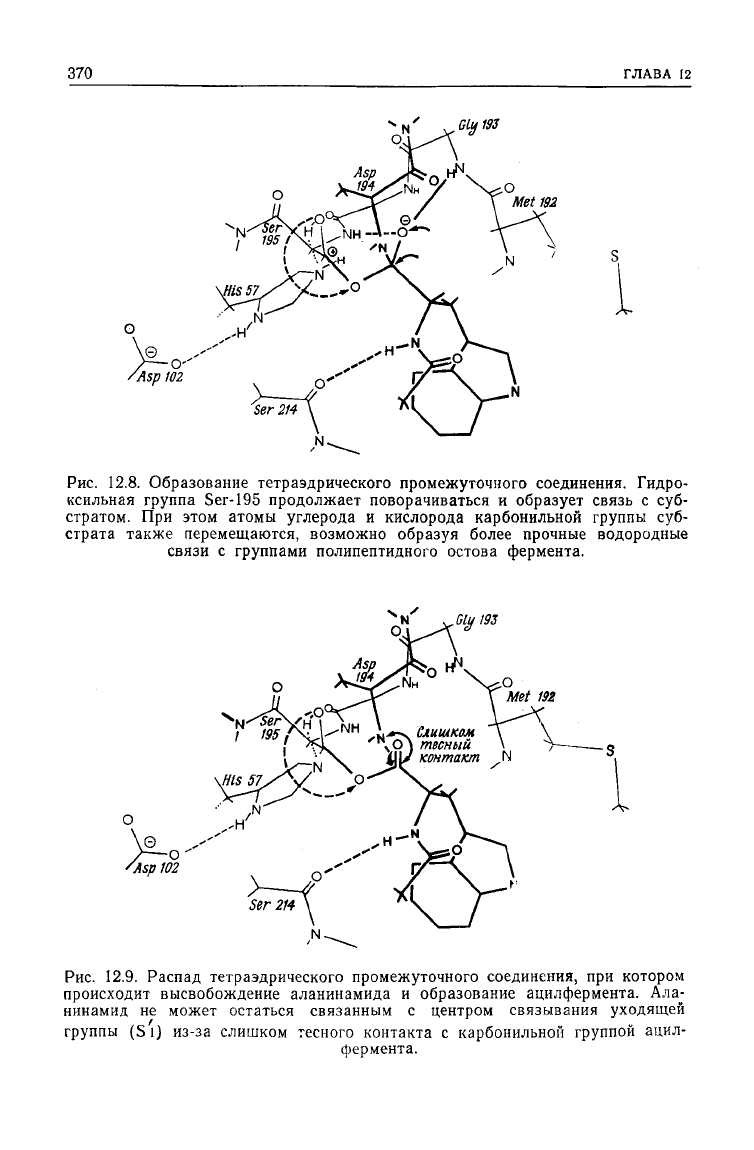
370
ГЛАВА
12
уэ
'Asp
102
Рис.
12.8. Образование тетраэдрического промежуточного соединения. Гидро-
ксильная
группа
Ser-195
продолжает поворачиваться и образует связь с суб-
стратом. При этом атомы углерода и кислорода карбонильной группы суб-
страта также перемещаются, возможно образуя более прочные водородные
связи
с группами полипептидного остова фермента.
NH
.M-*-N
Слишком
Ч
Оj
тесный
контакт
/Asp
102
Рис.
12.9. Распад тетраэдрического промежуточного соединения, при котором
происходит высвобождение аланинамида и образование ацилфермента. Ала-
нинамид
не может остаться связанным с центром связывания уходящей
группы (S l) из-за слишком тесного контакта с карбонильной группой ацил-
фермента.
