Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.

СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 391
катализа, поскольку а) при их ацетилировании фермент теряет
свою активность и б) остатки лизина находятся в положениях 7,
41 и 66 во
всех
20 (или около того) рибонуклеазах этого класса,
для которых установлена аминокислотная последовательность
[172]. Возможно, положительные заряды этих боковых цепей
стабилизируют промежуточное соединение, содержащее пяти-
валентный атом фосфора, которое образуется, когда гидро-
ксильная
группа атакует фосфат. Значения р/С
а
для His-12 и
His-119, измеренные с помощью ЯМР при
40°С,
оказались рав-
ными
5,8 и 6,2 соответственно [173]. При физиологическом рН
значительная часть гистидиновых остатков находится в таком
состоянии
ионизации, при котором возможен общий кислотно-
основный
катализ [схема (12.37)].
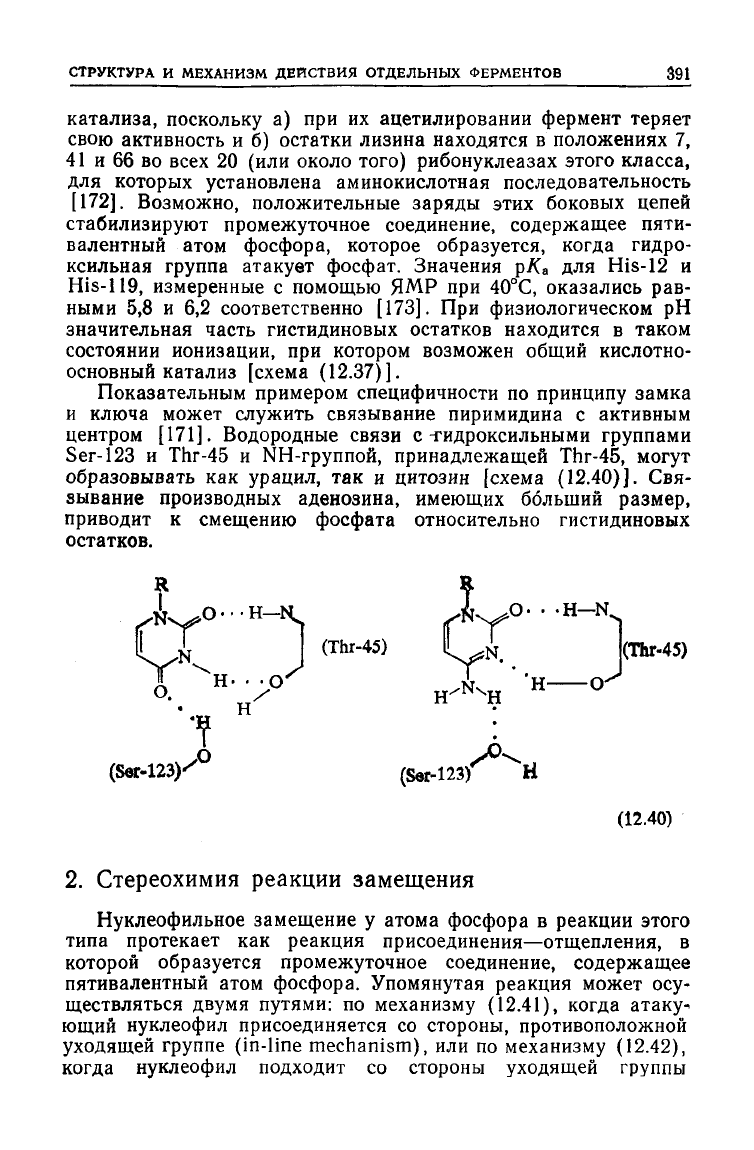
Показательным примером специфичности по принципу замка
и
ключа может служить связывание пиримидина с активным
центром [171]. Водородные связи с -гидроксильными группами
Ser-123
и Thr-45 и NH-группой, принадлежащей Thr-45,
могут
образовывать как урацил, так и цитозин [схема (12.40)]. Свя-
зывание производных аденозина, имеющих больший размер,
приводит к смещению фосфата относительно гистидиновых
остатков.
(Thr-45) |1 ^ ^ |(Thr-45)
Х„ 'н o-
JO
>Ч
(Ser-123)' (Ser-ШГ Н
2. Стереохимия реакции замещения
(12.40)
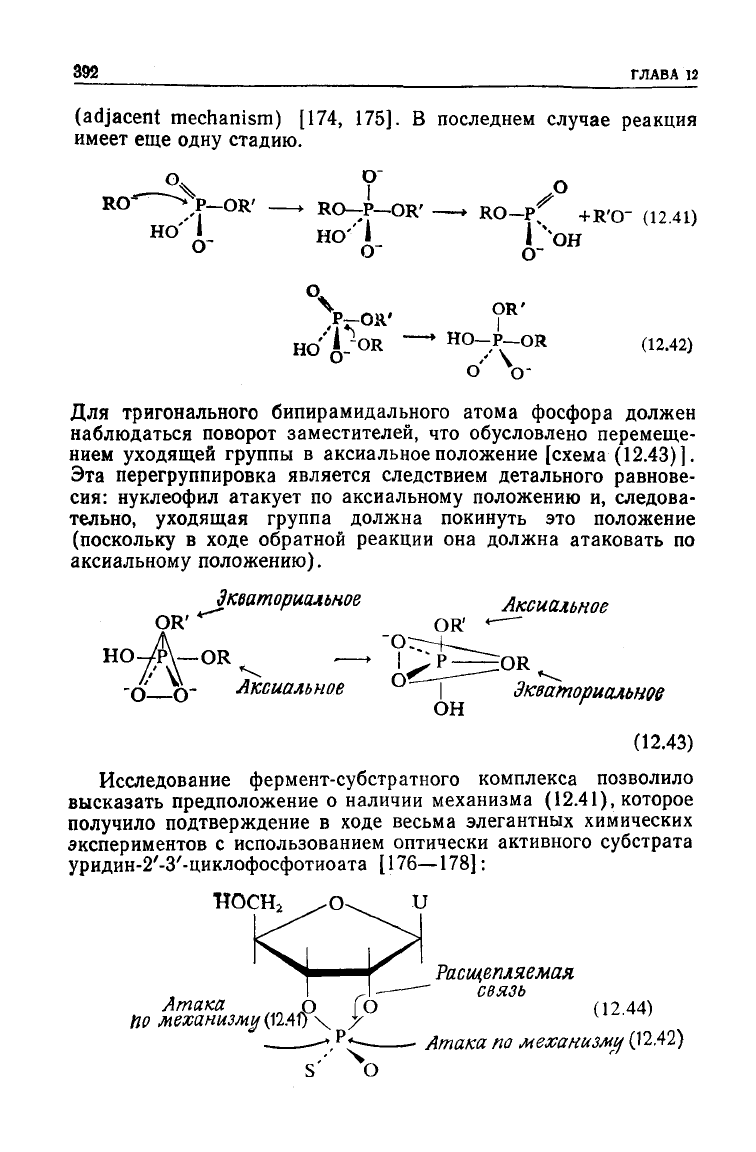
Нуклеофильное замещение у атома фосфора в реакции этого
типа протекает как реакция присоединения—отщепления, в
которой
образуется промежуточное соединение, содержащее
пятивалентный
атом фосфора. Упомянутая реакция может осу-
ществляться двумя путями: по механизму (12.41), когда атаку-
ющий
нуклеофил присоединяется со стороны, противоположной
уходящей группе (in-line mechanism), или по механизму (12.42),
когда нуклеофил подходит со стороны уходящей группы
392
ГЛАВА
12
(adjacent mechanism)
[174, 175]. В
последнем случае реакция
имеет
еще
одну стадию.
R
°^'f-°
R
'
— RO-.P-OR' — RO-pf
+R4r (1241)
но
I но'i
° О" О
Ho'pOR
OR'
НО—Р—OR
o'V
(12.42)
Для тригонального бипирамидального атома фосфора должен
наблюдаться поворот заместителей,
что
обусловлено перемеще-
нием
уходящей группы
в
аксиальное положение [схема (12.43)].
Эта перегруппировка является следствием детального равнове-
сия:
нуклеофил атакует
по
аксиальному положению
и,
следова-
тельно, уходящая группа должна покинуть
это
положение
(поскольку
в
ходе
обратной реакции
она
должна атаковать
по
аксиальному положению).
Экваториальное
НО
-7Р\
OR'
Аксиальное
OR
Аксиальное
ОН
Экваториальное
(12.43)
Исследование фермент-субстратного комплекса позволило
высказать предположение
о
наличии механизма (12.41), которое
получило подтверждение
в
ходе
весьма элегантных химических
экспериментов
с
использованием оптически активного субстрата
уридин-2'-3'-циклофосфотиоата [ 176— 178]:
•нош
Атака
механиз
Wj/(12.40°\
|°
р*
ч
Расщепляемая
связь
(12.44)
Атака
по механизму
(12.42)
О
СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ
393
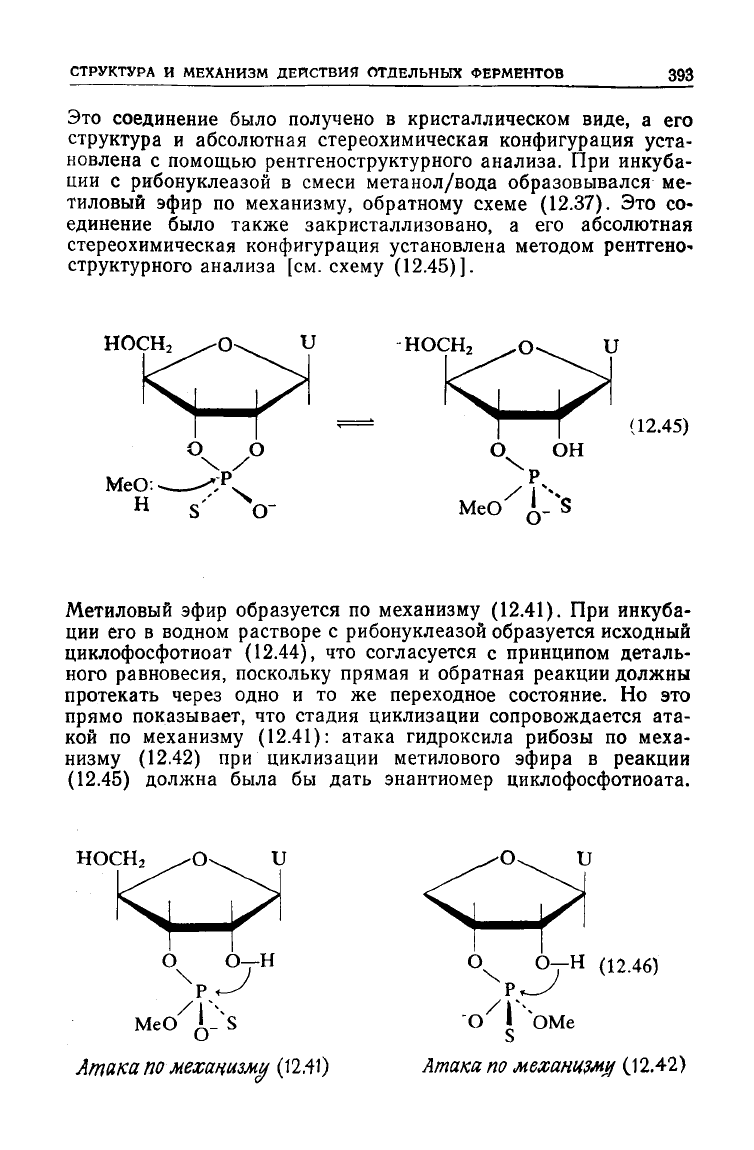
Это соединение было получено в кристаллическом виде, а его
структура и абсолютная стереохимическая конфигурация
уста-
новлена с помощью рентгеноструктурного анализа. При инкуба-
ции
с рибонуклеазой в смеси метанол/вода образовывался ме-
тиловый эфир по механизму, обратному схеме (12.37). Это со-
единение было также закристаллизовано, а его абсолютная
стереохимическая конфигурация установлена методом рентгено-
структурного анализа [см.
схему
(12.45)].
носн
МеО:-
Н
НОСН
О
\
s'
о
р
N
О
МеО
(12.45)
Метиловый эфир образуется по механизму (12.41). При инкуба-
ции
его в водном растворе с рибонуклеазой образуется исходный
циклофосфотиоат
(12.44), что согласуется с принципом деталь-
ного равновесия, поскольку прямая и обратная реакции должны
протекать через одно и то же переходное состояние. Но это
прямо
показывает, что стадия циклизации сопровождается ата-
кой
по механизму (12.41): атака гидроксила рибозы по меха-
низму
(12.42)
при циклизации метилового эфира в реакции
(12.45)
должна была бы дать энантиомер циклофосфотиоата.
НОСН
Атака
по
механизму
(12.41)
О-Н
(12.46)
Атака
по
механизму
(12.42)
394
ГЛАВА
12
Г. Стафилококковая нуклеаза [179, 180]
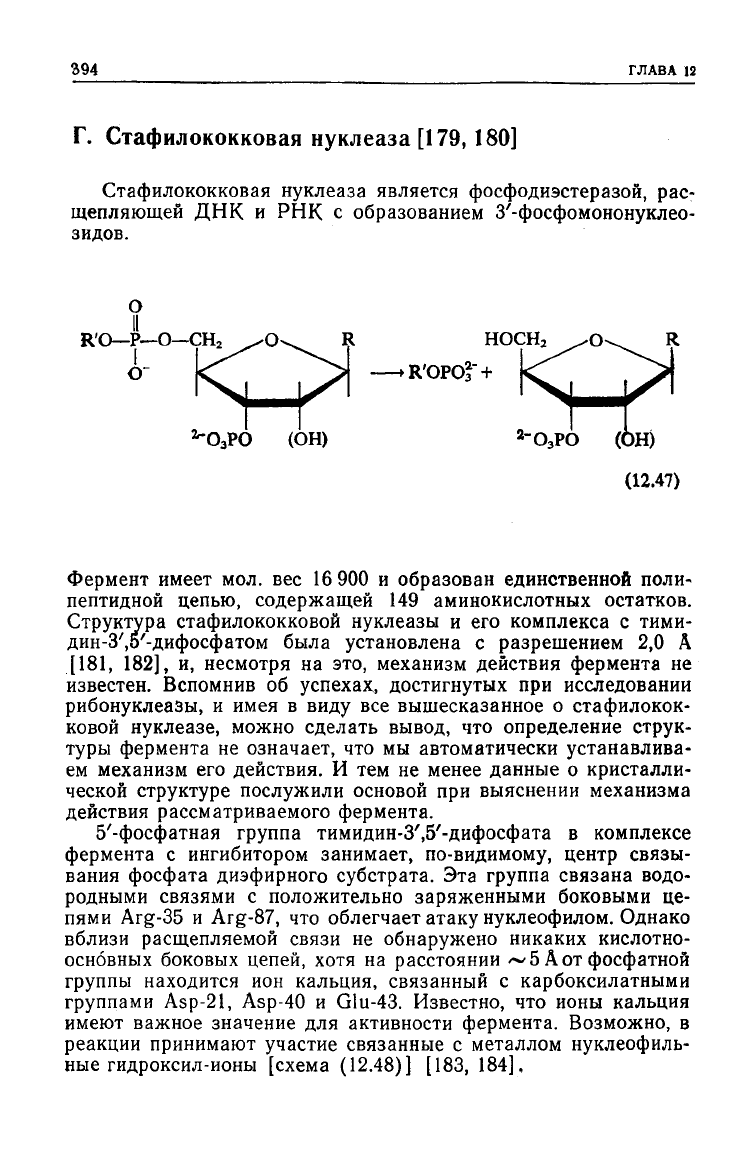
Стафилококковая нуклеаза является фосфодиэстеразой, рас-
щепляющей ДНК и РНК с образованием З'-фосфомононуклео-
зидов.
НОСН
2
•
R'OPOf +
(ОН)
2
-О
3
РО (ОН)
(12.47)
Фермент имеет мол. вес 16 900 и образован единственной поли-
пептидной цепью, содержащей 149 аминокислотных остатков.
Структура стафилококковой нуклеазы и его комплекса с тими-
дин-3',5'-дифосфатом была установлена с разрешением 2,0 А
[181, 182], и, несмотря на это, механизм действия фермента не
известен. Вспомнив об
успехах,
достигнутых при исследовании
рибонуклеазы, и имея в виду все вышесказанное о стафилокок-
ковой нуклеазе, можно сделать вывод, что определение струк-
туры
фермента не означает, что мы автоматически устанавлива-
ем механизм его действия. И тем не менее данные о кристалли-
ческой
структуре
послужили основой при выяснении механизма
действия рассматриваемого фермента.
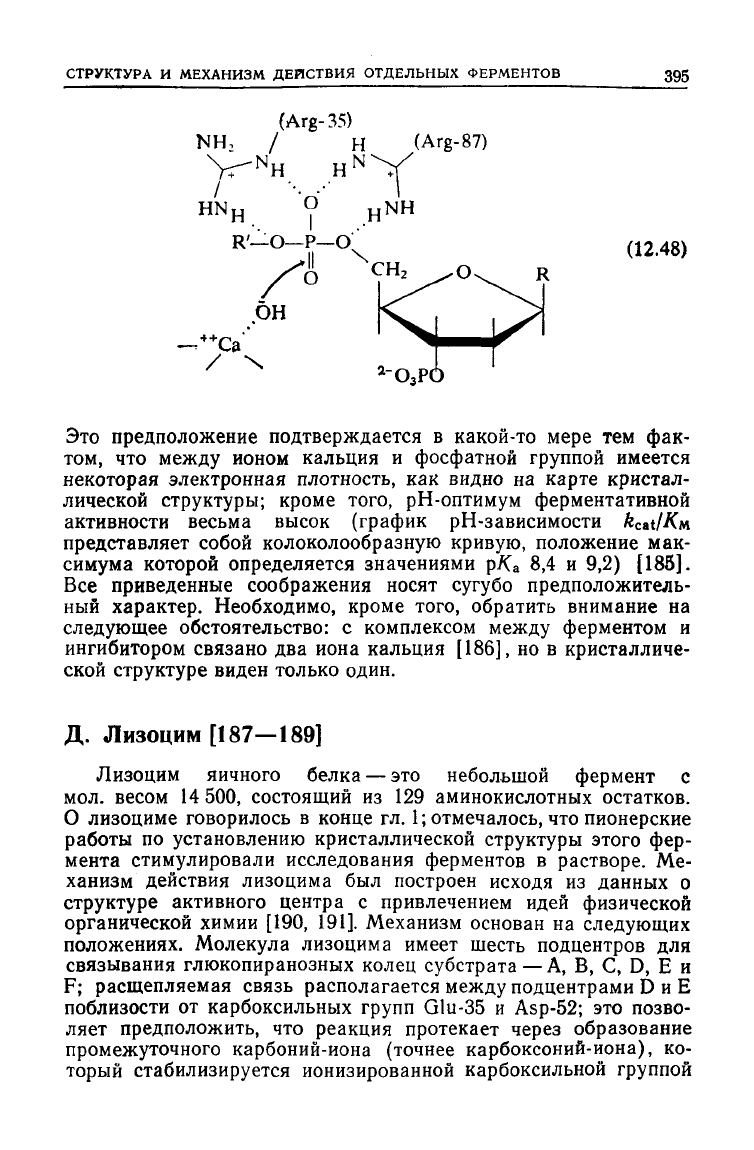
5'-фосфатная группа тимидин-3',5'-дифосфата в комплексе
фермента с ингибитором занимает, по-видимому, центр связы-
вания
фосфата диэфирного субстрата. Эта группа связана водо-
родными связями с положительно заряженными боковыми це-
пями
Arg-35
и
Arg-87,
что облегчает атаку нуклеофилом. Однако
вблизи расщепляемой связи не обнаружено никаких кислотно-
основных боковых цепей, хотя на расстоянии ~ 5 А от фосфатной
группы находится ион кальция, связанный с карбоксилатными
группами Asp-21,
Asp-40
и Glu-43. Известно, что ионы кальция
имеют важное значение для активности фермента. Возможно, в
реакции принимают участие связанные с металлом нуклеофиль-
ные гидроксил-ионы [схема
(12.48)]
[183, 184],
СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 395
(Arg-35)
NH,
/ н
(Arg-87)
'
Н. V _.
H
NH
(12.48)
HN
H
Это предположение подтверждается в какой-то мере тем фак-
том, что
между
ионом кальция и фосфатной группой имеется
некоторая
электронная плотность, как видно на карте кристал-
лической структуры; кроме того, рН-оптимум ферментативной
активности весьма высок (график рН-зависимости
k
ca
t/Kn
представляет собой колоколообразную кривую, положение мак-
симума которой определяется значениями р/С
а
8,4 и 9,2)
[186].
Все приведенные соображения носят
сугубо
предположитель-
ный
характер. Необходимо, кроме того, обратить внимание на
следующее обстоятельство: с комплексом
между
ферментом и
ингибитором связано два иона кальция [186], но в кристалличе-
ской
структуре
виден только один.
Д.
Лизоцим
[187—189]
Лизоцим
яичного белка — это небольшой фермент с
мол.
весом 14 500, состоящий из 129 аминокислотных остатков.
О лизоциме говорилось в конце гл. 1; отмечалось, что пионерские
работы по установлению кристаллической структуры этого фер-
мента стимулировали исследования ферментов в растворе. Ме-
ханизм действия лизоцима был построен исходя из данных о
структуре
активного центра с привлечением идей физической
органической химии [190, 191]. Механизм основан на следующих
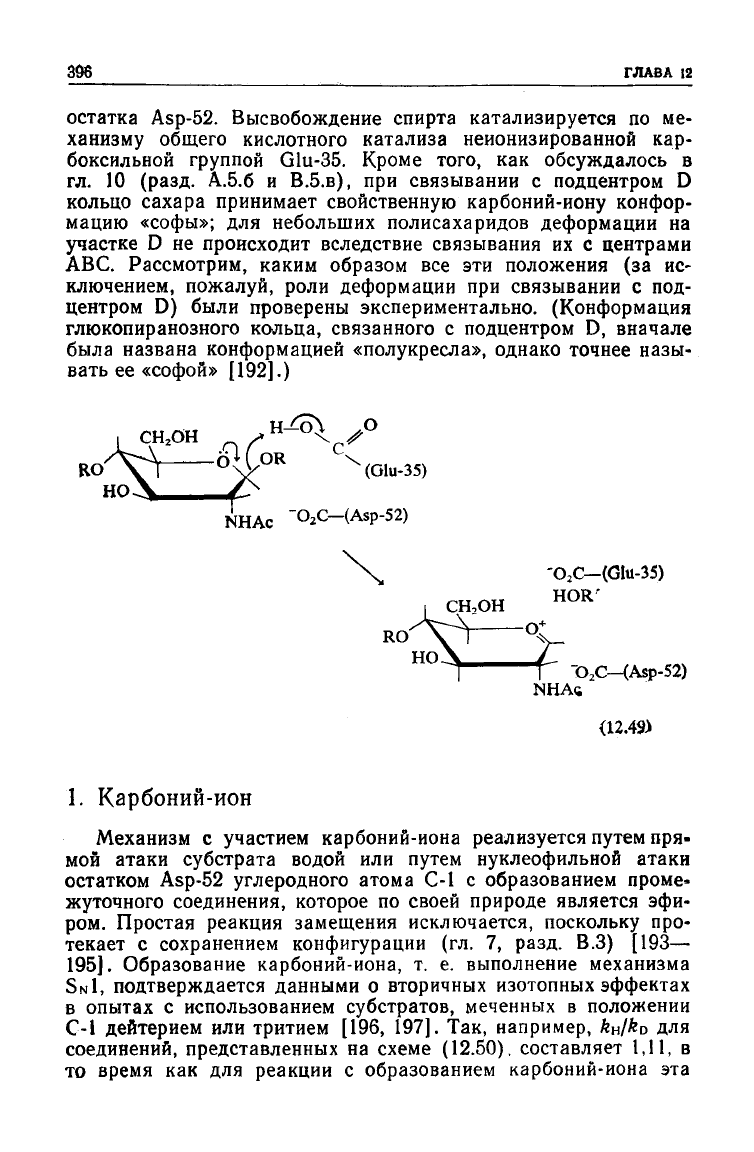
положениях. Молекула лизоцима имеет шесть подцентров для
связывания
глюкопиранозных колец субстрата — А, В, С, D, Е и
F;
расщепляемая связь располагается
между
подцентрами D и Е
поблизости от карбоксильных групп Glu-35 и
Asp-52;
это позво-
ляет предположить, что реакция протекает через образование
промежуточного карбоний-иона (точнее карбоксоний-иона), ко-
торый стабилизируется ионизированной карбоксильной группой
396 ^
ГЛАВА
12
остатка
Asp-52.
Высвобождение спирта катализируется по ме-
ханизму общего кислотного катализа неионизированной кар-
боксильной группой Glu-35. Кроме того, как обсуждалось в
гл. 10 (разд. А.5.6 и В.5.в), при связывании с подцентром D
кольцо сахара принимает свойственную карбоний-иону конфор-
мацию «софы»; для небольших полисахаридов деформации на
участке D не происходит вследствие связывания их с центрами
ABC. Рассмотрим, каким образом все эти положения (за ис-
ключением, пожалуй, роли деформации при связывании с под-
центром D) были проверены экспериментально. (Конформация
глюкопиранозного кольца, связанного с подцентром D, вначале
была названа конформацией «полукресла», однако точнее назы-
вать ее «софой»
[192].)
NHAc
-O
2
C-(Asp-52)
сн,он
"О
2
С—(Glu-35)
HOR'
~О
2
С—(Asp-52)
NHAe
{12.49)
1. Карбоний-ион
Механизм с участием карбоний-иона реализуется путем пря-
мой атаки субстрата водой или путем нуклеофильной атаки
остатком
Asp-52
углеродного атома С-1 с образованием проме-
жуточного соединения, которое по своей природе является эфи-
ром. Простая реакция замещения исключается, поскольку про-
текает с сохранением конфигурации (гл. 7, разд. В.З) [193—
195]. Образование карбоний-иона, т. е. выполнение механизма
SNI,
подтверждается данными о вторичных изотопных эффектах
в опытах с использованием субстратов, меченных в положении
С-1 дейтерием или тритием [196, 197]. Так, например, k
H
lk
D
для
соединений, представленных на
схеме
(12.50), составляет 1,11, в
то время как для реакции с образованием карбоний-иона эта

СТРУКТУРА
И
МЕХАНИЗМ
ДЕЙСТВИЯ
ОТДЕЛЬНЫХ ФЕРМЕНТОВ
397
величина равна 1,14, а для реакции бимолекулярного замеще-
ния (SN2)
В простых химических моделях — 1,03.
сн,он
но
сн,он
ОРИ
но
он
он
(12.50)
2. Электростатический и общий кислотный катализ
рН-зависимость
k
ca
\IKm показывает, что скорость реакции,
катализируемой лизоцимом, определяется состоянием ионизации
кислоты с р/Са ~6 и основания с рКа ~ 4 в свободном ферменте
[198]. Остаток
Asp-52
можно специфически блокировать по-
средством этерификации его триэтоксонийфторборатом (реак-
ция,
протекающая лишь при наличии ионизированной карбок-
сильной
группы). Различие в кривых титрования для модифи-
цированного
и нативного белка показывает, что значение
рАа
Asp-52
равно 4,5,
тогда
как для Glu-35 оно составляет 5,9
[199]. Таким образом,*" скорость реакции зависит от состояния
ионизации
этих
двух
остатков в соответствии с рассмотренным
выше механизмом действия лизоцима.
Результаты, полученные при исследовании обратной реакции,
указывают на наличие механизма общего кислотного катализа с
участием
Glu-35. Установлено, что скорость реакции спиртов с
карбоний-ионом
фактически не зависит от их р/С
а
. Этот факт
позволяет предположить, что имеет место катализируемая по
механизму общего основного катализа атака карбоний-иона
спиртом,
и, следовательно, согласно принципу детального рав-
новесия,
высвобождение алкоголят-иона из гликозида ускоряет-
ся
по механизму общего кислотного катализа [200].
Описывая
впервые механизм действия лизоцима, Верной
[191] подчеркивал, что наиболее важным фактором катализа
является электростатическая стабилизация карбоксоний-иона
остатком
Asp-52.
Проведенные недавно теоретические исследо-
вания,
в которых впервые принималась во внимание диэлектри-
ческая постоянная белка,
свидетельствуют
о том, что в резуль-
тате
электростатической стабилизации энергия активации для
стадии химического превращения, характеризующейся констан-
той
k
C
at,
уменьшается на 37,6 кДж-моль-
1
(9 ккал-моль-
1
)
[201J.
Этот вывод получил экспериментальное подтверждение

398
ГЛАВА
12
Такое сильное уменьшение энергии активации показывает, что
химическое превращение карбоксильной группы
Asp-52
в
—СНгОН-группу приводит к потере ферментативной активности
[202].
3. Энергии связывания с подцентрами
Первоначально предполагалось, что нековалентные взаимо-
действия
между
ферментом и сахарным кольцом на подцентре D
приводят к
тому,
что
сахар
переходит
в конформацию
«софы»,
свойственную карбоний-иону. Предпринимались попытки оце-
нить энергию связывания с этим подцентром
путем
выделения
соответствующей составляющей из суммарной энергии связыва-
ния,
полученной из кинетических данных и экспериментов по
связыванию [187, 189]. Некоторые
результаты
этих исследова-
ний
представлены в табл. 12.3.
Хотя
приведенные значения не
Таблица
12.3
Энергия
связывания
различных
остатков
с
подцентрами
лизоцима
яичного
белка
Подцентр
А
В
С
D
Е
F
а
>
NAG=
вая кислота.
Связываемый
остаток
а
'
NAQ
»
NAM
NAG
NAM
NAG
»
»
Эыергия связывания
кДж-моль"
1
-8
— 12
-16
-20
+ 12
0
— 16
—8
ккал.моль '
2
-3
—4
-5
+3
0
—4
о
Ч-ацетилглюкозамин, ХАМ=№ацетилмурамо-
отличаются высокой точностью,
ясно,
что взаимодействие NAM
с подцентром D сопровождается их взаимным отталкиванием.
Кроме того, поскольку установлено, что (NAQ)
4
связывается
примерно одинаково с подцентрами А, В, С и А, В, С, D,
никакого
выигрыша в энергии при связывании NAG с подцент-
ром D нет [203]. Место связывания небольших
субстратов
было
определено по их взаимодействию со специфическими соедине-
ниями-зондами,
например с красителем бибрихским алым [204]

СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 399
и
ионом лантанида [203], которые связывались в расщелине;
было показано, что указанные субстраты связываются в основ-
ном
непродуктивно. На первый взгляд это служит веским дово-
дом в пользу механизма деформации. Однако Левитт [205],
пересмотрев эти данные (гл. 10, разд.
В.4.в)
и проделав
соответствующие расчеты, пришел к выводу, что вероятность
деформации сахарного кольца при связывании с подцентром D
очень мала [201, 205]. Кроме того, было показано, что аналоги
переходного состояния, имеющие химически модифицированное
сахарное кольцо, структурно аналогичное карбоний-иону, свя-
зываются не более чем в 100 раз прочнее субстратов, у которых
это
кольцо не модифицировано (гл. 10, разд. А.5) [203, 206].
Далее, предполагается, что слабое связывание сахарного кольца
с подцентром D обусловлено вытеснением этим кольцом
двух
молекул воды, связанных с карбоксильной группой
Asp-52.
Сле-
довательно, связывание с подцентром является скорее «электро-
статическим», чем механическим. (В любом случае, как подчер-
кивалось в гл. 10, более прочное связывание переходного состо-
яния
не означает, что связанный
субстрат
деформирован.)
Данные,
полученные в
результате
рентгеноструктурных ис-
следований лизоцима и его комплексов с ингибиторами, не
только выдержали испытание временем, но и получили четкое
подтверждение при исследовании в растворах (но в этом
случае
основное
внимание уделялось электростатической компоненте
механизма напряжения, а не компоненте, обусловленной дефор-
мацией)
.
Наконец,
следует
отметить, что, как установлено, связывание
небольших субстратов является двухстадийным процессом, со-
провождающимся изомеризацией фермент-субстратного комп-
лекса [207, 208]. В чем состоит это так называемое конформа-
ционное
изменение и как соотносится с описанной выше схе-
мой
— неясно; можно предположить, что оно связано с неболь-
шими
структурными изменениями, наблюдающимися при свя-
зывании
(NAG)
3
в кристаллическом ферменте.
Е. Карбоангидраза [209, 210]
Карбоангидраза катализирует гидратацию двуокиси углеро-
да и дегидратацию бикарбоната:
СО
2
+ Н
2
О ?=+
НСОз+Н
+
.
(12.51)
Кристаллическая
структура
изоферментов В и С человека была
установлена с высоким разрешением [211, 212]. Обе формы
являются металлоферментами, содержащими один моль цинка,
прочно
связанного с единственной полипептидной цепью с мол.

400
ГЛАВА
12
весом 29 000. Полипептидная цепь более активной С-формы сот
стоит из 259 аминокислотных остатков — на один меньше, чем у
В-формы [213, 214]. Аминокислотные последовательности этих
двух
изоферментов совпадают на 60%, а их третичные структуры
очень сходны. Лигандами иона
Zn
2+
являются имидазольные
кольца
трех
остатков гистидина, расположенных на дне полости
активного центра на расстоянии около 12 А от поверхности
молекулы фермента. Четвертым лигандом служит, по-видимому,
молекула воды или гидроксил-ион (в зависимости от рН) [211,
212].
Изофермент
С является чрезвычайно эффективным катали-
затором. Для реакции гидратации
&
ca
t
равна 10
6
c
-1
, а /См для
СО
2
— 8,3 мМ, в то время как для реакции дегидратации
fe
cat
=
6-10
5
c-
1
,
а /См для НСОз равна 32мМ [215]. Каталити-
ческая активность фермента определяется состоянием иониза-
ции
группы с р/Са = 7 в свободном ферменте [215]. Реакция
гидратации зависит от доли этих групп, находящихся в основной
форме,
а реакция дегидратации — от доли этих же групп, нахо-
дящихся в кислой форме. Число оборотов для указанных реак-
ций
значительно выше констант скорости переноса протонов
между
водой и группой с р/С
а
= 7 (приблизительно 2-Ю
3
с~';
табл. 4.2). В нефизиологических реакциях эти ферменты ката-
лизируют также гидратацию альдегидов и гидролиз эфиров.
Предметом исследований в данной области являются в по-
следнее время три вопроса: а) что представляет собой ионизи-
рующаяся группа с рКа = 7, от которой зависит активность
фермента? б) какова природа субстрата, связываемого в реак-
ции
дегидратации
(НСОз.
или Н
2
СО
3
)? в) совместимы ли высо-
кие
числа оборотов со скоростями переноса протона?
В рамках классического механизма считается, что при высо-
ком
рН связанный с цинком нуклеофильный гидроксил-ион об-
разуется за счет связывания с этим атомом молекулы воды с
рКа
= 7 [210, 216]. Известно, что связанный с цинком гидро-
ксил-ион
является нуклеофилом и ионизируется в этой области
(гл. 2, разд. Б.7.6). Было высказано множество
других
предпо-
ложений на этот счет [217—219], но единственными группами в
активном
центре, которые
могут
иметь указанный р/С
а
, являются
гистидины. Однако исследование процесса ионизации остатков
гистидина с помощью ЯМР выявило несоответствие
между
ак-
тивностью фермента и состоянием их ионизации [220]. К тому
же результаты измерений ядерных квадрупольных взаимодей-
ствий в ферменте, где
цинк
замещен на кадмий, указывают на
ионизацию
связанной с металлом молекулы воды с таким же
рКа, какое было найдено из рН-зависимости активности фер-
мента [221],
